Alecensa (Bula do profissional de saúde)
PRODUTOS ROCHE QUÍMICOS E FARMACÊUTICOS S.A.
IDENTIFICAÇÃO DO MEDICAMENTO
Alecensa®
cloridrato de alectinibe
Cápsulas 150 mg
FORMA FARMACÊUTICA E APRESENTAÇÃO:
Cápsula dura
Embalagens que contém 224 cápsulas duras (4 cartuchos que contém 56 cápsulas duras cada um)
VIA ORAL
USO ADULTO
COMPOSIÇÃO:
Cada cápsula de Alecensa® contém:
| alectinibe (equivalente a 161,3 mg de cloridrato de alectinibe) | 150 mg |
| excipiente q.s.p. | 1 cápsula |
Excipientes: lactose1 monoidratada, laurilsulfato de sódio, carmelose cálcica, hiprolose e estearato de magnésio.
Cápsula dura: hipromelose, carragenina, cloreto de potássio, dióxido de titânio, amido e cera de carnaúba.
INFORMAÇÕES TÉCNICAS AOS PROFISSINAIS DE SAÚDE2
INDICAÇÕES
Alecensa® está indicado para o tratamento de primeira linha de pacientes com câncer3 de pulmão4 de não pequenas células5 (CPNPC) positivo para quinase do linfoma6 anaplásico7 (ALK) localmente avançado ou metastático.
Alecensa® está indicado para o tratamento de pacientes com CPNPC localmente avançado ou metastático positivo para ALK que tenham progredido durante o uso de crizotinibe, ou que sejam intolerantes a ele.
RESULTADOS DE EFICÁCIA
Câncer3 de pulmão4 de não pequenas células5 ALK positivo em pacientes não tratados previamente
A segurança e a eficácia de Alecensa® foram avaliadas em um estudo clínico aberto Fase III randomizado8 global (BO28984) em pacientes que apresentam CPNPC positivo para ALK, não tratados previamente. Foi exigida positividade no teste central realizado por imuno-histoquímica (IHQ) Ventana anti-ALK (D5F3) para a expressão da proteína ALK de amostras de tecidos de todos os pacientes antes da randomização para o estudo.
No total, 303 pacientes foram incluídos no estudo Fase III, sendo 151 pacientes randomizados para o braço crizotinibe e 152 pacientes randomizados para o braço de Alecensa®, via oral, na dose recomendada de 600 mg duas vezes ao dia.
ECOG (Eastern Cooperative Oncology Group [Grupo Cooperativo Oriental de Oncologia]) PS (Performance Status [Status de performance]) (0/1 versus 2), raça (asiática vs. não asiática) e metástases9 no sistema nervoso central10 (SNC11) no período basal (sim versus não) foram os fatores de estratificação para randomização. O desfecho primário do estudo foi demonstrar a superioridade de Alecensa® versus crizotinibe com base na sobrevida12 livre de progressão (SLP) de acordo com avaliação do investigador que utilizou os Critérios de Avaliação de Resposta em Tumores Sólidos (RECIST) versão 1.1. Características demográficas basais e características da doença para Alecensa® foram idade mediana de 58 anos (54 anos para crizotinibe), 55% do sexo feminino (58% para crizotinibe), 55% não asiáticos (54% para crizotinibe), 61% sem histórico de tabagismo (65% para crizotinibe), 93% ECOG PS de 0 ou 1 (93% para crizotinibe), 97% com doença em estágio IV (96% para crizotinibe), 90% de histologia com adenocarcinoma13 (94% para crizotinibe), 40% com metástases9 no SNC11 no período basal (38% para crizotinibe) e 17% que haviam recebido radioterapia14 prévia para SNC11 (14% para crizotinibe).
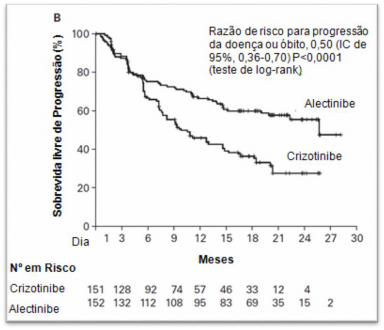
O estudo atingiu seu desfecho primário na análise primária. Dados de eficácia estão resumidos na Tabela 01 e as curvas de Kaplan-Meier para sobrevida12 livre de progressão (SLP) avaliada pelo investigador (INV) e pelo Comitê de Revisão Independente (CRI) são mostradas nas Figuras 1 e 2.
Tabela 1. Resumo dos resultados de eficácia do estudo BO28984.
|
|
crizotinibe N=151 |
Alecensa® N=152 |
|
Duração da mediana de acompanhamento (meses) |
17,6 (intervalo de 0,3 – 27,0) |
18,6 (intervalo de 0,5 – 29,0) |
|
Parâmetro primário de eficácia |
||
|
SLP (INV) Número de pacientes com evento N (%) Mediana (meses) [IC de 95%] |
102 (68%) 11,1 [9,1; 13,1] |
62 (41%) NE [17,7; NE] |
|
RR [IC de 95%] Valor de p log-rank estratificado |
0,47 [0,34, 0,65] p <0,0001 |
|
|
Parâmetros secundários de eficácia |
||
|
SLP (CRI) * Número de pacientes com evento N (%) Mediana (meses) [IC de 95%] |
92 (61%) 10,4 [7,7; 14,6] |
63 (41%) 25,7 [19,9; NE] |
|
RR [IC de 95%] Valor de p log-rank estratificado |
0,50 [0,36; 0,70] p < 0,0001 |
|
|
Tempo até progressão no SNC11 (CRI) * (sem doença progressiva sistêmica prévia**) Número de pacientes com evento N (%) |
68 (45%) |
18 (12%) |
|
RR específica por causa [IC de 95%] Valor de p log-rank estratificado |
0,16 [0,10; 0,28] p < 0,0001 |
|
|
Incidência15 cumulativa em 12 meses de progressão no SNC11 (CRI) % (IC de 95%) |
41,4% [33,2; 49,4] |
9,4% [5,4; 14,7] |
|
TRO (INV) *,*** Respondedores N (%) [IC de 95%] |
114 (75,5%) [67,8; 82,1] |
126 (82,9%) [76,0; 88,5] |
|
Sobrevida12 global* Número de pacientes com evento N (%) * Mediana (meses) [IC de 95%] |
40 (27%) NE [NE; NE] |
35 (23%) NE [NE; NE] |
|
RR [IC de 95%] |
0,76 [0,48; 1,20] |
|
|
Duração da resposta (INV) Mediana (meses) IC de 95% |
N=114 11,1 [7,9; 13,0] |
N=126 NE [NE; NE] |
|
SNC11-TRO em pacientes com metástases9 no SNC11 mensuráveis no período basal Respondedores SNC11 N (%) [IC de 95%] SNC11-RC N (%) SNC11-DR, mediana (meses) IC de 95% |
N=22 11 (50,0%) [28,2; 71,8] 1 (5%) 5,5 [2,1, 17,3] |
N=21 17 (81,0%) [58,1; 94,6] 8 (38%) 17,3 [14,8, NE] |
|
SNC11-TRO em pacientes que apresentam metástases9 no SNC11 mensuráveis e não mensuráveis no período basal (CRI) Respondedores SNC11 N (%) [IC de 95%] SNC11-RC N (%) SNC11-DR, mediana (meses) IC de 95%. |
N=58 15 (25,9%) [15,3%; 39,0%] 5 (9%) 3,7 [3,2, 6,8] |
N=64 38 (59,4%) [46,4%; 71,5%] 29 (45%) NE [17,3, NE] |
*Parte dos desfechos-chave secundários do teste hierárquico
** Análise de risco concorrente de progressão para SNC11, progressão sistêmica e óbito16 como eventos concorrentes
*** Dois pacientes no braço de crizotinibe e 6 pacientes no braço de alectinibe apresentaram RC
IC = intervalo de confiança; SNC11 = sistema nervoso central10; RC = resposta completa; DR = duração da resposta; RR = razão de risco; CRI = Comitê de Revisão Independente; INV = investigador; NE = não estimado; TRO = taxa de resposta objetiva e SLP = sobrevida12 livre de progressão.
A magnitude do benefício em SLP foi constante para pacientes17 que apresentam metástases9 no SNC11 no período basal (RR=0,40, IC de 95%: 0,25 - 0,64, SLP mediana para Alecensa® = NE, IC de 95% - 9,2-NE, SLP mediana para crizotinibe = 7,4 meses, IC de 95%: 6,6 - 9,6) e sem metástases9 no SNC11 no período basal (RR = 0,51, IC de 95%: 0,33 - 0,80, SLP mediana para Alecensa® = NE, IC de 95%: NE, SLP mediana para crizotinibe = 14,8 meses, IC de 95%:10,8-20,3), indicando benefício de Alecensa® em relação a crizotinibe nos dois subgrupos.
Figura 1. Plotagem de Kaplan-Meier de SLP avaliada pelo investigador no estudo clínico BO28984.
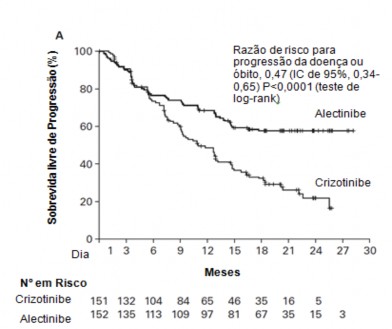
Figura 2. Plotagem de Kaplan-Meier de SLP avaliada pelo CRI no estudo clínico BO28984.
Câncer3 de pulmão4 de não pequenas células5 ALK positivo em pacientes tratados previamente com crizotinibe
A segurança e a eficácia de Alecensa® em pacientes com CPNPC ALK positivo tratados previamente com crizotinibe foram avaliadas em dois estudos clínicos Fase I/II (NP28761 e NP28673).
O estudo NP28761 foi um estudo Fase I/II de braço único, multicêntrico, conduzido em pacientes com CPNPC ALK positivo avançado que haviam progredido previamente durante tratamento com crizotinibe. Adicionalmente ao crizotinibe, os pacientes poderiam ter recebido tratamento prévio com quimioterapia18. No total, 87 pacientes foram incluídos na parte da fase II do estudo e receberam Alecensa® via oral na dose recomendada de 600 mg duas vezes ao dia.
O desfecho primário foi avaliar a eficácia de Alecensa® por taxa de resposta objetiva (TRO) de acordo com avaliação utilizando os Critérios de Avaliação de Resposta em Tumores Sólidos (RECIST) versão 1.1.
Os dados demográficos dos pacientes foram compatíveis com os de uma população com CPNPC ALK positivo. As características demográficas da população total do estudo foi 84% de brancos, 8% de asiáticos, 55% do sexo feminino e uma mediana de idade de 54 anos. A maioria dos pacientes não apresentava história de tabagismo (62%). O estado de desempenho ECOG (Eastern Cooperative Oncology Group [Grupo Cooperativo Oriental de Oncologia]) no período basal era 0 ou 1 em 90% dos pacientes e 2 em 10% dos pacientes. No momento da inclusão no estudo, 99% dos pacientes apresentavam doença em estágio IV, 60% apresentavam metástases9 cerebrais e, em 94% dos pacientes, os tumores foram classificados como adenocarcinoma13. Entre os pacientes incluídos no estudo, 26% haviam progredido previamente durante tratamento apenas com crizotinibe e 74% haviam progredido previamente durante tratamento com crizotinibe e quimioterapia18.
Tabela 2. Resumo de eficácia a partir do estudo NP28761
|
|
NP28761 |
|
Duração mediana do acompanhamento (meses) |
17 (intervalo de 1 – 29) |
|
Parâmetros primários de eficácia |
|
|
TRO (CRI) em população RE Respondedores N (%) [IC de 95%] |
N ? 67 a 35 (52,2%) [39,7%, 64,6%] |
|
Parâmetros secundários de eficácia |
|
|
DR (CRI) Número de pacientes com eventos N (%) Mediana (meses) [IC de 95%] |
N ? 35 20 (57,1%) 14,9 [6,9, NE] |
|
SLP (CRI) Número de pacientes com eventos N (%) Duração mediana (meses) [IC de 95%] |
N = 87 58 (66,7) 8,2 [6,3, 12,6] |
|
Parâmetros exploratórios de eficácia TCD (CRI) em População REb RC+RP+DEc [IC de 95%] |
N = 67a 53 (79,1%) [67,4%, 88,1%] |
IC = intervalo de confiança; DR = duração da resposta; TCD = taxa de controle de doença; CRI = comitê de revisão independente; NE = não estimado; TRO = taxa de resposta objetiva; SLP = sobrevida12 livre de progressão; RE ? resposta passível de avaliação; RC = resposta completa; RP = resposta parcial e DE = doença estável.
a 20 pacientes não apresentavam doença mensurável no período basal de acordo com o CRI e não foram incluídos na população passível de avaliação de resposta pelo CRI.
b Análise exploratória definida depois do fechamento do banco de dados.
c TCD calculado que inclui todos os pacientes que atingiram uma melhor resposta global (MRG) de DE (duração mínima de cinco semanas, de acordo com a Carta do CRI).
Como mostrado na plotagem em cascata na Figura 3, a maioria dos pacientes apresentou redução do volume tumoral em suas lesões19-alvo definidas, conforme avaliação do CRI de acordo com RECIST 1.1.
Figura 3. Plotagem em cascata da soma dos maiores diâmetros de lesões19-alvo – melhor alteração relativa ao valor basal sombreada pela melhor resposta global (CRI) a partir do estudo NP28761
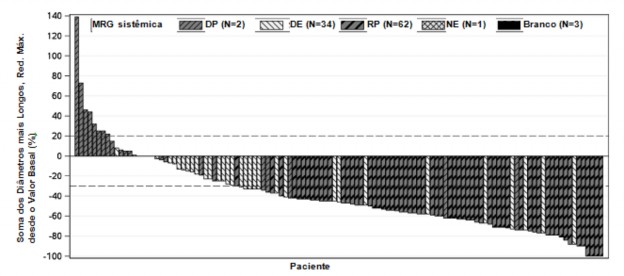
MRG = melhor resposta global, DP = doença progressiva, DE = doença estável, RP = resposta parcial e NE = não estimado.
Qualidade de vida (QoL)
Dos itens de QoL analisados (QLQ-C30 e QLQ-LC13), melhoras clinicamente significativas (alteração relativa ao valor basal ? 10 pontos) foram observadas nas subescalas de Estado Geral de Saúde2, Desempenho Emocional, Desempenho Social, Fadiga20 e Dor.
O estudo NP28673 foi um estudo Fase I / II de braço único, internacional, multicêntrico, conduzido em pacientes que apresentam CPNPC ALK positivo que haviam progredido anteriormente em tratamento com crizotinibe. Além de crizotinibe, os pacientes poderiam ter recebido tratamento prévio com quimioterapia18. No total, 138 pacientes foram incluídos na parte da fase II do estudo e receberam Alecensa® via oral na dose recomendada de 600 mg duas vezes ao dia.
O desfecho primário foi avaliar a eficácia de Alecensa® por TRO de acordo com a avaliação do CRI central que utilizou RECIST 1.1 na população geral (com e sem exposição prévia a tratamentos quimioterápicos citotóxicos21). O desfecho coprimário foi avaliar a TRO de acordo com avaliação do CRI central que utilizou RECIST 1.1 em pacientes que apresentam exposição prévia a tratamentos quimioterápicos.
Os dados demográficos dos pacientes foram compatíveis com os de uma população com CPNPC ALK positivo. As características demográficas da população total do estudo foram: 67% brancos, 26% asiáticos, 56% do sexo feminino e a mediana de idade foi de 52 anos. A maioria dos pacientes não apresentava história de tabagismo (70%). O estado de desempenho ECOG no período basal era 0 ou 1 em 91% dos pacientes e 2 em 9 % dos pacientes. No momento da inclusão no estudo, 99% dos pacientes apresentavam doença em estágio IV, 61% apresentavam metástases9 cerebrais e, em 96% dos pacientes, os tumores foram classificados como adenocarcinoma13. Entre os pacientes incluídos no estudo, 20% haviam progredido previamente durante tratamento apenas com crizotinibe e 80% haviam progredido previamente durante tratamento com crizotinibe e quimioterapia18.
Tabela 3. Resumo de eficácia a partir do estudo NP28673.
|
|
NP28673 |
|
Duração mediana de acompanhamento (meses) |
21 (intervalo de 1 – 30) |
|
Parâmetros primários de eficácia |
|
|
TRO (CRI) em população RE Respondedores N (%) [IC de 95%] |
N=122a 62 (50,8%) [41,6%, 60,0%] |
|
TRO (CRI) em pacientes tratados previamente com quimioterapia18 Respondedores N (%) [IC de 95%] |
N = 96 43 (44,8%) [34,6%, 55,3%] |
|
Parâmetros secundários de eficácia |
|
|
DR (CRI) Número de pacientes com eventos N (%) Mediana (meses) [IC de 95%] |
N = 62 36 (58,1%) 15,2 [11,2, 24,9] |
|
SLP (CRI) Número de pacientes com eventos N (%) Duração mediana (meses) [IC de 95%] |
N = 138 98 (71,0%) 8,9 [5,6, 12,8] |
|
Parâmetro exploratório de eficácia TCD (CRI) em população REb RC + RP + DEc [IC de 95%] |
N = 122a 96 (78,7%) [70,4%, 85,6%] |
IC = intervalo de confiança; DR = duração da resposta; TCD = taxa de controle de doença; CRI ? comitê de revisão independente; NE = não estimado; TRO = taxa de resposta objetiva; SLP = sobrevida12 livre de progressão; RE ? resposta passível de avaliação; DE = doença estável; RC = resposta completa e RP = resposta parcial.
a Dezesseis pacientes não apresentavam doença mensurável no período basal de acordo com o CRI e não foram incluídos na população passível de avaliação de resposta pelo CRI.
b Análise exploratória definida depois do fechamento do banco de dados.
c TCD calculada que incluiu todos os pacientes que atingiram uma melhor resposta global (MRG) de DE (duração mínima de cinco semanas de acordo com a Carta do CRI).
Como mostrado na plotagem em cascata na Figura 4, a maioria dos pacientes apresentou redução do volume tumoral de suas lesões19-alvo definidas, conforme avaliação do CRI de acordo com o RECIST 1.1.
Figura 4. Plotagem em cascata da soma dos maiores diâmetros de lesões19-alvo – melhor alteração relativa ao valor basal sombreada pela melhor resposta global (CRI) a partir do estudo NP28673
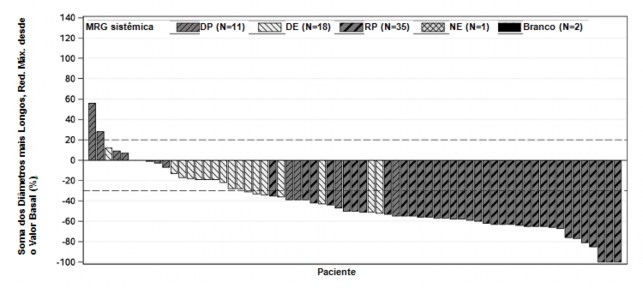
MRG= melhor resposta global, DP = doença progressiva, DE = doença estável, RP = resposta parcial, NE = não estimado.
Um resumo das análises agrupadas dos desfechos do sistema nervoso central10 (SNC11) baseadas em RECIST (CRI) realizadas em pacientes que apresentam lesões19 do SNC11 mensuráveis no período basal (N=50), incluídos na fase II do NP28761 e do NP28673, é apresentado na tabela a seguir.
Tabela 4. Resumo da análise agrupada para desfechos do SNC11 a partir dos estudos NP28761 e NP28673
|
Parâmetros do SNC11 (NP28761 e NP28673) |
Alecensa® 600 mg duas vezes ao dia |
|
Pacientes com lesões19 mensuráveis do SNC11 no período basal TRO SNC11 (CRI) Respondedores (%) [IC de 95%] Resposta completa Resposta parcial
TCD SNC11 (CRI) RC+RP+DEa [IC de 95%]
SNC11 DR (CRI) Número de pacientes com eventos (%) Mediana (meses) [IC de 95%] |
N = 50 32 (64,0%) [49,2%, 77,1%] 11 (22,0%) 21 (42,0%)
45 (90,0%) [78,2%, 96,7%]
N=32 18 (56,3%) 11,1 [7,6; NE] |
IC = intervalo de confiança; RC = resposta completa; TCD = taxa de controle de doença; DR = duração da resposta; CRI = comitê de revisão independente; NE = não estimado; TRO = taxa de resposta objetiva; RP = resposta parcial; DE = doença estável.
aTCD calculada que incluiu todos os pacientes que atingiram uma melhor resposta global (MRG) de DE (duração mínima de 5 semanas de acordo com a Carta do CRI).
Na fase II dos estudos NP28761 e do NP28673, em 136 pacientes incluídos, com lesões19 mensuráveis e/ou não mensuráveis do SNC11 no período basal, a taxa de resposta completa do SNC11 foi de 28,7%. Uma resposta parcial do SNC11 não pode ser estabelecida em lesões19 do SNC11 não mensuráveis de acordo com RECIST. A taxa de controle da doença no SNC11 foi de 86,0% [IC de 95% (79,1, 91, 4)].
Referências bibliográficas
- Clinical Study Report NP28761: Primary Clinical Study Report (NP28761/AF002JG) ? A Phase I/II Study of the ALK inhibitor alectinib in patients with ALK rearranged non-small cell lung cancer3 previously treated with crizotinib. Lancet Oncol. 2016 Feb;17(2):234-242. doi: 10.1016/S1470-2045(15)00488-X. Epub 2015 Dec 19.
Clinical Study Report NP28673: Primary Clinical Study Report (NP28673) ? An open-label, non- randomized, multicenter Phase I/II trial of RO5424802 given orally to non-small cell lung cancer3 patients who have ALK mutation and who have experienced disease progression on crizotinib. J Clin Oncol. 2016 Mar 1;34(7):661-8. doi: 10.1200/JCO.2015.63.9443. Epub 2015 Nov 23.3. Clinical Study Report Protocol BO28984 Report Number 1078196 – Global randomized Phase III open label clinical trial (BO28984) in ALK-positive NSCLC patients who were treatment naïve. N Engl J Med 2017; 377:829-838August 31, 2017DOI: 10.1056/NEJMoa1704795.
CARACTERÍSTICAS FARMACOLÓGICAS
Propriedades Farmacodinâmicas
Mecanismo de Ação: Alectinibe é um inibidor altamente seletivo e potente dos receptores tirosina22 quinase ALK e RET. Em estudos não clínicos, a inibição da atividade de tirosina22 quinase ALK levou ao bloqueio de vias de sinalização downstream que incluem STAT 3 e PI3K/AKT e induz morte celular tumoral (apoptose23).
Alectinibe demonstrou atividade in vitro e in vivo contra formas mutantes de ALK, que incluíram mutações responsáveis pela resistência ao crizotinibe. O principal metabólito24 de alectinibe (M4) apresentou potência e atividade semelhantes in vitro.
Com base nos dados não clínicos, alectinibe não é um substrato da glicoproteína P (P-gp) ou da Proteína de Resistência ao Câncer3 de Mama25 (BCRP), que são transportadores de efluxo na barreira hematoencefálica, e é, portanto, capaz de se distribuir e ser retido dentro do sistema nervoso central10. Alectinibe induziu regressão tumoral em modelos não clínicos de xenoenxerto em camundongo, o que inclui atividade antitumoral no cérebro26 e sobrevida12 prolongada em modelos de tumor27 intracraniano em animais.
Propriedades Farmacocinéticas
Os parâmetros farmacocinéticos de alectinibe e de seu principal metabólito24 ativo (M4) foram caracterizados em pacientes que apresentam CPNPC ALK positivo e em indivíduos saudáveis. As médias geométricas (coeficiente de variação %) de Cmax (concentração máxima), Cmin (concentração mínima) e ASC0-12hr (área sobre a curva de zero a doze horas) do alectinibe em estado de equilíbrio foram aproximadamente 665 ng/mL (44,3%), 572 ng/mL (47,8%) e 7430 ng*h/mL (45,7%), respectivamente. As médias geométricas de Cmax, Cmin e ASC0-12h em estado de equilíbrio do M4 foram aproximadamente 246 ng/mL (45,4 %), 222 ng/mL (46,6 %) e 2810 ng*h/mL (45,9 %), respectivamente.
Absorção: Depois da administração oral de 600 mg duas vezes ao dia com alimentos em pacientes que apresentam CPNPC ALK positivo, alectinibe foi rapidamente absorvido, atingiu Tmax depois de aproximadamente 4 (quatro) a 6 (seis) horas.
O estado de equilíbrio de alectinibe foi atingido em torno do Dia 7 com administração contínua da dosagem de 600 mg duas vezes ao dia e permaneceu estável desde então. A razão de acúmulo de médias geométricas estimada
por análise da população farmacocinética (PK) para o esquema de 600 mg duas vezes ao dia é 5,6. A análise da população PK apoia a proporcionalidade da dose do alectinibe no intervalo de doses de 300 a 900 mg com alimentos.
A biodisponibilidade absoluta do alectinibe foi de 36,9% (IC de 90%: 33,9%, 40,3%) com alimentos em participantes de pesquisa saudáveis.
Após uma única administração oral de 600 mg com uma refeição rica em gorduras e rica em calorias28, a exposição aumentou em 3 vezes em relação às condições de jejum (razão de médias geométricas [IC de 90%] de alectinibe combinado e M4: Cmax: 3,31 [2,79 – 3,93], ASCinf: 3,11 [2,73 – 3,55].
Distribuição: Alectinibe e seu principal metabólito24 M4 são altamente ligados às proteínas29 plasmáticas humanas (> 99%), independentemente da concentração da droga. A média das taxas de concentração no sangue30 e no plasma31 humano de alectinibe e M4 in vitro é 2,64 e 2,50, respectivamente, em concentrações clinicamente relevantes.
A média geométrica do volume de distribuição em estado de equilíbrio (Vss) de alectinibe depois de administração IV foi de 475L, que indicou extensa distribuição para os tecidos.
Metabolismo32: Estudos de metabolismo32 in vitro mostraram que a CYP3A4 é a principal isozima CYP mediando o alectinibe e seu principal metabólito24, M4. Estima-se que contribua com 40% a 50% do metabolismo32 de alectinibe nos hepatócitos humanos. Resultados do estudo de balanço de massa humano demonstraram que alectinibe e M4 foram as principais moléculas circulantes no plasma31, sendo que alectinibe e M4 juntos constituíram aproximadamente 76% da radioatividade total no plasma31. A média geométrica da razão metabólito24/droga original em estado de equilíbrio é de 0,399.
Eliminação: Após a administração de uma dose única de alectinibe marcado com 14C, administrado via oral em indivíduos saudáveis, a maior parte da radioatividade foi excretada nas fezes (recuperação média de 97,8%, intervalo de 95,6% a 100%) com excreção mínima na urina33 (recuperação média de 0,46%, intervalo de 0,30% a 0,60%). Nas fezes, 84% e 5,8% da dose foi excretada como alectinibe inalterado ou M4, respectivamente.
Com base em uma análise de população PK, a depuração (clearance) aparente (CL/F) de alectinibe foi de 81,9 L/hora. A média geométrica da meia-vida de eliminação individual estimada de alectinibe foi de 32,5 horas. Os valores correspondentes para M4 foram 217 L/hora e 30,7 horas, respectivamente.
Farmacocinética em populações especiais
População pediátrica: Não foram conduzidos estudos, a fim de investigar a farmacocinética de Alecensa® nesta população.
População geriátrica: A idade não tem um efeito sobre a exposição a Alecensa® (vide item “8. Posologia e Modo de Usar - Instruções Especiais de Posologia”).
Insuficiência renal34: Quantidades insignificantes de alectinibe e o metabólito24 ativo M4 são excretados inalterados na urina33 (< 0,2% da dose). Os dados obtidos em pacientes que apresentam insuficiência renal34 leve e moderada mostram que a farmacocinética de alectinibe não é afetada de forma significativa na insuficiência renal34. Nenhum estudo farmacocinético formal foi conduzido e não foi coletado nenhum dado de população PK em pacientes que apresentam insuficiência renal34 grave; no entanto, como a eliminação de alectinibe através do rim35 é insignificante, não é necessário nenhum ajuste de dose na insuficiência renal34 (vide item “8. Posologia e Modo de Usar - Instruções Especiais de Posologia”).
Insuficiência hepática36: Como a eliminação de alectinibe dá-se predominantemente por meio do metabolismo32 no fígado37, o comprometimento hepático pode aumentar a concentração plasmática de alectinibe e/ou de seu principal metabólito24 ativo, o M4. Com base em uma análise farmacocinética populacional, as exposições a alectinibe e M4 foram semelhantes em pacientes que apresentam comprometimento hepático leve (bilirrubina38 total basal menor ou igual a LSN e AST basal maior do que LSN ou bilirrubina38 total basal maior do que 1,0 a 1,5 vez LSN e qualquer AST basal) e função hepática39 normal (bilirrubina38 total menor ou igual a LSN e AST menor ou igual a LSN).
Após a administração de uma dose oral única de 300 mg de alectinibe em indivíduos com insuficiência hepática36 moderada (Child-Pugh B), a exposição combinada de alectinibe e M4 foi modestamente aumentada em comparação com indivíduos saudáveis (relação da média geométrica [Intervalo de confiança de 90%] para moderado / saudável: Cmax: 1,16 [0,786 - 1,72], AUCinf: 1,36 [0,947 - 1,96]). A administração de uma dose oral única de 300 mg de alectinibe em indivíduos com insuficiência hepática36 grave (Child-Pugh C) resultou num aumento maior da exposição de alectinibe e M4 comparados com indivíduos saudáveis (relação da média geométrica [intervalo de confiança de 90%] para grave / saudável: Cmax: 0,981 [0,517 - 1,86], AUCinf: 1,76 [0,984 - 3,15]).
Nenhum ajuste de dose é requerido para Alecensa® em pacientes com insuficiência hepática36 subjacente leve ou moderada. Pacientes com insuficiência hepática36 subjacente grave devem receber uma dose de 450 mg administradas oralmente, duas vezes ao dia (dose diária total de 900 mg).
Segurança não clínica
Carcinogenicidade: Não foram realizados estudos de carcinogenicidade para estabelecer o potencial carcinogênico de Alecensa®.
Genotoxicidade: Alectinibe não foi mutagênico in vitro no ensaio de mutação40 reversa bacteriana (Ames), mas induziu discreto aumento em aberrações numéricas no ensaio citogenético in vitro que utilizou células5 de Pulmão4 de Hamster Chinês (CHL) com ativação metabólica e micronúcleos em um teste de micronúcleo em uma medula óssea41 de rato. O mecanismo da indução de micronúcleo foi de segregação anormal de cromossomos42 (aneugenicidade), e não um efeito clastogênico sobre os cromossomos42.
Comprometimento da fertilidade: Não foram realizados estudos de fertilidade em animais para avaliar o efeito de Alecensa®. Não foram observados efeitos adversos sobre órgãos reprodutivos de machos e fêmeas em estudos de toxicologia geral conduzidos em ratos e macacos em exposições iguais ou maiores do que 2,6 e 0,5 vezes, respectivamente, da exposição humana com base na ASC na dose recomendada, de 600 mg duas vezes ao dia.
Toxicidade43 reprodutiva: Em estudos com animais, uma dose maternal de alectinibe equivalente a 2,7 vezes a dose humana recomendada, de 600 mg duas vezes ao dia (com base em ASC) causou perda embriofetal (abortamento44) em coelhas prenhes. A mesma dose equivalente administrada a ratas prenhes resultou em fetos pequenos com ossificação retardada e discretas anormalidades dos órgãos.
Outros
Alectinibe absorve a luz UV entre 200 e 400 nm e demonstrou potencial fototóxico em um teste de fotossegurança in vitro em cultura de fibroblastos45 murinos depois de irradiação UVA.
Órgãos-alvo tanto em ratos quanto em macacos com exposições clinicamente relevantes nos estudos de toxicologia de dose repetida incluíam, entre outros, o sistema eritroide, trato gastrintestinal e sistema hepatobiliar46.
Foi observada uma morfologia eritrocitária anormal em exposições iguais ou maiores que 10 a 60% da exposição humana por ASC na dose recomendada. A extensão de zona proliferativa em mucosa47 GI nas duas espécies foi observada em exposições iguais ou maiores do que 20% a 120% da exposição ASC humana na dose recomendada. O aumento da fosfatase alcalina48 (FA) hepática39 e da bilirrubina38 direta, bem como vacuolização/degeneração49/necrose50 do epitélio51 do ducto biliar e aumento / necrose50 focal de hepatócitos foi observada em ratos e/ou macacos nas exposições iguais ou maiores do que 20% a 30% da exposição humana por ASC na dose recomendada.
Foi observado um efeito hipotensor discreto em macacos em exposições clinicamente relevantes próximas. Alectinibe atravessou a barreira hematoencefálica em ratos e foi retido dentro do tecido52 cerebral, com uma razão de concentração entre SNC11 e plasma31 que variou de 0,9 a 1,5, 24 horas depois da administração.
CONTRAINDICAÇÕES
Alecensa® é contraindicado a pacientes com hipersensibilidade conhecida a alectinibe ou a quaisquer de seus excipientes.
ADVERTÊNCIAS E PRECAUÇÕES
Gerais
Doença pulmonar intersticial53 (DPI) / pneumonite54: Casos de DPI/pneumonite54 foram reportados em estudos clínicos com Alecensa® (vide item “9. Reações Adversas”). Os pacientes devem ser monitorados em relação a sintomas55 pulmonares indicativos de pneumonite54. Alecensa® deve ser imediatamente interrompido em pacientes diagnosticados com DPI/pneumonite54 e deve ser definitivamente descontinuado se não for identificada nenhuma outra potencial causa de DPI/pneumonite54 (vide item “8. Posologia e Modo de Usar”).
Hepatotoxicidade56: Elevações na alanina aminotransferase (ALT) e aspartato aminotransferase (AST) acima de cinco vezes o limite superior do normal (LSN), bem como elevações de bilirrubina38 maiores do que três vezes o LSN ocorreram em pacientes em estudos clínicos pivotais com Alecensa® (vide item “9. Reações Adversas”). A maior parte desses eventos ocorreu durante os primeiros três meses de tratamento. Nos estudos clínicos pivotais de Alecensa®, reportou-se que três pacientes que apresentam elevações graus 3-4 de AST/ALT apresentavam lesão57 hepática39 induzida por droga. Elevações concomitantes de ALT ou AST maiores ou iguais a três vezes o LSN e de bilirrubina38 total maiores ou iguais a duas vezes o LSN com fosfatase alcalina48 normal ocorreram em 1 paciente tratado em estudos clínicos com Alecensa®.
Função hepática39, o que inclui ALT, AST e bilirrubina38 total deve ser monitorada no período basal e depois a cada 2 semanas durante os primeiros 3 meses de tratamento. Depois, o monitoramento deve ocorrer periodicamente, porque os eventos podem ocorrer depois dos três meses, com testes mais frequentes em pacientes que desenvolverem elevações de transaminase e bilirrubina38. Com base na severidade da reação adversa à droga, suspenda Alecensa® e reinicie com uma dose reduzida ou descontinue definitivamente Alecensa®, conforme descrito na Tabela 06 (vide item “8. Posologia e Modo de Usar”).
Mialgia58 grave e elevação de creatina fosfoquinase (CPK): Foi reportada mialgia58 ou dor musculoesquelética em pacientes em estudos pivotais com Alecensa®, incluindo eventos Grau 3.
Ocorreram elevações de CPK em estudos pivotais com Alecensa®, incluindo eventos grau 3. O tempo mediano até a elevação Grau 3 de CPK foi de 14 dias nos estudos pivotais fase II (NP28761, NP28673). O tempo mediano até a elevação Grau 3 de CPK foi de 27,5 dias no estudo clínico pivotal fase III (BO28984) (vide item “9. Reações Adversas”).
Oriente os pacientes a reportar qualquer dor, sensibilidade ou fraqueza muscular inexplicada. Avalie os níveis de CPK a cada duas semanas no primeiro mês de tratamento e de acordo com a indicação clínica em pacientes reportando sintomas55. Com base na severidade da elevação de CPK, suspenda Alecensa® e depois reinicie ou reduza a dose (vide item “8. Posologia e Modo de Usar”).
Bradicardia59: Pode ocorrer bradicardia59 sintomática60 com Alecensa® (vide item “9. Reações Adversas”). A frequência cardíaca e a pressão arterial61 devem ser monitoradas conforme indicação clínica. A modificação da dose não é necessária em caso de bradicardia59 assintomática (vide item “8. Posologia e Modo de Usar”). Se os pacientes apresentarem bradicardia59 sintomática60 ou eventos potencialmente fatais, as medicações concomitantes que reconhecidamente
provocam bradicardia59, bem como as medicações anti-hipertensivas devem ser avaliadas e o tratamento com Alecensa® deve ser ajustado conforme descrito na Tabela 06 (vide itens “8. Posologia e Modo de Usar” e “6. Interações Medicamentosas - Substratos P-gp e BCRP”).
Fotossensibilidade
Foi reportada fotossensibilidade à luz solar durante administração de Alecensa® (vide item “9.Reações Adversas”). Os pacientes devem ser orientados a evitar exposição prolongada ao sol enquanto estiverem tomando Alecensa® e durante pelo menos 7 dias depois da descontinuação do tratamento. Os pacientes também devem ser orientados a usar filtro solar de amplo espectro para ultravioleta A (UVA) / ultravioleta B (UVB) e protetor labial (FPS ? 50) para ajudar na proteção contra potencial queimadura solar.
Toxicidade43 embriofetal
Alecensa® pode provocar dano fetal quando administrado a mulheres grávidas. Quando administrado em ratas e coelhas prenhes, alectinibe causou toxicidade43 embriofetal. Pacientes do sexo feminino férteis ou mulheres férteis que sejam parceiras de pacientes do sexo masculino que recebem Alecensa® precisam utilizar métodos contraceptivos altamente efetivos durante o tratamento e durante pelo menos três meses depois da última dose de Alecensa® (vide item “5. Advertências e Precauções – Uso em Populações Especiais”).
Abuso e dependência de drogas
Não se aplica.
Capacidade para dirigir e operar máquinas
Não foram realizados estudos sobre os efeitos na capacidade de dirigir veículos e de operar máquinas.
Informações importantes sobre um dos componentes do medicamento
Este medicamento contém lactose1. Pacientes com problemas hereditários raros de intolerância à galactose62, deficiência congênita63 de lactase ou má absorção de glicose64 e galactose62 não devem tomar este medicamento.
A dose diária de 1200 mg de Alecensa® contém 48 mg de SÓDIO, equivalente a 2,4% da dose máxima diária recomendada pela Organização Mundial da Saúde2 (OMS) de 2 g de sódio para um adulto.
Uso em populações especiais
Contracepção65: Pacientes do sexo feminino férteis ou mulheres férteis que sejam parceiras de pacientes do sexo masculino recebendo Alecensa® precisam usar métodos contraceptivos altamente efetivos durante o tratamento e pelo menos 3 meses depois da última dose de Alecensa®.
Gravidez66 e Lactação67
Categoria de risco na gravidez66: D.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica. Informe imediatamente seu médico em caso de suspeita de gravidez66.
Mulheres férteis precisam ser orientadas a evitar a gravidez66 enquanto estiverem recebendo Alecensa®. Não foram realizados estudos clínicos de Alecensa® em gestantes. Com base em seu mecanismo de ação, Alecensa® podecaus ar dano fetal quando administrado a uma gestante.
Pacientes do sexo feminino ou mulheres que sejam parceiras de pacientes do sexo masculino que recebem Alecensa® que ficarem grávidas enquanto recebem Alecensa® ou durante os 3 (três) meses depois da última dose de Alecensa® precisam entrar em contato com seu médico e devem ser orientadas sobre o potencial dano ao feto68.
Dados em animais: Em estudos feitos em animais, alectinibe causou toxicidade43 embriofetal (vide item “3. Características Farmacológicas - Segurança Não Clínica”).
Trabalho de parto e parto: A segurança de Alecensa® durante o trabalho de parto e o parto não foi estabelecido.
Lactação67: Não se sabe se Alecensa® é excretado no leite materno. Não foram conduzidos estudos para avaliar o impacto de Alecensa® sobre a produção do leite ou sua presença no leite materno. Como muitas drogas são excretadas no leite materno e por causa do potencial dano à criança, as mães devem ser orientadas a não realizar o aleitamento materno69 enquanto estiverem recebendo Alecensa®.
Uso pediátrico: A segurança e a eficácia em pacientes pediátricos com idade abaixo de 18 anos não foram estabelecidas.
Uso geriátrico: Vide itens “8. Posologia e Modo de Usar - Instruções Especiais de Posologia” e “3. Características Farmacológicas - Farmacocinética em Populações Especiais”.
Insuficiência renal34: Vide itens “8. Posologia e Modo de Usar - Instruções Especiais de Posologia” e “3. Características Farmacológicas - Farmacocinética em Populações Especiais”.
Comprometimento hepático: Vide itens “8. Posologia e Modo de Usar - Instruções Especiais de Posologia” e “3. Características Farmacológicas - Farmacocinética em Populações Especiais”.
INTERAÇÕES MEDICAMENTOSAS
Efeitos de alectinibe sobre outras drogas
Substratos CYP: Estudos in vitro indicam que nem alectinibe nem seu principal metabólito24 ativo (M4) inibe CYP1A2, CYP2B6, CYP2C9, CYP2C19 ou CYP2D6 em concentrações clinicamente relevantes. Alectinibe e M4 apresentam uma fraca inibição dependente do tempo de CYP3A4. In vitro, alectinibe apresenta um fraco potencial indutor de CYP3A4 e CYP2B6 em concentrações clínicas.
Resultados de um estudo clínico de interação medicamentosa em pacientes que apresentam CPNPC positivo para ALK demonstraram que múltiplas doses de alectinibe não tiveram nenhuma influência sobre a exposição de midazolam, um substrato CYP3A sensível. Portanto, não é necessário nenhum ajuste da dose para substratos CYP3A administrados concomitantemente.
Embora estudos in vitro indiquem que alectinibe é um inibidor de CYP2C8, o modelo farmacocinético de base fisiológica70 (PBPK) corrobora que, em concentrações clinicamente relevantes, alectinibe não tem o potencial para aumentar as concentrações plasmáticas de substratos de CYP2C8 administrados concomitantemente.
Substratos P-gp e BCRP: In vitro, alectinibe e M4 são inibidores dos transportadores de efluxo da P-glicoproteína (P-gp) e da Proteína de Resistência do Câncer3 de Mama25 (BCRP). Portanto, alectinibe pode ter o potencial para aumentar as concentrações plasmáticas de substratos administrados concomitantemente de transportadores P-gp ou BCRP (não é esperado que o aumento da exposição seja maior do que duas vezes). Quando alectinibe é administrado concomitantemente com substratos P-gp ou BCRP com índice terapêutico estreito (por exemplo: digoxina, dabigatrana e metotrexato), recomenda-se o monitoramento apropriado.
Efeitos de outras drogas sobre alectinibe: Com base em dados in vitro, CYP3A4 é a enzima71 primária na mediação do metabolismo32 de alectinibe e de seu principal metabólito24 ativo, M4, e a CYP3A contribui para 40% – 50% do metabolismo32 hepático total. Demonstrou- se que M4 tem potência e atividade in vitro semelhantes às do alectinibe contra o ALK.
Indutores CYP3A: A administração concomitante de múltiplas doses orais de 600 mg de rifampicina uma vez ao dia, um potente indutor de CYP3A, com uma única dose oral de 600 mg de alectinibe apresentou efeito mínimo sobre a exposição combinada de alectinibe e M4 (razão de médias geométricas com/sem rifampicina [intervalo de confiança 90%]: Cmax: 0,96 [0,88 – 1,05], ASCinf: 0,82 [0,74 – 0,90]). Portanto, não são necessários ajustes da dose quando Alecensa® é administrado concomitantemente com indutores CYP3A.
Inibidores de CYP3A: A administração concomitante de múltiplas doses orais de 400 mg de posaconazol duas vezes ao dia, um potente inibidor de CYP3A, com uma única dose oral de 300 mg de alectinibe teve um efeito mínimo sobre a exposição combinada de alectinibe e M4 (razão de médias geométricas com/sem posaconazol [intervalo de confiança 90%]: Cmax: 0,93 [0,81 – 1,08], ASCinf: 1,36 [1,24 – 1,49]). Portanto, não é necessário nenhum ajuste de dose quando Alecensa® é administrado concomitantemente com inibidores da CYP3A.
Medicamentos que aumentam o pH gástrico: Embora a solubilidade aquosa de alectinibe in vitro seja dependente do pH, um estudo clínico de interação medicamentosa realizado com 40 mg de esomeprazol, um inibidor de bomba de prótons, uma vez ao dia, não demonstrou efeito clinicamente relevante sobre a exposição combinada de alectinibe e M4. Portanto, não é necessário nenhum ajuste de dose quando Alecensa® é administrado concomitantemente com inibidores de bomba de prótons ou outras drogas que elevem o pH gástrico (por exemplo: antagonistas de receptor H2 ou antiácidos72).
Efeito dos transportadores sobre a distribuição de alectinibe
Com base em dados in vitro, alectinibe não é um substrato de P-gp. Alectinibe e M4 não são substratos de BCRP ou do polipeptídeo transportador de ânion orgânico (OATP) 1B1/B3. Por outro lado, M4 é um substrato de P-gp. Alectinibe inibe P-gp e, portanto, não se espera que a medicação concomitante com inibidores P-gp tenha um efeito relevante sobre a exposição a M4.
CUIDADOS DE ARMAZENAMENTO DO MEDICAMENTO
Cuidados de conservação
Alecensa® cápsulas duras deve ser conservado em temperatura ambiente (entre 15 e 30°C) e deve ser mantido dentro do cartucho para proteger da luz e umidade.
Prazo de validade: Este medicamento possui prazo de validade de 36 meses a partir da data de fabricação.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original. Antes de usar, observe o aspecto do medicamento.
Características físicas e organolépticas do produto
As cápsulas duras de Alecensa® apresentam coloração branca com as inscrições “ALE” e “150 mg” em preto.
Descarte de medicamentos não utilizados e/ou com data de validade vencida
O descarte de medicamentos no meio ambiente deve ser minimizado. Os medicamentos não devem ser descartados no esgoto, e o descarte em lixo doméstico deve ser evitado. Utilize o sistema de coleta local estabelecido, se disponível.
TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS.
POSOLOGIA E MODO DE USAR
Gerais
É necessário um ensaio ALK validado para seleção de pacientes que apresentam CPNPC ALK positivo. A situação de CPNPC ALK positivo deve ser estabelecida antes do início da terapia de primeira linha com Alecensa®.
As cápsulas duras de Alecensa® devem ser ingeridas com alimento, devem ser engolidas inteiras e não devem ser abertas ou dissolvidas.
A dose recomendada de Alecensa® é de 600 mg (quatro cápsulas de 150 mg) administradas por via oral duas vezes ao dia (dose diária total de 1200 mg) (vide item “3. Características Farmacológicas”).
Pacientes com insuficiência hepática36 grave subjacente devem receber a dose de 450 mg, administrada oralmente, duas vezes ao dia (dose diária total de 900 mg) (vide itens “8. Posologia e modo de usar - Instruções especiais de posologia” e “3. Características Farmacológicas - Farmacocinética em populações especiais”).
Este medicamento não deve ser partido, aberto ou mastigado.
Duração do tratamento
Recomenda-se que os pacientes sejam tratados com Alecensa® até a progressão da doença ou o aparecimento de toxicidade43 não manejável (vide item “2. Resultados de Eficácia”).
Conduta em caso de esquecimento
Se uma dose programada de Alecensa® for esquecida, os pacientes podem tomar aquela dose, desde que a dose seguinte seja dentro das próximas 6 (seis) horas. Se ocorrerem vômitos73 depois de tomar uma dose de Alecensa®, os pacientes devem tomar a dose seguinte no horário agendado.
Modificações da dose
O tratamento dos eventos adversos pode exigir interrupção temporária, redução da dose ou descontinuação do tratamento com Alecensa®. A dose de Alecensa® deve ser reduzida em passos de 150 mg duas vezes ao dia, com base na tolerabilidade. O tratamento com Alecensa® deve ser definitivamente descontinuado se os pacientes não conseguirem tolerar a dose de 300 mg duas vezes ao dia.
A Tabela 5, a seguir, apresenta a orientação geral para modificação de dose de Alecensa®.
|
Esquema de redução de dose |
Dose |
|
Dose |
600 mg duas vezes ao dia |
|
Primeira redução de dose |
450 mg duas vezes ao dia |
|
Segunda redução de dose |
300 mg duas vezes ao dia |
Tabela 6. Orientação para modificação de dose para Reações adversas à droga especificadas (vide itens “5. Advertências e Precauções” e “9. Reações Adversas”)
|
Grau |
Tratamento com Alecensa® |
|
Doença pulmonar intersticial53 (DPI) / pneumonite54 (todos os Graus) |
Interromper imediatamente e descontinuar definitivamente se não forem identificadas outras potenciais causas de DPI/pneumonite54 |
|
Elevação de ALT ou AST grau ≤3 (> 5 vezes LSN) com bilirrubina38 total ≤ 2 vezes LSN |
Suspender temporariamente até a recuperação para o valor basal ou ≤ grau 1 (≤ 3 vezes LSN), depois reiniciar em dose reduzida (consulte a Tabela 5) |
|
Elevação de ALT ou AST grau ≤ 2 (> 3 vezes LSN) com elevação de bilirrubina38 total > 2 vezes LSN na ausência de colestase74 ou hemólise75 |
Descontinuar definitivamente Alecensa® |
|
Bradicardiaa grau 2 ou grau 3 (sintomática60, pode ser grave e clinicamente significativa, com indicação de intervenção clínica) |
Suspender temporariamente até recuperação para bradicardia59 grau ≤ 1 (assintomática) ou para uma frequência cardíaca ≤ 60 bpm. Avaliar medicações concomitantes que reconhecidamente causam bradicardia59, bem como medicações anti-hipertensivas. Se a medicação concomitante contribuinte for identificada e descontinuada ou sua dose for ajustada, reinicie na dose prévia até recuperação para bradicardia59 grau ≤ 1 (assintomática) ou para uma frequência cardíaca ≤ 60 bpm. Se não for identificada nenhuma medicação concomitante contribuinte ou se as medicações concomitantes contribuintes não forem descontinuadas ou não tiverem suas doses modificadas, reinicie com dose reduzida (consulte a Tabela 1) até a recuperação para bradicardia59 grau ≥ 1 (assintomática) ou para uma frequência cardíaca ≤ 60 bpm. |
|
Bradicardiaa grau 4 (consequências potencialmente fatais, indicada intervenção urgente) |
Descontinuar definitivamente se não houver identificação de medicação concomitante contribuinte. Se for identificada medicação concomitante contribuinte e ela for descontinuada ou sua dose for ajustada, reinicie com dose reduzida (consulte a Tabela 1) depois da redução para bradicardia59 grau ≤ 1 (assintomática) ou para uma frequência cardíaca ≤ 60 bpm, com monitoramento frequente conforme indicação clínica. Descontinuar definitivamente em caso de recorrência76. |
|
Elevação de CPK > 5 vezes LSN |
Suspender temporariamente até a recuperação para o valor basal ou para ≤ 2,5 vezes LSN, depois reinicie na mesma dose |
|
Elevação de CPK >10 vezes LSN ou segunda ocorrência de elevação de CPK > 5 vezes LSN |
Suspender temporariamente até a recuperação para o valor basal ou para ≤ 2,5 vezes LSN, depois reinicie com dose reduzida conforme a Tabela 5 |
ALT = alanina transaminase; AST = aspartato transaminase e LSN = limite superior do normal.
a Frequência cardíaca menor que 60 batimentos por minuto (bpm).
Instruções Especiais de Posologia
Uso pediátrico: A segurança e a eficácia de Alecensa® em crianças e adolescentes (< 18 anos) não foram estudadas.
Uso geriátrico: Não é necessário ajuste de dose de Alecensa® em pacientes ? 65 anos de idade.
Insuficiência renal34: Não é necessário ajuste de dose em pacientes que apresentam insuficiência renal34 leve ou moderada. Alecensa® não foi estudado em pacientes que apresentam insuficiência renal34 grave; no entanto, como a eliminação renal77 de alectinibe é desprezível, nenhum ajuste de dose é necessário em pacientes que apresentam insuficiência renal34 grave (vide itens “5. Advertências e Precauções - Uso em Populações Especiais” e “3. Características Farmacológicas - Farmacocinética em Populações Especiais”).
Insuficiência hepática36: Não é necessário ajuste da dose em pacientes que apresentam insuficiência hepática36 subjacente leve ou moderada. Pacientes com insuficiência hepática36 subjacente grave devem receber uma dose de 450 mg administrada oralmente, duas vezes ao dia (dose diária total de 900 mg) (vide item “3. Características Farmacológicas - Farmacocinética em Populações Especiais”).
REAÇÕES ADVERSAS
Estudos clínicos
Para o programa de desenvolvimento clínico de Alecensa®, estima-se que um total de 928 pacientes tenha recebido Alecensa® e 203 pacientes tenham recebido Alecensa® cego. A segurança de Alecensa® foi avaliada em 253 pacientes nos estudos clínicos pivotais fase II (NP28761, NP28673) que apresentam câncer3 de pulmão4 de não pequenas células5 (CPNPC) positivo para ALK tratados com a dose recomendada de 600 mg duas vezes ao dia. A duração mediana de exposição a Alecensa® foi de 11 meses (intervalo de 0 a 35 meses). A segurança de Alecensa® foi também avaliada em 152 pacientes que apresentam CPNPC positivo para ALK tratados com uma dose de 600 mg duas vezes ao dia no estudo clínico fase III BO28984. A duração mediana de exposição a Alecensa® foi de 17,9 meses.
As reações adversas à droga mais comuns (≤ 20%) foram obstipação78 (36%), edema79 (34%, que inclui edema79 periférico generalizado, de pálpebras80 e periorbitário), mialgia58 (31%, que inclui mialgia58 e dor musculoesquelética), náuseas81 (22%), bilirrubina38 aumentada (21%, que inclui bilirrubina38 sérica aumentada, hiperbilirrubinemia e bilirrubina38 conjugada aumentada), anemia82 (20%, que inclui anemia82 e hemoglobina83 diminuída) e erupção84 (20%, que inclui erupção84, erupção84 maculopapular85, dermatite86 acneiforme, eritema87, erupção84 generalizada, erupção84 papular, erupção84 pruriginosa e erupção84 macular).A Tabela 7 apresenta as reações adversas à droga (RADs) que ocorreram em pacientes que receberam Alecensa® em estudos clínicos (NP28761, NP28673) e no estudo clínico fase III BO28984. Reações adversas à droga a partir de estudos clínicos são listadas por classe de grupo sistêmico88 do MedDRA. A categoria de frequência correspondente para cada reação adversa à droga é baseada na seguinte convenção: reação muito comum (≤1/10), reação comum (≤1/100 a <1/10), reação incomum (≤1/1.000 a <1/100), reação rara (≤1/10.000 a <1/1000) e reação muito rara (<1/10.000).
Tabela 7. Reações adversas à droga que ocorreram em pacientes tratados com Alecensa® em estudos clínicos pivotais fase II (NP28761, NP28673) e estudo fase III BO28984

|
Reações adversas |
Alecensa® |
||
|
Grupo sistêmico88 |
Todos os Graus (%) |
Grau 3 – 4 (%) |
Categoria da frequência(todos os graus) |
|
Distúrbios gastrintestinais |
|||
|
Obstipação78 |
36 |
0 |
muito comum |
|
Náuseas81 |
22 |
0,7# |
muito comum |
|
Diarreia89 |
18 |
1,2 |
muito comum |
|
Vômitos73 |
13 |
0,4 |
muito comum |
|
Estomatite90#1 |
3,3# |
0# |
comum |
|
Distúrbios gerais e condições do local de administração |
|||
|
Edema792 |
34 |
0,8 |
muito comum |
|
Distúrbios musculoesqueléticos e do tecido conectivo91 |
|||
|
Mialgia583 |
31 |
1,2 |
muito comum |
|
Creatina Fosfoquinase Sérica aumentada |
13 |
3,6 |
muito comum |
|
Distúrbio Cutâneo92 e do Tecido Subcutâneo93 |
|||
|
Erupção844 |
20 |
0,7# |
muito comum |
|
Reação de Fotossensibilidade |
12 |
0,7# |
muito comum |
|
Distúrbios do sistema nervoso94 |
|||
|
Disgeusia95#5 |
3,3# |
0,7# |
comum |
|
Distúrbios hepatobiliares96 |
|||
|
Bilirrubina38 aumentada64 |
21# |
3,3# |
muito comum |
|
AST aumentada |
16 |
5,3# |
muito comum |
|
ALT aumentada |
15# |
4,6# |
muito comum |
|
Lesão57 hepática39 induzida por droga7 |
0,8 |
0,8 |
incomum |
|
Distúrbios do sistema sanguíneo e linfático97 |
|||
|
Anemia828 |
20# |
4,6# |
muito comum |
|
Distúrbios oculares |
|||
|
Distúrbios da visão989 |
12 |
0 |
muito comum |
|
Distúrbios cardíacos |
|||
|
Bradicardia5910 |
11# |
0 |
muito comum |
|
Exames |
|||
|
Aumento de peso# |
9,9# |
0,7# |
comum |
|
Distúrbios renal77 e urinário |
|||
|
Creatinina99 sérica aumentada |
7,9# |
1,3#* |
comum |
|
Lesão57 renal77 aguda# |
2,6# |
2,6#* |
comum |
|
Distúrbios respiratórios, torácicos e mediastinais |
|||
|
Doença pulmonar Intersticial53 / pneumonite54 |
1,3# |
0,4 |
comum |
* Inclui um evento de grau 5
# Evento e/ou taxa reportado no estudo BO28984; N=152 pacientes tratados com Alecensa®; restante dos eventos e/ou taxas reportadas nos estudos NP28761, NP28673; N=253 pacientes tratados com Alecensa®
1 Inclui casos de estomatite90 e ulceração100 oral
2 Inclui casos de edema79 periférico, edema79, edema79 generalizado, edema79 de pálpebras80 e edema79 periorbitário
3 Inclui casos de mialgia58 e dor musculoesquelética
4 Inclui casos de erupção84, erupção84 maculopapular85, dermatite86 acneiforme, eritema87, erupção84 generalizada, erupção84 papular, erupção84 pruriginosa e erupção84 macular
5 Inclui casos de disgeusia95 e hipogeusia
6 Inclui casos de bilirrubina38 sérica aumentada, hiperbilirrubinemia e bilirrubina38 conjugada aumentada
7 Inclui um paciente que apresenta termo MedDRA reportado de lesão57 hepática39 induzida por droga bem como um paciente que apresenta AST e ALT aumentadas Grau 4 reportadas que apresentou lesão57 hepática39 induzida por droga comprovada por biópsia101 hepática39.
8 Inclui casos de anemia82 e hemoglobina83 diminuída
9 Inclui casos de visão98 turva, comprometimento visual, moscas volantes em vítreo102, acuidade visual103 reduzida, astenopia e diplopia104
10 Inclui casos de bradicardia59 e bradicardia59 sinusal
Mais informações sobre reações adversas à droga selecionadas:
O perfil de segurança de Alecensa® foi geralmente consistente entre o estudo clínico fase III (BO28984) e os estudos pivotais fase II (NP28761, NP28673); no entanto, diferenças relevantes entre os estudos são descritas a seguir.
Doença pulmonar intersticial53 (DPI) / pneumonite54
DPI/pneumonite54 garve ocorreu em pacientes tratados com Alecensa®. Nos estudos clínicos pivotais fase II (NP28761, NP28673), 1 de 253 pacientes tratados com Alecensa® (0,4%) apresentou um evento de DPI, que foi grau 3, levando à retirada do tratamento com Alecensa®. Não houve casos fatais de DPI em nenhum dos estudos clínicos.
Hepatotoxicidade56
Nos estudos clínicos pivotais fase II (NP28761, NP28673), dois pacientes que apresentam elevações grau 3-4 de AST/ALT apresentaram lesão57 hepática39 induzida por droga comprovada por biópsia101 hepática39. Reações adversas de níveis de AST e ALT aumentadas (16% e 14%, respectivamente) foram reportadas em pacientes tratados com Alecensa® nos estudos clínicos pivotais fase II (NP28761, NP28673). A maioria desses eventos teve intensidade grau 1 e 2 e eventos de grau ≤ 3 foram reportados em 2,8% e 3,2% dos pacientes, respectivamente. Os eventos em geral ocorreram durante os primeiros 3 meses de tratamento, foram geralmente transitórios e foram resolvidos com interrupção temporária do tratamento com Alecensa® (reportado para 1,2% e 3,2% dos pacientes, respectivamente) ou redução da dose (1,6% e 0,8%, respectivamente). Em 1,2% e 1,6% dos pacientes, as elevações de AST e ALT, respectivamente, levaram à retirada do tratamento com Alecensa®.
Reações adversas de elevações de bilirrubina38 foram reportadas em 17% dos pacientes tratados com Alecensa® em estudos clínicos pivotais fase II (NP28761, NP28673). A maior parte dos eventos foram de intensidade graus 1 e 2; eventos grau 3 foram reportados em 3,2% dos pacientes. Os eventos em geral ocorreram durante os primeiros 3 meses de tratamento, foram usualmente transitórios e foram resolvidos com a interrupção temporária do tratamento com Alecensa® (4,7% dos pacientes) ou redução da dose (2,8%). Em 4 pacientes (1,6%), as elevações de bilirrubina38 levaram à retirada do tratamento com Alecensa®.
Elevações concomitantes de ALT ou AST maiores ou iguais a três vezes o LSN e de bilirrubina38 total maiores ou iguais a duas vezes o LSN com fosfatase alcalina48 normal ocorreram em 1 paciente tratado, em estudos clínicos com Alecensa®.
Bradicardia59
Casos de bradicardia59 (7,9%) foram reportados em pacientes tratados com Alecensa® em estudos clínicos pivotais fase II (NP28761, NP28673); todos os casos foram de intensidade Grau 1 ou 2. Houve 44 de 221 pacientes (20%) tratados com Alecensa® que apresentaram valores de frequência cardíaca pós-administração abaixo de 50 batimentos por minuto (bpm).
Mialgia58 grave e elevação de CPK
Casos de mialgia58 (31%), que incluíram eventos de mialgia58 (25%) e dor musculoesquelética (7,5%) foram reportados em pacientes tratados com Alecensa® em estudos clínicos pivotais fase II (NP28761, NP28673). A maior parte dos eventos foram graus 1 ou 2 e três pacientes (1,2%) apresentaram um evento grau 3. Modificações de dose devido a esses eventos foram necessárias apenas para dois pacientes (0,8%). Elevações de CPK ocorreram em 46% de 219 pacientes que apresentam dados laboratoriais de CPK disponíveis nos estudos clínicos pivotais fase II (NP28761, NP28673) com Alecensa®. A incidência15 de elevações grau 3 de CPK foi de 5,0%. O tempo mediano até a elevação grau 3 de CPK foi de 14 dias nos estudos pivotais fase II (NP28761, NP28673). O tempo mediano até a elevação grau 3 de CPK foi de 27,5 dias no estudo clínico pivotal fase III (BO28984). Modificações de dose por elevação de CPK ocorreram em 4,0% dos pacientes.
Anormalidades laboratoriais
A tabela a seguir mostra os desvios emergentes com o tratamento em anormalidades laboratoriais que ocorreram em pacientes tratados com Alecensa® em estudos clínicos fase II (NP28761, NP28673) e no estudo fase III BO28984.
Tabela 8. Desvios emergentes com o tratamento de Alecensa® em anormalidades laboratoriais chave
|
Parâmetro |
Alectinibe N= 250*/N=152# |
|
|
|
Todos os Graus (%) |
Grau 3–4(%)° |
|
Bioquímica |
||
|
Creatinina99 sérica aumentada** |
38# |
3,4# |
|
AST aumentada |
53* |
6,2# |
|
ALT aumentada |
40# |
6,1# |
|
Creatina fosfoquinase sérica aumentada |
46* |
5,0* |
|
Bilirrubina38 sérica aumentada |
53# |
5,5# |
|
Hematologia |
||
|
Hemoglobina83 diminuída |
62# |
6,8# |
AST - Aspartato aminotransferase, ALT - Alanina aminotransferase
Observação: as anormalidades laboratoriais foram baseadas nos intervalos normais do NCI CTCAE.
* Taxa reportada nos estudos NP28761 e NP28673, N=219 para creatina fosfoquinase.
** Apenas pacientes que apresentam aumentos de creatinina99 baseados na definição do LSN (classificação CTCAE).
# Taxa reportada no estudo BO28984; pacientes que apresentam valor basal ignorado e/ou sem avaliações laboratoriais após valor basal foram excluídos das análises; N=147 para Creatinina99 Sérica, ALT e Hemoglobina83; N=145 para AST; N=146 para Bilirrubina38 Sérica.
° Não foi reportada nenhuma anormalidade laboratorial grau 5.
Experiência pós-comercialização
A reação adversa à droga referente ao aumento de fosfatase alcalina48 foi reportada com Alecensa® no período pós- comercialização. Casos de fosfatase alcalina48 aumentada foram reportados em estudos clínicos com Alecensa® [7,5% em pacientes tratados com Alecensa® em estudos clínicos pivotais fase II (NP28761, NP28673)].
A reação adversa à droga referente a anemia hemolítica105 foi reportada com Alecensa® no período pós- comercialização. Casos de anemia hemolítica105 foram reportados no estudo clínico (BO29554) com Alecensa®.
Atenção: este produto é um medicamento novo e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos. Nesse caso, notifique os eventos adversos pelo Sistema VigiMed, disponível no Portal da Anvisa.
SUPERDOSE
Não existe nenhuma experiência com superdosagem nos estudos clínicos NP28761, NP28673 e BO28984. Os pacientes que apresentarem superdosagem devem ser supervisionados cuidadosamente e deve ser instituído tratamento de suporte. Não existe nenhum antídoto106 específico para superdosagem com Alecensa®.
Em caso de intoxicação ligue para 0800 722 6001, se você precisar de mais orientações.
DIZERES LEGAIS
VENDA SOB PRESCRIÇÃO MÉDICA
MS-1.0100.0668
Farm. Resp.: Tatiana Tsiomis Díaz - CRF-RJ nº 6942
Fabricado por
Excella GmbH & Co. KG, Feucht, Alemanha.
Embalado por
Delpharm Milano S.R.L, Itália.
Importado por:
Produtos Roche Químicos e Farmacêuticos S.A.
Av. Engenheiro Billings, 1729
CEP 05321-900
São Paulo/SP
CNPJ 33.009.945/0001-23
SAC 0800 7720 289