Noripurum EV (Solução injetável endovenosa) (Bula do profissional de saúde)
TAKEDA PHARMA LTDA.
IDENTIFICAÇÃO DO MEDICAMENTO
NORIPURUM® EV
sacarato de hidróxido férrico
Solução injetável endovenosa
APRESENTAÇÕES
Solução injetável endovenosa 20 mg/ml
Embalagens contendo cinco ampolas de 5 ml cada
USO ENDOVENOSO
USO ADULTO E PEDIÁTRICO
COMPOSIÇÃO
Cada ampola (5 ml) de NORIPURUM® EV contém:
ferro III (na forma de sacarato de hidróxido férrico).............................. 100 mg
Excipientes: água para injetáveis e hidróxido de sódio.
INFORMAÇÕES TÉCNICAS AOS PROFISSINAIS DE SAÚDE1
INDICAÇÕES
- Anemias ferropênicas graves (pós-hemorrágicas2, pós-partos, pós-cirúrgicas)
- Distúrbios de absorção gastrointestinal ou impossibilidade de se utilizar a ferroterapia por via oral nos casos de intolerância aos preparados orais de ferro em doenças inflamatórias gastrointestinais, que poderiam ser agravadas pela ferroterapia oral, e nos casos em que a falta de resposta à ferroterapia seja suspeita de falta de adesão ao tratamento
- Anemias ferropênicas graves no 3º trimestre da gravidez3 ou no puerpério4
- Correção da anemia5 ferropênica no pré-operatório de grandes cirurgias
- Anemia ferropriva6 que acompanha a insuficiência renal7 crônica
RESULTADOS DE EFICÁCIA
Os dados de eficácia clínica foram obtidos exclusivamente dos estudos nos quais se usou a presente formulação de NORIPURUM®, ou seja, ampolas contendo ferro na forma de ferro-sacarose (1 ml correspondendo a 20 mg de ferro). O conteúdo das ampolas geralmente foi diluído em uma solução de soro8 fisiológico9 a 0,9% para infusão.
Suplementação10 de ferro intravenoso com tratamento de ferro-sacarose EV e r-HuEPO em pacientes com insuficiência renal7 crônica e anemia ferropriva6
Al-Momen (1999) observou em um estudo controlado, no qual avaliou durante 12 semanas 123 pacientes com IRC e em diálise11 divididos em dois grupos – grupo A (ferro sacarose) e grupo B (controle) – uma elevação significativa dos valores de hemoglobina12, hematócrito13 e eritrócitos14 em ambos os grupos. O aumento da hemoglobina12 alvo no grupo A foi atingido apesar de os pacientes terem recebido doses mais baixas de r-HuEPO (grupo A = 180,0 ± 52,2 U/kg/semana vs. grupo B = 238,5 ± 73,0 U/kg/semana, p < 0,001) e em período mais curto que no grupo B (58,4 ± 33,1 vs. 76,8 ± 28,0 dias, p < 0,001). Pode-se concluir que a suplementação10 de ferro EV aumenta o efeito e reduz o custo do tratamento com r-HuEPO (eritropoietina15 humana recombinante) em pacientes de hemodiálise16 com reservas normais de ferro.
Resultados semelhantes foram obtidos no estudo controlado realizado por Yavuz (1999), que avaliou 30 pacientes, também com IRC e em diálise11, divididos em 2 grupos (grupo 1 = 17 pacientes e grupo 2 = 13 pacientes), por 6 meses. Em ambos os grupos foram observados aumentos estatisticamente significativos dos parâmetros hematológicos, mais acentuados no grupo que recebeu suplementação10 de ferro EV adicional à r-HuEPO. Além disso, em pacientes tratados com ferro EV a dose de r-HuEPO pôde ser reduzida em aproximadamente 30%, enquanto as doses tiveram de ser aumentadas no grupo sem suplementação10 de ferro.
A eficácia de ferrossacarose por via EV (grupo 1) em comparação à da suplementação10 com ferro por via oral (sulfato ferroso; grupo 2) em pacientes de hemodiálise16 manifestou-se simultaneamente com a administração da dose baixa de r-HuEPO (25 U/kg, duas vezes por semana) e foi investigada em um estudo controlado realizado por Hussain (1999) envolvendo 20 pacientes com ferritina sérica >200 ng/ml e saturação de transferrina >30%. Após 3 meses, a média de hemoglobina12 estava significativamente mais elevada no grupo 1 do que no grupo 2 (Hb 11,60±0,7 g/dl vs. 10,6±1,2 g/dl; p<0,05) e a dose média final de r-HuEPO foi 31% mais baixa nos pacientes tratados com a suplementação10 de ferro EV. A saturação de transferrina e a média da ferritina sérica exibiram um aumento mais pronunciado no grupo 1 do que no grupo 2.
Um estudo controlado realizado por Schaefer et al. (1999) mostrou que em pacientes estáveis com hemodiálise16 em tratamento com r-HuEPO (fase de manutenção de tratamento com ferro), a eficácia e a segurança das doses altas de ferrossacarose (250 mg de ferro como NORIPURUM® uma vez por mês) comparadas com doses baixas de gluconato de ferro (62,5 mg de ferro como Ferriecit® uma vez por semana) são semelhantes em ambos os tratamentos com relação aos níveis de hemoglobina12 (manutenção), estado de ferro e demandas de dose de r-HuEPO. Durante o período de seis meses do estudo, a hemoglobina12 pôde ser mantida, a ferritina aumentou e a dose de r-HuEPO foi mantida constante em ambos os tratamentos. Previamente se demonstrou em pacientes de hemodiálise16 que uma frequência alta de administração de ferro intravenoso em dose baixa parece associar-se comrisco maior de óbitos por infecção17. Portanto, pode ser uma vantagem em termos de segurança administrar o ferro em dose mais alta uma vez por mês, por exemplo com NORIPURUM®, em vez de numa dose semanal baixa, como seria com Ferriecit®, cuja dose única máxima recomendada é de 62,5 mg de ferro.
O estudo de van Zyl-Smit et al. incluiu 131 pacientes com anemia5 associada a hemodiálise16 submetidos a hemodiálise16 de manutenção (duas a três sessões por semana), com Hb ≤ 100 g/l, saturação de transferrina sérica ≤0% e ferritina sérica ≤200 μg/l. Entre os pacientes, 48% receberam ferro por via oral sem sucesso antes da inclusão no estudo (Hb < 100 g/l). O tratamento com NORIPURUM® foi iniciado em todos os pacientes (27 pacientes com tratamento adicional de r-HuEPO). O valor médio de hemoglobina12 aumentou em 28% (p ≤ 0,0001) no final do período de tratamento de duas semanas e permaneceu constante por um período de duas semanas de acompanhamento. Os valores médios de MCV e MCH em comparação com os basais aumentaram em 9% (p ≤ 0,0001) na semana 4. Os valores médios de ferritina sérica estavam de seis a sete vezes mais altos na semana 2 e na avaliação final em comparação com o valor basal (p ≤ 0,0001). A média da capacidade total de ligação do ferro nestes dois períodos foi aproximadamente 22% inferior ao valor basal (p ≤ 0,0001). A saturação de transferrina sérica estava duplicada na semana 2 e na avaliação final (p≤0,0001).
Boren et al. (1999) mostraram que NORIPURUM® também é seguro e bem tolerado sem a aplicação de uma dose de teste. Num total de 77 pacientes de hemodiálise16, uma proporção significativa de pacientes avaliáveis atingiu hemoglobina12 de 11,0 g/dl (basal = 10,2 g/dl) na visita final de tratamento e nas visitas de acompanhamento de duas e de cinco semanas, tornando o tratamento global eficaz para 87% dos pacientes avaliáveis. Além disso, observaram-se aumentos médios significativos em todas as determinações secundárias de eficácia, isto é, hematócrito13 (aumento de 32,3% para 36,0%), ferritina sérica (83,6 ng/ml para 360,3 ng/ml) e saturação de transferrina sérica (16,9% para 25,8%) da fase basal até o final do tratamento (dia 24) para todos os pacientes com eficácia avaliável. Na visita de acompanhamento de cinco semanas observaram-se elevações máximas na saturação de transferrina (27,6%).
Charytan et al. (1999) investigaram a resposta da administração de ferrossacarose por via EV em 23 pacientes com deficiência de ferro e com histórico documentado de reações anafiláticas18 leves ou graves a ferrodextrana, submetidos à terapia com r-HuEPO para anemia5 associada à diálise11. Em todos os pacientes observaram-se elevações significativas do nível médio de hemoglobina12 e dos valores médios de hematócrito13, ferritina sérica e saturação de transferrina sérica observadas da fase basal até o final do tratamento (dia 24). Os autores concluíram que o ferrossacarose EV foi eficaz na elevação dos parâmetros hematológicos médios e que pode ser administrado com segurança a pacientes com prévias reações anafilactoides leves ou graves ao ferro-dextrana.
Suplementação10 intravenosa de ferro por tratamento com ferro-sacarose EV e r-HuEPO em mulheres no pós-parto
No estudo realizado por Lebrecht et al, (1995), as mulheres cuja hemoglobina12 era < 90 g/l receberam r-HuEPO (n=24) ou placebo19 (n=12). Todas as pacientes receberam uma dose única de 400 mg de ferro EV em forma de ferrossacarose no dia 2, seguida de 200 mg de fumarato ferroso por via oral e 1 mg de ácido fólico diariamente por 4 semanas. Em ambos os grupos observou-se uma clara melhora dos parâmetros hematológicos (hemoglobina12, hematócrito13, contagem de hemácias20, contagem de reticulócitos) no decorrer das semanas após o tratamento em comparação com os valores iniciais, porém não houve diferença estatística significativa entre os dois grupos no final do tratamento de quatro semanas, demonstrando que não se justifica a administração de eritropoietina15 no tratamento da anemia5 pós-parto.
Em outro estudo (Breymann et al. 1996), 90 mulheres no pós-parto foram randomizadas para receber uma dose única de 100 mg de ferro em forma de ferro-sacarose ou uma dose de 300 U de r-HuEPO SC ou 300 U de r-HuEPO EV mais uma dose única de 100 mg de ferro em forma de ferro- sacarose EV. Além disso, todos os grupos receberam 80 mg de ferro em forma de sulfato de ferro oral duas vezes ao dia. Após duas semanas, o grupo tratado com r-HuEPO EV e ferro EV apresentou um aumento significativamente maior de hemoglobina12 que os outros grupos. Apesar da suplementação10 com dose única de ferro EV (100 mg de ferro) e do ferro oral, todas as pacientes exibiram baixo nível de ferritina, revelando a necessidade de uma suplementação10 mais intensa de ferro intravenoso para reabastecer as reservas de ferro.
Breymann et al. (2000) trataram em um estudo prospectivo21, randomizado22 e controlado com placebo19, de centro único, 60 mulheres no pós-parto, cuja hemoglobina12 média era de 8,6 g/dl (critério de inclusão <10 g/dl) em 24-72 h após o parto. As pacientes randomizadas para o grupo I (n=20) receberam tratamento com r-HuEPO (300 U/kg.dia) e 200 mg de ferro em forma de ferro-sacarose EV, enquanto o grupo II (n=20) recebeu placebo19 e 200 mg de ferro-sacarose EV e o grupo III (n=20) recebeu 80 mg de ferro oral como sulfato de ferro, além de ácido fólico (0,35 mg, duas vezes ao dia). Do dia 5 em diante, todos os grupos receberam até o dia 14 suplementação10 de ferro oral e ácido fólico nas mesmas doses que o grupo III. O estudo revelou um aumento maior do hematócrito13 após a r-HuEPO e a ferro-sacarose EV do que após o ferro isolado (ferro por via EV ou oral). Os níveis de ferritina aumentaram significativamente após a terapia com ferro parenteral (grupos I e II), enquanto no grupo III diminuíram continuamente até o dia 14. No grupo I, a contagem de reticulócitos foi mais alta do que no grupo III no dia 4 e do que nos grupos II e III no dia 7. De acordo com os autores, os resultados do estudo confirmam que a ferro-sacarose EV libera níveis suficientes de ferro plasmático para elevar a eritropoiese23 após a terapia com r-HuEPO em pacientes com condições inflamatórias após o parto. Por outro lado, pôde-se observar suprimento insuficiente de ferro nas pacientes que foram tratadas apenas com ferro por via oral. Os autores concluíram que o ferro EV e a r-HuEPO são mais eficazes por causa de uma sinergia: a r-HuEPO estimula a eritropoiese23, enquanto que a ferro-sacarose é mais eficaz na liberação de ferro para a síntese de hemoglobina12. A r-HuEPO aumenta a eficácia da ferro-sacarose isolada. Como o ferro EV isolado é mais econômico na restauração do hematócrito13 na população anêmica do pós-parto, a r-HuEPO poderia ser destinada às pacientes com sintomas24 significativos.
Khurram et al. (2000) compararam o tratamento de ferro com ferro-sorbitol25 EV ou ferro-sacarose EV em 68 pacientes do sexo feminino internadas em hospital de ginecologia e obstetrícia e apresentando anemia5 (Hb 6-8 g/dl). Entre estas, 45 eram pacientes obstétricas (11 anteparto e 34 pós-parto) e 23 eram ginecológicas. Quarenta e duas pacientes receberam uma ampola de ferro-sorbitol25 por via intramuscular diariamente ou em dias alternados (12 ± 3 ampolas) e 26 pacientes receberam o complexo de ferro-sacarose por infusão intravenosa (6 ± 2 ampolas) em duas a três doses divididas de 7 mg/kg de peso corporal (dose máxima de 500 mg diluída em 500 ml administrada em pelo menos 3,5 horas). A dose total foi baseada no déficit de ferro calculado individualmente. Em ambos os grupos administrou-se uma dose de teste, isto é, 0,1 ml de ferro-sorbitol25 por via intraglútea ou 1 ml de ferro-sacarose em 10 ml de soro8 fisiológico9 normal em 20 min. O nível médio de hemoglobina12 na inclusão no estudo foi de 7,3 g/dl. A taxa de resposta em ambos os grupos de tratamento foi comparável, com os níveis de hemoglobina12 subindo de 7,3 para 11 g/dl em ambos os grupos e a ferritina aumentando de 10,8 μg/l para 15,1 (ferro-sorbitol25) e 15,2 (ferro-sacarose) μg/l. Entretanto, houve necessidade de menos visitas para o tratamento com NORIPURUM® (uma a três visitas vs. 10-15 visitas com o ferro-sorbitol25). No grupo de NORIPURUM®, uma paciente apresentou náusea26 e uma apresentou edema27 generalizado (concentrado nos braços e nas pernas), que se resolveram dentro de quatro horas sem tratamento. Os autores concluíram que o ferro-sorbitol25 via IM é econômico, mas é doloroso e implica risco de manchar, devendo, portanto, ser desestimulado, enquanto NORIPURUM® propicia adesão melhor.
Gravier et al. (1999) investigaram a eficácia e a segurança de NORIPURUM® em 30 mulheres no pós-parto com nível médio de hemoglobina12 de 7,07 ± 0,428 g/dl. As pacientes receberam 200 mg de ferro nos dias 0 e 3 em forma de ferro-sacarose EV diluídos em 250 ml de NaCl 0,9% durante 1 hora. Duas pacientes com nível de hemoglobina12 <8 g/dl no dia 7 receberam um ciclo adicional. Os resultados mostraram uma elevação estatisticamente significativa do nível médio de hemoglobina12, com o tratamento por ferro-sacarose permitindo melhora rápida do "conforto" das pacientes e evitando transfusões durante o pós-parto.
Vinte mulheres com anemia5 grave (Hb = 5,52±1,24 g/dl) após parto vaginal (n=12) ou por cesariana (n=8) receberam uma dose média de 1.200 mg (900-1.500 mg) de ferro EV em forma de ferro-sacarose durante um período médio de quatro dias (Delaporte-Cerceau et al., 1999). No final do tratamento relatou-se um aumento médio de 2 g/dl na Hb e nenhuma paciente precisou de transfusão28.
O mesmo grupo [Frappier et al. (1999)] relatou sobre 10 mulheres no pós-parto que receberam ferro-sacarose (NORIPURUM®) para tratar hemorragia29 (n=5) ou anemia hemolítica30 (n=3) (Hb 5,7 ± 0,8 g/dl) ou uma deficiência de ferro pré-parto agravada (n=2) após parto vaginal (n=5) ou cesariana (n=8). As pacientes receberam uma dose total de 28 mg/kg em forma de NORIPURUM® durante 4 dias. O aumento nos níveis de hemoglobina12 após a ferro-sacarose foi de 0,37 g/dl/dia ao longo de 6 dias, e o hematócrito13 aumentou 1%/dia durante 6 dias. Nenhuma das pacientes precisou de transfusão28 com sangue31 homólogo e não se observou reação adversa. Os autores concluíram que os resultados comprovam a eficácia e a boa tolerabilidade da ferro-sacarose no tratamento de anemia5 grave pós-parto.
Suplementação10 intravenosa de ferro-sacarose no tratamento de anemia ferropriva6 na gravidez3
Al-Momen et al. (1996) relataram uma restauração mais rápida dos valores de hemoglobina12 em 52 mulheres grávidas com anemia ferropriva6 grave (Hb <90 g/l, MCV <78 fL, MCH <30 pg, ferritina sérica <20 μg/l, com ferro baixo e capacidade elevada de ligação do ferro) após a administração de NORIPURUM® quando comparadas com 59 mulheres grávidas tratadas com sulfato ferroso por via oral.
Chamate (1962) estudou 120 mulheres com anemia ferropriva6 na gravidez3, no puerpério4, no pós-parto e após aborto com nível de hemoglobina12 menor que 100 g/l. Os resultados do estudo mostraram que a ferro-sacarose é eficiente e bem tolerada no tratamento da anemia ferropriva6 nas situações clínicas mencionadas. O tratamento intravenoso com NORIPURUM® produziu resultados clínicos e hematológicos favoráveis, com um aumento médio de hemoglobina12 acima de 40 g/l durante um período de tratamento de 15-30 dias.
Polatti et al. (1983) trataram 30 mulheres acometidas de anemia ferropriva6 após a 24ª semana gestacional com ferro-sacarose EV (100 mg de ferro) diariamente por 14 dias até a dose de ferro total calculada individualmente. Os parâmetros hematológicos (contagem de hemácias20, hematócrito13, hemoglobina12 e contagem de reticulócitos) medidos na fase basal melhoraram significativamente após 5 e 14 dias de tratamento. Resultados semelhantes foram descritos por Breymann et al. [65] em onze mulheres grávidas que receberam r-HuEPO em combinação com ferro-sacarose EV, e pelo mesmo grupo [87] em duas mulheres grávidas com doença inflamatória intestinal concomitante. Além disso, no estudo de Khurram et al. (2000) [88] também foram incluídas pacientes grávidas.
Suplementação10 de ferro por via intravenosa com ferro-sacarose EV e tratamento com r-HuEPO em pacientes agendados para procedimentos ortopédicos ou de cirurgia de grande porte
Um estudo realizado por Béris et al. demonstrou a influência de NORIPURUM® sobre a doação de sangue31 autólogo em pacientes não anêmicos (n=45) submetidos a um procedimento cirúrgico eletivo32 que requeria cinco ou mais unidades de sangue31. Neste estudo comparativo controlado, 24 pacientes (grupo A) receberam aproximadamente 150 U/kg de r-HuEPO por via SC (dependendo do peso corporal), seis vezes durante um período de 14 dias, e 21 pacientes (grupo B) receberam placebo19 equivalente. Todos os pacientes foram adicionalmente tratados com infusões de cinco vezes 200 mg de ferro em forma de NORIPURUM® administradas durante 45 minutos nos dias -35, -28, -21, -14 e -7 antes da cirurgia. O aumento na contagem de reticulócitos no grupo A foi estatisticamente significativo quando comparado com o do grupo B. A doação de cinco unidades de sangue31 (420 ml cada) foi possível para 79% dos pacientes (n=18) no grupo A (r-HuEPO) e para 67% (n=14) no grupo B (apenas o ferro EV). Os pacientes no grupo placebo19 doaram uma média de 4,6±0,8 unidades de sangue31 em comparação com 4,7±0,6 unidades para aqueles no grupo com r-HuEPO (p=0,52). Mais pacientes do grupo placebo19 receberam sangue31 alogênico em comparação aos do grupo de r-HuEPO (43% vs. 26%). Os resultados do grupo placebo19 revelaram que NORIPURUM® pode suprir a quantidade de ferro perdida durante a doação de cinco unidades de sangue31 (1.000 mg de ferro) quase imediatamente após a administração EV e que, portanto, ele pode apoiar a eritropoiese23.
Kipnis et al. mostraram que a administração de NORIPURUM® isolado permite evitar a transfusão28 de sangue31 autólogo em pacientes agendados para cirurgia ortopédica de grande porte. Vinte e quatro pacientes com cirurgia ortopédica receberam NORIPURUM® durante quatro a oito dias após os procedimentos cirúrgicos e apresentaram uma elevação clinicamente significativa de Hb e Hct, tornando desnecessária a transfusão28 de sangue31 homólogo.
Suplementação10 intravenosa de ferro com ferro-sacarose em pacientes intolerantes à terapia de ferro por via oral ou não aderentes
Em estudo que incluiu 121 pacientes (Ahsan N. et al, 1996) divididos em 2 grupos (grupo gluconato de ferro = 50 pacientes e grupo ferro-sacarose = 71 pacientes) com má absorção ou intolerância ao ferro oral, a eficácia do gluconato de ferro por via EV foi comparada com a do ferro-sacarose por via EV Quanto à eficácia, ambos os preparados de ferro parenteral foram igualmente eficazes na correção da anemia ferropriva6 e na repleção das reservas de ferro em pacientes com intolerância ao ferro oral. No entanto, o gluconato de ferro foi administrado em doses extremamente altas, duas vezes a dose única máxima realmente recomendada pelo fabricante.
Suplementação10 intravenosa de ferro com ferro-sacarose em pacientes com doença inflamatória intestinal em que os preparados de ferro por via oral são ineficazes
Em dois estudos, Gasché et al. investigaram a eficácia e a segurança da ferro-sacarose em pacientes com doença inflamatória intestinal intolerantes aos preparados de ferro oral ou com má absorção de ferro. Com base nos resultados do primeiro estudo conduzido em 40 pacientes anêmicos com doença de Crohn33 pode-se concluir que 75% dos pacientes com esta condição respondem significativamente ao ferro isolado por via EV. A r-HuEPO exerce um efeito adicional sobre a concentração de hemoglobina12, como se observa nos estudos anteriores. Os resultados mostraram que a combinação de r-HuEPO e NORIPURUM® se associa com uma elevação maior e mais rápida das concentrações de hemoglobina12 em comparação à dos pacientes tratados apenas com NORIPURUM®. Conclusões muito semelhantes podem ser tiradas dos achados do segundo estudo realizado em 20 pacientes com colite34 ulcerativa, no qual quinze pacientes (75%) apresentaram resposta completa (aumento médio de hemoglobina12 de 4,5±1,5 g/dl) apenas com suplementação10 de ferro EV. A adição de r-HuEPO foi altamente eficaz nos pacientes sem resposta prévia.
Outros estudos realizados em pacientes com anemia ferropriva6 de várias origens em que os preparados de ferro oral não podem providenciar suplementação10 suficiente
Silverberg et al. (2000) avaliaram a eficácia e a segurança da ferro-sacarose intravenosa em pacientes com insuficiência cardíaca congestiva35. O aumento significativo dos parâmetros hematológicos teve um efeito benéfico adicional sobre outras variáveis: a LVEF média aumentou em 27,8%, a classe de NYHA caiu significativamente e a média de hospitalização caiu em 91,9%.
Referências
- Al-Momen A.K. et al. Enhancement of r-HuEPO effect by iron saccharate in hemodialysis patients;
- Synopsis of the Clinical study report. 26.2.1999;
- Yavuz M. et al. Treatment of iron deficient patients on hemodialysis with i.v. iron(III-)hydroxide sucrose complex and rHuEPO simultaneously;
- Synopsis of the Clinical study report. 15.1.1999.;
- Hussain R. et al. Experience of Venoferrum (iron sucrose) supplementation in hemodialysis patients treated with erythropoietin;
- Synopsis of the Clinical study report. 27.1.1999;
- .Van Zyl-Smit R. et al. A multicenter study to investigate the tolerance, safety and efficacy of intravenous iron sucrose in haemodialysis patients with anaemia. Summary of the Study Report 26.5.1997;
- .Schaefer R.M. et al. A single centre, open, randomised, controlled parallel-group study for comparison of two intravenous iron preparations in stable renal36 patients treated with erythropoietin;
- Synopsis of the Study report 1999;
- Roland M. Schaefer et al. A randomized, controlled parallel-group trial on efficacy and safety of iron sucrose (Venofer®) vs iron gluconate (Ferriecit®) in haemodialysis patients treated with rHuEpo;
- Nephrol Dial Transplant (2001);
- Lebrecht A. et al. Postpartum Anaemia: Intravenous Iron Supplementation Renders Therapy with rHuEPO Redundant (translation);
- Geburtshilfe Frauenheilkd. 1995; 55: 167-170;
- Breymann C. et al. Use of recombinant human erythropoietin in combination with parenteral iron in the treatment of postpartum anaemia;
- Eur J Clin Invest. 1996; 26: 123-130;
- Zimmermann R. et al. rhEPO treatment of postpartum anaemia;
- J. Perinat. Med. 1995; 23: 111-117;
- Al-Momen A.K. et al. Intravenous iron sucrose complex in the treatment of iron deficiency anemia5 during pregnancy;
- Eur J Obstet Gynecol Reprod Biol. 1996; 69: 121-124;
- Chamate E. Treatment of iron deficiency anaemia in pregnancy and in the immediate puerperium, and of other ferropenic conditions, with saccharated iron administered intravenously in fractionated doses (translation);
- XlVth Int. Congress of Haematology. 1972, São Paulo, Brasil;
- Polatti F. and Mandelli B. Treatment with intravenous Fe of hypochromic anaemia in pregnancy (translation);
- Bollettino della Società Medico-Chirurgica di Piava. 1983; 97: 13-16;
- Breymann C. et al. Recombinant human erythropoietin and parenteral iron in the treatment of pregnancy anaemia: A pilot study. J Perinat Med. 1995; 23: 89-98;
- Boren K.R., Van Wyck David B. et al. A phase II/III open label study of the safety and efficacy of Venofer [iron sucrose injection] in patiens with dialysis-associated anemia5;
- Synopsis of the Clinical study report. 19.11.1999;
- Charytan C., Van Wyck David B. et al. Efficacy and Safety of Iron Sucrose for Iron Deficiency in Patients with dialysis-associated anemia5: North American Clinical Trial Am J Kidney Dis., Vol 37, No2 (February), 2001: pp 300-307;
- Charytan C., van Wyck David B. et al. An open-label study of the safety of Venofer [iron sucrose injection] in patients with anaphylactoid reactions to iron dextran;
- Synopsis of the Clinical study report. 26.7.1999. van Wyck D.B. et al. Safety and efficacy of iron sucrose in patients sensitive to iron dextran: North American clinical trial. Am J Kidney Dis. 2000; 36 (1): 88-97;
- Breymann C. et al. Effectiveness of recombinant erythropoietin and iron sucrose vs. iron therapy only, in patients with postpartum anaemia and blunted erythropoiesis;
- Eur J Clin Inv. 2000; 30: 154-161;
- Gravier A. et al. Avoiding postpartum transfusions: The utility of intravenous iron supplementation (translation);
- J Gynecol Obstet Biol Reprod. 1999; 28: 77-78.;
- Khurram A. et al.;
- Injectable iron therapy; intramuscular vs intravenous therapy. Biomedica. 2000; 16: 44-47.;
- Delaporte-Cerceau S. et al. Intravenous iron therapy for correction of severe post partum anaemia;
- ESA Cowes, April, 2000, Viena, Áustria;
- Frappier J et al. Managing severe postpartum anemia5: The utility of intravenous iron saccharate (translation);
- 41e Congrès National d'Anesthésie et de Réanimation, 23-26 September, 1999, Paris, França;
- Silverberg DS et al. The use of subcutaneous erythropoietin and intravenous iron for the treatment of the anemia5 of severe, resistant congestive heart failure improves cardiac and renal36 function and functional cardiac class, and markedly reduces hospitalizations;
- J Am Coll Cardiol. 2000; 35(7): 1737-1744.
CARACTERÍSTICAS FARMACOLÓGICAS
O ferro presente em NORIPURUM® EV está na forma trivalente de complexo coloidal macromolecular de sacarato de hidróxido férrico.
O núcleo de hidróxido férrico polinuclear é superficialmente rodeado por um grande número de moléculas de sacarose ligadas não covalentemente, resultando em um complexo cuja massa molecular é de aproximadamente 43 kDa. É suficientemente grande para impedir a eliminação renal36. O complexo resultante é estável e não libera íons37 de ferro sob condições fisiológicas38. O ferro nos núcleos polinucleares está ligado a uma estrutura similar, como ocorre fisiologicamente com a ferritina.
O ferro trivalente do complexo coloidal de sacarato de hidróxido férrico presente em NORIPURUM® EV combina-se sem alteração de valência com a transferrina. Parte dele forma ferro de depósito (ferritina) e outra parte destina-se à gênese de hemoglobina12, de mioglobina e de enzimas contendo ferro. A aplicação pela via endovenosa promove utilização instantânea do ferro, o que constitui um fator relevante, particularmente em casos de anemias muito pronunciadas.
Estudos clínicos demonstraram que a resposta hematológica é mais rápida com a administração endovenosa do complexo de sacarato de hidróxido férrico do que com a administração oral de produtos solúveis à base de ferro.
O ligante do complexo é a sacarose (dissacarídeo39). Não contém nenhum dextrano (polissacarídeo), de modo que não ocorre nenhuma reação com o anticorpo40 específico para dextrano, o que causaria uma reação anafilática41 induzida por este.
Propriedades farmacodinâmicas
A ferrocinética de NORIPURUM® EV marcado com 59Fe e 52Fe foi avaliada em 6 pacientes com anemia5 e falência renal36 crônica. A depuração de 52Fe no plasma42 se deu em 60 a 100 minutos. O 52Fe foi distribuído para o fígado43, o baço44 e a medula óssea45. Duas a quatro semanas após a administração, a máxima utilização de 59Fe pelos glóbulos vermelhos do sangue31 alcançou 68% a 97%.
Propriedades farmacocinéticas
Após uma injeção46 de 100 mg de ferro (uma ampola de NORIPURUM® EV) em indivíduos sadios, a concentração plasmática máxima foi em média de 538 µmol/l, 10 minutos após a injeção46. O volume de distribuição do compartimento central se correlaciona bem com o volume sérico (aproximadamente 3 l).
O ferro injetado foi rapidamente eliminado do plasma42 e a meia-vida foi de aproximadamente 6 horas.
O volume de distribuição no estado de equilíbrio foi de aproximadamente 8 l, o que indica baixa distribuição do ferro nos fluidos corporais.
Um estudo clínico realizado com 10 pacientes anêmicos e não anêmicos, utilizando-se complexo de sacarato de hidróxido férrico marcado com 59Fe, mostrou que, após 5 e 10 dias, respectivamente 50% e 80% da dose administrada foi incorporada aos eritrócitos14.
Devido à baixa estabilidade da sacarose de ferro em comparação com a transferrina, observou-se uma troca competitiva do ferro com a transferrina. Isso resultou em transporte de aproximadamente 31 mg de ferro/24 horas. Quatro horas após a primeira administração, a saturação da transferrina é superior a 90% e, após 24 horas, o nível de ferritina é o dobro.
A eliminação renal36 do ferro ocorrida nas primeiras quatro horas após a injeção46 corresponde a menos de 5% da depuração total. Após 24 horas, os níveis de ferro são reduzidos aos níveis pré-dose e aproximadamente 75% da dose de sacarose foi excretada.
Não se sabe ainda se o complexo sacarato de hidróxido férrico passa através da barreira placentária, mas há evidências de uma pequena passagem do ferrodextrano. O ferro que habitualmente passa a barreira placentária está ligado à transferrina e o que passa para o leite materno está ligado à lactoferrina.
Dados de segurança pré-clínicos
Dados pré-clínicos baseados em estudos convencionais de toxicidade47 repetida, genotoxicidade e toxicidade47 na reprodução48 em animais não mostraram riscos especiais.
Observou-se toxicidade47 em animais apenas com doses suficientemente altas em comparação com a dose máxima para seres humanos. Os dados experimentais em animais demonstram não haver riscos à segurança de seres humanos.
CONTRAINDICAÇÕES
O uso de NORIPURUM® EV é contraindicado em:
- hipersensibilidade conhecida ao sacarato de hidróxido férrico, NORIPURUM® EV ou a qualquer um dos seus excipientes ;
- todas as anemias não ferropênicas, como por exemplo anemia hemolítica30, anemia megaloblástica49 causada por deficiência de vitamina50 B12, distúrbios na eritropoiese23, hipoplasia51 de medula52, as anemias falciformes puras e as anemias associadas a infecções53 ou neoplasias54;
- situações de sobrecarga férrica, como por exemplo hemocromatose55, hemosiderose;
- distúrbios da utilização do ferro, como por exemplo anemia5 sídero-acréstica, talassemia56, anemias provocadas por chumbo, porfiria57 cutânea58 tardia.
ADVERTÊNCIAS E PRECAUÇÕES
NORIPURUM® EV somente deve ser administrado quando a indicação da ferroterapia tiver sido confirmada por meio de investigação apropriada com exames laboratoriais (por ex. ferro sérico, ferritina sérica e/ou hemoglobina12 e/ou hematócrito13 e/ou contagem de eritrócitos14 e/ou hematimetria - VCM, HCM,CHCM).
A administração parenteral de preparados de ferro pode causar reações alérgicas ou anafiláticas, que podem ser potencialmente letais. Deve haver disponibilidade de suporte para ressuscitação cardiopulmonar e tratamento antialérgico.
Reações de hipersensibilidade também foram relatadas após doses anteriores sem eventos de qualquer complexo de ferro parenteral, incluindo sacarato de hidróxido férrico. Cada paciente deve ser observado para efeitos adversos durante pelo menos 30 minutos após cada aplicação de NORIPURUM® EV.
Administrar o produto com cuidado em pacientes com histórico de asma59, eczema60, outras alergias ou reações alérgicas por outros preparados parenterais de ferro, uma vez que tais pacientes apresentam risco acentuado de apresentar reação alérgica61.
Entretanto, demonstrou-se em diversos estudos com pacientes que tiveram histórico de reações de hipersensibilidade ao dextrano de ferro ou ao gluconato férrico que NORIPURUM® EVfoi bem tolerado.
NORIPURUM® EV deve ser administrado com cuidado a pacientes com disfunção hepática62.
Deve-se ter cuidado especial na administração do produto em pacientes que sofram de infecções53 agudas ou crônicas. É recomendado que a administração de NORIPURUM® EV seja interrompida em pacientes com bacteriemia. Em pacientes com infecção17 crônica, uma avaliação de risco / benefício deve ser realizada
Deve-se evitar o extravasamento paravenoso, pois o extravasamento de NORIPURUM® EV no local da injeção46 pode causar dor, inflamação63 e manchas na pele64.
A estabilidade de sistemas coloidais é limitada. Por isso, particularmente nos casos de armazenagem inadequada, há possibilidade de formação de sedimentos nas ampolas do preparado.
Gravidez3
Não há ou há apenas uma quantidade limitada de dados (menos de 300 casos de gravidez3) do uso de sacarato de hidróxido férrico em mulheres grávidas no primeiro trimestre. Uma quantidade moderada de dados (entre 300-1.000 casos da gravidez3) do uso de NORIPURUM® EV em mulheres grávidas no segundo e terceiro trimestres não mostrou preocupações de segurança para a mãe ou para o recém-nascido.
NORIPURUM® EV deve ser utilizado durante gravidez3 somente se o benefício potencial justificar o risco potencial para o feto65, particularmente durante o primeiro trimestre.
Os estudos em animais não indicam efeitos nocivos diretos ou indiretos com relação à toxicidade47 reprodutiva (ver secção "Dados de segurança pré-clínica").
Categoria B de risco na gravidez3 – Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
NORIPURUM® EV deve ser utilizado durante gravidez3 somente se o benefício potencial justificar o risco potencial para o feto65, particularmente durante o primeiro trimestre.
Amamentação66
A informação sobre a excreção de ferro no leite materno após a administração de sacarato de hidróxido férrico intravenoso é limitada. Em um estudo clínico, dez mães saudáveis amamentando com deficiência de ferro receberam 100 mg de ferro sob a forma de sacarato de hidróxido férrico. Quatro dias após o tratamento, o conteúdo de ferro no leite materno não tinha aumentado e não havia nenhuma diferença em relação ao grupo controle (n = 5). Não se pode excluir a possibilidade de que recém-nascidos/lactentes67 podem ser expostos a ferro derivado de NORIPURUM® EV através do leite materno, portanto, o risco/benefício deve ser avaliado.
Dados pré-clínicos não indicam efeitos nocivos diretos ou indiretos para a criança em amamentação66. Em ratas lactantes68, tratadas com sacarato de hidróxido férrico com Ferro 59 marcado, foi observada baixa secreção de ferro no leite e transferência de ferro para a prole. É pouco provável que o sacarato de hidróxido férrico não metabolizado passe para o leite materno.
Fertilidade
Não foram observados efeitos do tratamento de sacarato de hidróxido férrico sobre a fertilidade, o desempenho sexual e o desenvolvimento embrionário inicial em ratos.
Pacientes pediátricos
Se houver necessidade clínica, recomenda-se não exceder a dose de 0,15 ml de NORIPURUM® EV (3 mg de ferro) por kg de peso corporal, uma a três vezes por semana, dependendo do nível de hemoglobina12.
Pacientes idosos
Não existem cuidados especiais para administração endovenosa de NORIPURUM® EV em pacientes idosos.
Dirigir e operar máquinas
É improvável que NORIPURUM® EV influencie a capacidade de dirigir ou utilizar máquinas. No entanto, se sintomas24 como tonturas69, confusão ou delírios ocorrerem após a administração de NORIPURUM® EV, pacientes afetados não devem conduzir veículos ou utilizar máquinas até que os sintomas24 tenham diminuído.
INTERAÇÕES MEDICAMENTOSAS
Até o momento não há relatos de casos de interação medicamentosa com o produto.
Assim como todos os preparados à base de ferro para uso parenteral, NORIPURUM® endovenoso não deve ser administrado concomitantemente aos compostos orais de ferro, uma vez que a absorção oral do ferro seria reduzida.
CUIDADOS DE ARMAZENAMENTO DO MEDICAMENTO
Conservar o medicamento a temperaturas abaixo de 25ºC. Não congelar. Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Características físicas e organolépticas do produto
NORIPURUM® EV é uma solução aquosa e viscosa, de cor marrom, apresentada em ampolas de vidro incolor.
As ampolas devem ser visualmente inspecionadas antes da utilização quanto a sedimentos e danos. Somente aquelas livres de sedimento e que apresentem solução homogênea devem ser usadas. O armazenamento inadequado do produto poderá levar à formação de sedimentos visíveis a olho70 nu.
Uma vez aberta a ampola, a administração deve ser imediata.
Estudos de estabilidade físico-química demonstram que NORIPURUM® EV, diluído em solução fisiológica71 estéril, é estável dentro das primeiras 12 horas após a diluição, desde que mantido em temperatura abaixo de 25°C. Do ponto de vista microbiológico72, o produto deve ser usado imediatamente. Se não for usado imediatamente, o tempo e as condições de armazenamento antes do uso são de responsabilidade do usuário. Normalmente não deveriam exceder 3 horas a temperaturas abaixo de 25°C, a menos que a diluição tenha ocorrido em condições assépticas controladas e validadas.
Antes de usar, observe o aspecto do medicamento.
Todo medicamento deve ser mantido fora do alcance das crianças.
POSOLOGIA E MODO DE USAR
POSOLOGIA
Cálculo73 da posologia
A posologia de NORIPURUM® EV deverá ser determinada individualmente, conforme a necessidade total de ferro, levando-se em conta três fatores:
- Grau de deficiência de ferro (em mg), déficit total de ferro em mg
- Peso do paciente em kg
- Reserva necessária de ferro
Pode-se encontrar a dose total (em ml) para um tratamento completo com NORIPURUM® endovenoso, por meio das seguintes fórmulas:
Deficiência total de Fe (mg) = [peso (kg) × DHb (g/dl) x 2,4] + reservas de Fe (mg)
Total em ml de NORIPURUM® EV a administrar = deficiência total de Fe (mg)/20 mg/ml
DHb = diferença entre a hemoglobina12 ideal para o sexo e a idade do paciente e a hemoglobina12 encontrada no exame laboratorial do paciente (em g/dl).
2,4 = 0,34% (porcentagem de ferro presente em cada molécula de hemoglobina12) × 7% (volume percentual aproximado de sangue31 no organismo).
Valores normais de hemoglobina12 (Hb) desejados e reservas de ferro para os seguintes pesos aproximados:
|
|
Valores médios de hemoglobina12 desejados |
Reservas de ferro desejadas |
|
< 35 kg de peso corporal |
13,0 g/ dl |
15 mg/kg |
|
> 35 kg de peso corporal |
15,0 g/ dl |
500 mg |
Para a determinação fácil e rápida do total de ml ou de ampolas com 5 ml necessárias, pode-se usar a seguinte tabela:
|
HEMOGLOBINA12 ATUAL DO PACIENTE |
6,0 g/dl |
7,5 g/dl |
9,0 g/dl |
10,5 g/dl |
||||
|
PESO EM KG |
ml |
Nº de ampolas com 5 ml |
ml |
Nº de ampolas com 5 ml |
ml |
Nº de ampolas com 5 ml |
ml |
Nº de ampolas com 5 ml |
|
5 |
8 |
1,5 |
7 |
1,5 |
6 |
1 |
5 |
1 |
|
10 |
16 |
3 |
14 |
3 |
12 |
2,5 |
11 |
2 |
|
15 |
24 |
5 |
21 |
4,5 |
19 |
3,5 |
16 |
3 |
|
20 |
32 |
6,5 |
28 |
5,5 |
25 |
5 |
21 |
4 |
|
25 |
40 |
8 |
35 |
7 |
31 |
6 |
26 |
5,5 |
|
30 |
48 |
9,5 |
42 |
8,5 |
37 |
7,5 |
32 |
6,5 |
|
35 |
63 |
12,5 |
57 |
11,5 |
50 |
10 |
44 |
9 |
|
40 |
68 |
13,5 |
61 |
12 |
54 |
11 |
47 |
9,5 |
|
45 |
74 |
15 |
66 |
13 |
57 |
11,5 |
49 |
10 |
|
50 |
79 |
16 |
70 |
14 |
61 |
12 |
52 |
10,5 |
|
55 |
84 |
17 |
75 |
15 |
65 |
13 |
55 |
11 |
|
60 |
90 |
18 |
79 |
16 |
68 |
13,5 |
57 |
11,5 |
|
65 |
95 |
19 |
84 |
16,5 |
72 |
14,5 |
60 |
12 |
|
70 |
101 |
20 |
88 |
17,5 |
75 |
15 |
63 |
12,5 |
|
75 |
106 |
21 |
93 |
18,5 |
79 |
16 |
66 |
13 |
|
80 |
111 |
22,5 |
97 |
19,5 |
83 |
16,5 |
68 |
13,5 |
|
85 |
117 |
23,5 |
102 |
20,5 |
86 |
17 |
71 |
14 |
|
90 |
122 |
24,5 |
106 |
21,5 |
90 |
18 |
74 |
14,5 |
Para converter Hb (mM) para Hb (g/dl), multiplicar o primeiro por 1,6.
Se a dose total necessária exceder a dose única máxima permitida, a administração deve ser dividida. A dose total administrada não deve exceder a dose calculada.
Cálculo73 da posologia para reposição de ferro secundária à perda de sangue31 e para compensar a doação de sangue31 autóloga
A dose de NORIPURUM® EV requerida para compensar a deficiência de ferro é calculada segundo as fórmulas a seguir:
- Se a quantidade de sangue31 perdido for conhecida: a administração intravenosa de 200 mg de ferro (=10 ml de NORIPURUM® EV) resulta em um aumento do nível de hemoglobina12 equivalente a uma unidade de sangue31 (=400 ml com índice 150 g/l de hemoglobina12)
Ferro a ser reposto [mg] = número de unidades de sangue31 perdido × 200 ou
quantidade de NORIPURUM® EV necessária [ml] = número de unidades de sangue31 perdido × 10 - Se o nível de hemoglobina12 for reduzido: aplicar a fórmula anterior, considerando que a reserva de ferro não precisa ser restaurada.
Ferro a ser reposto [mg] = peso corporal [kg] × 0,24 × (hemoglobina12 ideal - hemoglobina12 real) [g/l]
Por exemplo: peso corporal de 60 kg e déficit de hemoglobina12 de 10 g/l → ferro a ser reposto ≅ 150 mg → necessidade de 7,5 ml de NORIPURUM® EV.
Posologia média recomendada
- Adultos e pacientes idosos: 5-10 ml de NORIPURUM® EV (100 a 200 mg de ferro) uma a três vezes por semana, dependendo do nível de hemoglobina12.
- Crianças: há uma quantidade moderada de dados referentes a crianças nas situações estudadas. Se houver necessidade clínica, recomenda-se não exceder a dose de 0,15 ml de NORIPURUM® EV (3 mg de ferro) por kg de peso corporal, por mais que três vezes na semana, dependendo do nível de hemoglobina12.
Dose única máxima tolerada
- Adultos e pacientes idosos:
Injeção46: 10 ml de NORIPURUM® EV (200 mg de ferro) administrados em no mínimo 10 minutos.
Infusão: Quando a situação clínica exigiu, chegaram-se a administrar doses de até 500 mg. A dose única máxima tolerada é de 7 mg de ferro por kg de peso corporal administrada uma vez por semana, mas não excedendo 25 ml de NORIPURUM® EV (500 mg de ferro) diluídos em 500 ml de solução fisiológica71 estéril, administrados em no mínimo 3,5 horas.
Os tempos de infusão recomendados neste item devem ser estritamente seguidos até mesmo se o paciente não receber a dose única máxima tolerada.
MODO DE USAR
Cuidados na administração
As ampolas devem ser visualmente inspecionadas quanto a sedimentos e danos antes de serem utilizadas. Devem-se usar somente aquelas livres de sedimento e que apresentem solução homogênea.
Uma vez aberta a ampola, a administração deve ser imediata.
Estudos de estabilidade físico-química demonstram que NORIPURUM® EV, diluído em solução fisiológica71 estéril é estável dentro das primeiras 12 horas após a diluição, desde que mantido em temperatura abaixo de 25°C. Do ponto de vista microbiológico72, o produto deve ser usado imediatamente. Se não for usado imediatamente, o tempo e as condições de armazenamento antes do uso são de responsabilidade do usuário. Normalmente não deveriam exceder 3 horas a temperatura abaixo de 25°C, a menos que a diluição tenha ocorrido em condições assépticas controladas e validadas.
NORIPURUM® EV deve ser diluído somente com solução de cloreto de sódio estéril 0,9% p/v. Não devem ser usadas outras soluções ou medicamentos de diluição intravenosa, uma vez que há potencial para precipitação e/ou interação. Não se conhece a compatibilidade com recipientes que não sejam de vidro, polietileno ou PVC.
NORIPURUM® EV deve ser administrado por via intravenosa e nunca por via intramuscular pois, em função de seu elevado pH. Pode-se administrar a solução por infusão, por injeção46 endovenosa lenta ou diretamente na linha do dialisador.
NORIPURUM® EV não é adequado para dose total de infusão (TDI), em que a dose total de ferro necessária, correspondendo à deficiência total de ferro do paciente, seja administrada em uma única infusão completa.
A solução diluída deve ser marrom e límpida.
Cada ampola de NORIPURUM® EV é destinada a uma única aplicação. Produto não utilizado ou resíduos devem ser descartados de acordo com as normas aplicáveis.
Infusão endovenosa:
|
Concentração de ferro |
100 mg |
200 mg |
300 mg |
400 mg |
500 mg |
|
Velocidade mínima de infusão |
15 min. |
30 min. |
1,5 h |
2,5 h |
3,5 h |
NORIPURUM® EV deve ser exclusivamente diluído em soro8 fisiológico9 estéril, em uma diluição de 1 ml de NORIPURUM® EV (20 mg de ferro) em 20 ml de solução de cloreto de sódio estéril a 0,9% p/v [5 ml (100 mg de ferro) em no máximo 100 ml de solução de cloreto de sódio a 0,9% p/v, até 25 ml (500 mg de ferro) em no máximo 500 ml de solução de cloreto de sódio a 0,9% p/v]. A diluição deve ser feita imediatamente antes da infusão e a solução deve ser administrada como segue:
Para administração da dose única máxima tolerada de 7 mg de ferro/kg de peso corporal, deve-se respeitar o tempo de infusão de no mínimo três horas e meia, qualquer que seja a dose total.
Injeção46 endovenosa:
NORIPURUM® EV pode ser administrado não diluído, por injeção46 endovenosa lenta, a uma velocidade máxima de 1 ml por minuto (uma ampola de 5 ml em 5 minutos), não excedendo a dose de 10 ml (200 mg de ferro) por injeção46. Após a aplicação, estender o braço do paciente.
Deve-se ter cautela com o extravasamento paravenoso (vide “Precauções e advertências”).
Injeção46 direta no dialisador:
NORIPURUM® EV pode ser administrado diretamente na linha do dialisador, seguindo-se as mesmas recomendações para injeção46 endovenosa ou infusão endovenosa.
Instruções para abertura da ampola
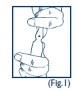
A ampola de NORIPURUM® EV apresenta no local de ruptura uma microincisão, o que facilita sua abertura. A ampola apresenta em sua haste duas identificações coloridas: um ponto azul, que é o ponto de ruptura, e acima um anel roxo para identificação do produto. Portanto, siga as instruções a seguir para a correta abertura da ampola:
- Segure a ampola com uma das mãos74, deixando o ponto de ruptura azul voltado para fora. Deve-se ter cautela para não deixar o produto entrar em contato com a roupa, pois causa manchas (Fig.1).
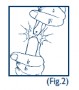
- Quebre a ampola pressionando com o polegar da outra mão75 a parte superior da ampola e fazendo uma flexão para trás com o dedo indicador (Fig. 2).
REAÇÕES ADVERSAS
A reação adversa ao medicamento mais comumente relatada em estudos clínicos com NORIPURUM® EV foi a disgeusia76, que ocorreu em uma proporção de 4,5 eventos por 100 pacientes. As reações de hipersensibilidade são as reações adversas graves ao medicamento associadas ao NORIPURUM® EV mais importantes, as quais ocorreram a uma proporção de 0,25 eventos por 100 pacientes em estudos clínicos.
As reações adversas ao medicamento relatadas após a administração de NORIPURUM® EV em 4.046 sujeitos em estudos clínicos, assim como as relatadas no pós-comercialização, são apresentadas a seguir:
Reação comum (≥1/100 e <1/10): disgeusia76, hipotensão77, hipertensão78, náusea26, reações no local da injeção46/infusão*.
Reação incomum (≥1/1.000 e <1/100): hipersensibilidade, dor de cabeça79, vertigem80, parestesia81, hipoestesia82, rubor, flebite83, dispneia84, vômitos85, dor abdominal, diarreia86, constipação87, prurido88, erupção89 cutânea58, espasmos90 musculares, mialgia91, artralgia92, dor nas extremidades, dor nas costas93, calafrios94, astenia95, fadiga96, edema27 periférico, dor, aumento da gama-glutamil transferase, aumento da alanina aminotransferase, aumento da aspartato aminotransferase, aumento da ferritina sérica.
Reação rara (≥1/10.000 e <1/1.000): síncope97, sonolência, palpitações98, cromatúria, dor no peito99, hiperidrose100, pirexia101, aumento da lactato102 desidrogenase sérica.
Frequência desconhecida(1): Reações anafilactoides, angioedema103, nível reduzido de consciência, estado de confusão, perda da consciência, tremor, ansiedade, bradicardia104, taquicardia105, colapso106 circulatório, tromboflebite107, broncoespasmo108, urticária109, eritema110, suor frio, mal-estar, palidez
*As mais frequentemente relatadas são: dor, extravasamento, irritação, reações, mudança de cor da pele64, inchaço111 e queimação no local da injeção46/infusão.
(1) Relatos pós-comercialização espontâneos
Em casos de eventos adversos, notifique o Sistema de Notificações em Vigilância Sanitária – NOTIVISA, ou à Vigilância Sanitária Estadual ou Municipal. Informe também a empresa através do seu serviço de atendimento.
SUPERDOSE
Uma superdose pode causar sobrecarga aguda de ferro, que pode manifestar-se como hemosiderose. Superdoses podem ser tratadas com medidas de suporte e, se requerido, um agente quelante de ferro.
Ver item 8. POSOLOGIA E MODO DE USAR- Dose única máxima tolerada.
Em caso de intoxicação, ligue para 0800 722 6001 se você precisar de mais orientações sobre como proceder.
DIZERES LEGAIS
VENDA SOB PRESCRIÇÃO MÉDICA
MS – 1.0639.0255
Carla A. Inpossinato CRF-SP nº 38.535
Fabricado por
Takeda Austria GmbH
Linz - Áustria
Importado por:
Takeda Pharma Ltda.
Rodovia SP 340 S/N km 133,5 - Jaguariúna - SP
CNPJ 60.397.775/0008-40
SAC 0800 7710345