Tremfya
JANSSEN-CILAG FARMACÊUTICA LTDA
IDENTIFICAÇÃO DO MEDICAMENTO
Tremfya®
guselcumabe
solução injetável
FORMA FARMACÊUTICA E APRESENTAÇÃO:
Solução injetável
Seringa1 preenchida
USO SUBCUTÂNEO2
USO ADULTO
COMPOSIÇÃO:
Cada mL de Tremfya® contém:
| guselcumabe | 100 mg |
| veículo q.s.p. | 1 mL |
Veículo: histidina, cloridrato de histidina monoidratado, sacarose, polissorbato 80 e água para injetáveis.
INFORMAÇÕES AO PACIENTE
PARA QUE ESTE MEDICAMENTO É INDICADO?
Psoríase3 em placa4
Adultos: Tremfya® é indicado para o tratamento de pacientes adultos com psoríase3 moderada a grave que são candidatos para tratamento sistêmico5 (com ação em todo o organismo) ou fototerapia (tratamento baseado em banho de luz).
COMO ESTE MEDICAMENTO FUNCIONA?
Tremfya® é um medicamento imunossupressor6 que funciona atuando nas causas da doença inflamatória da psoríase3 em placas7 no seu corpo. O guselcumabe (princípio ativo) exerce efeitos clínicos na psoríase3 em placas7 por meio do bloqueio de uma proteína (citocina8) chamada IL-23 (proteína envolvida na regulação da resposta inflamatória e da imunidade9).
QUANDO NÃO DEVO USAR ESTE MEDICAMENTO?
Você não deve usar Tremfya® se apresentar hipersensibilidade (alergia10) ao guselcumabe ou a qualquer componente da fórmula do medicamento; ou se você tem uma infecção11 ativa, como por exemplo, tuberculose12 ativa.
O QUE DEVO SABER ANTES DE USAR ESTE MEDICAMENTO?
Registre o nome e o número do lote do produto para fins de rastreabilidade.
Infecções13
Tremfya® pode aumentar o risco de infecção11. O tratamento com Tremfya® não deve ser iniciado em pacientes com qualquer infecção11 ativa clinicamente importante até que a infecção11 se resolva ou seja adequadamente tratada. Se você estiver sendo tratado com Tremfya® e ocorram sinais14 ou sintomas15 de infecção11 crônica ou aguda clinicamente importantes, é recomendado que você busque aconselhamento com o seu médico. Se você desenvolver uma infecção11 clinicamente importante ou grave ou não estiver respondendo ao tratamento padrão, seu médico deverá monitorá-lo atentamente e descontinuar Tremfya® até que a infecção11 se resolva.
Avaliação pré-tratamento para tuberculose12
Seu médico deve avaliá-lo para infecção11 por tuberculose12 (TB) antes de iniciar o tratamento com Tremfya®. O tratamento da TB latente deve ser iniciado antes de administrar Tremfya®. Seu médico deve monitorá-lo para sinais14 e sintomas15 de TB ativa durante e depois do tratamento com Tremfya®. Seu médico deve considerar o tratamento anti-TB antes de iniciar o tratamento com Tremfya® se você tiver histórico de TB latente ou ativa no qual um ciclo de tratamento adequado não possa ser confirmado.
Hipersensibilidade
Se ocorrer uma reação de hipersensibilidade (alergia10) grave com você, seu médico interromperá a administração de Tremfya® imediatamente e iniciará a terapia apropriada.
Imunizações
Antes de iniciar o tratamento com Tremfya®, a conclusão de todas as imunizações apropriadas deve ser considerada, de acordo com as atuais diretrizes de imunização16. Vacinas vivas não devem ser usadas concomitantemente em pacientes tratados com Tremfya®. Não há dados disponíveis quanto à resposta a vacinas vivas ou inativas. Antes da vacinação com vírus17 vivos ou bactérias vivas, o tratamento com Tremfya® deve ser parado durante, pelo menos, 12 semanas após a última dose e pode ser retomado, no mínimo, 2 semanas após a vacinação.
Fertilidade, Gravidez18 e Lactação19
As mulheres com potencial para engravidar devem utilizar métodos contraceptivos eficazes durante o tratamento e durante, pelo menos, 12 semanas após o tratamento.
O uso de Tremfya® em gestantes não foi estudado. O efeito de Tremfya® na gestação humana é desconhecido. Tremfya® deve ser utilizado durante a gestação apenas se claramente necessário.
Não se sabe se o guselcumabe é excretado no leite humano. Você e seu médico deverão decidir se deve interromper a amamentação20 durante o tratamento e até 12 semanas após a última dose ou interromper o tratamento com Tremfya®.
O efeito de Tremfya® na fertilidade humana não foi avaliado.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica.
Efeitos na habilidade de dirigir e operar máquinas
Tremfya® não possui influência ou tem influência insignificante na capacidade de dirigir e usar máquinas.
Interações Medicamentosas
Interações com substratos CYP450: A formação de enzimas CYP450 pode ser alterada por níveis aumentados de certas citocinas21 (por exemplo, IL-1, IL-6, IL-10, TNF?, interferon) produzidas pela inflamação22 crônica da psoríase3. Após o início de Tremfya® em pacientes que estão recebendo medicamentos que são metabolizados pelas enzimas CYP450, por exemplo, midazolam, varfarina, omeprazol, dextrometorfano e cafeína, o seu médico deve considerar o monitoramento do efeito terapêutico e/ou a concentração das drogas e considerar o ajuste da dose, conforme necessário.
Terapia imunossupressora concomitante ou fototerapia: A segurança e a eficácia de Tremfya® em combinação com imunossupressores, incluindo biológicos ou fototerapia, não foram avaliadas.
Medicamentos imunossupressores podem ativar focos primários de tuberculose12. Os médicos que acompanham pacientes sob imunossupressão23 devem estar alertas quanto à possibilidade de surgimento de doença ativa, tomando, assim, todos os cuidados para o diagnóstico24 precoce e tratamento.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento. Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde25.
Informações importantes sobre um dos componentes do medicamento
Alerta: Este medicamento contém AÇÚCAR26; portanto, deve ser usado com cautela por pessoas com diabetes27.
ONDE, COMO E POR QUANTO TEMPO POSSO GUARDAR ESTE MEDICAMENTO?
Cuidados de conservação
Este medicamento deve ser armazenado sob refrigeração (temperatura entre 2°C e 8°C), protegido da luz.
Não congelar. Não agitar. Armazenar na embalagem original até o momento do uso.
Número de lote e datas de fabricação e validade: vide embalagem. Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Características físicas e organolépticas do produto
Tremfya® é uma solução transparente, incolor a amarelo-clara, essencialmente livre de material particulado visível com um pH de aproximadamente 5,8.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS.
COMO DEVO USAR ESTE MEDICAMENTO?
Tremfya® é indicado para uso sob a orientação e supervisão de um médico experiente no diagnóstico24 e tratamento de psoríase3 em placas7.
Posologia
Adultos (18 anos ou mais)
Psoríase3 em placas7: A dose recomendada de Tremfya® é de 100 mg administrada por injeção subcutânea28 na semana 0 e 4, seguida por dose de manutenção a cada 8 semanas.
A descontinuação do tratamento deve ser considerada em doentes que não apresentem qualquer resposta após 16 semanas de tratamento.
Modo de administração
Uso subcutâneo2. Se possível, áreas da pele29 que tem lesões30 de psoríase3 devem ser evitadas como locais de injeção31.
Após o treinamento adequado na técnica de injeção subcutânea28, você pode injetar Tremfya® se seu médico determinar que é apropriado. Você será instruído a injetar a quantidade total de Tremfya® de acordo com as "Instruções de uso" fornecidas abaixo.
Para obter mais instruções sobre a preparação e precauções especiais de manuseio, consulte “Precauções especiais para descarte e outros tratamentos” e a seção "Instruções para uso".
Precauções especiais de descarte e outros tratamentos
Depois de remover a seringa1 preenchida da geladeira, mantenha-a dentro do cartucho e deixe atingir a temperatura ambiente esperando por 30 minutos antes de injetar Tremfya®. A seringa1 preenchida não deve ser agitada.
Antes de usar, recomenda-se uma inspeção32 visual da seringa1 preenchida. A solução deve ser clara, incolor a amarelo claro e pode conter algumas pequenas partículas brancas ou claras. Tremfya® não deve ser usado se a solução estiver turva ou descolorida ou contiver partículas grandes.
Qualquer quantidade de medicamento não utilizado ou material de resíduos deve ser descartado de acordo com os requisitos locais.
Populações especiais
Pacientes pediátricos (menores de 18 anos): A segurança e eficácia de Tremfya® em crianças e adolescentes abaixo de 18 anos ainda não foram estabelecidas. Não há dados disponíveis até o momento.
Idosos (65 anos ou mais): Não é necessário ajuste da dose. Há informações limitadas em indivíduos com idade igual ou superior a 65 anos.
Insuficiência renal33 ou hepática34: Tremfya® não foi estudado nesta população de pacientes. Nenhuma recomendação de dose pode ser fornecida.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento.
Não interrompa o tratamento sem o conhecimento do seu médico.
INSTRUÇÕES DE USO
Seringa1 preenchida

DISPOSITIVO DE USO ÚNICO
Importante
Se o seu médico decidir que você poderá se aplicar ou um cuidador poderá aplicar suas injeções de Tremfya® em casa, você deverá receber treinamento sobre o modo correto de preparar e injetar Tremfya® usando a seringa1 preenchida antes de tentar a injeção31.
Leia estas Instruções para uso antes de usar a seringa1 preenchida de Tremfya® e a cada vez que você administrar ou receber as injeções. Podem haver novas informações. Este guia de instruções não substitui falar com seu médico sobre sua condição médica ou seu tratamento. Leia também a bula do Paciente com cuidado antes de iniciar sua injeção31 e discuta quaisquer perguntas que possa ter com o seu médico ou enfermeiro.
A seringa1 preenchida de Tremfya® destina-se a injeção31 sob a pele29, não no músculo ou na veia. Após a injeção31, a agulha será retraída no corpo do dispositivo e será bloqueada.

Informação de armazenamento
Armazenar na geladeira de 2°C a 8°C. Não congelar.
Mantenha Tremfya® e todos os medicamentos fora do alcance das crianças.
Não agite a seringa1 preenchida em momento algum.
Você vai precisar desses suprimentos:
- 1 swab com álcool
- 1 bola de algodão ou compressa de gaze
- 1 curativo adesivo
- 1 recipiente para objetos cortantes (vide Etapa 3)
Preparo para injeção31
30 minutos
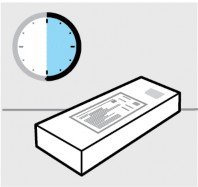
Inspecione o cartucho
Remova o cartucho com a seringa1 preenchida da geladeira. Mantenha a seringa1 preenchida no cartucho e deixe-o sobre uma superfície plana à temperatura ambiente por pelo menos 30 minutos antes do uso.
Não aqueça de maneira alguma.
Verifique a data de validade (‘VAL’) no cartucho.
Não use se a data de validade estiver vencida.
Não prossiga com a injeção31 se a embalagem estiver violada. Contate seu médico ou farmacêutico para maiores informações.
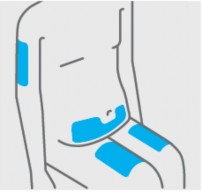
Escolha o local da injeção31
Selecione as seguintes áreas para injeção31:
- Frente das coxas35 (recomendado)
- Região inferior do abdômen
Não use a área de 5 centímetros ao redor do umbigo36.
- Parte de trás dos braços (se um cuidador lhe aplicar a injeção31)
Não injetar na pele29 se estiver inchada, machucada, vermelha, escamosa37 ou dura.
Não injetar em áreas com cicatrizes38 ou estrias.
Limpe o local da injeção31
Lave bem suas mãos39 com sabão e água morna.
Limpe o local de injeção31 escolhido com um swab com álcool e deixe secar.
Não toque, ventile ou assopre o local da injeção31 depois de limpá-lo.
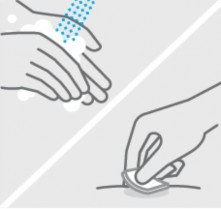
Inspecione o líquido
Retire a seringa1 preenchida do cartucho.
Verique o líquido na janela de visualização. Este deve ser claro a levemente amarelado e pode conter pequenas partículas brancas ou claras. Você também poderá ver uma ou mais bolhas de ar. Isto é normal.
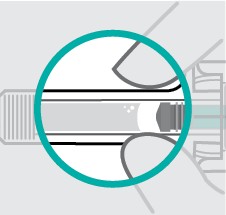
Não injetar se o líquido estiver turvo ou descolorido ou se tiver partículas grandes. Se você não tiver certeza, contate seu médico ou farmacêutico para maiores informações.
Injetar Tremfya® usando a seringa1 preenchida
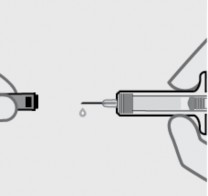
Remova a tampa da agulha
Segure a seringa1 pelo corpo e puxe a tampa da agulha diretamente. É normal ver uma gota40 de líquido.
Injetar dentro de 5 minutos após remover a tampa da agulha.
Não coloque a tampa da agulha de volta, pois isso pode danificar a agulha.
Não toque a agulha ou deixe-a tocar em qualquer superfície.
Não use a seringa1 preenchida de Tremfya® se cair. Contate seu médico ou farmacêutico para maiores informações.
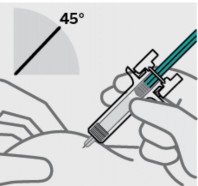
Posicione os dedos e insira a agulha
Coloque o polegar, o indicador e o dedo médio diretamente sob a flange para os dedos, como mostrado.
Não toque o êmbolo41 ou a área acima do flange para os dedos, pois isso pode fazer com que o dispositivo de segurança da agulha seja ativado.
Use a outra mão42 para formar uma prega de pele29 no local da injeção31. Posicione a seringa1 em aproximadamente um ângulo de 45 graus com a pele29.
É importante formar uma prega de pele29 de tamanho suficiente para injetar o medicamento sob a pele29 e não no músculo.
Insira a agulha com um movimento rápido, como um dardo.
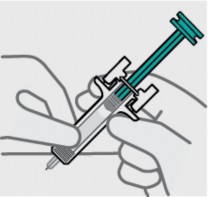
Solte a prega de pele29 e reposicione a mão42
Use sua mão42 livre para segurar o corpo da seringa1.
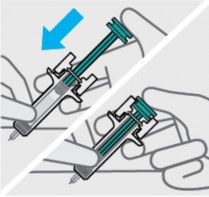
Pressione o êmbolo41
Coloque o polegar da mão42 oposta sobre o êmbolo41 e pressione o êmbolo41 todo para baixo até o fim.
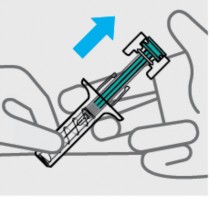
Solte a pressão do êmbolo41
O protetor de segurança cobrirá a agulha e a travará, removendo a agulha da sua pele29.
Depois da injeção31
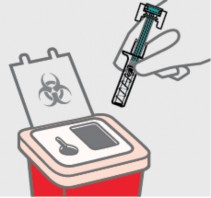
Descarte a seringa1 preenchida usada
Coloque sua seringa1 usada em um recipiente para descarte de objetos cortantes imediatamente após o uso. Certifique-se de descartar o recipiente de acordo com as instruções do seu médico ou enfermeiro quando o recipiente estiver cheio.
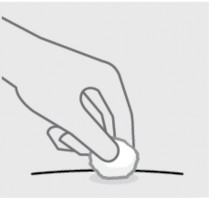
Verifique o local da injeção31
Pode haver uma pequena quantidade de sangue43 ou líquido no local da injeção31. Mantenha pressão sobre a sua pele29 com uma bola de algodão ou gaze até que o sangramento pare.
Não esfregue o local da injeção31.
Se necessário, cubra o local da injeção31 com um curativo.
Sua aplicação está agora completa!
O QUE DEVO FAZER QUANDO EU ME ESQUECER DE USAR ESTE MEDICAMENTO?
Se você esqueceu de tomar a sua dose de Tremfya®, aplique uma dose assim que se lembrar. Em seguida, tome a sua próxima dose no horário regular programado. Se não tiver certeza do que fazer, contate o seu médico.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
QUAIS OS MALES QUE ESTE MEDICAMENTO PODE ME CAUSAR?
Resumo do perfil de segurança: A reação adversa mais comum foi infecção11 do trato respiratório superior.
Lista tabulada de reações adversas
Um total de 1748 pacientes com psoríase3 em placas7 foram tratados com Tremfya® em um estudo de fase II e em três estudos de fase III. Destes, 1393 pacientes com psoríase3 foram expostos a Tremfya® durante pelo menos 6 meses e 728 pacientes foram expostos durante pelo menos 1 ano (isto é, tratados até a semana 48).
As frequências das reações adversas especificadas foram determinadas a partir da análise conjunta de 823 pacientes com psoríase3 em placas7 de moderada a grave que receberam Tremfya® durante os períodos controlados por placebo44 de dois estudos de fase III.
As reações adversas (Tabela 1) são classificadas pelo MedDRA System Organ Class (Grupos Sistêmicos45 do Dicionário Médico para Atividades Regulamentares) e a frequência, utilizando a seguinte convenção: muito comum (≥ 1/10), comum (≥ 1/100 a <1/10), incomum (≥ 1 / 1.000 para <1/100), rara (≥ 1 / 10.000 a <1 / 1.000), muito rara (<1 / 10.000), desconhecida (não pode ser estimada a partir dos dados disponíveis).
Tabela 1: Lista de reações adversas em estudos clínicos
|
Classe de sistema de órgãos |
Frequência |
Reações Adversas |
|
Infecções13 e infestações |
Muito comum |
Infecção11 do trato respiratório superior |
|
|
Comum |
Gastroenterite46 |
|
|
Comum |
Infecções13 por herpes simples |
|
|
Comum |
Infecções13 por Tinea sp. |
|
Distúrbios do sistema neural47 |
Comum |
Cefaleia48 (dor de cabeça49) |
|
Distúrbios gastrointestinais |
Comum |
Diarreia50 |
|
Distúrbios da pele29 e do tecido subcutâneo51 |
Comum |
Urticária52 |
|
Distúrbios musculoesqueléticos e do |
Comum |
Artralgia54 (dor nas articulações55) |
|
Distúrbios gerais e condições do local |
Comum |
Eritema56 (vermelhidão) no local |
|
|
Incomum |
Dor no local de aplicação |
Descrição de reações adversas selecionadas
Gastroenterite46: Nos estudos clínicos, gastroenterite46 ocorreu mais frequentemente no grupo tratado com Tremfya® (1,1%) do que no grupo placebo44 (0,7%). Reações adversas de gastroenterite46 não foram graves e não causaram descontinuação de Tremfya® até a Semana 48.
Reações no local de injeção31: Nos estudos clínicos até a Semana 48, 0,7% das injeções de Tremfya® e 0,3% das injeções de placebo44 foram associadas a reações no local da injeção31. Reações adversas de eritema56 e dor no local da injeção31 foram todas leves a moderadas em gravidade, nenhuma foi grave e causou a descontinuação de Tremfya®.
Imunogenicidade: Em estudos clínicos, menos de 6% dos pacientes tratados com Tremfya® desenvolveram anticorpos57 antidroga em até 52 semanas de tratamento. Dos pacientes que desenvolveram anticorpos57 antidroga, aproximadamente 7% apresentaram anticorpos57 que foram classificados como neutralizantes, o que equivale a 0,4% de todos os indivíduos tratados com Tremfya®. Os anticorpos57 antidroga não foram associados com diminuição de eficácia ou desenvolvimento de reações no local da injeção31.
Atenção: este produto é um medicamento novo e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos. Nesse caso, informe seu médico ou cirurgião-dentista.
O QUE FAZER SE ALGUÉM USAR UMA QUANTIDADE MAIOR DO QUE A INDICADA DESTE MEDICAMENTO?
No caso de superdose você deve ser monitorado para quaisquer sinais14 ou sintomas15 de reações adversas e receber o tratamento sintomático58 apropriado imediatamente.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
DIZERES LEGAIS
VENDA SOB PRESCRIÇÃO MÉDICA
MS – 1.1236.3418
Farm. Resp.: Marcos R. Pereira – CRF/SP nº 12.304
Registrado por:
JANSSEN-CILAG FARMACÊUTICA LTDA.
Avenida Presidente Juscelino Kubitschek, 2041, São Paulo – SP
CNPJ 51.780.468/0001-87
Fabricado por:
Cilag AG
Schaffhausen – Suíça
Importado por:
Janssen-Cilag Farmacêutica Ltda.
Rodovia Presidente Dutra, km 154 São José dos Campos – SP
CNPJ 51.780.468/0002-68
SAC 0800 701 1851