Hyqvia
BAXALTA BRASIL BIOCIÊNCIA LTDA
IDENTIFICAÇÃO DO MEDICAMENTO
Hyqvia
imunoglobulina1 humana normal
Injetável 0,1g/mL
FORMA FARMACÊUTICA E APRESENTAÇÃO:
Solução injetável
Frasco duplo composta por um frasco de imunoglobulina1 humana normal (Imunoglobulina1 a 10% ou IG 10%) e um frasco de hialuronidase humana recombinante (rHuPH20)
USO ADULTO
VIA SUBCUTÂNEA2
COMPOSIÇÃO:
Cada mL de Imunoglobulina1 normal humana (IG a 10%) contém:
| Imunoglobulina1 normal humana (pureza mínima de 98% de imunoglobulina1 G (IgG)) | 100 mg |
| veículo q.s.p. | 1 mL |
Veículo: Glicina e água para injetáveis.
A hialuronidase humana recombinante é uma glicoproteína de 447 aminoácidos em células3 de ovário4 de hamster chinês (CHO) por tecnologia de DNA recombinante. Veículo: Cloreto de sódio, fosfato de sódio dibásico, albumina5 humana, ácido etilenodiaminotetracético (EDTA) dissódico, cloreto de cálcio, hidróxido de sódio (para ajuste de pH), ácido clorídrico6 (para ajuste de pH) e água para injetáveis.
|
hialuronidase humana recombinante |
imunoglobulina1 humana normal 10% |
|
|
Volume (mL) |
Proteína (g) |
Volume (mL) |
|
1,25 |
2,5 |
25 |
|
2,5 |
5 |
50 |
|
5 |
10 |
100 |
|
10 |
20 |
200 |
|
15 |
30 |
300 |
Distribuição das subclasses de IgG (valores aproximados):
|
IgG1 |
≥ 56,9% |
|
IgG2 |
≥ 26,6% |
|
IgG3 |
≥ 3,4% |
|
IgG4 |
≥ 1,7% |
INFORMAÇÕES AO PACIENTE
PARA QUE ESTE MEDICAMENTO É INDICADO?
Hyqvia é indicado para adultos com um sistema imune7 fraco, que não possuem anticorpos8 suficientes em seu sangue9 e tendem a apresentar infecções10 frequentes. Doses regulares e suficientes de Hyqvia podem elevar níveis anormalmente baixos de imunoglobulina1 em seu sangue9 para níveis normais (terapia de reposição).
Hyqvia é prescrito como terapia de reposição para pacientes11 que não possuem anticorpos8 suficientes, incluindo os seguintes casos:
- Pacientes com incapacidade congênita12 ou redução da capacidade de produzir anticorpos8 (imunodeficiências primárias);
- Pacientes com determinados tipos de câncer13 sanguíneo (leucemia14 linfocítica crônica) que causam diminuição da produção de anticorpos8 e infecções10 recorrentes quando os antibióticos preventivos falharam;
- Pacientes com determinados tipos de câncer13 sanguíneo (mieloma15 múltiplo) e diminuição da produção de anticorpos8 com infecções10 recorrentes no qual não houve resposta a vacina16 contra determinada bactéria17 (pneumococci);
- Pacientes com baixa produção de anticorpos8 antes e após transplante de células3 de medula óssea18 de outra pessoa.
COMO ESTE MEDICAMENTO FUNCIONA?
Hyqvia contém duas soluções para infusão (gotejamento) sob a pele19 (infusão subcutânea2 ou SC). É fornecida como embalagem contendo um frasco de imunoglobulina1 normal humana a 10% (a substância ativa) e um frasco de hialuronidase humana recombinante (uma substância que auxilia a imunoglobulina1 humana normal a 10% a chegar ao seu sangue9).
Imunoglobulina1 humana normal a 10% pertence a uma classe de medicamentos denominados “imunoglobulinas humanas normais”. Imunoglobulinas20 também são conhecidas como anticorpos8 e são encontradas no sangue9 de pessoas hígidas. Os anticorpos8 são parte do sistema imune7 (as defesas naturais do sangue9) e auxiliam seu organismo a combater infecções10.
O frasco de imunoglobulinas20 foi preparado a partir do sangue9 de pessoas hígidas. O medicamento atua exatamente do mesmo modo que as imunoglobulinas20 naturalmente presentes no sangue9. Hialuronidase humana recombinante é uma proteína que facilita a infusão de imunoglobulinas20 (gotejamento) sob a pele19 e a chegar ao seu sistema sanguíneo.
QUANDO NÃO DEVO USAR ESTE MEDICAMENTO?
NÃO injetar ou infundir Hyqvia:
- caso seja alérgico a imunoglobulinas20, hialuronidase, hialuronidase recombinante ou qualquer dos outros princípios deste medicamento (listados na seção 6, “Conteúdo da embalagem e outras informações”).
- caso apresente anticorpos8 contra imunoglobulina1 A (IgA) em seu sangue9. Isto poderá ocorrer caso apresente deficiência de IgA. Uma vez que Hyqvia contém quantidades traço de IgA, você poderá apresentar uma reação alérgica21.
- em um vaso sanguíneo (via intravenosa) e no músculo (via intramuscular).
O QUE DEVO SABER ANTES DE USAR ESTE MEDICAMENTO?
Advertências e precauções
As advertências e precauções a seguir deverão ser consideradas antes que você receba ou use Hyqvia. Converse com seu médico ou enfermeira em caso de quaisquer dúvidas.
Reações alérgicas
Você pode ser alérgica às imunoglobulinas20 sem saber. Reações alérgicas como queda súbita na pressão arterial22 ou choque anafilático23 (uma queda súbita na pressão arterial22 com sintomas24 como edema25 de garganta26, dificuldades para respirar e erupção27 cutânea28) são raras, porém podem ocorrer ocasionalmente, mesmo que não tenha apresentado problemas com tratamentos similares. Você apresenta maior risco de reações alérgicas se apresentar deficiência de IgA com anticorpos8 anti IgA. Os sinais29 ou sintomas24 destas reações alérgicas raras incluem:
- sensação de tontura30 ou desmaio,
- erupção27 cutânea28 e coceira, edema25 na boca31 ou garganta26, dificuldade para respirar, respiração ruidosa, frequência cardiaca anormal, dor torácica, lábios ou dedos das mãos32 ou dos pés azulados,
- visão33 embaçada.
Seu médico ou enfermeira infundirá primeiro Hyqvia lentamente, e o monitorará atentamente por todas as primeiras infusões, de modo que qualquer reação alérgica21 possa ser imediatamente detectada e tratada.
Caso perceba qualquer destes sinais29 durante a infusão, informe seu médico ou enfermeira imediatamente. Ele/a decidirá se reduzirá a velocidade de infusão ou interromperá totalmente a infusão.
Velocidade de infusão
É muito importante infundir o medicamento na velocidade correta. Seu médico ou enfermeira o aconselhará sobre a velocidade adequada de infusão a ser utilizada quando estiver infundindo Hyqvia em casa. Monitoramento durante a infusão
Determinados efeitos colaterais34 poderão ocorrer mais frequentemente se: você estiver recebendo Hyqvia pela primeira vez. você tiver recebido outra imunoglobulina1 e tiver sido transferido para Hyqvia. tiver havido um intervalo longo (por exemplo, mais de 2 ou 3 intervalos de infusão) desde a última vez que recebeu Hyqvia.
Nestes casos, você será atentamente monitorado durante sua primeira infusão e pela primeira hora após o término de sua infusão.
Em todos os demais casos, você deverá ser monitorado durante a infusão e por no mínimo 20 minutos depois de ter recebido Hyqvia pelas primeiras infusões.
Tratamento domiciliar
Antes de iniciar o tratamento domiciliar, você deverá designar uma pessoa como tutor. Você e seu tutor serão treinados a detectar os sinais29 iniciais de efeitos colaterais34, principalmente reações alérgicas. Este tutor deverá auxiliá-lo a estar atento a possíveis efeitos colaterais34. Durante a infusão, você deverá monitorar possíveis primeiros sinais29 de efeitos colaterais34.
Caso apresente quaisquer efeitos colaterais34, você ou seu tutor deverá interromper a infusão imediatamente e contatar um médico.
Caso apresente um efeito colateral35 grave, você ou seu tutor deverá buscar imediatamente tratamento emergencial.
Disseminação de infecções10 localizadas
Não infundir Hyqvia no interior ou ao redor de uma área infectada ou edemaciada36 e vermelha em sua pele19, uma vez que isso poderá causar disseminação da infecção37.
Não foram observadas alterações em longo prazo (crônicas) na pele19 nos estudos clínicos. Qualquer inflamação38, protuberâncias (nódulos) ou inflamação38 crônicas ocorridas no local de infusão e com duração superior a alguns dias deverão ser relatadas ao seu médico.
Efeitos nos testes sanguíneos
Hyqvia contém muitos anticorpos8 diferentes, alguns dos quais podem afetar os testes sanguíneos (testes sorológicos).
Informe seu médico sobre seu tratamento com Hyqvia antes de qualquer teste sanguíneo.
Informações sobre a matéria-prima de Hyqvia
A imunoglobulina1 humana normal a 10% de Hyqvia e albumina5 sérica humana (um princípio de hialuronidase humana recombinante) são produzidas a partir do plasma39 humano (a parte líquida do sangue9).
Quando medicamentos são fabricados a partir do sangue9 humano ou plasma39, determinadas medidas são realizadas para prevenção de transmissão de infecções10 aos pacientes. Estas incluem:
- seleção cautelosa dos doadores de sangue9 e plasma39 para garantir que os indivíduos em risco de apresentar infecções10 sejam excluídos, e
- teste de cada doação e pools de plasma39 quanto aos sinais29 de vírus40/infecções10.
Os fabricantes destes produtos também incluem etapas no processamento de sangue9 ou plasma39, que podem inativar ou remover vírus40. Apesar destas medidas, quando medicamentos preparados a partir do sangue9 ou plasma39 humano são utilizados, a possibilidade de transmissão de infecção37 não poderá ser totalmente descartada. Isto também se aplica a quaisquer vírus40 desconhecidos ou emergentes ou outros tipos de infecções10.
As medidas realizadas para fabricação de Hyqvia são consideradas eficazes para vírus40 envelopados, como vírus40 da imunodeficiência41 humana (HIV42), vírus40 da hepatite43 B e vírus40 da hepatite43 C, e para os vírus40 não envelopados de hepatite43 A e parvovírus B19.
As imunoglobulinas20 não foram associadas a infecções10 por hepatite43 A ou parvovírus B19 possivelmente porque os anticorpos8 contra estas infecções10, que estão presentes em Hyqvia, são protetores.
Recomenda-se enfaticamente que a cada vez que utilize Hyqvia, os dados a seguir sejam registrados em seu diário de tratamento: data de administração, número de lote do medicamento e volume injetado, velocidade de fluxo, número e localização dos locais de infusão.
Outros medicamentos e Hyqvia
Informe seu médico, farmacêutico ou enfermeira caso esteja administrando, tenha administrado recentemente ou possa administrar quaisquer outros medicamentos.
Vacinações
Hyqvia poderá reduzir o efeito de algumas vacinas virais, como sarampo44, rubéola45, caxumba46 e varicela47 (vacinas virais vivas). Portanto, depois de receber Hyqvia, você poderá precisar aguardar até 3 meses antes de iniciar determinadas vacinas. Você poderá precisar aguardar até 1 ano depois de receber Hyqvia antes que possa receber sua vacina16 contra sarampo44.
Informe ao seu médico ou enfermeira responsável pela vacinação sobre seu tratamento com Hyqvia.
Efeitos na habilidade de dirigir e usar máquinas
Os pacientes poderão apresentar efeitos colaterais34 (por exemplo, tontura30 ou náusea48) durante o tratamento com Hyqvia, que podem afetar a capacidade de dirigir e operar máquinas. Se isto ocorrer, você deverá aguardar até o desaparecimento das reações.
Informações importantes sobre um dos componentes do medicamento
Hyqvia contém SÓDIO
A hialuronidase humana recombinante de Hyqvia contém pequenas quantidades (3,68 mg por mL) de sódio. Isto poderá ter que ser considerado para pacientes11 que estão em dieta com controle de sódio.
Fertilidade, Gravidez49 e Lactação50
Os efeitos do uso crônico51 de hialuronidase humana recombinante na gestação, lactação50 e fertilidade atualmente são desconhecidos. Hyqvia deverá ser utilizado por gestantes e lactantes52 apenas após discussão com seu médico.
Caso engravide durante o uso de Hyqvia, você deverá discutir com seu médico a possibilidade de participar de um registro de gestação para coleta de dados sobre sua gestação e desenvolvimento do bebê. A finalidade deste registro é coletar e compartilhar dados apenas com as autoridades de saúde53 pública responsáveis pelo monitoramento da segurança deste produto. A participação no registro é voluntária.
Categoria C – Não há estudos adequados em mulheres. Em experiências animais ocorreram alguns efeitos colaterais34 no feto54, mas o benefício do produto pode justificar o risco potencial durante a gravidez49.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento. Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde53.
ONDE, COMO E POR QUANTO TEMPO POSSO GUARDAR ESTE MEDICAMENTO?
Cuidados de conservação
O produto deve ser armazenado em temperatura entre +2°C e +8°C (refrigerado).
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Manter os frascos no cartucho externo para protegê-los da luz. Prazo de validade: 36 meses
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS.
COMO DEVO USAR ESTE MEDICAMENTO?
Não congelar. Não agitar.
Não utilizar este medicamento caso as soluções estejam turvas ou apresentem partículas ou depósitos. Após a abertura, descartar quaisquer soluções não utilizadas nos frascos.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Sempre utilize este medicamento exatamente como seu médico o informou. Verifique com seu médico caso não tenha certeza.
Hyqvia deverá ser infundido sob a pele19 (administração subcutânea2 ou SC).
O tratamento será iniciado pelo seu médico ou enfermeira, porém você poderá utilizar o medicamento em casa depois de ter recebido as primeiras infusões sob supervisão médica e depois de ter sido adequadamente treinado (e/ou seu tutor). Você e seu médico decidirão se você poderá utilizar Hyqvia em casa. Não inicie o tratamento com Hyqvia em casa até que tenha recebido instruções completas.
Administração
Seu médico calculará a dose correta para você com base em seu peso corporal, qualquer tratamento anterior que possa ter recebido e sua resposta ao tratamento. A dose inicial recomendada é aquela que fornece 400 a 800 mg de substância ativa por kg de peso corporal ao mês. No início, você receberá um quarto da dose em intervalos de 1 semana. Esta dose será elevada gradualmente para doses maiores em intervalos de 3 a 4 semanas com as infusões seguintes. Algumas vezes, seu médico poderá recomendar que doses mais elevadas sejam divididas e administradas em dois locais de uma vez. Seu médico também poderá ajustar sua dose dependendo de sua resposta ao tratamento.
Tratamento inicial
Seu tratamento será iniciado por um médico ou enfermeira com experiência no tratamento de pacientes com sistema imune7 fraco e na orientação dos pacientes para tratamento domiciliar. Você será observado cautelosamente por toda a infusão e por no mínimo 1 hora após o término da infusão, para verificar quão bem tolera o medicamento. No início, seu médico ou enfermeira utilizará baixa velocidade de infusão e a aumentará gradualmente durante a primeira infusão e nas infusões seguintes. Quando o médico ou enfermeira tiver encontrado a dose e velocidade de infusão corretas para você, você poderá autoadministrar o tratamento em casa.
Tratamento domiciliar
Você será instruído sobre:
- Técnicas de infusão sem germes (asséptica),
- Uso de bomba de infusão ou acionador de seringa55 (se necessário),
- Manutenção de diário de tratamento, e
- Medidas a serem realizadas em caso de efeitos colaterais34 graves.
Você deverá seguir cautelosamente as instruções de seu médico sobre a dose, velocidade de infusão e cronograma para infusão de Hyqvia, de modo que o tratamento funcione para você.
- Para pacientes11 com peso corporal ≥ 40 kg, a velocidade inicial é de 10 mL por hora por local de infusão. Se bem tolerada, esta poderá ser elevada em intervalos de no mínimo 10 minutos para 240 mL por hora por local para as duas infusões iniciais. Para infusões subsequentes, a velocidade poderá ser elevada para 300 mL por hora por local de infusão;
- Para pacientes11 com peso corporal inferior a 40 kg, a velocidade inicial é de 5 mL por hora por local de infusão. Se bem tolerada, esta poderá ser elevada em intervalos de no mínimo 10 minutos para 80 mL por hora por local para as duas infusões iniciais. Para todas as infusões subsequentes, a velocidade poderá ser elevada para 160 mL por hora por local de infusão.
1. Retirar Hyqvia da caixa
- Deixar que os frascos cheguem à temperatura ambiente. Isto poderá levar até 60 minutos.
- Não aquecer ou agitar Hyqvia.
- Verificar cada frasco de Hyqvia antes do uso:
- Data de validade: Não utilizar após a data de validade.
- Cor:
- Hialuronidase humana recombinante deverá ser límpida e incolor.
- Imunoglobulina1 humana normal a 10% deverá ser límpida e incolor ou amarela pálida.
- Se o líquido estiver turvo ou apresentar partículas, não utilize.
- Tampa: A tampa protetora está na unidade do frasco duplo. Não utilizar o produto se este não possuir a tampa.
2. Reunir todos os materiais:
Reunir todos os itens para sua infusão. Os itens incluem: unidade(s) de frasco duplo de Hyqvia, materiais para infusão (conjunto de agulha subcutânea2, recipiente com solução (bolsa ou seringa55), bandagem e fita adesiva transparentes estéreis, tubos da bomba, dispositivos de transferência, seringas, gaze e fita adesiva), recipiente para materiais perfurocortantes, bomba de infusão eletromecânica de velocidade variável e livro de registro de tratamento e outros materiais, conforme necessários.

3. Preparar uma área de trabalho limpa.
4. Lavar as mãos32:
Lavar bem a mãos32. Posicionar todos os materiais reunidos e abri-los conforme instruído por seu profissional da saúde53.
5. Abrir a(s) unidade(s) de frasco duplo de Hyqvia:
- Retirar as tampas protetoras azuis para expor as tampas do frasco.
- Preparar para transferir o componente hialuronidase humana recombinante de Hyqvia, limpando a tampa de cada frasco com uma haste de algodão com álcool, caso instruído, e deixar secar ao ar (no mínimo 30 segundos).

6. Preparar o frasco de hialuronidase humana recombinante (HY):
- Retirar a seringa55 estéril menor da embalagem e anexar a um aplicador sem ventilação56 ou agulha (dispositivo).
- Puxar o êmbolo57, preencher a seringa55 menor com ar igual à quantidade de hialuronidase humana recombinante no(s) frasco(s) de HY.
- Retirar a tampa da agulha/dispositivo de transferência sem ventilação56.
- Inserir a extremidade da agulha/dispositivo de transferência sem ventilação56 no centro da tampa do frasco e empurrar diretamente para baixo. Empurrar o ar no frasco.
- Virar o frasco de cabeça58 para baixo, com a agulha/dispositivo de transferência sem ventilação56 permanecendo no frasco. A ponta da seringa55 estará apontando para cima.
- Retirar todo o conteúdo da hialuronidase humana recombinante na seringa55.
- Repetir a etapa 6, caso mais de um frasco de hialuronidase humana recombinante seja necessário para sua dose.
- Se possível, combinar toda a hialuronidase humana recombinante necessária para toda a dose de IgG na mesma seringa55.
- Apontar a extremidade da seringa55 para cima e retirar quaisquer bolhas de ar apontando a extremidade da seringa55 para cima e suavemente batendo na seringa55 com seu dedo. Empurrar de modo lento e cauteloso o êmbolo57 para retirar qualquer ar restante.

7. Preparar o conjunto de agulha com hialuronidase humana recombinante (HY):
- Anexar a seringa55 preenchida com hialuronidase humana recombinante ao conjunto da agulha
- Empurrar o êmbolo57 da seringa55 menor para retirar o ar e preencher o conjunto de agulha até as asas da agulha com hialuronidase humana recombinante.
- Observação: Seu profissional da saúde53 poderá recomendar o uso de um conector em “Y” (para mais de um local) ou outra configuração de conjunto de agulha.

8. Preparar imunoglobulina1 humana normal a 10% frasco:
- Preparar para transferir o componente imunoglobulina1 a 10% de Hyqvia, limpando a tampa de cada frasco com uma haste de algodão com álcool, caso instruído, e deixar secar ao ar (no mínimo 30 segundos).
- Imunoglobulina1 humana normal a 10% de Hyqvia poderá ser infundida
- por agrupamento a partir dos frascos em uma seringa55 maior ou bolsa de infusão conforme instruído por seu profissional da saúde53, dependendo da bomba de infusão eletromecânica de velocidade variável a ser utilizada ou
- diretamente a partir do frasco de IG . Inserir o aplicador do tubo da bomba com ventilação56 ou aplicador e agulha com ventilação56 no(s) frasco(s) de imunoglobulina1 humana normal a 10%. Preencher o tubo da bomba de administração e separar até que hialuronidase humana recombinante tenha sido administrada.
- Caso seja necessário mais de um frasco para uma dose completa, perfurar frascos subsequentes após a administração completa do primeiro frasco.
9. Programar a bomba eletromecânica de velocidade variável:
Seguir as instruções do fabricante para preparação da bomba eletromecânica de velocidade variável.
Programar as velocidades de infusão de imunoglobulina1 humana normal a 10% conforme instrução de seu profissional da saúde53.


10. Preparar o local de infusão:
- Escolher um local de infusão na parte intermediária ou superior do abdômen ou coxa59. Vide imagem para a localização do local de infusão. o Selecionar locais em lados opostos do corpo caso seja instruído a infundir em dois locais para doses acima de 600 mL.
- Evitar áreas ósseas, vasos sanguíneos60 visíveis, cicatrizes61 e quaisquer áreas de inflamação38 ou infecção37.
- Alternar os locais de infusão, escolhendo lados opostos do corpo entre as futuras infusões.
- Se instruído por seu profissional da saúde53, limpar o(s) local(is) de infusão com uma haste de algodão com álcool. Deixar secar (no mínimo 30 segundos).

11. Inserir a agulha:
- Retirar a cobertura da agulha. Pegar firmemente e pinçar no mínimo 2 a 2,5 cm de pele19 entre dois dedos.
- Inserir totalmente a agulha até as asas da agulha com um movimento rápido direto na pele19, em um ângulo de 90°. As asas da agulha deverão repousar em posição reta na pele19.
- Manter a agulha no lugar com fita adesiva estéril.
- Repetir esta etapa caso tenha um segundo local de infusão.

(ângulo de 90 graus à pele19)
12. Verificar o posicionamento adequado da agulha antes do início da infusão, caso instruído por seu profissional da saúde53.


13. Manter a agulha na pele19:
- Manter a(s) agulha(s) no local, colocando uma bandagem transparente estéril sobre a agulha.
- Verificar ocasionalmente o(s) local(is) de infusão por toda a infusão quanto ao deslocamento ou extravasamento.

14. Administrar primeiro a infusão de hialuronidase humana recombinante:
- Empurrar lentamente o êmbolo57 da seringa55 menor com hialuronidase humana recombinante em velocidade inicial por local de infusão até aproximadamente 1 a 2 mL por minuto e aumentar conforme tolerado.
- Se estiver utilizando uma bomba, programar a bomba para infundir hialuronidase humana recombinante na velocidade inicial por local de infusão de 1 a 2 mL por minuto e aumentar conforme tolerado.

15. Administrar imunoglobulina1 humana normal a 10%:
Após infusão de todo o conteúdo da seringa55 menor (hialuronidase humana recombinante), retirar a seringa55 do centro do conjunto de agulha. Anexar o tubo da bomba ou a seringa55 maior que contém imunoglobulina1 humana normal a 10% ao conjunto da agulha.
Administrar imunoglobulina1 humana normal a 10% nas velocidades prescritas por seu profissional da saúde53.
16. Lavar o tubo da bomba quando a infusão estiver concluída, se instruído por seu profissional da saúde53:
- Se instruído por seu profissional da saúde53, anexar uma bolsa de solução fisiológica62/seringa55 de lavagem ao tubo da bomba/conjunto de agulha para empurrar imunoglobulina1 humana normal a 10% até as asas da agulha.
17. Retirar o conjunto da agulha:
- Retirar o conjunto da agulha tirando a bandagem em todas as extremidades.
- Puxar as asas da agulha diretamente para cima e para fora.
- Pressionar suavemente um pequeno pedaço de gaze sobre o local da agulha e cobrir com bandagem protetora.
- Descartar a(s) agulha(s) no recipiente para materiais perfurocortantes.
- Descartar o recipiente para materiais perfurocortantes utilizando as instruções fornecidas no recipiente, ou contatar seu profissional da saúde53.
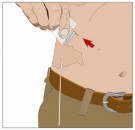
18. Registrar a infusão:
- Retirar o rótulo destacável do frasco de Hyqvia, que possui o número do lote e data de validade do produto, e colocar o rótulo em seu registro/livro de tratamento.
- Escrever a data, horário, dose, local(is) de infusão (para auxiliar na rotação dos locais) e quaisquer reações após cada infusão.
- Descartar qualquer produto não usado no frasco e os materiais descartáveis conforme recomendação por seu profissional da saúde53.
- Acompanhar com seu médico conforme orientação.
Siga a orientação do seu médico, respeitando sempre os horários, as doses e a duração do tratamento. Não interrompa o tratamento sem conhecimento do seu médico.
O QUE DEVO FAZER QUANDO EU ME ESQUECER DE USAR ESTE MEDICAMENTO?
Não infundir uma dose dupla de Hyqvia para compensar uma dose omitida. Caso acredite ter omitido uma dose, converse com seu médico tão logo possível.
Caso tenha quaisquer outras dúvidas sobre o uso deste medicamento, pergunte ao seu médico, farmacêutico ou enfermeira.
QUAIS OS MALES QUE ESTE MEDICAMENTO PODE ME CAUSAR?
Como todos os medicamentos, este medicamento poderá causar efeitos colaterais34, embora nem todos os apresentem.
Determinados efeitos colaterais34, como dor de cabeça58, calafrios63 ou dores no corpo, poderão ser reduzidos pela diminuição da velocidade de infusão.
Efeitos colaterais34 sérios
Infusões de medicamentos como Hyqvia poderão ocasionalmente resultar em reações alérgicas sérias, porém raras. Você poderá apresentar uma redução súbita na pressão arterial22 e, em casos isolados, choque anafilático23. Os médicos estão cientes destes possíveis efeitos colaterais34 e o monitorarão durante e após as infusões iniciais.
Os sinais29 ou sintomas24 típicos incluem: sensação de tontura30 leve, tontura30 ou desmaio, erupção27 cutânea28 e coceira, edema25 na boca31 ou garganta26, dificuldade para respirar, respiração ruidosa, frequência cardiaca anormal, dor torácica, lábios ou dedos das mãos32 ou pés azuis, visão33 embaçada.
- Informar imediatamente seu médico ou enfermeira caso perceba qualquer destes sinais29 durante a infusão.
- Ao usar Hyqvia em casa, você deverá realizar a infusão na presença de um tutor designado que o auxiliará a permanecer alerta quanto a reações alérgicas, interromper a infusão e buscar auxílio, se necessário.
- Vide também a seção 2 deste folheto sobre o risco de reações alérgicas e uso domiciliar de Hyqvia.
Efeitos colaterais34 muito comuns (podem afetar mais de 1 em 10 infusões): Dor no local de infusão, incluindo desconforto e sensibilidade leve a moderada. Estas reações geralmente desaparecem em poucos dias.
Efeitos colaterais34 comuns (podem afetar até 1 em 10 infusões): Reações no local de infusão: Estas incluem vermelhidão, edema25, prurido64, endurecimento e erupção27 no local de infusão. Estas reações geralmente desaparecem em poucos dias. Dor de cabeça58, cansaço, náusea48, vômito65, diarreia66, dor abdominal, dor muscular ou articular, dor torácica, febre67, sensação de fraqueza ou mal-estar.
Efeitos colaterais34 incomuns (podem afetar até 1 em 100 infusões): Calafrios63, enxaqueca68, aumento da pressão arterial22, tontura30, distensão abdominal, erupção27 cutânea28/erupção27 alérgica/vermelhidão, prurido64, dor torácica, nos braços e/ou pernas, edema25 genital (resultante da disseminação do edema25 a partir do local de infusão), edema25 das pernas, pés e tornozelos, testes sanguíneos positivos para anticorpos8.
Frequência desconhecida (não pode ser calculada a partir dos dados disponíveis): Hipersensibilidade e doença gripal.
Efeitos colaterais34 observados com medicamentos similares
Os efeitos colaterais34 a seguir foram observados com a infusão de medicamentos como imunoglobulina1 humana normal a 10% administrados sob a pele19 (via subcutânea2). Embora estes efeitos colaterais34 não tenham sido observados até o momento com Hyqvia, é possível que algumas pessoas que utilizam Hyqvia os apresentem:
Tremores, formigamento oral, batimento cardiaco rápido, reações alérgicas, rubor ou palidez, frio nas mãos32 ou pés, dispneia69, edema25 da face70, sudorese71 excessiva, rigidez muscular, alteração nos testes séricos de função hepática72 (aumento de alanino aminotransferase).
Os efeitos colaterais34 raros a seguir foram observados em pacientes que utilizaram medicamentos como imunoglobulina1 humana normal a 10% administrados em uma veia (via intravenosa). Estas reações não foram observadas com Hyqvia, porém há uma pequena possibilidade de que algumas pessoas que utilizam Hyqvia os apresentem:
- Coágulos sanguíneos nos vasos sanguíneos60 (reações tromboembólicas) causando ataque cardiaco, acidente vascular cerebral73, bloqueio das veias74 profundas ou de vasos sanguíneos60 que chegam ao pulmão75 (embolismo76 pulmonar), distúrbio ou insuficiência renal77, inflamação38 das camadas que revestem o cérebro78 (meningite asséptica79), destruição dos eritrócitos80 (hemólise81).
Caso apresente quaisquer efeitos colaterais34, converse com seu médico, farmacêutico ou enfermeira. Isto inclui quaisquer possíveis efeitos colaterais34 não listados neste folheto.
Informe ao seu médico, cirurgião-dentista ou farmacêutico o aparecimento de reações indesejáveis pelo uso do medicamento. Informe também à empresa através do seu serviço de atendimento.
O QUE FAZER SE ALGUÉM USAR UMA QUANTIDADE MAIOR DO QUE A INDICADA DESTE MEDICAMENTO?
Caso acredite ter utilizado mais Hyqvia do que deveria, converse com seu médico tão logo possível.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
DIZERES LEGAIS
USO RESTRITO A HOSPITAIS
VENDA SOB PRESCRIÇÃO MÉDICA
MS nº 1.5628.0011
Farm. Resp.: Jônia Gurgel Moraes CRF/SP 10.616
Fabricado por:
Baxalta Belgium Manufacturing S.A.
Lessines, Bélgica
Importado por:
Baxalta Brasil Biociência Ltda.
Avenida Dr. Chucri Zaidan, 1.240 Torre B, 12° andar, Conj. 1204, Parte A
São Paulo – SP
CEP 04711-130
CNPJ: 22.558.594/0001-93
SAC 0800 940 0367