Fastfen (5 mcg/mL) (Bula do profissional de saúde)
CRISTÁLIA PRODUTOS QUÍMICOS FARMACÊUTICOS LTDA.
IDENTIFICAÇÃO DO MEDICAMENTO
Fastfen®
citrato de sufentanila
Injetável 7,5 mcg/mL (equivalente a 5 mcg/mL)
Medicamento similar equivalente ao medicamento de referência.
FORMA FARMACÊUTICA E APRESENTAÇÃO:
Solução Injetável
Embalagens contendo 30 ampolas de 2 mL em estojos esterilizados (indicado para uso epidural1).
USO EPIDURAL1
USO ADULTO E PEDIÁTRICO
COMPOSIÇÃO:
Cada mL de Fastfen® 5 mcg/mL contém:
| citrato de sufentanila (equivalente a 5 mcg de sufentanila) | 7,5 mcg |
| veículo q.s.p. | 1 mL |
Veículo: água para injetáveis e cloreto de sódio.
INFORMAÇÕES TÉCNICAS AOS PROFISSIONAIS DE SAÚDE2
INDICAÇÕES
Uso Adulto
Fastfen® é indicado para administração epidural1 em anestesia3 espinhal.
Fastfen® quando utilizado pela via EPIDURAL1 é indicado:
- para o manejo da dor pós-operatória após cirurgia geral, torácica, ou procedimentos ortopédicos e cesariana;
- como analgésico4 associado à bupivacaína epidural1 para analgesia em parto vaginal.
Uso em crianças
O uso epidural1 de sufentanila é indicado em crianças com idade igual ou superior a 1 ano para manejo da dor pós-operatória após cirurgia geral, torácica ou procedimentos ortopédicos.
RESULTADOS DE EFICÁCIA
Pacientes Adultos
Administração epidural1: Foi realizado um estudo randomizado5, duplo-cego, ativo-controlado e com variação de dose, para avaliar a eficácia, resposta à dose e reações adversas da sufentanila quando administrada como analgésico4 peridural6 pós-operatório para parto cesárea, e comparar os resultados com a administração peridural6 de sulfato de morfina. Quarenta mulheres sadias foram randomizadas em 4 grupos (10 pacientes em cada grupo) e receberam sufentanila (30 mcg, 45 mcg ou 60 mcg) ou sulfato de morfina (5 mg) através de cateter peridural6. As pacientes do grupo da morfina apresentaram um tempo médio significativamente maior até início do alívio de 90% da dor (90 minutos) em comparação a todos os grupos da sufentanila (30 minutos para todas as três doses de sufentanila, p <0,05).
Um estudo duplo-cego7, randomizado8, ativo-controlado, investigou os efeitos da sufentanila peridural6 adicionada à bupivacaína 0,125% na qualidade da analgesia durante o trabalho de parto. As pacientes receberam bupivacaína peridural6 12,5 mg com epinefrina 12,5 mcg, com 10 mcg de sufentanila (grupo sufentanila) ou sem sufentanila (grupo controle). Um total de 695 mulheres foi randomizado8 em dois grupos: sufentanila (n=348) ou controle (n=347). A qualidade da analgesia foi significativamente melhor no grupo da sufentanila, com menos pacientes (1,1%) relatando analgesia insuficiente, comparado com 8,4% no grupo controle (p <0,001). A analgesia também durou mais tempo nas pacientes do grupo da sufentanila em comparação ao grupo controle (p <0,01). Os autores concluíram que a injeção9 peridural6 de sufentanila adicionada à bupivacaína 0,125% com epinefrina, melhorou a qualidade da analgesia durante o trabalho de parto e diminuiu a incidência10 de partos fórceps.
Pacientes pediátricos
Administração epidural1: Dois estudos avaliaram a eficácia de sufentanila epidural1 para a analgesia pós-operatória em crianças. Em um estudo, 15 crianças (faixa etária 4-12 anos) receberam uma injeção9 de 0,75 mcg/kg de sufentanila em 2 mL de solução salina isotônica11 através de um cateter peridural6 ao final da cirurgia urológica, quando ocorreu dor de grau 2 (dor expressa verbalmente espontaneamente, com choro ou agitação). O início da analgesia (definida como ausência de dor) ocorreu 3,0 ± 0,3 min (intervalo, 1-5 min) após injeção9 epidural1 de sufentanila; A duração foi de 198±19 min (intervalo, 90-240 min). A sufentanila epidural1 proporcionou analgesia rápida e efetiva em crianças. Durante a primeira hora após administração de sufentanila peridural6, ocorreu depressão do controle ventilatório, o que demandou monitoramento de perto das crianças que recebem sufentanila epidural1 por mais de 1 hora. O segundo estudo comparou sufentanila epidural1 caudal (com bupivacaína mais adrenalina12), bupivacaína mais adrenalina12 e morfina (com bupivacaína mais adrenalina12). Um total de 102 crianças, de 2 a 11 anos, foram randomizadas para receber 1 de 3 soluções: bupivacaína 0,125% 1 mg/kg e sufentanila 0,75 μg/kg (n=35); bupivacaína 0,125% 1 mg/kg (n=41); ou bupivacaína 1 mg/kg e morfina 50 μg/kg (n=26). Não houve necessidade de analgesia adicional em nenhum indivíduo por até 5 horas de pós-operatório, sendo todos os indivíduos classificados como grau I (analgesia adequada). Observou-se diferença significativa às 6 horas de pós-operatório, com mais queixas de dor no grupo da bupivacaína apenas do que nos outros 2 grupos (p <0,03). Nenhum grupo apresentou depressão respiratória. No entanto, a frequência de náuseas13, vômitos14, prurido15 e retenção urinária16 grave foi significativamente maior no grupo da morfina do que nos outros 2 grupos (p <0,05). A sufentanila epidural1 com bupivacaína proporcionou melhor analgesia do que a bupivacaína isolada.
Referências bibliográficas
- Kay B, Rolly G. Duration of action of analgesic supplements to anesthesia. A double-blind comparison between morphine, fentanyl and sulfentanil. Acta Anaesth Belg. 1977;28:25-32.
- De Lange S, Boscoe MJ, Stanley TH, Pace N. Comparison of sulfentanyl-O2 and fentanyl-O2 for coronary artery surgery. Anesthesiology. 1982;56(2):112-118.
- Rosen MA, Dailey PA, Hughes SC, et al. Epidural1 sufentanil for postoperative analgesia after cesarean section. Anesthesiol. 1988;68:448-454.
- Vertommen JD, Vandermeulen E, Van Aken H, et al. The effects of the addition of sufentanil to 0.125% bupivacaine on the quality of analgesia during labor and on the incidence of instrumental deliveries. Anesthesiology. 1991;74(5):809-814.
- Baptista JS, Dias MC. Post-operative analgesia with caudal epidural1 sufentanil. Pediatr Anesth. 1993;3(6):371–374. EDMS-ERI-71333140.
- Benlabed M, Ecoffey C, Levron JC, Flaisler B, Gross JB. Analgesia and ventilatory response to CO2 following epidural1 sufentanil in children. Anesthesiology. 1987;67(6):948-951. EDMS-ERI-71335516.
- Prakanrattana U, Suksompong S. Comparison of sufentanil and fentanyl for surgical repair of congenital cardiac defects. J Med Assoc Thai. 2002;85(Suppl 3):807-813. EDMS-ERI-71334269.
- Xue FS, Xu YC, Liu Y, et al. Different small-dose sufentanil blunting cardiovascular responses to laryngoscopy and intubation in children: a randomized, double-blind comparison. Br J Anaesth. 2008;100(5):717-723. EDMS-ERI-71335511
CARACTERÍSTICAS FARMACOLÓGICAS
Propriedades Farmacodinâmicas
A sufentanila é um analgésico4 opioide altamente potente (7 a 10 vezes mais potente do que a fentanila no homem) e com elevada taxa de segurança (DL50/DE50 = 25211 com o nível mais baixo de analgesia) em ratos, em comparação com a fentanila (277) e com a morfina (69,5).
Como ocorre com outros analgésicos17 opioides, a sufentanila, dependendo da dose e da velocidade de administração, pode causar rigidez muscular, assim como euforia, miose18 e bradicardia19.
Os pacientes que receberam sufentanila não apresentaram potencial de liberação de histamina20.
Todas as ações da sufentanila são imediata e completamente reversíveis quando administrado um antagonista21 opioide específico.
Administração epidural1: Quando utilizado por via epidural1, sufentanila produz uma analgesia espinhal de início rápido (5 a 10 minutos) e de duração moderada (geralmente 4 a 6 horas).
População pediátrica: O tempo médio para o início de ação e de duração da analgesia foi de, respectivamente, 3,0 (± 0,3) e 198 (± 19) minutos após administração epidural1 de 0,75 mcg/mL de sufentanila em 15 crianças com idades de 4 a 12 anos.
Sufentanila por via epidural1 foi administrada apenas em um número limitado de crianças com idades de 3 meses a um ano, em dose única em bolus22 de 0,25 – 0,75 mcg/kg para controle da dor pós-operatória.
Em crianças com idade acima de 3 meses, uma dose epidural1 em bolus22 de 0,1 mcg/kg de sufentanila seguida de uma infusão epidural1 de 0,03 – 0,3 mcg/kg/h combinada com um anestésico local tipo amida, forneceu uma analgesia pós-operatória efetiva por até 72 horas em pacientes após cirurgia sub-umbilical.
Propriedades Farmacocinéticas
A sufentanila é um opioide sintético com efeitos farmacológicos µ agonista23.
Distribuição: Em estudos com doses epidurais, os picos de concentração plasmática são alcançados em 10 minutos e são 4 a 6 vezes menores do que aqueles observados após a administração intravenosa. Quando associada à epinefrina (50 a 75 mcg) observa-se uma redução da absorção rápida inicial de 25 a 50%. Após uma dose epidural1 única de 75 µg de sufentanila em pacientes em pós-operatório, o volume de distribuição médio no estado de equilíbrio Vdss foi 9,5 ± 1,8 L/kg. A meia vida (t1/2) de eliminação terminal média após uma dose epidural1 única de 75 µg variou de 4,6 horas a 5,9 horas.
A ligação de sufentanila às proteínas24 plasmáticas é de cerca de 92,5%. A ligação às proteínas24 plasmáticas em crianças é menor quando comparada aos adultos e aumenta com a idade. Em recém-nascidos, a sufentanila é cerca de 80,5% ligada às proteínas24 quando comparado a 88,5% em bebês25 e a 91,9% em crianças.
Metabolismo26: Os principais locais de biotransformação são o fígado27 e o intestino delgado28. A sufentanila é metabolizada principalmente através da isoenzima 3A4 do citocromo P450 humano.
Eliminação: A meia-vida de eliminação terminal média de sufentanila é de 784 (656–938) minutos. Devido às limitações dos métodos de detecção, a meia-vida de eliminação da sufentanila foi significativamente mais curta (240 minutos) após uma dose de 250 mcg do que após uma dose de 1500 mcg. A depuração plasmática é de 917 mL/minuto. Aproximadamente 80% da dose administrada é excretada em 24 h, e apenas 2% da dose é eliminada de forma inalterada.
Populações especiais
Insuficiência hepática29: O volume de distribuição é levemente aumentado e a depuração total é levemente reduzida em pacientes cirróticos quando comparado aos controles. Isso resulta em um prolongamento significativo da meia-vida em cerca de 30%, o que requer um período maior de vigilância pós-operatória (vide “Advertências e Precauções”).
Insuficiência renal30: O volume de distribuição no estado de equilíbrio, a depuração total e a meia-vida terminal de eliminação em pacientes em diálise31 e que se submeteram a transplante renal32 não são diferentes daqueles em controles saudáveis. A fração livre de sufentanila na população não é diferente daquela em pacientes saudáveis.
População pediátrica: As informações sobre a farmacocinética em crianças são limitadas.
Administração epidural1
Após a administração epidural1 de 0,75 mcg/kg de sufentanila em 15 crianças com idades de 4 a 12 anos, os níveis plasmáticos avaliados 30, 60, 120 e 240 minutos após a injeção9 variaram de 0,08 (± 0,01) a 0,10 (± 0,01) ng/mL.
Em crianças com idades entre 5 e 12 anos recebendo sufentanila em bolus22 a 0,6 mcg/kg seguida de infusão epidural1 contínua contendo 0,08 mcg/kg/h de sufentanila e bupivacaína 0,2 mg/kg/h por 48 horas, as concentrações máximas foram alcançadas em aproximadamente 20 minutos após a injeção9 por bolus22 abaixo do limite de quantificação (< 0,02 ng/mL) a 0,074 ng/mL.
CONTRAINDICAÇÕES
Sufentanila é contraindicado em pacientes com intolerância conhecida aos componentes do medicamento ou a qualquer outro opioide. O uso intravenoso no parto, ou antes do clampeamento do cordão umbilical33 durante cesariana, é contraindicado devido à possibilidade de depressão respiratória no recém-nascido. Entretanto, para uso epidural1, doses de até 30 mcg de sufentanila não influenciam na condição da mãe ou do recém-nascido.
Como ocorre com outros opioides administrados por via epidural1, sufentanila não deve ser dado em presença de: hemorragia34 ou choque35 graves; septicemia36; infecção37 no local da injeção9; distúrbios da hemostase tais como trombocitopenia38 e coagulopatias; ou na presença de tratamento anticoagulante39 ou de qualquer outro tratamento medicamentoso ou outra condição médica concomitante onde seja contraindicada a utilização da técnica por via epidural1.
ADVERTÊNCIAS E PRECAUÇÕES
Depressão respiratória
Como para com todos os opioides potentes, pode ocorrer depressão respiratória dose-dependente, mas que pode ser revertida pelo uso de um antagonista21 opioide específico; entretanto, doses repetidas do antagonista21 podem ser necessárias porque a depressão respiratória pode durar mais tempo do que o tempo de ação do antagonista21 opioide. Depressão respiratória importante acompanha a analgesia profunda. Ela pode persistir no período pós-operatório, e, se a sufentanila foi dada por via intravenosa, ela pode até mesmo recorrer. Assim, os pacientes devem permanecer sob observação apropriada. Os tratamentos de reanimação e antagonistas opioides devem estar prontamente disponíveis. A hiperventilação durante a anestesia3 pode alterar a resposta do paciente ao CO2 e assim afetar a respiração no período pós-operatório.
Risco do uso concomitante de depressores do sistema nervoso central40 (SNC41), especialmente benzodiazepínicos ou medicamentos relacionados
O uso concomitante de sufentanila e depressores do sistema nervoso central40 (SNC41), especialmente benzodiazepínicos ou medicamentos relacionados, em pacientes com respiração espontânea, pode aumentar o risco de sedação42 profunda, depressão respiratória, coma43 e morte. Se for tomada a decisão de administrar sufentanila concomitantemente com um depressor do SNC41, especialmente um benzodiazepínico ou medicamento relacionado, deve ser administrada a menor dose eficaz de ambos os medicamentos, durante o período mais curto de utilização concomitante. Os pacientes devem ser cuidadosamente monitorados quanto a sinais44 e sintomas45 de depressão respiratória e sedação42 profunda. Portanto, é altamente recomendável informar os pacientes e seus cuidadores para que estejam cientes desses sintomas45 (vide “Interações Medicamentosas”).
Dependência de drogas e potencial para abuso
Tolerância, dependência física e dependência psicológica podem se desenvolver com a administração repetida de opioides. Os riscos aumentam em pacientes com histórico pessoal ou familiar de abuso de substâncias (incluindo abuso ou dependência de drogas ou álcool) ou doença mental (por exemplo, depressão maior). Portanto, é possível que uma dose maior de sufentanila seja necessária para produzir o mesmo resultado.
A dependência física pode resultar em sintomas45 agudos de abstinência após descontinuação abrupta ou redução significativa da dosagem de opioides.
O uso abusivo de sufentanila pode ocorrer de maneira semelhante a outros agonistas opioides. O abuso ou uso indevido intencional de sufentanila pode resultar em superdosagem e/ou morte. Mesmo pessoas sob risco aumentado de abuso de opioides podem ser adequadamente tratadas com sufentanila.
Síndrome46 de abstinência neonatal
Caso mulheres utilizem opioides cronicamente durante a gravidez47, há risco de seus bebês25 recém-nascidos apresentarem a síndrome46 de abstinência neonatal (veja “Gravidez (Categoria B)”).
Rigidez muscular
A indução de rigidez muscular que também pode envolver os músculos respiratórios48 torácicos pode ocorrer, mas pode ser evitada se forem seguidas as seguintes medidas: injeção9 intravenosa lenta (geralmente suficiente para doses baixas), pré-medicação com benzodiazepínicos e o uso de relaxantes musculares.
Movimentos (mio) clônicos não-epilépticos podem ocorrer.
Doença cardíaca
Bradicardia19 e possivelmente parada cardíaca podem ocorrer se o paciente tiver recebido uma quantidade insuficiente de anticolinérgicos ou quando sufentanila é combinado com relaxantes musculares não-vagolíticos. A bradicardia19 pode ser tratada com atropina.
Os opioides podem induzir hipotensão49, especialmente em pacientes hipovolêmicos. Medidas apropriadas de manutenção de uma pressão arterial50 estável devem ser tomadas.
Condições especiais de administração
O uso de injeções de opioides em bolus22 rápido deve ser evitado em pacientes apresentando acometimentos intracerebrais; em tais pacientes uma queda transitória da pressão arterial50 média foi ocasionalmente acompanhada de uma redução na pressão de perfusão cerebral de curta duração.
Pacientes em tratamento crônico51 com opioides ou com uma história de abuso de opioides podem necessitar de doses maiores.
É recomendada a redução da posologia em pacientes idosos e em pacientes debilitados. Os opioides devem ser titulados com precaução em pacientes com qualquer uma das seguintes condições: hipotireoidismo52 não controlado; doença pulmonar; reserva respiratória diminuída, alcoolismo; insuficiência renal30 ou hepática53. Tais pacientes também necessitam acompanhamento pós-operatório prolongado.
Com a administração epidural1, deve-se ter cuidado na presença de depressão respiratória ou comprometimento da função respiratória e na presença de sofrimento fetal. A paciente deve ser monitorada cuidadosamente por pelo menos 1 hora após cada dose, pois depressão respiratória precoce pode ocorrer.
Hiperalgesia54 induzida por opioide
Hiperalgesia54 induzida por opioide (HIO) é uma resposta paradoxal55 a um opioide, particularmente com altas doses ou uso crônico51, na qual há aumento na percepção da dor apesar de exposição estável ou crescente ao opioide. Difere da tolerância, na qual são necessárias doses mais altas de opioide para obter o mesmo efeito analgésico4 ou tratar a dor recorrente. A HIO pode se manifestar como níveis aumentados de dor, dor mais generalizada (isto é, menos localizada) ou dor a estímulos comuns (isto é, não dolorosos) (alodinia56) sem evidência de progressão da doença.
Quando houver suspeita de HIO, a dose de opioides deve ser diminuída ou reduzida gradativamente, se possível.
População pediátrica
Devido à alta variabilidade dos parâmetros farmacocinéticos em recém-nascidos, existe um risco de superdose ou de subdose de sufentanila por via intravenosa no período neonatal.
A segurança e a eficácia da administração epidural1 de sufentanila em crianças com menos de 1 ano de idade não foram estabelecidas.
Efeitos na habilidade de dirigir e operar máquinas
Os pacientes só devem dirigir veículos ou operar máquinas se um período de tempo suficiente depois da administração de sufentanila tiver transcorrido.
Gravidez47 e Lactação57
A segurança do uso intravenoso da sufentanila em gestantes humanas não foi bem estabelecida, apesar dos estudos em animais não demonstrarem nenhum efeito teratogênico58. Como ocorre com outros medicamentos, o risco deve ser pesado contra os potenciais benefícios para o paciente.
O uso crônico51 de um opioide durante a gravidez47 pode causar dependência da droga no neonato59, levando à síndrome46 de abstinência neonatal. Se o uso de opioide for necessário por um período prolongado em uma mulher grávida, informe ao paciente o risco de síndrome46 de abstinência neonatal causada por opioide.
Estudos clínicos controlados durante o trabalho de parto demonstraram que sufentanila associado à bupivacaína epidural1 numa dose total de até 30 mcg não provocou sofrimento fetal ou qualquer efeito deletério sobre a mãe, mas o uso intravenoso é contraindicado no trabalho de parto. Sufentanila atravessa a placenta. Após administração epidural1 de dose total não excedendo 30mcg, a média da concentração plasmática detectada na veia umbilical foi de 0,016ng/mL. Um antídoto60 para a criança deve estar sempre disponível.
Sufentanila é excretado no leite humano. Deve-se ter cuidado quando se administra sufentanila a mulheres que estejam amamentando.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista. Este medicamento pode causar doping.
INTERAÇÕES MEDICAMENTOSAS
Depressores do Sistema Nervoso Central40 (SNC41)
Medicamentos tais como barbitúricos, benzodiazepínicos ou medicamentos relacionados, neurolépticos61, anestésicos gerais e outros depressores não seletivos do SNC41 (por exemplo: álcool) podem potencializar a depressão respiratória dos opioides. Quando os pacientes tiverem recebido tais substâncias depressoras do SNC41, a dose de sufentanila deverá ser menor que a usual. O uso concomitante de sufentanila em pacientes que respiram espontaneamente pode aumentar o risco de depressão respiratória, sedação42 profunda, coma43 e morte (vide “Advertências e Precauções”).
Efeitos de Fastfen® em outros medicamentos
Após a administração de sufentanila, a dose dos outros depressores do SNC41 deverá ser reduzida. Isto é particularmente importante após uma cirurgia, pois a analgesia profunda é acompanhada por depressão respiratória acentuada, que pode persistir ou reaparecer no período pós-operatório. A administração de depressores do SNC41, como benzodiazepinicos ou medicamentos relacionados, durante este período pode aumentar desproporcionalmente o risco de depressão respiratória (vide “Advertências e Precauções”).
Inibidores do citocromo P450 3A4 (CYP3A4)
A sufentanila é metabolizada principalmente via isoenzima 3A4 do citocromo humano P450. No entanto, não tem sido observada inibição in vivo por eritromicina (um conhecido inibidor da isoenzima 3A4 do citocromo P450). Embora dados clínicos não estejam disponíveis, dados in vitro sugerem que outros inibidores potentes da isoenzima 3A4 do citocromo P450 (por exemplo: cetoconazol, itraconazol e ritonavir) podem inibir o metabolismo26 da sufentanila. Isto pode aumentar o risco de depressão respiratória prolongada ou tardia. O uso concomitante de tais fármacos requer cuidado especial e observação do paciente; em particular, pode ser necessário reduzir a dose de sufentanila.
Inibidores da monoamina oxidase (IMAO62)
Geralmente, recomenda-se que seja interrompido o uso de inibidores da monoaminoxidase63 duas semanas antes de qualquer procedimento anestésico ou cirúrgico.
Medicamentos serotoninérgicos
A coadministração de sufentanila com um agente serotoninérgico, como os inibidores seletivos de recaptação da serotonina (ISRSs), os inibidores de recaptação da serotonina e norepinefrina (IRSNs) ou os inibidores da monoamina oxidase (IMAOs), pode aumentar o risco de síndrome serotoninérgica64, uma condição potencialmente fatal.
CUIDADOS DE ARMAZENAMENTO DO MEDICAMENTO
Cuidados de conservação
Conservar o produto em temperatura ambiente, entre 15 e 30°C, protegido da luz. Evitar o congelamento. O produto deve ser protegido da luz após diluição.
O prazo de validade é de 24 meses a partir da data de fabricação impressa na embalagem. O produto não contém conservantes.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Características físicas e organolépticas do produto
solução límpida incolor, essencialmente livre de partículas visíveis.
Antes de usar, observe o aspecto do medicamento.
TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS.
POSOLOGIA E MODO DE USAR
Sufentanila é uma solução aquosa isotônica11, estéril, sem conservantes, contendo citrato de sufentanila equivalente a 5 ou 50 mcg de sufentanila por mL, para uso epidural1. Se necessário, sufentanila pode ser misturado em infusões de soro65 fisiológico66 ou soro65 glicosado. Tais diluições são compatíveis com equipamentos de infusão de plástico, e devem ser utilizados no máximo até 24 h após a preparação e protegido da luz durante todo esse período.
Posologia
A posologia de sufentanila deve ser individualizada de acordo com a idade, o peso, o estado físico, patologias subjacentes, o uso de outras medicações e o tipo de procedimento cirúrgico e a anestesia3. O efeito da dose inicial deve ser levado em conta para a determinação das doses suplementares.
Administração epidural1
A localização adequada da agulha ou do cateter no espaço epidural67 deve ser verificada antes de sufentanila ser injetado.
Uso para manejo da dor pós-operatória: Uma dose inicial de 30 a 50 mcg deve provavelmente promover um alívio adequado da dor por até 4 a 6 horas. Doses adicionais em bolus22 de 25 mcg podem ser administradas se existirem evidências de superficialização da analgesia.
Uso como agente analgésico4 durante o parto: A adição de sufentanila 10 mcg à bupivacaína epidural1 (0,125%–0,25%) proporciona uma maior duração e uma melhor qualidade da analgesia. Se necessário, duas injeções subsequentes da combinação podem ser dadas. Recomenda-se não exceder uma dose total de 30 mcg de sufentanila.
Populações especiais
Idosos (65 anos de idade ou mais): Assim como para outros opioides, a dose deve ser reduzida em pacientes idosos e em pacientes debilitados.
População pediátrica: A sufentanila deve ser administrada por via epidural1 em crianças apenas por anestesiologistas especificamente treinados em anestesia3 pediátrica epidural1 e no manejo dos efeitos da depressão respiratória provocada por opioides. Equipamento apropriado de reanimação, incluindo dispositivos de manutenção das vias aéreas e um antagonista21 opioide devem estar prontamente disponíveis.
Pacientes pediátricos devem ser monitorados para sinais44 e sintomas45 de depressão respiratória por pelo menos 2 horas após administração epidural1 de sufentanila.
Dados limitados estão disponíveis para o uso epidural1 de sufentanila em pacientes pediátricos.
- Crianças < 1 ano: Não existem dados disponíveis para a administração epidural1 de sufentanila em recém-nascidos e bebês25 com menos de 3 meses de idade, e são limitados os dados disponíveis em crianças entre 3 meses e 1 ano de idade (vide “Propriedades Farmacodinâmicas”).
A segurança e a eficácia de sufentanila em crianças com menos de 1 ano de idade não foram estabelecidas (vide “Advertências e Precauções” e “Propriedades Farmacodinâmicas”). Não podem ser feitas recomendações posológicas para crianças nesta faixa etária. Sendo assim, não é recomendado o uso de sufentanila nessa população.
- Crianças ≥ 1 ano: Uma dose única em bolus22 de 0,25 – 0,75 mcg/kg de sufentanila administrada no intra-operatório resultou em alívio da dor por um período que variou de 1 a 12 horas nos estudos clínicos. A duração da analgesia efetiva é influenciada pelo procedimento cirúrgico e uso concomitante de anestésico local epidural1 do tipo amida.
Modo de usar
- Use luvas ao abrir a ampola.
- Mantenha a ampola entre o polegar e o indicador, deixando a extremidade da ampola livre.
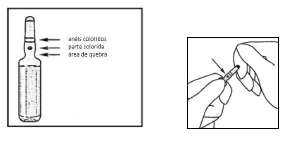
- Com a outra mão68, segure a extremidade da ampola colocando o indicador contra o pescoço69 da ampola, e o polegar na parte colorida em paralelo aos anéis de identificação coloridos.
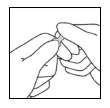
- Mantendo o polegar na parte colorida, quebre rapidamente a extremidade da ampola enquanto segura firmemente a outra parte da ampola com a mão68.
Exposição dérmica acidental deve ser tratada através da lavagem da área afetada com água. Evite o uso de sabonete, álcool e outros materiais de limpeza que possam causar abrasões químicas ou físicas à pele70.
REAÇÕES ADVERSAS
Ao longo desta seção, as reações adversas são apresentadas. As reações adversas são eventos adversos considerados razoavelmente associados ao uso de sufentanila com base na avaliação abrangente da informação disponível sobre eventos adversos. Uma relação causal com a sufentanila não pode ser estabelecida de forma confiável em casos individuais. Além disso, como os ensaios clínicos71 são conduzidos sob condições muito variadas, as taxas de reações adversas observadas nos ensaios clínicos71 de uma droga não podem ser comparadas diretamente às taxas nos estudos clínicos de outra droga e podem não refletir as taxas observadas na prática clínica.
Dados de estudos clínicos
A segurança de sufentanila foi avaliada em 650 indivíduos que receberam sufentanila e que participaram de 6 estudos clínicos. Destes, 78 indivíduos participaram de 2 estudos para a administração intravenosa de sufentanila como agente anestésico para indução e manutenção da anestesia3 em indivíduos submetidos a procedimentos cirúrgicos de grande porte (ponte de safena ou cirurgia cardíaca a céu aberto). Os 572 indivíduos remanescentes participaram de 4 estudos para a administração epidural1 de sufentanila como analgésico4 pós-operatório ou como analgésico4 adjuvante à administração epidural1 de bupivacaína durante o trabalho de parto ou parto normal. Estes indivíduos receberam pelo menos uma dose de sufentanila e produziram dados de segurança. Reações adversas que foram relatadas por ≥1% dos indivíduos que receberam sufentanila nestes estudos estão apresentados na Tabela 2.
Tabela 2. Reações adversas relatadas por ≥ 1% dos indivíduos que receberam sufentanila em 6 estudos clínicos de sufentanila.
|
Classe de Sistema/Órgão |
sufentanila |
|
Distúrbios do Sistema Nervoso72 |
|
|
Sedação42 |
19,5 |
|
Tremor neonatal |
4,5 |
|
Tontura73 |
1,4 |
|
Cefaléia74 |
1,4 |
|
Distúrbios Cardíacos |
|
|
Taquicardia75 |
1,8 |
|
Distúrbios Vasculares76 |
|
|
Hipertensão77 |
4,9 |
|
Hipotensão49 |
3,2 |
|
Palidez |
1,4 |
|
Distúrbios Respiratórios, Torácicos e do Mediastino78 |
|
|
Cianose79 neonatal |
2,0 |
|
Distúrbios Gastrintestinais |
|
|
Náusea80 |
9,8 |
|
Vômito81 |
5,7 |
|
Distúrbios da Pele e Tecido Subcutâneo82 |
|
|
Prurido15 |
15,2 |
|
Descoloração da pele70 |
3,1 |
|
Distúrbios Musculoesqueléticos e do Tecido Conjuntivo83 |
|
|
Contração muscular |
2,0 |
|
Distúrbios Renais e Urinários |
|
|
Retenção urinária16 |
3,2 |
|
Incontinência urinária84 |
1,5 |
|
Distúrbios Gerais e Condições do Local da administração |
|
|
Pirexia85 |
1,7 |
As reações adversas adicionais que ocorreram <1% dos indivíduos que receberam sufentanila em 6 estudos clínicos estão listadas na Tabela 3.
Tabela 3. Reações adversas relatadas por <1% dos indivíduos que receberam sufentanila em 6 estudos clínicos de sufentanila.
|
Classe de Sistema/Órgão Reação Adversa |
|
Infecção37 e Infestação86 |
|
Rinite87 |
|
Distúrbios do Sistema Imunológico88 |
|
Hipersensibilidade |
|
Distúrbios Psiquiátricos |
|
Apatia89 |
|
Nervosismo |
|
Distúrbios do Sistema Nervoso72 |
|
Ataxia90 |
|
Discinesia neonatal |
|
Distonia91 |
|
Hiperreflexia92 |
|
Hipertonia93 |
|
Hipocinseia neonatal |
|
Sonolência |
|
Distúrbios Oftalmológicos |
|
Distúrbios visuais |
|
Distúrbios Cardíacos |
|
Arritmia94* |
|
Anormalidade no eletrocardiograma95 |
|
Bloqueio atrioventricular |
|
Bradicardia19 |
|
Cianose79 |
|
Distúrbios Respiratórios, Torácicos e do Mediastino78 |
|
Broncoespasmo96 |
|
Tosse |
|
Disfonia97 |
|
Soluço |
|
Hipoventilação |
|
Distúrbios Respiratórios |
|
Distúrbios da Pele70 e do Tecido Conjuntivo83 |
|
Dermatite98 alérgica * |
|
Pele70 seca |
|
Hiperidrose99 |
|
Erupção100 cutânea101 |
|
Erupção100 cutânea101 neonatal |
|
Distúrbios Musculoesqueléticos e do Tecido Conjuntivo83 |
|
Dor nas costas102 |
|
Hipotonia103 neonatal |
|
Rigidez muscular * |
|
Distúrbios Gerais e Condições do Local da Administração |
|
Calafrios104 |
|
Hipotermia105 |
|
Diminuição da temperatura do corpo |
|
Dor no local da injeção9 * |
|
Reação no local da injeção9 |
|
Dor |
|
Laboratoriais |
|
Aumento da temperatura do corpo |
*Reações adversas relatadas provenientes apenas de estudos nos quais a sufentanila foi administrada por via intravenosa como agente anestésico.
Dados de pós-comercialização
As reações adversas inicialmente identificadas durante a experiência de pós-comercialização com citrato de sufentanila estão apresentadas a seguir.
As reações adversas estão apresentadas por frequência da categoria baseada nas taxas de relatos espontâneas.
Reação muito rara (< 1/10.000), incluindo relatos espontâneos:
- Distúrbios do Sistema Imunológico88: choque anafilático106, reação anafilática107, reação anafilactoide108;
- Distúrbios do Sistema Nervoso72: coma43, convulsão109, contrações musculares involuntárias;
- Distúrbios Oftalmológicos: miose18;
- Distúrbios Cardíacos: parada cardíaca (vide “Advertências e Precauções”);
- Distúrbios Vasculares76: choque35;
- Distúrbios Respiratórios, Torácicos e do Mediastino78: parada respiratória, apneia110, depressão respiratória, edema pulmonar111, laringoespasmo (vide “Contraindicações” e “Advertências e Precauções”);
- Distúrbios da Pele70 e do Tecido Subcutâneo112: eritema113;
- Distúrbios Musculoesqueléticos e do Tecido Conjuntivo83: espasmo114 muscular (vide “Advertências e Precauções”).
População pediátrica
É esperado que a frequência, o tipo e a gravidade das reações adversas em pacientes pediátricos sejam os mesmos daqueles em adultos.
Em casos de eventos adversos, notifique pelo Sistema VigiMed, disponível no Portal da Anvisa.
Uma superdose de sufentanila manifesta-se como uma extensão de suas ações farmacológicas. Pode ocorrer depressão respiratória, que pode variar de bradipneia a apneia110.
Tratamento
Na presença de hipoventilação ou apneia110, deve ser administrado oxigênio e a respiração deve ser assistida ou controlada conforme indicado. Um antagonista21 opioide específico deve ser usado como indicado para controlar a depressão respiratória. Isso não exclui a utilização de medidas mais imediatas. A depressão respiratória pode durar mais do que o efeito do antagonista21; doses adicionais podem ser assim necessárias.
Se a depressão respiratória é associada com rigidez muscular, um bloqueador neuromuscular intravenoso pode ser necessário para facilitar a respiração assistida ou controlada.
O paciente deve ser observado cuidadosamente; a temperatura corporal e a infusão adequada de líquidos devem ser mantidas. Se a hipotensão49 é grave ou persistente, a possibilidade de hipovolemia115 deve ser considerada e, se presente, deve ser controlada com administração apropriada de líquidos por via parenteral.
Em caso de intoxicação ligue para 0800 722 6001, se você precisar de mais orientações.
DIZERES LEGAIS
VENDA SOB PRESCRIÇÃO MÉDICA
USO RESTRITO A HOSPITAIS
ATENÇÃO: PODE CAUSAR DEPENDÊNCIA FÍSICA OU PSÍQUICA
MS nº 1.0298.0216
Farm. Resp.: Dr. José Carlos Módolo - CRF-SP nº 10.446
Registrado por:
CRISTÁLIA - Produtos Químicos Farmacêuticos Ltda.
Rodovia Itapira-Lindóia, km 14 - Itapira - SP
CNPJ nº 44.734.671/0001-51
Indústria Brasileira
Fabricado por:
CRISTÁLIA - Produtos Químicos Farmacêuticos Ltda.
Av. Nossa Senhora da Assunção, 574 - Butantã - São Paulo - SP
CNPJ nº 44.734.671/0008-28
Indústria Brasileira
SAC 0800-7011918