Lucentis (Bula do profissional de saúde)
NOVARTIS BIOCIENCIAS S.A
IDENTIFICAÇÃO DO MEDICAMENTO
Lucentis®
ranibizumabe
Injeção1 10 mg/mL
FORMA FARMACÊUTICA E APRESENTAÇÃO:
Solução para injeção1
Embalagem com 1 frasco-ampola contendo 2,3 mg de ranibizumabe em 0,23 mL de solução e uma agulha com filtro para retirada do conteúdo do frasco
VIA INTRAVÍTREA
USO ADULTO E PEDIÁTRICO (VIDE INDICAÇÕES)
COMPOSIÇÃO:
Cada frasco-ampola de Lucentis® contém:
| ranibizumabe | 2,3 mg |
| solução | 0,23 mL |
Veículo: alfa, alfa-trealose di-hidratada, cloridrato de histidina monoidratado, histidina, polissorbato 20, água para injetáveis.
INFORMAÇÕES TÉCNICAS AOS PROFISSIONAIS DE SAÚDE2
INDICAÇÕES
Lucentis® é indicado em adultos para:
- o tratamento da degeneração macular3 neovascular (exsudativa4 ou úmida) relacionada à idade (DMRI);
- o tratamento de deficiência visual devido ao edema macular5 diabético (EMD);
- o tratamento de retinopatia diabética6 proliferativa (RDP);
- o tratamento da deficiência visual devido ao edema macular5 secundário à oclusão de veia da retina7 (OVR);
- o tratamento do comprometimento visual devido à neovascularização8 coroidal (NVC). Lucentis® é indicado em bebês9 prematuros para:
- o tratamento da retinopatia da prematuridade (RP) com zona I (fase 1+, 2+ 3 ou 3+), zona II (estágio 3+) ou RP-PA (RP posterior agressiva).
RESULTADOS DE EFICÁCIA
Tratamento da forma neovascular da DMRI
Na forma neovascular da DMRI, a segurança e a eficácia clínica de Lucentis® foram avaliadas em três estudos randomizados, duplo-mascarados, controlados com injeções ativas ou simuladas*, em pacientes com DMRI neovascular (FVF2598g (MARINA), FVF2587g (ANCHOR) e FVF3192g (PIER))1, 2, 3, 4, 5, 6. Um total de 1.323 pacientes (879 ativos e 444 controles) foram incluídos nesses estudos5.
– Estudo FVF2598g (MARINA) e estudo FVF2587g (ANCHOR)
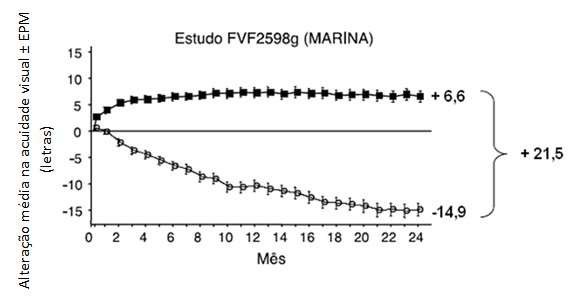
Nos 24 meses do estudo FVF2598g (MARINA)1,3, pacientes com NVC minimamente clássica ou oculta sem componente clássico receberam injeções intravítreas mensais de Lucentis® 0,3 mg ou 0,5 mg ou injeções simuladas. Um total de 716 pacientes foram incluídos neste estudo (injeções simuladas, 238; Lucentis® 0,3 mg, 238; Lucentis® 0,5 mg, 240).
Nos 24 meses do estudo FVF2587g (ANCHOR)2, pacientes com lesões10 NVC predominantemente clássicas receberam: 1) injeções intravítreas mensais de Lucentis® 0,3 mg e terapia fotodinâmica (TFD) simulada; 2) injeções intravítreas mensais de Lucentis® 0,5 mg e TFD simulada; ou 3) injeções intravítreas simuladas e TFD ativa com verteporfina. TFD com verteporfina ou simulada foi aplicada com a injeção1 inicial de Lucentis® (ou simulada) e a cada 3 meses se a angiografia11 com fluoresceína mostrasse persistência ou recorrência12 de vazamento vascular13. Um total de 423 pacientes foram incluídos nesse estudo (Lucentis® 0,3 mg, 140; Lucentis® 0,5 mg, 140; TFD com verteporfina,143).
*O procedimento controle de injeção1 simulada de Lucentis® envolve a anestesia14 do olho15 de forma idêntica à injeção1 intravítrea de Lucentis®. A ponta de uma seringa16 sem agulha é então pressionada contra a conjuntiva17 e o êmbolo18 da seringa16 sem agulha é empurrado.
Os principais resultados estão resumidos nas Tabelas 1 e 2 e na Figura 1.
Tabela 1. Resultados no mês 12 e no mês 24 no estudo FVF2598g (MARINA)
|
Medida do resultado |
Mês |
Injeção1 simulada (n = 238) |
Lucentis® 0,5 mg |
|
Perda de < 15 letras na acuidade visual19 (%)a (Manutenção da visão20) |
Mês 12 |
62% |
95% |
|
Mês 24 |
53% |
90% |
|
|
Ganho de ≥ 15 letras na acuidade visual19 (%)a |
Mês 12 |
5% |
34% |
|
Mês 24 |
4% |
33% |
|
|
Alteração média na acuidade visual19 (letras) (DP)a |
Mês 12 |
-10,5 (16,6) |
+7,2 (14,4) |
|
Mês 24 |
-14,9 (18,7) |
+6,6 (16,5) |
ap < 0,01
Tabela 2. Resultados nos meses 12 e 24 no estudo FVF2587g (ANCHOR)
|
Medida do resultado |
Mês |
TFD verteporfina (n = 143) |
Lucentis® 0,5 mg |
|
Perda de < 15 letras na acuidade visual19 (%)a (Manutenção da visão20) |
Mês 12 |
64% |
96% |
|
Mês 24 |
66% |
90% |
|
|
Ganho de ≥ 15 letras na acuidade visual19 (%)a |
Mês 12 |
6% |
40% |
|
Mês 24 |
6% |
41% |
|
|
Alteração média na acuidade visual19 (letras) (DP)a |
Mês 12 |
-9,5 (16,4) |
+11,3 (14,6) |
|
Mês 24 |
-9,8 (17,6) |
+10,7 (16,5) |
ap < 0,01
Figura 1. Alteração média na acuidade visual19 a partir do início até o mês 24 no estudo FVF2598g (MARINA) e no estudo FVF2587g (ANCHOR): população ITT
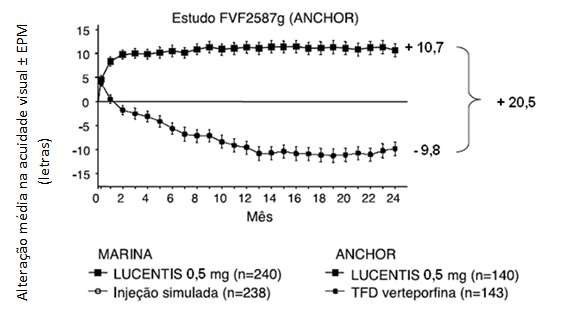
Pacientes no grupo tratado com Lucentis® tiveram, em média, crescimento observável mínimo da lesão21 NVC. No mês 12 a alteração média na área total da lesão21 NVC foi de 0,1 a 0,3 AD para o Lucentis® versus 2,3 a 2,6 AD para os braços controle5.
Os resultados de ambos estudos indicaram que o tratamento continuado com ranibizumabe pode ser um benefício também em pacientes que perderam ≥ 15 letras da melhor acuidade visual19 corrigida (MAVC) no primeiro ano de tratamento7.
Em ambos os estudos MARINA e ANCHOR, a melhora na acuidade visual19 observada com Lucentis® 0,5 mg em 12 meses foi acompanhada por benefícios relatados por pacientes, medidos pelas pontuações do Questionário de Função Visual do Instituto Nacional do Olho15 (VFQ-25). As diferenças entre Lucentis® 0,5 mg e os dois grupos controle foram avaliadas com valores “p” variando de 0,009 a < 0,0001 5,6.
– Estudo FVF3192g (PIER)
O estudo FVF3192g (PIER)4,8 foi um estudo de dois anos, controlado com injeções simuladas, duplo-mascarado, randomizado22 desenhado para avaliar a segurança e a eficácia de Lucentis® em 184 pacientes com DMRI neovascular (com ou sem componente clássico de NVC). Os pacientes receberam injeções intravítreas de Lucentis® 0,3 mg ou 0,5 mg ou injeções simuladas uma vez ao mês por 3 doses consecutivas, seguidas por uma dose administrada uma vez a cada 3 meses. A partir do mês 14 do estudo, os pacientes tratados com injeções simuladas foram realocados para começar a receber ranibizumabe e a partir do mês 19, tratamentos mais frequentes foram possíveis. Pacientes tratados com Lucentis® no PIER receberam uma média de 10 tratamentos durante o estudo 5,8.
O indicador primário de eficácia foi a alteração média na acuidade visual19 no mês 12 comparado com o início. Em média, após um aumento inicial na acuidade visual19 (seguida de doses mensais), pacientes que receberam uma dose a cada três meses com Lucentis® perderam acuidade visual19, retornando ao basal no mês 12 e este efeito foi mantido na maioria dos pacientes tratados com Lucentis® (82%) no mês 24. Dados de um número limitado de indivíduos que foram realocados para receber ranibizumabe após mais de um ano de tratamento com injeções simuladas sugerem que o início precoce do tratamento pode estar associado a uma melhor preservação da acuidade visual19 5,8.
– Estudo FVF3689g(SAILOR)
O estudo FVF3689g (SAILOR)9 foi um estudo multicêntrico de um ano, fase IIIb, simples mascarado, em pacientes não tratados e tratados previamente com neovascularização8 de coroide23 secundária à DMRI. O objetivo primário do estudo foi estimar a incidência24 de reações adversas sérias oculares e não oculares em pacientes tratados por 12 meses. No geral, 2.378 pacientes foram randomizados em uma proporção de 1:1 para receber uma injeção1 intravítrea com 0,3 mg ou 0,5 mg de ranibizumabe todo mês, por três meses consecutivos seguidos por um retratamento se necessário, não mais que uma vez por mês.
Em resumo, nenhum desequilíbrio entre os dois grupos de dose foi observado na frequência de reações adversas oculares e não oculares. Houve uma tendência estatisticamente não significativa em relação a maiores taxas de acidente vascular cerebral25 no grupo de 0,5 mg comparado ao grupo de 0,3 mg. Os respectivos 95% dos ICs para a taxa de acidente vascular cerebral25 total foram amplos (0,3% para 1,3% para o grupo de 0,3 mg vs 0,7% para 2,0% para o grupo de 0,5 mg). O número de acidentes vasculares26 cerebrais foi pequeno em ambos os grupos de doses, e não há evidências suficientes para concluir (ou excluir) que existe uma diferença real nas taxas de acidente vascular cerebral25 entre os dois grupos de tratamento9. A diferença das taxas de acidente vascular cerebral25 pode ser maior em pacientes com fator de risco27 conhecido para acidente vascular cerebral25, incluindo histórico anterior de acidente vascular cerebral25 ou ataque isquêmicotransitório10.
Tratamento de deficiência visual devido ao EMD
A eficácia e segurança do Lucentis® foram avaliadas em dois estudos randomizados, duplo-mascarados, controlado por simulado ou ativo com duração de 12 meses em pacientes com deficiência visual devido a edema macular5 diabético (Estudos D2301 (RESTORE) e D2201 (RESOLVE)). Um total de 496 pacientes (336 ativos e 160 controle) foram incluídos nestes estudos, a maioria tinha diabetes28 tipo II, 28 pacientes tratados com ranibizumabe tinham diabetes28 tipo I.
– Estudo D2301 (RESTORE)
No estudo D2301 (RESTORE)11,12,13, um total de 345 pacientes com deficiência visual devido ao edema macular5 foram randomizados para receber ou injeção1 intravítrea inicial de ranibizumabe 0,5 mg como monoterapia e fotocoagulação a laser simulada (n = 116), ou ranibizumabe 0,5 mg e fotocoagulação a laser combinados (n = 118), ou injeção1 simulada e fotocoagulação a laser (n = 111). O tratamento com ranibizumabe foi iniciado com injeções intravítreas mensais e continuado até que a acuidade visual19 estivesse estável por pelo menos três avaliações mensais consecutivas. O tratamento foi reiniciado, quando houve uma redução da MAVC, devido à progressão do EMD. A fotocoagulação a laser foi aplicada no início no mesmo dia, pelo menos 30 minutos antes da injeção1 de ranibizumabe e, em seguida, conforme necessário com base em critérios do Estudo de Tratamento Precoce de Retinopatia Diabética6 (ETDRS).
Os principais resultados estão resumidos na Tabela 3 e na Figura 2.
Tabela 3. Resultados no mês 12 do estudo D2301 (RESTORE)
|
Medida do resultado |
ranibizumabe 0,5 mg |
ranibizumabe 0,5 mg + Laser |
Laser |
|
Variação média na MAVC do mês 1 ao mês 12 em relação ao valor basal (letras) (DP)b |
+6,1 (6,43) |
+5,9 (7,92) |
+0,8 (8,56) |
|
Alteração média na MAVC no mês 12 em relação ao valor basal (letras) (DP) |
+6,8 (8,25)b |
+6,4 (11,77)c |
+0,9 (11,44) |
|
Ganho de ≥ 10 letras na MAVC (% dos pacientes) no mês 12 |
37,4d |
43,2b |
15,5 |
|
Ganho de ≥ 15 letras na MAVC (% dos pacientes) no mês 12 |
22,6e |
22,9f |
8,2 |
bp < 0,0001, cp = 0,0004, dp = 0,0001, ep = 0,0032, fp = 0,0021
Figura 2. Variação média da MAVC do basal ao longo do tempo no estudo D2301 (RESTORE)
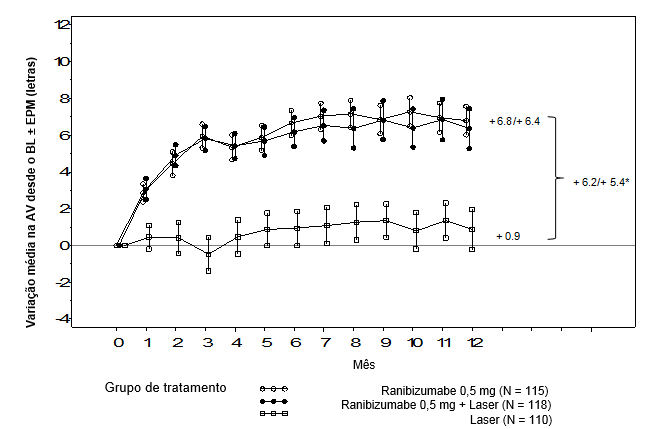
BL = linha de base; EPM = erro padrão da média
– Estudo D2301E1 (Extensão do RESTORE)
O estudo de extensão D2301E1 (Extensão do RESTORE)14 foi um estudo aberto, multicêntrico, de 24 meses de extensão. Duzentos e quarenta (240) pacientes que completaram o estudo principal de 12 meses entraram no estudo de extensão e foram tratados com ranibizumabe 0,5 mg pro re nata (PRN) no mesmo olho15 que foi selecionado como o olho15 do estudo no estudo principal. O tratamento foi administrado mensalmente devido a uma redução de acuidade visual19 por EMD até que a MAVC tenha se mantido estável. Além disso, o tratamento a laser foi administrado, se considerado necessário pelo investigador, e com base nas diretrizes do ETDRS.
Em média, 6,4 injeções de ranibizumabe foram administradas por paciente no período de extensão de 24 meses empacientes que foram tratados com ranibizumabe no estudo principal. Dos 74 pacientes do estudo principal de tratamento a laser, 59 (79%) dos pacientes receberam ranibizumabe, em algum momento durante a fase de extensão. Em média, esses 59 pacientes receberam 8,1 injeções de ranibizumabe por paciente ao longo dos 24 meses do estudo de extensão. As proporções de pacientes que não necessitaram de qualquer tratamento de ranibizumabe durante a fase de extensão foram 19%, 25% e 20% antes de ranibizumabe, antes de ranibizumabe + laser, e antes do grupo de laser, respectivamente. As principais medidas do desfecho estão resumidas na Tabela 4.
Tabela 4. Desfechos no mês 36 no estudo D2301E1 (Extensão do RESTORE)
|
Medida do desfecho comparada ao basal principal |
ranibizumabe prévio 0,5 mg |
ranibizumabe prévio 0,5 mg + laser |
laser prévio |
|
Variação média na MAVC em relação ao basal no estudo principal no mês 36 (DP) |
+8,0 (10,09) |
+6,7 (9,59) |
+6,0 (9,35) |
|
Ganho de ≥ 10 letras em relação ao basal principal ou MAVC ≥ 84 (%) no mês 36 |
39 (47,0) |
37 (44,6) |
31 (41,9) |
|
Ganho de ≥ 15 letras em relação ao basal principal ou MAVC ≥ 84 (%) no mês 36 |
23 (27,7) |
25 (30,1) |
16 (21,6) |
n O número de pacientes com um valor tanto no basal principal (mês 0) quanto na visita do mês 36.
* Dos 74 pacientes com tratamento anterior a laser, 59 (79%) dos pacientes receberam ranibizumabe no estudo de extensão.
Pontuações VFQ-25 em pacientes que foram previamente tratados com ranibizumabe PRN no estudo principal estabilizaram-se durante a fase de extensão. Aqueles tratados com laser no grupo controle do estudo principal, e que então trocaram o tratamento para ranibizumabe PRN na fase de extensão, demonstraram uma melhoria nas pontuações VFQ-25. O perfil de segurança a longo prazo de ranibizumabe observado neste estudo de extensão de 24 meses é consistente com o perfil de segurança conhecido de Lucentis®.
– Estudo D2201 (RESOLVE)
No estudo D2201 (RESOLVE)15,11,13, um total de 151 pacientes com acometimento macular central causando deficiência visual foram tratados com ranibizumabe (6 mg/mL, n = 51, 10 mg/mL, n = 51) ou injeção1 simulada (n = 49); por injeções intravítreas mensais até que os critérios pré-definidos de parada do tratamento fossem atingidos. A dose inicial de ranibizumabe (0,3 mg ou 0,5 mg) poderia ser dobrada em qualquer momento durante o estudo após a primeira injeção1 se o pesquisador avaliasse que a resposta ao tratamento não foi suficientemente alcançada. O tratamento de resgate com fotocoagulação a laser foi autorizado a partir do mês 3 em ambos os braços de tratamento. O estudo foi composto de duas partes: uma parte exploratória (os primeiros 42 pacientes analisados no mês 6) e uma parte de confirmação (os restantes 109 pacientes analisados no mês 12). Os principais resultados da parte de confirmação do estudo (2/3 dos pacientes) estão resumidos na Tabela 5 e na Figura 3.
Tabela 5. Resultados do mês 12 no estudo D2201 (RESOLVE) (população total do estudo)
|
Medida do resultado |
ranibizumabe agrupado |
Placebo29 |
|
Variação média da MAVC do mês 1 ao mês 12 em relação ao valor basal (letras)b |
+7,8 (7,72) |
-0,1 (9,77) |
|
Variação média da MAVC no mês 12 em relação ao valor basal (letras) (DP)b |
+10,3 (9,14) |
-1,4 (14,16) |
|
Ganho de ≥ 10 letras de MAVC (%dos pacientes) no mês 12b |
60,8 |
18,4 |
|
Ganho de ≥ 15 letras de MAVC (%dos pacientes) no mês 12g |
32,4 |
10,2 |
bp < 0,0001, gp = 0,0043
Figura 3. Variação média da acuidade visual19 a partir do basal ao longo do tempo no estudo D2201 (RESOLVE) (população total)
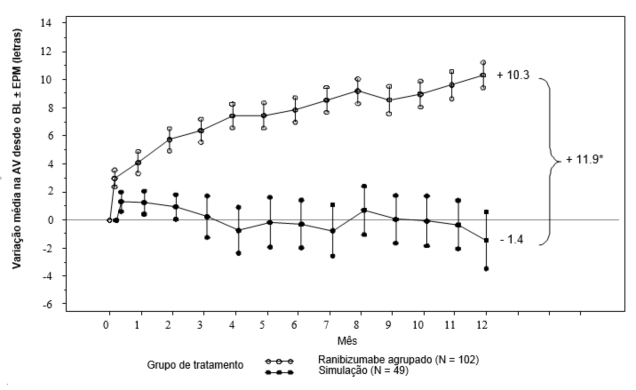
BL = Linha de base; EPM = erro padrão da média
Os pacientes tratados com ranibizumabe apresentaram uma redução contínua na espessura central da retina7 (do inglês: central retinal tickness ou CRT). Em 12 meses, a variação média da CRT comparado ao basal foi de - 194 micrômetros para o ranibizumabe versus - 48 micrômetros para o placebo29.
Globalmente, os resultados de segurança ocular e não ocular em pacientes com EMD de ambos estudos D2201 e D2301 foram comparáveis com o perfil de segurança conhecido previamente observado em pacientes com a forma neovascular da DMRI16.
– Estudo D2304 (RETAIN)
No estudo D2304 fase IIIb (RETAIN)17, 18, 19, 20, 372 pacientes comdeficiência visual devido ao EMD foram randomizados para receber injeção1 intravítrea de:
- ranibizumabe 0,5 mg com concomitante fotocoagulação a laser em um regime tratar e estender (do inglês: treat-and-extend ou TE) (n = 121);
- monoterapia com ranibizumabe 0,5 mg em regime TE (n = 128); ou
- monoterapia com ranibizumabe 0,5 mg em regime pro re nata (PRN) (n = 123).
Em todos os grupos, o tratamento com ranibizumabe foi iniciado com injeções intravítreas mensais e continuou até que a MAVC ficasse estável por pelo menos três avaliações mensais e consecutivas. A fotocoagulação a laser foi administrada no início, no mesmo dia da primeira injeção1 de ranibizumabe, e depois, se necessária com base em critérios de ETDRS. No regime TE, ranibizumabe foi então administrado pelo tratamento programado em intervalos de 2–3 meses. Em regime PRN, a MAVC foi avaliada mensalmente e o ranibizumabe foi administrado em seguida, durante a mesma visita, se necessário. Em todos os grupos, o tratamento mensal foi reiniciado após a diminuição da MAVC devido à progressão do EMD e continuou até que a MAVC ficasse estável novamente. A duração do estudo foi de 24 meses.
No estudo RETAIN o número de visitas de tratamento programados necessárias pelo regime TE foi 40% menor do que o número de visitas mensais exigidas pelo regime PRN. Em ambos os regimes, mais de 70% dos pacientes foram capazes de manter a MAVC com uma frequência de visita de ≥ 2 meses.
As principais medidas do resultado estão resumidas na Tabela 6.
Tabela 6. Resultados do estudo D 2304 (RETAIN)
|
Medida do resultado comparada ao inicial |
TE ranibizumabe 0,5 mg + laser |
TE ranibizumabe 0,5 mg |
PRN ranibizumabe 0,5 mg |
|
Alterações na variação média na MAVC do mês 1 ao mês 12 (DP) |
+5,9 (5,5)b |
+6,1 (5,7)b |
+6,2 (6,0) |
|
Alterações na variação média na MAVC do mês 1 ao mês 24 (DP) |
+6,8 (6,0) |
+6,6 (7,1) |
+7,0 (6,4) |
|
Alteração média na MAVC no mês 24 (DP) |
+8,3 (8,1) |
+6,5 (10,9) |
+8,1 (8,5) |
|
Ganho de ≥ 10 letras ou MAVC ≥ 84 (%) no |
43,6 |
40,8 |
45,3 |
|
Ganho de ≥ 15 letras ou MAVC ≥ 84 (%) no mês 24 |
25,6 |
28,0 |
30,8 |
bp < 0,0001
Em estudos de EMD, a melhora da MAVC foi acompanhada por uma redução ao longo do tempo da CRT média em todos os grupos de tratamento.
Não houve diferença nos resultados da MAVC ou da CRT dos pacientes no estudo RETAIN que receberam ou não tiazolidinedionas concomitantes.
– Estudo D2303 (REVEAL)
O estudo D2303 (REVEAL)31,32 foi um estudo clínico de 12 meses, randomizado22, duplo-cego de fase IIIb, conduzido em pacientes asiáticos. Semelhante ao estudo RESTORE de 12 meses em relação ao desenho do estudo clínico e aos critérios de inclusão/exclusão, 390 pacientes com deficiência visual devido ao edema macular5 foram randomizados para receber ou injeção1 de ranibizumabe 0,5 mg como monoterapia e fotocoagulação a laser de simulada (n = 133), ou injeção1 de ranibizumabe 0,5 mg e fotocoagulação a laser (n = 129), ou injeção1 simulada e fotocoagulação a laser (n = 128). A alteração média na acuidade visual19 no mês 12 em relação à linha de base foi de + 6,6 letras no grupo da monoterapia de ranibizumabe, + 6,4 letras no grupo do ranibizumabe mais laser e + 1,8 letras no grupo do laser. No geral, os resultados de eficácia e segurança do estudo REVEAL em pacientes asiáticos com EMD são consistentes com os do estudo RESTORE em pacientes caucasianos comEMD.
Tratamento de retinopatia diabética6 proliferativa (RDP)
A segurança clínica e a eficácia de Lucentis em pacientes com retinopatia diabética6 proliferativa (RDP) foram abordadas no Protocolo S, que avaliou o tratamento com injeções intravítreas de ranibizumabe 0,5 mg, em comparação com panfotocoagulação (PRP). O desfecho primário foi a alteração da acuidade visual19 média no ano 2. Adicionalmente, mudança na gravidade da retinopatia diabética6 foi avaliada com base em fotografias de fundo de olho30 utilizando o score de gravidade de retinopatia diabética6 (DRSS).
O Protocolo S foi um estudo de Fase 3 multicêntrico, randomizado22, com controle ativo, de atribuição paralela e de não inferioridade que incluiu 305 pacientes (394 olhos31 estudados) com RDP com ou sem EMD no início do estudo e comparou injeções intravítreas de ranibizumabe 0,5 mg ao tratamento padrão com a PRP. Um total de 191 olhos31 (48,5%) foram randomizados para ranibizumabe 0,5 mg e 203 olhos31 (51,5%) foram randomizados para PRP. Um total de 88 olhos31 (22,3%) tinham EMD no início do estudo: 42 (22,0%) e 46 (22,7%) olhos31 nos grupos ranibizumabe e PRP, respectivamente.
Neste estudo, a alteração média da acuidade visual19 no ano 2 foi de +2,7 letras no grupo ranibizumabe, em comparação com 0,7 letras no grupo PRP. A diferença nas médias dos mínimos quadrados foi de 3,5 letras (IC 95%: [0,2 a 6,7]).
No ano 1, 41,8% dos olhos31 apresentaram melhora de ≥2 estágios da DRSS quando tratados com ranibizumabe (n = 189) em comparação com 14,6% dos olhos31 tratados com PRP (n = 199). A diferença estimada entre o ranibizumabe e o laser foi de 27,4% (IC 95%:[18.9, 35.9]).).
Tabela 7. Melhora ou agravamento no DRSS ≥ 2 ou ≥ 3 estágios no ano 1 no Protocolo S (Método LOCF)
|
Mudança categorizada da linha de base |
Protocolo S |
||
|
Ranibizumabe 0.5 mg (N=189) |
PRP (N=199) |
Diferença na proporção (%), CI |
|
|
≥ 2-estágios melhoria |
79 (41.8%) |
29 (14.6%) |
27.4 (18.9, 35.9%) |
|
≥ 3-estágios melhoria |
54 (28.6%) |
6 (3.0%) |
25.7 (18.9, 32.6%) |
|
≥ 2-estágios piora |
3 (1.6%) |
23 (11.6%) |
-9.9 (-14.7, -5.2%) |
|
≥ 3-estágios piora |
1 (0.5%) |
8 (4.0%) |
-3.4 (-6.3, -0.5%) |
DRSS = escore de gravidade da retinopatia diabética6, n = número de pacientes que satisfizeram a condição na consulta, N = número total de olhos31 do estudo.
No ano 1 no grupo tratado com ranibizumabe no Protocolo S, a melhora ≥2 estágios no DRSS foi consistente tanto nos olhos31 sem EMD no momento basal (39,9%) quanto nos com EMD no momento basal (48,8%).
Uma análise de dados de 2 anos do Protocolo S demonstrou que 42,3% (n=80) dos olhos31 no grupo tratado com ranibizumabe apresentaram uma melhoria de ≥ 2 estágios no DRSS em relação aos valores iniciais, em comparação com 23,1%(n=46) dos olhos31 no grupo de PRP. No grupo tratado com ranibizumabe, observou-se uma melhora ≥ 2 estágios no DRSS desde o início do estudo em 58,5% (n=24) dos olhos31 com EMD na baseline e 37,8% (n=56) olhos31 sem EMD na baseline.
O score de gravidade da retinopatia diabética6 (DRSS) também foi avaliado em três estudos fase III separados de EMD (ranibizumabe 0,5 mg PRN vs laser) ativos controlados que incluíram um total de 875 pacientes, dos quais aproximadamente 75% eram de origem asiática. Em uma meta-análise desses estudos, 48,4% dos 315 pacientes com score DRSS graduáveis no subgrupo de pacientes com retinopatia diabética6 não proliferativa moderadamente grave (RNDP) ou grave apresentaram no início do estudo uma melhora ≥ 2 etapas no DRSS no mês 12 quando tratados com ranibizumabe (n = 192) vs 14,6% dos pacientes tratados com laser (n = 123). A diferença estimada entre o ranibizumabe e o laser foi de 29,9% (IC95%: [20,0, 39,7]). Nos 405 pacientes de DRSS graduáveis com RDNP moderado ou melhor, foi observada uma melhora de ≥ 2 etapas na DRSS em 1,4% e 0,9% dos grupos ranibizumabe e laser, respectivamente.
Tratamento da deficiência visual devido ao edema macular5 secundário à OVR21, 22, 23, 24
– Estudo FVF4165g (BRAVO) e estudo FVF4166g (CRUISE)
A segurança e eficácia clínica de Lucentis® em pacientes com deficiência visual devido ao edema macular5 secundário à OVR foram avaliadas nos estudos randomizados, duplo-cego, controlados, BRAVO e CRUISE que recrutaram pacientes com ORVR (n = 397) e OVCR (n = 392), respectivamente. Nos dois estudos, os pacientes receberam injeções intravítreas de ranibizumabe 0,3 mg ou 0,5 mg ou injeção1 simulada. Após 6 meses, os pacientes no braço controle com injeção1 simulada foram passados para ranibizumabe 0,5 mg. No estudo BRAVO, a fotocoagulação a laser como tratamento de resgate foi permitida em todos os braços a partir do 3º mês.
Resultados positivos dos estudos BRAVO e CRUISE estão resumidos nas Tabelas 8 e 9 e nas Figuras 4 e 5.
Tabela 8. Resultados no Mês 6 e 12 (BRAVO)
|
|
Simulação/Lucentis® 0,5 mg |
Lucentis® 0,5 mg |
|
Alteração média na acuidade visual19 da linha de base ao mês 6b (letras) (desfecho primário) |
+7,3 |
+18,3 |
|
Alteração média na acuidade visual19 da linha de base ao mês 12 (letras) |
+12,1 |
+18,3 |
|
Proporção de pacientes que ganharam ≥ 15 letras na MAVC da linha de base ao mês 6b |
28,8% |
61,1% |
|
Proporção de pacientes que ganharam ≥ 15 letras na MAVC da linha de base ao mês 12 |
43,9% |
60,3% |
|
Proporção de pacientes que receberam laser alternativo acima de 12 meses |
61,4% |
34,4% |
bp < 0,0001
Figura 4. Alteração média dos valores basais de MAVC ao longo do tempo até o mês 6 e o mês 12 (BRAVO)
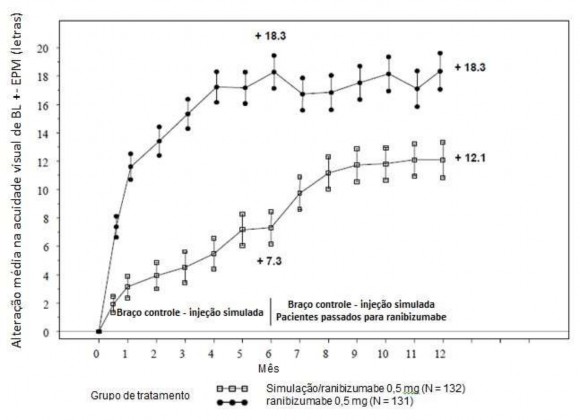
BL= linha de base; EPM = erro padrão da média
Tabela 9. Resultados do mês 6 e 12 (CRUISE)
|
|
Simulação/ Lucentis® 0,5 |
Lucentis® 0,5 mg |
|
Alteração média na acuidade visual19 da linha de base ao mês 6b (letras) |
+0,8 |
+14,9 |
|
Alteração média na acuidade visual19 da linha de base ao mês 12 (letras) |
+7,3 |
+13,9 |
|
Proporção de pacientes que ganharam ≥ 15 letras na MAVC da linha de base ao mês 6b |
16,9% |
47,7% |
|
Proporção de pacientes que ganharam ≥ 15 letras na MAVC da linha de base ao mês 12 |
33,1% |
50,8% |
bp < 0,0001
Figura 5. Alteração média dos valores basais de MAVC ao longo do tempo até o mês 6 e mês 12 (CRUISE)
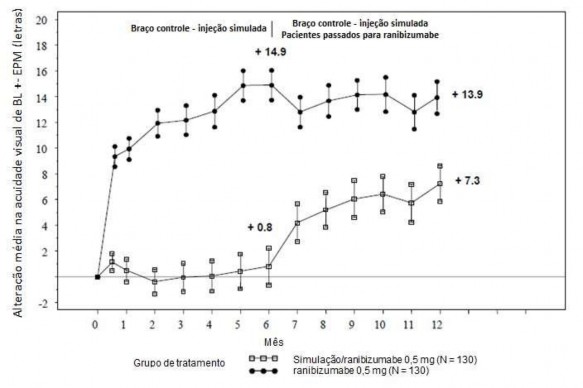
BL= linha de base; EPM = erro padrão da média
Em ambos os estudos, a melhora da visão20 foi acompanhada por uma diminuição contínua no edema macular5 medida pela espessura central da retina7.
A melhora da acuidade visual19 com o tratamento com ranibizumabe nos meses 6 e 12, foi acompanhada de benefícios relatados pelo paciente, medidos pelas subescalas do Questionário do Instituto Nacional do Olho15 e Função Visual (VFQ-25), subescalas relacionadas às atividades para longe e perto, um desfecho de eficácia secundário pré-especificado. A diferença entre Lucentis® 0,5 mg e o grupo controle foi avaliada no Mês 6, com valores de p de 0,02 a 0,0002.
– Estudo E2401 (CRYSTAL) e estudo E2402 (BRIGHTER)33,34,35
A segurança e eficácia clínica a longo prazo (24 meses) de Lucentis® em pacientes com deficiência visual devido ao edema macular5 secundário à OVR foram avaliadas nos estudos BRIGHTER e CRYSTAL, os quais recrutaram indivíduos com ORVR (n = 455) e OVCR (n = 357), respectivamente. Em ambos os estudos, os pacientes receberam um regime de dose de ranibizumabe 0,5 mg PRN, direcionado por critérios de estabilização individualizados. O BRIGHTER foi um estudo de três braços, randomizado22, controlado ativamente, que comparou ranibizumabe 0,5 mg administrado como monoterapia ou em combinação com fotocoagulação a laser adjuvante, com a fotocoagulação a laser isolada. Após 6 meses, os indivíduos do braço da monoterapia a laser receberam ranibizumabe 0,5 mg. O CRYSTAL foi um estudo de braço único32 com ranibizumabe 0,5 mg como monoterapia.
As medidas dos resultados-chave dos estudos BRIGHTER e CRYSTAL são apresentadas na Tabela 10 e nas Figuras 6 e 7.
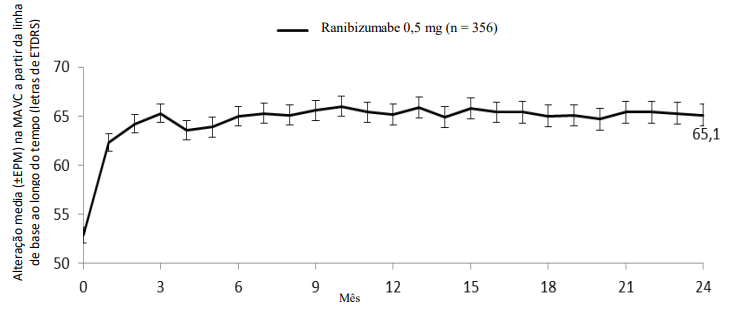
Tabela 10. Resultados do Mês 6 (BRIGHTER) e Mês 24 (BRIGHTER e CRYSTAL)
|
|
BRIGHTER |
CRYSTAL |
||
|
|
Lucentis® 0,5 mg |
Lucentis® 0,5 mg + Laser |
Laser* |
Lucentis® 0,5 mg |
|
Alteração média na MAVC no Mês 6b (letras) (DP) |
+14,8 |
+14,8 |
+6,0 |
+12,0 |
|
Alteração média na MAVC no Mês 24b (letras) (DP) |
+15,5 |
+17,3 |
+11,6 |
+12,1 |
|
Proporção de pacientes que ganharam ≥ 15 letras na MAVC no Mês 24 |
52,8 % |
59,6 % |
43,3 % |
49,2 % |
|
Número médio de injeções (DP) (Meses 0–23) |
11,4 |
11,3 |
NA |
13,1 |
*O tratamento com ranibizumabe 0,5 mg foi permitido a partir do Mês 6 (24 pacientes foram tratados apenas com laser).
b: p < 0,0001 para ambos os comparadores em BRIGHTER no Mês 6: Lucentis® 0,5 mg vs Laser e Lucentis® 0,5 mg + Laser vs Laser.
bp < 0,0001 para hipótese nula em CRYSTAL, na qual a alteração média no Mês 24 a partir da linha de base é zero.
Figura 6. BRIGHTER: Alteração média da MAVC da linha de base até 24 meses
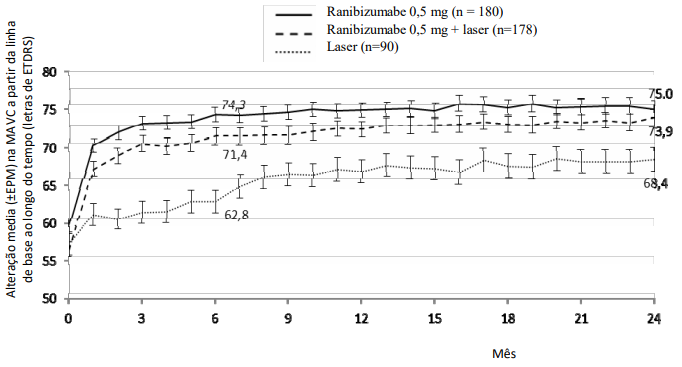
Figura 7. CRYSTAL: Alteração média da MAVC da linha de base até 24 meses
 |
No BRIGHTER, o tratamento com ranibizumabe 0,5 mg e terapia a laser adjuvante demonstrou não inferioridade em relação à ranibizumabe como monoterapia desde a linha de base até o Mês 24, como avaliado pela alteração média da MAVC. Não houve diferença entre os dois grupos no número de injeções de ranibizumabe administradas durante este período.
Em ambos os estudos, uma redução rápida e significativa na espessura do subcampo da retina7 central versus a linha de base,foi observada no Mês 1. Este efeito foi mantido até o Mês 24.
O efeito benéfico do tratamento com ranibizumabe foi semelhante, independente da presença de isquemia33 retiniana. No BRIGHTER, pacientes com presença (n = 87) ou ausência (n = 35) de isquemia33 retiniana, e tratados com ranibizumabe como monoterapia, apresentaram uma alteração média a partir da linha de base de +15,4 e +12,9 letras, respectivamente, no mês 24. No CRYSTAL, pacientes com presença (n = 107) ou ausência (n = 109) de isquemia33 retiniana, tratados com ranibizumabe como monoterapia, apresentaram alteração média a partir da linha de base de +11,1 e +12,9 letras, respectivamente.
O efeito benéfico em termos de melhora visual foi observado em todos os pacientes tratados com ranibizumabe 0,5 mg como monoterapia, independentemente da duração da doença em ambos os estudos BRIGHTER e CRYSTAL. Em pacientes com duração da doença < 3 meses, um aumento na acuidade visual19 de 13,3 e 10,0 letras foi visto no Mês 1; e 17,7 e 13,2 letras no Mês 24 em BRIGHTER e CRYSTAL, respectivamente. O início do tratamento no momento do diagnóstico34 deve ser considerado.
O perfil de segurança a longo prazo de ranibizumabe, observado nestes estudos de 24 meses, é consistente com o perfil de segurança conhecido de Lucentis®.
Tratamento do comprometimento visual devido à NVC
A partir do Mês 2, todos os pacientes receberam tratamento aberto com ranibizumabe, conforme necessário. O desfecho primário foi avaliado pela melhor alteração na acuidade visual19 corrigida (MAVC) desde o início até o Mês 2.
Os resultados principais do MINERVA estão resumidos na Tabela 11 e 12 e Figura 8.
Tabela 11. Resultados no Mês 2 (MINERVA)
|
|
Ranibizumabe |
Injeção1 simulada |
|
Alteração média na MAVC no Mês 2 (letras) (Média dos mínimos quadrados)a |
+9,5 |
-0,4 |
|
Proporção de pacientes que ganharam ≥ 10 letras a partir da linha de base ou alcançaram 84 letras no Mês 2 |
42,4% |
14,0% |
|
Proporção de pacientes que ganharam ≥ 15 letras a partir da linha de base ou atingiram 84 letras no Mês 2 |
31,4% |
12,3% |
|
Redução na ESCC a partir da linha de base até o Mês 2(Média dos mínimos quadrados)a |
77 µm |
-9,8 µm |
ESCC = Espessura do subcampo central
a: Um lado p<0,001em comparação com controle simulado
Figura 8. Alteração média da MAVC da linha de base ao longo dos 12 meses (MINERVA)
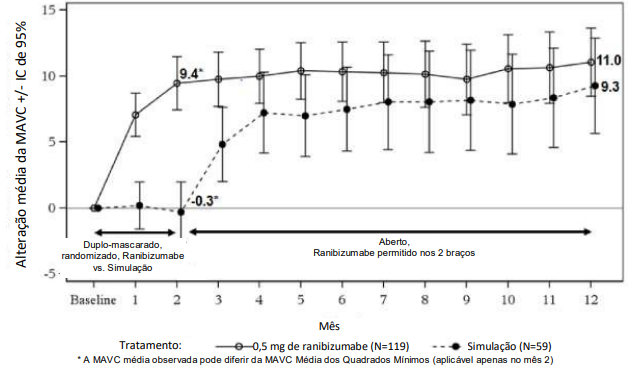
Tabela 12. Efeito do tratamento geral e efeito do tratamento entre os subgrupos de etiologias de base para a variável primária no Mês 2 (MINERVA)
|
Geral e por etiologias de base |
Efeito do tratamento em relação à simulação (letras) |
Número de pacientes |
|
Geral |
9,9 |
175* |
|
Estrias angioides |
14,6 |
27 |
|
Retinocoroidopatia pós-inflamatória |
6,5 |
27 |
|
Coriorretinopatia serosa central |
5,0 |
23 |
|
Coriorretinopatia idiopática35 |
11,4 |
62 |
|
Etiologia36 diversaa |
10,6 |
36 |
a Compreende etiologias de NVC que não se enquadram nos outros subgrupos
* Número de pacientes com dados disponíveis na análise
A melhora na visão20 foi acompanhada por uma redução na espessura do subcampo central durante o período de 12 meses. O número médio de injeções de ranibizumabe aplicadas no olho15 estudado ao longo de 12 meses foi de 5,8 no braço de ranibizumabe contra 5,4 no grupo de pacientes em simulação de ranibizumabe. No braço de simulação, 7 dos 59 pacientes não receberam nenhum tratamento com ranibizumabe no olho15 estudado durante o período de 12 meses.
Uma tendência nos benefícios relatados pelo paciente, como medida pela pontuação composta NEI VFQ-25, foi observada desde o início até o Mês 2 para os pacientes que recebem tratamento com ranibizumabe em relação ao grupo controle de simulação. Esta tendência manteve-se até ao Mês 12.
O tratamento de deficiência visual decorrente de NVC deve ser determinado individualmente por paciente, com base na atividade da doença. Alguns pacientes podem precisar de apenas uma injeção1 durante os primeiros 12 meses; outros podem precisar de uma frequência maior de tratamento, inclusive injeções mensais. Em relação a NVC decorrente de miopia37 patológica (MP), muitos pacientes podem precisar de apenas uma ou duas injeções durante o primeiro ano.
Pacientes pediátricos
Cinco pacientes adolescentes com idade entre 12 a 17 anos com comprometimento visual secundário à NVC receberam tratamento aberto com ranibizumabe 0,5 mg no início do estudo seguido por um regime de tratamento individualizado com base na evidência de atividade da doença (por exemplo, comprometimento de AV, fluido intra/sub-retinal, hemorragia38 ou extravasamento de fluido). A mudança na MAVC desde o início até o Mês 12 melhorou em todos os cinco pacientes, variando de 5 a 38 letras (média de 16,6 letras). A melhora na visão20 foi acompanhada por estabilização ou redução da espessura do subcampo central durante o período de 12 meses. O número médio de injeções de ranibizumabe aplicadas no olho15 estudado ao longo de 12 meses foi de três (vide “Posologia e Modo de Usar – Pacientes pediátricos”).
Tratamento do comprometimento visual devido à NVC secundária devido à Miopia37 Patológica 25, 26, 27, 28, 29, 30
– Estudo F2301(RADIANCE)
A segurança e a eficácia clínica de Lucentis® nos pacientes com comprometimento visual devido à NVC em MP foram avaliadas com base nos dados de 12 meses do estudo randomizado39, duplo-cego, estudo pivotal controlado F2301 (RADIANCE) que foi desenhado para avaliar dois regimes de doses diferentes de 0,5 mg de ranibizumabe recebido como injeção1 intravítrea, comparados à terapia fotodinâmica com verteporfina TFD (vTFD, terapia fotodinâmica com Visudyne®).
Os 277 pacientes foram randomizados para um dos seguintes braços:
– Estudo G2301 (MINERVA)36,37
A segurança e eficácia clínica de Lucentis® em pacientes com comprometimento visual devido à NVC secundária a outras etiologias que não DMRI e MP foram avaliadas com base nos dados de 12 meses do estudo pivotal randomizado22, duplo-cego, controlado com simulação G2301 (MINERVA). Devido às múltiplas etiologias de base envolvidas, cinco subgrupos (estrias angióides, retinocoroidopatia pós-inflamatória, coriorretinopatia serosa central, coriorretinopatia idiopática35 e etiologia36 diversa) foram pré-definidos para análise. Neste estudo, 178 pacientes foram randomizados em uma razão de 2:1 para um dos seguintes braços:
- ranibizumabe 0,5 mg no início do estudo, seguido por um regime de dose individualizado baseado na atividade da doença.
- injeção1 simulada no início do estudo seguido por um regime de tratamento individualizado baseado na atividade da doença.
- Grupo I (ranibizumabe 0,5 mg, regime de dose direcionado pelo critério de “estabilidade” definido como sem mudanças da MAVC, comparadas a duas avaliações mensais precedentes);
- Grupo II (ranibizumabe 0,5 mg, regime de dose direcionado pelo critério de “atividade da doença” definido como comprometimento visual atribuível do fluído intra-ou-sub-retiniano ou ao vazamento ativo devido à lesão21 NVC como avaliado pela OCT e/ou FA);
- Grupo III (vPDT – pacientes foram autorizados a receber tratamento com ranibizumabe por 3 meses).
Ao longo dos 12 meses de estudo os pacientes receberam em média, 4,6 injeções (variação 1-11) no Grupo I e 3,5 injeções (variação 1-12) no Grupo II. No Grupo II (em que os pacientes receberam o esquema de tratamento preconizado com base na atividade da doença, vide “Posologia e modo de usar”), 50,9% dos pacientes necessitaram de 1 ou 2 injeções, 34,5% necessitaram de 3 a 5 injeções e 14,7% necessitaram de 6 a 12 injeções durante o período de estudo de 12 meses. No Grupo II, 62,9% dos pacientes não necessitaram de injeções no segundo semestre do estudo.
Os principais resultados do estudo RADIANCE estão resumidos na Tabela 13 e na Figura 9.
Tabela 13. Resultados no 3° mês e no 12° mês (RADIANCE)
|
|
Grupo I ranibizumabe 0,5 mg “estabilidade da acuidade visual” |
Grupo II ranibizumabe 0,5 mg “atividade da doença” |
Grupo III vPDT* |
|
3° mês |
|||
|
Média MAVC alteração do 1° mês para 3° mês comparado ao basala (letras) |
+10,5 |
+10,6 |
+2,2 |
|
Proporção de pacientes que ganharam |
|||
|
≥ 10 letras ou alcançaram ≥ 84 letras em MAVC |
61,9% |
65,5% |
27,3% |
|
≥ 15 letras ou alcançaram ≥ 84 letras em MAVC |
38,1% |
43,1% |
14,5% |
|
12° mês |
|||
|
Número de injeções até o 12° mês: |
|||
|
Média |
4,6 |
3,5 |
NA |
|
Mediana |
4,0 |
2,0 |
NA |
|
Média MAVC alteração do 1° mês para 12° mês comparado ao basal (letras) |
+12,8 |
+12,5 |
NA |
|
Proporção de pacientes que ganharam |
|||
|
≥ 10 letras ou alcançaram ≥ 84 letras em MAVC |
69,5% |
69,0% |
NA |
|
≥ 15 letras ou alcançaram ≥ 84 letras em MAVC |
53,3% |
51,7% |
NA |
*Comparativo com controle até o 3° mês. Os pacientes randomizados para vPDT foram autorizados a receber tratamento com ranibizumabe a partir do 3° mês (no Grupo III, 38 pacientes receberam tratamento com ranibizumabe a partir do 3° mês adiante).
hp < 0,00001 comparado com vPDT controle
Figura 9. Alteração média da MAVC basal ao longo do tempo até 12 meses (RADIANCE)
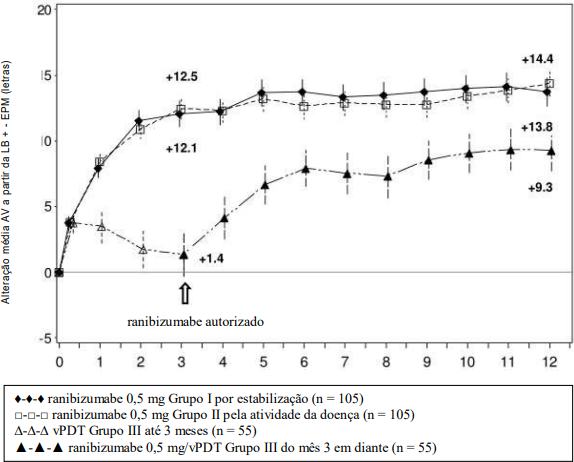
BL= linha de base
EPM = erro padrão da média
Pacientes randomizados para vPDT foram autorizados a receber o tratamento com ranibizumabe a partir do 3 mês.
A melhora da visão20 foi acompanhada pela redução na espessura central da retina7.
Os benefícios relatados pelo paciente foram observados nos grupos que utilizaram ranibizumabe versus o grupo que usou o TFD (com p < 0,05), em relação à melhora dos escores compostos e em uma série de sub-escalas (visão20 geral, atividade próximas, saúde2 mental e dependência), no Questionário de Função Visual do Instituto Nacional dos Olhos31 (VFQ-25).
Tratamento da Retinopatia da Prematuridade em prematuros
– Estudo H2301 (RAINBOW)
A segurança clínica e a eficácia de Lucentis® 0,2 mg para o tratamento da RP em prematuros foram avaliadas com base nos dados de 6 meses do estudo de superioridade H2301 (RAINBOW), randomizado22, aberto, de 3 braços, de grupos paralelos, que foi desenvolvido para avaliar ranibizumabe 0,2 mg e 0,1 mg administrados como injeções intravítreas em comparação com a terapia a laser. Os pacientes elegíveis tiveram que ter um dos seguintes achados de retina7 em cada olho15:
- Zona I, doença em estágio 1+, 2+, 3 ou 3+; ou
- Zona II, doença em estágio 3+; ou
- Retinopatia da prematuridade agressiva posterior (RP-AP)
Neste estudo, 225 pacientes foram randomizados em uma proporção de 1:1:1 para receber ranibizumabe intravítreo 0,2 mg (n = 74), 0,1 mg (n = 77), ou terapia com laser (n = 74).
O sucesso do tratamento, medido pela ausência de RP ativa e ausência de desfechos estruturais desfavoráveis em ambos os olhos31 24 semanas após o primeiro estudo, foi maior com ranibizumabe 0,2 mg (80,0%) em comparação com a terapia a laser (66,2%). A diferença entre o ranibizumabe 0,2 mg e o laser foi clinicamente relevante com uma razão de probabilidade (OR) de 2,19 (intervalo de confiança de 95% (IC) [0,9932, 4,8235]). O desfecho primário não atingiu significância estatística (ver Tabela 14).
Tabela 14. Resultados da semana 24 (RAINBOW)
|
|
Sucesso de tratamento |
|
|
|
|
|
|
Tratamento |
n/M (%) |
95% IC |
Comparação |
Odds ratio (OR)a |
95% IC |
p-valor b |
|
Ranibizumabe 0,2 mg (N=74) |
56/70 (80,0) |
(0,6873, 0,8861) |
Ranibizumabe 0,2 mg vs Laser |
2,19 |
(0,9932, 4,8235) |
0,0254 |
|
Terapia com laser (N=74) |
45/68 (66,2) |
(0,5368, 0,7721) |
|
|
|
|
|
IC = intervalo de confiança, M = número total de pacientes com valor não ausente no desfecho primário de eficácia (incluindo valores imputados), n = número de pacientes com ausência de RP ativa e ausência de desfecho estrutural desfavorável em ambos os olhos31 24 semanas após o primeiro tratamento do estudo (incluindo valores imputados). Se um paciente morreu ou trocou o tratamento do estudo antes ou na semana 24, então o paciente foi considerado como tendo RP ativa e desfechos estruturais desfavoráveis na semana 24. a um odds ratio é calculado usando o teste de Cochran-Mantel-Haenszel com a Zona da RP no início do estudo (Zona I e II; por CRF) como fator do estrato. b p-valor para comparação par a par é unilateral. Para o desfecho primário, o nível de significância pré-especificado para o valor p unilateral foi de 0,025. |
||||||
A maioria dos pacientes tratados com ranibizumabe 0,2 mg (78,1%) recebeu uma injeção1 única por olho15. Dos pacientes restantes tratados com ranibizumabe 0,2 mg que receberam pelo menos um tratamento adicional em um ou ambos os olhos31, dois (2,7%) pacientes receberam dois tratamentos adicionais em um ou ambos os olhos31. Durante as 24 semanas de estudo, poucos pacientes de 0,2 mg de ranibizumabe mudaram para outra modalidade de tratamento devido à falta de resposta em comparação com o grupo de laser (14,9% vs 24,3%). Desfechos estruturais desfavoráveis foram menos frequentemente relatados para ranibizumabe 0,2 mg (1 paciente, 1,4%) em comparação com a terapia a laser (7 pacientes, 10,1%). Além disso, 75% dos pacientes obtiveram resolução de mais doença em 8 dias com ranibizumabe 0,2 mg comparado a 22,5 dias em pacientes tratados com laser.
Referências bibliográficas
- [Chung CY, Kim R (2005)] A Phase III, multicenter, randomized, double-masked, sham injection-controlled study of the efficacy and safety of rhufab v2 (ranibizumab) in subjects with minimally classic or occult subfoveal neovascular age-related macular degeneration (MARINA). Study report no CSR FVF2598g.
- [Sy JP, Schneider S, Damico L (2005)] A Phase III, multicenter, randomized, double masked, active treatment- controlled study of the efficacy and safety of rhufab v2 (ranibizumab) compared with verteporfin (Visudyne®) photodynamic therapy in subjects with predominantly classic subfoveal neovascular age-related macular degeneration (ANCHOR). Study report no CSR FVF2587g.
- [Chung CY, Kim R (2006)] A Phase III, multicenter, randomized, double-masked, sham injection-controlled study of the efficacy and safety of rhuFab v2 (ranibizumab) in subjects with minimally classic or occult subfoveal neovascular age-related macular degeneration (MARINA). Addendum to study report no CSR FVF2598g.
- [Yue H, Shams N (2006)] A Phase IIIb, Multicenter, Randomized, Double-Masked, Sham Injection–Controlled Study of the Efficacy and Safety of Ranibizumab in Subjects with Subfoveal Choroidal Neovascularization (CNV) with or without Classic CNV Secondary to Age-Related Macular Degeneration.
- Clinical Expert Statement in support of the Basic Prescribing Information (BPI) Update. Novartis Pharma AG. Basel, Switzerland. 01 Nov06.
- [Sy JP, Kotlovker D, Schneider S (2007)] A Phase III, multicenter, randomized, doublemasked, active treatment- controlled study of the efficacy and safety of rhufab v2 (ranibizumab) compared with verteporfin (Visudyne®) photodynamic therapy in subjects with predominantly classic subfoveal neovascular age-related macular degeneration (ANCHOR). Study report no CSR Addendum FVF2587g. 27 Mar 07.
- RFB002 (ranibizumab) Lucentis®. Response to follow-up measure 003.1 and 004. Novartis Pharma AG. Basel, Switzerland. 20 Sep 07.
- PIER 2-year Study Report - A phase IIIb, multicenter, randomized, double-masked, sham injection–controlled study of the efficacy and safety of ranibizumab in subjects with subfoveal choroidal neovascularization (CNV) with or without classic cnv secondary to age-related macular degeneration. Addendum Study FVF3192. 8-Mar-2007.
- [SAILOR Study report (2008)] A Phase IIIb, multicenter study to evaluate the safety and tolerability of ranibizumab in naïve and previously treated subjects with choroidal neovascularization (CNV) secondary to age-related macular degeneration (AMD) (SAILOR). Study report no CSR FVF3689. 24 Jun 08.
- Clinical Safety Statement in support of the Basic Prescribing Information (BPI) Amendment. Novartis Pharma AG. Basel, Switzerland. 16 Dec 08.
- 2.7.3 Summary of Clinical Efficacy in Diabetic Macular Edema40 (DME). – RFB002D. Novartis Pharma AG. Basel, Switzerland. 16 Jun 10.
- [RESTORE Study report (2010)] A randomized, double-masked, multicenter, laser-controlled Phase III study assessing the safety and efficacy of ranibizumab (intravitreal injections) as adjunctive and mono-therapy in patients with visual impairment due to diabetic macular edema40 (DME). 07 May10.
- 2.5 Clinical Overview in Diabetic Macular Edema40 (DME) – RFB002D. Novartis Pharma AG. Basel, Switzerland. 08 Jul 10.
- [RESTORE Extension study report (2012)] An open-label, multi-center, 24-month extension study to evaluate the safety of ranibizumab as symptomatic treatment for visual impairment due to diabetic macular edema40 in patients who have completed the RESTORE trial. Study CRFB002D2301E1 report. 19-Sep-2012.
- [RESOLVE Study report (2009)] A randomized, double-masked, multicenter, Phase II study assessing the safety and efficacy of two concentrations of ranibizumab (intravitreal injections) compared with non-treatment control for the treatment of diabetic macular edema40 (DME) with center involvement. 10 Sep 09.
- 2.7.4 Summary of Clinical Safety in Diabetic Macular Edema40 (DME) – RFB002D. Novartis Pharma AG. Basel, Switzerland. 06 Jul 10.
- 2.5 Clinical Overview – Rationale for changes to Core Data Sheet (CDS) / Product information – Posology update for the treatment of wet AMD, visual impairment due to DME or due to macular edema40 secondary to RVO, visual impairment due to CNV secondary to PM; addition of results from study RESTORE Extension and from study RETAIN. Novartis. 19-Mar-2014.
- RETAIN study report (2014)]. A 2-year randomized, single-masked, multicenter, controlled phase IIIb trial assessing the efficacy and safety of 0.5 mg ranibizumab in two “treat and extend” treatment algorithms vs. 0.5 mg ranibizumab as needed in patients with macular edema40 and visual impairment secondary to Diabetes mellitus41. Study report RFB002D2304 (RETAIN). 03-Mar-2014.
- 2.7.3 Summary of Clinical Efficacy in patients with macular edema40 in diabetes mellitus41 to support new monitoring and re-treatment regimens and address post-authorization measures - RFB002D2304 (RETAIN). Novartis. 20-Feb- 2014.
- 2.7.4 Summary of Clinical Safety in patients with macular edema40 in diabetes mellitus41 to support new monitoring and re-treatment regimens and address post-authorization measures - RFB002D2304 (RETAIN). Novartis. 20-Feb- 2014.
- 2.5 Clinical Overview in retinal vein occulsion (RVO) – RFB002E. Novartis Pharma AG. Basel, Switzerland. 17 Sep 10.
- 2.7.3 Summary of Clinical Efficacy in retinal vein occlusion (RVO) – RFB002E. Novartis Pharma AG. Basel, Switzerland. 06 Sep 10.
- [BRAVO Study report (2010)] A Phase III, multicenter, randomized, sham injection-controlled study of the efficacy and safety of ranibizumab injection compared with sham in subjects with macular edema40 secondary to branch retinal vein occlusion (RVO). Study report no CSR Addendum FVF4165g. 30 Jul 10.
- [CRUISE Study report (2010)] A Phase III, multicenter, randomized, sham injection-controlled study of the efficacy and safety of ranibizumab injection compared with sham in subjects with macular edema40 secondary to central retinal vein occlusion (RVO). Study report no CSR Addendum FVF4166g. 16 Aug 10.
- 2.5 Clinical Overview in pathologic myopia (PM) – RFB002F. Novartis. 31-Jul-2012.
- [F2301 Study report (2012)]. CSR F2301A 12-month, Phase III, randomized, double-masked, multicenter, active- controlled study to evaluate efficacy and safety of two different dosing regimens of 0.5 mg ranibizumab vs verteporfin PDT in patients with visual impairment due to choroidal neovascularization secondary to pathologic myopia. Novartis. Aug-2012.
- 2.7.3 Summary of Clinical Efficacy in pathologic myopia (PM) – RFB002F. Novartis. 31-Jul-2012.
- 2.5 Clinical Overview in pathologic myopia (PM) – RFB002F Clinical Overview 12 month data. Novartis. 21-Dec- 2012.
- [F2301 Study report (2012)]. A 12-month, Phase III, randomized, double-masked, multicenter, active-controlled study to evaluate efficacy and safety of two different dosing regimens of 0.5 mg ranibizumab vs verteporfin PDT in patients with visual impairment due to choroidal neovascularization secondary to pathologic myopia. 12 month data CSR. Novartis.31-Dec-2012.
- 2.7.3 Summary of Clinical Efficacy in pathologic myopia (PM) – RFB002F SCE 12 month data. Novartis. 21-Dec- 2012.
- 2.5 Clinical Overview – Rationale for changes to Core Data Sheet (CDS) / Product information – Addition of clinical data from study D2303 (REVEAL). Novartis. 20-Oct-2014.
- [D2303 Study report (2012)]. A randomized, double-masked, multicenter, laser controlled Phase III study assessing the efficacy and safety of ranibizumab (intravitreal injections) as adjunctive and mono-therapy in patients with visual impairment due to diabetic macular edema40. Novartis. 16-Mar-2012.
- [2.5 Clinical Overview].Rationale for changes to Core Data Sheet (CDS)-Efficacy update to include long term (24-month) efficacy data from CRYSTAL and BRAVO studies in patients with visual impairment due to macular edema40 secondary to RVO. Novartis. 18-Nov-2015.
- [CSR CRFB002E2401] A 24-month, phase IIIb, open-label, single-arm, multicenter study assessing the efficacy and safety of an individualized, stabilization criteria-driven PRN dosing regimen with 0.5-mg ranibizumab intravitreal injections applied as monotherapy in patients with visual impairment due to macular edema40 secondary to central retinal vein occlusion (CRVO) (CRYSTAL). Novartis. 13-Oct-2015.
- [CSR CRFB002E2402] A 24-month, phase IIIb, open-label, randomized, active-controlled, 3-arm, multicenter study assessing the efficacy and safety of an individualized, stabilization-criteria-driven PRN dosing regimen with 0.5-mg ranibizumab intravitreal injections applied as monotherapy or with adjunctive laser photocoagulation in comparison to laser photocoagulation in patients with visual impairment due to macular edema40 secondary to branch retinal vein occlusion (BRVO) (BRIGHTER). Novartis. 13-Oct-2015.
- 2.5 Clinical Overview in the treatment of visual impairment due to choroidal neovascularization (CNV) (based on 12-month data). Novartis. 8-Jul-2016.
- CRFB002G2301 Clinical Study Report. A 12-month, randomized, double-masked, sham-controlled, multicenter study to evaluate the efficacy and safety of 0.5 mg ranibizumab intravitreal injections in patients with visual impairment due to vascular13 endothelial growth factor (VEGF) driven choroidal neovascularization (CNV). Novartis. 8-Mar-2016.
- 2.5 Clinical Overview in Diabetic Retinopathy. Novartis. 23-Oct-2018
- 2.5 Clinical Overview in Retinopathy of Prematurity (ROP). Novartis. 24-Sep-2018.
- CRFB002H2301 Clinical Study Report. RAINBOW study: a randomized, controlled study evaluating the efficacy and safety of Ranibizumab compared with laser therapy for the treatment of Infants Born prematurely with retinopathy of prematurity. Novartis. 13-Apr-2018
CARACTERÍSTICAS FARMACOLÓGICAS
Grupo Farmacoterapêutico: agentes antineovascularizantes.
Código ATC: S01LA04.
Mecanismo de ação
O ranibizumabe é um fragmento42 de anticorpo43 monoclonal recombinante humanizado que tem como alvo o fator de crescimento endotelial vascular13 humano A (VEGF-A). Liga-se com alta afinidade às isoformas do VEGF-A (p. ex.: VEGF110, VEGF121 e VEGF165), deste modo prevenindo a ligação do VEGF-A aos seus receptores VEGFR-1 e VEGFR- 2.
Farmacodinâmica
A ligação do VEGF-A aos seus receptores leva à proliferação das células44 endoteliais e neovascularização8, assim como ao vazamento vascular13, os quais acredita-se que contribuem para a progressão da forma neovascular de degeneração macular3 relacionada à idade, para o desenvolvimento da NVC, incluindo NVC secundária à miopia37 patológica ou para o edema macular5 causando dano visual na diabetes28 e oclusão de veia da retina7.
Farmacocinética
Absorção: Após a administração intravítrea mensal de Lucentis® em pacientes com DMRI neovascular, as concentrações séricas de ranibizumabe foram geralmente baixas, com níveis máximos (Cmáx) geralmente abaixo da concentração de ranibizumabe necessária para inibir a atividade biológica do VEGF a 50% (11 a 27 ng/mL, conforme avaliado em um ensaio de proliferação celular in vitro). A Cmáx foi proporcional à dose ao longo do intervalo de dose de 0,05 a 1,0 mg/olho15. Após a administração intravítrea mensal de Lucentis® 0,5 mg/olho15, a Cmax sérica de ranibizumabe, alcançada cerca de 1 dia após a administração, é prevista geralmente entre 0,79 e 2,90 ng/mL, e Cmin é prevista geralmente entre 0,07 e 0,49 ng/mL. Concentrações séricas de ranibizumabe em pacientes com EMD e OVR foram semelhantes às observadas em pacientes com DMRI neovascular.
Distribuição e eliminação: Baseado na análise da farmacocinética da população e no desaparecimento do ranibizumabe no soro45 de pacientes com DMRI neovascular tratados com dose de 0,5 mg, a média da meia-vida de eliminação vítrea de ranibizumabe é de aproximadamente 9 dias. Espera-se que a exposição sérica de ranibizumabe seja aproximadamente 90.000 vezes mais baixa que a exposição vítrea de ranibizumabe.
Populações especiais
População Pediátrica (bebês9 prematuros com RP): Após a administração intravítrea de Lucentis® em bebês9 prematuros com RP, em uma dose de 0,2 mg (por olho15), as concentrações séricas de ranibizumabe foram superiores às observadas em doentes adultos com DMRI da fase neovascular que receberam 0,5 mg em um olho15. Com base numa análise farmacocinética populacional, as diferenças na Cmax e AUC46 inf foram aproximadamente 16 vezes e 12 vezes superiores, respectivamente. A aparente meia-vida sistêmica foi de aproximadamente 6 dias. Nesta análise, não foi determinada a relação entre as concentrações sistêmicas de ranibizumabe e as concentrações sistêmicas de VEGF.
Insuficiência renal47: Não foram conduzidos estudos formais para verificar a farmacocinética de Lucentis® em pacientes com insuficiência renal47. Em uma análise farmacocinética da população de pacientes com DMRI neovascular, 68% (136 de 200) tinham insuficiência renal47 (46,5% leve [50 a 80 mL/min], 20% moderada [30 a 50 mL/min] e 1,5% severa [<30 mL/min]). Em pacientes com OVR, 48,2% (253 de 525) tinham insuficiência renal47 (36,4% leve, 9,5% moderada e 2,3% grave). O clearance (depuração) sistêmico48 foi ligeiramente mais baixo, mas não foi clinicamente significante
Insuficiência hepática49: Não foram conduzidos estudos formais para verificar a farmacocinética de Lucentis® em pacientes com insuficiência hepática49.
Dados de segurança pré-clínicos
A administração intravítrea bilateral de ranibizumabe em macacos cynomolgus de doses entre 0,25 mg/olho15 e 2,0 mg/olho15 uma vez a cada 2 semanas por até 26 semanas resultou em efeitos oculares dose-dependentes.
Intraocularmente, ocorreram aumentos, dose-dependentes, do flare da câmara anterior50 e do número de células44, com um pico 2 dias após a injeção1. A gravidade da resposta inflamatória geralmente diminuiu com injeções subsequentes ou durante a recuperação. No segmento posterior ocorreram infiltrações celulares vítreas e moscas volantes, que também tenderam a ser dose-dependentes e geralmente persistiram até o fim do período de tratamento. Na semana 26 do estudo, a gravidade da inflamação51 vítrea aumentou com o número de injeções. Entretanto, evidências de reversibilidade foram observadas após a recuperação. A natureza e o tempo da inflamação51 do segmento posterior são sugestivos de uma resposta imuno-mediada por anticorpos52, que pode ser clinicamente irrelevante. Formação de catarata53 foi observada em alguns animais após um período relativamente longo de inflamação51 intensa, sugerindo que alterações do cristalino54 foram secundárias à inflamação51 grave. Um aumento transitório na pressão intraocular55 pós-dose foi observado após injeções intravítreas, independente da dose.
Alterações oculares microscópicas foram relacionadas à inflamação51 e não indicam processos degenerativos56. Alterações inflamatórias granulomatosas foram observadas no disco óptico57 de alguns olhos31. Essas alterações no segmento posterior diminuíram e em algumas instâncias foram resolvidas durante o período de recuperação. Após a administração intravítrea não foram detectados sinais58 de toxicidade59 sistêmica. Foram encontrados anticorpos52 ao ranibizumabe no soro45 e no vítreo60 em um grupo de animaistratados.
Nenhum dado de carcinogenicidade e mutagenicidade está disponível.
CONTRAINDICAÇÕES
Hipersensibilidade ao princípio ativo ou a qualquer um dos excipientes. Pacientes com infecções61 oculares ou perioculares ativas ou suspeitas. Pacientes com inflamação51 intraocular ativa.
ADVERTÊNCIAS E PRECAUÇÕES
Reações relacionadas às injeções intravítreas
Injeções intravítreas, incluindo aquelas com Lucentis®, têm sido associadas com endoftalmite, inflamação51 intraocular, descolamento de retina7 regmatogênico, ruptura da retina7 e catarata53 traumática iatrogênica62 (vide “Reações Adversas”). Técnicas de injeção1 asséptica apropriadas devem sempre ser utilizadas na administração de Lucentis®. Além disso, pacientes devem ser monitorados durante a semana seguinte à injeção1 para permitir um tratamento precoce caso ocorra uma infecção63. Os pacientes devem ser orientados a relatar quaisquer sintomas64 sugestivos de endoftalmite ou qualquer dos eventos mencionados acima sem atraso.
Aumentos na pressão intraocular55
Em adultos aumentos transitórios na pressão intraocular55 (PIO) têm sido observados nos primeiros 60 minutos após a injeção1 de Lucentis® (vide “Reações Adversas”). Aumentos sustentados da pressão intraocular55 (PIO) também têm sido relatados. Tanto a pressão intraocular55 quanto a perfusão da cabeça do nervo óptico65, devem ser apropriadamente monitoradas e controladas.
Os pacientes devem ser informados dos sintomas64 e potenciais reações adversas além de, serem instruídos a informar ao médico sobre o aparecimento de possíveis sinais58 oculares como dor no olho15 ou desconforto aumentado, piora da vermelhidão, visão20 desfocada ou diminuída, o aumento do número de partículas pequenas na visão20 ou o aumento da sensibilidade à luz (vide “Reações Adversas”).
Eventos tromboembólicos arteriais
Existe um risco potencial de eventos tromboembólicos arteriais após o uso intravítreo de inibidores de VEGF (fator de crescimento endotelial vascular13). Em estudos de fase III da forma neovascular da DMRI, as frequências totais de eventos tromboembólicos arteriais foram similares entre ranibizumabe e o controle. Uma taxa de acidente vascular cerebral25 numericamente maior foi observada em pacientes tratados com ranibizumabe 0,5 mg comparado com ranibizumabe 0,3 mg ou controle, entretanto, as diferenças não foram estatisticamente significantes. A diferença nas taxas de acidente vascular cerebral25 pode ser maior em pacientes com fator de risco27 conhecido para o acidente vascular cerebral25, incluindo histórico de acidente vascular cerebral25 anterior ou ataque isquêmico66 transitório. Portanto, estes pacientes devem ser cuidadosamente avaliados por seus médicos se o tratamento com Lucentis® é adequado e se os benefícios sobrepõem o potencial risco.
Imunogenicidade
Assim como todas as proteínas67 terapêuticas existe um potencial de imunogenicidade com Lucentis®. Uma vez que existe um potencial para uma exposição sistêmica aumentada em indivíduos com EMD, um risco aumentado de desenvolver hipersensibilidade nessa população de pacientes não pode ser excluído. Os pacientes também devem ser instruídos a informar ao médico se uma inflamação51 intraocular aumenta em gravidade, o que pode ser um sinal68 clínico atribuível à formação de anticorpos52 intraoculares.
Tratamento bilateral
Dados disponíveis não sugerem um aumento no risco de reações adversas sistêmicas com o tratamento bilateral.
População de pacientes com dados limitados
Lucentis® não foi estudado em pacientes com infecções61 sistêmicas ativas ou em pacientes com condições oculares simultâneas como descolamento de retina7 ou buraco macular.
Existe apenas uma experiência limitada no tratamento de indivíduos com EMD devido à diabetes28 tipo I. Também não há experiência de tratamento com Lucentis® empacientes diabéticos com HbA1c69 acima de 12% e hipertensão70 não controlada. Essa falta de informação deve ser considerada pelo médico ao tratar esses pacientes.
Não há dados suficientes para concluir sobre o efeito de Lucentis® em pacientes com OVR apresentando perda de função visual isquêmicairreversível.
Em pacientes com MP, existem dados limitados sobre o efeito de Lucentis® em pacientes que já foram submetidos ao tratamento mal sucedido com a terapia fotodinâmica com verteporfina (vTFD). Alémdisso, enquanto um efeito consistente foi observado em indivíduos com lesões10 subfoveais e justafoveais, não há dados suficientes para concluir sobre o efeito de Lucentis® emindivíduos com MP com lesões10 extrafoveais.
Ruptura do epitélio71 pigmentado na retina7
Um dos fatores de risco associado ao desenvolvimento da ruptura do epitélio71 pigmentar da retina7 após a terapia com anti- VEGF na DMRI neovascular e potencialmente também em outras formas de neovascularização8 coroidal, inclui a presença de descolamentos do epitélio71 pigmentar grandes em volume e/ou altura. Portanto, ao iniciar a terapia comranibizumabe, precaução deve ser utilizada em pacientes com esse fator de risco27 para a ruptura do epitélio71 pigmentar da retina7.
Descolamento da retina7
O tratamento deve ser descontinuado em pacientes que apresentam descolamento de retina7 regmatogênico ou buraco macular (estágios 3 ou 4).
Uso concomitante de outros anti-VEGF (fator de crescimento endotelial vascular13)
Lucentis® não deve ser administrado simultaneamente com outros medicamentos anti-VEGF (sistêmicos72 ou oculares).
Suspensão do tratamento com Lucentis®
A dose deve ser suspensa e o tratamento não deverá ser retomado antes da próxima consulta médica, no caso de eventos como:
- diminuição da acuidade visual19 corrigida (MAVC) de ≥ 30 letras em comparação com a acuidade visual19 anteriormente avaliada;
- pressão intraocular55 de ≥ 30 mmHg;
- ruptura da retina7;
- hemorragia38 subretiniana envolvendo o centro da fóvea, ou, se o tamanho da hemorragia38 for ≥ 50% da área total da lesão21;
- realização ou planejamento de cirurgia intraocular dentro dos 28 dias anteriores ou posteriores.
Gravidez73
Não existem dados clínicos disponíveis de exposição de grávidas ao ranibizumabe.
Estudo em macacos cynomolgus não indicou efeitos prejudiciais diretos ou indiretos relacionados à gravidez73 ou ao desenvolvimento embrionário/fetal (vide “Dados de segurança pré-clínicos”). A exposição sistêmica ao ranibizumabe é baixa após administração ocular, mas devido ao seu mecanismo de ação, o ranibizumabe deve ser considerado como potencialmente teratogênico74 e embrio-fetotóxico. Portanto, o ranibizumabe não deve ser usado durante a gravidez73 a menos que o benefício esperado supere o risco potencial para o feto75. Para as mulheres que desejam engravidar e têm sido tratadas com ranibizumabe, é recomendável esperar pelo menos 3 meses após a última dose de ranibizumabe antes de engravidar.
Este medicamento pertence à categoria de risco na gravidez73 C, portanto, este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Dados em animais
Em macacas grávidas, a administração intravítrea de ranibizumabe não provocou toxicidade59 ou teratogenicidade no desenvolvimento, e não teve efeito sobre o peso ou estrutura da placenta. No entanto, devido a restrições ditadas pela via de administração intravítrea, as doses utilizadas no estudo não atingiram a toxicidade59 materna, mas atingiram um múltiplo (até 100 vezes) em relação à exposição sistêmica humana.
A ausência de efeitos mediados pelo ranibizumabe no desenvolvimento embriofetal está plausivelmente relacionada à incapacidade do fragmento42 de ligação ao antígeno76 (Fab) de atravessar a placenta devido à ausência de uma região Fc. No entanto, foi descrito um caso com altos níveis séricos de ranibizumabe e presença de ranibizumabe em soro45 fetal, sugerindo que o anticorpo43 anti-ranibizumabe atuou como proteína transportadora (contendo a região Fc) para o ranibizumabe, diminuindo a depuração sérica materna e possibilitando a transferência placentária. As investigações de desenvolvimento embrionário-fetal foram realizadas em animais prenhes saudáveis, e doenças (como diabetes28) podem modificar a permeabilidade77 da placenta em relação a um fragmento42 Fab.
Lactação78
Não há dados disponíveis sobre a presença de ranibizumabe no leite humano, os efeitos do ranibizumabe no lactente79 amamentado ou os efeitos do ranibizumabe na produção de leite/excreção. Como medida de precaução, a amamentação80 não é recomendada durante o tratamento com Lucentis®.
Fertilidade
Mulheres com potencial reprodutivo devem usar contraceptivos eficazes durante o tratamento com ranibizumabe.
Infertilidade81
Não há dados de fertilidade disponíveis
Efeitos na habilidade de dirigir e operar máquinas
O procedimento de tratamento com Lucentis® pode induzir alterações visuais temporárias, que podem afetar a habilidade de dirigir veículos e/ou operar máquinas (vide “Reações adversas”). Pacientes que apresentarem esses sintomas64 não devemdirigir veículos e/ou operar máquinas até que essas alterações visuais temporárias diminuam.
INTERAÇÕES MEDICAMENTOSAS
Não foram realizados estudos formais de interação.
Em estudos clínicos para o tratamento de deficiência visual devido ao EMD, o resultado com relação à acuidade visual19 ou a espessura central da retina7 em pacientes tratados com Lucentis® não foi afetado pelo tratamento concomitante com tiazolidinedionas (vide “Resultados de eficácia”).
Para o uso conjunto de fotocoagulação a laser e Lucentis® em EMD ou OVR vide “Resultados de eficácia” e “Posologia e modo de usar”.
Incompatibilidades
Na ausência de estudos de compatibilidade, este medicamento não deve ser misturado com outros medicamentos.
CUIDADOS DE ARMAZENAMENTO DO MEDICAMENTO
Cuidados de conservação
Armazenar o produto sob refrigeração (entre 2 e 8 °C). Não congelar. Mantenha o frasco-ampola na embalagem externa para protegê-lo da luz. O prazo de validade é de 36 meses a partir da data de fabricação.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Características físicas e organolépticas do produto
Lucentis® é uma solução límpida a levemente opalescente.
Antes de usar, observe o aspecto do medicamento.
TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS.
POSOLOGIA E MODO DE USAR
Modo de usar
Lucentis® deve ser aplicado em hospitais, clínicas oftalmológicas especializadas ou salas de cirurgia ambulatorial82, sob visão20 de microscópio, com o adequado monitoramento do paciente. Sua administração deve ser realizada somente por profissionais habilitados.
Assim como todos os medicamentos de uso parenteral, Lucentis® deve ser inspecionado visualmente para verificação de material particulado e descoloração antes da administração.
O procedimento de injeção1 deve ser conduzido sob condições assépticas, que inclui o uso de desinfecção83 cirúrgica das mãos84, luvas estéreis, um campo cirúrgico estéril e um espéculo85 de pálpebra estéril (ou equivalente) e o equipamento de paracentese86 estéril deve estar disponível como medida de precaução. O histórico médico do paciente para reações de hipersensibilidade deve ser cuidadosamente avaliado antes de realizar o procedimento intravítreo (vide “Contraindicações”). Adequada anestesia14 e um microbicida tópico87 de amplo espectro para desinfetar a pele88 periocular, pálpebra e superfície ocular devem ser administrados antes da injeção1.
Em adultos, a agulha de injeção1 deve ser inserida a 3,5 a 4,0 mm posterior ao limbo, dentro da cavidade vítrea, evitando o meridiano horizontal e apontando para o centro do globo. O volume da injeção1 de 0,05 mL é, então, injetado; o local de injeção1 na esclera89 deve ser alternado para injeções subsequentes.
Em bebês9 prematuros, a agulha da injeção1 deve ser inserida 1,0 a 2,0 mm posterior ao limbo, com a agulha apontando para o nervo óptico. O volume de injeção1 de 0,02 mL é então injetado.
Cada frasco-ampola é para ser utilizado uma única vez.
O frasco é estéril. Não utilize o frasco se a embalagem estiver danificada. A esterilidade90 do frasco não pode ser garantida, a menos que o lacre da embalagem permaneça intacto. Não utilize o frasco se a solução estiver descolorida, turva ou contenha partículas.
Para preparar Lucentis® para a administração intravítrea, siga as instruções:
|
A.
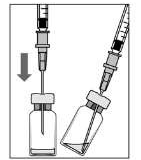 |
|
|
B.
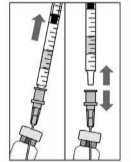 |
|
|
C.
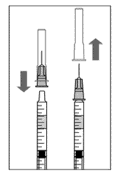
|
|
|
D.  |
|
|
|
Após a injeção1, não tampe a agulha ou retire-a da seringa16. Descarte a seringa16 utilizada junto com a agulha em um recipiente de descarte de objetos cortantes ou de acordo com as exigênciaslocais. |
Posologia
Frasco de uso único somente para injeção1 intravítrea apenas. O uso de mais de uma injeção1 por frasco pode levar à contaminação do produto e subsequente infecção63 ocular.
Lucentis® deve ser administrado por um oftalmologista91 qualificado com experiência em injeções intravítreas.
Adultos: A dose recomendada de Lucentis® em adultos é de 0,5 mg administrada como injeção1 intravítrea única. Isto corresponde a um volume injetado de 0,05 mL. O intervalo entre as duas doses injetadas no mesmo olho15 deve ser de no mínimo 4 semanas.
Bebês9 prematuros: A dose recomendada para o Lucentis® em bebês9 prematuros é de 0,2 mg administrada como uma única injeção1 intravítrea. Isso corresponde a um volume de injeção1 de 0,02 mL. O tratamento da RP é iniciado com uma dose única e pode ser administrado bilateralmente no mesmo dia. No total, podem ser administradas até três injeções por olho15 no período de seis meses após o início do tratamento, se houver sinais58 de atividade da doença. A maioria dos pacientes (78%) no estudo clínico recebeu uma injeção1 por olho15. A administração de mais de três injeções não foi estudada. O intervalo entre duas doses injetadas no mesmo olho15 deve ser de no mínimo 4 semanas.
População alvo geral:
– Tratamento da forma neovascular da DMRI, EMD, RDP, edema macular5 secundário a OVR, NVC ou NVC secundária a MP.
O tratamento é iniciado com uma injeção1 por mês até que a acuidade visual19 máxima seja atingida e/ou não haja sinais58 de atividade da doença.
Depois disso, os intervalos de monitoração e tratamento devem ser determinados pelo médico e deverão ser baseados na atividade da doença, bem como avaliado por meio da acuidade visual19 e/ou parâmetros anatômicos.
O monitoramento da atividade da doença pode incluir exame clínico, teste funcional ou técnicas de imagem(por exemplo, tomografia de coerência óptica ou angiofluoresceinografia92).
Se os pacientes começaram o tratamento em regime de tratar-e-estender por exemplo, os intervalos de tratamento podem ser estendidos gradualmente até que os sinais58 de atividade da doença ou deficiência visual se repitam. O intervalo de tratamento deve ser estendido por duas semanas de cada vez na forma neovascular da DMRI e na oclusão de veia central da retina7 (OVCR), ou por um mês de cada vez para o EMD e oclusão de ramo de veia da retina7 (ORVR). Se aatividade da doença é recorrente, o intervalo de tratamento deve ser reduzido adequadamente.
O tratamento do comprometimento visual devido à NVC deve ser determinado individualmente, por paciente, baseado na atividade da doença. Alguns pacientes podem apenas necessitar de uma injeção1 durante os primeiros 12 meses, outros pacientes podem necessitar de tratamento mais frequente, incluindo uma injeção1 mensal. No tratamento do comprometimento visual devido à NVC secundária a MP muitos pacientes podem apenas necessitar de uma ou duas injeções durante o primeiro ano, enquanto alguns pacientes podem necessitar tratamento mais frequente (vide “Resultados de eficácia”).
– Lucentis® e fotocoagulação a laser no EMD e na OVR
Lucentis® tem sido utilizado concomitantemente com fotocoagulação a laser em estudos clínicos (vide “Resultados de eficácia”). Quando administrado no mesmo dia, Lucentis® deve ser administrado pelo menos 30 minutos após a fotocoagulação a laser. Lucentis® pode ser administrado em pacientes que receberam fotocoagulação a laser anteriormente.
– Tratamento da RP em prematuros
O tratamento em bebês9 prematuros é iniciado com uma única injeção1. Outro tratamento pode ser administrado se houver sinais58 de atividade da doença.
Populações especiais
Insuficiência renal47: Nenhum ajuste de dose é necessário em pacientes com insuficiência renal47 (vide “Farmacocinética”).
Insuficiência hepática49: Lucentis® não foi estudado em pacientes com insuficiência hepática49. Entretanto, como a exposição sistêmica é insignificante, nenhuma medida especial é considerada necessária nesta população.
Pacientes pediátricos: A segurança e eficácia de Lucentis® em crianças e adolescentes com menos de 18 anos de idade para outras indicações que não a retinopatia da prematuridade não foram estabelecidas. O uso de Lucentis® em crianças e adolescentes entre 12 e 17 anos não é recomendado.
Pacientes geriátricos (65 anos ou mais): Nenhum ajuste de dose é necessário em pacientes idosos.
REAÇÕES ADVERSAS
Resumo do perfil de segurança População com a forma neovascular da DMRI
Um total de 1.315 pacientes fizeram parte da população de segurança em três estudos controle de fase III para a forma neovascular da DMRI (FVF2598g(MARINA), FVF2587g(ANCHOR) e FVF3192g (PIER)), com24 meses de exposição ao Lucentis® e 440 pacientes foram tratados com a dose recomendada de 0,5 mg.
Reações adversas graves relacionadas ao procedimento de injeção1 incluíram endoftalmite, descolamento de retina7 regmatogênico, ruptura da retina7 e catarata53 traumática iatrogênica62 (vide “Advertências e precauções”).
Outras reações oculares graves observadas entre os pacientes tratados com Lucentis® incluíram inflamação51 intraocular e aumento da pressão intraocular55 (vide “Advertências e precauções”).
As reações adversas listadas a seguir, na Tabela 15, ocorreram numa proporção mais alta (pelo menos 2 pontos percentuais) em pacientes que receberam tratamento com Lucentis® 0,5 mg do que naqueles pacientes que receberam tratamento controle (injeções simuladas, como definido em “Resultados de Eficácia”, ou terapia fotodinâmica [TFD] com verteporfina) no conjunto de dados dos três estudos controlados da forma neovascular da DMRI. Estas foram, portanto, consideradas reações adversas potenciais relacionados ao medicamento. Os dados de segurança descritos a seguir também incluem todas as reações adversas suspeitas de estarem pelo menos potencialmente relacionadas ao procedimento de injeção1 ou ao medicamento nos 440 pacientes com forma neovascular da DMRI tratados com 0,5 mg de Lucentis®.
População com EMD
A segurança do Lucentis® foi estudada em um estudo com simulação controlada de um ano (RESOLVE) e em um estudo laser controlado de um ano (RESTORE) conduzidos, respectivamente, com 102 e 235 pacientes com deficiência visual devido ao EMD tratados com ranibizumabe (vide “Resultados de eficácia”). A reação de infecção63 do trato urinário93, na categoria de frequência comum, preencheu os critérios de reação adversa da tabela abaixo; de maneira diferente as reações adversas oculares e não oculares nos estudos RESOLVE e RESTORE foram relatadas com uma frequência e gravidade semelhantes às observadas nos estudos com a forma neovascular da DMRI.
População de RDP
A segurança de Lucentis empacientes com retinopatia diabética6 proliferativa foi estudada até 24 meses no Protocolo S, incluindo 191 pacientes tratados com ranibizumabe (ver item 2. Resultados de Eficácia). Os eventos oculares e não oculares observados foram consistentes com o que seria esperado numa população de pacientes diabéticos com retinopatia diabética6, ou foram notificados com uma frequência e gravidade semelhantes aos observados em ensaios clínicos94 anteriores com Lucentis.
População com OVR
A segurança do Lucentis® foi estudada em dois estudos de 12 meses (BRAVO e CRUISE) conduzidos, respectivamente, com 264 e 261 pacientes tratados com ranibizumabe com deficiência visual devido a edema macular5 secundário em ORVR e OVCR, respectivamente (vide “Resultados de eficácia). Reações oculares e não oculares nos estudos BRAVO e CRUISE foram relatadas com uma frequência e gravidade semelhantes às observadas nos estudos coma95 forma neovascular da DMRI.
População com NVC
A segurança de Lucentis® foi estudada em um estudo clínico de 12 meses (MINERVA), que incluiu 171 pacientes com comprometimento visual devido à NVC tratados com ranibizumabe (vide “Resultados de Eficácia”). O perfil de segurança nestes pacientes foi consistente com os observados em estudos clínicos anteriores comLucentis®.
População com MP
Dados de segurança de 6 meses de Lucentis® de um estudo clínico de 12 meses (F2301), o qual incluiu 224 pacientes tratados com ranibizumabe com deficiência visual devido à NVC secundária a MP (vide “Resultados de Eficácia”), foram avaliados. Eventos oculares e não oculares neste estudo clínico foram relatados com a frequência e gravidade similares a aqueles vistos nos estudos clínicos da forma neovascular da DMRI.
Tabela de resumo das reações adversas dos estudos clínicos
As reações adversas medicamentosas dos estudos clínicos estão listadas por sistema classe-órgão MedDRA. Dentro de cada sistema classe-órgão, as reações adversas medicamentosas são classificadas por frequência, com as reações mais frequentes primeiro. Dentro de cada grupo de frequência, as reações adversas medicamentosas são apresentadas em ordem decrescente de gravidade. Além disso, a categoria de frequência correspondente para cada reação adversa àdroga é baseada na seguinte convenção (CIOMS III): muito comum (≥ 1/10), comum (≥ 1/100, < 1/10), incomum (≥ 1/1.000 a < 1/100), raro (≥ 1/10.000 a < 1/1.000) e muito raro (< 1/10.000).
Tabela 15 - Reações adversas a medicamentos dos estudos clínicos
|
Infecções61 e infestações |
|
|
Muito comum |
nasofaringite |
|
Comum |
gripe96, infecção63 do trato urinário93*** |
|
Distúrbios do sistema sanguíneo e linfático97 |
|
|
Comum |
anemia98 |
|
Distúrbios psiquiátricos |
|
|
Comum |
ansiedade |
|
Distúrbios do sistema nervoso99 |
|
|
Muito comum |
dor de cabeça100 |
|
Comum |
acidente vascular cerebral25 |
|
Distúrbios oculares |
|
|
Muito Comum |
inflamação51 intraocular, vitreite, descolamento do vítreo60, hemorragia38 retiniana, distúrbio visual, dor no olho15, moscas volantes, hemorragia38 conjuntival, irritação do olho15, sensação de corpo estranho no olho15, lacrimejamento aumentado, blefarite101, olho15 seco, hiperemia102 ocular e prurido103 nos olhos31. |
|
Comum |
degeneração104 retiniana, distúrbio retiniano, descolamento da retina7, ruptura retiniana, descolamento do epitélio71 pigmentar retiniano, ruptura do epitélio71 pigmentar retiniano, redução da acuidade visual19, hemorragia38 vítrea, distúrbio vítreo60, uveíte105, irite106, iridociclite, catarata53, catarata53 subcapsular, opacificação da cápsula posterior, ceratite ponteada, abrasão da córnea107, turvação da câmara anterior50, visão20 borrada, hemorragia38 no local da injeção1, hemorragia38 do olho15, conjuntivite108, conjuntivite108 alérgica, secreçãodo olho15, fotopsia, fotofobia109, desconforto ocular, edema40 da pálpebra, dor na pálpebra, hiperemia102 conjuntival. |
|
Incomum |
cegueira, endoftalmite, hipópio, hifema, ceratopatia, adesão da íris110, depósito corneal, edema40 corneal, estrias corneanas, dor no local de injeção1, irritação no local da injeção1, sensação estranha no olho15, irritação da pálpebra. |
|
Distúrbios respiratórios, torácicos e mediastinal |
|
|
Comum |
tosse |
|
Distúrbio gastrointestinais |
|
|
Comum |
náusea111 |
|
Distúrbios do tecido112 cutâneo113 e subcutâneo114 |
|
|
Comum |
reações alérgicas (rash115, urticária116, prurido103, eritema117) |
|
Distúrbios do tecido112 musculoesquelético e conjuntivo |
|
|
Muito comum |
artralgia118 |
|
Laboratoriais |
|
|
Muito comum |
aumento da pressão intraocular55 |
*** Observado apenas na população com EMD
Uma meta-análise de dados de segurança agrupados a partir de estudos globais, duplo-mascarados, randomizados, completos, demonstrou uma taxa maior de incidência24 de feridas não graves e não oculares provenientes de infecção63/inflamação51 em pacientes com EMD tratados com Lucentis® 0,5 mg (1,85/100 pacientes-ano) em comparação com o grupo controle (0,27/100 pacientes-ano). A relação com Lucentis® permanece desconhecida.
População de Retinopatia da Prematuridade (RP) - População pediátrica
A segurança de Lucentis® 0,2 mg foi estudada no ensaio clínico de 6 meses (RAINBOW), que incluiu 73 prematuros tratados com ranibizumabe com RP (ver Estudos clínicos). Os eventos oculares observados no estudo RAINBOW foram consistentes com os observados em adultos tratados com ranibizumabe 0,5 mg. Em geral, os eventos não oculares neste estudo foram consistentes com o que seria esperado para essa população de pacientes com múltiplas comorbidades119 devido à prematuridade. O perfil de segurança em longo prazo em prematuros ainda não foi estabelecido.
Atenção: este produto é um medicamento que tem uma Nova Indicação Terapêutica120 no País e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos. Nesse caso, notifique os eventos adversos pelo Sistema VigiMed, disponível no Portal da Anvisa."
SUPERDOSE
Casos de superdose acidental (injeção1 de volumes maiores do que o recomendado de 0,05 mL de Lucentis®) foram relatados nos estudos clínicos da forma neovascular da DMRI e após comercialização. As reações adversas mais frequentes associadas com estes casos relatados foram aumento da pressão intraocular55 e dor no olho15. Se ocorrer superdose, a pressão intraocular55 deve ser monitorada e tratada, caso seja considerado necessário pelo médico.
Em estudos clínicos, doses de até 2 mg de Lucentis® em um volume de injeção1 de 0,05 mL a 0,10 mL foram administradas em pacientes com forma neovascular de DMRI e EMD. O tipo e a frequência das reações adversas oculares e sistêmicas foram consistentes com aquelas relatadas para dose de 0,5 mg (em 0,05 mL) de Lucentis®.
Em caso de intoxicação ligue para 0800 722 6001, se você precisar de mais orientações.
DIZERES LEGAIS
VENDA SOB PRESCRIÇÃO MÉDICA
MS – 1.0068.1056
Farm. Resp.: Flavia Regina Pegorer – CRF-SP 18.150
Importado por:
Novartis Biociências S.A.
Av. Prof. Vicente Rao, 90 São Paulo - SP
CNPJ:56.994.502/0001-30
Indústria Brasileira
Fabricado por:
Novartis Pharma Stein AG, Stein, Suíça
SAC 0800 888 3003