Faulblastina (Bula do profissional de saúde)
LIBBS FARMACÊUTICA LTDA
IDENTIFICAÇÃO DO MEDICAMENTO
Faulblastina®
sulfato de vimblastina
Injetável 1 mg/mL
FORMA FARMACÊUTICA E APRESENTAÇÃO:
Solução injetável
Embalagem contendo 5 frascos-ampola com 10 mL
USO INTRAVENOSO
USO ADULTO e PEDIÁTRICO
COMPOSIÇÃO:
Cada de Faulblastina® contém:
| sulfato de vimblastina | 1 mg |
| veículo q.s.p. | 1 mL |
Veículos: cloreto de sódio, hidróxido de sódio, ácido sulfúrico e água para injetáveis.
INFORMAÇÕES TÉCNICAS AOS PROFISSIONAIS DE SAÚDE1
INDICAÇÕES
O sulfato de vimblastina é frequentemente associado a outros agentes antineoplásicos no tratamento das seguintes neoplasias2: doença de Hodgkin3 generalizada (estágio III e IV); linfoma4 linfocítico (nodular e difuso, pouco ou muito diferenciado); linfoma4 histiocítico; micose5 fungoide (estágio avançado); carcinoma6 de testículo7 avançado; sarcoma de Kaposi8; doença de Letter-Siwe (histiocitose X). Também pode ser utilizado no tratamento de coriocarcinoma resistente a outros agentes quimioterápicos e no carcinoma6 de mama9 que não responde a outros agentes terapêuticos.
RESULTADOS DE EFICÁCIA
A vimblastina é considerada um agente específico do ciclo celular, principalmente por sua ação na metáfase da mitose celular. Este efeito citotóxico10 é, provavelmente, facilitado pela sua habilidade em se ligar à tubulina; no entanto, intermediários reativos também podem ser parcialmente responsáveis pela atividade citotóxica (Gilman et al. 1990); (Devita et al. 1989); (Young & Koda-Kimble, et al.1988).
Doença de Hodgkin3: O tratamento da doença de Hodgkin3 está baseado no estadiamento da doença. Pacientes com estadiamento inicial são candidatos à quimioterapia11, terapia combinada12 ou radioterapia13 isolada. Pacientes com estadiamento II a IV ou na presença de sintomas14 B requerem tratamento combinado de quimioterapia11 com ou sem radioterapia13 adicional. Canellos e colaboradores, 1992 realizaram um estudo randomizado15, comparando a efetividade do esquema MOPP (mecloretamina, vincristina, procarbazina e prednisona) que foi o tratamento padrão por mais de 20 anos, com os esquemas ABVD (doxorrubicina, bleomicina, vimblastina e dacarbazina) e MOPP alternado com ABVD. Foram avaliados 361 pacientes com estadiamento IIA a IV. Os esquemas que continham ABVD foram superiores ao MOPP isolado em termos de sobrevida16 livre de recorrência17 (50% vs 36%, em um acompanhamento médio de 14 anos) e o esquema de ABVD isolado foi menos tóxico do que os outros esquemas. Duggan e colaboradores, 2003 conduziram um estudo comparativo entre os esquemas ABVD e MOPP/ABV em 856 pacientes com doença avançada. A eficácia entre os dois esquemas foi equivalente em termos de sobrevida16 livre de recorrência17 e sobrevida16 global, entretanto, o esquema MOPP/ABV revelou-se mais tóxico. Johnson e colaboradores, 2005 publicaram estudo realizado em 807 pacientes com doença avançada, no qual era comparado o esquema ABVD com outros dois esquemas de quimioterapia11 que incluíam etoposídeo, clorambucila, vincristina e procarbazina. Com um acompanhamento de 52 meses, a avaliação de sobrevida16 livre de eventos foi de 75% para o esquema ABVD e também para os outros dois esquemas. A sobrevida16 global aos três anos foi de 90% para o grupo ABVD e 88% para os outros grupos. Não houve diferença significativa entre os grupos, entretanto, o esquema ABVD revelou-se menos tóxico, permanecendo até hoje como tratamento padrão para doença de Hodgkin3.
Linfoma4 linfocítico: O uso de vimblastina está indicado como tratamento paliativo18 do linfoma4 linfocítico, formas nodular e difusa e bem diferenciado ou indiferenciado (Prod Info Velban(R), vinblastine sulfate, et al. 2000). Grigoletto e colaboradores, 1981 realizaram estudo em 14 pacientes com linfomas linfocíticos difusos, indiferenciados, avançados, utilizando a combinação de doxorrubicina, bleomicina, vimblastina e dacarbazina (ABVD). Respostas completas foram alcançadas em 50% dos casos e respostas objetivas em 80%. A toxicidade19 foi aceitável e não houve ocorrência de morte relacionada ao fármaco20. Concluiu-se que o esquema ABVD não é o ideal para tratamento de primeira linha, mas pode ser avaliado em pacientes em que a primeira linha de tratamento não foi efetiva. Micose5 fungoide: A micose5 fungoide é um linfoma4 de pele21 e pode ser primário ou uma manifestação secundária de diferentes tipos de linfoma4 como o histiocítico ou o linfoblástico. O tratamento quimioterápico pode ser feito utilizando alcaloides da vinca, em especial a vimblastina. Entretanto, apesar de regressões muito significativas com o tratamento sistêmico22, a quimioterapia11 não demonstrou o aumento da sobrevida16 (Braunwald et al. 1990a).
Carcinoma6 dos testículos23: Historicamente a vimblastina foi incluída em vários protocolos de tratamento para câncer24 testicular (Scheulen et al. (1980); Samson et al. 1980). Regimes terapêuticos sequenciais com vimblastina combinada com outros fármacos como bleomicina, dactinomicina, cisplatina e doxorrubicina promoveram boas taxas de resposta (parcial e completa) atingindo níveis de 78% a 88% (Neidhart et al. 1980; Scheulen et al. 1980). Einhorn e colaboradores, 1980 avaliaram 19 pacientes com diagnóstico25 de seminoma26 disseminado com a combinação de cisplatina, vimblastina, bleomicina com ou sem doxorrubicina. Doze pacientes (63%) alcançaram remissão completa com duração mediana de 18 meses. Esses resultados são comparáveis aos alcançados em tumores de testículo7 não seminomatosos e pode ser utilizada estratégia similar. Protocolos com doses reduzidas de vimblastina (0,2 a 0,4 mg/kg/dose) associada à cisplatina com bleomicina promoveram bons índices de respostas (remissões completas de 71% a 97%) e com baixa toxicidade19 (Pizzocaro et al. 1986; Stoter et al. 1986). Loehrer e colaboradores, 1998 estudaram a efetividade da combinação de vimblastina, ifosfamida e cisplatina (VeIP) em tratamento de segunda linha de pacientes com tumores de células germinativas27. Foram avaliados 135 pacientes com doença progressiva após terapia baseada na combinação cisplatina e etoposídeo. Dos pacientes avaliados 67 (49,6%) apresentaram-se livres da doença após o tratamento. Concluíram que o esquema VeIP é capaz de produzir respostas duráveis nesses pacientes.
Sarcoma de Kaposi8: Laubenstein e colaboradores, 1984 estudaram a combinação de doxorrubicina, bleomicina e vimblastina (ABV) em 31 pacientes com sarcoma de Kaposi8 epidêmico. A maior parte dos pacientes apresentava doença avançada, infecções28 oportunistas prévias ou falhas aos tratamentos anteriores. Com um acompanhamento de 24 meses, a duração mediana de resposta foi de oito meses. A taxa de resposta global foi de 84%. Volberding e colaboradores, 1985 estudaram 38 pacientes portadores de sarcoma de Kaposi8 relacionado à síndrome29 de imunodeficiência30. Foram administradas doses semanais intravenosas de vimblastina de 4 a 8 mg; dez pacientes obtiveram resposta objetiva e 19 obtiveram estabilidade da doença durante o tratamento. A toxicidade19 foi mínima. A terapia alternada de vincristina e vimblastina foi efetiva como paliativa para o sarcoma de Kaposi8 em pacientes imunossuprimidos. Os pacientes receberam vincristina 2 mg nas semanas ímpares e vimblastina 0,1 mg/kg nas semanas pares. Dos 23 pacientes avaliados, um paciente respondeu completamente e oito parcialmente; sete pacientes mantiveram a doença estável durante o tratamento. O tempo médio de resposta foi de 13 semanas, a duração média da resposta foi atingida em 35 semanas (Kaplan et al. 1986).
Doença de Letter-Siwe: A doença de Letter-Siwe, de ocorrência em crianças, é considerada uma histiocitose disseminada, uma forma não usual de linfoma4 maligno. A apresentação clínica consiste em hepatoesplenomegalia31, linfadenopatia, anemia32 e hiperplasia33 generalizada. Komp e colaboradores, 1977 estudaram 25 crianças com histiocitose X tratadas com ciclofosfamida, vimblastina e prednisona. A resposta completa foi obtida em oito crianças, oito com resposta parcial, duas com doença progressiva e sete não responderam. As respostas nas crianças acima de um ano de idade foram melhores do que as reportadas com agentes únicos. Nas crianças abaixo de um ano de idade a resposta foi muito pobre e a toxicidade19 muito alta. Vários outros agentes quimioterápicos incluindo vincristina, vimblastina, ciclofosfamida, metotrexato, clorambucila, mercaptopurina e prednisona foram utilizados para tratar a doença disseminada e progressiva. A terapia com agentes isolados foi tão efetiva quanto à combinada, atingindo níveis de resposta ao redor de 50% (Braunwald et al. 1990a; Behrman et al. 1987).
CARACTERÍSTICAS FARMACOLÓGICAS
O sulfato de vimblastina é o sal de um alcaloide34 extraído da Vinca rosea Linn, uma planta florescente comum, conhecida como pervinca (mais propriamente conhecida como Catharanthus roseus G. Don). O sulfato de vimblastina é um alcaloide34 dimérico composto dos grupos funcionais indól e di-hidroindól. As evidências físicas e químicas indicam que o sulfato de vimblastina possui um peso molecular de 909,07 e fórmula empírica C46H58O9N4.H2SO4. É um pó branco a quase branco facilmente solúvel em água, solúvel em metanol, fracamente solúvel em etanol e insolúvel em benzeno e éter.
Propriedades Farmacodinâmicas
A vimblastina é um fármaco20 citotóxico10, cujo mecanismo de ação está relacionado com a inibição da formação de microtúbulos no fuso mitótico, resultando em uma parada da divisão celular na metáfase.
Propriedades Farmacocinéticas
Estudos farmacocinéticos em pacientes com câncer24 demonstraram uma queda trifásica do nível sérico após injeção35 intravenosa rápida de vimblastina. A meia-vida inicial, média e final é de 3,7 minutos, 1,6 e 24,8 horas, respectivamente. O volume do compartimento central é 70% do peso corporal, provavelmente refletindo uma ligação tecidual muito rápida aos elementos do sangue36. Ocorre extensa reversão da ligação tecidual. Baixas concentrações estão presentes no organismo 48 a 72 horas após a injeção35. Foi demonstrado que o metabolismo37 dos alcaloides da vinca é mediado pelas isoenzimas hepáticas38 do citocromo P450 CYP3A. A maior via de eliminação da vimblastina é pelo sistema biliar e também pela urina39. Após injeção35 de sulfato de vimblastina tritiada em pacientes com câncer24, 10% da radioatividade foi encontrada nas fezes e 14% na urina39, a atividade restante não foi computada. Estudos similares em cães mostraram que após nove dias, 30% a 36% da radioatividade foram detectadas na bile40 e 17% na urina39. Um estudo similar em ratos demonstrou que as concentrações mais altas de radioatividade foram encontradas no pulmão41, fígado42, baço43 e rins44, duas horas após a injeção35.
CONTRAINDICAÇÕES
Em casos de hipersensibilidade conhecida ao sulfato de vimblastina ou a qualquer componente de sua formulação. Não deve ser administrada em pacientes com leucopenia45 ou pacientes com infecção46 bacteriana.
Categoria de risco na gravidez47: D.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica. Informe imediatamente seu médico em caso de suspeita de gravidez47.
ADVERTÊNCIAS E PRECAUÇÕES
Cuidados na administração
Deve ser administrada exclusivamente por infusão intravenosa e sob supervisão de um profissional com experiência no uso de agentes quimioterápicos. A administração nas extremidades deve ser feita com cuidado, pois a presença de disfunção circulatória aumenta o risco de ocorrência de trombose48. A administração deve ser realizada com muita cautela a fim de evitar infiltração nos tecidos subcutâneos. Em caso de extravasamento, a administração deve ser imediatamente interrompida e a quantidade restante administrada em outra veia. Para dispersar o fármaco20 e minimizar desconforto e possível lesão49 tecidual, pode-se aplicar localmente calor e injeção35 de hialuronidase. Devido à possibilidade de ocorrência de efeitos tóxicos severos, os pacientes devem ser hospitalizados pelo menos durante o início da terapia. Faulblastina®, bem como outros alcaloides de vinca, não deve ser administrada por via intramuscular, subcutânea50 ou intratecal. A administração intratecal pode ser fatal.
Insuficiência hepática51
A toxicidade19 pode estar aumentada na presença de insuficiência hepática51.
Mielossupressão
A monitoração frequente do hemograma deve ser instituída durante o tratamento. Em caso de leucopenia45 (< 2.000 leucócitos52/mm3) após uma dose de vimblastina, o paciente deve ser cuidadosamente observado quanto aos sintomas14 de infecção46, até que a contagem da série branca tenha retornado a um nível seguro. Pacientes com infiltração de células53 malignas na medula óssea54 poderão apresentar leucopenia45 e trombocitopenia55 acentuadas após administração de doses moderadas, sendo desaconselhável o uso posterior do fármaco20 nestes pacientes.
Reações de hipersensibilidade
Falta de ar aguda e broncoespasmo56 grave foram relatados após a administração de alcaloides da vinca. Essas reações foram mais frequentes quando o alcaloide34 da vinca foi usado em combinação com a mitomicina e podem requerer tratamento agressivo, particularmente se houver disfunção pulmonar preexistente. Estas reações podem se iniciar dentro de minutos ou várias horas após a administração da vinca e podem ocorrer até duas semanas após a dose de mitomicina. Pode ocorrer dispneia57 progressiva, requerendo terapia crônica. Nestes casos a vimblastina não deve ser readministrada.
Gerais
Deve ser evitado o uso de vimblastina em pacientes, principalmente idosos, que apresentem caquexia58 ou áreas ulceradas na superfície da pele21, pois nestas condições a resposta leucopênica ao fármaco20 pode estar mais acentuada. Não é aconselhável o uso de pequenas quantidades diárias de vimblastina por longos períodos, mesmo que a dose semanal total resultante seja semelhante àquela recomendada. Pouco ou nenhum efeito terapêutico foi demonstrado quando tais esquemas foram usados. A estrita aderência ao sistema de dose recomendada é muito importante. Em caso de doses elevadas pode ocorrer neurotoxicidade. O risco-benefício do uso de vimblastina deve ser avaliado quando o paciente apresentar as seguintes patologias: catapora59 (ou exposição recente), herpes zoster60, gota61 ou histórico de cálculo62 renal63, disfunção hepática64 e infecções28.
Efeitos na habilidade de dirigir e operar máquinas
Durante o tratamento, o paciente não deve dirigir veículos ou operar máquinas, por causa das náuseas65 e vômitos66.
Gravidez47 e Lactação67
Estudos em animais sugerem a possibilidade de efeitos teratogênicos68. Os animais que receberam este fármaco20 no início da gestação apresentaram reabsorção do concepto e os fetos sobreviventes demonstraram deformidades marcantes. Não há estudos adequados e bem controlados em mulheres grávidas.
Caso a vimblastina seja utilizada durante a gestação ou a paciente engravidar durante o tratamento, a paciente deverá ser informada sobre os potenciais danos ao feto69.
Mulheres em idade fértil devem evitar a gravidez47.
Não se sabe se a vimblastina é excretada no leite humano. Recomenda-se a descontinuação da amamentação70 durante o tratamento.
Faulblastina® é um medicamento classificado na categoria D de risco de gravidez47 – Há evidências de risco em fetos humanos. Só usar se o benefício justificar o risco potencial. Em situação de risco de vida ou em caso de doenças graves para as quais não se possa utilizar drogas mais seguras, ou se estas drogas não forem eficazes.
Portanto, este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica. Informe imediatamente ao médico em caso de suspeita de gravidez47.
Carcinogênese, mutagênese, comprometimento da fertilidade: Foram relatados casos de aspermia em homens. Estudos em animais sugerem a ocorrência de efeitos teratogênicos68 pela observação de retardo na metáfase e alterações degenerativas71 nas células germinativas27. Foi relatada a ocorrência de amenorreia72 em alguns pacientes tratadas com a combinação de um agente alquilante, procarbazina, prednisona e sulfato de vimblastina. Esta ocorrência foi relacionada à dose total dos quatro agentes utilizados, sendo frequente a volta das menstruações. A mesma combinação de fármacos, administrada a pacientes do sexo masculino, produziu azoospermia73; se houve retorno da espermatogênese, isto não aconteceu em menos de dois anos de remissão sem medicação. Testes em Salmonella typhimurium e com o ensaio letal dominante em camundongos não demonstraram mutagenicidade. Anormalidades no esperma74 foram observadas em camundongos. A vimblastina provocou um aumento na formação micronucleica nas células53 de medula óssea54 de camundongos. Entretanto, uma vez que inibe a formação do fuso mitótico, não se pode concluir que seja evidência de mutagenicidade. Estudos adicionais em camundongos não demonstraram redução na fertilidade dos machos. Ocorreram translocações75 cromossômicas nos camundongos machos. Os machos descendentes da primeira geração desses camundongos não eram portadores de translocação76 heterozigótica. Testes in vitro com culturas de células53 pulmonares de hamsters demonstraram alterações cromossômicas, incluindo quebras e trocas de cromátides, enquanto testes usando outros tipos de células53 de hamsters não demonstraram mutação77. Não foram observadas quebras e alterações nas análises dos cromossomas das células da medula óssea78 dos pacientes tratados com vimblastina. Não se sabe ainda como este fármaco20 afeta a síntese dos ácidos nucleicos. Alguns autores acreditam que não haja interferência e outros acham que a vimblastina interfere no metabolismo37 dos ácidos nucleicos, não por ação direta, mas possivelmente devido ao distúrbio bioquímico em outras áreas da organização molecular celular. Na exposição de células53 de hepatoma de ratos em cultura com vimblastina em níveis não citotóxicos79 não foi observada inibição da síntese de RNA. Resultados conflitantes foram encontrados em outros achados sobre interferência na síntese de DNA. Não há evidência de carcinogenicidade da vimblastina em seres humanos, desde o início de seu uso clínico no final de 1950. Pacientes tratados por doença de Hodgkin3 desenvolveram leucemia80 após radioterapia13 e administração de vimblastina em combinação com outros quimioterápicos, incluindo agentes que se intercalam com o DNA. Não se sabe quanto a vimblastina pode ter contribuído para o aparecimento da leucemia80. Dados disponíveis em ratos e camundongos não demonstraram clara evidência de carcinogênese, quando os animais foram tratados com a dose máxima tolerada e com a metade desta dose por seis meses. Esse sistema de teste evidenciou outros agentes como carcinogênicos, enquanto que a vimblastina ficou no grupo de fármacos que causaram leve aumento (1,5-2 vezes) ou a mesma incidência81 de tumor82 que o controle.
Populações especiais
Uso pediátrico: Uma revisão de literatura publicada de 1993 a 1995 mostrou que as doses iniciais de vimblastina em pacientes pediátricos variaram conforme o esquema utilizado e se a administração foi como agente único ou incorporado dentro de um regime quimioterápico particular. Como agente único para tratamento da doença de Letter- Siwe, a dose inicial de vimblastina foi reportada como 6,5 mg/m2. Quando a vimblastina foi usada em combinação com outros agentes quimioterápicos para tratamento da doença de Hodgkin3, a dose inicial reportada foi de 6 mg/m2. Para carcinomas de células germinativas27 testiculares, a dose inicial de vimblastina foi reportada como 3 mg/m2 em um regime combinado. Modificações de dose devem ser conduzidas pela tolerância hematológica.
Uso em pacientes idosos: Não é recomendada a utilização da vimblastina em pacientes idosos com caquexia58 ou áreas ulcerosas na pele21.
Uso em pacientes com insuficiência renal83 ou hepática64: É recomendada redução de 50% na dose de vimblastina nos pacientes com dosagem sérica de bilirrubina84 direta acima de 3 mg/100 mL. Como o metabolismo37 e a excreção são principalmente hepáticos, nenhuma modificação é recomendada em pacientes com comprometimento da função renal63.
INTERAÇÕES MEDICAMENTOSAS
Faulblastina® não deve ser combinada com qualquer outra substância química no mesmo recipiente de administração. Pequenos volumes de solução remanescente devem ser descartados imediatamente.
Fenitoína: A administração oral ou intravenosa simultânea de fenitoína com vimblastina pode reduzir a eficácia terapêutica85 da fenitoína, sendo recomendada monitoração dos níveis séricos da fenitoína e ajuste de dose, se necessário. Fármacos inibidores das isoenzimas hepáticas38 do citocromo P450 CYP3A (como eritromicina): Essa coadministração pode precipitar o início ou aumento da gravidade das reações adversas (ver item “9. Reações adversas”). Deve ser evitada essa coadministração, se usada concomitantemente, a dosagem de vimblastina deve ser reduzida e sua toxicidade19 monitorada. É recomendada cautela na administração concomitante em pacientes com disfunção hepática64.
Imunossupressores como azatioprima, interferona, cloranfenicol, anfotericina B, colchicina, flucitosina e zidovudina: Recomendada cautela no uso concomitante de vimblastina com agentes imunossupressores.
Vacinas: A administração de vacinas com vírus86 inativado não é recomendada em pacientes sob tratamento com vimblastina, por causa da inibição da resposta imunológica. A eficácia da vacina87 pode ser baixa e sua administração pode causar uma infecção46 generalizada.
Bleomicina e cisplatina: O tratamento quimioterápico combinado de vimblastina, bleomicina e cisplatina (VBP) pode causar toxicidade19 cardiovascular severa com risco à vida. Esta combinação é bastante eficaz no tratamento do câncer24 de testículo7, porém apresenta alto risco de toxicidade19.
Mitomicina: Foi relatado aumento da incidência81 de distúrbios pulmonares (dano pulmonar difuso com infiltrados intersticiais e efusões88 pleurais) quando dessa coadministração, resultando em dificuldade respiratória e tosse. A combinação de alcaloides da vinca com mitomicina causa reações adversas como dispneia57 aguda, tosse, dor torácica e broncoespasmo56 grave, pelo aumento da toxicidade19 crônica da mitomicina.
Doxorrubicina e alfainterferona 2A: A combinação de vimblastina, doxorrubicina e alfainterferona 2A causa severa trombocitopenia55 e leucopenia45 devido à alta toxicidade19. Este tratamento não é recomendado para o tratamento de carcinoma6 de célula89 renal63.
Derivados da platina: Maiores cuidados devem ser dispensados quando a vimblastina for administrada com outros antineoplásicos de ototoxicidade90 conhecida, como os derivados da platina.
Agentes antifúngicos azólicos (itraconazol, cetoconazol e voriconazol): Pode resultar no aumento da toxicidade19 da vimblastina (pode aumentar o risco de neurotoxicidade e íleo paralítico91). Deve ser evitada essa coadministração, se usada concomitantemente, a dosagem de vimblastina deve ser reduzida e sua toxicidade19 monitorada.
CUIDADOS DE ARMAZENAMENTO DO MEDICAMENTO
Cuidados de conservação
Este medicamento deve ser conservado sob refrigeração, entre 2°C e 8°C, protegido da luz. Este medicamento tem prazo de validade de 24 meses a partir da data de fabricação.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Faulblastina® não contém qualquer agente conservante. A fim de evitar a possibilidade de contaminação microbiana, a infusão deve ser iniciada logo após de sua preparação , e todos os resíduos devem ser descartados.
Características físicas e organolépticas do produto
Faulblastina® apresenta-se na forma de uma solução límpida, incolor a levemente amarelada e isenta de partículas visíveis.
Antes de usar, observe aspecto do medicamento.
TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS.
POSOLOGIA E MODO DE USAR
Faulblastina® deve ser administrada exclusivamente por via intravenosa (infusão). Faulblastina® deve ser administrada uma vez a cada sete dias. Em adultos, a posologia inicial é de uma dose única de 3,7 mg/m2 de superfície corporal, seguida da contagem de leucócitos52, para avaliação da sensibilidade individual do paciente ao sulfato de vimblastina. A dose nunca deve ser superior àquela que reduz a contagem de leucócitos52 para valores próximos de 3.000 células53/mm3. A dose recomendada para intervalos semanais deve seguir a tabela abaixo:
|
Doses |
Adultos |
Crianças |
|
1ª dose |
3,7 |
2,5 |
|
2ª dose |
5,5 |
3,75 |
|
3ª dose |
7,4 |
5,0 |
|
4ª dose |
9,25 |
6,25 |
|
5ª dose |
11,1 |
7,5 |
A dose poderá ser aumentada sem exceder os valores de 18,5 mg/m2 em adultos e 12,5 mg/m2 em crianças. A dose não deve ser aumentada após a contagem de leucócitos52 atingir valores de aproximadamente 3 x 109 células53/L (3.000 células53/mm3). Para a maioria dos pacientes adultos, a dose semanal máxima está entre 5,5–7,4 mg/m2 de superfície corporal. Poderá ocorrer leucopenia45 com o uso de doses de 3,7 mg/m2 de superfície corporal. Alguns pacientes poderão precisar de doses de 11,1 mg/m2 de superfície corporal, muito raramente de 18,5 mg/m2, não devendo esta dose ser excedida. Outra dose não deve ser administrada até que a contagem de leucócitos52 tenha retornado a valores de pelo menos 4.000 células53/mm3, mesmo que já tenham decorrido mais de sete dias após a última administração. Em alguns casos, a resposta terapêutica85 pode preceder o efeito leucopênico. Quando isto ocorrer, não há necessidade do aumento subsequente da dose.
Terapia de manutenção: A dose na terapia de manutenção deve ser administrada uma vez por semana, e será a dose imediatamente inferior àquela que reduz a contagem de leucócitos52 para valores próximos de 3.000 células53/mm3. Desta forma, o paciente estará recebendo uma dose máxima que não causa leucopenia45. A duração da terapia de manutenção depende da patologia92 que está sendo tratada e do agente antineoplásico usado em combinação. A terapia de manutenção no tratamento da doença de Hodgkin3 está sujeita a uma variedade de opções e de duração. O uso prolongado de quimioterápicos na terapia de manutenção envolve vários riscos, entre eles, a ocorrência de doenças infecciosas, esterilidade93 e a possibilidade de aparecimento de outros tipos de câncer24, devido à supressão do sistema imunológico94.
Pacientes com comprometimento hepático: Recomenda-se redução de 50% na dose de vimblastina quando a dosagem sérica de bilirrubina84 direta estiver acima de 3 mg/100 mL.
CUIDADOS DE ADMINISTRAÇÃO
Faulblastina® não deve ser administrada por via intramuscular, subcutânea50 ou intratecal. A administração intratecal pode ser fatal.
Antes de sua administração, as medicações para uso parenteral devem ser inspecionadas visualmente quanto à presença de partículas em suspensão e quanto à descoloração, sempre que a solução e o recipiente permitirem. Podem ser utilizadas seringas com ajuste “Luer-Lock” e de diâmetro interno largo, para minimizar a pressão e a formação eventual de aerossol. A formação de aerossol pode ser diminuída pela utilização de agulha com respiro durante a preparação. Faulblastina® deve ser administrada por infusão intravenosa. É extremamente importante certificar-se de que a agulha ou cateter esteja corretamente colocado na veia, antes que qualquer quantidade de vimblastina seja injetada. A ocorrência de extravasamento nos tecidos adjacentes durante a administração intravenosa poderá causar grande irritação, devendo ser evitada. Em caso de extravasamento, a administração deve ser imediatamente interrompida e a quantidade remanescente introduzida em outra veia. A administração deve durar cerca de um minuto. A administração prolongada (30 a 60 minutos) aumenta a frequência de irritações na veia e o risco de extravasamento. O medicamento não deve ser injetado nas extremidades com circulação95 comprometida ou potencialmente comprometida por neoplasma96, flebites ou varicosite devido à possibilidade de ocorrência de trombose48.
Todo o procedimento de manuseio e dispensação devem ser realizados por pessoal altamente treinado.
Qualquer manipulação deve ser realizada em capela de fluxo laminar, mediante material de proteção adequado como luvas, máscaras e vestimenta apropriada.
Evitar contato acidental da preparação citotóxica com os olhos97, pele21 ou mucosa98. Em caso de contato com pele21 e mucosas99, deve-se lavar imediatamente a pele21 com água e sabão ou enxaguar a mucosa98 com água em abundância.
Qualquer preparação citotóxica não deve ser manipulada por funcionárias que possam estar grávidas.
Todos os dispositivos utilizados na reconstituição ( agulhas, etc.) devem ser descartados de maneira adequada e cuidadosa.
Em caso de derramamento acidental, o acesso ao local deve ser restrito. O líquido derramado deve ser absorvido mediante toalhas absorventes próprias e a área contaminada limpa com uma solução de hipoclorito de sódio 10%. O local deve ser lavado com bastante água. O material utilizado deve ser descartado em contêineres e/ou sacos plásticos duplos, próprios para o descarte. O rótulo deve conter os seguintes dizeres: LIXO TÓXICO PARA INCINERAÇÃO. A incineração deve ser a 1100°C.
Preparação para administração intravenosa: Faulblastina® pode ser diluída em solução fisiológica100 0,9% ou soro101 glicosado 5%. Entretanto, não é recomendada a diluição em grandes volumes de diluente (100 a 250 mL) e não deve ser realizada infusão prolongada (mais que 30 a 60 minutos) tendo em vista o risco aumentado de extravasamento.
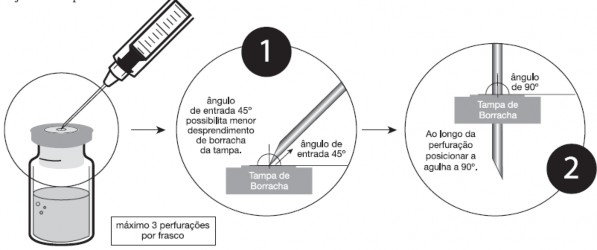
Recomendações de práticas seguras e adequadas para perfuração do frasco-ampola:
- Inserir a agulha de injeção35 de, no máximo, 1,20x40 mm de calibre;
- Apoiar o frasco-ampola firmemente na posição vertical;
- Perfurar a tampa de borracha de Faulblastina® dentro do círculo central demarcado, inserindo assepticamente a agulha a 45º com bisel voltado para cima e, ao longo da perfuração, posicioná-la a 90º;
- Evitar que as novas perfurações sejam no mesmo local;
- É recomendado não perfurar mais de 3 vezes a área demarcada (círculo central);
- A cada 3 perfurações com uma mesma agulha, substituí-la por uma nova.
O profissional da saúde1 deverá inspecionar cuidadosamente, antes de sua utilização, se a solução no interior do frasco- ampola está fluida, livre de fragmentos102 ou de alguma substância que possa comprometer a eficácia e a segurança do medicamento. Não é recomendado a utilização do produto ao verificar qualquer alteração que possa prejudicar a saúde1 do paciente.
REAÇÕES ADVERSAS
Antes da administração de vimblastina, o paciente deve ser alertado da possibilidade de sintomas14 indesejáveis. No geral, a incidência81 de reações adversas relativas ao uso de vimblastina é dose dependente. Com exceção de alopecia103, leucopenia45 e manifestações neurológicas, as reações adversas não persistem, geralmente, por mais de 24 horas. Os efeitos neurológicos não são comuns, mas quando ocorrem, tem frequência de mais de 24 horas. A reação adversa mais comum é leucopenia45, normalmente dose dependente.
Hematológicas: A leucopenia45 é uma reação adversa clinicamente esperada, sendo o número de leucócitos52 um fator importante para a terapia com este fármaco20 (dose limitante). Este quadro clínico não é permanente e os leucócitos52 retornam aos níveis normais após o período de indução da leucopenia45 pelo fármaco20. O período de maior supressão dos leucócitos52 pode ocorrer cinco a dez dias após o último dia de administração do fármaco20. A recuperação completa dos leucócitos52 ocorre entre 7-21 dias. Na terapia de manutenção com utilização de pequenas doses de vimblastina, a leucopenia45 pode não ser detectada. Apesar da contagem de plaquetas104 não se alterar significativamente, pacientes previamente tratados com radiação ou com outros medicamentos oncológicos podem apresentar trombocitopenia55. Quando não há tratamento prévio com quimioterapia11 ou radiação, raramente ocorre trombocitopenia55, mesmo no caso de significante leucopenia45 decorrente da vimblastina. Geralmente, o quadro de trombocitopenia55 é revertido em poucos dias. O efeito da vimblastina sobre as hemácias105 e hemoglobina106, geralmente não é significativo quando não há tratamento conjunto com outros fármacos e terapias, no entanto, os pacientes com doenças malignas podem apresentar anemia32 mesmo na ausência de qualquer terapia.
Dermatológicas: A ocorrência de alopecia103 é comum. Quando ocorre, geralmente não é total e, em alguns casos, os cabelos nascem novamente durante a terapia de manutenção. Também podem ocorrer fotossensibilidade, necrose107 epidérmica e erupções cutâneas108.
Gastrintestinais: Constipação109, anorexia110, náusea111, vômito112, dor abdominal, íleo paralítico91, ulceração113 da boca114, faringite115, diarreia116, enterocolite hemorrágica117, sangramento de úlcera péptica118 já existente e sangramento retal. Náuseas65 e vômitos66, geralmente podem ser controlados facilmente com agentes antieméticos119.
Neurológicas: Parestesia120, perda dos reflexos tendinosos profundos, neurite121 periférica, depressão mental, dor de cabeça122 e convulsões. O tratamento com alcaloides da vinca pode resultar raramente em dano vestibular123 e auditivo do oitavo nervo cranial. Manifestações incluem surdez parcial ou total, que podem ser temporárias ou permanentes, e dificuldades de equilíbrio incluindo desmaios, nistagmo124 e vertigem125. Cuidado particular deve ser tomado quando da terapia combinada12 de vimblastina com outros agentes conhecidamente ototóxicos, como os compostos com platina.
Cardiovasculares: Hipertensão126. Efeitos cardíacos como infarto do miocárdio127, angina128 pectoris e anormalidades transitórias do ECG relacionadas à isquemia129 coronária, foram reportados raramente. Casos inesperados de infarto do miocárdio127 e acidente vascular cerebral130 foram relatados em pacientes sob tratamento poliquimioterápico com vimblastina, bleomicina e cisplatina. Síndrome29 de Raynaud também foi relatada com essa combinação. Foram registrados casos de neuropatia131 autônoma cardiovascular com variações anormais da frequência cardíaca e pressão arterial132 com a utilização da vimblastina.
Pulmonares: Dano pulmonar difuso, caracterizado por infiltração intersticial133 e efusão134 pleural, resultando em dificuldade respiratória, broncoespasmos135 e tosse, foram descritos após o tratamento com vimblastina em associação com a mitomicina. A reação adversa pode ocorrer minutos ou várias horas após administração da vimblastina ou até duas semanas após a dose da mitomicina. Nos casos de dispneia57 progressiva é necessário o tratamento crônico136 e a vimblastina não deve ser readministrada. Fibrose137 intersticial133, hiperplasia33 alveolar e septal e edema138 intra-alveolar foram observados em exames histológicos139.
Renal63/genitourinária: Retenção urinária140 relacionada à neuropatia autonômica141. Aspermia, oligospermia, reversíveis com duração típica de 6-24 meses.
Reação no local da aplicação: O extravasamento durante administração pode levar à celulite142 e flebite143, e se a quantidade extravasada for grande, poderá ocorrer necrose107 local. Para aliviar a irritação do tecido144 afetado pelo extravasamento pode ser administrada localmente injeção35 de hialuronidase e aquecimento moderado na região afetada, a fim de auxiliar a dispersão do fármaco20 e minimização do desconforto.
Outras reações: Dores musculares, nos ossos, na mandíbula145, e no local do tumor82; mal-estar, fraqueza, tonturas146, vesiculação da pele21, hipertensão126 e síndrome29 de Raynaud foram relatados durante a terapia com vimblastina combinada à bleomicina e cisplatina no tratamento do câncer24 do testículo7. Síndrome29 de secreção inapropriada do hormônio147 antidiurético foi relatada com doses de vimblastina maiores que as recomendadas.
Em casos de eventos adversos, notifique pelo Sistema VigiMed, disponível no Portal da Anvisa.
SUPERDOSE
Sintomas14 clínicos: Os sintomas14 de superdose parecem extensões da ação farmacológica da vimblastina. Como a principal via de excreção da vimblastina é através do sistema biliar, a toxicidade19 do fármaco20 poderá ser potencializada nos pacientes com insuficiência hepática51. Os possíveis sintomas14 de toxicidade19 são os listados no item “9. Reações adversas”.
Monitoramento: O tratamento sintomático148 e de suporte deve ser instituído. Deve ser dada atenção especial à prevenção e ao tratamento de possíveis infecções28 secundárias e à leucopenia45 persistente.
Recomendações: Prevenção de efeitos adversos da síndrome29 de secreção inapropriada do hormônio147 antidiurético; administração de um anticonvulsivante; prevenção de íleo adinâmico149; monitoramento do sistema cardiovascular150; avaliação hematológica diária para orientar solicitações de transfusões e avaliação do risco de infecção46. O principal efeito de doses excessivas de vimblastina é a mielossupressão. Não há informações sobre a eficácia da diálise151 ou de colestiramina para o tratamento de superdose. O sulfato de vimblastina no estado seco é absorvido de forma irregular e imprevisível pelo trato gastrintestinal após a administração oral. A absorção da solução oral não foi estudada. Caso a vimblastina tenha sido administrada por via oral por engano, deve ser administrada uma suspensão de carvão ativado com água e posteriormente um laxante152. Não há informações sobre o uso de colestiramina nesta situação. Os sintomas14 de superdose são proporcionais à quantidade de vimblastina. A dose de vimblastina que resulta em trombocitopenia55, leucopenia45 e depressão da medula153 ou dos precursores da medula153 deve ser considerada como situação de risco à vida. As infusões consecutivas diárias podem ser mais tóxicas do que a administração da mesma quantidade total por infusão intravenosa rápida, a superdose ocorre durante o uso prolongado. Em camundongos a dose letal média é de 10 mg/kg do peso, em ratos é 2,9 mg/kg. A dose oral letal em ratos é 7 mg/kg. No caso de superdose, deve ser realizado monitoramento rigoroso e a manutenção dos sinais vitais154, determinação de gasometria e eletrólitos155 séricos, entre outros exames. A absorção do fármaco20 pelo trato gastrintestinal pode ser reduzida com a administração de carvão ativado, mas em alguns casos a indução do vômito112 ou lavagem gástrica156 são mais efetivas. Doses seguidas de carvão ativado podem acelerar a eliminação de alguns fármacos. A segurança das vias aéreas do paciente durante o esvaziamento gástrico ou administração do carvão ativado devem ser observadas.
Em caso de intoxicação, ligue para 0800 722 6001 se você precisar de mais orientações.
DIZERES LEGAIS
USO RESTRITO A HOSPITAIS
VENDA SOB PRESCRIÇÃO MÉDICA
MS nº: 1.0033.0130
Farmacêutica Responsável: Cintia Delphino de Andrade – CRF-SP nº 25.125
Registrado por:
Libbs Farmacêutica Ltda.
Rua Josef Kryss, 250 – São Paulo – SP
CNPJ: 61.230.314/0001-75
Fabricado por:
Libbs Farmacêutica Ltda.
Rua Alberto Correia Francfort, 88 – Embu das Artes– SP
Indústria Brasileira
SAC 0800 0135044