

Kyprolis (Bula do profissional de saúde)
AMGEN BIOTECNOLOGIA DO BRASIL LTDA.
IDENTIFICAÇÃO DO MEDICAMENTO
Kyprolis®
carfilzomibe
Injetável 60 mg/frasco
FORMA FARMACÊUTICA E APRESENTAÇÃO:
Pó liofilizado1 para solução injetável
Embalagem com 1 frasco-ampola
USO INTRAVENOSO
USO ADULTO
COMPOSIÇÃO:
Cada frasco-ampola de Kyprolis® contém:
| carfilzomibe* | 60 mg |
| excipiente q.s.p. | 1 frasco-ampola |
Excipientes: sulfobutileter de beta-ciclodextrina, ácido cítrico anidro, hidróxido de sódio
* Após reconstituição, cada mL contém 2 mg de carfilzomibe.
INFORMAÇÕES TÉCNICAS AOS PROFISSIONAIS DE SAÚDE2
INDICAÇÕES
Kyprolis em combinação com daratumumabe e dexametasona, lenalidomida e dexametasona, ou com dexametasona isolada é indicado para o tratamento de pacientes com mieloma3 múltiplo recidivado que receberam de uma a três terapias prévias.
Kyprolis, como um agente isolado, está indicado para o tratamento de pacientes com mieloma3 múltiplo recidivado ou refratário que tenham recebido pelo menos duas terapias prévias que incluíram bortezomibe e um agente imunomodulador.
RESULTADOS DE EFICÁCIA
Resumo das informações de eficácia clínica
Em combinação com lenalidomida e dexametasona para o tratamento de pacientes com mieloma3 múltiplo (recidivado)
Estudo PX-171-009
A segurança e a eficácia de Kyprolis foram avaliadas em um estudo randomizado4, em regime aberto e multicêntrico que incluiu 792 pacientes com mieloma3 múltiplo recidivado que haviam recebido de 1 a 3 terapias prévias (mediana de 2), o estudo avaliou a combinação de Kyprolis com lenalidomida e dexametasona versus lenalidomida e dexametasona isoladamente, randomizados 1:1. Os pacientes que tinham as seguintes características foram excluídos do estudo: clearance de creatinina5 < 50 mL/min, insuficiência cardíaca congestiva6 Classe funcional III ou IV da New York Heart Association ou infarto do miocárdio7 nos 4 meses anteriores ao estudo. O tratamento com Kyprolis foi administrado por um máximo de 18 ciclos, a menos que fosse descontinuado anteriormente por progressão da doença ou toxicidade8 inaceitável. A administração de lenalidomida e dexametasona poderia continuar até progressão da doença ou toxicidade8 inaceitável.
O estudo incluiu uma população representativa de mieloma3 múltiplo recidivado; as características basais, inclusive aquelas relacionadas à doença, foram bem balanceadas entre os dois braços de tratamento.
Os pacientes no braço Kyprolis, lenalidomida e dexametasona (KRd) apresentaram melhor sobrevida9 livre de progressão (SLP) em comparação aos pacientes no braço lenalidomida e dexametasona (Rd) (Hazard Ratio [HR] = 0,69; com valor de p unicaudal < 0,0001). Este achado representa uma melhora de 45% na SLP ou uma redução de 31% no risco de evento, conforme determinado pelo uso do critério de resposta objetiva padrão do International Myeloma Working Group (IMWG)/European Blood and Marrow Transplantation (EBMT) por um Comitê de Revisão Independente (Independent Review Committee, IRC).
A SLP mediana foi de 26,3 meses (IC 95%: 23,3 a 30,5 meses) no braço KRd versus 17,6 meses (IC 95%: 15,0 a 20,6 meses) no braço Rd, uma diferença na mediana de 8,7 meses (vide Figura 1). O benefício do KRd na SLP foi consistentemente observado em todos os subgrupos (vide Figura 2).
Uma análise prévia de sobrevida9 global (SG) foi realizada após 246 mortes no braço KRd e 267 mortes no braço Rd. A mediana de acompanhamento foi de aproximadamente 67 meses. Uma vantagem estatisticamente significante na SG foi observada em pacientes no braço KRd em comparação com pacientes no braço Rd. Os pacientes no braço KRd tiveram uma redução de 21% no risco de morte em comparação com aqueles no braço Rd (HR = 0,79; IC 95%: 0,67, 0,95; valor p = 0,0045). A mediana da SG melhorou em 7,9 meses em pacientes do braço KRd em comparação com os do braço Rd (vide Tabela 1 e Figura 3).
A taxa de resposta global (TRG) foi mais alta no braço KRd versus o braço Rd (87,1% versus 66,7%; valor de p unicaudal < 0,0001). A taxa e a profundidade da resposta foram maiores no braço KRd versus o braço Rd, resposta completa (RC) ou maior foi de 31,8% no braço KRd (incluindo 14,1% de resposta completa rigorosa [RCr]) versus 9,3% de RC ou maior no braço Rd (incluindo 4,3% de RCr). Os pacientes tratados com KRd relataram status de saúde2 global melhorado, com escores mais elevados de Status de Saúde2 Global/Qualidade de Vida (QV) comparados com os
pacientes tratados com Rd ao longo de 18 ciclos de tratamento (valor de p unicaudal = 0,0001) medidos pelo EORTC QLQ-C30, um instrumento validado em mieloma3 múltiplo (vide Figura 4).
Tabela 1: Resumo da análise de eficácia
|
|
Terapia combinada10 KRd |
|
|
Estudo PX-171-009 |
||
|
Braço KRda (N = 396) |
Braço Rda (N = 396) |
|
|
SLP meses, mediana (IC 95%) |
26,3 (23,3; 30,5) |
17,6 (15,0; 20,6) |
|
HR (IC 95%); valor de p unicaudalb |
0,69 (0,57; 0,83); < 0,0001 |
|
|
SG meses, mediana (IC 95%) |
48,3 (42,4, 52,8) |
40,4 (33,6, 44,4) |
|
HR (IC 95%); valor de p unicaudal |
0,79 (0,67; 0,95); 0,0045 |
|
|
TRG n (%) |
345 (87,1) |
264 (66,7) |
|
RCr |
56 (14,1) |
17 (4,3) |
|
RC |
70 (17,7) |
20 (5,1) |
|
RPMB |
151 (38,1) |
123 (31,1) |
|
RP |
68 (17,2) |
104 (26,3) |
|
IC 95% ou TRG |
83,4; 90,3 |
61,8; 71,3 |
|
valor de p unicaudal |
< 0,0001 |
|
|
DR meses, mediana (IC 95%) |
28,6 (24,9; 31,3) |
21,2 (16,7; 25,8) |
|
TR meses, mediana (min, máx)c |
1 (1; 14) |
1 (1; 16) |
|
TBC n (%) |
360 (90,9) |
302 (76,3) |
|
IC 95% de TBC |
87,6; 93,6 |
71,8; 80,4 |
|
DBC meses, mediana (IC 95%) |
28,3 (24,3; 30,5) |
20,3 (16,6; 24,0) |
|
TCD n (%) |
367 (92,7) |
345 (87,1) |
|
IC 95% de TCD |
89,7; 95,0 |
83,4; 90,3 |
TBC = taxa de benefício clínico; IC = intervalo de confiança; RC = resposta completa; DBC = duração do benefício clínico; TCD = taxa de controle da doença; DR = duração da resposta; EBMT = European Blood and Marrow Transplantation; HR = hazard ratio; IMWG = International Myeloma Working Group; KRd = Kyprolis, lenalidomida e dexametasona; SG = sobrevida9 global; TRG = taxa de resposta global; SLP = sobrevida9 livre de progressão; RP = resposta parcial; Rd = lenalidomida e dexametasona; RCr = resposta completa rigorosa; TR = tempo para resposta; RPMB = resposta parcial muito boa
a Determinado por um Comitê de Revisão Independente usando um critério de resposta objetiva padrão do IMWG/EBMT.
b Estatisticamente significante.
c Esta é uma amostra mediana, não uma mediana de Kaplan-Meier.
Figura 1: Curva de Kaplan-Meier da sobrevida9 livre de progressãoa
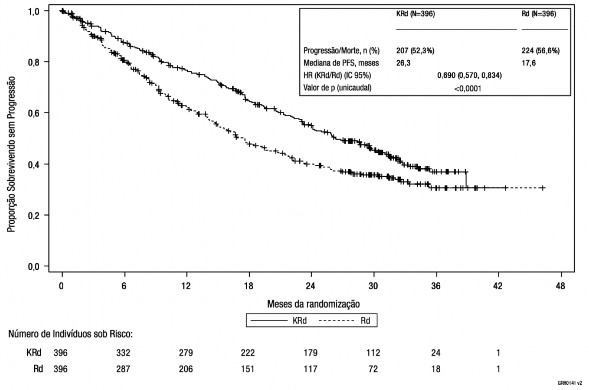
IC = intervalo de confiança; EBMT = European Blood and Marrow Transplantation; HR = hazard ratio; IMWG = International Myeloma Working Group; KRd = Kyprolis, lenalidomida e dexametasona; SLP = sobrevida9 livre de progressão; Rd = lenalidomida e dexametasona Nota: A resposta e os resultados PD foram determinados usando o critério de resposta objetiva padrão do IMWG/EBMT.
a Estudo PX-171-009
Figura 2: Análises de subgrupo da sobrevida9 livre de progressão determinada por um Comitê de Revisão Independente (subgrupos selecionados)
População com intenção de tratamento
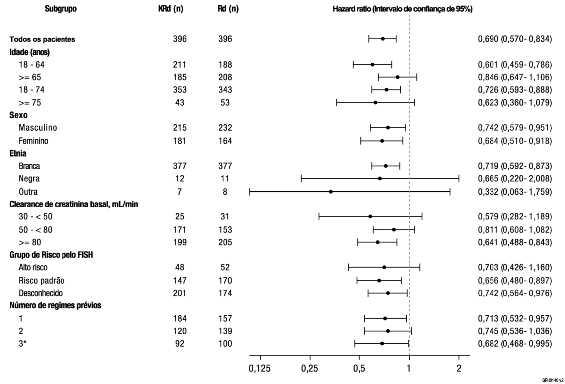
KRd = Kyprolis, lenalidomida e dexametasona; FISH = hibridização fluorescente in situ11; Rd = lenalidomida e dexametasona
* Incluindo 2 pacientes com 4 regimes anteriores.
Figura 3: Curva de Kaplan-Meier da sobrevida9 globala
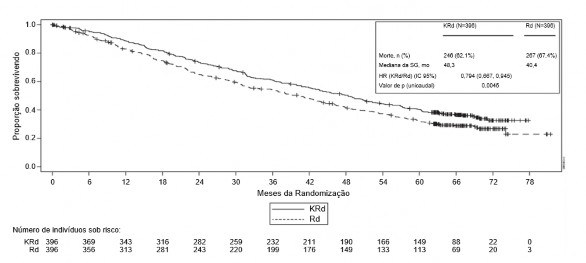
IC = intervalo de confiança; HR = hazard ratio; KRd = Kyprolis, lenalidomida e dexametasona; SG = sobrevida9 global; Rd = lenalidomida e dexametasona
a Estudo PX-171-009
Figura 4: Estudo PX-171-009 QV global
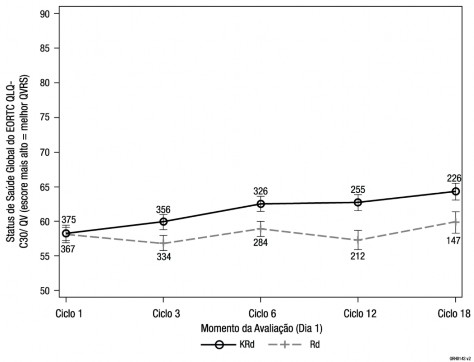
EORTC QLQ-C30 = European Organization for Research and Treatment of Cancer12 Quality of Life Questionnaire Core Module; QVRS = qualidade de vida relacionada à saúde2; KRd = Kyprolis, lenalidomida e dexametasona; MMMR = modelo misto para medidas repetidas; QV = qualidade de vida; Rd = lenalidomida e dexametasona
Nota: um valor de p unicaudal de 0,0001 para o efeito de tratamento global foi obtido, com base em um teste tipo 3 para efeitos fixados (MMMR).
Kyprolis em combinação com dexametasona para o tratamento de pacientes com mieloma3 múltiplo (recidivado) Estudo 2011-003
A segurança e a eficácia de Kyprolis 56 mg/m2 duas vezes por semana foram avaliadas em um estudo de Fase 3, randomizado13, aberto e multicêntrico de Kyprolis mais dexametasona (Kd) versus bortezomibe mais dexametasona (Vd) em pacientes com múltiplo mieloma3 refratário ou recidivado que receberam de 1 a 3 linhas prévias de tratamento. Um total de 929 pacientes foi incluído e randomizado13 (464 no braço Kd; 465 no braço Vd). Pacientes foram excluídos se apresentaram menos que RP em todos os regimes anteriores; clearance de creatinina5 < 15 mL/min; transaminase hepática14 ≥ 3 x limite superior normal (ULN); ou fração de ejeção ventricular esquerda < 40% ou outras condições cardíacas significativas. Este estudo avaliou Kyprolis em uma dose inicial de 20 mg/m2, que foi aumentada para 56 mg/m2 no Ciclo 1, Dia 8, administrada duas vezes por semana como uma infusão de 30 minutos até progressão da doença ou toxicidade8 inaceitável.
O desfecho primário do estudo foi a SLP determinada por um Comitê de Revisão Independente (IRC) usando os critérios de resposta do International Myeloma Working Group (IMWG). O estudo mostrou melhora significativa na SLP para os pacientes do braço Kd em relação aos do braço Vd (HR: 0,53, IC 95%: 0,44; 0,65 [valor de p < 0,0001]), com uma diferença na mediana da SLP de 9,3 meses (18,7 meses no braço Kd [IC 95%: 15,6; NE] versus 9,4 meses no braço Vd [IC 95%: 8,4; 10,4]) (vide Figura 5).
Figura 5: Curva de Kaplan-Meier da sobrevida9 livre de progressão determinada por um Comitê de Revisão Independente (população com intenção de tratamento)a
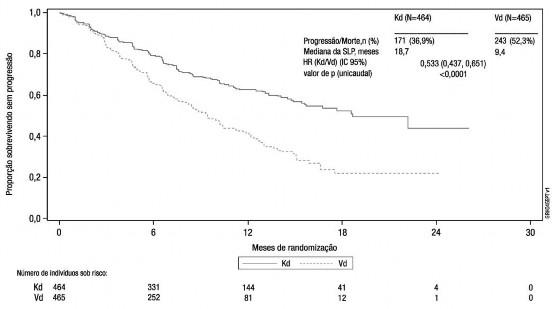
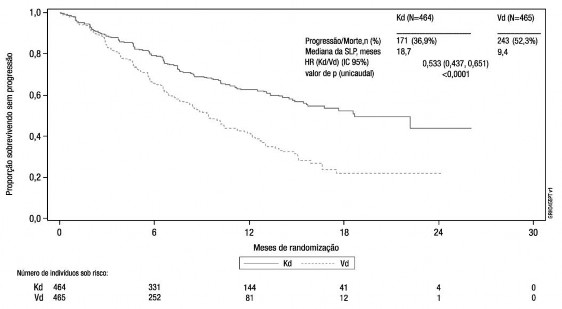
HR = hazard ratio; Kd = HR = hazard ratio; Kd = Kyprolis mais dexametasona; SLP = sobrevida9 livre de progressão;
Vd = bortezomibe e dexametasona
a Estudo 2011-003
Figura 6: Análises de subgrupo da sobrevida9 livre de progressão determinada por um Comitê de Revisão Independente (subgrupos selecionados) população com intenção de tratamento
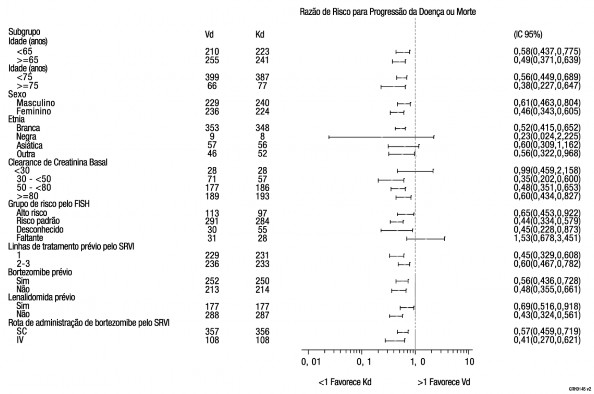
Os desfechos secundários chaves foram a SG, TRG e incidência15 de eventos de neuropatia periférica16 (Grau ≥ 2).
A análise de SG pré-planejada foi realizada após 189 mortes no braço Kd e 209 mortes no braço Vd. A mediana do acompanhamento foi de aproximadamente 37 meses. Uma vantagem estatisticamente significativa na SG foi observada em pacientes no braço Kd em comparação aos pacientes no braço Vd (HR = 0,791; IC 95%: 0,648, 0,964; valor de p = 0,010) (vide Tabela 2 e Figura 7).
A TRG foi de 76,9% (IC 95%: 72,8; 80,7) para os pacientes no braço Kd e 62,6% (IC 95%: 58,0; 67,0) para os pacientes no braço Vd (odds ratio = 2,032; IC 95%: 1,519; 2,718), (valor de p < 0,0001) (vide Tabela 2).
Figura 7: Curva de Kaplan-Meier da sobrevida9 globala
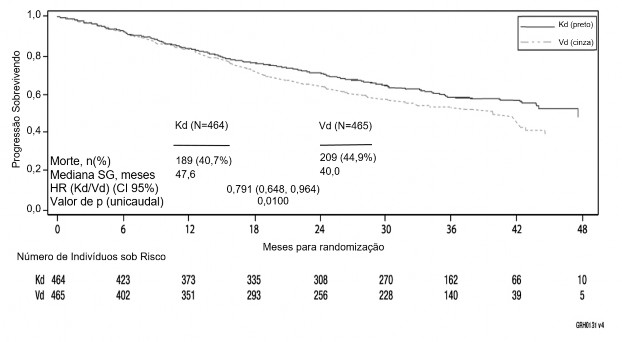
IC = intervalo de confiança; HR = hazard ratio; Kd = Kyprolis mais dexametasona; SG = sobrevida9 global; Vd = bortezomibe mais dexametasona
a Estudo 2011-003
No momento da análise de SG pré-planejada, a incidência15 de eventos de neuropatia periférica16 Grau ≥ 2 no braço Kd (taxa de evento de 6,9% [IC 95%: 4,6; 9,2]) foi aproximadamente 5 vezes menor que no braço Vd (taxa de evento de 34,9% [IC 95%: 30,5; 39,2]) (odds ratio = 0,139; IC 95%: 0,092; 0,208; valor de p < 0,0001).
Tabela 2: Resumo dos resultados-chave (População com intenção de tratamento)
|
|
Braço Kd (N = 464) |
Braço Vd (N = 465) |
|
Sobrevida9 livre de progressão (meses)a |
|
|
|
Mediana (IC 95%) |
18,7 (15,6; —) |
9,4 (8,4; 10,4) |
|
Valor de p (unicaudal) |
< 0,0001 |
|
|
Hazard Ratio (Kd/Vd) (IC 95%) |
0,533 (0,44; 0,65) |
|
|
Sobrevida9 global (meses) |
|
|
|
Mediana (IC 95%) |
47,6 (42,5, —) |
40,0 (32,6, 42,3) |
|
Valor de p (unicaudal) |
0,010 |
|
|
Hazard Ratio (Kd/Vd) (IC 95%) |
0,791 (0,648, 0,964) |
|
|
TRGa |
|
|
|
N com Respostab |
357 |
291 |
|
TRG (IC 95%) |
76,9 (72,8; 80,7) |
62,6 (58,0; 67,0) |
|
Valor de p (unicaudal) |
< 0,0001 |
|
|
Odds Ratio (Kd/Vd) (IC 95%) |
2,032 (1,519; 2,718) |
|
|
≥ RCc |
|
|
|
N com ≥ RC |
58 |
29 |
|
RC ou Melhor (IC 95%) |
12,5 (9,6; 15,9) |
6,2 (4,2; 8,8) |
|
Valor de p (unicaudal) |
0,0005 |
|
|
Odds Ratio (Kd/Vd) (IC 95%) |
2,140 (1,344; 3,408) |
|
|
≥ RPMBc |
|
|
|
N com ≥ RPMB |
252 |
133 |
|
RPMB ou Melhor (IC 95%) |
54,3 (49,7; 58,9) |
28,6 (24,5; 32,9) |
|
Valor de p (unicaudal) |
< 0,0001 |
|
|
Odds Ratio (Kd/Vd) (IC 95%) |
3,063 (2,322; 4,040) |
|
|
DR (meses)a |
||
|
Mediana (IC 95%) |
21,3 (21,3; —) |
10,4 (9,3; 13,9) |
|
Eventos de neuropatia periférica16 Grau 2+d |
463e |
456e |
|
N (%) com NP |
32 (6,9) |
159 (34,9) |
|
IC 95% |
4,6, 9,2 |
30,5, 39,2 |
|
Valor de p (unicaudal) |
< 0,0001 |
|
|
Odds Ratio (Kd/Vd) (IC 95%) |
0,139 (0,092; 0,208) |
|
IC = intervalo de confiança; RC = resposta completa; DR = duração da resposta; Kd = Kyprolis mais dexametasona; TRG = taxa de resposta global; NP = neuropatia periférica16; Vd = bortezomibe e dexametasona; RPMB = resposta parcial muito boa
a Esses desfechos foram determinados por um Comitê de Revisão Independente.
b Resposta global é definida como alcançar uma resposta maior ou igual a RP. A análise da duração da resposta inclui pacientes alcançando apenas resposta global.
c Os valores de p apresentados são fornecidos apenas para fins descritivos, pois eles não são desfechos secundários pré- especificados com testes estatísticos.
d A análise de Grau 2 ou mais de eventos de NP é baseada na População de Segurança, para a qual o tamanho da amostra está listado para cada braço.
e A população de segurança foi usada para determinar os eventos de NP.
Estudo 20140355
A segurança e a eficácia de Kyprolis 70 mg/m2 uma vez por semana foram avaliadas em um estudo Fase 3 randomizado13, aberto, multicêntrico de Kd 70 mg/m2 uma vez por semana versus Kd 27 mg/m2 duas vezes por semana em pacientes com mieloma3 múltiplo refratário e recidivado que receberam de 2 a 3 linhas prévias de tratamento. Um total de 478 pacientes foi incluído e randomizado13 (240 no braço Kd 70 mg/m2; 238 no braço Kd 27 mg/m2). Este estudo avaliou Kyprolis em uma dose inicial de 20 mg/m2 que foi aumentada para 70 mg/m2 no Ciclo 1, Dia 8, administrado uma vez por semana com uma infusão de 30 minutos até a progressão da doença ou toxicidade8 inaceitável.
O desfecho primário do estudo foi a SLP. O estudo mostrou uma maior duração da SLP para os pacientes tratados com Kd 70 mg/m2 uma vez por semana em relação aos tratados com Kd 27 mg/m2 duas vezes por semana ( HR: 0,68, IC 95%: 0,54,0,87 [valor de p < 0,00010]), com uma diferença na mediana da SLP de 3,7 meses (11,3 meses no braço Kd 70 mg/m2 uma vez por semana versus 7,6 meses no braço Kd 20/27 mg/m2 duas vezes por semana) (vide Figura 8).
Figura 8: Curva de Kaplan-Meier da Sobrevida9 Livre de Progressão (População com intenção de tratamento)a,b
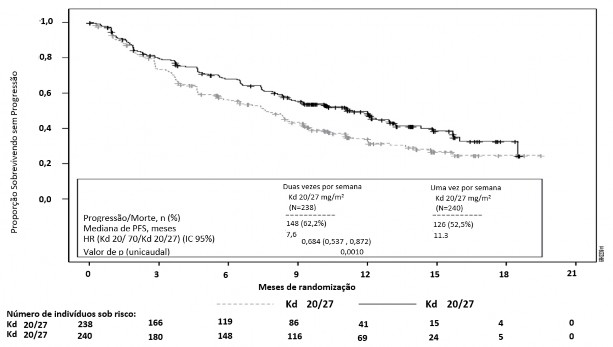
IC = intervalo de confiança; HR = hazard ratio; Kd = Kyprolis mais dexametasona; SLP = sobrevida9 livre de progressão
a Estudo 20140355
b Determinado pelo Comitê de Revisão Independente
Os desfechos-chaves secundários foram TRG e SG. A TRG foi de 63,8% (IC 95%: 57,3, 69,8) para pacientes17 no braço Kd 70 mg/m2 uma vez por semana e 41,2% (IC 95%: 34,9, 47,7) para pacientes17 no braço Kd 27 mg/m2 duas vezes por semana (odds ratio = 2,53; IC 95% 1,75, 3,66; valor p < 0,0001) (vide Tabela 3).
No momento da análise primária da SLP, o HR para SLP foi de 0,80 (IC 95%: 0,56, 1,14; p unicaudal = 0,1070).
Tabela 3: Resumo dos resultados-chave (População com intenção de tratamento)
|
|
Estudo Fase 1/2 Kd 70 mg/m2 |
Estudo Fase 3 |
|
|
Braço Kd |
Braço Kd 27 mg/m2 |
||
|
Sobrevida9 livre de progressão (meses) |
|||
|
Mediana (IC 95%) |
16,2 (10,2, 21,0) |
11,3 (8,6, 13,2) |
7,6 (5,7, 8,7) |
|
valor de p (unicaudal) |
- |
0,0010 |
|
|
Hazard Ratio (Kd 70 mg/m2 uma vez por semana/Kd 27 mg/m2 duas vezes por semana) (IC 95%) |
- |
0,68 (0,54, 0,87) |
|
|
TRG |
|||
|
N com Resposta Completab |
80 |
153 |
98 |
|
TRG (IC 95%) |
76,9 (67,6, 84,6) |
63,8 (57,3, 69,8) |
41,2 (34,9, 47,7) |
|
valor de p (unicaudal) |
- |
< 0.0001 |
|
|
Odds Ratio (Kd 70 mg/m2 Uma vez por semana/Kd 27 mg/m2 Duas vezes por semana) (IC 95%) |
- |
2,53 (1,75, 3,66) |
|
IC = intervalo de confiança; Kd = Kyprolis/dexametasona; TRG = taxa de resposta global
a Determinado pelo Comitê de Revisão Independente
b Resposta global é definida como o atingimento da melhor resposta global de RP, RPMB, RC ou RCr ou acima.
– Estudo 20130403
A segurança e eficácia de Kyprolis 70 mg/m2 uma vez por semana foram avaliadas num estudo clínico de fase 1/2, multicêntrico e aberto. A dose máxima tolerada (DMT) de Kd 70 mg/m2 uma vez por semana foi determinada na Fase 1, e a Fase 2 incluiu pacientes com mieloma3 múltiplo recidivado ou refratário que receberam 1 a 3 linhas prévias de tratamento. Houve um total de 104 pacientes no grupo Kd 70 mg/m2 uma vez por semana em ambas as fases combinadas. Os pacientes foram excluídos do estudo quando apresentavam: taxas de depuração de creatinina5 <30 mL/min, insuficiência cardíaca congestiva6 classe III a IV da segundo a New York Heart Association ou infarto do miocárdio7 nos últimos 6 meses.
O desfecho primário foi a TRG definida como a proporção de indivíduos que obtiveram uma resposta parcial confirmada [RP] ou melhor. A TRG (resposta completa [RC] + muito boa resposta parcial RPMB] + resposta parcial [RP]) foi de 76,9% (95% CI: 67,6, 84,6) (N = 104). A duração mediana da resposta (DOR) foi de 18 meses (IC 95%: 14,5, 21,9). A eficácia de Kd uma vez por semana é resumida na Tabela 3.
Kyprolis como um agente isolado no mieloma3 múltiplo
Kyprolis em monoterapia foi avaliado em dois estudos de mieloma3 múltiplo recidivado e refratário.
– Estudo PX-171-003 A1
A segurança e a eficácia de Kyprolis foram avaliadas em um estudo clínico de braço único e multicêntrico. Um total de 266 pacientes com mieloma3 múltiplo recidivado e refratário que haviam recebido pelo menos duas terapias prévias (incluindo bortezomibe e talidomida e/ou lenalidomida) foram incluídos. Os pacientes que tinham as seguintes características foram excluídos do estudo: taxas de clearance de creatinina5 < 30 mL/min, insuficiência cardíaca congestiva6 Classe funcional III ou IV da New York Heart Association ou infarto do miocárdio7 nos 6 meses anteriores ao estudo.
Kyprolis foi administrado por via intravenosa (IV) em um período de 2 a 10 minutos em dois dias consecutivos a cada semana, durante três semanas, seguidas por um período de descanso de 12 dias (ciclo de tratamento de 28 dias), até a progressão da doença, toxicidade8 inaceitável ou por um máximo de 12 ciclos. Os pacientes receberam 20 mg/m2 em cada dose no Ciclo 1 e 27 mg/m2 nos ciclos subsequentes. Para reduzir a incidência15 e a gravidade da febre18, tremores, calafrios19, dispneia20, mialgia21 e artralgia22, dexametasona 4 mg por via oral ou por infusão IV foi administrada antes de cada dose de Kyprolis durante o primeiro ciclo e antes de todas as doses de Kyprolis durante o primeiro ciclo de escalonamento da dose (27 mg/m2). A pré-medicação com dexametasona (4 mg por via oral ou IV) era reiniciada se esses sintomas23 reaparecessem durante os ciclos subsequentes.
O desfecho primário foi a taxa de resposta global (TRG) determinada pela avaliação de um Comitê de Revisão Independente usando os critérios do IMWG/EBMT. A TRG (resposta completa rigorosa [RCr] + resposta completa [RC] + resposta parcial muito boa [RPMB] + resposta parcial [RP]) foi de 22,9% (IC 95%: 18,0; 28,5) (N = 266). A mediana da duração da resposta (DR) foi de 7,8 meses (IC 95%: 5,6; 9,2).
– Estudo PX-171-011
O estudo PX-171-011 foi um estudo de Fase 3 com 315 pacientes que haviam recebido pelo menos três terapias prévias, que avaliou a monoterapia com Kyprolis versus um braço de comparador ativo (referido no protocolo como Melhor Tratamento de Suporte [MTS]) com um protocolo metronômico com corticosteroides em baixa dose (84 mg/ciclo de 28 dias) e ciclofosfamida opcional (1.400 mg/ciclo de 28 dias, que foi usado por 91,8% dos pacientes randomizados para o braço comparador). Os pacientes que tinham as seguintes características foram excluídos do estudo: taxas de clearance de creatinina5 < 15 mL/min, insuficiência cardíaca congestiva6 Classe funcional III ou IV da New York Heart Association ou infarto do miocárdio7 nos 3 meses anteriores ao estudo.
Os pacientes incluídos no Estudo PX-171-011 haviam sido previamente tratados de maneira mais agressiva e tinham pior função de órgãos e da medula24 em comparação àqueles incluídos no Estudo PX-171-003A1.
O estudo não atingiu seu desfecho primário de eficácia de prolongamento da SG com a monoterapia com Kyprolis em comparação ao controle. O HR foi de 0,975 (IC 95%: 0,760; 1,249); com um valor de p unicaudal de 0,4172. A SG mediana foi de 10,2 meses (IC 95%: 8,4; 14,4 meses) no braço de Kyprolis versus 10,0 meses (IC 95%: 7,7; 12,0 meses) no braço comparador.
A SLP mediana foi de 3,7 meses no braço de Kyprolis versus 3,3 meses no braço comparador. O HR foi de 1,091 [IC 95%: 0,843; 1,410]; com valor de p unicaudal de 0,2479. A TRG no braço Kyprolis foi de 19,1% em comparação a 11,4% no braço comparador.
Kyprolis em combinação com dexametasona e daratumumabe em mieloma3 múltiplo
A segurança da administração de 20/56 mg/m2 de Kyprolis duas vezes por semana em combinação com daratumumabe e dexametasona (KdD) foi avaliada em um estudo fase 3, randomizado13, aberto (CANDOR). Além disso, a segurança da administração de 20/70 mg/m2 de Kyprolis uma vez por semana em combinação com daratumumabe e dexametasona foi avaliada em um estudo não randomizado13, aberto, multi coorte25 (EQUULEUS). CANDOR foi um estudo randomizado4, aberto, multicêntrico e de superioridade de Kyprolis com daratumumabe e dexametasona (KdD) duas vezes por semana (20/56 mg/m2) comparado à administração de Kyprolis mais dexametasona (Kd) duas vezes por semana (20/56 mg/m2) em pacientes com mieloma3 múltiplo recidivado ou refratário que receberam de 1 a 3 linhas de terapia prévia. Os pacientes foram excluídos caso apresentassem asma26 persistente moderada ou severa conhecida nos últimos 2 anos, doença pulmonar obstrutiva crônica (DPOC) conhecida com FEV1 < 50% de insuficiência cardíaca congestiva6 ativa e normal prevista. Um total de 466 pacientes foram incluídos e randomizados em uma proporção 2:1 (312 no grupo KdD e 154 no grupo Kd). A randomização foi estratificada pelo ISS na triagem (estágio 1 ou 2 vs estágio 3), exposição anterior a inibidor de proteassoma (sim vs não), número de linhas prévias de terapia (1 vs ≥ 2) e terapia prévia com anticorpo27 CD38 (antígeno28 de diferenciação de cluster 38) (sim vs não).
Nos grupos KdD e Kd, o Kyprolis foi administrado a uma dose inicial de 20 mg/m2, que foi aumentada para 56 mg/m2 no Ciclo 1, Dia 8 em diante. O Kyprolis foi administrado duas vezes por semana como uma infusão de 30 minutos nos Dias 1, 2, 8, 9, 15 e 16 de cada ciclo de 28 dias. No grupo KdD, o daratumumabe foi administrado em uma dose de 16 mg/kg no Ciclo 1 dividida em 8 mg/kg nos Dias 1 e 2. Em seguida, o daratumumabe foi administrado a 16 mg/kg uma vez por semana nos Dias 8, 15 e 22 do Ciclo 1 e nos Dias 1, 8, 15 e 22 do Ciclo 2 e depois a cada duas semanas por 4 ciclos (ciclos 3 a 6) e, então, a cada 4 semanas nos ciclos restantes ou até a progressão da doença. Nos dois grupos, a dexametasona 20 mg foi administrada nos Dias 1, 2, 8, 9, 15 e 16 e depois 40 mg via oral ou intravenosa no Dia 22 de cada ciclo de 28 dias. Os dados demográficos e as características basais estão resumidos na Tabela 4.
Tabela 4: Dados demográficos e características basais
|
Características |
Grupo KdD (N = 312) |
Grupo Kd (N = 154) |
|
Idade na randomização (anos) |
||
|
Mediana (mín, máx) |
64 (29,84) |
65 (35,83) |
|
Grupo etário – n (%) |
|
|
|
18 – 64 anos |
163 (52,2) |
77 (50,0) |
|
65 – 74 anos |
121 (38,8) |
55 (35,7) |
|
75 – 84 anos |
28 (9,0) |
22 (14,3) |
|
≥ 85 anos |
0 (0,0) |
0 (0,0) |
|
Sexo – n (%) |
|
|
|
Masculino |
177 (56,7) |
91 (59,1) |
|
Feminino |
135 (43,3) |
63 (40,9) |
|
Raça – n (%) |
|
|
|
Asiático |
46 (14,7) |
20 (13,0) |
|
Negro ou Afro-Americano |
7 (2,2) |
2 (1,3) |
|
Branco |
243 (77,9) |
123 (79,9) |
|
Outro |
16 (5,1) |
9 (5,8) |
|
Região geográfica – n (%) |
|
|
|
América do Norte |
21 (6,7) |
12 (7,8) |
|
Europa |
207 (66,3) |
103 (66,9) |
|
Ásia Pacífico |
84 (26,9) |
39 (25,3) |
|
Status de desempenho do ECOG – n (%) |
295 (94,6) |
147 (95,5) |
|
0 ou 1 |
15 (4,8) |
7 (4,5) |
|
2 |
2 (0,6) |
0 (0,0) |
|
Grupo de risco29, conforme determinado por hibridização fluorescente in situ11 (FISH) – n (%) |
|
|
|
Alto risco |
48 (15,4) |
26 (16,9) |
|
Risco padrão |
104 (33,3) |
52 (33,8) |
|
Desconhecido |
160 (51,3) |
76 (49,4) |
|
Estágio ISS de acordo com IxRS na triagem – n (%) |
|
|
|
I ou II |
252 (80,8) |
127 (82,5) |
|
III |
60 (19,2) |
27 (17,5) |
|
Número de regimes anteriores – n (%) |
|
|
|
1 |
144 (46,2) |
70 (45,5) |
|
2 |
99 (31,7) |
46 (29,9) |
|
3 |
69 (22,1) |
37 (24,0) |
|
Terapias prévias |
|
|
|
lenalidomida |
123 (39,4) |
74 (48,1) |
|
Refratário a lenalidomida |
99 (31,7) |
55 (35,7) |
|
bortezomibe |
287 (92) |
134 (87) |
|
Terapia prévia com anticorpo27 CD38 – n (%) |
1 (0,3) |
0 (0,0) |
|
Transplante prévio de células30 tronco (TACTH) – n (%) |
195 (62,5) |
75 (48,7) |
K= Kyprolis, d=dexametasona, D=daratumumabe
*O número de pacientes com regimes anteriores >3 foi 0 no grupo KdD e 1 no grupo Kd.
A eficácia do Kyprolis foi avaliada pela SLP usando os critérios de resposta do IMWG. O estudo demonstrou melhora na SLP no grupo KdD, comparado ao grupo Kd. A SLP mediana não foi ainda atingida no grupo KdD, versus 15,8 meses no grupo Kd (razão de risco [HR]=0,630; IC 95%: 0,464, 0,854; p=0,0014) representando uma redução de 37% no risco de progressão da doença ou morte nos pacientes tratados com KdD.
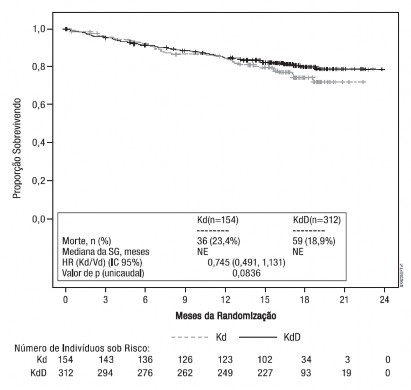
Outros desfechos incluíram TRG. A TRG foi de 84,3% para pacientes17 no grupo KdD e de 74,7% no grupo Kd (consulte a Tabela 5). Os dados de sobrevida9 global (vide Figura 9) não estavam maduros, no entanto, havia uma tendência para SG mais longa no grupo KdD, comparado ao grupo Kd. A duração média da resposta não pode ser estimada para o grupo KdD e foi de 16,6 meses (13,9, NE) para o grupo Kd. O tempo mediano de resposta foi de 1,0 (1, 14) mes para o grupo KdD e 1,0 (1,10) mes para o grupo Kd.
Tabela 5: Resumo da análise de eficácia
|
|
KdD |
Kd |
|
SLP |
|
|
|
Número de eventos, (%) |
110 (35,3) |
68 (44,2) |
|
Mediana, Meses (IC 95%) |
NE (NE, NE) |
15,8 (12,1, NE) |
|
Razão de risco |
0,630 (0,464, 0,854) |
|
|
valor de p (unicaudal) |
0,0014 |
|
|
Refratário a lenalidomida |
|
|
|
Mediana, Meses (IC 95%) |
NE (18,5, NE) |
11,1 (7,4, 14,9) |
|
Razão de risco (KdD/Kd) |
0,453 (0,279, 0,737) |
|
|
Exposto a lenalidomida |
|
|
|
Mediana, Meses (IC 95%) |
NE (18,5, NE) |
12,1 (8,4, 15,3) |
|
Razão de risco |
0,521 (0,339, 0,802) |
|
|
Resposta global |
|
|
|
N com resposta |
263 |
115 |
|
TRG (%) (IC 95%) |
84,3 (79,8, 88,1) |
74,7 (67,0, 81,3) |
|
Odds Ratio |
1,925 (1,184, 3,129) |
|
|
valor de p (unicaudal) |
0,0080 |
|
|
RC DRM [-] em 12 meses, % (IC 95%) |
12,5 (9,0, 16,7) |
1,3 (0,2, 4,6) |
|
Odds Ratio |
11,329 (2,703, 47,476) |
|
|
valor de p (unicaudal) |
<0,0001 |
|
|
Categoria de resposta, n (%) |
|
|
|
Resposta completa (RC) |
89 (28,5) |
16 (10,4) |
|
RC DRM [-] |
43 (13,8) |
5 (3,2) |
|
RPMB |
127 (40,7) |
59 (38,3) |
|
RP |
47 (15,1) |
40 (26,0) |
Figura 9: Curva de Kaplan-Meier de sobrevida9 livre de progressão
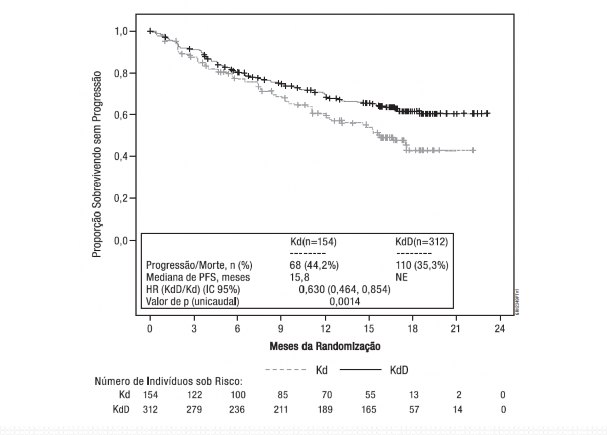
Figura 10: Curva de Kaplan-Meier de sobrevida9 global
O EQUULEUS foi um estudo aberto, de vários grupos de daratumumabe em combinação com terapia de mieloma3 múltiplo. O grupo que avalia semanalmente o Kyprolis com daratumumabe mais dexametasona (KdD) incluiu 85 pacientes com mieloma3 múltiplo recidivado ou refratário. Os pacientes foram excluídos caso apresentassem asma26 persistente moderada ou severa conhecida nos últimos 2 anos, doença pulmonar obstrutiva crônica (DPOC) conhecida com FEV1 < 50% de insuficiência cardíaca congestiva6 ativa e normal prevista. O Kyprolis foi administrado a uma dose inicial de 20 mg/m2, que foi aumentada para 70 mg/m2 no Ciclo 1, Dia 8 e sucessivamente. O Kyprolis foi administrado uma vez por semana como uma infusão de 30 minutos nos Dias 1, 8 e 15 de cada ciclo de 28 dias. Dez pacientes receberam uma única primeira dose de daratumumabe a 16 mg/kg no Ciclo 1, Dia 1. Os 75 pacientes restantes receberam uma primeira dose dividida de daratumumabe a 8 mg/kg por dia no Ciclo 1, Dias 1 e 2. A partir daí, uma única dose de 16 mg/kg foi administrada nos Dias 8, 15 e 22 do Ciclo 1 e nos Dias 1, 8, 15 e 22 do Ciclo 2, a cada 2 semanas, durante 4 ciclos (ciclos 3 a 6) e, depois a cada 4 semanas durante os ciclos restantes de cada ciclo de 28 dias. A dexametasona é administrada via oral ou intravenosa a uma dose 20 mg nos Ciclos 1 e 2 nos Dias 1, 2, 8, 9, 15, 16, 22 e 23. Nos ciclos 3-6, a dexametasona é administrada a uma dose de 20 mg nos Dias 1, 2, 15 e 16 e a uma dose de 40 mg no Dia 22. Nos ciclos 7 e a partir dele, a dexametasona é administrada a uma dose de 20 mg nos Dias 1 e 2 e a uma dose de 40 mg nos Dias 8, 15 e 22. Para pacientes17 com idade >75 anos, administre 20 mg de dexametasona via oral ou intravenosa semanalmente depois da primeira semana. Administre a dexametasona de 30 minutos a 4 horas antes do Kyprolis. A dexametasona 40 mg foi administrada nos Dias 1, 8, 15 e 22 de cada ciclo de 28 dias. O tratamento deve ser continuado, até a progressão da doença ou toxicidade8 inaceitável.
Tabela 6: Dados demográficos e características basais
|
Características |
Grupo KdD (N = 85) |
|
Idade (anos) |
|
|
Média (mín, máx) |
66 (38,85) |
|
Grupo etário – n (%) |
|
|
<65 anos |
36 (42,4%) |
|
65 - <75 anos |
41 (48,2%) |
|
≥ 75 anos |
8 (9,4%) |
|
Sexo – n (%) |
|
|
Masculino |
46 (54,1%) |
|
Feminino |
39 (45,9%) |
|
Raça – n (%) |
|
|
Asiático |
3 (3,5%) |
|
Negro ou Afro-Americano |
3 (3,5%) |
|
Branco |
68 (80,0%) |
|
Pontuação no ECOG, n (%) |
|
|
0 |
32 (37,6) |
|
1 |
46 (54,1) |
|
2 |
7 (8,2) |
|
FISH, n (%) |
|
|
N |
67 |
|
Risco padrão |
54 (80,6) |
|
Alto risco |
13 (19,4) |
|
Número de regimes anteriores |
|
|
1 |
20 (23,5) |
|
2 |
40 (47,1) |
|
3 |
23 (27,1) |
|
>3 |
2 (2,4) |
|
Terapias prévias |
|
|
bortezomibe |
85 (100) |
|
lenalidomida |
81 (95,3) |
|
Transplante prévio de células-tronco31 (TACTH) |
62 (72,9) |
|
Refratário à lenalidomida |
51 (60) |
A eficácia do Kyprolis foi avaliada por SLP usando os critérios de resposta do IMWG. A SLP mediana foi de 26 meses (IC 95%: 14,8, NE), depois de uma mediana de acompanhamento de 24 meses. Outros desfechos incluíram TRG. A TRG foi de 81%. A mediana de sobrevida9 global não foi atingida. A taxa de sobrevida9 em 12 meses foi de 82% e a taxa de sobrevida9 em 24 meses foi de 71%. O tempo mediano de resposta foi de 0,95 meses (intervalo: 0,9, 14,3). A duração mediana da resposta foi de 28 meses (IC 95%: 20,5, NE). O tempo mediano para terapia antimieloma posterior foi de 29 meses (IC 95%: 19,5, NA).
Tabela 7: Resumo da análise de eficácia
|
|
KdD |
|
SLP |
|
|
Número de eventos, (n%) |
40 |
|
Mediana, Meses (IC 95%) |
26 (14,8, NEA) |
|
Resposta global |
|
|
N com resposta |
69 |
|
TRG (%) (IC 95%) |
81 (71, 89) |
|
Categoria de resposta, n(%) |
|
|
RCr |
18 (21,2) |
|
RC |
12 (14,1) |
|
RPMB |
28 (32,9) |
|
RP |
11 (12,9) |
K=Kyprolis, d=dexametasona, D=daratumumabe
Referências bibliográficas
- Siegel D et al., A phase 2 study of single-agent carfilzomib (PX-171-003-A1) in patients with relapsed and refractory multiple myeloma. Blood 2012; 120:2817.
- Dimopoulos M et al., Carfilzomib and dexamethasone versus bortezomib and dexamethasone for patients with relapsed or refractory multiple myeloma (ENDEAVOR): a randomized, phase 3, open-label, multicentre study. The Lancet; published online December 5, 2015, http://dx.doi.org/10.1016/S1470-2045(15)00464-7.
- Stewart A.K., Carfilzomib, Lenalidomide and Dexamethasone for Relapsed Multiple Myeloma, The New England Journal of Medicine, January 8, 2015; 372;2
CARACTERÍSTICAS FARMACOLÓGICAS
Mecanismo de ação
O carfilzomibe é um inibidor de proteassoma epoxicetona tetrapeptídeo que se liga seletiva e irreversivelmente à treonina N terminal nos sítios ativos do proteassoma 20S, a partícula central proteolítica dentro do proteassoma 26S; ele apresenta pouca ou nenhuma atividade contra outras classes de proteases. O carfilzomibe tem atividades antiproliferativas e pró-apoptóticas em modelos pré-clínicos de tumores sólidos e hematológicos. Em animais, carfilzomibe inibiu a atividade proteassomal em sangue32 e em tecidos e retardou o crescimento tumoral em modelos de mieloma3 múltiplo e de tumores sólidos e hematológicos. In vitro, carfilzomibe demonstrou neurotoxicidade mínima e mínima reação a proteases não proteassomais.
Efeitos farmacodinâmicos
O carfilzomibe administrado por via IV resultou em supressão da atividade do proteassoma semelhante à quimiotripsina (chymotrypsin-like [CT-L]) medida no sangue32 uma hora após a primeira dose. Doses ≥ 15 mg/m2 consistentemente induziram uma inibição (≥ 80%) da atividade do proteassoma CT-L. Além disso, a administração de carfilzomibe na dose de 20 mg/m2 resultou em inibição do polipeptídeo 2 de baixa massa molecular (latent membrane protein 2 [LMP2]) e das subunidades da multicatalytic endopeptidase complex-like 1 (MECL1) do imunoproteassoma, que variou de 26% a 32% e 41% a 49%, respectivamente. A inibição do proteassoma foi mantida por ≥ 48 horas após a primeira dose de carfilzomibe para cada semana de administração. A administração combinada com lenalidomida e dexametasona não afetou a inibição do proteassoma.
Propriedades farmacocinéticas
Nas doses entre 20 e 70 mg/m2, o carfilzomibe administrado como uma infusão de 30 minutos resultou em um aumento dose-dependente nas concentrações plasmáticas máximas (Cmáx) e área sob a curva (AUC33). Após doses repetidas de 70 mg/m2 de carfilzomibe, a exposição sistêmica (AUC33) e a meia-vida foram similares às do Dia 15 dos Ciclos 1 e 2, sugerindo que não houve acúmulo sistêmico34 de carfilzomibe. Uma infusão de 30 minutos resultou em uma meia-vida e em uma AUC33 semelhantes, mas em uma Cmáx 2 a 3 vezes menor em comparação àquela observada com uma infusão de 2 a 10 minutos na mesma dose.
Distribuição: O volume de distribuição médio no estado de equilíbrio dinâmico com a dose de 20 mg/m2 de carfilzomibe foi de 28 L. Quando testada in vitro, a ligação de carfilzomibe às proteínas35 plasmáticas foi de aproximadamente 97%, nas concentrações de 0,4 a 4 micromolar.
Metabolismo36: O carfilzomibe foi rapidamente e extensivamente metabolizado. Os metabólitos37 predominantes medidos no plasma38 humano e na urina39 e gerados in vitro por hepatócitos humanos, foram fragmentos40 peptídicos e o diol de carfilzomibe, sugerindo que a clivagem por peptidase e epóxido hidrolase foram as vias principais do metabolismo36. Mecanismos mediados por citocromo P450 desempenharam um papel pouco importante no metabolismo36 global do carfilzomibe. Os metabólitos37 não têm atividade biológica conhecida.
Eliminação: Após a administração IV de doses ≥ 15 mg/m2, carfilzomibe foi rapidamente eliminado da circulação41 sistêmica com uma meia-vida ≤ 1 hora no Dia 1 do Ciclo 1. O clearance sistêmico34 variou de 151 a 263 L/hora e excedeu o fluxo sanguíneo hepático, sugerindo que o carfilzomibe foi amplamente eliminado extrahepaticamente. O carfilzomibe é eliminado primariamente via metabolismo36 com excreção subsequente na urina39.
Populações especiais: Análises farmacocinéticas populacionais indicam que não houve efeitos da idade, sexo ou etnia sobre a farmacocinética de carfilzomibe.
Insuficiência hepática42: A farmacocinética do carfilzomibe foi estudada em pacientes com neoplasias43 em estágio avançado em progressão ou recidivadas com insuficiência hepática42 crônica moderada ou leve comparada com àqueles com função hepática14 normal.
Nenhuma diferença significativa nas exposições (AUC33 e Cmáx) foram observadas entre pacientes com função hepática14 normal e àqueles com insuficiência hepática42 leve ou moderada. Não é necessário ajuste de dose inicial em pacientes com insuficiência hepática42 basal leve ou moderada. A farmacocinética de carfilzomibe não foi estudada em pacientes com insuficiência hepática42 grave (vide “ADVERTÊNCIAS E PRECAUÇÕES – Insuficiência44 hepática”).
Insuficiência renal45: A farmacocinética de carfilzomibe foi estudada em pacientes com mieloma3 múltiplo recidivado com função renal46 normal; insuficiência renal45 leve, moderada ou grave; e em pacientes com doença renal46 em estágio avançado com necessidade de hemodiálise47. Exposições ao carfilzomibe (AUC33 e Cmáx) em pacientes com insuficiência renal45 foram similares àqueles com função renal46 normal.
Nenhum ajuste de dose inicial é necessário para pacientes17 com insuficiência renal45 basal (vide “ADVERTÊNCIAS E PRECAUÇÕES – Insuficiência44 renal”).
Citocromo P450: Com base em dados in vitro e in vivo, não se espera que carfilzomibe iniba as atividades do CYP3A4/5 e/ou afete a exposição a substratos do CYP3A4/5. Um estudo clínico usando midazolam oral como um marcador do CYP3A mostrou que a farmacocinética de midazolam não foi afetada pela administração concomitante de carfilzomibe.
P-gp: O carfilzomibe é um substrato da glicoproteína P (P-gp). No entanto, considerando que o carfilzomibe é administrado por via IV e é extensivamente metabolizado, o perfil farmacocinético de carfilzomibe muito provavelmente não é afetado por inibidores ou indutores da P-gp.
CONTRAINDICAÇÕES
Kyprolis está contraindicado em pacientes com hipersensibilidade conhecida ao carfilzomibe ou a qualquer componente da formulação do produto.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica. Informe imediatamente seu médico em caso de suspeita de gravidez48.
ADVERTÊNCIAS E PRECAUÇÕES
Desordens cardíacas
Piora da insuficiência cardíaca49 ou diagnóstico50 desta condição (por exemplo: insuficiência cardíaca congestiva6, edema pulmonar51, redução da fração de ejeção), isquemia52 e infarto do miocárdio7 ocorreram após a administração de Kyprolis. Morte devido à parada cardíaca ocorreu dentro de um dia da administração de Kyprolis e resultados fatais foram relatados com insuficiência cardíaca49 e infarto do miocárdio7.
Embora hidratação adequada seja necessária antes do Ciclo 1, todos os pacientes devem ser monitorados para evidências de sobrecarga de volume, especialmente pacientes em risco de insuficiência cardíaca49. O volume total de fluidos pode ser ajustado conforme indicação clínica em pacientes com insuficiência cardíaca49 basal ou que estão em risco de insuficiência cardíaca49 (vide “POSOLOGIA E MODO DE USAR”).
Kyprolis deve ser interrompido em casos de eventos cardíacos Grau 3 ou 4 até a recuperação; deve-se considerar o reinício de Kyprolis com 1 nível de redução de dose com base na avaliação do risco/benefício.
O risco de insuficiência cardíaca49 é maior em pacientes idosos (≥ 75 anos). O risco de insuficiência cardíaca49 é aumentado em pacientes asiáticos. Pacientes com insuficiência cardíaca49 em Classe funcional III ou IV da New York Heart Association, infarto do miocárdio7 recente, anormalidades de condução, angina53 ou arritmias54 não controladas com medicamentos não foram elegíveis para os estudos clínicos. Devido ao maior risco de complicações cardíacas, a terapia com Kyprolis nestes pacientes é recomendada apenas quando houver uma avaliação criteriosa baseada no perfil risco/benefício. Antes de iniciar o tratamento, estes pacientes devem ser submetidos a uma avaliação médica completa (em particular, o controle da pressão arterial55 e gestão de fluídos) e então permanecer sob acompanhamento cuidadoso.
Alterações eletrocardiográficas
Foram relatados casos de prolongamento do intervalo QT em estudos clínicos. Um efeito de Kyprolis no intervalo QT não pode ser excluído. Uma avaliação dos possíveis efeitos de carfilzomibe na função cardíaca foi realizada através da análise, com leitura de avaliação central cega, ECG triplicado em 154 pacientes com malignidades avançadas, incluindo mieloma3 múltiplo, o efeito de carfilzomibe na repolarização cardíaca utilizando o intervalo QT com a fórmula de correção Fridericia (intervalo QTcF) e análise da relação da concentração-QTc não demonstra sinal56 claro de qualquer efeito relacionado a dose. O limite superior do intervalo de confiança (IC) 95% unilateral para efeito previsto no QTcF no Cmáx foi de 4,8 ms. Com a formula de correção Bazett (intervalo QTcB), o limite superior do intervalo de confiança (IC) 95% unilateral para o efeito previsto no QTcB no Cmáx foi de 5.9 ms.
Toxicidade8 pulmonar
Síndrome57 da Angústia Respiratória Aguda (SARA), insuficiência respiratória aguda58 e doença pulmonar infiltrativa difusa aguda, como pneumonite59 e doença pulmonar intersticial60, ocorreram em pacientes recebendo Kyprolis e alguns destes eventos foram fatais. Deve-se avaliar e interromper Kyprolis até que essas condições se resolvam e deve-se considerar o reinício de Kyprolis com base na avaliação do risco/benefício.
Hipertensão61 pulmonar
Hipertensão61 pulmonar tem sido relatada em pacientes tratados com Kyprolis. Alguns desses eventos foram fatais. Deve-se avaliar e interromper Kyprolis até a resolução do quadro e deve-se considerar o reinício de Kyprolis com base na avaliação do risco/benefício.
Dispneia20
Dispneia20 foi comumente relatada em pacientes tratados com Kyprolis. Deve-se avaliar a dispneia20, para que se possam excluir condições cardiopulmonares, incluindo insuficiência cardíaca49 e síndromes pulmonares. Deve-se interromper Kyprolis em casos de dispneia20 Grau 3 e 4 até a resolução do quadro e deve-se considerar o reinício de Kyprolis com base na avaliação do risco/benefício.
Hipertensão61
Hipertensão61, incluindo crises e emergências hipertensivas, foram observadas durante o tratamento com Kyprolis. Alguns desses eventos foram fatais. É recomendado controlar a hipertensão61 antes de iniciar Kyprolis. Todos os pacientes devem ser rotineiramente avaliados para a hipertensão arterial62 durante o tratamento com Kyprolis e tratados conforme a necessidade. Caso a hipertensão61 não possa ser controlada, a dose de Kyprolis deve ser reduzida. Em caso de crise hipertensiva, Kyprolis deve ser interrompido até a resolução do quadro e deve-se considerar o reinício de Kyprolis com base na avaliação do risco/benefício.
Insuficiência renal45 aguda
Casos de insuficiência renal45 aguda foram relatados em pacientes que receberam Kyprolis. Alguns desses eventos foram fatais. Insuficiência renal45 aguda foi relatada mais frequentemente em pacientes com mieloma3 múltiplo recidivado e refratário avançado que receberam Kyprolis em monoterapia. A incidência15 foi aumentada em pacientes com um clearance de creatinina5 estimado diminuído, calculado com a equação de Cockcroft e Gault, antes do início da terapia com Kyprolis. Deve-se monitorar a função renal46 com medidas regulares da creatinina5 sérica e/ou do clearance de creatinina5 estimado. Deve-se reduzir ou interromper o tratamento, conforme se julgar apropriado.
Síndrome57 de lise63 tumoral
Casos de Síndrome57 da lise63 tumoral (SLT), incluindo resultados fatais, foram relatados em pacientes que receberam Kyprolis. Pacientes com uma alta carga tumoral devem ser considerados como de maior risco para a SLT. Deve-se assegurar que os pacientes estejam bem hidratados antes da administração de Kyprolis no Ciclo 1, e nos ciclos subsequentes, conforme necessário. Reduções de medicamentos que diminuem o ácido úrico devem ser consideradas em pacientes de alto risco para SLT. Deve-se monitorar os pacientes para sinais64 de SLT durante o tratamento, incluindo mensurações regulares dos eletrólitos65 séricos e com a adoção de medidas rápidas, se necessário. Deve-se interromper o uso de Kyprolis até a resolução da SLT.
Reações infusionais
Reações infusionais, incluindo reações que ameaçam a vida, foram relatadas em pacientes que receberam Kyprolis. Sinais64 e sintomas23 incluem febre18, calafrios19, artralgia22, mialgia21, rubor facial, edema66 facial, vômitos67, fraqueza, dispneia20, hipotensão68, síncope69, aperto torácico ou angina53. Essas reações podem ocorrer imediatamente ou até 24 horas após a administração de Kyprolis. Deve-se administrar dexametasona antes do uso de Kyprolis, seja como pré-medicação ou como parte da terapia combinada10, para reduzir a incidência15 e a gravidade das reações (vide “POSOLOGIA E MODO DE USAR”).
Hemorragia70 e trombocitopenia71
Casos de hemorragia70 (por exemplo: gastrintestinal, pulmonar e hemorragia70 intracraniana) têm sido relatados em pacientes tratados com Kyprolis, frequentemente associados com trombocitopenia71. Alguns destes eventos foram fatais (vide “REAÇÕES ADVERSAS”).
Kyprolis causa trombocitopenia71 com nadirs de plaquetas72 observados no Dia 8 ou Dia 15 de cada ciclo de 28 dias, com recuperação para os valores basais de contagem de plaquetas72 até o início do próximo ciclo (vide “REAÇÕES ADVERSAS”). Deve-se monitorar as contagens plaquetárias frequentemente durante o tratamento com Kyprolis. Deve-se reduzir ou interromper as doses, conforme apropriado.
Trombose73 venosa
Casos de eventos tromboembólicos venosos, incluindo trombose venosa profunda74 e embolia75 pulmonar, com resultados fatais, foram relatados em pacientes que receberam Kyprolis.
Tromboprofilaxia deve ser considerada com base na avaliação individual de risco/benefício.
Toxicidade8 hepática14
Casos de insuficiência hepática42, incluindo casos fatais, foram relatados. Kyprolis pode causar elevações das transaminases séricas (vide “REAÇÕES ADVERSAS”). As enzimas hepáticas76 e bilirrubina77 devem ser avaliadas no início do tratamento e monitoradas mensalmente durante o tratamento com Kyprolis, independentemente dos valores iniciais, e devem ser feitas modificações de dose adequadas com base na toxicidade8. Deve-se reduzir ou interromper as doses, conforme apropriado.
Microangiopatia trombótica78
Casos de microangiopatia trombótica78, incluindo púrpura79 trombocitopênica trombótica78 e síndrome57 hemolítica urêmica (PTT/SHU) foram relatados em pacientes que receberam Kyprolis; alguns desses eventos foram fatais. Deve-se monitorar os pacientes para sinais64 e sintomas23 de PTT/SHU. Caso se suspeite desse diagnóstico50, deve-se interromper Kyprolis e avaliar os pacientes para PTT/SHU; se esses diagnósticos forem excluídos, Kyprolis pode ser reiniciado. A segurança do reinício da terapia com Kyprolis em pacientes que experimentaram previamente PTT/SHU não é conhecida.
Síndrome57 da encefalopatia80 posterior reversível
A síndrome57 da encefalopatia80 posterior reversível (SEPR), previamente conhecida como síndrome57 da leucoencefalopatia posterior reversível (SLPR), é uma desordem neurológica que pode se apresentar com convulsões, cefaleia81, letargia82, confusão, cegueira, alteração do estado de consciência e outros distúrbios visuais e neurológicos, juntamente com hipertensão61, e o diagnóstico50 é confirmado por imagens neurorradiológicas.
Casos de SEPR foram relatados em pacientes recebendo Kyprolis. Kyprolis deve ser descontinuado em casos de suspeita de SEPR. A segurança do reinício da terapia com Kyprolis em pacientes que experimentaram previamente SEPR não é conhecida.
Reativação do vírus83 da Hepatite84 B (HBV)
Casos de reativação do vírus83 da Hepatite84 B (HBV) foram reportados em pacientes em tratamento com Kyprolis. Os pacientes devem fazer exames para HBV antes de iniciar o tratamento. Para os pacientes que são portadores do HBV, deve ser considerada a profilaxia com antivirais. Portadores do HBV que precisam de tratamento com Kyprolis devem ser cuidadosamente monitorados quanto a sinais64 e sintomas23 de uma infecção85 ativa causada pelo HBV durante todo o tratamento e depois do fim do tratamento. Os pacientes com testes positivos para HBV devem considerar procurar um especialista antes ou durante o tratamento. A segurança de prosseguir com o tratamento com Kyprolis após a reativação do HBV ser controlada de forma adequada não é conhecida. Portanto, o prescritor deverá ponderar os riscos e os benefícios ao considerar prosseguir com o tratamento em face86 a esta situação.
Leucoencefalopatia multifocal progressiva
Casos de Leucoencefalopatia Multifocal Progressiva (PML) foram reportados em pacientes tratados com Kyprolis com terapia imunossupressora prévia ou concomitante. A relação causal com o Kyprolis não é conhecida. Os pacientes devem ser monitorados quando a sinais64 ou sintomas23 neurológicos, cognitivos87 ou comportamentais novos ou agravantes que possam sugerir PML como parte do diagnóstico50 de distúrbios do SNC88. Se houver suspeita de PML, suspenda a administração de Kyprolis; os pacientes devem ser encaminhados prontamente para um especialista e os testes para o diagnóstico50 devem ser iniciados. Descontinue o uso do Kyprolis, caso o diagnóstico50 de PML seja confirmado.
Incidência15 elevada de eventos fatais e eventos adversos sérios em combinação com melfalano e prednisona em pacientes inelegíveis para transplante recém diagnosticados com mieloma3 múltiplo
Em um estudo clínico de 955 pacientes com mieloma3 múltiplo recém-diagnosticado, não elegíveis para transplante, randomizados para Kyprolis (20/36 mg/m2 por infusão de 30 minutos duas vezes por semana durante quatro semanas de cada ciclo de seis semanas), melfalano e prednisona (KMP) ou bortezomibe, melfalano e prednisona (VMP), uma incidência15 maior de efeitos adversos fatais (6,5% versus 4,3%), uma maior incidência15 de eventos adversos sérios (49,6% versus 42,1%) e uma maior incidência15 de eventos adversos de qualquer grau envolvendo insuficiência cardíaca49 (10,8% versus 4,3%), hipertensão61 (24,7% versus 8,1%), insuficiência renal45 aguda (13,9% versus 6,2%) e dispneia20 (18,1% versus 8,5%) foi observada em pacientes no braço KMP em comparação aos pacientes no braço VMP. Este estudo não atendeu à medida de superioridade de desfecho primário na sobrevida9 livre de progressão (SLP) para o braço KMP. Kyprolis em combinação com melfalano e prednisona não é indicado para pacientes17 inelegíveis para transplante com mieloma3 múltiplo recém-diagnosticado.
Fertilidade, Gravidez48 e Lactação89
Gravidez48
Não há dados do uso de Kyprolis em mulheres grávidas.
Mulheres e homens com potencial reprodutivo devem ser aconselhados a evitar a concepção90/reprodução91 enquanto estiverem sendo tratados com Kyprolis.
Considerando que carfilzomibe foi clastogênico no teste de aberração cromossômica in vitro em linfócitos de sangue32 periférico, como precaução, aconselhe as mulheres grávidas sobre o risco potencial para o feto92. Aconselhe as mulheres com potencial reprodutivo a usar métodos contraceptivos eficazes durante o tratamento com Kyprolis e por 6 meses após a dose final. Aconselhe os homens com parceiras sexuais femininas com potencial reprodutivo a usar métodos contraceptivos eficazes durante o tratamento com Kyprolis e por 3 meses após a dose final. Se ocorrer uma gravidez48 durante este tempo, os pacientes devem ser informados sobre o potencial risco para o feto92. Kyprolis só deve ser usado durante a gravidez48 se os benefícios potenciais para a mãe superarem os riscos potenciais para o feto92.
Não é conhecido se carfilzomibe irá reduzir a eficácia dos contraceptivos orais.
Devido a um risco aumentado de trombose73 venosa associada com Kyprolis, pacientes que atualmente utilizam contraceptivos orais ou um método de contracepção93 hormonal associado com um risco de trombose73 devem considerar um método alternativo de contracepção93 eficaz.
Com base em seu mecanismo de ação e nos achados em animais, o carfilzomibe pode causar dano fetal quando administrado em mulheres grávidas. O carfilzomibe causou toxicidade8 embrio-fetal em coelhas prenhas em doses que eram menores que aquelas de pacientes recebendo a dose recomendada. O carfilzomibe administrado em ratas e coelhas prenhas durante o período da organogênese não foi teratogênico94 em doses de até 2 mg/kg/dia em ratas ou até 0,8 mg/kg/dia em coelhas. O carfilzomibe, administrado por via intravenosa em coelhos prenhes durante a organogênese, em uma dose de aproximadamente 40% da dose clínica de 27 mg/m2 com base na BSA, causou perda pós-implantação e diminuição no peso fetal.
Categoria D para gravidez48: Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica. Informe imediatamente seu médico em caso de suspeita de gravidez48.
Amamentação
Não se sabe se Kyprolis está presente no leite materno. Kyprolis não deve ser administrado em mulheres que estão amamentando. Devido ao potencial de efeitos adversos de Kyprolis em lactentes95, a decisão de descontinuar a amamentação96 ou de descontinuar o uso de Kyprolis deve levar em consideração o potencial benefício de Kyprolis para a mãe.
Fertilidade
Não foram realizados estudos de fertilidade.
Populações especiais
População pediátrica: a segurança e a eficácia de Kyprolis não foram estabelecidas em pacientes pediátricos.
População idosa: Em geral, a incidência15 de certos eventos adversos (incluindo insuficiência cardíaca49) nos estudos clínicos foi mais alta em pacientes ≥ 75 anos de idade em comparação aos pacientes < 75 anos de idade, vide “ADVERTÊNCIAS E PRECAUÇÕES – Desordens cardíacas”. Em um estudo controlado randomizado13 de fase 3 de KdD versus Kd para o tratamento de pacientes com mieloma3 múltiplo recidivado ou refratário (CANDOR), 47% dos 308 pacientes que receberam KdD 20/56 mg/m2 duas vezes por semana tinham ≥ 65 anos de idade. No braço KdD do estudo, eventos adversos fatais emergentes ao tratamento (TEAEs) ocorreram em 6% dos pacientes <65 anos de idade e em 14% dos pacientes ≥ 65 anos de idade. No braço Kd, TEAEs fatais ocorreram em 8% dos pacientes <65 anos de idade e em 3% dos pacientes ≥ 65 anos de idade, ver “REAÇÕES ADVERSAS - Combinação com dexametasona e daratumumabe.
Insuficiência renal45: Nenhum ajuste de dose inicial é necessário para pacientes17 com insuficiência renal45 basal leve, moderada ou grave ou para pacientes17 em diálise97 crônica. Uma vez que o clearance dialítico das concentrações de Kyprolis não foi estudado, o medicamento deve ser administrado após o procedimento de diálise97 (vide “CARACTERÍSTICAS FARMACOLÓGICAS – Propriedades farmacocinéticas”).
Insuficiência hepática42: Nenhum ajuste de dose inicial é necessário para pacientes17 com insuficiência hepática42 moderada ou leve. A farmacocinética de Kyprolis não foi avaliada em pacientes com insuficiência hepática42 grave (vide “CARACTERÍSTICAS FARMACOLÓGICAS – Propriedades farmacocinéticas”).
Comprometimento cardíaco: Pacientes com insuficiência cardíaca49 em Classe funcional III ou IV da New York Heart Association não foram elegíveis para os estudos clínicos. A segurança e a eficácia nessa população não foram avaliadas.
Efeitos na habilidade de dirigir e operar máquinas
Não foram realizados estudos avaliando os efeitos de carfilzomibe sobre a habilidade de dirigir e operar máquinas. Fadiga98, tontura99, desmaio e/ou quedas na pressão arterial55 foram observados nos estudos clínicos. Os pacientes tratados com Kyprolis devem, portanto, ser aconselhados a não dirigir ou operar máquinas se apresentarem quaisquer desses sintomas23.
INTERAÇÕES MEDICAMENTOSAS
O carfilzomibe é primariamente metabolizado por atividades de peptidase e de epóxido hidrolase, e como resultado, o perfil farmacocinético de carfilzomibe provavelmente não é afetado pela administração concomitante de inibidores e indutores do citocromo P450. Não é esperado que carfilzomibe influencie a exposição a outras drogas (vide “CARACTERÍSTICAS FARMACOLÓGICAS – Propriedades farmacocinéticas”).
CUIDADOS DE ARMAZENAMENTO DO MEDICAMENTO
Cuidados de conservação
Frascos fechados de Kyprolis são estáveis até a data indicada na embalagem quando armazenados sob refrigeração (2°C a 8°C) na embalagem original para serem protegidos da luz direta.
Os frascos-ampolas de Kyprolis não contêm conservantes antimicrobianos e devem ser usados uma única vez. Técnicas apropriadas de assepsia100 devem ser observadas durante seu preparo.
Qualquer medicamento não usado ou material residual deve ser descartado, de acordo com as exigências locais.
O tempo entre a reconstituição e a administração de Kyprolis não deve exceder 24 horas. Armazene a solução reconstituída no frasco-ampola, seringa101 ou bolsa para líquido IV refrigeradas (2°C a 8°C) por até 24 horas ou a temperatura ambiente (15°C a 30°C) por até 4 horas.
Após a reconstituição, mantenha a temperatura ambiente por até 4 horas ou refrigerada por até 24 horas.
Solução salina normal não deve ser utilizada para reconstituição do carfilzomibe. O carfilzomibe reconstituído para injeção102 não deve ser diluído em bolsa de cloreto de sódio 0,9% para administração IV.
Características físicas e organolépticas do produto
Um frasco de dose única contém 60 mg de carfilzomibe, um pó liofilizado1 para solução injetável, estéril, branco a esbranquiçado.
Prazo de validade: 36 meses
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original. Antes de usar, observe o aspecto do medicamento.
TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS.
POSOLOGIA E MODO DE USAR
O Kyprolis é uma infusão intravenosa (IV) que pode ser administrado uma ou duas vezes por semana, baseado no regime selecionado (vide Tabela 8). O tratamento deve ser continuado até a progressão da doença ou até a ocorrência de toxicidade8 inaceitável.
Tabela 8: Informação sobre a dose de Kyprolis
|
Regime |
Dose inicial de Kyprolis |
Se tolerada, a dose de Kyprolis deve ser aumentada no Dia 8 do Ciclo 1 |
Tempo de infusão de Kyprolisa |
|
Kyprolis em monoterapia |
20 mg/m2 |
27 mg/m2 duas vezes por semana |
10 minutos |
|
Kyprolis, lenalidomida e dexametasona |
20 mg/m2 |
27 mg/m2 duas vezes por semana |
10 minutos |
|
Kyprolis mais dexametasona |
20 mg/m2 |
56 mg/m2 duas vezes por semana |
30 minutos |
|
20 mg/m2 |
70 mg/m2 uma vez por semana |
30 minutos |
|
|
Kyprolis, daratumumabe e dexametasona |
20 mg/m2 |
56 mg/m2 duas vezes por semana |
30 minutos |
|
20 mg/m2 |
70 mg/m2 uma vez por semana |
30 minutos |
a O tempo de infusão é consistente em todos os regimes de dose.
A dose é calculada a partir da área de superfície corpórea (ASC) do paciente. Pacientes com uma ASC maior que 2,2 m2 devem receber a dose com base na ASC de 2,2 m2. Não são necessários ajustes de dose para mudanças no peso corporal menores ou iguais a 20%.
Kyprolis em monoterapia
Administração da dose duas vezes por semana (27 mg/m2)
O Kyprolis é administrado a uma dose inicial de 20 mg/m2 no Ciclo 1 nos Dias 1 e 2. Se tolerado, a dose deverá ser aumentada para 27 mg/m2 no Dia 8 do Ciclo 1. O Kyprolis é omitido nos Dias 8 e 9 dos Ciclos 13 e posteriores. O Kyprolis 20/27 mg/m2 é administrado IV em dois dias consecutivos, toda semana, por três semanas (Dias 1, 2, 8, 9, 15 e 16), seguido por um período de descanso de 12 dias (Dias 17 a 28). Cada período de 28 dias é considerando um ciclo de tratamento.
Tabela 9: Kyprolis 20/27 mg/m2 em monoterapia duas vezes por semana (infusão de 10 minutos)
|
|
Ciclo 1 |
|||||||||
|
Semana 1 |
Semana 2 |
Semana 3 |
Semana 4 |
|||||||
|
Dia 1 |
Dia 2 |
Dias 3–7 |
Dia 8 |
Dia 9 |
Dias 10-14 |
Dia 15 |
Dia 16 |
Dias 17-21 |
Dias 22-28 |
|
|
Kyprolis (mg/m2)a |
20 |
20 |
- |
27 |
27 |
- |
27 |
27 |
- |
- |
|
|
Ciclos 2 a 12 |
|||||||||
|
Semana 1 |
Semana 2 |
Semana 3 |
Semana 4 |
|||||||
|
Dia 1 |
Dia 2 |
Dias 3–7 |
Dia 8 |
Dia 9 |
Dias 10-14 |
Dia 15 |
Dia 16 |
Dias 17-21 |
Dias 22-28 |
|
|
Kyprolis (mg/m2) |
27 |
27 |
- |
27 |
27 |
- |
27 |
27 |
- |
- |
|
|
Ciclos 13 e posteriores |
|||||||||
|
Semana 1 |
Semana 2 |
Semana 3 |
Semana 4 |
|||||||
|
Dia 1 |
Dia 2 |
Dias 3–7 |
Dia 8 |
Dia 9 |
Dias 10-14 |
Dia 15 |
Dia 16 |
Dias 17-21 |
Dias 22-28 |
|
|
Kyprolis (mg/m2) |
27 |
27 |
- |
- |
- |
- |
27 |
27 |
- |
- |
a Pré-medicação com dexametasona é necessária para cada dose de Kyprolis no Ciclo 1.
O Kyprolis em combinação com lenalidomida e dexametasona
Kyprolis é administrado na dose inicial de 20 mg/m2 no Ciclo 1 nos Dias 1 e 2. Se tolerada, a dose deve ser aumentada para 27 mg/m2 no Dia 8 do Ciclo 1. Kyprolis é omitido nos Dias 8 e 9 dos Ciclos 13 em diante. Kyprolis 20/27 mg/m2 é administrado por via IV em dois dias consecutivos a cada semana durante três semanas (Dias 1, 2, 8, 9, 15 e 16), seguidas por um período de descanso de 12 dias (Dias 17 a 28). Cada período de 28 dias é considerado um ciclo de tratamento.
A lenalidomida é administrada como 25 mg via oral nos Dias 1-21 e a dexametasona é administrada como 40 mg via oral ou IV nos Dias 1, 8, 15 e 22 dos ciclos de 28 dias. Redução apropriada da dose inicial de lenalidomida deve ser considerada, de acordo com as recomendações da bula de lenalidomida, por exemplo, para pacientes17 com comprometimento renal46 basal. A dexametasona deve ser administrada de 30 minutos a 4 horas antes do Kyprolis.
Tabela 10: Kyprolis duas vezes por semana (infusão de dez minutos) em combinação com lenalidomida e dexametasona
|
|
Ciclo 1 |
||||||||||
|
Semana 1 |
Semana 2 |
Semana 3 |
Semana 4 |
||||||||
|
Dia 1 |
Dia 2 |
Dias 3–7 |
Dia 8 |
Dia 9 |
Dias 10-14 |
Dia 15 |
Dia 16 |
Dias 17-21 |
Dia 22 |
Dias 23-28 |
|
|
Kyprolis (mg/m2) |
20 |
20 |
- |
27 |
27 |
- |
27 |
27 |
- |
- |
- |
|
dexametasona (mg) |
40 |
- |
- |
40 |
- |
- |
40 |
- |
- |
40 |
- |
|
lenalidomida (mg) |
25 mg diariamente, nos Dias 1-21 |
- |
- |
||||||||
|
|
Ciclos 2 a 12 |
||||||||||
|
Semana 1 |
Semana 2 |
Semana 3 |
Semana 4 |
||||||||
|
Dia 1 |
Dia 2 |
Dias 3–7 |
Dia 8 |
Dia 9 |
Dias 10-14 |
Dia 15 |
Dia 16 |
Dias 17-21 |
Dia 22 |
Dias 23-28 |
|
|
Kyprolis (mg/m2) |
27 |
27 |
- |
27 |
27 |
- |
27 |
27 |
- |
- |
- |
|
dexametasona (mg) |
40 |
- |
- |
40 |
- |
- |
40 |
- |
- |
40 |
- |
|
lenalidomida (mg) |
25 mg diariamente nos Dias 1-21 |
- |
- |
||||||||
|
|
Ciclos 13 e posterioresa |
||||||||||
|
Semana 1 |
Semana 2 |
Semana 3 |
Semana 4 |
||||||||
|
Dia 1 |
Dia 2 |
Dias 3–7 |
Dia 8 |
Dia 9 |
Dias 10-14 |
Dia 15 |
Dia 16 |
Dias 17-21 |
Dia 22 |
Dias 23-28 |
|
|
Kyprolis (mg/m2) |
27 |
27 |
- |
- |
- |
- |
27 |
27 |
- |
- |
- |
|
dexametasona (mg) |
40 |
- |
- |
40 |
- |
- |
40 |
- |
- |
40 |
- |
|
lenalidomida (mg) |
25 mg diariamente nos Dias 1-21 |
- |
- |
||||||||
A O Kyprolis é administrado até o Ciclo 18; a lenalidomida e a dexametasona continuam a partir daí.
Kyprolis em combinação com dexametasona
Administração duas vezes por semana da dose (56 mg/m2)
O Kyprolis é administrado como uma dose inicial de 20 mg/m2 no Ciclo 1 nos Dias 1 e 2. Se tolerado, a dose deverá ser aumentada para 56 mg/m2 no Dia 8 do Ciclo 1. O Kyprolis 20/56 mg/m2 é administrado IV em dois dias consecutivos, toda semana, durante três semanas (Dias 1, 2, 8, 9, 15 e 16), seguido por um período de descanso de 12 dias (Dias 17 a 28). Cada período de 28 dias é considerando um ciclo de tratamento.
A dexametasona é administrada na dose de 20 mg por via oral ou intravenosa nos Dias 1, 2, 8, 9, 15, 16, 22 e 23 dos ciclos de 28 dias. A dexametasona deve ser administrada de 30 minutos a 4 horas antes do Kyprolis.
Tabela 11: Kyprolis duas vezes por semanas (infusão de 30 minutos) em combinação com dexametasona
|
|
Ciclo 1 |
||||||||||||
|
Semana 1 |
Semana 2 |
Semana 3 |
Semana 4 |
||||||||||
|
Dia 1 |
Dia 2 |
Dias 3–7 |
Dia 8 |
Dia 9 |
Dias 10-14 |
Dia 15 |
Dia 16 |
Dias 17-21 |
Dia 22 |
Dia 23 |
Dias 24-28 |
||
|
Kyprolis (mg/m2) |
20 |
20 |
- |
56 |
56 |
- |
56 |
56 |
- |
- |
- |
- |
|
|
dexametasona (mg) |
20 |
20 |
- |
20 |
20 |
- |
20 |
20 |
- |
20 |
20 |
- |
|
|
|
Ciclo 2 e posterior |
||||||||||||
|
Semana 1 |
Semana 2 |
Semana 3 |
Semana 4 |
||||||||||
|
Dia 1 |
Dia 2 |
Dias 3–7 |
Dia 8 |
Dia 9 |
Dias 10-14 |
Dia 15 |
Dia 16 |
Dias 17-21 |
Dia 22 |
Dia 23 |
Dias 24-28 |
||
|
Kyprolis (mg/m2) |
56 |
56 |
- |
56 |
56 |
- |
56 |
56 |
- |
- |
- |
- |
|
|
dexametasona (mg) |
20 |
20 |
- |
20 |
20 |
- |
20 |
20 |
- |
20 |
20 |
- |
|
Administração uma vez por semana da dose (70 mg/m2)
Kyprolis é administrado em uma dose inicial de 20 mg/m2 no Ciclo 1 no Dia 1. Se tolerada, a dose deve ser aumentada para 70 mg/m2 no Dia 8 do Ciclo 1. Kyprolis 20/70 mg/m2 é administrado IV uma vez por semana durante três semanas (Dias 1, 8 e 15), acompanhado por um período de 13 dias de descanso (Dias 16 a 28). Cada período de 28 dias é considerando um ciclo de tratamento. A dexametasona é administrada como 40 mg via oral ou IV nos dias 1, 8 e 15 de todos os ciclos e no Dia 22 dos Ciclos 1 a 9. A dexametasona deve ser administrada de 30 minutos a 4 horas antes de Kyprolis.
Tabela 12: Kyprolis uma vez por semana (infusão de 30 minutos) em combinação com dexametasona
|
|
Ciclo 1 |
|||||||||||
|
Semana 1 |
Semana 2 |
Semana 3 |
Semana 4 |
|||||||||
|
Dia 1 |
Dia 2 |
Dias 3–7 |
Dia 8 |
Dia 9 |
Dias 10–14 |
Dia 15 |
Dia 16 |
Dias 17-21 |
Dia 22 |
Dia 23 |
Dias 24-28 |
|
|
Kyprolis (mg/m2) |
20 |
- |
- |
70 |
- |
- |
70 |
- |
- |
- |
- |
- |
|
dexametasona (mg) |
40 |
- |
- |
40 |
- |
- |
40 |
- |
- |
40 |
- |
- |
|
|
Ciclos 2 a 9 |
|||||||||||
|
Semana 1 |
Semana 2 |
Semana 3 |
Semana 4 |
|||||||||
|
Dia 1 |
Dia 2 |
Dias 3–7 |
Dia 8 |
Dia 9 |
Dias 10–14 |
Dia 15 |
Dia 16 |
Dias 17-21 |
Dia 22 |
Dia 23 |
Dias 24-28 |
|
|
Kyprolis (mg/m2) |
70 |
- |
- |
70 |
- |
- |
70 |
- |
- |
- |
- |
- |
|
dexametasona (mg) |
40 |
- |
- |
40 |
- |
- |
40 |
- |
- |
40 |
- |
- |
|
|
Ciclo 10 e posterior |
|||||||||||
|
Semana 1 |
Semana 2 |
Semana 3 |
Semana 4 |
|||||||||
|
Dia 1 |
Dia 2 |
Dias 3–7 |
Dia 8 |
Dia 9 |
Dias 10–14 |
Dia 15 |
Dia 16 |
Dias 17-21 |
Dia 22 |
Dia 23 |
Dias 24-28 |
|
|
Kyprolis (mg/m2) |
70 |
- |
- |
70 |
- |
- |
70 |
- |
- |
- |
- |
- |
|
dexametasona (mg) |
40 |
- |
- |
40 |
- |
- |
40 |
- |
- |
- |
- |
- |
Kyprolis em combinação com daratumumabe mais dexametasona
Para o regime de combinação com daratumumabe mais dexametasona, administre o Kyprolis via intravenosa uma vez por semana ou duas vezes por semana como uma infusão de 30 minutos, conforme descrito nas Tabelas 13 e 14 abaixo.
Regime de 20/70 mg/m2 uma vez por semana por infusão de 30 minutos
O Kyprolis é administrado via intravenosa como uma infusão de 30 minutos toda semana durante três semanas, seguido de um período de descanso de 13 dias, conforme mostrado na Tabela 13. Cada período de 28 dias é considerando um ciclo de tratamento. Administre o Kyprolis a uma dose inicial de 20 mg/m2 no Ciclo 1 no Dia 1. Se tolerado, aumente a dose para 70 mg/m2 no Dia 8 do Ciclo 1 e a partir daí. A dexametasona é administrada via oral ou intravenosa a uma dose 20 mg nos Ciclos 1 e 2 nos Dias 1, 2, 8, 9, 15, 16, 22 e 23. Nos ciclos 3-6, a dexametasona é administrada a uma dose de 20 mg nos Dias 1, 2, 15 e 16 e a uma dose de 40 mg nos Dias 8 e 22. Nos ciclos 7 e a partir dele, a dexametasona é administrada a uma dose de 20 mg nos Dias 1 e 2 e a uma dose de 40 mg nos Dias 8, 15 e 22. Para pacientes17 com idade >75 anos, administre 20 mg de dexametasona via oral ou intravenosa semanalmente depois da primeira semana. Administre a dexametasona de 30 minutos a 4 horas antes do Kyprolis. O daratumumabe é administrado via intravenosa a uma dose 16 mg/kg , considerando o peso corporal real, com uma dose dividida de 8 mg/kg nos Dias 1 e 2 do Ciclo 1. Administre o daratumumabe 16 mg/kg uma vez por semana nos Dias 8, 15 e 22 do Ciclo 1 e nos Dias 1, 8, 15 e 22 do Ciclo 2, depois a cada duas semanas em 4 ciclos (ciclos 3 a 6) e, então, a cada 4 semanas pelos ciclos restantes ou até a progressão da doença.
Tabela 13: Kyprolis uma vez por semana (infusão IV de 30 minutos) em combinação com daratumumabe mais dexametasona
|
|
Ciclo 1 |
|||||||||||
|
Semana 1 |
Semana 2 |
Semana 3 |
Semana 4 |
|||||||||
|
Dia 1 |
Dia 2 |
Dias 3–7 |
Dia 8 |
Dia 9 |
Dias 10-14 |
Dia 15 |
Dia 16 |
Dias 17-21 |
Dia 22 |
Dia 23 |
Dias 24-28 |
|
|
Kyprolis (mg/m2) |
20 |
- |
- |
70 |
- |
- |
70 |
- |
- |
- |
- |
- |
|
dexametasona (mg)* |
20 |
20 |
- |
20 |
20 |
- |
20 |
20 |
- |
20 |
20 |
- |
|
daratumumabe (mg/kg) |
8 |
8 |
- |
16 |
- |
- |
16 |
- |
- |
16 |
- |
- |
|
|
Ciclo 2 |
|||||||||||
|
Semana 1 |
Semana 2 |
Semana 3 |
Semana 4 |
|||||||||
|
Dia 1 |
Dia 2 |
Dias 3–7 |
Dia 8 |
Dia 9 |
Dias 10–14 |
Dia 15 |
Dia 16 |
Dias 17-21 |
Dia 22 |
Dia 23 |
Dias 24-28 |
|
|
Kyprolis (mg/m2) |
70 |
- |
- |
70 |
- |
- |
70 |
- |
- |
- |
- |
- |
|
dexametasona (mg)* |
20 |
20 |
- |
20 |
20 |
- |
20 |
20 |
- |
20 |
20 |
- |
|
daratumumabe (mg/kg) |
16 |
- |
- |
16 |
- |
- |
16 |
- |
- |
16 |
- |
- |
|
|
Ciclos 3 a 6 |
|||||||||||
|
Semana 1 |
Semana 2 |
Semana 3 |
Semana 4 |
|||||||||
|
Dia 1 |
Dia 2 |
Dias 3–7 |
Dia 8 |
Dia 9 |
Dias 10–14 |
Dia 15 |
Dia 16 |
Dias 17-21 |
Dia 22 |
Dia 23 |
Dias 24-28 |
|
|
Kyprolis (mg/m2) |
70 |
- |
- |
70 |
- |
- |
70 |
- |
- |
- |
- |
- |
|
dexametasona (mg)* |
20 |
20 |
- |
40 |
- |
- |
20 |
20 |
- |
40 |
- |
- |
|
daratumumabe (mg/kg) |
16 |
- |
- |
- |
- |
- |
16 |
- |
- |
- |
- |
- |
|
|
Ciclos 7 e posteriores |
|||||||||||
|
Semana 1 |
Semana 2 |
Semana 3 |
Semana 4 |
|||||||||
|
Dia 1 |
Dia 2 |
Dias 3–7 |
Dia 8 |
Dia 9 |
Dias 10–14 |
Dia 15 |
Dia 16 |
Dias 17-21 |
Dia 22 |
Dia 23 |
Dias 24-28 |
|
|
Kyprolis (mg/m2) |
70 |
- |
- |
70 |
- |
- |
70 |
- |
- |
- |
- |
- |
|
dexametasona (mg)* |
20 |
20 |
- |
40 |
- |
- |
40 |
- |
- |
40 |
- |
- |
|
daratumumabe (mg/kg) |
16 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
*Para pacientes17 com idade > 75 anos, administre 20 mg de dexametasona via oral ou intravenosa toda semana depois da primeira semana.
O tratamento pode ser continuado, até que ocorra progressão da doença ou toxicidade8 inaceitável. Consulte as informações da bula da dexametasona e do daratumumabe para obter outras informações sobre esses produtos.
Regime de 20/56 mg/m2 duas vezes por semana por infusão de 30 minutos.
O Kyprolis é administrado via intravenosa como uma infusão de 30 minutos em dois dias consecutivos, toda semana, durante três semanas, depois de um período de descanso de 12 dias, conforme mostrado na Tabela 14. Cada período de 28 dias é considerado um ciclo de tratamento. Administre o Kyprolis a uma dose inicial de 20 mg/m2 no Ciclo 1 nos Dias 1 e 2. Se tolerado, aumente a dose para 56 mg/m2 no Dia 8 do Ciclo 1 em diante. A dexametasona 20 mg é administrada via oral ou intravenosa nos Dias 1, 2, 8, 9, 15 e 16 e 40 mg via oral ou intravenosa no Dia 22 de cada ciclo de 28 dias. Administre a dexametasona de 30 minutos a 4 horas antes do Kyprolis.
O daratumumabe é administrado via intravenosa a uma dose de 16 mg/kg, considerando o peso corporal real, com uma dose dividida de 8 mg/kg no Ciclo 1 nos Dias 1 e 2. Administre 16 mg/kg uma vez por semana nos Dias 8, 15 e 22 do Ciclo 1 e nos Dias 1, 8, 15 e 22 do Ciclo 2, depois a cada duas semanas durante 4 ciclos (ciclos 3 a 6) e depois a cada 4 semanas durante os ciclos restantes, ou até progressão da doença.
Tabela 14: Kyprolis duas vezes por semana (infusão de 30 minutos) em combinação com dexametasona e daratumumabe
|
|
Ciclo 1 |
|||||||||||
|
Semana 1 |
Semana 2 |
Semana 3 |
Semana 4 |
|||||||||
|
Dia 1 |
Dia 2 |
Dias 3–7 |
Dia 8 |
Dia 9 |
Dias 10-14 |
Dia 15 |
Dia 16 |
Dias 17-21 |
Dia 22 |
Dia 23 |
Dias 24-28 |
|
|
Kyprolis (mg/m2) |
20 |
20 |
- |
56 |
56 |
- |
56 |
56 |
- |
- |
- |
- |
|
dexametasona (mg)* |
20 |
20 |
- |
20 |
20 |
- |
20 |
20 |
- |
40 |
- |
- |
|
daratumumabe (mg/kg) |
8 |
8 |
- |
16 |
- |
- |
16 |
- |
- |
16 |
- |
- |
|
|
Ciclo 2 |
|||||||||||
|
Semana 1 |
Semana 2 |
Semana 3 |
Semana 4 |
|||||||||
|
Dia 1 |
Dia 2 |
Dias 3–7 |
Dia 8 |
Dia 9 |
Dias 10–14 |
Dia 15 |
Dia 16 |
Dias 17-21 |
Dia 22 |
Dia 23 |
Dias 24-28 |
|
|
Kyprolis (mg/m2) |
56 |
56 |
- |
56 |
56 |
- |
56 |
56 |
- |
- |
- |
- |
|
dexametasona (mg)* |
20 |
20 |
- |
20 |
20 |
- |
20 |
20 |
- |
40 |
- |
- |
|
daratumumabe (mg/kg) |
16 |
- |
- |
16 |
- |
- |
16 |
- |
- |
16 |
- |
- |
|
|
Ciclos 3 a 6 |
|||||||||||
|
Semana 1 |
Semana 2 |
Semana 3 |
Semana 4 |
|||||||||
|
Dia 1 |
Dia 2 |
Dias 3–7 |
Dia 8 |
Dia 9 |
Dias 10–14 |
Dia 15 |
Dia 16 |
Dias 17-21 |
Dia 22 |
Dia 23 |
Dias 24-28 |
|
|
Kyprolis (mg/m2) |
56 |
56 |
- |
56 |
56 |
- |
56 |
56 |
- |
- |
- |
- |
|
dexametasona (mg)* |
20 |
20 |
- |
20 |
20 |
- |
20 |
20 |
- |
40 |
- |
- |
|
daratumumabe (mg/kg) |
16 |
- |
- |
- |
- |
- |
16 |
- |
- |
- |
- |
- |
|
|
Ciclos 7 e posteriores |
|||||||||||
|
Semana 1 |
Semana 2 |
Semana 3 |
Semana 4 |
|||||||||
|
Dia 1 |
Dia 2 |
Dias 3–7 |
Dia 8 |
Dia 9 |
Dias 10–14 |
Dia 15 |
Dia 16 |
Dias 17-21 |
Dia 22 |
Dia 23 |
Dias 24-28 |
|
|
Kyprolis (mg/m2) |
56 |
56 |
- |
56 |
56 |
- |
56 |
56 |
- |
- |
- |
- |
|
dexametasona (mg)* |
20 |
20 |
- |
20 |
20 |
- |
20 |
20 |
- |
40 |
- |
- |
|
daratumumabe (mg/kg) |
16 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
*Para pacientes17 com idade > 75 anos, administre 20 mg de dexametasona via oral ou intravenosa toda semana depois da primeira semana.
O tratamento pode ser continuado até a progressão da doença ou até a ocorrência de toxicidade8 inaceitável. Consulte a bula do daratumumabe e da dexametasona para obter detalhes adicionais sobre a administração e medicamentos concomitantes.
Pré-medicação com dexametasona na monoterapia com Kyprolis
Quando Kyprolis é administrado como monoterapia, a dexametasona na dose de 4 mg por via oral ou IV deve ser administrada pelo menos 30 minutos, mas não mais do que 4 horas antes de todas as doses de Kyprolis durante o Ciclo 1, para reduzir a incidência15 e a gravidade das reações infusionais, vide “ADVERTÊNCIAS E PRECAUÇÕES”. Administre a dexametasona como pré-medicação se esses sintomas23 se desenvolverem ou reaparecerem durante ciclos subsequentes.
Medicação concomitante
Considerar a necessidade de se realizar profilaxia antiviral em pacientes recebendo Kyprolis, para diminuir o risco de reativação de herpes zoster103. Consulte a bula da lenalidomida e da dexametasona para informações sobre outros medicamentos concomitantes, tais como o uso de profilaxia anticoagulante104 e antiácida, que podem ser necessárias com estes medicamentos.
Hidratação, fluídos e monitoramento eletrolítico
Hidratação adequada é necessária antes da administração do Ciclo 1, especialmente em pacientes em alto risco de SLT ou toxicidade8 renal46. Todos os pacientes devem ser monitorados para evidências de sobrecarga de volume, e as necessidade de fluidos deve ser individualizada para cada paciente. O volume total de fluidos pode ser ajustado conforme as indicações clínicas em pacientes com insuficiência cardíaca49 basal ou em risco de insuficiência cardíaca49, vide “ADVERTÊNCIAS E PRECAUÇÕES”. A hidratação recomendada inclui tanto ingestão por via oral (30 mL/kg/dia por 48 horas antes do Dia 1 do Ciclo 1) quanto a administração de fluidos intravenosos (250 mL a 500 mL de fluido apropriado por via intravenosa antes de cada dose no Ciclo 1). A administração de 250 mL a 500 mL adicionais de fluidos intravenosa pode ser feita conforme a necessidade, após a administração de Kyprolis. A hidratação oral e/ou intravenosa deve continuar, conforme necessário, nos ciclos subsequentes.
Quando administrado em combinação com daratumumabe IV, a hidratação oral e/ou intravenosa não é necessária nos dias em que o daratumumabe IV é administrado.
Monitorar os níveis de potássio sérico regularmente durante o tratamento com Kyprolis.
Modificações de dose recomendadas
As doses devem ser modificadas com base na toxicidade8. As ações recomendadas e as modificações de dose estão apresentadas na Tabela 15. As reduções no nível de dose estão apresentadas na Tabela 16.
Tabela 15: Modificações de doses durante o tratamento com Kyprolis
|
Toxicidade8 hematológica |
Ação recomendada |
|
CAN < 0,5 x 109/L |
Interromper dose
Para quedas subsequentes para valores < 0,5 x 109/L, seguir as mesmas recomendações acima e considerar redução de 1 nível de dose quando do reinício de Kyprolisa |
|
Neutropenia105 febril |
Interromper dose
|
|
Plaquetas72 < 10 x 109/L ou evidência de sangramento com trombocitopenia71 (vide “ADVERTÊNCIAS E PRECAUÇÕES”) |
Interromper dose
Se recuperar para valores < 10 x 109/L e/ou o sangramento for controlado, continuar na mesma dose |
|
Toxicidade8 não hematológica (renal46) |
Ação recomendada |
|
Creatinina5 sérica ≥ 2 × o valor basal ou Clearance de creatinina5 < 15 mL/min (ou redução do clearance de creatinina5 para ≤ 50% do valor basal) ou necessidade de diálise97 (vide “ADVERTÊNCIAS E PRECAUÇÕES”) |
Interromper dose e continuar monitorando a função renal46 (creatinina5 sérica ou
Se tolerada, a dose reduzida pode ser aumentada para a dose prévia a critério do médico Para pacientes17 em diálise97 recebendo Kyprolis, a dose deve ser administrada após o procedimento da diálise97 clearance de creatinina5) |
|
Outras toxicidades não hematológicas |
Ação recomendada |
|
Todas as outras toxicidades não hematológicas Grau 3 ou 4 (vide “ADVERTÊNCIAS E PRECAUÇÕES”) |
Interromper até resolução ou retorno ao basal Considerar o reinício do próximo tratamento com redução de 1 nível de dosea Se tolerada, a dose reduzida pode ser aumentada para a dose prévia a critério do médico |
CAN = contagem absoluta de neutrófilos106
a Vide Tabela 8 para reduções de dose.
Tabela 16: Reduções das doses de Kyprolis
|
Regime |
Dose |
Primeira redução de dose |
Segunda redução de dose |
Terceira redução de dose |
|
Monoterapia |
27 mg/m2 |
20 mg/m2 |
15 mg/m2a |
— |
|
Kyprolis, lenalidomida e dexametasona |
27 mg/m2 |
20 mg/m2 |
15 mg/m2a |
— |
|
Kyprolis, dexametasona e daratumumabe |
56 mg/m2 |
45 mg/m2 |
36 mg/m2 |
27 mg/m2a |
|
|
70 mg/m2 |
56 mg/m2 |
45 mg/m2 |
36 mg/m2 |
|
Kyprolis mais dexametasona |
56 mg/m2 |
45 mg/m2 |
36 mg/m2 |
27 mg/m2a |
|
|
70 mg/m2 |
56 mg/m2 |
45 mg/m2 |
36 mg/m2 |
|
Nota: Os tempos de infusão devem permanecer inalterados durante as reduções de dose. a Se os sintomas23 não se resolverem, o tratamento com Kyprolis deverá ser descontinuado. |
||||
Reconstituição e preparo da administração intravenosa
A solução reconstituída contém carfilzomibe na concentração de 2 mg/mL. Leia as instruções completas de preparo antes da reconstituição.
Remova o frasco-ampola da geladeira apenas imediatamente antes de usar.
Calcule a dose (mg/m2) e o número de frascos-ampolas de Kyprolis necessários usando a ASC basal do paciente. Pacientes com uma ASC maior que 2,2 m2 devem receber uma dose baseada na ASC de 2,2 m2. Ajustes de dose não precisam ser feitos para alterações ponderais ≤ 20%.
Use apenas agulha de 21 gauges ou com gauge superior (diâmetro externo da agulha de 0,8 mm ou menor) para reconstituir assepticamente cada frasco-ampola injetando lentamente 29 mL de água estéril (para frasco de 60 mg) através da tampa e direcionando a solução para a PAREDE INTERNA DO FRASCO-AMPOLA, para minimizar a formação de bolhas. Não reconstituir Kyprolis com solução salina normal.
Movimente em círculos ou inverta lentamente o frasco-ampola por aproximadamente 1 minuto, ou até completa dissolução. NÃO AGITE. Se houver formação de bolhas, deixe a solução descansar no frasco-ampola até que as bolhas desapareçam (aproximadamente 5 minutos) e a solução fique clara.
Inspecione visualmente para verificar se há a presença de partículas ou alterações na coloração antes da administração. O produto reconstituído deve ser uma solução clara, transparente a levemente amarelada e não deve ser administrado caso se observem partículas ou alterações na coloração.
Descarte qualquer material deixado no frasco-ampola.
Kyprolis pode ser administrado diretamente por infusão IV ou optar por administrar em uma bolsa para infusão IV. Não administrar como bolus107 IV.
Quando a administração for realizada em bolsa para infusão IV utilizar somente agulha de 21 gauges ou com gauge superior (diâmetro externo da agulha de 0,8 mm ou menor) para retirar a dose calculada do frasco-ampola e diluir em uma bolsa para infusão IV de 50 ou 100 mL contendo glicose108 5% para injeção102. Não diluir Kyprolis em solução salina normal.
Populações especiais
Insuficiência renal45: Pacientes com insuficiência renal45 moderada a grave foram incluídos nos estudos de combinação de Kyprolis e dexametasona, porém foram excluídos dos estudos de combinação de Kyprolis com lenalidomida. Desta forma, existem dados limitados para Kyprolis em combinação com lenalidomida e dexametasona em pacientes com clearance de creatinina5 (CrCL < 50 mL/min). Redução apropriada da dose para dose inicial de lenalidomida em pacientes com insuficiência renal45 de base pode ser considerada de acordo com as recomendações da bula de lenalidomida.
Não há ajuste de dose inicial recomendado para Kyprolis para pacientes17 com insuficiência renal45 leve, moderada ou grave ou para pacientes17 em diálise97 crônica baseado em dados de farmacocinética disponíveis (vide “CARACTERÍSTICAS FARMACOLÓGICAS”). Entretanto, em estudos clínicos de fase 3 a incidência15 de eventos adversos de insuficiência renal45 aguda foi maior em pacientes com clearance de creatinina5 de base menores do que entre os pacientes com maior clearance de creatinina5 de base.
A função renal46 deve ser avaliada no início do tratamento e monitorada ao menos uma vez ao mês ou de acordo com os guias de práticas médicas, particularmente em pacientes com clearance de creatinina5 de base menores (CrCL < 30 mL/min). Modificações de dose apropriadas baseadas na toxicidade8 devem ser realizadas (vide Tabela 11). Há dados limitados de segurança e eficácia em pacientes com clearance de creatinina5 de base < 30 mL/min.
Como o clearance da concentração de Kyprolis com a diálise97 não foi estudado, o produto deve ser administrado após o procedimento de diálise97.
Insuficiência hepática42: Pacientes com insuficiência hepática42 moderada ou grave foram excluídos dos estudos de Kyprolis em combinação tanto com lenalidomida e dexametasona quanto com dexametasona isolada.
A farmacocinética de Kyprolis não foi avaliada em pacientes com insuficiência hepática42 grave. Não há ajuste de dose inicial recomendado para pacientes17 com insuficiência hepática42 leve ou moderada baseado nos dados de farmacocinética disponíveis. Entretanto, a incidência15 maior de pacientes com função hepática14 anormal, eventos adversos ≥ grau 3 e eventos adversos graves foram reportados em pacientes com insuficiência hepática42 leve a moderada de base comparada com pacientes com função hepática14 normal (vide “ADVERTÊNCIAS E PRECAUÇÕES” e “CARACTERÍSTICAS FARMACOLÓGICAS”). As enzimas hepáticas76 e a bilirrubina77 devem ser avaliadas no início do tratamento e monitorados mensalmente durante o tratamento com carfilzomibe, independentemente dos valores iniciais, e devem ser feitas modificações de dose adequadas com base na toxicidade8 (vide Tabela 11). Deve ser dada especial atenção aos pacientes com insuficiência hepática42 moderada e grave, tendo em vista os dados de segurança e eficácia muito limitados sobre essa população.
População idosa: Em geral, a incidência15 de certos eventos adversos (incluindo insuficiência cardíaca49) nos estudos clínicos foi maior em pacientes > 75 anos de idade em comparação aos pacientes < 75 anos de idade (vide “ADVERTÊNCIAS E PRECAUÇÕES”).
População pediátrica: A segurança e a eficácia de Kyprolis não foram estabelecidas em pacientes pediátricos. Não há dados disponíveis.
Método de administração
Administre por via IV como uma infusão de 10 ou de 30 minutos, dependendo do regime de dose de Kyprolis (vide Tabela 3). Kyprolis não deve ser administrado como um bolus107 IV.
O equipo e o cateter de administração IV devem ser lavados com solução salina ou com solução de glicose108 5% imediatamente antes e após a administração de Kyprolis.
Não misture ou administre Kyprolis com outros medicamentos.
REAÇÕES ADVERSAS
As reações adversas que ocorreram durante o tratamento com Kyprolis incluem: insuficiência cardíaca49; infarto do miocárdio7, parada cardíaca, isquemia52 miocárdica, doença pulmonar intersticial60, pneumonite59, síndrome57 da angústia respiratória aguda, insuficiência respiratória aguda58; hipertensão61 pulmonar; dispneia20; hipertensão61, incluindo crises hipertensivas; insuficiência renal45 aguda; síndrome57 de lise63 tumoral; reações relacionadas à infusão; hemorragia70 gastrointestinal, hemorragia70 intracraniana, hemorragia70 pulmonar; trombocitopenia71, insuficiência hepática42; reativação do vírus83 da hepatite84 B, SEPR e microangiografia trombótica78. Em estudos clínicos com Kyprolis, toxicidade8 cardíaca e dispneia20 ocorreram tipicamente no início da terapia com Kyprolis (vide “ADVERTÊNCIAS E PRECAUÇÕES”). As reações adversas mais comuns (ocorrendo em > 20% dos indivíduos) foram: anemia109, trombocitopenia71, neutropenia105, náusea110, diarreia111, fadiga98, pirexia112, infecção85 do trato respiratório, dispneia20 e tosse.
Combinação com dexametasona e daratumumabe
No estudo CANDOR, em que Kyprolis 20/56 mg/m2 duas vezes por semana foi administrado nos dois braços, mortes devido a eventos adversos em até 30 dias depois da última dose de qualquer tratamento do estudo ocorreram em 30/308 dos pacientes (10%) no grupo KdD, comparado com 8/153 (5%) pacientes no grupo Kd. A causa mais comum de morte entre os pacientes (%) nos dois grupos (KdD comparado a Kd) foi infecção85 14 (5%) versus 4 (3%). O risco de eventos adversos fatais emergentes ao tratamento foi maior entre os pacientes ≥ 65 anos de idade, veja ADVERTÊNCIAS E PRECAUÇÕES – População Geriátrica. Eventos adversos sérios foram relatados em 56% dos pacientes no braço KdD e em 46% dos pacientes no braço Kd. Os eventos adversos sérios mais comuns reportados no grupo KdD, se comparado ao grupo Kd foram anemia109 (2% ante 1%), diarreia111 (2% ante 0%), pirexia112 (4% ante 2%), pneumonia113 (12% ante 9%), influenza114 (4% ante 1%), sepse115 (4% ante 1%) e bronquite (2% ante 0%). Eventos adversos de grau ≥ 3 ocorreram em 82% dos pacientes no grupo KdD, comparado a 74% no grupo Kd. Os eventos adversos de grau ≥ 3 mais frequentemente reportados (ocorrendo ≥ 10% dos participantes em qualquer um dos grupos de tratamento [KdD, Kd]) incluíram trombocitopenia71 (24%, 16%), hipertensão61 (18%, 13%), anemia109 (17%, 14%) e pneumonia113 (13%, 9%). A descontinuação do tratamento do estudo devido a quaisquer eventos adversos ocorreu em 22% dos pacientes no grupo KdD, ante 25% no grupo Kd.
Tabela 17: Resumo de incidência15, nos pacientes, de eventos adversos decorrentes do tratamento (na populaç ão de segurança dos grupos Kd e KdD)
|
|
KD |
KdD |
|---|---|---|
|
Todos os eventos adversos decorrentes do tratamento |
147 (96,1) |
306 (99,4) |
|
Grau ≥ 3 |
113 (73,9) |
253 (82,1) |
|
Eventos adversos sérios |
70 (45,8) |
173 (56,2) |
|
Eventos adversos fatais |
8 (5,2) |
30 (9,7) |
K = Kyprolis, d = dexametasona, D = daratumumabe
Eventos adversos decorrentes do tratamento são definidos como qualquer evento adverso com início depois da administração da primeira dose e em até 30 dias depois da última dose de qualquer produto em investigação. Os eventos adversos são codificados usando MedDRA (versão 22.0) e classificados usando NCI-CTCAE (versão 4.03).
Tabela resumo das reações adversas
As reações adversas estão apresentadas abaixo por classes de sistemas de órgãos e frequência (Tabela 18).
As categorias de frequência foram determinadas pela taxa de incidência15 bruta relatada para cada reação adversa em uma base de dados dos estudos clínicos agrupados (n = 3.878). Em cada categoria de classe de sistema de órgão e frequência, as reações adversas estão apresentadas em ordem decrescente de seriedade.
Tabela 18: Resumo das Reações Adversas
|
Sistema Órgão Classe MedDRA |
Muito comum |
Comum |
Incomum |
Raro |
|
Infecções116 e infestações |
Pneumonia113 Infecção85 do trato respiratório Bronquite |
Sepsis Infecção85 pulmonar Influenza114 Herpes zoster103* Infecção85 do trato urinário117 Gastroenterite118 Infecção85 viral Nasofaringite Rinite119 |
Choque120 séptico Colite121 Clostridium difficile Infecção85 por citomegalovírus122 Reativação do vírus83 da Hepatite84 B |
|
|
Desordens do sistema imunológico123 |
|
|
Hipersensibilidade à droga |
|
|
Desordens do sangue32 e sistema linfático124 |
Trombocitopenia71 Neutropenia105 Anemia109 Linfopenia Leucopenia125 |
Neutropenia105 febril |
Púrpura79 trombocitopênica trombótica78 |
Síndrome57 hemolítico urêmica Microangiopatia trombótica78 |
|
Metabolismo36 e desordens nutricionais |
Hipocalemia126 Redução do apetite |
Desidratação127 Hipercalemia128 Hipomagnesemia Hiponatremia129 Hipercalcemia Hipocalcemia130 Hipofosfatemia Hiperuricemia Hipoalbuminemia131 Hiperglicemia132 |
Síndrome57 da lise63 tumoral |
|
|
Desordens psiquiátricas |
Insônia |
Ansiedade Confusão |
|
|
|
Desordens do sistema nervoso133 |
Tontura99 Neuropatia periférica16 Cefaleia81 |
Parestesia134 Hipoestesia135 |
Hemorragia70 intracraniana Acidente cerebrovascular Síndrome57 da encefalopatia80 posterior reversível |
|
|
Desordens oculares |
|
Catarata136 Visão137 embaçada |
|
|
|
Desordens do ouvido e do labirinto138 |
|
Zumbido |
|
|
|
Desordens cardíacas |
|
Insuficiência cardíaca49 Infarto do miocárdio7 Fibrilação atrial Taquicardia139 Palpitações140 |
Parada cardíaca Isquemia52 miocárdica Redução da fração de ejeção Derrame141 do pericárdio142 Cardiomiopatia Pericardite143 |
|
|
Desordens vasculares144 |
Hipertensão61 |
Trombose venosa profunda74 Hipotensão68 Ondas de calor |
Crise hipertensiva Hemorragia70 |
Emergência145 hipertensiva |
|
Desordens respiratórias, torácicas e mediastinais |
Dispneia20 Tosse |
Embolia75 pulmonar Edema pulmonar51 Epistaxe146 Dor orofaríngea147 Disfonia148 Sibilo Hipertensão61 pulmonar |
Síndrome57 da angústia respiratória aguda Insuficiência respiratória aguda58 Hemorragia70 pulmonar Doença pulmonar intersticial60 Pneumonite59 |
|
|
Desordens gastrintestinais |
Vômitos67 Diarreia111 Constipação149 Náusea110 |
Dor abdominal Dispepsia150 Dor de dente151 |
Hemorragia70 gastrintestinal Perfuração gastrintestinal Obstrução intestinal Pancreatite152 aguda |
|
|
Desordens hepatobiliares153 |
|
Elevação da alanina aminotransferase Elevação da aspartato aminotransferase Elevação da gama- glutamiltransferase Hiperbilirrubinemia |
Insuficiência hepática42 Colestase154 |
|
|
Desordens da pele e tecido subcutâneo155 |
|
Erupção156 cutânea157 Prurido158 Eritema159 Hiperidrose160 |
|
Angioedema161 |
|
Desordens do tecido conjuntivo162 e musculoesquelético |
Dor nas costas163 Artralgia22 Dor nas extremidades Espasmos164 musculares |
Dor musculoesquelética Dor no peito165 Dor óssea Mialgia21 Fraqueza muscular |
|
|
|
Desordens renais e urinárias |
Elevação da creatinina5 |
Insuficiência renal45 aguda Insuficiência renal45 Comprometimento renal46 Redução do clearance de creatinina5 |
|
|
|
Desordens gerais e condições no sítio de administração |
Pirexia112 Edema66 periférico Astenia166 Fadiga98 |
Dor no peito165 Dor Reação no sítio de infusão Doença como Influenza114 Mal-estar Calafrios19 |
Síndrome57 da disfunção de múltiplos órgãos |
|
|
Investigações |
|
Elevação da proteína C reativa Elevação do ácido úrico |
|
|
|
Lesão167, envenenamento e complicações procedimentais |
|
Reações relacionadas à infusão |
|
|
* Frequência calculada baseada em dados de estudos clínicos nos quais a maioria dos pacientes realizaram profilaxia.
Relato de suspeita de reações adversas
O relato de suspeita de reações adversas após autorização do produto clínico é importante. Isso permite continuar o monitoramento do equilíbrio de risco/benefício do medicamento.
Em casos de eventos adversos, notifique ao Sistema de Notificação de Eventos Adversos a Medicamentos – VIGIMED, ou para a Vigilância Sanitária Estadual ou Municipal.
SUPERDOSE
Início agudo168 de calafrios19, hipotensão68, insuficiência renal45, trombocitopenia71 e linfopenia foi relatado após uma dose de 200 mg de Kyprolis administrada erroneamente.
Não existe um antídoto169 específico conhecido para ser usado em caso de superdose de carfilzomibe. Em caso de superdose, o paciente deve ser monitorado especificamente para os efeitos colaterais170 e/ou reações adversas listadas em “REAÇÕES ADVERSAS”.
Em caso de intoxicação, ligue para 0800 722 6001 se você precisar de mais orientações.
DIZERES LEGAIS
VENDA SOB PRESCRIÇÃO MÉDICA
USO RESTRITO A HOSPITAIS
MS 1.0244.0010
Farm. Resp.: Monica Carolina Dantas Pedrazzi - CRF-SP 30.103
Importado por:
Amgen Biotecnologia do Brasil Ltda. Rua Patrícia Lucia de Souza, 146.
Taboão da Serra – SP CNPJ: 18.774.815/0001-93
Fabricado por:
Patheon Manufacturing Services LLC Greenville – Estados Unidos da América
Ou
Amgen Technology (Ireland) Unlimited Company Dublin - Irlanda
Embalada por:
Amgen Manufacturing Limited – Juncos, Porto Rico
SAC 0800 264 0800






