Prosoy (Bula do profissional de saúde)
FARMOQUÍMICA S/A
IDENTIFICAÇÃO DO MEDICAMENTO
Prosoy®
cloridrato de dapoxetina
Comprimidos 30 mg
FORMA FARMACÊUTICA E APRESENTAÇÃO:
Comprimido revestido
Embalagem com 3 ou 6 comprimidos
VIA ORAL
USO ADULTO
COMPOSIÇÃO:
Cada comprimido de Prosoy® contém:
| cloridrato de dapoxetina (equivalente a 30 mg de dapoxetina base) | 33,582 mg |
| excipientes q.s.p. | 1 comprimido |
Excipientes: lactose1 monohidratada, celulose microcristalina, croscarmelose sódica, hipromelose, álcool isopropílico, dióxido de silício, estearato de magnésio, álcool polivinílico, dióxido de titânio, polietilenoglicol, talco e água purificada.
INFORMAÇÕES TÉCNICAS AOS PROFISSIONAIS DE SAÚDE2
INDICAÇÕES
Prosoy® é indicado no tratamento da ejaculação3 precoce (EP) em homens de 18 a 64 anos de idade, com todas as seguintes características:
- ejaculação3 persistente ou recorrente com mínima estimulação sexual antes, durante ou logo após a penetração e antes que o paciente deseje; e
- angústia pessoal acentuada ou dificuldade interpessoal como consequência da EP; e pouco controle sobre a ejaculação3.
RESULTADOS DE EFICÁCIA
A eficácia do cloridrato de dapoxetina no tratamento da ejaculação3 precoce foi estabelecida em cinco estudos clínicos1, 2, 3 e 4 duplo-cegos e controlados por placebo4, nos quais um total de 6081 indivíduos foram randomizados. Os indivíduos tinham 18 anos de idade ou mais com histórico de EP na maioria das experiências sexuais no período de 6 meses antes da inclusão. Em quatro dos estudos1, 3 e 4, os indivíduos apresentaram um tempo de latência5 ejaculatória intravaginal (IELT; tempo desde a penetração vaginal até o momento da ejaculação3 intravaginal) ≤ 2 minutos em, no mínimo, 75% das relações sexuais avaliáveis durante o período basal. No quinto estudo2, os indivíduos tinham os mesmos critérios de entrada; no entanto, o IELT não foi medido usando um cronômetro. Indivíduos com outras formas de disfunção sexual, incluindo disfunção erétil, ou aqueles que utilizam outras formas de farmacoterapia para o tratamento da EP foram excluídos de todos os estudos. Em quatro estudos1, 3 e 4, o desfecho primário do IELT médio foi medido usando um cronômetro durante cada episódio de relação sexual.
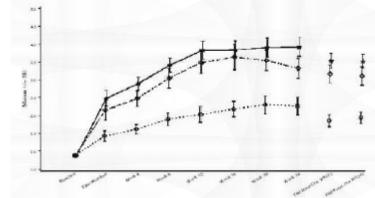
Os resultados de todos os estudos randomizados foram consistentes. Em um estudo representativo (R096769-PRE-3001)1 com a maior duração de tratamento (24 semanas), 1162 indivíduos foram randomizados, 385 para placebo4, 388 para cloridrato de dapoxetina 30 mg conforme necessário e 389 para cloridrato de dapoxetina 60 mg conforme necessário. A média do IELT médio no período basal e do desfecho do estudo para todos os grupos de tratamento é mostrada na Figura 1. Os aumentos na média do IELT médio no desfecho da Semana 24 (LPOCF) foram estatisticamente significativos (p<0,001) nos dois grupos do cloridrato de dapoxetina em comparação ao placebo4. A magnitude do prolongamento do IELT estava relacionada ao IELT basal e era variável entre indivíduos. A relevância clínica dos efeitos do tratamento com cloridrato de dapoxetina é descrita abaixo em termos de taxas de resposta relatadas pelos pacientes.
Figura 1: Média (+/- EP) do IELT (min) ao longo do tempo - Estudo R096769-PRE-3001
|
|
Tamanho da amostra (N) para cada visita na Figura 1 |
|||||||||
|
Período basal |
Primeira Pós-dose |
Sem 4 |
Sem 8 |
Sem 12 |
Sem 16 |
Sem 20 |
Sem 24 |
Desfecho S |
Desfecho |
|
|
Placebo4 |
382 |
339 |
332 |
280 |
238 |
221 |
195 |
182 |
339 |
339 |
|
DPX 30 mg PRN¹ |
385 |
363 |
356 |
303 |
264 |
240 |
221 |
218 |
363 |
363 |
|
DPX 60 mg PRN¹ |
387 |
355 |
347 |
287 |
249 |
229 |
214 |
198 |
355 |
355 |
¹PRN = conforme necessário
Grupo de Tratamento: •• PLACEBO4 •• DPX 30 MG PRN •• DPX 60 MG PRN
Desfecho (TRT Sem 12) = LPOCF até a Semana 12.
Desfecho (TRT Sem 24) = LPOCF até a Semana 24 O LPOCF é a última observação pós-período basal realizada.
Além do desfecho primário do IELT médio, foi demonstrado um benefício significativo do tratamento para o paciente no estudo acima, usando uma definição de resposta ao tratamento que consiste em um composto de pelo menos um aumento de duas categorias no controle da ejaculação3 e pelo menos uma diminuição de 1 categoria em angústia relacionada à ejaculação3. Uma porcentagem significativamente maior do ponto de vista estatístico de indivíduos respondeu em cada um dos grupos de cloridrato de dapoxetina versus placebo4 a partir da semana 4 e até a semana 24 (p=0,003 para dapoxetina 30 mg versus placebo4 na semana 16, todas as outras comparações p ≤ 0,001). Também foram observadas uma redução significativa na angústia do indivíduo e uma melhora significativa na satisfação do indivíduo com a relação sexual. As melhoras nas Semanas 12 e 24 (LPOCF) para os principais desfechos secundários são apresentadas na Tabela 1.
Tabela 1: Porcentagem de indivíduos com melhora nos principais desfechos secundários - Estudo R096769-PRE-3001
|
Principal desfecho secundário (LPOCF *) |
Placebo4 |
cloridrato de dapoxetina 30 mg |
cloridrato de dapoxetina 60 mg |
|
Composto de Resposta do Tratamento (alteração ≥ 2 no controle e ≤ -1 na angústia) |
(n=346) |
(n=359) |
(n=353) |
|
Semana 12 |
12,1 |
27,3* |
34,0* |
|
Semana 24 |
13,0 |
25,3* |
37,1* |
|
Alteração ≤ -1 em angústia |
(n=347) |
(n=360) |
(n=353) |
|
Semana 12 |
46,1 |
63,1* |
65,4* |
|
Semana 24 |
47,8 |
60,0* |
68,6* |
|
Alteração ≥ 1 em satisfação |
(n=347) |
(n=359) |
(n=353) |
|
Semana 12 |
31,7 |
51,3* |
56,1* |
|
Semana 24 |
35,7 |
48,5* |
55,8* |
Valor de p <0,001 para cloridrato de dapoxetina versus placebo4; LPOCF é a última observação pós-período basal realizada
Outros desfechos secundários de resultados relatados pelo paciente (PRO) foram avaliados nos estudos clínicos, incluindo a impressão clínica global de alteração de condição, CGIC, uma medida comumente usada na qual os pacientes avaliam o status de sua condição. Os pacientes foram solicitados a comparar sua ejaculação3 precoce desde o início do estudo, com opções de resposta variando de muito melhor a muito pior. Os desfechos de CGIC mostraram melhora estatisticamente significativa em comparação com o placebo4 quando testados no nível de significância nominal de 0,05 (bilateral). Os resultados de CGIC por grupo de tratamento relatados no final do estudo acima são mostrados na Tabela 2.
Tabela 2: Resultados da impressão clínica global de alteração de condição no desfecho do estudo (LPOCF*); Estudo R096769-PRE-3001
|
Resultado da Resposta de CGIC |
Placebo4 n (%) |
cloridrato de dapoxetina 30 mg n (%) |
cloridrato de dapoxetina 60 mg n (%) |
|
Sem Alteração ou Pior** |
236 (68,0%) |
152 (42,3%) |
97 (27,6%) |
|
Ligeiramente Melhor |
57 (16,4%) |
97 (27,0%)+ |
117 (33,2%)+ |
|
Melhor |
41(11,8%) |
74 (20,6%) |
96 (27,3%) |
|
Muito Melhor |
13 (3,7%) |
36 (10,0%) |
42 (11,9%) |
|
Total |
347 (100%) |
359 (100%) |
352 (100%) |
*LPOCF é a última observação pós-período basal realizada
**Sem alteração ou pior inclui Nenhuma Alteração, Um pouco pior, Pior ou Muito pior
+Taxa de resposta de CGIC pelo menos ligeiramente melhor (inclui Ligeiramente melhor, Melhor e Muito melhor): Placebo4 (32%,) cloridrato de dapoxetina 30 mg (57,7%) e cloridrato de dapoxetina 60 mg (72,4%) com valor de p <0,0001 para cloridrato de dapoxetina 30 mg versus placebo4 e cloridrato de dapoxetina 60 mg versus placebo4
Os efeitos de abstinência de doses diárias crônicas e conforme necessário de 60 mg de cloridrato de dapoxetina no tratamento da ejaculação3 precoce foram avaliados em um estudo2 em grupo paralelo, duplo-cego e controlado por placebo4, em que 1238 indivíduos foram randomizados. Os indivíduos receberam placebo4 ou 60 mg de cloridrato de dapoxetina uma vez ao dia ou conforme necessário por 62 dias, seguidos por uma fase de avaliação de abstinência de 7 dias de tratamento adicional com cloridrato de dapoxetina ou placebo4. Os efeitos de abstinência após a interrupção abrupta da terapia foram medidos usando a ferramenta Sinais6 e Sintomas7 Emergentes da Descontinuação (DESS), um instrumento classificado pelo médico que consulta sintomas7 e sinais6 associados à descontinuação do tratamento com inibidores da recaptação de serotonina. Para cada indivíduo, a síndrome8 de descontinuação foi definida como um aumento na pontuação semanal do DESS em pelo menos 4 pontos do dia 63 ao dia 70. Nesse estudo, não havia evidências claras da síndrome8 de descontinuação (abstinência) após a descontinuação abrupta da terapia com cloridrato de dapoxetina. Consistente com a falta de síndrome8 de descontinuação baseada no DESS, os dados de eventos adversos mostraram pouca evidência de sintomas7 de abstinência. Resultados semelhantes foram observados em um segundo estudo clínico2 duplo-cego, com uma fase de tratamento de 24 semanas com doses de 30 e 60mg, conforme necessário, seguido de um período de avaliação de abstinência de 1 semana.
Nos dois estudos3 multidose de Fase 3 em que foi identificado o status do metabolizador de CYP2D6, um total de 120 metabolizadores fracos e 1598 metabolizadores extensos foram incluídos e tratados com cloridrato de dapoxetina. Não foram observadas diferenças gerais na eficácia ou segurança entre metabolizadores fracos e extensos.
Referências Bibliográficas:
- BUVAT J, TESFAYE F, ROTHMAN M, RIVAS DA, GIULIANO F. Dapoxetine for the treatment of premature ejaculation: results from a randomized, doubleblind, placebo4-controlled phase 3 trial in 22 countries. Eur Urol. 2009;55: 957–67.
- KAUFMAN JM, ROSEN RC, MUDUMBI RV, TESFAYE F, HASHMONAY R, RIVAS D. Treatment benefit of dapoxetine for premature ejaculation: results from a placebo4-controlled phase III trial. BJU Int. 2009;103:651–8.
- PRYOR JL, ALTHOF SE, STEIDLE C, ROSEN RC, HELLSTROM WJ, SHABSIGH R, et al. Efficacy and tolerability of dapoxetine in treatment of premature ejaculation: an integrated analysis of two double-blind, randomised controlled trials. Lancet. 2006;368:929–37.
- MCMAHON C, KIM SW, PARK NC, CHANG CP, RIVAS D, TESFAYE F, et al. Treatment of premature ejaculation in the Asia-Pacific region: results from a phase III double-blind, parallel- group study of dapoxetine. J Sex Med. 2010;7:256–68
CARACTERÍSTICAS FARMACOLÓGICAS
Farmacodinâmica
Mecanismo de ação: Presume-se que o mecanismo de ação da dapoxetina na ejaculação3 precoce esteja ligado à inibição da recaptação neuronal da serotonina e à subsequente potencialização da ação do neurotransmissor nos receptores pré e pós-sinápticos.
A ejaculação3 humana é principalmente mediada pelo sistema nervoso9 simpático10. A via ejaculatória se origina de um centro de reflexo espinhal, mediado pelo tronco encefálico11, que é influenciado inicialmente por vários núcleos no cérebro12 (núcleos pré-ópticos e paraventriculares mediais). No rato, a dapoxetina inibe o reflexo de expulsão ejaculatório, agindo no nível supraespinhal com o núcleo paragigantocelular lateral (LPGi) como uma estrutura cerebral necessária para o efeito. As fibras simpáticas pós-ganglionares que inervam as vesículas seminais13, o canal deferente14, a próstata15, os músculos16 bulbouretrais e o colo17 da bexiga18 fazem com que se contraiam de maneira coordenada para alcançar a ejaculação3. A dapoxetina modula esse reflexo ejaculatório em ratos, causando um aumento na latência5 da descarga do reflexo do motoneurônio do pudendo (PMRD) e uma redução na duração da PMRD.
Farmacocinética
Absorção: A dapoxetina é rapidamente absorvida com concentrações plasmáticas máximas (Cmáx) ocorridas em aproximadamente 1-2 horas após a ingestão do comprimido. A biodisponibilidade absoluta de 42% (faixa de 15 a 76%). Após doses orais únicas de 30 mg e 60 mg em jejum, as concentrações plasmáticas máximas de dapoxetina foram 297 ng/mL após 1,01 horas e 498 ng/mL após 1,27 horas, respectivamente.
A ingestão de uma refeição rica em gorduras reduziu modestamente a Cmáx (em 10%) e aumentou modestamente a ASC (em 12%) da dapoxetina e atrasou ligeiramente o tempo para a dapoxetina atingir concentrações máximas; no entanto, a extensão da absorção não foi afetada pelo consumo de uma refeição rica em gordura19. Essas alterações não são clinicamente significativas. Prosoy® pode ser tomado com ou sem alimentos.
Distribuição: Mais de 99% da dapoxetina está ligada in vitro às proteínas20 humanas. O metabolito21 ativo desmetildapoxetina está ligado a 98,5% de proteínas20. A dapoxetina parece ter uma distribuição rápida com um volume de distribuição médio em estado de equilíbrio de 162 L. Após administração intravenosa em humanos, os valores médios estimados de meia-vida inicial, intermediária e terminal para a dapoxetina foram de 0,10, 2,19 e 19,3 horas respectivamente.
Biotransformação: Estudos in vitro sugerem que a dapoxetina é eliminada por múltiplos sistemas enzimáticos no fígado22 e nos rins23, principalmente CYP2D6, CYP3A4 e flavina monooxigenase (FMO1). Após a administração oral em um estudo clínico desenvolvido para explorar o metabolismo24 da 14C-dapoxetina, a dapoxetina foi extensivamente metabolizada em múltiplos metabólitos25, principalmente através das seguintes vias de biotransformação: N-oxidação, N-desmetilação, hidroxilação de naftil, glicuronidação e sulfatação. Havia evidência de metabolismo24 pré-sistêmico26 de primeira passagem após administração oral.
A dapoxetina intacta e o dapoxetina-N-óxido foram as principais espécies circulantes no plasma27. Estudos in vitro mostram que o dapoxetina-N-óxido era inativo em uma bateria de estudos de ligação e transporte in vitro. Metabolitos25 adicionais incluem desmetildapoxetina (DED) e didesmetildapoxetina, que representam menos de 3% do material relacionado ao medicamento em circulação28. Estudos de ligação in vitro indicam que a DED é equipotente à dapoxetina e a didesmetildapoxetina possui aproximadamente 50% da potência da dapoxetina. A exposição não ligada de DED é aproximadamente 1/2 da exposição livre da dapoxetina. Estima-se que a Cmáx não ligada da DED seja 20-25% da Cmáx da dapoxetina na ausência de fatores intrínsecos ou extrínsecos que podem alterar os níveis de exposição.
Eliminação: Os metabolitos25 da dapoxetina foram principalmente eliminados nos conjugados de urina29. A substância ativa inalterada não foi detectada na urina29. A dapoxetina tem uma eliminação rápida, conforme evidenciado por uma baixa concentração (menos de 5% do pico) 24 horas após a administração. Houve acúmulo mínimo de dapoxetina após a dose diária. A meia-vida terminal é de aproximadamente 19 horas após a administração oral. A meia-vida da DED é semelhante à da dapoxetina.
Populações Especiais
Raça: Análises de estudos de farmacologia30 clínica de dose única usando 60 mg de dapoxetina não indicaram diferenças estatisticamente significativas entre caucasianos, negros, hispânicos e asiáticos. Um estudo clínico realizado para comparar a farmacocinética da dapoxetina em indivíduos japoneses e caucasianos mostrou níveis plasmáticos 10% a 20% mais altos (ASC e concentração máxima) da dapoxetina em indivíduos japoneses devido ao menor peso corporal. Não se espera que a exposição ligeiramente maior tenha um efeito clínico significativo.
Idosos (65 anos ou mais): As análises de um estudo de farmacologia30 clínica de dose única com 60 mg de dapoxetina mostraram que idosos saudáveis apresentaram um ligeiro aumento na AUCinf, em aproximadamente 12%, e uma meia- vida terminal média de aproximadamente 26 horas. Não se espera que esta exposição ligeiramente mais alta e meia-vida mais longa tenham um efeito clinicamente significativo
Comprometimento renal31: Em um estudo clínico farmacológico de dose única utilizando 60 mg de dapoxetina, não foi observada correlação entre a depuração da creatinina32 e a Cmáx ou ASCinf de dapoxetina em indivíduos com comprometimento renal31 leve (depuração de creatinina32 de 50 a 80 mL/min), moderado (depuração de creatinina32 de 30 a <50 mL/min) e grave (depuração de creatinina32 <30 mL/min). A farmacocinética da dapoxetina não foi avaliada em pacientes que necessitam de diálise33 renal31. Dados limitados (n = 4) em indivíduos com insuficiência renal34 grave mostraram um aumento aproximado de 100% na AUCinf quando comparados com indivíduos saudáveis sem insuficiência renal34. O uso do Prosoy® em pacientes com insuficiência renal34 grave não é recomendado.
Comprometimento hepático: Em pacientes com comprometimento hepático leve, a Cmáx não ligada da dapoxetina diminui em 28% e a ASC não ligada permanece inalterada. A Cmáx não ligada e a ASC da fração ativa (a soma da exposição não ligada de dapoxetina e desmetildapoxetina) diminuíram 30% e 5%, respectivamente. Em pacientes com comprometimento hepático moderado, a Cmáx não ligada da dapoxetina é essencialmente inalterada (redução de 3%) e a ASC não ligada aumenta em 66%. A Cmáx e ASC não ligadas da fração ativa foram essencialmente inalteradas e duplicaram, respectivamente.
Nos pacientes com comprometimento hepático grave, a Cmáx não ligada da dapoxetina diminuiu 42%, mas a ASC não ligada aumentou aproximadamente 223%. A Cmáx e a ASC da fração ativa tiveram alterações semelhantes.
O uso de Prosoy® em pacientes com insuficiência hepática35 moderada ou grave (Child-Pugh Classe B ou C) é contraindicado.
Polimorfismo de CYP2D6
Em um estudo clínico farmacológico de dose única, utilizando 60 mg de cloridrato de dapoxetina, as concentrações plasmáticas nos metabolizadores fracos do CYP2D6 foram superiores às dos metabolizadores extensos (aproximadamente 31% superiores para Cmáx e 36% superiores para ASCinf) de dapoxetina e 98% superiores para Cmáx e 161% superiores para ASCinf de desmetildapoxetina). Assim, a fração ativa de cloridrato de dapoxetina pode ser aumentada em aproximadamente 46% na Cmáx e em aproximadamente 90% na ASC. Este aumento pode resultar em uma maior incidência36 e gravidade de eventos adversos dependentes da dose.
A segurança de cloridrato de dapoxetina em metabolizadores fracos de CYP2D6 é particularmente preocupante com a administração concomitante de outros medicamentos que podem inibir o metabolismo24 da dapoxetina, como inibidores moderados e potentes de CYP3A4.
Espera-se que as concentrações plasmáticas de dapoxetina e desmetildapoxetina nos metabolizadores ultrarrápidos de CYP2D6 sejam diminuídas.
Carcinogenicidade, mutagenicidade e comprometimento da fertilidade
Em estudos com administração oral, a dapoxetina não foi cancerígena em ratos quando administrada diariamente por aproximadamente dois anos em doses de até 225 mg/kg/dia, produzindo aproximadamente o dobro das exposições (ASC) observadas em humanos do sexo masculino, dada a Dose Máxima Recomendada para Seres Humanos (MRHD) de 60 mg.
A dapoxetina também não causou tumores em camundongos Tg.rasH2 quando administrada nas doses máximas possíveis de 100 mg/kg por 6 meses e 200 mg/kg por 4 meses. As exposições em estado de equilíbrio de dapoxetina em camundongos após administração oral de 6 meses a 100 mg/kg/dia foram inferiores às exposições em dose única observadas clinicamente em 60 mg. A administração tópica diária por 6 meses em camundongos transgênicos Tg.AC a 375, 750 ou 1500 mg/kg/dia produziu alguma atividade promotora de tumor37 a (papilomas no local da aplicação) 750 mg/kg/dia ou mais. A exposição sistêmica ao medicamento, medida pela ASC da dapoxetina e seus principais metabólitos25 humanos, foi de aproximadamente 1 a 2 vezes a exposição em homens, dada a Dose Máxima Recomendada para Seres Humanos (MRHD) de 60 mg. O modelo de exposição tópica não é relevante para medicamentos administrados por via oral. Dapoxetina e seu principal metabólito21 humano não foram mutagênicos no ensaio bacteriano Ames in vitro ou no teste de mutação38 direta em células39 de linfoma40 de camundongo. A dapoxetina não foi clastogênica no teste de aberração cromossômica in vitro em células39 de ovário41 de hamster chinês ou no ensaio de micronúcleo de camundongo in vivo.
Com base em dados do estudo de carcinogenicidade de 2 anos em ratos, estudo de carcinogenicidade de 6 meses em Tg.rasH2 e estudos de toxicologia genética, não se espera que dapoxetina apresente risco carcinogênico. Não houve efeitos na fertilidade, desempenho reprodutivo ou morfologia de órgãos reprodutivos em ratos machos ou fêmeas e nenhum sinal42 adverso de embriotoxicidade ou fetotoxicidade em ratos ou coelhos.
CONTRAINDICAÇÕES
Prosoy® está contraindicado em pacientes com hipersensibilidade (alergia43) ao princípio ativo ou a qualquer um dos excipientes da fórmula.
Prosoy® também está contraindicado nos casos abaixo:
- Em pacientes com comprometimento hepático moderado e grave.
- Em pacientes com condições cardíacas patológicas significativas (como insuficiência cardíaca44 (classe II-IV da NYHA), anormalidades de condução (bloqueio AV de segundo ou terceiro grau ou síndrome8 do nódulo sinusal45) não tratadas com marca-passo46 permanente, doença cardíaca isquêmica significativa ou doença valvular significativa.
- Tratamento concomitante com inibidores da monoaminoxidase47 (IMAOs) ou dentro de 14 dias após a descontinuação do tratamento com um IMAO48. Da mesma forma, um IMAO48 não deve ser administrado dentro de 7 dias após a descontinuação do Prosoy®.
- Tratamento concomitante com tioridazina ou nos 14 dias seguintes à descontinuação do tratamento com tioridazina. Da mesma forma, a tioridazina não deve ser administrada dentro de 7 dias após a descontinuação do Prosoy®.
- Tratamento concomitante com inibidores da recaptação de serotonina [inibidores seletivos da recaptação de serotonina (ISRSs), inibidores da recaptação de serotonina-norepinefrina (IRSNs), antidepressivos tricíclicos (TCAs)] ou outros produtos medicinais/fitoterápicos com efeitos serotoninérgicos [por exemplo, L-triptofano, triptanos, tramadol, linezolida, lítio, erva de São João (Hypericum perforatum)] ou nos 14 dias seguintes à descontinuação do tratamento com estes produtos medicinais/fitoterápicos. Da mesma forma, esses produtos medicinais/fitoterápicos não devem ser administrados dentro de 7 dias após a descontinuação do Prosoy®.
- Tratamento concomitante com inibidores potentes do CYP3A4, como cetoconazol, itraconazol, ritonavir, saquinavir, telitromicina, nefazodona, nelfinavir, atazanavir, etc.
- Em pacientes que já tiveram síncope49.
- Em pacientes que já tiveram mania ou depressão grave.
ADVERTÊNCIAS E PRECAUÇÕES
Prosoy® é indicado apenas em homens com EP. A segurança não foi estabelecida e não há dados sobre os efeitos de retardamento da ejaculação3 em homens sem EP.
Etanol
A combinação de álcool com cloridrato de dapoxetina pode aumentar os efeitos neurocognitivos relacionados ao álcool e também aumentar os eventos adversos neurocardiogênicos, como a síncope49, aumentando o risco de lesões50 acidentais; portanto, os pacientes devem ser aconselhados a evitar o álcool enquanto tomam Prosoy®.
Síncope49
A frequência da síncope49 caracterizada como perda de consciência no programa de desenvolvimento clínico do cloridrato de dapoxetina variou de acordo com a população estudada e variou de 0,06% (30 mg) a 0,23% (60 mg) para indivíduos incluídos nos estudos clínicos controladas por placebo4 de Fase 3 a 0,64% (todas as doses combinadas) para estudos de Fase 1 de indivíduos saudáveis sem EP.
Possivelmente sintomas7 prodrômicos51 como náusea52, tontura53/vertigem54 e diaforese55 foram relatados com mais frequência entre os pacientes tratados com cloridrato de dapoxetina em comparação com o placebo4. Nos pacientes que receberam 30 mg de cloridrato de dapoxetina nos estudos clínicos de Fase 3, foram relatadas náuseas56 em 11,0%, tonturas57 em 5,8% e hiperidrose58/diaforese55 em 0,8%. Nos pacientes que receberam 60 mg de cloridrato de dapoxetina nos estudos clínicos de Fase 3, foram relatadas náuseas56 em 21,2%, tontura53 em 11,7% e hiperidrose58/diaforese55 em 1,5%. Além disso, a ocorrência de síncope49 e possivelmente sintomas7 prodrômicos51 parecem dependentes da dose, como demonstrado por maior incidência36 entre pacientes tratados com doses superiores a 60 mg, a dose diária máxima recomendada.
Os casos de síncope49 caracterizados como perda de consciência observados nos estudos clínicos foram considerados vasovagais na etiologia59 e a maioria ocorreu nas primeiras 3 horas após a administração da dose, após a primeira dose ou associada a procedimentos relacionados ao estudo no contexto clínico (como coleta de sangue60 e manobras ortostáticas e medidas da pressão arterial61). Possivelmente sintomas7 prodrômicos51, como náusea52, tontura53, vertigem54, palpitações62, astenia63, confusão e diaforese55 geralmente ocorreram nas primeiras 3 horas após a administração e muitas vezes precederam a síncope49. Os pacientes precisam estar cientes de que podem apresentar síncope49 a qualquer momento, com ou sem sintomas7 prodrômicos51, durante o tratamento com cloridrato de dapoxetina. Os responsáveis pela prescrição devem aconselhar os pacientes sobre a importância de manter a hidratação adequada e sobre como reconhecer sinais6 e sintomas7 prodrômicos51 para diminuir a probabilidade de lesões50 graves associadas às quedas devido à perda de consciência. Se o paciente tiver sintomas7 possivelmente prodrômicos51, ele/ela deve deitar-se imediatamente para que sua cabeça64 fique mais baixa do que o resto do corpo ou sentar-se com a cabeça64 entre os joelhos até que os sintomas7 passem, e deve evitar situações em que lesões50 possam ocorrer, incluindo dirigir ou operar máquinas perigosas, caso ocorra síncope49 ou outros efeitos no SNC65.
A combinação de álcool com cloridrato de dapoxetina pode aumentar os eventos adversos neurocardiogênicos, como a síncope49, aumentando assim o risco de lesões50 acidentais; portanto, os pacientes devem ser aconselhados a evitar o álcool ao tomar cloridrato de dapoxetina.
Indivíduos com doença cardiovascular subjacente foram excluídos de estudos clínicos de Fase 3. O risco de resultados cardiovasculares adversos da síncope49 (síncope49 cardíaca e síncope49 de outras causas) é aumentado em pacientes com doença cardiovascular estrutural subjacente (por exemplo, obstrução de fluxo documentada, doença cardíaca valvular, estenose66 carotídea e doença coronariana67). Não existem dados suficientes para determinar se esse risco aumentado se estende à síncope49 vasovagal em pacientes com doença subjacente.
Hipotensão68 ortostática
Um teste ortostático deve ser realizado antes do início da terapia. No caso de um histórico de reação ortostática documentada ou suspeita, o tratamento com cloridrato de dapoxetina deve ser evitado.
A hipotensão68 ortostática foi relatada em estudos clínicos. O responsável pela prescrição deve avisar o paciente com antecedência de que, se ele apresentar possíveis sintomas7 prodrômicos51, como tontura53 logo após ficar em pé, deve deitar-se imediatamente para que sua cabeça64 fique mais baixa que o resto do corpo ou sentar-se com a cabeça64 entre os joelhos até os sintomas7 passem. O responsável pela prescrição também deve informar o paciente para que não levante rapidamente após ter estado na posição deitada ou sentada por tempo prolongado. Além disso, cloridrato de dapoxetina deve ser prescrito com cautela em pacientes que tomam medicamentos com propriedades de vasodilatação (como antagonistas dos receptores alfa- adrenérgicos69, nitratos, inibidores de PDE5) devido a possível tolerância ortostática reduzida.
Inibidores moderados de CYP3A4
A dose é restrita a 30 mg quando usada concomitantemente com inibidores moderados de CYP3A4, como eritromicina, claritromicina, fluconazol, amprenavir, fosamprenavir, aprepitante, verapamil e diltiazem, e recomenda-se cautela.
Inibidores potentes de CYP2D6
Recomenda-se cautela se aumentar a dose para 60 mg em pacientes que tomam inibidores potentes de CYP2D6 ou se aumentar a dose para 60 mg em pacientes com metabolismo24 insatisfatório para CYP2D6, pois isso pode aumentar o nível de exposição, o que pode resultar em maior incidência36 e gravidade de eventos adversos dependentes da dose.
Suicídio/Pensamentos suicidas
Demonstrou-se que os ISRSs aumentam o risco comparado ao placebo4 do pensamento suicida e da taxa de suicídio em estudos de curto prazo em crianças e adolescentes com Transtorno Depressivo Maior e outros transtornos psiquiátricos. Estudos de curto prazo não mostraram um aumento no risco de taxa de suicídio com antidepressivos em comparação com o placebo4 em adultos acima de 24 anos. Em estudos clínicos com cloridrato de dapoxetina para o tratamento da ejaculação3 precoce, não havia indicação clara de taxa de suicídio emergente do tratamento.
Mania
Prosoy® não deve ser utilizado em pacientes com histórico de mania/hipomania ou transtorno bipolar e deve ser descontinuado em qualquer paciente que desenvolva sintomas7 desses transtornos.
Convulsão70
Devido ao potencial de ISRSs para diminuir o limiar convulsivo, Prosoy® deve ser descontinuado em qualquer paciente que desenvolva convulsões e evitado em pacientes com epilepsia71 instável. Pacientes com epilepsia71 controlada devem ser cuidadosamente monitorados.
Depressão comórbida e transtornos psiquiátricos
Homens com sinais6 e sintomas7 subjacentes de depressão devem ser avaliados antes do tratamento com Prosoy® para descartar transtornos depressivos não diagnosticados. O tratamento concomitante de Prosoy® com antidepressivos, incluindo ISRSs e IRSNs, é contraindicado. Não é recomendado descontinuar o tratamento para depressão ou ansiedade em andamento, a fim de iniciar Prosoy® para o tratamento de EP. Prosoy® não é indicado para transtornos psiquiátricos e não deve ser usado em homens com esses transtornos, como esquizofrenia72, ou naqueles que sofrem de depressão comórbida, pois o agravamento dos sintomas7 associados à depressão não pode ser excluído.
Isso pode ser o resultado de um transtorno psiquiátrico subjacente ou pode resultar de terapia com medicamentos. Os médicos devem incentivar os pacientes a relatarem pensamentos ou sentimentos angustiantes a qualquer momento e, se houver sinais6 e sintomas7 de depressão durante o tratamento, Prosoy® deve ser descontinuado.
Hemorragia73
Houve relatos de anormalidades hemorrágicas74 com ISRSs. Recomenda-se cautela em pacientes que tomam Prosoy®, particularmente em uso concomitante com medicamentos que afetam a função plaquetária (por exemplo, antipsicóticos atípicos e fenotiazinas, a maioria dos antidepressivos tricíclicos [TCAs], ácido acetilsalicílico, medicamentos anti-inflamatórios não esteroides [AINEs], agentes antiplaquetários) ou anticoagulantes75 (por exemplo, varfarina), bem como em pacientes com histórico de distúrbios hemorrágicos76 ou de coagulação77.
Comprometimento renal31
Prosoy® não é recomendado para uso em pacientes com comprometimento renal31 grave e recomenda-se cautela em pacientes com comprometimento renal31 leve ou moderado.
Insuficiência hepática35
Prosoy® é contraindicado para uso em pacientes com insuficiência hepática35 moderada ou grave (Child- Pugh Classe B ou C) e recomenda-se cautela em pacientes com insuficiência hepática35 leve.
Efeitos de abstinência
Foi relatado que a descontinuação abrupta de ISRSs administrados cronicamente e usados para tratar transtornos depressivos crônicos resulta nos seguintes sintomas7: humor disfórico, irritabilidade, agitação, tontura53, distúrbios sensoriais (por exemplo, parestesias78 como sensações de choque79 elétrico), ansiedade, confusão, cefaleia80, letargia81, labilidade emocional, insônia e hipomania.
No entanto, um estudo clínico duplo-cego em indivíduos com EP projetado para avaliar os efeitos de abstinência de 62 dias de dose diária ou conforme necessária de 60 mg de cloridrato de dapoxetina não mostrou evidências de síndrome8 de abstinência e poucas evidências de sintomas7 de abstinência com apenas uma incidência36 ligeiramente maior de insônia leve ou moderada e tontura53 relatadas em indivíduos que mudaram para placebo4 após administração diária. Resultados consistentes foram observados em um segundo estudo clínico duplo-cego com uma fase de tratamento de 24 semanas com doses de 30 e 60 mg, conforme necessário, seguido de um período de avaliação de abstinência de uma semana.
Distúrbios oculares
Tal como acontece com outros ISRSs, o cloridrato de dapoxetina tem sido associado a efeitos oculares leves, como a midríase82. Prosoy® deve ser utilizado com precaução em pacientes com pressão intraocular83 elevada ou em risco de glaucoma84 de ângulo fechado.
Disfunção Sexual
Em estudos clínicos, Prosoy® 30 mg foi associado a uma maior incidência36 de eventos adversos sexuais, como disfunção erétil (2,3%) e diminuição da libido85 (0,5%) em comparação com placebo4 (1,6% e 0,3%, respectivamente). Homens com disfunção erétil clinicamente significativa e outros distúrbios sexuais foram excluídos dos estudos clínicos. Deve-se tomar cuidado ao prescrever Prosoy® a homens com outras formas de disfunção sexual, pois não se sabe se a disfunção sexual poderia piorar.
Uso com drogas recreacionais/ilícitas86
Os pacientes devem ser alertados para não utilizar Prosoy® junto com drogas recreativas/ilícitas86. Medicamentos com atividade serotoninérgica, como a quetamina, a metilenodioximetanfetamina (MDMA) e drogas proscritas como ácido lisérgico dietilamida (LSD), podem causar reações potencialmente sérias se combinadas com Prosoy®. Essas reações incluem, entre outras, arritmia87, hipertermia e síndrome serotoninérgica88. O uso de Prosoy® com medicamentos não prescritos com propriedades sedativas como narcóticos e benzodiazepínicos podem aumentar mais ainda a sonolência e a tontura53.
Uso na Gravidez89
Prosoy® não é indicado para uso em mulheres.
Não há evidências de teratogenicidade, embriotoxicidade ou fetotoxicidade em ratos ou coelhos que receberam até 100 mg/kg (ratos) ou 75 mg/kg (coelhos).
Não há evidências que sugiram que a exposição à dapoxetina tenha efeito na gravidez89 de uma parceira com base em dados observacionais limitados do banco de dados clínico.
Populações especiais
Uso em crianças e adolescentes com menos de 18 anos: Prosoy® não deve ser utilizado em indivíduos com menos de 18 anos de idade.
Uso em idosos: A segurança e eficácia de Prosoy® não foram estabelecidas em indivíduos com 65 anos ou mais e os dados disponíveis nesta população são limitados.
Efeitos na habilidade de dirigir e operar máquinas
Tonturas57, distúrbios na atenção, síncope49, visão90 turva e sonolência foram relatados em indivíduos que receberam dapoxetina em estudos clínicos. Portanto, os pacientes devem ser aconselhados a evitar situações em que possam ocorrer lesões50, incluindo dirigir ou operar máquinas perigosas.
INTERAÇÕES MEDICAMENTOSAS
Potencial de interação com inibidores da monoaminoxidase47
Em pacientes que receberam um ISRS em combinação com um inibidor da monoaminoxidase (IMAO48), houve relatos de reações graves, às vezes fatais, incluindo hipertermia, rigidez, mioclonia91, instabilidade autonômica com possíveis flutuações rápidas dos sinais vitais92 e alterações no estado mental que incluem agitação extrema progredindo para delírio93 e coma94. Essas reações também foram relatadas em pacientes que descontinuaram recentemente um ISRS e iniciaram em um IMAO48. Alguns casos apresentaram características semelhantes à síndrome8 neuroléptica maligna. Os dados em animais sobre os efeitos do uso combinado de um ISRS e IMAOs sugerem que esses medicamentos podem agir sinergicamente para elevar a pressão sanguínea e provocar excitação comportamental. Portanto, Prosoy® não deve ser usado em combinação com um IMAO48 ou dentro de 14 dias após a descontinuação do tratamento com um IMAO48. Da mesma forma, um IMAO48 não deve ser administrado dentro de 7 dias após a descontinuação do Prosoy®.
Potencial de interação com tioridazina
A administração de tioridazina isoladamente produz prolongamento do intervalo QTc, que está associado a arritmias95 ventriculares graves. Medicamentos como Prosoy®, que inibem a isoenzima CYP2D6 parecem inibir o metabolismo24 da tioridazina e os níveis elevados resultantes de tioridazina devem aumentar o prolongamento do intervalo QTc. Prosoy® não deve ser utilizado em combinação com tioridazina ou nos 14 dias seguintes à descontinuação do tratamento com tioridazina. Da mesma forma, a tioridazina não deve ser administrada dentro de 7 dias após a descontinuação do Prosoy®.
Produtos medicinais/fitoterápicos com efeitos serotonérgicos
Tal como com outros ISRSs, a administração concomitante com produtos medicinais/fitoterápicos serotoninérgicos (incluindo IMAOs, L-triptofano, triptanos, tramadol, linezolida, ISRSs, IRSNs, lítio e preparações de erva de São João (Hypericum perforatum)) pode levar a uma incidência36 efeitos associados à serotonina. O Prosoy® não deve ser utilizado concomitantemente com outros ISRSs, IMAOs ou produtos medicinais/fitoterápicos serotonérgicos ou nos 14 dias seguintes à descontinuação do tratamento com estes produtos medicinais/fitoterápicos. Da mesma forma, estes produtos medicinais/fitoterápicos não devem ser administrados dentro de 7 dias após a descontinuação do Prosoy®.
Medicamentos ativos no SNC65
A utilização de Prosoy® em combinação com medicamentos ativos no SNC65 não foi avaliada sistematicamente em pacientes com ejaculação3 precoce. Consequentemente, recomenda-se precaução se for necessária a administração concomitante de Prosoy® e de tais medicamentos.
Efeitos de medicamentos coadministrados com cloridrato de dapoxetina
Estudos in vitro em microssomas hepáticos, renais e intestinais humanos indicam que a dapoxetina é metabolizada principalmente pela CYP2D6, CYP3A4 e flavina monooxigenase 1 (FMO 1). Portanto, os inibidores dessas enzimas podem reduzir a depuração da dapoxetina.
Inibidores de CYP3A4 – Inibidores potentes de CYP3A4: A administração de cetoconazol (200 mg duas vezes ao dia por 7 dias) aumentou a Cmáx e a ASCinf da dapoxetina (60 mg em dose única) em 35% e 99%, respectivamente. Considerando a contribuição da dapoxetina não ligada e da desmetildapoxetina, a Cmáx da fração ativa pode ser aumentada em aproximadamente 25% e a ASC da fração ativa pode ser duplicada se tomada com inibidores potentes de CYP3A4.
Os aumentos na Cmáx e na ASC da fração ativa podem ser acentuadamente aumentados em uma parte da população que não possui uma enzima96 CYP2D6 funcional, isto é, metabolizadores fracos de CYP2D6 ou em combinação com inibidores potentes de CYP2D6.
Portanto, o uso concomitante de Prosoy® e inibidores potentes de CYP3A4, como o cetoconazol, itraconazol, ritonavir, saquinavir, telitromicina, nefazodona e nelfinavir é contraindicado.
Inibidores de CYP3A4 – Inibidores moderados de CYP3A4: O tratamento concomitante com inibidores moderados de CYP3A4, como eritromicina, claritromicina, fluconazol, amprenavir, fosamprenavir, aprepitante, verapamil, diltiazem, também pode dar origem a um aumento significativo da exposição à dapoxetina e desmetildapoxetina, especialmente nos metabólitos25 fracos de CYP2D6. Portanto, a dose máxima de dapoxetina deve ser de 30 mg se a dapoxetina for combinada com qualquer um desses medicamentos e recomenda-se cautela.
Inibidores potentes de CYP2D6: A Cmáx e ASCinf de dapoxetina (dose única de 60 mg) aumentaram 50% e 88%, respectivamente, na presença de fluoxetina (60 mg/dia por 7 dias). Considerando a contribuição da dapoxetina não ligada e da desmetildapoxetina, a Cmáx da fração ativa pode ser aumentada em aproximadamente 50% e a ASC da fração ativa pode ser duplicada se tomada com inibidores potentes de CYP2D6. Estes aumentos na Cmáx e na ASC da fração ativa são semelhantes aos esperados para metabolizadores fracos de CYP2D6 e resultam em maior incidência36 e gravidade de eventos adversos dependentes da dose. Portanto, recomenda-se cautela ao aumentar a dose para 60 mg em um paciente em uso de inibidores potentes de CYP2D6 ou se aumentar a dose para 60 mg em um paciente conhecido por ser um metabolizador fraco de CYP2D6.
Inibidores de PDE5: A farmacocinética de dapoxetina (60 mg) em combinação com tadalafila (20 mg) e sildenafila (100 mg) foi avaliada em um estudo cruzado de dose única. A tadalafila não afetou a farmacocinética da dapoxetina. A sildenafila causou pequenas alterações na farmacocinética da dapoxetina (aumento de 22% na ASCinf e aumento de 4% na Cmáx), que não se espera que sejam clinicamente significativas. No entanto, Prosoy® deve ser prescrito com cautela em pacientes que usam inibidores da PDE5 devido a uma possível tolerância ortostática reduzida.
Efeitos do cloridrato de dapoxetina em produtos medicinais coadministrados
Tansulosina: A administração concomitante de doses únicas ou múltiplas de 30 mg ou 60 mg de dapoxetina a pacientes que receberam doses diárias de tansulosina não resultou em alterações na farmacocinética da tansulosina. A adição de Prosoy® à tansulosina não resultou em uma alteração no perfil ortostático e não houve diferenças nos efeitos ortostáticos entre a tansulosina combinada com 30 ou 60 mg de dapoxetina e tansulosina isoladamente. No entanto, Prosoy® deve ser prescrito com cautela em pacientes que usam antagonistas dos receptores alfa adrenérgicos69 devido à possível tolerância ortostática reduzida.
Produtos medicinais metabolizados por CYP2D6: Doses múltiplas de dapoxetina (60 mg/dia por 6 dias), seguidas de uma dose única de 50 mg de desipramina, aumentaram a Cmáx média e a ASCinf da desipramina em aproximadamente 11% e 19%, respectivamente, em comparação com desipramina administrada isoladamente. A dapoxetina pode dar origem a um aumento semelhante nas concentrações plasmáticas de outros medicamentos metabolizados por CYP2D6. A relevância clínica provavelmente será pequena.
Produtos medicinais metabolizados por CYP3A: A dose múltipla de dapoxetina (60 mg/dia por 6 dias) diminuiu a ASCinf de midazolam (8 mg dose única) em aproximadamente 20% (faixa de -60 a + 18%). A relevância clínica do efeito no midazolam provavelmente será pequena na maioria dos pacientes. O aumento da atividade de CYP3A pode ser de relevância clínica em alguns indivíduos tratados concomitantemente com um produto medicinal metabolizado principalmente por CYP3A e com uma janela terapêutica97 estreita.
Produtos medicinais metabolizados por CYP2C19: A administração múltipla de dapoxetina (60 mg/dia durante 6 dias) não afetou a farmacocinética de uma dose única de 40 mg de omeprazol. É improvável que a dapoxetina afete a farmacocinética de outros substratos de CYP2C19.
Produtos medicinais metabolizados por CYP2C9: A administração múltipla de dapoxetina (60 mg/dia durante 6 dias) não afetou a farmacocinética ou a farmacodinâmica de uma dose única de 5 mg de gliburida. É improvável que a dapoxetina afete a farmacocinética de outros substratos de CYP2C9.
Inibidores de PDE5: Em um estudo cruzado de dose única, a dapoxetina (60 mg) não afetou a farmacocinética do tadalafila (20 mg) ou sildenafila (100 mg).
Varfarina: Não há dados que avaliem o efeito do uso crônico98 de varfarina com cloridrato de dapoxetina; portanto, recomenda-se cautela quando Prosoy® é usado em pacientes que tomam varfarina cronicamente. Em um estudo farmacocinético, a dapoxetina (60 mg/dia por 6 dias) não afetou a farmacocinética ou a farmacodinâmica (PT ou INR) da varfarina após uma dose única de 25 mg.
Etanol: A administração concomitante de uma dose única de etanol, 0,5 g/kg (aproximadamente 2 doses de bebidas alcoólicas), não alterou a farmacocinética da dapoxetina (60 mg em dose única) nem a farmacocinética do etanol, entretanto, a combinação de dapoxetina com etanol aumenta a sonolência e diminui significativamente a agilidade auto avaliada. O uso concomitante de álcool e dapoxetina aumentou a chance ou a gravidade de reações adversas, como tontura53, sonolência, reflexos lentos ou julgamento alterado. O uso combinado de bebidas alcoólicas com dapoxetina também pode aumentar os eventos adversos neurocardiogênicos, como síncope49, aumentando dessa forma o risco de dano acidental, portanto, os pacientes devem ser aconselhados a evitar o consumo de álcool enquanto estiverem tomando Prosoy®.
CUIDADOS DE ARMAZENAMENTO DO MEDICAMENTO
Cuidados de conservação
Prosoy® deve ser mantido em temperatura ambiente (15 a 30°C). O prazo de validade do produto nestas
condições de armazenagem é de 36 meses.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Características físicas e organolépticas do produto
Prosoy® apresenta-se na forma de comprimidos revestidos redondos de coloração branca a bege e faces lisas.
Antes de usar, observe o aspecto do medicamento.
TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS.
POSOLOGIA E MODO DE USAR
A dose inicial recomendada para todos os pacientes é de 30 mg, tomada aproximadamente 1 a 3 horas antes da atividade sexual, se necessário.
Prosoy® pode ser tomado com ou sem alimentos. Prosoy® não deve ser iniciado com uma dose de 60 mg. Prosoy® não se destina ao uso diário.
A frequência máxima recomendada é de uma dose a cada 24 horas. Se a resposta individual à dose de 30 mg for insuficiente e o paciente não apresentar eventos adversos moderados ou graves ou sintomas7 prodrômicos51 sugestivos de síncope49, a dose poderá ser aumentada para uma dose máxima recomendada de 60 mg, tomada conforme necessário aproximadamente 1 a 3 horas antes da atividade sexual. A incidência36 e gravidade das reações adversas são maiores com a dose de 60 mg. Se o paciente apresentar reações ortostáticas com a dose inicial de 30 mg a dose não deve ser aumentada para 60 mg (ver seção 5. ADVERTÊNCIAS E PRECAUÇÕES).
Uma avaliação cuidadosa da relação benefício/risco individual do uso de Prosoy® deve ser realizada pelo médico após as primeiras quatro semanas de tratamento ou após 6 doses de tratamento para determinar se é apropriado continuar o tratamento com Prosoy®. Os dados sobre eficácia e segurança de Prosoy® após 24 semanas são limitados. A relação benefício/risco e a necessidade clínica da manutenção do tratamento com Prosoy® deve ser reavaliada pelo menos a cada seis meses.
Dosagens especiais
Idosos (65 anos ou mais): A eficácia e segurança de Prosoy® não foram estabelecidas em pacientes com 65 anos ou mais e seu uso não é indicado para esses pacientes (ver seção 5. ADVERTÊNCIAS E PRECAUÇÕES).
População pediátrica: Não há uso relevante de Prosoy® em população pediátrica para a indicação de ejaculação3 precoce. Prosoy® não deve ser utilizado em indivíduos com menos de 18 anos de idade.
Pacientes com insuficiência renal34: Não é necessário ajuste da dose, mas recomenda-se cautela em pacientes com insuficiência renal34 leve ou moderada. Prosoy® não é recomendado em doentes com insuficiência renal34 grave (ver seções 3. CARACTERÍSTICAS FARMACOLÓGICAS e 5. ADVERTÊNCIAS E PRECAUÇÕES).
Pacientes com insuficiência hepática35: Não é necessário ajuste da dose em doentes com insuficiência hepática35 leve. Prosoy® é contraindicado em pacientes com insuficiência hepática35 moderada ou grave (Classe B e C de Child-Pugh) (ver seções 3. CARACTERÍSTICAS FARMACOLÓGICAS e 4. CONTRAINDICAÇÕES).
Pacientes com metabolismo24 lento do CYP2D6 ou pacientes tratados com inibidores potentes do CYP2D6: Recomenda-se cautela no uso de Prosoy® em pacientes com metabolismo24 lento conhecido do CYP2D6 ou em pacientes que recebem inibidores potentes concomitantes do CYP2D6 (ver seções 3. CARACTERÍSTICAS FARMACOLÓGICAS, 5. ADVERTÊNCIAS E PRECAUÇÕES e 6. INTERAÇÕES MEDICAMENTOSAS).
Pacientes tratados com inibidores moderados ou potentes do CYP3A4: O uso concomitante de inibidores potentes do CYP3A4 é contraindicado. Recomenda-se cautela quando usado concomitantemente com inibidores moderados do CYP3A4 e a dose deve ser limitada a 30 mg para pacientes99 tratados concomitantemente com inibidores moderados do CYP3A4 (ver seções 4. CONTRAINDICAÇÕES, 5. ADVERTÊNCIAS E PRECAUÇÕES e 6. INTERAÇÕES MEDICAMENTOSAS).
Este medicamento não deve ser partido, aberto ou mastigado.
REAÇÕES ADVERSAS
A segurança de cloridrato de dapoxetina foi avaliada em 6081 indivíduos com ejaculação3 precoce que participaram de cinco estudos clínicos duplo-cegos e controlados por placebo4. Dos indivíduos avaliados, 4222 receberam dapoxetina, 1615 receberam dapoxetina 30 mg conforme necessário e 2607 receberam 60 mg, conforme necessário ou uma vez ao dia.
A síncope49 caracterizada como perda de consciência foi relatada em estudos clínicos e é considerada relacionada ao produto medicinal. A maioria dos casos ocorreu durante as primeiras 3 horas após a administração, após a primeira dose ou associada a procedimentos relacionados ao estudo no ambiente clínico (como coleta de sangue60 e manobras ortostáticas e medidas da pressão arterial61). Os sintomas7 prodrômicos51 geralmente precedem a síncope49.
Foi relatada hipotensão68 ortostática em estudos clínicos. As reações adversas medicamentosas mais comuns (>5%) relatadas durante os estudos clínicos foram cefaleia80, tontura53, náusea52, diarreia100, insônia e fadiga101. Os eventos mais comuns que levaram à descontinuação foram náusea52 (2,2% dos indivíduos tratados com dapoxetina) e tontura53 (1,2% dos indivíduos tratados com dapoxetina).
As reações adversas medicamentosas relatadas por ≥1% dos indivíduos tratados com dapoxetina nesses estudos são mostradas na Tabela 3.
Tabela 3: Reações adversas medicamentosas relatadas por ≥1% de indivíduos tratados com cloridrato de dapoxetina em 5 estudos clínicos duplo-cegos, controlados por placebo4 de cloridrato de dapoxetina xxx
|
Classe de sistemas/órgão Reação adversa medicamentosa |
PLACEBO4 |
Dapoxetina 30 mg |
Dapoxetina 60 mg |
Dapoxetina 60 mg |
|
Investigações |
||||
|
Aumento da pressão arterial613 |
0,2 |
0,4 |
1,1 |
2,2 |
|
Distúrbios do sistema nervoso9 |
||||
|
Tontura534 |
2,2 |
5,8 |
11,0 |
14,9 |
|
Cefaleia80 |
4,8 |
5,6 |
8,8 |
11,2 |
|
Sonolência5 |
0,6 |
3,1 |
4,8 |
4,0 |
|
Tremor |
0,2 |
0,5 |
0,9 |
1,6 |
|
Perturbação na atenção |
0,5 |
0,4 |
0,8 |
2,6 |
|
Parestesia102 |
0,3 |
0,4 |
0,8 |
1,2 |
|
Distúrbios oculares |
||||
|
Visão90 turva6 |
0,4 |
0,2 |
0,6 |
2,0 |
|
Distúrbios do ouvido e labirinto103 |
||||
|
Zumbido |
0,4 |
0,2 |
0,5 |
1,2 |
|
Distúrbios respiratórios, torácicos e do mediastino104 |
||||
|
Congestão nasal |
0,3 |
0,7 |
1,0 |
1,6 |
|
Bocejo |
0 |
0,4 |
0,9 |
1,2 |
|
Distúrbios gastrointestinais |
||||
|
Náusea52 |
2,2 |
11,0 |
22,2 |
17,1 |
|
Diarreia1007 |
1,7 |
3,5 |
6,9 |
9,4 |
|
Dor abdominal8 |
1,2 |
2,2 |
2,6 |
4,4 |
|
Boca105 seca |
0,7 |
1,2 |
2,6 |
3,4 |
|
Vômito106 |
0,4 |
1,0 |
2,3 |
1,8 |
|
Dispepsia107 |
0,4 |
0,9 |
1,4 |
0,8 |
|
Flatulência |
0,1 |
0,4 |
0,9 |
1,4 |
|
Constipação108 |
0,3 |
0,3 |
0,4 |
1,8 |
|
Distensão abdominal |
0,3 |
0,1 |
0,6 |
1,0 |
|
Distúrbios da pele109 e do tecido subcutâneo110 |
||||
|
Hiperidrose58 |
0,2 |
0,8 |
1,2 |
3,0 |
|
Distúrbios vasculares111 |
||||
|
Ruborização9 |
0,3 |
0,9 |
1,3 |
1,4 |
|
Distúrbios gerais e condições do local de administração |
||||
|
Fadiga101 |
1,2 |
2,0 |
4,1 |
9,2 |
|
Irritabilidade |
0,8 |
0,1 |
1,1 |
3,6 |
|
Distúrbios da mama112 e do sistema reprodutivo |
||||
|
Disfunção erétil |
1,6 |
2,3 |
2,6 |
1,2 |
|
Distúrbios psiquiátricos |
||||
|
Insônia10 |
1,6 |
2,3 |
4,3 |
9,0 |
|
Ansiedade |
0,5 |
1,1 |
2,0 |
2,2 |
|
Nervosismo11 |
0,5 |
0,6 |
1,2 |
3,0 |
|
Diminuição da libido8512 |
0,4 |
0,6 |
0,9 |
1,4 |
|
Depressão13 |
0,6 |
0,4 |
0,9 |
1,2 |
|
Apatia11314 |
0,1 |
0,4 |
0,2 |
1,0 |
|
Sonhos anormais15 |
0,3 |
0,2 |
0,4 |
2,0 |
1 Um paciente randomizado114 nunca recebeu medicação do estudo
2 Duração do tratamento até aproximadamente 70 dias
3 Também inclui aumento da pressão arterial diastólica115 e aumento da pressão arterial61 ortostática
4 Também inclui tonturas57 posturais e tonturas57 após esforços
5 Também inclui hipersonia e início repentino do sono
6 Também inclui perturbação visual
7 Também inclui a urgência116 de defecação
8 Também inclui dor abdominal superior, desconforto estomacal, desconforto abdominal e desconforto epigástrico
9 Também inclui ondas de calor
10 Também inclui insônia média e insônia inicial
11 Também inclui agitação e inquietação
12 Também inclui perda de libido85
13 Também inclui humor deprimido
14 Também inclui indiferença
15 Também inclui pesadelo
Reações adversas medicamentosas adicionais que ocorreram em <1% dos indivíduos tratados com cloridrato de dapoxetina estão listadas abaixo na Tabela 4.
Tabela 4: Reações adversas medicamentosas relatadas por <1% dos indivíduos tratados com dapoxetina em 5 estudos clínicos duplo-cegos e controlados por placebo4 de dapoxetina
|
Classe de sistema/órgão Reação adversa medicamentosa |
|
Distúrbios cardíacos Taquicardia1171 Bradicardia118 sinusal Parada sinusal |
|
Distúrbios do sistema nervoso9 Nível de consciência deprimido2 Disgeusia119 Letargia81 Síncope493 Acatisia120 |
|
Distúrbios oculares Midríase82, Dor ocular |
|
Distúrbios do ouvido e labirinto103 Vertigem54 |
|
Distúrbios da pele109 e do tecido subcutâneo110 Prurido121 Suor frio |
|
Distúrbios vasculares111 Hipotensão68 Hipertensão122 sistólica |
|
Distúrbios gerais e condições do local de administração Astenia63 Sensação anormal Sensação de calor Sensação de nervosismo Sensação de embriaguez |
|
Distúrbios da mama112 e do sistema reprodutivo Falha de ejaculação3 Distúrbio orgásmico masculino4 Parestesia102 da genital masculina |
|
Transtornos psiquiátricos Humor eufórico Humor alterado Estado confusional Distúrbio do sono Bruxismo Desorientação Hipervigilância Pensamento anormal |
1 Também inclui aumento da frequência cardíaca
2 Também inclui sedação123
3 Também inclui síncope49 vasovagal
4 Também inclui anorgasmia124 (também transferida da classe de sistemas de órgãos de Transtornos psiquiátricos)
As reações adversas medicamentosas relatadas no estudo de extensão aberta a longo prazo foram consistentes com as relatadas nos estudos duplo-cegos e nenhuma reação adversa medicamentosa adicional foi relatada.
Em casos de eventos adversos, notifique pelo Sistema VigiMed, disponível no Portal da Anvisa.
SUPERDOSE
Não houve relatos de superdose durante os estudos clínicos.
Não houve eventos adversos inesperados em um estudo de farmacologia30 clínica de cloridrato de dapoxetina com doses diárias de até 240 mg (duas doses de 120 mg com 3 horas de intervalo). Em geral, os sintomas7 de superdose com ISRSs incluem reações adversas mediadas por serotonina, como sonolência, distúrbios gastrointestinais, como náusea52 e vômito106, taquicardia117, tremor, agitação e tontura53.
Em casos de superdose, medidas padrão de suporte devem ser adotadas conforme necessário. Devido à alta ligação às proteínas20 e ao grande volume de distribuição de cloridrato de dapoxetina, é pouco provável que diurese125 forçada, diálise33, hemoperfusão e transfusão126 de troca sejam benéficas. Nenhum antídoto127 específico para cloridrato de dapoxetina é conhecido.
Em caso de intoxicação ligue para 0800 722 6001, se você precisar de mais orientações.
DIZERES LEGAIS
VENDA SOB PRESCRIÇÃO MÉDICA
MS: 1.0390.0222
Farm. Resp.: Dra. Marcia Weiss I. Campos CRF-RJ nº 4499
Registrado por:
FARMOQUÍMICA S/A
Av. José Silva de Azevedo Neto, 200, Bloco 1, 1º andar, Barra da Tijuca.
Rio de Janeiro – RJ CEP: 22775-056
CNPJ: 33.349.473/0001-58
Fabricado por:
FARMOQUÍMICA S/A
Rua Viúva Cláudio, 300, Jacaré. Rio de Janeiro – RJ
CEP: 20970-032
CNPJ: 33.349.473/0003-10
Indústria brasileira
SAC 0800 025 0110