

Fauldvincri (Bula do profissional de saúde)
LIBBS FARMACÊUTICA LTDA
IDENTIFICAÇÃO DO MEDICAMENTO
Fauldvincri®
sulfato de vincristina
Injetável 1 mg/mL
Medicamento similar equivalente ao medicamento de referência.
FORMA FARMACÊUTICA E APRESENTAÇÃO:
Solução injetável
Embalagem contendo 5 frascos-ampola com 1 mL cada
USO INTRAVENOSO
USO ADULTO E PEDIÁTRICO
COMPOSIÇÃO:
Cada mL de Fauldvincri® contém:
| sulfato de vincristina (equivalente a aproximadamente 0,894 mg de vincristina base) | 1 mg |
| veículo q.s.p. | 1 mL |
Veículos: manitol, ácido sulfúrico, hidróxido de sódio e água para injetáveis.
INFORMAÇÕES TÉCNICAS AOS PROFISSIONAIS DE SAÚDE1
INDICAÇÕES
Fauldvincri® pode ser utilizado como quimioterapia2 combinada na leucemia3 linfoide4 aguda, Doença de Hodgkin5, linfomas malignos não Hodgkin (tipos linfocíticos, de células6 mistas, histiocíticos, não diferenciados, nodulares e difusos), rabdomiossarcoma7, neuroblastoma, tumor8 de Wilms, sarcoma9 osteogênico, micose10 fungoide, sarcoma9 de Ewing, carcinoma11 de cervix uterino, câncer12 de mama13, melanoma14 maligno, carcinoma11 “oat cell” de pulmão15 e tumores ginecológicos de infância.
Pacientes com púrpura16 trombocitopênica idiopática17 verdadeira, resistentes ao tratamento convencional, podem ser beneficiados com o uso desse medicamento.
Fauldvincri®, também poderá ser utilizado em conjunto com outros medicamentos para o tratamento de algumas neoplasias18 pediátricas, tais como: neuroblastoma, sarcoma9 osteogênico, sarcoma9 de Ewing, rabdomiossarcoma7, tumor8 de Wilms, doença de Hodgkin5, linfoma19 não Hodgkin, carcinoma11 embrionário de ovário20 e rabdomiossarcoma7 de útero21.
RESULTADOS DE EFICÁCIA
Em estudo clínico publicado no JCO, a combinação de vincristina com prednisona foi superior à utilização isolada de melfalano, em termos de sobrevida22, no tratamento do mieloma23 múltiplo inicial.
A utilização de protocolos contendo carboplatina e vincristina é eficaz no tratamento de glioma de baixo grau progressivo recém-diagnosticado em crianças.
Carcinoma11 de Cervix Uterino
Um estudo clínico realizado em 295 pacientes com carcinoma11 uterino de células6 escamosas estágio IIB evidenciou alta taxa de sobrevida22 nos pacientes que receberam quimioterapia2 neoadjuvante (vincristina, bleomicina e cisplatina) seguida de cirurgia pós-radiação (65%) quando comparada a cirurgia e radiação (41%; p<0,001), radioterapia24 isoladamente (48%; p<0,005) ou quimioterapia2 neoadjuvante e radiação (54%). Os resultados foram obtidos após uma média das avaliações de seguimento durante 84 meses após o tratamento. Pacientes tratados com quimioterapia2 receberam três cursos rápidos da seguinte terapia VBP: vincristina (1 mg/m2) no dia 1, bleomicina (25 mg/m2) nos dias 1 a 3, e cisplatina (50 mg/m2) no dia 1. Esta terapia foi repetida com intervalos de 10 dias. Nos pacientes que participaram dos dois grupos cirúrgicos houve aumento da sobrevida22, associado com o pré-tratamento do tumor8 com volume menor que 5 centímetros. Apenas graus 1 e 2 de toxicidade25 (escala de toxicidade25 de Miller – Miller toxicity scale) foram verificados nos dois grupos que receberam quimioterapia2. A quimioterapia2 neoadjuvante em conjunto com cirurgia e radiação fornecem uma alternativa de tratamento para a radioterapia24 convencional, com um aumento da sobrevida22 global1.
Linfoma19 não-Hodgkin
Uma análise post-hoc retrospectiva de um estudo clínico randomizado26 com 459 pacientes com linfoma19 não-Hodgkin evidenciou uma maior taxa de sobrevida22 com o tratamento PACEBOM (prednisolona, doxorubicina, ciclofosfamida, etoposida, bleomicina, vincristina, metotrexato) sobre o tratamento CHOP (ciclofosfamida, doxorubicina, vincristina, prednisolona) para pacientes27 com a doença em estágio IV e para pacientes27 com menos de 50 anos de idade. As taxas de completa remissão (64% versus 57%), a sobrevida22 global de 8 anos (51% versus 41%) e a sobrevida22 com causa específica (59% versus 49%) foram estatisticamente equivalentes nos grupos PACEBOM e CHOP, respectivamente. Entre os pacientes abaixo de 50 anos de idade, a taxa de sobrevida22 causa-específica e a sobrevida22 global de 8 anos foram de 78% e 55% para os pacientes que receberam PACEBOM e CHOP, respectivamente (p=0,0036). Os números correspondentes para a doença em estágio IV foram 51% e 30%, respectivamente (p=0,02)2.
Carcinoma11 de pequenas células6 de pulmão15
Dois regimes de tratamento apresentaram resultados comparáveis em pacientes com extenso câncer12 de pulmão15 de pequenas células6: tratamento PE (cisplatina e etoposida) e CAV (ciclofosfamida, doxorrubicina e vincristina). Além disso, a alternância de tratamento com estes dois regimes não forneceu vantagens terapêuticas sobre o uso de cada um dos regimes isoladamente. Estas conclusões foram baseadas em um estudo randomizado28 envolvendo 437 pacientes sem tratamento anterior à quimioterapia2. A taxa de resposta total para PE, CAV e CAV/EP foi de, respectivamente, 61%, 51% e 59% e a taxa de resposta completa foi de 10%, 7% e 7%, respectivamente. A sobrevida22 média foi de 8,6; 8,3 e 8,1 meses, respectivamente3.
CARACTERÍSTICAS FARMACOLÓGICAS
Fauldvincri® é um agente quimioterápico útil para o tratamento de neoplasias18 e pertence à classe dos produtos naturais, pois é um alcaloide29 obtido de uma planta florescente comum, a pervinca (Vinca rósea Líné). Conhecida originalmente como leucocristina, tem sido designada também como LCR e VCR. A relativa baixa toxicidade25 da vincristina para as células6 normais de medula óssea30 torna-a um fármaco31 extraordinário dentre os fármacos antineoplásicos, sendo frequentemente utilizada em associação quimioterápica com outros agentes mielossupressores.
Farmacodinâmica
Os alcaloides da vinca são substâncias que atuam especificamente sobre o ciclo celular, bloqueando a mitose com interrupção da metáfase. Esta ação biológica da vincristina pode ser explicada por sua habilidade em unir-se especificamente com a tubulina, que é um componente chave dos microtúbulos celulares que dão origem ao esqueleto32 celular. A união da vincristina com os túbulos é complexa e diferentes sítios moleculares estão envolvidos. O fato mais evidente é que a inibição da formação completa de tubulina acarreta uma dissolução dos microtúbulos, uma inibição da formação do fuso mitótico e interrupção da mitose na metáfase.
Além desta ação chave sobre a formação do fuso mitótico, há evidências de que a vincristina também tenha outras ações como: aumento da síntese do AMP cíclico, em ratos; modificação no transporte de cálcio calmodulina-dependente; redução da incorporação da uridina para a síntese do RNA transportador; bloqueio na incorporação de fosfolipídeos. Entretanto, ainda não existem relações muito claras entre estas ações e a sua aplicação na prática clínica.
Somente a inibição da formação da tubulina está relacionada com a atividade citotóxica da vincristina e é possível que certas atividades sobre o SNC33 ou transmissão neuromuscular, que envolvam a formação de microtúbulos, possam também ser afetadas por este derivado alcaloide29 da vinca. Apesar da similaridade estrutural entre os derivados da vinca, não se observou uma resistência cruzada entre eles.
Recentemente, entretanto, a atenção tem sido voltada para o fenômeno pleiotrópico da resistência aos fármacos, na qual as células6 tumorais apresentam resistências cruzadas com uma ampla gama de fármacos não similares. Assim, células6 de tumores animais e humanos que apresentam uma resistência cruzada aos alcaloides da vinca, às epipodofilotoxinas, às antraciclinas, dactinomicina e com a colchicina têm sido identificadas. Alterações cromossômicas que consistem em amplificação do gene têm sido observadas. Existem, todavia, relatórios de que bloqueadores dos canais de cálcio, como o verapamil, podem reverter a resistência para a vincristina e doxorrubicina.
A quimioterapia2 do câncer12 envolve o uso simultâneo de diversos fármacos. Já que estes fármacos possuem toxicidade25 e mecanismo de ação característicos, a associação deve ser feita de maneira que o aumento do efeito terapêutico ocorra sem adição de toxicidade25. Raramente encontram-se resultados igualmente satisfatórios no tratamento com apenas um medicamento. Assim, Fauldvincri® é escolhido frequentemente como parte de uma poliquimioterapia, pela ausência de supressão significante de medula óssea30 (em doses recomendadas) e pela sua toxicidade25 clínica característica.
Farmacocinética
Não há ainda dados conclusivos sobre a absorção oral da vincristina. Nas doses clínicas usuais, a concentração plasmática é de 0,4 M.
Após a administração intravenosa em animais, as concentrações tissulares são muito maiores do que as concentrações séricas. O fármaco31 é excretado principalmente pelo fígado34 e através da bile35. No rato, após a administração intraperitoneal da vincristina, observou-se um pico de concentração sérica após 3 horas de administração, com uma meia-vida plasmática de 15 a 75 minutos.
Após administração intravenosa em humanos, a curva de concentração plasmática é compatível com o modelo tricompartimental, apresentando meias-vidas inicial, intermediária e final de 5 minutos, 2 horas e 18 minutos e 85 horas, respectivamente.
Após 15 a 30 minutos da administração intravenosa, mais de 90% do fármaco31 já se encontra nos tecidos, onde permanece localizado, mas não irreversivelmente ligado. A vincristina liga-se às proteínas36 plasmáticas (75%) e concentra-se extensivamente nas plaquetas37 e, em menor quantidade, nos leucócitos38 e eritrócitos39. Seu volume de distribuição é alto e variável, cerca de 56 a 1165 L/m2 (media de 325 L/m2)4. A vincristina apresenta baixa penetração no fluido cérebro40-espinhal5. É extensamente biotransformada pelo fígado345,6 pelas isoenzimas hepáticas41 da família citocromo P450, na subfamília CYP 3A5.
Como ficou demonstrado em animais, o fígado34 é o maior órgão biotransformador (67%), cerca de 80% da dose administrada é eliminada nas fezes e o restante (10–20%) na urina42. A depuração corporal total da vincristina é de cerca de 34 a 830 mL/min/m2 (média de 357 mL/min/m2)4.
CONTRAINDICAÇÕES
Fauldvincri® é contraindicado em pacientes hipersensíveis a algum componente da fórmula e em pacientes que apresentam a forma desmielinizante43 da Síndrome44 de Charcot-Marie Tooth.
Não há contraindicação relativa a faixas etárias.
Categoria de risco na gravidez45: D – Há evidências de risco em fetos humanos. Só usar se o benefício justificar o risco potencial. Em situação de risco de vida ou em caso de doenças graves para as quais não se possa utilizar drogas mais seguras, ou se estas drogas não forem eficazes.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica. Informe imediatamente seu médico em caso de suspeita de gravidez45.
ADVERTÊNCIAS E PRECAUÇÕES
Fauldvincri® deve ser administrado exclusivamente por via intravenosa, não devendo ser administrado por via intramuscular, subcutânea46 ou intratecal. A administração intratecal de Fauldvincri® é fatal.
Fauldvincri® deve ser administrado por profissional experiente e é extremamente importante que a agulha ou catéter estejam corretamente inseridos na veia antes que qualquer quantidade de Fauldvincri® seja administrada.
No caso de administração intratecal acidental de Fauldvincri®, deve-se fazer intervenção neurocirúrgica imediata para prevenir paralisia47 ascendente que leve à morte. Em pequeno número de pacientes, a paralisia47 com risco de morte subsequente foi evitada, mas resultaram em sequelas48 neurológicas devastadoras, com recuperação limitada posteriormente. Em adultos, a paralisia47 progressiva foi estabilizada pelo seguinte tratamento, iniciado imediatamente após a injeção49 intratecal:
- Remoção da quantidade máxima possível do líquido cefalorraquidiano50, retirado com segurança através da punção lombar.
- Inserção de um catéter epidural51 no espaço subaracnoide, via espaço intervertebral acima da punção lombar e irrigação do líquido cefalorraquidiano50 com lactato52 de Ringer.
- Assim que possível, infundir 25 mL de plasma fresco congelado53 a cada litro de solução de lactato52 de Ringer.
- Inserção de um dreno intraventricular ou catéter por neurocirurgião e continuação da irrigação do líquido cefalorraquidiano50 com fluído removido da punção lombar, conectado a um sistema fechado de drenagem54. A solução de lactato52 de Ringer deve ser administrada através de infusão contínua a 150 mL/hora quando o plasma fresco congelado53 for adicionado.
- A taxa de infusão deve ser ajustada para manter o nível de proteína no líquido cafalorraquidiano em 150 mg/dL55. Pode-se também utilizar as seguintes medidas, mas não são essenciais:
- 10 mg de ácido glutâmico, via intravenosa, por 24 horas, seguidos por 500 mg três vezes ao dia, via oral, por um mês.
- ácido folínico administrado por via intravenosa em forma de bolus56 de 25 mg a cada 6 horas por uma semana.
- piridoxina (vitamina57 B12) tem sido utilizada na dose de 50 mg a cada 8 horas, por infusão intravenosa por 30 minutos. Essas ações na redução da neurotoxicidade ainda não são claras.
Como Fauldvincri® parece não atravessar a barreira hematoencefálica em concentrações adequadas, aconselha-se a utilização de medicamentos mais específicos no caso de leucemia3 do Sistema Nervoso Central58.
Em pacientes com distúrbios neurológicos concomitantes: deve-se dar atenção especial à posologia, objetivando minimizar possíveis reações adversas; o mesmo se aplica quando da utilização concomitante de medicamentos potencialmente neurotóxicos.
É necessário ajuste de dose em pacientes com insuficiência hepática59 e icterícia60 ou recebendo radiações no fígado34.
Em caso de contato acidental dos olhos61 com Fauldvincri®, pode ocorrer irritação grave e ulceração62 de córnea63, recomendando se, portanto, que o olho64 atingido seja lavado imediatamente e vigorosamente com água.
Testes laboratoriais: A toxicidade25 clínica é dose-dependente e manifesta-se através da neurotoxicidade. A evolução clínica (histórico, exame físico) é necessária para detectar a necessidade de alterações na dosagem. Após a administração de Fauldvincri® alguns pacientes podem apresentar queda na contagem de leucócitos38 ou plaquetas37, particularmente quando a terapia anterior ou a própria doença reduzirem a função da medula óssea30. Logo, um hemograma completo deve ser realizado antes da administração de cada dose. Também pode ocorrer elevação aguda do ácido úrico durante a indução de remissão na leucemia3 aguda, assim, tais níveis devem ser determinados frequentemente durante as primeiras três ou quatro semanas de tratamento, ou medidas apropriadas para prevenir a nefropatia65 úrica devem ser realizadas.
Deve-se ter cautela com pacientes que apresentem doença neuromuscular e disfunção pulmonar pré-existente7.
Deve-se monitorar a Transaminase Glutâmico Oxalacética (TGO), transaminase glutâmica pirúvica (TGP), bilirrubina66 e desidrogenase láctica67 (LDH) séricas para evitar hepatotoxicidade687.
Gravidez45 e Lactação69
Categoria de risco na gravidez45: D
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica. Informe imediatamente seu médico em caso de suspeita de gravidez45.
Fauldvincri® pode causar dano fetal quando administrado em pacientes grávidas. Após administração de vincristina, 23 a 85% dos fetos de camundongos e hamsters foram reabsorvidos, sendo produzida malformação70 fetal em todos os sobreviventes. Foram administradas a cinco macacas, dose única de vincristina entre os dias 27 e 34 de gravidez45. Três dos fetos foram normais e a termo e dois fetos viáveis e a termo apresentaram malformação70 evidente. Em diversas espécies animais, o Fauldvincri® pode induzir efeitos teratogênicos71, bem como embrioletalidade com doses não tóxicas ao animal grávido. Não há estudos adequados e bem controlados em mulheres grávidas. Se este medicamento for usado durante a gravidez45, ou se a paciente engravidar enquanto estiver recebendo o medicamento, ela deverá ser alertada do risco potencial ao feto72. Mulheres com capacidade reprodutiva devem ser aconselhadas a evitar a gravidez45.
Não há estudo que comprove que o Fauldvincri® seja excretado pelo leite, porém, pelo seu potencial em causar reações adversas graves em lactentes73, deve-se decidir entre descontinuar a amamentação74 ou o tratamento, levando-se em consideração a importância do tratamento para a mãe.
Populações especiais
Uso em idosos: O médico deve avaliar a necessidade do tratamento em idosos visto que esses pacientes são mais suscetíveis às reações adversas.
Carcinogênese, mutagênese e danos à fertilidade: Tem sido demonstrado que a vincristina é carcinogênico em animais e pode estar associada a um maior risco de desenvolvimento de carcinomas secundários em seres humanos. Tanto in vitro como in vivo, os testes de laboratório não demonstraram efeitos conclusivos quanto a sua mutagenicidade. Em pacientes submetidos à terapia antineoplásica, especialmente com medicamentos alquilantes, pode ocorrer uma supressão gonadal, levando a azoospermia75 ou amenorreia76, geralmente relacionadas com a dose e a duração da terapia, podendo ser irreversíveis em alguns casos. Devido ao fato deste efeito geralmente vir associado à utilização combinada de vários medicamentos antineoplásicos, torna-se muito difícil à valorização dos efeitos de cada fármaco31 individualmente. A recuperação ocorreu muitos meses após o término da quimioterapia2 em alguns pacientes, mas não na sua totalidade. Quando o mesmo tratamento é administrado em pacientes pré-púberes, a possibilidade de ocorrer azoospermia75 e amenorreia76 permanentes é remota.
INTERAÇÕES MEDICAMENTOSAS
Deve-se ter cautela com pacientes que estejam utilizando medicamentos que inibam o metabolismo77 de isoenzimas hepáticas41 do citocromo P450, subfamília CYP3A, ou em pacientes com disfunção hepática78.
A administração concomitante de Fauldvincri® e itraconazol causou início prematuro e/ou aumento da gravidade dos efeitos adversos neuromusculares. Foi reportado o aumento da toxicidade25 em crianças que receberam itraconazol, juntamente com nifedipino ou não, durante tratamento envolvendo vincristina. O itraconazol parece potencializar a toxicidade25 de vincristina através da inibição das isoenzimas da família citocromo P450 através da redução da depuração da vincristina9,10,11,12 ou através da inibição da bomba de efluxo da glicoproteína P10,11, aumentando a concentração intracelular de vincristina. O nifedipino também diminui a depuração da vincristina por mecanismos semelhantes e pode, teoricamente, potencializar a toxicidade259,11,12.
O uso concomitante de Fauldvincri® com fenitoína pode causar redução dos níveis sanguíneos do anticonvulsionante e consequente aumento da convulsão79 e o ajuste de dose pode ser necessário baseado na monitoração do nível sanguíneo. A contribuição do Fauldvincri® para essa interação com fenitoína não é certa. Em estudo farmacocinético foi verificado que a depuração sistêmica de vincristina foi 63% maior quando utilizada concomitantemente com fenitoína ou carbamazepina (dois indutores da isoenzima CYP3A4). A significância clínica deste fato é desconhecida13.
O uso associado de mitomicina C com os alcaloides da vinca pode desencadear reações como broncoespasmo80 e dispneia81 aguda, que pode ocorrer dentro de minutos ou várias horas após a administração de Fauldvincri®. Pode ocorrer dispneia81 progressiva que necessite de terapia crônica e, neste caso, Fauldvincri® não deve ser readministrado.
Fauldvincri® pode interagir com os seguintes medicamentos:
- Alopurinol, colchicina, probenecida e sulfimpirazona: Provoca um aumento da concentração sérica de ácido úrico. Torna-se necessário, portanto, um ajuste da dose dessas substâncias para se evitar uma possível nefropatia65.
- Asparaginase: Pode acarretar neurotoxicidade. Aconselha-se que, quando da necessidade de associação com Fauldvincri®, a asparginase seja administrada após o Fauldvincri®.
- Bleomicina: O uso de Fauldvincri® associado com a bleomicina facilita a ação da bleomicina, pois interrompe o ciclo celular na fase de mitose.
- Medicamentos que produzem discrasia sanguínea, depressores da medula óssea30 e radioterapia24: O uso simultâneo com o Fauldvincri® pode potencializar a ação depressora sobre a medula óssea30.
- Doxorrubicina: O uso com Fauldvincri® e prednisona acarreta maior depressão medular, não sendo aconselhável esta combinação.
- Medicamentos neurotóxicos e irradiação da medula82: Pode levar a uma neurotoxicidade auditiva.
- Isoniazida: Ocorrência de neurotoxicidade grave em uso concomitante com vincristina14.
- Digoxina: Em uso concomitante os efeitos da digoxina podem ser diminuídos15.
- Varfarina: Como é um anticoagulante83, aumenta os riscos de sangramento16,17,18,19,20,21,22.
- Vacinas com vírus84 vivos: Como os mecanismos de defesa estão diminuídos, o uso simultâneo de vacinas com vírus84 vivos pode acarretar uma replicação desses vírus84, aumentar os eventos adversos da vacina85 e/ou diminuir a resposta humoral86 do paciente à vacina85. A imunização87 de pacientes em tratamento com Fauldvincri® só deverá ser realizada com a autorização do médico quimioterapeuta responsável e após uma avaliação do quadro hematológico do paciente.
O intervalo de tempo entre a interrupção dos medicamentos que produzem imunossupressão88 e a recuperação da capacidade de resposta à vacina85 depende do medicamento utilizado, de sua intensidade e da enfermidade subjacente, entre outros fatores e estima-se em aproximadamente três meses a 1 ano. Os pacientes com leucemia3 em fase de remissão não devem receber vacinas com vírus84 vivos até pelo menos três meses após a última quimioterapia2. Além disso, a imunização87 com vacinas orais de poliovírus devem ser adiadas naquelas pessoas em contato direto com o paciente, especialmente os membros da família.
Adjuvantes intravenosos incompatíveis:
- Furosemida: Uso de furosemida 5 mg/0,5 mL com vincristina 0,5 mg/0,5 mL causa formação imediata de precipitado na adição direta em seringa8923.
- Idarrubicina: Uso de idarrubicina 1 mg/mL em cloreto de sódio a 0,9% com vincristina 1 mg/mL não causa diluição. Imediatamente ocorre ligeira mudança na coloração, a qual persiste segundo avaliação por 24 horas em temperatura de 25°C em luz fluorescente24.
CUIDADOS DE ARMAZENAMENTO DO MEDICAMENTO
Cuidados de conservação
Fauldvincri® deve ser conservado sob refrigeração (2–8°C), protegido da luz.
O medicamento não contém qualquer agente conservante, por isso, para evitar a possibilidade de contaminação microbiana, deve-se iniciar a administração da infusão logo após a sua preparação. Todos os resíduos devem ser descartados.
Este medicamento possui prazo de validade de 24 meses a partir da sua data de fabricação.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Características físicas e organolépticas do produto
A solução injetável de Fauldvincri® apresenta-se como solução límpida, incolor a levemente amarelada, isenta de partículas visíveis.
Antes de usar, observe o aspecto do medicamento.
TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS.
POSOLOGIA E MODO DE USAR
Fauldvincri® deve ser aplicado exclusivamente por via intravenosa em intervalos semanais. A utilização da administração por via intratecal é fatal.
Fauldvincri® pode ser diluído em água destilada ou soro90 fisiológico91 em concentrações de 0,01 a 1 mg/mL. Fauldvincri® não deve ser misturado no mesmo recipiente com qualquer outra medicação antes ou durante sua aplicação. Não utilizar soluções que alterem o pH (3,5 a 5,5) para mais ou para menos.
A aplicação de Fauldvincri® deve ser realizada apenas por profissionais experientes no uso de medicamentos citostáticos92. Deve-se ter extrema cautela no cálculo93 e administração da dose de Fauldvincri®, pois a superdose geralmente acarreta reações adversas muito graves e até fatais. O cálculo93 da dose é feito de acordo com a doença e a necessidade de medicamentos associados. A neurotoxicidade parece estar relacionada com a dose.
É extremamente importante certificar-se de que a agulha ou catéter estejam corretamente inseridos na veia antes que qualquer quantidade de Fauldvincri® seja administrada. Caso ocorra extravasamento, pode ocorrer irritação considerável e a administração deve ser descontinuada imediatamente e qualquer porção restante da dose deve ser aplicada em outra veia. A injeção49 local de hialuronidase e a aplicação de calor local moderado na área do extravasamento ajudam a dispersar o medicamento, minimizando o desconforto e a possibilidade de celulite94.
A infusão venosa deve ser evitada sempre que possível. O Fauldvincri® deve ser administrado através de venólise ou cateter intacto tomando-se cuidado para que não haja furos ou vazamentos durante a administração. Não deve ser utilizado em pacientes que estejam recebendo radioterapia24 que inclui o fígado34.
A administração de Fauldvincri® deve ser finalizada dentro de aproximadamente 1 minuto. As práticas usuais de quimioterapia2 antineoplásica envolvem o uso simultâneo de vários medicamentos. Portanto, para obter-se o efeito terapêutico desejado sem aumentar os efeitos tóxicos, deve-se selecionar fármacos com diferentes mecanismos de ação e diferentes graus de toxicidade25 clínica.
POSOLOGIA
As doses usuais de Fauldvincri® são:
Adultos: Dose de 0,4 a 1,4 mg/m2/semana ou 0,01 a 0,03 mg por kg de peso como dose única a cada 7 dias. Para adultos com bilirrubina66 acima de 3 mg/mL as doses devem ser reduzidas em 50%. A dose máxima por dia de aplicação não deve exceder 2 mg.
Crianças: Dose de 1,5 a 2 mg/m2/semana. Para crianças com 10 kg ou menos a dose é de 0,05 mg/kg/semana. Para crianças com bilirrubina66 acima de 3 mg/mL as doses devem ser reduzidas em 50%.
Pacientes com insuficiência hepática59: A dose inicial deve ser de 0,05 a 1 mg/m2. As doses seguintes serão ajustadas de acordo com a tolerância do paciente.
Pacientes idosos são mais propensos aos efeitos neurotóxicos.
Quando associada à L-asparginase, a dose de Fauldvincri® deverá ser administrada entre 12 e 24 horas antes da enzima95, com o objetivo de evitar-se uma diminuição da excreção hepática78 da vincristina, com consequente aumento de sua toxicidade25.
Recomendações de práticas seguras e adequadas para perfuração do frasco-ampola:
- Inserir a agulha de injeção49 de, no máximo, 1,20×40 mm de calibre;
- Apoiar o frasco-ampola firmemente na posição vertical;
- Perfurar a tampa de borracha de Fauldvincri® dentro do círculo central demarcado, inserindo assepticamente a agulha a 45º com bisel voltado para cima e, ao longo da perfuração, posicioná-la a 90º (figura abaixo);
- Evitar que as novas perfurações sejam no mesmo local;
- É recomendado não perfurar mais de 3 vezes a área demarcada (círculo central);
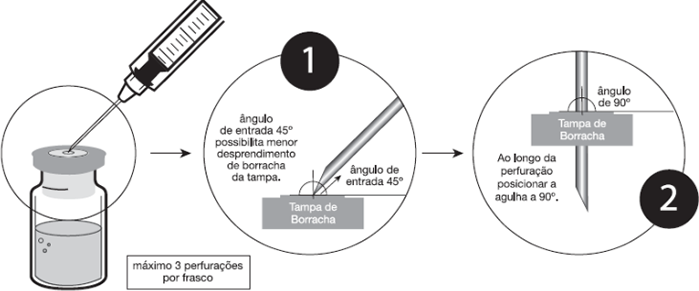
A cada 3 perfurações com uma mesma agulha, substituí-la por uma nova. Veja abaixo o procedimento:
O profissional da saúde1 deverá inspecionar cuidadosamente, antes de sua utilização, se a solução no interior do frasco-ampola está fluida, livre de fragmentos96 ou de alguma substância que possa comprometer a eficácia e a segurança do medicamento. Não é recomendado a utilização do produto ao verificar qualquer alteração que possa prejudicar a saúde1 do paciente.
REAÇÕES ADVERSAS
Antes da utilização de Fauldvincri®, pacientes e familiares devem ser alertados quanto à possibilidade de ocorrência de eventos adversos pelo uso do próprio medicamento e suas associações. Essas reações geralmente são reversíveis e dose-dependentes.
O evento adverso mais frequente é a alopecia97 e os mais desagradáveis são os distúrbios neuromusculares.
Quando são utilizadas doses únicas semanais, as reações adversas tipo leucopenia98, dor neurítica, obstipação99 e dificuldade para caminhar são geralmente de curta duração (duram menos do que sete dias). Quando a dose é reduzida, estas reações diminuem de intensidade ou desaparecem. Elas parecem aumentar quando todo o medicamento é administrado em doses fracionadas. Outras reações como perda de cabelo100, parestesia101, descoordenação motora, diminuição das sensações, diminuição dos reflexos tendinosos profundos e cansaço muscular podem persistir durante todo o período de tratamento. A disfunção generalizada sensorial e motora pode agravar-se progressivamente com a continuação do tratamento. Na maioria dos casos, as reações adversas desaparecem por volta da sexta semana após a suspensão do tratamento; porém em alguns pacientes, as dificuldades neuromusculares podem persistir por períodos mais prolongados. O cabelo100 pode voltar a crescer durante a terapia de manutenção.
Neurológicas: A neurotoxicidade é o efeito mais comum dose-limitante. Frequentemente há uma sequência no desenvolvimento das reações adversas neuromusculares. Inicialmente são observados apenas diminuição sensorial e parestesia101. Continuando-se o tratamento, pode aparecer dor neurítica e posteriormente motora. Não foi desenvolvido ainda algum medicamento que possa reverter às manifestações neuromusculares que acompanham a terapia com sulfato de vincristina. Perda de reflexos tendinosos profundos, queda do pé, ataxia102 e paralisia47 foram relatadas com a continuação do tratamento. Manifestações no nervo craniano, incluindo paralisia47 isolada e/ou paralisia47 dos músculos103 controlados pelos nervos cranianos motores podem ocorrer na ausência de insuficiência104 motora; os músculos103 extra-oculares e laríngeos são os mais comumente envolvidos. Há relatos de paralisia47 das cordas vocais105 (paralisia47 do nervo laríngeo) após tratamento com vincristina em crianças25,26,27. Toxicidade25 ocular, com diplopia106 e outros sintomas107 causados pela paralisia47 dos nervos cranianos também foram reportados em outros estudos28. Ptose108 e complicações da musculatura ocular também foram relatadas, com 1 caso de cegueira noturna29. Dor maxilar, na faringe109, nas glândulas parótidas110, nos ossos, nas costas111, nos membros inferiores e superiores e mialgias112 foram relatadas, podendo ser graves as dores dessas áreas. Foram relatadas convulsões, frequentemente com hipertensão113, em poucos pacientes que estejam recebendo sulfato de vincristina. Em crianças foram observadas convulsões, seguidas de coma114. Foram relatadas também cegueira cortical transitória e atrofia115 óptica com cegueira. Há relatos de perda auditiva em idosos30,31.
Hipersensibilidade: Casos raros de reações tipo alérgicas, como anafilaxia116, erupção117 e edema118 foram relacionadas a pacientes que receberam vincristina como parte da poliquimioterapia.
Gastrointestinais: Pode ocorrer obstipação99, cólicas119 abdominais, perda de peso, náuseas120, vômitos121, ulcerações122 orais, diarreia123, íleo paralítico124, necrose125 e/ou perfuração intestinal e anorexia126. A obstipação99 pode ocasionar bloqueio do colo ascendente127 e, no exame físico o reto128 pode encontrar-se vazio. A dor abdominal ou cólica, na presença de um reto128 vazio, pode confundir o médico. Uma simples radiografia do abdômen é útil para demonstrar essa condição. Todos os casos responderam ao tratamento com laxativos129 e enemas130. Recomenda-se um regime profilático rotineiro contra a constipação131 para todos os pacientes recebendo sulfato de vincristina. Pode ocorrer íleo paralítico124, mimetizando o “abdômen cirúrgico”, particularmente em crianças pequenas. Este quadro recupera-se com a interrupção temporária do medicamento e com tratamento sintomático132. Também há relatos da ocorrência de pancreatite133 aguda em uso concomitante da vincristina com ciclofosfamida, doxorrubicina e prednisona32.
Renais: Foram relatadas poliúria134, disúria135 e retenção urinária136 devido à atonia da bexiga137. Outros medicamentos conhecidos por causarem retenção urinária136 (particularmente em idosos) devem, se possível, ser temporariamente suspensas durante os primeiros dias após a administração de sulfato de vincristina.
Hepáticas41: O aparecimento de doença venoclusiva do fígado34 e hepatotoxicidade68 foram associados com o uso de vincristina7. Segundo estudo clínico com 821 pacientes, a incidência138 do aparecimento da hepatotoxicidade68 é de 1,2%33.
Hematológicas: O sulfato de vincristina parece não exercer qualquer efeito constante ou significativo sobre as plaquetas37 ou hemácias139. A depressão grave da medula óssea30 não é geralmente o maior fator dose-limitante. Contudo, foram relatadas anemia140, leucopenia98 e trombocitopenia141. A trombocitopenia141, se presente quando a terapia com sulfato de vincristina é iniciada, pode melhorar efetivamente antes do aparecimento da remissão da medula82.
Leucemia3: Foi realizado um estudo clínico pelo Grupo de Pediatria Oncológica (Pediatric Oncology Group) com 198 crianças menores de 3 anos de idade que apresentavam tumores cerebrais malignos e foram tratados com quimioterapia2 pós-operativa a longo prazo. Neste estudo observou-se a incidência138 de leucemia3 secundária (todas fatais) de 1,5%. Após a administração de ciclos de ciclofosfamida juntamente com vincristina, alternando com cisplatina e etoposídeo, durante um período de 2 anos, o primeiro diagnóstico142 em três crianças com idade inferior a 2 anos revelou o surgimento da síndrome44 mielodisplásica em 2 destes pacientes (com supressão do cromossomo143 7) e leucemia3 mieloide em 1 paciente. O período de latência144 entre o início da quimioterapia2 e a malignidade secundária variou de 2,8 a 7,7 anos. A dose de cisplatina foi de 4 mg/kg uma vez a cada 3 meses para uma dose cumulativa de aproximadamente 600 mg/m2, 36.
Cardiovasculares: Hipertensão113 e hipotensão145 foram relatadas. Quimioterapia2 que inclui o sulfato de vincristina quando administrada a pacientes previamente tratados com radioterapia24 do mediastino146 foi associada a doenças coronárias e infarto do miocárdio147. A causalidade não foi estabelecida. Em estudo clínico foi verificado o aparecimento de angina148 pectoris, provavelmente causada por vasoconstrição149 coronária34.
Endócrinas: Ocorrências raras de uma síndrome44 atribuída à secreção inadequada de hormônio150 antidiurético foi observado em pacientes tratados com sulfato de vincristina. Essa síndrome44 é caracterizada por uma alta excreção de sódio na urina42, na presença de hiponatremia151, e na ausência de: doença renal152 ou adrenal, hipotensão145, desidratação153, azotemia e edema118 clínico. Com a restrição hídrica, ocorre melhora na hiponatremia151 e na perda renal152 de sódio.
Pele154: Alopecia97 e erupções.
Respiratórias: Alcaloides da vinca estão associados com a síndrome44 do desconforto respiratório (falta de ar e broncoespasmo80). Ocasionalmente este efeito tóxico respiratório pode ser fatal7.
Sistema reprodutor masculino: A vincristina foi independentemente correlacionada com azoospermia75 em 51% de 55 pacientes adultos que sobreviveram de câncer12 na infância, que foram tratados com radioterapia24, cirurgia e medicamentos citotóxicos155. Seis dos sete pacientes que foram submetidos a irradiação testicular também receberam vincristina ou ciclofosfamida (ou ambos) e todos apresentaram azoospermia75. O paciente remanescente recebeu apenas a radiação e não apresentou a azoospermia75. Em análise multivariada, a dose de vincristina (mg/m2) foi determinada para apresentar uma relação inversa com a contagem de espermatozoides156 (p=0,002) e parece estar relacionada com a azoospermia75 5 vezes mais do que outros medicamentos (p=0,02)35.
Outras: Febre157 e dor de cabeça158.
Em casos de eventos adversos, notifique pelo Sistema VigiMed, disponível no Portal da Anvisa.
SUPERDOSE
A superdose de Fauldvincri® pode acarretar uma exacerbação, às vezes fatal, das reações mencionadas anteriormente, uma vez que estas reações tóxicas são dose-relacionadas. Os sintomas107 relacionados ao sistema nervoso central58 incluem delírio159 progressivo a inconsciência160, convulsões e morte. Dentro de 24 horas da superdose pode ocorrer náusea161, vômito162 e febre157. Outros efeitos incluem supressão grave da medula óssea30, hiponatremia151, hipocalemia163 e síndrome44 de secreção inadequada de hormônio150 antidiurético.
Neuropatias, perda profunda dos reflexos dos tendões164, delírios, alucinações165, coma114, convulsões e morte podem ocorrer durante a primeira semana posterior à intoxicação37.
Houve morte em crianças menores de 13 anos após receberem 10 vezes a dose recomendada de vincristina. Podem ocorrer sintomas107 graves nesse grupo de pacientes após doses de 3 a 4 mg/m2. Podem ocorrer sintomas107 graves em adultos após doses únicas de 3 mg/m2 ou mais.
Em caso de superdose, as seguintes medidas devem ser tomadas:
- Prevenir a síndrome44 da secreção inapropriada do hormônio150 antidiurético, diminuindo a oferta de líquidos e, nos casos indicados, utilizar diuréticos166 que atuem sobre o túbulo distal167 ou alça de Henle168;
- Prevenção da convulsão79 pela administração de fenobarbital em doses anticonvulsivantes;
- Prevenção do íleo paralítico124 através de enemas130. Em alguns casos torna-se necessária a descompressão169 do trato gastrointestinal;
- Controle cuidadoso do sistema cardiovascular170;
- Realização de hemograma diário para controle e verificação da necessidade de transfusões;
- Administração de ácido folínico de 50 a 100 mg por via endovenosa a cada 3 horas por um período de 48 horas, a seguir a cada 6 horas por mais um período mínimo de 48 horas. O uso do ácido folínico não dispensa as medidas de apoio mencionadas acima.
É previsto que os níveis teciduais teóricos de sulfato de vincristina permaneçam significativamente elevados por, no mínimo, 72 horas.
A maior parte de uma dose intravenosa de Fauldvincri® é excretada na bile35 após uma rápida ligação com os tecidos. A hemodiálise171 parece não auxiliar no tratamento da superdose já que uma quantidade muito pequena do fármaco31 aparece no líquido de diálise172. Pacientes com doença hepática78, que diminui a excreção biliar do medicamento, podem apresentar um aumento na gravidade das reações adversas. O aumento da excreção fecal de vincristina, administrada parenteralmente, foi demonstrado em cães pré-tratados com colestiramina. Não há dados clínicos publicados sobre o uso da colestiramina como um antídoto173 em humanos. Não há dados clínicos publicados sobre as consequências de ingestão oral de vincristina. Se ocorrer ingestão oral, o estômago174 deve ser esvaziado, seguido de administração oral de carvão ativado e catártico.
A administração intratecal causa paralisia47 ascendente, neurotoxicidade grave, coma114 e geralmente é fatal37.
Em caso de intoxicação ligue para 0800 722 6001, se você precisar de mais orientações.
REFERÊNCIAS BIBLIOGRÁFICAS
- Sardi JE, Giaroli A, Sananes C, et al: Long-term follow-up of the first randomized trial using neoadjuvant chemotherapy in stage Ib squamous carcinoma11 of the cervix: the final results. Gynecol Oncol. 1997 Oct;67(1):61–9.
- Linch DC, Smith P, Hancock BW, et al: A randomised british national lymphoma investigation trial of CHOP vs. a weekly multi-agent regimen (PACEBOM) in patients with histologically aggressive non-Hodgkin’s lymphoma. Ann Oncol 2000; 11(suppl 1):s87-s90.
- Roth BJ, Johnson DH, Einhorn LH, et al: Randomized study of cyclophosphamide, doxorubicin, and vincristine versus etoposide and cisplatin versus alternation of these two regimens in extensive small-cell lung cancer12: a phase III trial of the Southeastern Cancer12 Study Group. J Clin Oncol. 1992 Feb;10(2):282–91.
- Gidding CEM, Meeuwsen-de Boer GJ, Koopmans P, et al: Vincristine pharmacokinetics after repetitive dosing in children. Cancer12 Chemother Pharmacol 1999; 44:203–209.
- Product Information: Oncovin(R), vincristine sulfate. Eli Lilly and Company, Indianapolis, IN, 1999.
- Knoben JE & Anderson POKnoben JE & Anderson PO (Eds): Handbook of Clinical Drug Data, 6th. Drug Intelligence Publications, Inc, Hamilton, IL, 1988.
- Vincristine, Drugdex Evaluations – Micromedex, disponível em: http://www.thomsonhc.com/hcs/librarian/ND_T/HCS/ND_PR/Main/CS/4E76BC/DUPLICATIONSHIELDSYNC/0BCA BD/ND_PG/PRIH/ND_B/HCS/SBK/7/ND_P/Main/PFActionId/hcs.common.RetrieveDocumentCommon/DocId/1936/C ontentSetId/31/SearchTerm/ vincristin%20/SearchOption/BeginWith.
- Harris J, Dodds LJ. Handling waste from patients receiving cytotoxic drugs. Pharm J 1985; 235: 289–91.
- Murphy JA, et al. Vincristine toxicity in five children with acute lymphoblastic leukaemia. Lancet 1995; 346: 443. (PubMed id:7623589).
- Jeng MR, Feusner J. Itraconazole-enhanced vincristine neurotoxicity in a child with acute lymphoblastic leukemia. Pediatr Hematol Oncol 2001; 18: 137–42. (PubMed id:11255732).
- Sathiapalan RK, El-Solh H. Enhanced vincristine neurotoxicity from drug interactions: case report and review of literature. Pediatr Hematol Oncol 2001; 18: 543–6. (PubMed id:11764105).
- Kamaluddin M, et al. Potentiation of vincristine toxicity by itraconazole in children with lymphoid malignancies. Acta Paediatr 2001; 90: 1204–7. (PubMed id:11697438).
- Villikka K, et al. Cytochrome P450-inducing antiepileptics increase the clearance of vincristine in patients with brain tumours. Clin Pharmacol Ther 1999; 66: 589–93. (PubMed id:10613614).
- Carrión C, et al. Possible vincristine-isoniazid interaction. Ann Pharmacother 1995; 29: 201. (PubMed id:7756727).
- Kuhlmann J, Zilly W, & Wilke J: Effects of cytostatic drugs on plasma175 level and renal152 excretion of beta-acetyldigoxin. Clin Pharmacol Ther 1981; 30:518–527.
- Product Information: COUMADIN(R) oral tablets, IV injection, warfarin sodium oral tablets, IV injection. Bristol-Myers Squibb Company, Princeton, NJ, 2007.
- Product Information: CYTOXAN(R) injection, oral tablets, cyclophosphamide injection, oral tablets. Bristol-Myers Squibb Company, Princeton, NJ, 2005.
- Product Information: ETOPOPHOS(R) injection, etoposide phosphate. Bristol-Myers Squibb Company, Princeton, NJ, 2004.
- Product Information: MATULANE(R) capsules, procarbazine hydrochloride capsules. Sigma-Tau Pharmaceuticals Inc., Gaithersburg, MD, 2004.
- Product Information: Vincristine sulfate injection USP. Gensia Sicor Pharmaceuticals Inc, Irvine, CA (PI issued 07/1999) reviewed 04/2004, 07/1999.
- Product Information: MUSTARGEN(R) injection, mechlorethamine hcl injection. Merck & Co., Whitehouse Station, NJ, 2004.
- Product Information: RUBEX(R) injection, doxorubicin hydrochloride injection. Mead Johnson, Princeton, NJ, 2001.
- Cohen MH, Johnston-Early A, Hood MA, et al: Drug precipitation within IV tubing: a potential hazard of chemotherapy administration. Cancer12 Treat Rep 1985h; 69:1325–1326.
- Turowski RC & Durthaler JM: Visual compatibility of idarubicin hydrochloride with selected drugs during simulated Y-site injection. Am J Hosp Pharm 1991; 48:2181–2184.
- Product Information: Oncovin(R), vincristine sulfate. Eli Lilly and Company, Indianapolis, IN, 1999b.
- Annino DJ Jr, MacArthur CJ, & Friedman EM: Vincristine-induced recurrent laryngeal nerve paralysis. Laryngoscope 1992; 102:1260–1262.
- Tobias JD & Bozeman PM: Vincristine-induced recurrent laryngeal nerve paralysis in children. Intensive Care Med 1991; 17:304–305.
- Griffin JD & Garnick MB: Eye toxicity of cancer12 chemotherapy: a review of the literature. Cancer12 1981; 48:1539–1549.
- Sandler SG, Tobin W, & Henderson ES: Vincristine induced neuropathy: a clinical study of fifty leukemic patients. Neurology 1969; 19:367–374.
- Yousif H, Richardson SGN, & Saunders WA: Partially reversible nerve deafness due to vincristine (letter). Postgrad Med J 1990; 66:688–689.
- Mahajan SL, Ikeda Y, Myers TJ, et al: Acute acoustic nerve palsy associated with vincristine therapy. Cancer12 1981; 47:2404–2406.
- Puckett JB, Butler WM, & McFarland JA: Pancreatitis and cancer12 chemotherapy (letter). Ann Intern Med 1982; 97:453.
- Ortega JA, Donaldson SS, Ivy SP, et al: Venoocclusive disease of the liver after chemotherapy with vincristine, actinomycin D, and cyclophosphamide for the treatment of rhabdomyosarcoma: a report of the Intergroup Rhabdomyosarcoma Study Group. Cancer12 1997; 79:2435–2439.
- Dixon A, Nakamura JM, Oishi N,et al: Angina148 pectoris and therapy with cisplatin, vincristine, and bleomycin. Ann Intern Med. 1989 Aug 15;111(4):342–3.
- Rautonen J, Koskimies AI, & Siimes MA: Vincristine is associated with the risk of azoospermia75 in adult male survivors of childhood malignancies. Eur J Cancer12 1992; 28A:1837–1841.
- Duffner PK, Krischer JP, Horowitz ME, et al: Second malignancies in young children with primary brain tumors following treatment with prolonged postoperative chemotherapy and delayed irradiation: a pediatric oncology group study. Ann Neurol 1998; 44:313–316.
- Vincristine, Poisindex Summary – Micromedex, disponível em: http://www.thomsonhc.com/hcs/librarian/ND_T/HCS/ND_PR/Main/CS/4E76BC/DUPLICATIONSHIELDSYNC/0BCA BD/ND_PG/PRIH/ND_B/HCS/SBK/5/ND_P/Main/PFActionId/hcs.common.RetrieveDocumentCommon/DocId/610/Co ntentSetId/68/SearchTerm/vincristin/SearchOption/BeginWith.
DIZERES LEGAIS
VENDA SOB PRESCRIÇÃO MÉDICA
USO RESTRITO A HOSPITAIS
MS nº: 1.0033.0135
Farmacêutica Responsável: Cintia Delphino de Andrade – CRF-SP nº: 25.125
Registrado por:
Libbs Farmacêutica Ltda.
Rua Josef Kryss, 250 – São Paulo – SP
CNPJ: 61.230.314/0001–75
Fabricado por:
Libbs Farmacêutica Ltda.
Rua Alberto Correia Francfort, 88 – Embu das Artes – SP
Indústria Brasileira
SAC 0800 0135044






