

Fluir (Bula do profissional de saúde)
COSMED INDUSTRIA DE COSMETICOS E MEDICAMENTOS S.A.
IDENTIFICAÇÃO DO MEDICAMENTO
Fluir®
fumarato de formoterol di-hidratado
Cápsula 12 mcg
FORMA FARMACÊUTICA E APRESENTAÇÃO:
Cápsula dura
Embalagens contendo 20, 30 ou 60 cápsulas duras, com ou sem inalador
VIA DE ADMINISTRAÇÃO: INALATÓRIA POR VIA ORAL
USO ADULTO E PEDIÁTRICO ACIMA DE 5 ANOS
COMPOSIÇÃO:
Cada cápsula de Fluir® contém:
| fumarato de formoterol di-hidratado | 12mcg |
| excipientes q.s.p | 1 cápsula |
Excipientes: lactose1.
INFORMAÇÕES TÉCNICAS AOS PROFISSIONAIS DE SAÚDE2
INDICAÇÕES
- profilaxia e tratamento de broncoconstrição em pacientes com asma3 como terapia adicional aos Corticosteroides Inalatórios (ICS) (vide “Advertências e precauções”).
- profilaxia de broncoespasmo4 induzido por alérgenos5 inalados, ar frio ou exercício.
- profilaxia e tratamento de broncoconstrição em pacientes com Doença Pulmonar Obstrutiva Crônica (DPOC) reversível ou irreversível, incluindo bronquite crônica6 e enfisema7. Fluir® mostrou aumentar a qualidade de vida nos pacientes com DPOC.
RESULTADOS DE EFICÁCIA
Asma31
Vinte e sete ensaios clínicos8 internos em uma ampla faixa de idades incluíram populações pediátricas, de adultos e de idosos. Ensaios clínicos8 bem controlados demonstraram a superioridade do formoterol em relação ao placebo9 e salbutamol10 no tratamento da asma3, com um intervalo de tempo de tratamento de 1 dia (dose única) a 12 semanas. Além disso, quatro estudos clínicos abertos de acompanhamento incluindo as populações pediátricas, de adultos e de idosos desses estudos anteriores foram realizados demonstrando eficácia e perfil de segurança aceitáveis de formoterol por mais 12 meses de tratamento. Abaixo estão descritos três dos grandes ensaios clínicos8 que apoiaram a indicação de formoterol para asma3 em crianças, adultos e idosos, respectivamente.
O estudo DP/PD2 foi um estudo multicêntrico, duplo-cego, de 12 semanas, de grupos paralelos, que avaliou formoterol pó 12 mcg e 24 mcg por dia versus salbutamol10 pó 1200 mcg, diariamente, em 219 crianças com asma3 (5 a 13 anos). O estudo concluiu que o formoterol pó 12 mcg, duas vezes ao dia, administrado na forma de cápsulas dura com pó para inalação através do inalador tem efeito broncodilatador11 superior quando comparado com salbutamol10 pó 400 mcg, três vezes ao dia, após 12 semanas de terapia, conforme avaliado pelo Pico de Fluxo Expiratório (PEFR). Em relação à segurança, o formoterol 12 mcg, duas vezes ao dia, foi ligeiramente melhor tolerado que salbutamol10 400 mcg, três vezes ao dia ou sobre formoterol 6 mcg, duas vezes ao dia, durante 3 meses de tratamento.
O estudo DP/RD1 foi um estudo placebo9-controlado, multicêntrico, duplo cego, entre pacientes, que comparou doses múltiplas de 12 mcg de formoterol pó com doses múltiplas de 400 mcg de salbutamol10 pó em 304 pacientes (19 a 72 anos) com asma3, durante um período de 12 semanas de tratamento ativo. O estudo concluiu que o formoterol 12 mcg, duas vezes ao dia, foi estatisticamente superior, tanto ao salbutamol10 400 mcg, quatro vezes ao dia quanto ao placebo9 com relação à variável de desfecho primário (PEFR pela manhã, antes da inalação). Em relação à segurança, o formoterol 12 mcg, duas vezes ao dia, foi igualmente bem tolerado como o salbutamol10 400 mcg, quatro vezes ao dia ou o placebo9, durante 3 meses de tratamento.
O estudo DP/RD3 foi um estudo multicêntrico, duplo-cego, de grupos paralelos, que comparou a eficácia e tolerabilidade de 3 meses de formoterol pó para inalação 12 mcg e 24 mcg, duas vezes ao dia e salbutamol10 400 mcg pó, quatro vezes ao dia, em 262 pacientes idosos (64 a 82 anos) com asma3. O estudo concluiu que o formoterol 12 mcg e 24 mcg, duas vezes ao dia, foi estatisticamente superior ao salbutamol10 400 mcg, quatro vezes ao dia, com relação à variável de desfecho primário (PEFR pela manhã, antes da inalação) ao longo de 3 meses. Em relação à segurança, o formoterol foi ligeiramente melhor tolerado que o salbutamol10.
Profilaxia de broncoespasmo4 induzido por alérgenos5 inalados, ar frio ou exercícios2
Quatro estudos clínicos foram realizados com formoterol em pacientes tratados para a profilaxia de broncoespasmo4 induzido por exercício e dois estudos foram realizados em pacientes para a profilaxia de broncoespasmo4 induzido por alérgeno12 inalado. Os três estudos principais que suportam a indicação de formoterol na profilaxia do broncoespasmo4 induzido por alérgenos5 inalados, ar frio ou exercício são descritos abaixo.
– Profilaxia da broncoconstrição induzida pelo exercício
Um estudo cruzado com 4 braços, de dose única, randomizado13, duplo-cego, duplo-simulado comparou formoterol 12 mcg e 24 mcg cápsulas dura com pó para inalação, 180 mcg de albuterol com inalador dosimétrico versus placebo9 em 17 pacientes (13-50 anos) para a prevenção da broncoconstrição induzida pelo exercício. O estudo concluiu que uma única dose de formoterol 12 mcg ou 24 mcg proporciona uma proteção significativamente maior contra a broncoconstrição induzida pelo exercício, conforme avaliado pelo VEF1 em comparação com placebo9, 15 minutos e 4, 8 e 12 horas após a dosagem. Ambas as doses de formoterol proporcionaram proteção significativamente maior do que o albuterol em 4, 8 e 12 horas após a dose. Nenhuma diferença significativa na eficácia foi identificada entre formoterol 12 mcg e 24 mcg. Houve menos eventos adversos relatados com o formoterol 24 mcg.
– Profilaxia da broncoconstrição induzida por alérgenos5
Um ensaio clínico multicêntrico, randomizado13, placebo9-controlado, intrapaciente, avaliou a eficácia e a tolerabilidade de uma dose única de formoterol inalado 24 mcg na proteção da broncoconstrição induzida por alérgenos5 em 24 pacientes (17 a 40 anos) com asma3, avaliada entre 3 e 32 horas após a inalação do medicamento do estudo. O estudo concluiu que o formoterol levou a uma proteção significativa e duradoura da broncoconstrição induzida pelo alérgeno12, conforme avaliado pelo VEF1. Em relação à segurança, o formoterol teve um perfil de tolerabilidade excelente.
– Profilaxia da broncoconstrição induzida pelo ar frio
Em um estudo controlado, a duração do efeito do formoterol inalado (24 mcg) foi comparada com a do placebo9 e de albuterol (200 mcg) em 12 pacientes asmáticos adultos que foram submetidos a testes de hiperventilação com ar seco frio (-20°C) em 4 dias de estudo. No dia controle, eles foram submetidos a quatro testes de hiperventilação para assegurar a estabilidade funcional. Nos 3 dias remanescentes após o primeiro teste de hiperventilação, eles inalaram placebo9, albuterol e formoterol em estudo randomizado14 e duplo-cego. O teste de hiperventilação foi repetido em 1, 4, e 8 horas e, se o efeito de bloqueio ainda estava presente, 12 e 24h após o medicamento ter sido administrado. O estudo concluiu que a proteção contra a broncoconstrição, conforme avaliado pelo VEF1, induzida pela hiperventilação de ar não condicionado em indivíduos asmáticos é significativamente mais prolongada após o uso de formoterol do que após o uso de albuterol.
DPOC3
Dois grandes estudos controlados, multinacional, multicêntrico, randomizado13, duplo-cego, de grupos paralelos, foram realizados na população-alvo de pacientes com DPOC (estudos 25827 02 056 e 25827 02 058). Ambos foram placebos controlados e incluíram um braço comparador ativo. O objetivo primário em ambos os ensaios foi avaliar a eficácia de formoterol 12 mcg e 24 mcg, duas vezes ao dia, administrado pelo inalador em comparação com o placebo9.
Em ambos os ensaios foi feita uma análise mais aprofundada de pacientes classificados como "reversível" ou "irreversível", em uma linha de base fundamentada em um ponto de corte de 15% de aumento no VEF1, 30 minutos após a inalação de 200 mcg salbutamol10. Aproximadamente 50% dos pacientes tinham DPOC reversível em ambos os ensaios.
O estudo 25827 02 056 foi um ensaio randomizado13, duplo-cego, entre pacientes, que comparou duas doses de fumarato de formoterol pó para inalação (12 e 24 mcg, duas vezes ao dia) com placebo9 e brometo de ipratrópio MDI (40 mcg, quatro vezes ao dia) por 12 semanas em 698 pacientes (40 a 87 anos) com DPOC. O estudo concluiu que o fumarato de formoterol (12 e 24 mcg, duas vezes ao dia) produziu melhoras estatisticamente e clinicamente significativas na função pulmonar, conforme medido pela área sob a curva de VEF1, quando comparado com o placebo9, após 12 semanas de tratamento. O fumarato de formoterol também melhorou a qualidade de vida dos pacientes e foi mais eficaz do que o brometo de ipratrópio (40 mcg, quatro vezes ao dia) com tolerabilidade satisfatória similar.
O estudo 25827 02 058 foi um ensaio randomizado13, entre pacientes, que comparou duas doses de fumarato de formoterol pó para inalação (12 mcg, duas vezes ao dia e 24 mcg, duas vezes ao dia) com placebo9 (duplo-cego) e com teofilina de liberação lenta por via oral (200-400 mg), em doses individuais com base nos níveis séricos (aberto), cada um administrado duas vezes por dia durante um ano em 725 pacientes (34 a 88 anos) com DPOC. O estudo concluiu que fumarato de formoterol, ambos, 24 mcg e 12 mcg, duas vezes ao dia produziram melhoras clinicamente e estatisticamente significativas na função pulmonar, conforme medido pela área sob a curva de VEF, quando comparado com o placebo9, após 12 semanas de tratamento. O fumarato de formoterol também melhorou a qualidade de vida dos pacientes e foi mais eficaz do que a teofilina, com tolerabilidade superior.
Referências bibliográficas
- Clinical Overview - Rationale for changes to Core Data Sheet (CDS) / Product Information – Asthma - Clinical sections. Novartis. 24-Oct-2012.
- Clinical Overview - Rationale for changes to Core Data Sheet (CDS) / Product Information – Prophylaxis of bronchospasm induced by inhaled allergens, cold air, or exercise –Clinical sections. Novartis. 24-Oct-2012.
- Clinical Overview - Rationale for changes to Core Data Sheet (CDS) / Product Information – COPD Clinical sections. Novartis. 24-Oct-2012.
CARACTERÍSTICAS FARMACOLÓGICAS
Grupo farmacoterapêutico: agonista15 seletivo beta2-adrenérgico16, código ATC: R03AC13.
Farmacodinâmica
O mecanismo de ação e a farmacodinâmica do formoterol são de um potente estimulante seletivo beta2-adrenérgico16.
Exerce efeito broncodilatador11 em pacientes com obstrução reversível das vias aéreas. O efeito inicia-se rapidamente (em 1 a 3 minutos), permanecendo ainda significativo 12 horas após a inalação. Com as doses terapêuticas, os efeitos cardiovasculares são pequenos e ocorrem apenas ocasionalmente.
O formoterol inibe a liberação de histamina17 e dos leucotrienos18 do pulmão19 humano sensibilizado passivamente. Algumas propriedades anti-inflamatórias, tais como inibição de edema20 e do acúmulo de células21 inflamatórias, têm sido observadas em experimentos com animais.
Estudos in vitro em traqueia22 de cobaia indicaram que o formoterol racêmico23 e seus enantiômeros (R,R)- e (S,S)- são adrenoreceptores beta2-agonistas altamente seletivos. O enantiômero (S,S)- foi 800 a 1.000 vezes menos potente que o enantiômero (R,R)- e não afetou a atividade deste no músculo liso24 da traqueia22. Nenhuma base farmacológica para o uso de um dos dois enantiômeros em preferência à mistura racêmica25 foi demonstrada.
No homem, tem-se demonstrado que Fluir® é eficaz na prevenção do broncoespasmo4 induzido por alérgenos5 inalados, exercícios, ar frio, histamina17 ou metacolina.
O formoterol administrado pelo inalador em doses de 12 microgramas e 24 microgramas duas vezes ao dia mostrou objetivamente fornecer um rápido início da broncodilatação26 em pacientes com Doença Pulmonar Obstrutiva Crônica (DPOC) estável, a qual foi mantida por no mínimo 12 horas e foi acompanhada por uma melhora subjetiva em termos de qualidade de vida, usando-se o “Saint George’s Respiratory Questionnaire”.
Farmacocinética
Fluir® tem uma faixa de dose terapêutica27 de 12 a 24 microgramas, duas vezes ao dia. Dados de farmacocinética plasmática do formoterol foram coletados em voluntários sadios após inalação de doses mais altas que as recomendadas e em pacientes com DPOC após inalação de doses terapêuticas. A excreção urinária de formoterol inalterado, utilizada como indicador indireto da exposição sistêmica, corresponde com os dados de disposição do fármaco28 no plasma29. As meias-vidas de eliminação calculadas para urina30 e plasma29 são similares.
Absorção
Após inalação de uma dose única de 120 microgramas de fumarato de formoterol di-hidratado por voluntários sadios, o formoterol foi rapidamente absorvido para o plasma29, atingindo a concentração máxima de 266pmol/L em 5 min após a inalação. Em pacientes com DPOC tratados por 12 semanas com 12 ou 24 microgramas de fumarato de formoterol, duas vezes ao dia, a média da concentração plasmática de formoterol estendeu-se entre 11,5 e 25,7pmol/L e 23,3 e 50,3pmol/L, respectivamente, 10 min, 2 horas e 6 horas após a inalação.
Estudos investigativos da excreção urinária cumulativa de formoterol e/ou seus enantiômeros (R, R)- e (S, S)- mostraram que a quantidade de formoterol disponível na circulação31 aumenta em proporção à dose inalada (12 a 96 microgramas).
Após inalação de 12 ou 24 microgramas de fumarato de formoterol di-hidratado, duas vezes ao dia durante 12 semanas, a excreção urinária de formoterol inalterado aumentou entre 63 e 73% (última vs. primeira dose) em pacientes com asma3, e entre 19 e 38% em pacientes com DPOC. Isto sugere um acúmulo limitado de formoterol no plasma29 com doses múltiplas. Não houve acúmulo relativo de um enantiômero em relação ao outro após doses repetidas.
Como relatado para outros fármacos inalados, é provável que a maioria do formoterol administrado pelo inalador seja ingerida e, em seguida, absorvido pelo trato gastrintestinal. Quando 80 microgramas de fumarato de formoterol di-hidratado 3H-marcado foi administrado oralmente a 2 voluntários sadios, pelo menos 65% do fármaco28 foi absorvido.
Distribuição
A ligação do formoterol às proteínas32 plasmáticas foi de 61 a 64%, e a ligação à albumina33 humana sérica foi 34%.
Não há saturação dos sítios de ligação na faixa de concentração atingida com doses terapêuticas.
Biotransformação/metabolismo34
O formoterol é eliminado principalmente pelo metabolismo34, sendo a glicuronidação direta a principal via de biotransformação. A O-demetilação seguida de glicuronidação é outra via. Outras vias de menor importância envolvem sulfato conjugação do formoterol e deformilação seguida de sulfato conjugação. Isoenzimas múltiplas catalisam a glicuronidação (UGT1A1, 1A3, 1A6, 1A7, 1A8, 1A9, 1A10, 2B7 e 2B15) e O-demetilação (CYP2D6, 2C19, 2C9 e 2A6) do formoterol, sugerindo um baixo potencial para interações fármaco28-fármaco28, apesar da inibição de uma isoenzima específica envolvida no metabolismo34 do formoterol. O formoterol não inibe isoenzimas do citocromo P450 em concentrações terapeuticamente relevantes.
Eliminação
Em pacientes asmáticos e com DPOC tratados por 12 semanas com 12 ou 24 microgramas de fumarato de formoterol, duas vezes por dia, aproximadamente 10% e 7% da dose de formoterol inalterado é recuperado na urina30, respectivamente. Os enantiômeros (R, R)- e (S, S)- contabilizaram, respectivamente, 40% e 60% da recuperação urinária de formoterol inalterado, após doses únicas (12 a 120 microgramas) em voluntários sadios e após doses únicas e repetidas em pacientes com asma3.
O fármaco28 e seus metabólitos35 foram completamente eliminados do organismo sendo aproximadamente dois terços de uma dose oral excretada na urina30 e um terço nas fezes. O clearance (depuração) renal36 de formoterol do sangue37 foi de 150 mL/min.
Em voluntários sadios, a meia-vida de eliminação terminal do formoterol no plasma29, após inalação de uma dose única de 120 microgramas de fumarato de formoterol di-hidratado, foi 10 horas e as meias-vidas de eliminação terminal dos enantiômeros (R, R)- e (S, S)-, como derivados das taxas de excreção urinária, foram 13,9 e 12,3 horas, respectivamente.
Populações especiais
- Efeito do gênero: após correção do peso corpóreo, a farmacocinética de formoterol não diferiu significativamente entre homens e mulheres.
- Pacientes idosos: a farmacocinética de formoterol não foi estudada na população de idosos.
- Crianças: em um estudo em crianças entre 5 e 12 anos com asma3, nas quais se administrou 12 ou 24 microgramas de fumarato de formoterol di-hidratado, duas vezes ao dia por inalação, durante 12 semanas, a excreção urinária de formoterol inalterado aumentou entre 18 e 84%, quando comparado a quantidades medidas após a primeira dose. Acúmulo em crianças não excedeu ao dos adultos, onde o aumento foi entre 63 e 73% (vide acima). Nas crianças estudadas, aproximadamente 6% da dose foi recuperada como formoterol inalterado na urina30.
- Pacientes com insuficiência hepática38/renal36: a farmacocinética de formoterol não foi estudada em pacientes com insuficiência hepática38 ou renal36.
Dados de segurança pré-clínicos
Mutagenicidade: Foram conduzidos testes de mutagenicidade cobrindo uma ampla faixa de parâmetros. Não foi encontrado efeito genotóxico em qualquer dos testes efetuados in vitro ou in vivo.
Carcinogenicidade: Estudos de dois anos em ratos e camundongos não indicaram qualquer potencial carcinogênico. Camundongos machos tratados com níveis de dosagem bastante altos demonstraram uma incidência39 ligeiramente maior de tumor40 benigno de célula41 subcapsular adrenal. Entretanto, o mesmo não foi
observado em um segundo estudo de alimentação para camundongos, no qual alterações patológicas com altas doses consistiram em um aumento da incidência39 de ambos os tumores benignos de músculo liso24 no trato genital das fêmeas e tumores de fígado42 em ambos os sexos. Tumores de músculo liso24 são efeitos conhecidos de beta-agonistas quando administrados em altas doses em roedores.
Dois estudos em ratos, com diferentes faixas de dosagem, demonstraram um aumento de leiomiomas mesovarianos. Esses neoplasmas43 benignos são tipicamente associados, em tratamentos prolongados de ratos, com altas dosagens de fármacos beta2-adrenérgicos44. Um aumento na incidência39 de cistos ovarianos e células21 tumorais benignas da teca e da granulosa foi também observado; são conhecidos os efeitos dos beta-agonistas em ovário45 de ratas, sendo os mesmos específicos de roedores. Alguns outros tipos de tumores observados no primeiro estudo com altas dosagens estavam de acordo com a incidência39 do histórico da população controle e não foram observados no ensaio de doses menores. Nenhuma das incidências de tumores aumentou a uma extensão estatisticamente significativa na dose mais baixa do segundo estudo com ratos, dose esta que levou a uma exposição sistêmica 10 vezes maior do que a esperada com a dosagem máxima recomendada de formoterol em humanos.
Baseando-se nas conclusões dos estudos e na ausência de potencial mutagênico, conclui-se que o uso de formoterol em doses terapêuticas não apresenta risco carcinogênico.
Toxicidade46 sobre a reprodução47
Para fertilidade, reprodução47 e desenvolvimento de estudos de toxicologia, ver seção “Advertências e precauções – Gravidez48, lactação49, homens e mulheres com potencial reprodutivo”.
Estudo de toxicidade46 juvenil: Em um estudo de toxicidade46 juvenil em ratos, o formoterol ((R, R) - enantiômero) causou atrofia50 tubular testicular, detritos espermáticos, oligospermia em epidídimos em machos a 3 mg/kg/dia [correspondendo a 1500 vezes, a dose máxima recomendada em humanos (MRHID) baseado na superfície de área corporal (BSA)].
CONTRAINDICAÇÕES
Fluir® é contraindicado a pacientes com hipersensibilidade ao formoterol ou a qualquer outro excipiente.
ADVERTÊNCIAS E PRECAUÇÕES
Fluir® cápsula dura com pó para inalação deve ser utilizado com o inalador fornecido na embalagem.
Morte relacionada à asma3
O formoterol, substância ativa do Fluir®, pertence à classe dos agonistas beta2-adrenérgicos44 de longa duração. Em um estudo com salmeterol, um diferente beta2-agonista15 de longa duração, uma maior taxa de mortes devido à asma3 foi observada em pacientes tratados com salmeterol (13/13.176) quando comparado com o grupo placebo9 (3/13.179). Não foram realizados estudos específicos para determinar se a taxa de mortes relacionada à asma3 seja aumentada com o Fluir®.
Dose recomendada
A dose recomendada de Fluir® deve ser adequada de acordo com as necessidades individuais de cada paciente e deve ser a menor possível para atingir o objetivo terapêutico. Não se deve aumentar a dose mais que a máxima recomendada (vide “Posologia e modo de usar”).
Necessidade de tratamento anti-inflamatório na asma3
No tratamento de pacientes com asma3, use Fluir®, um beta2-agonista15 de longa duração (LABA), apenas em adição a um Corticosteroide Inalatório (ICS) para os pacientes que não estão controlados adequadamente com um corticosteroide inalatório apenas, ou naqueles em que a gravidade da doença claramente justifique o início de tratamento com ambos, corticosteroides inalatórios e beta2-agonistas de longa duração.
Para crianças de 5 a 12 anos, o tratamento combinado com um produto contendo um corticosteroide inalatório e um beta2-agonista15 de longa duração (LABA) é recomendado, exceto nos casos em que um corticosteroide inalatório e um beta2-agonista15 de longa duração (LABA) forem necessários separadamente (vide “Posologia e modo de usar” e “Reações adversas”).
Fluir® não deverá ser utilizado em conjunto com outro beta2-agonista15 de longa duração (LABA).
Quando Fluir® for prescrito, o paciente deve ser avaliado quanto à adequação do tratamento anti-inflamatório que estiver recebendo. Os pacientes devem ser alertados a manter o tratamento anti-inflamatório inalterado após a introdução de Fluir®, mesmo quando os sintomas51 melhorarem.
Uma vez controlados os sintomas51 da asma3, considerações podem ser feitas para a redução gradual da dose de Fluir®. O monitoramento regular dos pacientes enquanto o tratamento é reduzido é importante. A menor dose efetiva de Fluir® deve ser usada.
Exacerbações da asma3
Estudos clínicos com fumarato de formoterol di-hidratado sugeriram uma maior incidência39 de exacerbações graves de asma3 em pacientes que receberam fumarato de formoterol di-hidratado quando comparado com aqueles que receberam placebo9, particularmente nos pacientes entre 5 e 12 anos (vide “Reações adversas”). Esses estudos não permitem uma quantificação precisa das diferenças das taxas de exacerbações graves de asma3 entre os grupos de tratamento.
O médico deve reavaliar o tratamento da asma3 caso os sintomas51 persistam ou se o número de doses de Fluir® necessárias para o controle dos sintomas51 aumentar, pois geralmente indicam que a condição subjacente está deteriorada.
O tratamento com Fluir® não deve ser iniciado ou sua dose aumentada durante a exacerbação da asma3. Fluir® não deve ser utilizado para o alívio dos sintomas51 agudos da asma3. No caso de um ataque agudo52, um beta2-agonista15 de curta duração deve ser utilizado. Os pacientes devem ser informados que é necessário procurar tratamento médico imediatamente, caso sua asma3 inesperadamente piorar.
Condições concomitantes
Cuidado especial e supervisão, com ênfase particular nos limites de dosagem, são necessários em pacientes tratados com Fluir®, quando coexistirem as seguintes condições: doença cardíaca isquêmica, arritmias53 cardíacas (especialmente bloqueio atrioventricular de terceiro grau), descompensação cardíaca grave, estenose54 subvalvular aórtica idiopática55, hipertensão56 grave, aneurisma57, feocromocitoma58, cardiomiopatia obstrutiva hipertrófica, tireotoxicose, prolongamento suspeito ou conhecido do intervalo QT (QTc > 0,44seg; vide “Interações medicamentosas”).
Devido ao efeito hiperglicêmico dos beta2-estimulantes, incluindo Fluir®, recomenda-se monitoramento adicional de glicose sanguínea59 em pacientes diabéticos.
Hipopotassemia60
Hipopotassemia60 potencialmente grave pode resultar do tratamento com beta2-agonistas, incluindo Fluir®. A hipopotassemia60 pode aumentar a susceptibilidade61 a arritmias53 cardíacas. Recomenda-se cuidado especial em pacientes com asma3 grave, já que a hipopotassemia60 pode ser potencializado por hipóxia62 e tratamento concomitante (vide “Interações medicamentosas”). Recomenda-se que os níveis de potássio sérico sejam monitorizados em tais situações.
Broncoespasmo4 paradoxal63
Assim como em outros tratamentos por inalação, o potencial para broncoespasmo4 paradoxal63 deve ser considerado. Se isso ocorrer, o medicamento deve ser imediatamente descontinuado e substituído por tratamento alternativo.
Via de administração incorreta
Há relatos de pacientes que erroneamente engoliram cápsulas dura de Fluir® ao invés de colocar as cápsulas dura no dispositivo de inalação. A maioria destas ingestões não foi associada com reações adversas. Os profissionais de saúde2 devem discutir com o paciente como utilizar corretamente Fluir® com o inalador (vide “Posologia e modo de usar”). Caso o paciente para o qual esteja prescrito Fluir® não apresente melhora na respiração, o médico deve verificar como o paciente está utilizando Fluir®.
Gravidez48 e lactação49, homens e mulheres em potencial reprodutivo
Gravidez48
Não existem estudos adequados ou controlados em mulheres grávidas para informar o risco associado ao produto.
Existem dados limitados quanto à utilização de fumarato de formoterol di-hidratado em mulheres grávidas. Em estudos de reprodução47 animal, a administração oral de do fumarato de formoterol racemato em ratos resultou em fetotoxicidade em doses 30 vezes a mais que a dose máxima recomendada à inalação humana (MRHID) baseado na área de superfície do corpo (BSA), enquanto que em coelhos, nenhuma fototoxicidade foi observada com doses 20000 vezes a MRHID com base na BSA.
Em estudos conduzidos por outra empresa, a administração oral de formoterol (R,R)-enantiomero em ratos e coelhos resultaram em teratogenicidade em 500 e 20000 vezes, respectivamente, a MRHID baseada na BSA. O uso de formoterol deve ser realizado durante a gravidez48 somente se o benefício superar os potenciais riscos ao feto64.
Considerações clínicas
Trabalho de parto e parto: Como outros estimulantes beta2-adrenérgicos44, o formoterol pode inibir o trabalho de parto, por seu efeito relaxante na musculatura lisa uterina.
Dados em animais: Em estudos de desenvolvimento embriofetal, o racemato de formoterol foi administrado por via oral a ratos (0,2, 6 e 60 mg/kg/dia) e coelhos (0,2, 60 e 500 mg/kg/dia) durante o período de organogênese. Em ratos, ossificação retardada e diminuição do peso corporal fetal foram observados com 0,2 e 6 mg/kg/dia, respectivamente, correspondendo a 30 e 1000 vezes, o MRHID baseado em BSA. Em coelhos, a diminuição espontânea no número de corpos lúteos e locais de implantação foi observada em 500 mg/kg/dia (correspondendo a 166000 vezes o MRHID com base em BSA) e a dose sem efeito foi de 60 mg/kg/dia (correspondendo a 20000 vezes o MRHID com base no BSA).
Num estudo de desenvolvimento peri e pós-natal, ratas grávidas foram administradas por via oral com racemato de formoterol (0,2, 6 e 30 mg/kg/dia) desde o dia 17 de gestação até ao final da lactação49. Natimortos, mortalidade65 neonatal e supressão do ganho de peso corporal foram observados na prole F1 a 6 mg/kg/dia (correspondendo a 1000 vezes o MRHID com base na BSA). Esses efeitos também foram observados em um estudo de adoção de enfermagem em ratos (ver dados de animais em lactação49). Nenhum efeito sobre os parâmetros reprodutivos e de desenvolvimento foi observado tanto na prole F1 quanto na F2.
Em estudos de desenvolvimento embriofetal conduzidos por outra empresa, o formoterol ((R,R) - enantiomero) demonstrou ser teratogênico66 após administração oral a ratos e coelhos, mas não após inalação em ratos. Em um estudo combinado de fertilidade e reprodução47, ratos machos e fêmeas foram tratados com formoterol ((R, R) – enantiômero oral (gavagem) por 9 semanas e por 2 semanas antes do acasalamento, respectivamente. O tratamento das fêmeas continuou durante o acasalamento, gravidez48 e lactação49. Foram observados hérnia67 umbilical, efeitos embriocidas e aumento da perda de filhotes com doses de 3 mg/kg/dia (correspondendo a 500 vezes o MRHID baseado em BSA) e braquiggnatia, com doses de 15 mg/kg/dia (correspondendo a 2500 vezes o MRHID com base em BSA). Em coelhos, cistos hepáticos subcapsulares observados em fetos indicaram teratogenicidade a 60 mg/kg/dia (correspondendo a 20.000 vezes o MRHID com base em BSA). No estudo de desenvolvimento embrio-fetal por inalação em ratos, nenhum efeito teratogênico66 foi observado até a dose máxima testada de 0,091 mg/kg/dia (15 vezes o MRHID com base em BSA).
Este medicamento pertence à categoria de risco na gravidez48 C, portanto, este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Lactação49: Não se sabe se o formoterol é transferido para o leite materno. No entanto, o formoterol é transferido ao leite de ratas lactantes68 após administração oral. O desenvolvimento e benefícios da amamentação69 devem ser considerados junto com a necessidade médica da mãe para o uso de formoterol e qualquer potencial efeito adverso na amamentação69 por conta de formoterol.
Dados em animais: Em um estudo de adoção cruzada em ratos, o racemato de formoterol (6 mg/kg/dia) foi administrado por via oral desde o dia 17 de gestação até o dia 21 de lactação49. Filhotes de mães tratadas com formoterol exibiram peso ao nascer significativamente reduzido, mas, quando amamentados por 14 dias por ratas controle, seus o pesos corporais tornaram se comparáveis aos dos controles. Quando os filhotes das ratas controle foram cruzados e amamentados pelas ratas tratadas com formoterol, observou-se uma diminuição no peso corporal evidente após 14 dias.
Homens e mulheres com potencial reprodutivo: Não existem recomendações especiais para mulheres com potencial reprodutivo.
Infertilidade70: Não existem dados sobre o efeito do formoterol na fertilidade humana. Não foi observado nenhum comprometimento na fertilidade com racemato de formoterol quando administrado oralmente com 60 mg/kg/dia (correspondendo a 10000 vezes o MRHID baseado em BSA) em estudos realizados em ratos machos e fêmeas. A administração oral de formoterol–(R,R)–enantiomero causou uma diminuição na taxa de gravidez48 a 15 mg/kg/dia (correspondendo a 2500 vezes o MRHID com base no BSA) e foi atribuído a insuficiência71 da fertilidade masculina.
Efeitos na habilidade de dirigir e operar máquinas
Pacientes que tiverem tontura72 ou efeitos adversos similares devem ser aconselhados a evitar dirigir ou utilizar máquinas.
Informações importantes sobre um dos componentes do medicamento
Este medicamento contém LACTOSE1. Este medicamento pode causar doping.
INTERAÇÕES MEDICAMENTOSAS
Fluir®, como outros beta2-agonistas, deve ser administrado com cautela em pacientes tratados com fármacos como quinidina, disopiramida, procainamida, fenotiazínicos, anti-histamínicos, macrolídeos, inibidores de monoaminoxidases e antidepressivos tricíclicos ou qualquer outro fármaco28 que prolongue o intervalo QTc, pois a ação dos agonistas adrenérgicos44 no sistema cardiovascular73 pode ser potencializada por estes agentes. Os fármacos que são conhecidos por prolongar o intervalo QTc tem um risco aumentado de arritmia74 ventricular (vide “Advertências e precauções”).
A administração concomitante de outros agentes simpatomiméticos pode potencializar os efeitos não desejados de Fluir®.
O tratamento concomitante com derivados xantínicos, esteroides ou diuréticos75 pode potencializar o possível efeito hipopotassêmico dos beta2-agonistas. A hipopotassemia60 pode aumentar a susceptibilidade61 a arritmias53 cardíacas em pacientes tratados com digitálicos (vide “Advertências e precauções”).
Existe um risco elevado de arritmias53 em pacientes recebendo anestesia76 concomitante com hidrocarbonetos halogenados.
Os bloqueadores beta-adrenérgicos44 podem diminuir ou antagonizar o efeito de Fluir®. Portanto, Fluir® não deve ser administrado juntamente com bloqueadores beta-adrenérgicos44 (inclusive colírios), a não ser que existam razões que obriguem seu uso.
CUIDADOS DE ARMAZENAMENTO DO MEDICAMENTO
Cuidados de conservação
Conservar em temperatura ambiente (entre 15 e 30°C). Prazo de validade: 18 meses.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original. Antes de usar, observe o aspecto do medicamento.
Características físicas e organolépticas do produto
Fluir® apresenta-se como cápsula dura transparente contendo pó branco, solto e livre de partículas estranhas.
Antes de usar, observe o aspecto do medicamento.
TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS.
POSOLOGIA E MODO DE USAR
Posologia
1) Adultos
– Asma3
Para tratamento de manutenção regular, inalação de 1 a 2 cápsulas dura (equivalente a 12 a 24 microgramas de formoterol), duas vezes ao dia. Fluir® deve ser prescrito apenas em adição a um corticosteroide inalatório.
A dose máxima de manutenção recomendada é 48 microgramas/dia.
Se necessário, 1 a 2 cápsulas dura, adicionalmente às requeridas para tratamento de manutenção, podem ser usadas por dia para o alívio de sintomas51 comuns desde que a máxima dose diária recomendada de 48 microgramas/dia não seja excedida. Entretanto, se a necessidade de dose adicional for mais do que ocasional (ex.: em mais de dois dias por semana), nova consulta médica deve ser feita e o tratamento reavaliado, já que isso pode indicar uma deterioração da condição subjacente. Fluir® não deve ser
utilizado para o alívio dos sintomas51 agudos da crise de asma3. No caso de uma crise de asma3, um beta2-agonista15 de curta duração deve ser utilizado (vide “Advertências e precauções”).
– Profilaxia contra o broncoespasmo4 induzido por exercício ou antes de exposição inevitável a um alérgeno12 conhecido
O conteúdo de uma cápsula dura para inalação (12 microgramas) deve ser inalado, com pelo menos 15 minutos de antecedência ao exercício ou exposição. Em pacientes com histórico de broncoespasmo4 grave, a inalação de 2 cápsulas dura (24 microgramas) pode ser necessária como profilaxia.
Em pacientes com asma3 persistente, o uso de Fluir® para prevenção de broncoespasmo4 induzido por exercícios, ou antes da exposição inevitável a um alérgeno12 conhecido, pode ser clinicamente indicado, no entanto, o tratamento para asma3 também deve incluir um Corticosteroide Inalatório (ICS).
– Doença Pulmonar Obstrutiva Crônica
Para tratamento de manutenção regular, inalação de 1 a 2 cápsulas dura (12 a 24 microgramas), duas vezes ao dia.
Populações especiais
- Insuficiência renal77: O formoterol não foi estudado em pacientes com insuficiência renal77 (vide “Farmacocinética”).
- Insuficiência hepática38: O formoterol não foi estudado em pacientes com insuficiência hepática38 (vide “Farmacocinética”).
2) Pacientes pediátricos (crianças com 5 anos ou mais):
– Asma3
Para tratamento de manutenção regular, inalação de uma cápsula dura (12 microgramas), duas vezes ao dia. Fluir® deve ser prescrito apenas em adição a um corticosteroide inalatório.
Para crianças de 5 a 12 anos, o tratamento combinado com um produto contendo um corticosteroide inalatório e um beta2-agonista15 de longa duração (LABA) é recomendado, exceto nos casos em que um Corticosteroide Inalatório e um beta2-agonista15 de longa duração (LABA) forem necessários separadamente (vide “Advertências e precauções”).
A dose máxima recomendada é de 24 microgramas/dia.
Fluir® não deve ser usado para alívio dos sintomas51 agudos de um ataque de asma3. No momento de um ataque agudo52, um beta2-agonista15 de curta duração deve ser usado (vide “Advertências e precauções”).
– Profilaxia contra o broncoespasmo4 induzido por exercício ou antes de exposição inevitável a um alérgeno12 conhecido
O conteúdo de uma cápsula dura para inalação (12 microgramas) deve ser inalado com pelo menos 15 minutos de antecedência ao exercício ou exposição.
Em pacientes com asma3 persistente, o uso de Fluir® para prevenção de broncoespasmo4 induzido por exercícios ou antes da exposição inevitável a um alérgeno12 conhecido, pode ser clinicamente indicado, no entanto, o tratamento para asma3 também deve incluir um Corticosteroide Inalatório (ICS).
Fluir® não é recomendado para crianças abaixo de 5 anos.
Adultos e crianças com 5 anos ou mais
O efeito broncodilatador11 de Fluir® permanece significativo por 12 horas após a inalação. Portanto, na maioria dos casos, o tratamento de manutenção, duas vezes ao dia controlará a broncoconstrição associada com as condições crônicas, tanto de noite como de dia.
Pacientes geriátricos (com 65 anos ou mais)
A farmacocinética do formoterol não foi estudada em populações idosas (vide “Farmacocinética”). Os dados disponíveis a partir dos estudos clínicos conduzidos em pacientes idosos não sugerem que a dosagem deva ser diferente dos outros adultos (vide “Resultados de eficácia”).
Método de administração
Para uso inalatório por via oral em adultos e em crianças 5 anos ou mais.
As cápsulas dura com pó para inalação de Fluir® devem apenas ser utilizadas com o inalador fornecido na embalagem de Fluir®.
Para garantir a administração apropriada do medicamento, o médico ou outro profissional de saúde2 deve:
- mostrar ao paciente como utilizar o inalador.
- utilizar a capsula dura somente com o inalador.
- instruir o paciente que as cápsulas duras são apenas para inalação e não devem ser engolidas (vide “Advertências e precauções”).
As instruções detalhadas do manuseio estão incluídas na bula presente na embalagem.
É importante que o paciente entenda que a cápsula gelatinosa pode se fragmentar e pequenos pedaços de gelatina podem alcançar a boca78 ou garganta79 após a inalação. A tendência de que isso ocorra é minimizada quando a cápsula não é perfurada mais do que uma vez. A cápsula feita de gelatina comestível não é prejudicial se ingerida.
As cápsulas duras devem ser removidas do blister apenas imediatamente antes da utilização.
Como usar as cápsulas duras com o inalador:
Atenção: as cápsulas duras não devem ser engolidas. Devem ser usadas exclusivamente para inalação. As instruções para aprender a utilizar as cápsulas dura de Fluir® com o inalador devem ser seguidas.
Fluir® é utilizado no tratamento de doenças respiratórias; portanto, sua administração incorreta não produzirá o efeito desejado.
Siga as instruções para aprender a utilizar as cápsulas dura de Fluir® com o inalador.
Use as cápsulas de Fluir® apenas com o inalador fornecido na embalagem. Ele foi desenvolvido especialmente para o uso das cápsulas dura de Fluir®.
Remova as cápsulas dura do blister apenas imediatamente antes de seu uso. Certifique-se que seus dedos estejam completamente secos para não molhar a cápsula dura.
Não engula a cápsula dura. O pó dentro da cápsula dura é para inalação apenas. Para usar o inalador, proceda do seguinte modo:
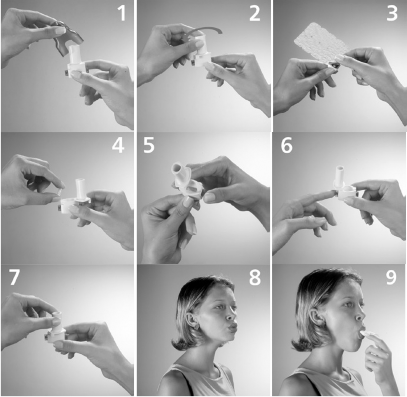
- Retire a tampa.
- Segure firmemente a base do inalador e, para abrir, gire o bocal na direção indicada pela seta.
- Remova a cápsula dura do blister, levantando e puxando a aba de alumínio. É importante que a cápsula somente seja retirada do blister imediatamente antes do uso.
- Coloque a cápsula no compartimento adequado, na base do inalador.
- Mantenha o inalador em posição vertical, pressione os botões laterais completamente, uma só vez, acompanhando visualmente a perfuração das duas extremidades da cápsula dura.
- Solte os botões e, em seguida, pressione levemente um deles, empurrando um dos lados da cápsula para certificar-se de que ela se encontra solta no fundo do compartimento. Soltar a cápsula dura é uma operação que garante a eficácia da aspiração, pois durante a perfuração a cápsula dura pode ficar presa no fundo do compartimento.
- Gire o bocal de volta para a posição fechada.
- Solte o ar dos pulmões80 o máximo possível.
- Coloque aproximadamente 2/3 do bocal do inalador na boca78 e feche os lábios ao redor dele. Inspire de maneira rápida e o mais profundamente possível. Você deverá ouvir um som de vibração, como se a cápsula dura girasse na câmara do inalador com a dispersão do produto.
- Quando ouvir o som de vibração, segure a respiração pelo maior tempo que você confortavelmente conseguir (aproximadamente 10 segundos); enquanto isso, retire o inalador da boca78. Em seguida, respire normalmente. Abra o inalador e verifique se ainda há resíduo de pó na cápsula dura. Se ainda restar pó na cápsula dura, repita os passos de 5 a 9.
- Após o uso, abra o inalador e remova a cápsula dura vazia. A cápsula dura poderá ter-se partido em pequenos fragmentos81 e estes fragmentos81 de gelatina poderão ter atingido sua boca78 ou garganta79. A gelatina é comestível e, portanto, não é prejudicial. Da mesma forma, fragmentos81 de gelatina podem permanecer no fundo do compartimento e estes resíduos deverão ser removidos com o auxílio de uma escovinha ou pincel macio. Feche o bocal e recoloque a tampa.
Limpeza do inalador. Para melhor conservação do inalador, utilizar escova ou pincel macio, removendo resíduos após cada uso. Após a última inalação do dia, limpe o bocal e o compartimento da cápsula com uma haste flexível de algodão, podendo ocasionalmente umedecê-la em solução antisséptica (como, por exemplo, água oxigenada 10 volumes). Não utilize álcool, pois poderá danificar a superfície plástica. Não utilize água para limpar o inalador. Seguindo estes cuidados de conservação e posologia, a vida útil estimada de seu inalador será de 3 meses.
Este medicamento não deve ser partido, aberto ou mastigado.
REAÇÕES ADVERSAS
Exacerbações graves de asma3
Estudos clínicos controlados com placebo9, com duração de pelo menos 4 semanas de tratamento com fumarato de formoterol di-hidratado, sugerem uma maior incidência39 de exacerbações graves de asma3 em pacientes que receberam fumarato de formoterol di-hidratado (0,9% para 10 a 12 microgramas, duas vezes ao dia; 1,9% para 24 microgramas, duas vezes ao dia) quando comparados com aqueles que receberam placebo9 (0,3%), particularmente nos pacientes entre 5 e 12 anos.
Experiência em pacientes adolescentes e adultos com asma3
Em dois estudos pivotais controlados de 12 semanas conduzidos para o registro nos EUA com 1.095 pacientes a idade a partir de 12 anos ou mais, as exacerbações graves de asma3 (piora aguda da asma3 resultando em hospitalização) ocorreram mais comumente com fumarato de formoterol di-hidratado 24 microgramas, duas vezes ao dia (9/271; 3,3%) quando comparado com fumarato de formoterol di-hidratado 12 microgramas, duas vezes ao dia (1/275; 0,4%), placebo9 (2/277; 0,7%) ou albuterol (2/272; 0,7%).
Um estudo clínico subsequente para abordar esta observação com 2.085 pacientes foi realizado para comparar os eventos adversos graves relacionados à asma3 em grupos com doses mais altas e mais baixas de formoterol. Os resultados deste estudo de 16 semanas não demonstraram uma aparente relação de dose para o fumarato de formoterol di-hidratado. A porcentagem de pacientes com exacerbações graves de asma3 nesse estudo foi um pouco maior com fumarato de formoterol di-hidratado que com placebo9. Para os três grupos de tratamento duplo-cego: fumarato de formoterol di-hidratado 24 microgramas, duas vezes ao dia (2/527; 0,4%); fumarato de formoterol di-hidratado 12 microgramas, duas vezes ao dia (3/527; 0,6%) e placebo9 (1/514; 0,2%), e para o grupo de tratamento aberto: fumarato de formoterol di-hidratado 12 microgramas, duas vezes ao dia, com até duas doses adicionais por dia (1/517; 0,2%).
Experiência em crianças de 5 a 12 anos com asma3
A segurança de fumarato de formoterol di-hidratado 12 microgramas, duas vezes ao dia, comparado a do fumarato de formoterol di-hidratado 24 microgramas, duas vezes ao dia, e placebo9 foi investigada em um grande estudo clínico multicêntrico, randomizado13, duplo-cego de 52 semanas, com 518 crianças com asma3 (de 5 a 12 anos) que necessitavam de tratamento diário com broncodilatador11 e anti-inflamatório.
Um maior número de crianças que receberam fumarato de formoterol di-hidratado 24 microgramas, duas vezes ao dia (11/171; 6,4%) ou fumarato de formoterol di-hidratado 12 microgramas, duas vezes ao dia (8/171; 4,7%) apresentaram exacerbações graves da asma3 quando comparados com placebo9 (0/176; 0,0%).
Para recomendações do tratamento, vide “Posologia e modo de usar” e “Advertências e precauções”.
Tabela resumo das reações adversas ao medicamento
As reações adversas estão listadas de acordo com o sistema de classes de órgão do MedDRA. Dentro de cada sistema de classes de órgãos, as reações adversas são listadas pela frequência, com as reações mais frequentes primeiro. Dentro de cada grupo de frequência, as reações adversas são apresentadas em ordem decrescente de gravidade. Adicionalmente, a categoria de frequência correspondente para cada reação adversa ao medicamento é baseada na seguinte convenção (CIOMS III): muito comum (?1/10); comum (?1/100 a <1/10); incomum (?1/1.000 a <1/100); rara (?1/10.000 a <1/1.000), muito rara (< 1/10.000), incluindo relatos isolados.
Reações adversas provenientes de ensaios clínicos8 e outras fontes
Distúrbios do sistema imune82
- Muito raros: Hipersensibilidade (incluindo hipotensão83, urticária84, angioedema85, prurido86, erupção87 cutânea88)
Distúrbios psiquiátricos
- Incomuns: Agitação, ansiedade, nervosismo, insônia
Distúrbios do sistema nervoso89
- Comuns: Dor de cabeça90, tremor
- Incomum: Tontura72
- Muito raro: Disgeusia91
Distúrbios cardíacos
- Comum: Palpitações92
- Incomum: Taquicardia93
- Muito raro: Edema20 periférico
Distúrbios respiratórios, torácicos e mediastinais
- Incomuns: Broncoespasmo4, incluindo broncoespasmo4 paradoxal63, irritação da garganta79
Distúrbios gastrintestinais
- Incomuns: Boca78 seca
- Muito raro: Náusea94
Distúrbios musculoesqueléticos e do tecido conjuntivo95
- Incomuns: Espasmos96 musculares, mialgia97
Reações adversas da experiência de relatos espontâneos de pós-comercialização (frequência desconhecida)
As seguintes reações adversas ao medicamento foram derivadas da experiência de pós-comercialização em pacientes tratados com fumarato de formoterol di-hidratado. Uma vez que estas reações foram relatadas voluntariamente por uma população de tamanho incerto, não é possível estimar confiavelmente suas frequências que são, portanto, categorizadas como desconhecidas.
As reações adversas estão listadas de acordo com o sistema de classe de órgãos em MedDRA. Dentro de cada sistema de classe de órgão, as reações adversas estão listadas na tabela abaixo (Tabela 2), em ordem decrescente de gravidade:
Tabela 2 - Reações adversas provenientes de relatos espontâneos e da literatura (frequência desconhecida):
Distúrbios do metabolismo34 e nutrição98
- Hipopotassemia60, hiperglicemia99
Distúrbios cardíacos
- Angina100 pectoris, arritmias53 cardíacas (ex.: fibrilação atrial, extrassístole ventricular, taquiarritmia101)
Distúrbios respiratórios, torácicos e mediastinais
- Tosse
Distúrbios da pele102 e tecidos subcutâneos
- Erupção87 cutânea88
Laboratoriais
- Intervalo QT prolongado no eletrocardiograma103, pressão arterial104 aumentada (incluindo hipertensão56)
Em casos de eventos adversos, notifique pelo Sistema VigiMed, disponível no Portal da Anvisa.
SUPERDOSE
Sintomas51 - a superdose com Fluir® provavelmente conduzirá aos efeitos típicos de estimulantes beta2-adrenérgicos44, a saber: náusea94, vômitos105, cefaleia106, tremor, sonolência, palpitações92, taquicardia93, arritmia74 ventricular, acidose metabólica107, hipopotassemia60, hiperglicemia99 e hipertensão56.
Tratamento - são indicados tratamentos sintomáticos e de suporte. Em casos graves, os pacientes devem ser hospitalizados.
Deve ser avaliado o uso de betabloqueador cardiosseletivo, mas apenas sob a supervisão de um médico e com extremo cuidado, já que o uso de medicação bloqueadora beta-adrenérgica pode provocar broncoespasmo4.
Em caso de intoxicação ligue para 0800 722 6001, se você precisar de mais orientações.
DIZERES LEGAIS
VENDA SOB PRESCRIÇÃO MÉDICA
Reg. M.S. nº 1.7817.0791
Farm. Resp.: Luciana Lopes da Costa - CRF-GO nº 2.757
Registrado por:
Cosmed Indústria de Cosméticos e Medicamentos S.A.
Rua Bonnard (Green Valley I) nº 980, Bloco 12, Nível 3, Sala A - Alphaville Empresarial – Barueri - SP - CEP 06465-134 - C.N.P.J.: 61.082.426/0002-07
Indústria Brasileira
Fabricado por:
Brainfarma Indústria Química e Farmacêutica S.A.
VPR 1 - Quadra 2-A - Módulo 4 - DAIA - Anápolis – GO - CEP 75132-020
SAC 0800 97 99 900
DIZERES LEGAIS:
VENDA SOB PRESCRIÇÃO MÉDICA
Reg. M.S. nº 1.7817.0791
Farm. Resp.: Luciana Lopes da Costa - CRF-GO nº 2.757
Registrado por:
Cosmed Indústria de Cosméticos e Medicamentos S.A.
Rua Bonnard (Green Valley I) nº 980, Bloco 12, Nível 3, Sala A - Alphaville Empresarial
Barueri - SP - CEP 06465-134 - C.N.P.J.: 61.082.426/0002-07
Indústria Brasileira
Fabricado por:
Brainfarma Indústria Química e Farmacêutica S.A.
VPR 1 - Quadra 2-A - Módulo 4 - DAIA - Anápolis - GO - CEP 75132-020
SAC 0800 97 99 900



