Bonviva (Informações aos profissionais de saúde)
ROCHE
Bonviva® (Informações aos profissionais de saúde1)
Roche
Ibandronato de sódio
Drogas para tratamento de doenças ósseas
Identificação da Bonviva
Nome do produto: Bonviva®Nome genérico: ibandronato de sódio
Apresentações da Bonviva
Comprimidos revestidos de 150 mg. Caixa com 1 comprimido.
VIA ORAL (Bonviva® comprimidos)
Composição da Bonviva
Cada comprimido contém:Princípio ativo: ibandronato de sódio monoidratado ......................................... 168,75 mg (equivalente a 150 mg de ácido ibandrônico)
Excipientes: lactose2 monoidratada, povidona, celulose microcristalina, crospovidona, ácido esteárico purificado, sílica coloidal anidra. Revestimento: hipromelose, dióxido de titânio, talco, macrogol 6.000.
Informações Técnicas Aos Profissionais de Saúde1 da Bonviva
1. INDICAÇÕES
Bonviva®, 150 mg, é indicado para o tratamento da osteoporose3 pós-menopausa4, com a finalidade de reduzir o risco de fraturas vertebrais.
Em um subgrupo de pacientes de risco, com escore T < -3,0 DP no colo do fêmur5, Bonviva® também demonstrou reduzir o risco de fraturas não vertebrais.
Tratamento da osteoporose3: a osteoporose3 pode ser confirmada pelo achado de baixo índice de massa óssea (escore T < -2,0 DP) e pela presença de histórico de fratura6 osteoporótica ou de baixo índice de massa óssea (escore T < -2,5 DP) na ausência de fratura6 osteoporótica pré-existente documentada.
2. RESULTADOS DE EFICÁCIA
Tratamento da osteoporose3 na pós-menopausa4
Bonviva®, 2,5 mg, administrado diariamente
Em um estudo preliminar sobre fraturas, com duração de três anos, randomizado7, duplo-cego, controlado com placebo8, demonstrou-se diminuição estatisticamente significativa e clinicamente relevante na incidência9 de novas fraturas vertebrais radiográficas morfométricas e clínicas. Bonviva® foi avaliado em doses de 2,5 mg administradas diariamente e de 20 mg administradas de forma intermitente10 (20 mg em dias alternados, perfazendo um total de 12 doses no início de cada ciclo de três meses, seguido por um intervalo sem medicamento de nove a dez semanas). Bonviva® foi administrado uma hora antes da ingestão do primeiro alimento ou líquido do dia (período de jejum pós-dose). O estudo recrutou 2.946 mulheres com idade entre 55 e 80 anos (2.928 foram elegíveis para a avaliação de eficácia), que estavam há, pelo menos, cinco anos na menopausa4, apresentavam densidade mineral óssea na coluna vertebral11 lombar de 2 a 5 DP (desvios-padrão) abaixo da média da pré-menopausa4 (escore T) em pelo menos uma vértebra [L1 – L4] e que apresentavam de uma a quatro fraturas vertebrais prevalentes. Todas as pacientes receberam 500 mg de cálcio e 400 UI de vitamina12 D diariamente. Bonviva® proporcionou redução estatística e clinicamente significativa na incidência9 de novas fraturas vertebrais com ambos os esquemas terapêuticos testados. O esquema de 2,5 mg diariamente reduziu a ocorrência de novas fraturas vertebrais comprovadas radiologicamente em 62% ao longo dos três anos de duração do estudo. As fraturas vertebrais diagnosticadas clinicamente também foram reduzidas em 49%. Além disso, o efeito pronunciado sobre as fraturas vertebrais também foi acompanhado por uma redução estatisticamente significativa na perda da altura (decorrente do achatamento13 de vértebras por fraturas vertebrais), em comparação com o placebo8.
O efeito contra fraturas foi consistente durante o período de três anos de duração do estudo. Não houve nenhuma indicação de declínio do efeito no decorrer do tempo.
Embora o estudo clínico sobre fraturas do ibandronato de sódio não tenha sido especificamente desenhado para demonstrar eficácia antifratura nos casos de fraturas não vertebrais, observou-se redução relativa no risco, de magnitude semelhante (69%) à das fraturas vertebrais, para fraturas não vertebrais em um grupo de pacientes com risco elevado para fraturas (densidade mineral óssea no colo14 de fêmur15 - escore T < -3,0 DP). A observação de eficácia em fraturas não vertebrais em subgrupos de alto risco é consistente com os achados de estudos clínicos de outros bisfosfonatos. Não foram conduzidos estudos especificamente desenhados para avaliar redução de risco de fraturas de fêmur15.
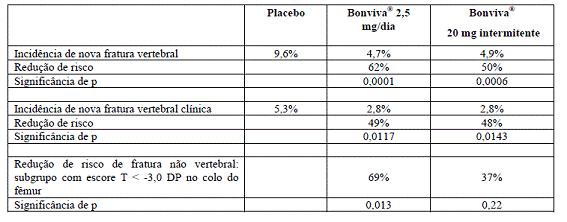
Portanto, esse estudo demonstrou a eficácia antifratura vertebral dos esquemas diários e intermitentes16 do ibandronato e a eficácia antifratura não vertebral do ibandronato 2,5 mg administrado diariamente em um subgrupo de pacientes de risco, isto é, que apresentavam escore T < -3,0 DP no colo do fêmur5.
O aumento na densidade mineral óssea da coluna vertebral11 lombar, em três anos, comparado ao placebo8, foi de 5,3% para o esquema de dose diária. Em comparação com os valores iniciais, esse aumento foi de 6,5%.
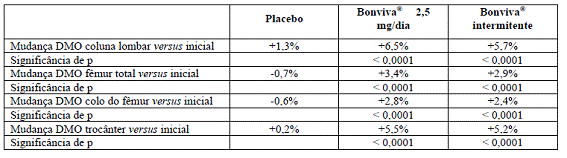
Os marcadores bioquímicos de remodelação óssea (tais como CTX urinário e osteocalcina sérica) apresentaram o padrão esperado de supressão para os níveis da pré-menopausa4 e atingiram a supressão máxima dentro de um período de três a seis meses. Observou-se redução clinicamente significativa de 50% a 78% nos marcadores de reabsorção óssea já em um mês após o início do tratamento com Bonviva® 2,5 mg, diariamente, e 20 mg, intermitentemente, respectivamente. Diminuições nos marcadores bioquímicos de reabsorção óssea foram evidenciadas sete dias após início do tratamento.
NNT: no estudo MF 4411 (BONE), o NNT é 21 pacientes, comparável ao do risedronato (VERT-NA, conduzido na América do Norte).
Bonviva® 150 mg, uma vez por mês – dose única mensal
Densidade mineral óssea (DMO)
A administração de Bonviva®, 150 mg, uma vez por mês, demonstrou ser, pelo menos, tão eficaz quanto a administração de Bonviva®, 2,5 mg, diariamente, no aumento da densidade mineral óssea (DMO) em um estudo multicêntrico, duplo-cego, de dois anos (BM 16549) em mulheres na pós-menopausa4 e com osteoporose3 (densidade mineral óssea na coluna vertebral11 lombar inferior a -2,5 DP na avaliação inicial). Isso foi demonstrado tanto na análise primária do primeiro ano quanto na análise confirmatória do objetivo no segundo ano (Tabela 1).
Tabela 1: Variação média em relação à DMO inicial da coluna lombar, quadril total, colo femoral17 e trocânter18 após um ano (análise primária) e dois anos de tratamento (população per-protocol) no estudo BM 16549.
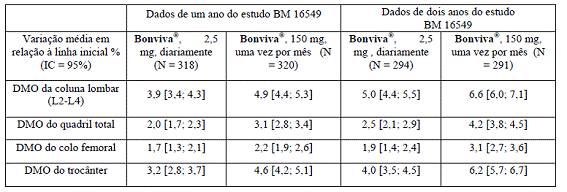
Além disso, Bonviva®, 150 mg, uma vez por mês, demonstrou ser superior a Bonviva®, 2,5 mg, diariamente, por aumentar a densidade mineral óssea da coluna lombar em análise prospectivamente planejada em um ano, p = 0,002, e em dois anos, p < 0,001.
Ao fim de um ano (análise primária), 91,3% (p = 0,005) dos pacientes tratados com Bonviva®,150 mg, uma vez por mês, tiveram um aumento na DMO da coluna lombar superior ou igual à linha inicial (respondedores em relação à DMO), em comparação com 84% dos pacientes que receberam Bonviva®, 2,5 mg, diariamente. Aos dois anos, 93,5% (p = 0,004) dos pacientes que receberam Bonviva®, 150 mg, uma vez por mês, e 86,4% dos pacientes que receberam Bonviva®, 2,5 mg, diariamente, responderam ao tratamento.
Para a densidade mineral óssea do quadril total, 90,0% (p < 0,001) dos pacientes tratados com Bonviva®, 150 mg, uma vez por mês, e 76,7% dos pacientes que receberam Bonviva®, 2,5 mg, diariamente, tiveram aumentos na densidade mineral óssea do quadril total superior ou igual ao valor inicial, ao fim de um ano. Aos dois anos, 93,4% (p < 0,001) dos pacientes tratados com Bonviva®, 150 mg, uma vez por mês, e 78,4%, dos pacientes que receberam Bonviva®, 2,5 mg, diariamente, tiveram aumentos na densidade mineral óssea do quadril total superior ou igual ao valor inicial.
Quando um critério mais rigoroso é considerado, que combina tanto a densidade mineral óssea da coluna lombar como do quadril total, 83,9% (p < 0,001) dos pacientes que receberam Bonviva®, 150 mg, uma vez por mês, e 65,7% dos pacientes que receberam Bonviva®, 2,5 mg, diariamente, responderam ao tratamento em um ano. Aos dois anos, 87,1% (p < 0,001) e 70,5% dos pacientes atingiram esse critério no tratamento com 150 mg mensais e 2,5 mg diariamente, respectivamente.
Marcadores bioquímicos da remodelação óssea
Foram observadas reduções clinicamente significativas nos níveis do CTX sérico em todos os períodos de avaliação, isto é, 3, 6, 12 e 24 meses. Após um ano (análise primária), a variação média relativa do valor inicial foi de -76% para Bonviva®, 150 mg, uma vez por mês, e de -67% para Bonviva®, 2,5 mg, diariamente. Aos dois anos, a variação média relativa foi de -68% e -62%, nos 150 mg mensais e 2,5 mg diariamente, respectivamente.
Ao fim de um ano, 83,5% (p = 0,006) dos pacientes tratados com Bonviva®, 150 mg, uma vez por mês, e 73,9% dos pacientes que receberam Bonviva®, 2,5 mg, diariamente, foram identificados como respondedores (definido como uma diminuição de ≥ 50% do valor inicial). Aos dois anos, 78,7% (p = 0,002) e 65,6% dos pacientes foram identificados como respondedores aos 150 mg mensais e 2,5 mg diariamente, respectivamente.
Com base nos resultados do estudo BM 16549, espera-se que Bonviva®, 150 mg, uma vez por mês, seja tão eficaz quanto Bonviva®, 2,5 mg, diariamente, na prevenção de fraturas.
Implicações de doses esquecidas na eficácia (isto é, supressão de marcadores ósseos) foram exploradas usando-se um modelo farmacodinâmico de CTX urinário criado com os dados clínicos de 850 pacientes que receberam ibandronato de sódio nos estudos MF 9853, MF 4361 e MF 4411. As simulações com base no modelo mostram que se uma dose mensal única for esquecida, um pequeno aumento na área sob a curva de concentração versus tempo (ASC) do CTX urinário (correspondente a uma pequena redução na supressão percentual em relação ao valor inicial) poderá ocorrer (aumento de ~3,5% na ASC, quando comparada à ingestão correta do medicamento em 15 meses), com os perfis de CTX urinário se refazendo em seis meses. Se a dose for tomada com atraso, por exemplo, sete semanas após a última dose programada, ocorrerá um pequeno aumento transitório previsto de ~0,7%, com os perfis de CTX urinário se refazendo dentro de três meses.
Dessa forma, com base na modelagem matemática de um marcador de remodelação óssea (CTX urinário), não há preocupação de que uma dose atrasada em até três semanas ou mesmo uma dose perdida venha a comprometer a eficácia do produto.
Prevenção da osteoporose3 na pós-menopausa4
Bonviva®, 2,5 mg, diariamente
A prevenção da perda óssea foi demonstrada em um estudo duplo-cego19, controlado com placebo8, com duração de dois anos, considerando-se a alteração na densidade mineral óssea lombar como critério de avaliação de resultado principal (Estudo MF 4499). Esse estudo comparou a administração diária de três doses diferentes de ibandronato de sódio (0,5 mg; 1,0 mg e 2,5 mg) com placebo8. Um suplemento de 500 mg de cálcio por dia foi fornecido para cada paciente. O estudo recrutou 653 mulheres na pós-menopausa4, sem osteoporose3 (648 foram elegíveis para avaliação de eficácia), estratificadas de acordo com o tempo de início da menopausa4 (1 – 3 anos e > 3 anos) e de acordo com a densidade mineral óssea da coluna vertebral11 lombar (escore T > -1, -1 a - 2,5).
A administração de Bonviva®, 2,5 mg, diariamente resultou em aumento médio na densidade mineral óssea de 3,1%, em comparação com o placebo8, e de 1,9% em relação ao valor ao início do estudo. No grupo tratado com placebo8, ocorreu diminuição na densidade mineral óssea de, aproximadamente, 1% na coluna vertebral11 lombar ao final de dois anos, confirmando a conhecida perda óssea acelerada logo após a menopausa4. Independentemente do tempo de início da menopausa4 ou do grau de perda óssea pré-existente, o tratamento com Bonviva® resultou em resposta sobre a densidade mineral óssea lombar estatisticamente maior que a encontrada com o grupo placebo8 nos quatro grupos de estratificação. Setenta por cento das pacientes que receberam Bonviva® responderam ao tratamento, tendo sido a resposta definida como aumento da densidade mineral óssea lombar em relação ao inicial.
O tratamento com Bonviva® também resultou em aumento significativo na densidade mineral óssea do quadril total em 1,8%, em comparação com o grupo tratado com placebo8 (alteração média em relação ao inicial de 1,2%).
Observou-se redução clinicamente significativa nos marcadores bioquímicos de reabsorção óssea (CTX urinário) já em um mês após o início do tratamento.
Referências bibliográficas
1. Rogers MJ et al. Cellular and molecular mechanisms of action of bisphosphonates. Cancer20 2000; 88: 2961-78.
2. Ravn P et al. The effect on bone mass and bone markers of different doses of ibandronate: a new bisphosphonate for prevention and treatment of postmenopausal osteoporosis: A 1-year, randomized, double-blind, placebocontrolled dose-finding study. Bone 1996; 19: 527-533.
3. Chestnut CH et al. Effects of oral ibandronate administered daily or intermittently on fracture risk in postmenopausal osteoporosis. J Bone Miner Res 2004; 19: 1241–1249.
4. Dooley M et al. Ibandronate. Drugs 1999; 57(1): 101-108.
5. Adami S et al. Ibandronate: new options in the treatment of osteoporosis. Drugs of Today 2003; 39(11): 877-886.
6. Papapoulos SE. Ibandronate: a potent new bisphosphonate in the management of postmenopausal osteoporosis. Int J Clin Pract 2003; 57(5): 417-22.
7. Tankó LB et al. Oral ibandronate: changes in markers of bone turnover during adequately dosed continuous and weekly therapy and during different suboptimally dosed treatment regimens. Bone 32 (2003) 687–693.
8. Chapurlat RD et al. Review of ibandronate in the treatment of osteoporosis. Expert Opin Pharmacother 2003; 4(3): 391-396.
9. Schimmer RC et al. Effect of daily and intermittent use of ibandronate on bone mass and bone turnover in postmenopausal osteoporosis: a review of three phase II studies. Clin Ther 2003; 25(1): 19-34.
10. Miller P, et al. Monthly oral ibandronate therapy in postmenopausal osteoporosis: 1-year results from the MOBILE Study. Journal of Bone and Mineral Research 2005; 20(8): 1315-22.
3. CARACTERÍSTICAS FARMACOLÓGICAS
Farmacodinâmica
A ação farmacodinâmica do ibandronato de sódio é a inibição da reabsorção óssea. In vivo, o ibandronato de sódio impede a destruição óssea induzida experimentalmente causada pelo término da função gonadal, por retinoides e por tumores ou extratos de tumores. Em ratos jovens tratados (fase de crescimento rápido), a reabsorção óssea endógena também é inibida, levando ao aumento da massa óssea, em comparação aos animais não tratados.
Os modelos em animais confirmam que o ibandronato de sódio é um inibidor altamente potente da atividade osteoclástica. Em ratos em fase de crescimento, não se evidenciou alteração da mineralização óssea, mesmo com doses acima de 5.000 vezes a dose requerida para o tratamento da osteoporose3.
A potência elevada e a margem terapêutica21 do ibandronato de sódio permitem esquemas posológicos mais flexíveis e tratamento intermitente10, com longos intervalos sem medicamento, e em doses comparativamente baixas.
Em ratos, cães e macacos, tanto a administração diária quanto a intermitente10 (com longos intervalos sem medicamento) associaram-se à formação de tecido ósseo22 de qualidade normal e / ou com resistência mecânica aumentada, mesmo com doses além das farmacologicamente preconizadas, incluindo a variação de dose tóxica. Em humanos, a eficácia do ibandronato de sódio, tanto em administração diária quanto intermitente10, com intervalos livre de medicamento de nove a dez semanas, foi confirmada em estudo clínico, no qual se demonstrou que Bonviva® apresenta eficácia contra fraturas.
Em mulheres na pós-menopausa4, doses orais de Bonviva®, tanto em administração diária quanto intermitente10 com intervalos livre de medicamento de nove a dez semanas por trimestre, produziram alterações bioquímicas indicativas de inibição da reabsorção óssea dependente da dose, incluindo a supressão de marcadores bioquímicos urinários de degradação do colágeno23 do osso (tais como deoxipiridinolina e telopeptídeos C e N do colágeno23 tipo I).
Após descontinuação do tratamento, observa-se reversão dos marcadores ósseos, de volta aos índices patológicos pré-tratamento de reabsorção óssea elevada, associada à osteoporose3 pós-menopausa4.
Análise histológica24 de biópsia25 óssea após dois e três anos de tratamento de mulheres na pós-menopausa4 mostrou tecido ósseo22 de qualidade normal e ausência de sinais26 de defeito da mineralização.
Em um estudo de bioequivalência de Fase I, realizado em 72 mulheres na pós-menopausa4 e que receberam 150 mg de ibandronato de sódio por via oral a cada 28 dias, perfazendo um total de quatro doses, observou-se inibição do CTX sérico após a primeira dose, já nas 24 horas após a administração da dose (inibição média de 28%), observando-se inibição média máxima (69%) seis dias depois. Após a terceira e a quarta dose, a inibição média máxima seis dias depois da administração foi de 74%, reduzindo-se para 56% 28 dias após a quarta dose. Na ausência de doses subsequentes, houve perda da supressão dos marcadores bioquímicos de reabsorção óssea.
Mecanismo de ação
O ibandronato de sódio é um bisfosfonato de terceira geração altamente potente, pertencente ao grupo dos bisfosfonatos nitrogenados, que age sobre o tecido ósseo22 e inibe especificamente a atividade do osteoclasto27, não interferindo com o recrutamento de osteoclastos28. A ação seletiva do ibandronato de sódio sobre o tecido ósseo22 baseia-se na alta afinidade desse composto para a hidroxiapatita que representa a matriz mineral do osso.
O ibandronato de sódio reduz a reabsorção óssea sem afetar diretamente a formação óssea. Em mulheres na pós-menopausa4, reduz o índice elevado de remodelação óssea para níveis próximos aos níveis da pré-menopausa4, levando a um ganho progressivo de massa óssea.
A administração diária ou intermitente10 do ibandronato de sódio resulta em redução da reabsorção óssea, refletida por níveis reduzidos de marcadores bioquímicos urinários e séricos de remodelação óssea, no aumento da densidade mineral óssea e na redução do risco de fraturas associado à osteoporose3 pós-menopausa4.
Farmacocinética
Os efeitos farmacológicos do ibandronato de sódio não estão diretamente relacionados às concentrações plasmáticas efetivas. Isso foi demonstrado por vários estudos, em animais e em humanos, nos quais a eficácia do ibandronato de sódio foi demonstrada tanto após esquemas de administração diária quanto intermitentes16, inclusive com intervalo de várias semanas sem medicamento (pelo menos seis semanas em ratos, 11 semanas em cães, 30 dias em macacos e, pelo menos, 9,5 semanas em humanos), desde que a mesma dose total fosse administrada durante esse período.
Absorção
A absorção do ibandronato de sódio pelo trato gastrintestinal superior29 é rápida após administração oral, e as concentrações plasmáticas aumentam de modo proporcional à dose até a dose de 50 mg por via oral. Com doses superiores a 50 mg, observam-se aumentos acima da proporcionalidade da dose. As concentrações plasmáticas máximas são atingidas dentro de 0,5 a duas horas (média de uma hora) em jejum, e a biodisponibilidade absoluta é de, aproximadamente, 0,6%. A absorção é prejudicada quando Bonviva® é administrado juntamente com alimentos ou bebidas que não sejam água pura. A biodisponibilidade é reduzida em cerca de 90% quando Bonviva® é administrado juntamente com uma refeição matinal padrão, em comparação com a biodisponibilidade observada em indivíduos que ingerem o medicamento em jejum. Não ocorre redução significativa na biodisponibilidade se Bonviva® for administrado uma hora antes da refeição. A biodisponibilidade e, consequentemente, o ganho de densidade mineral óssea são reduzidos quando alimentos ou bebidas são ingeridos menos de uma hora após a administração de Bonviva®.
Distribuição
Após a exposição sistêmica inicial, o ibandronato de sódio se liga rapidamente ao tecido ósseo22 ou é excretado pela urina30. Em humanos, o volume de distribuição aparente terminal é de, pelo menos, 90 litros, e estima-se que a quantidade da dose que chega ao osso seja em torno de 40% a 50% da dose circulante. A ligação proteica em humanos é baixa (aproximadamente 85% de ligação com concentrações terapêuticas); portanto, o potencial para interações medicamentosas devidas a deslocamentos é baixo.
Metabolismo31
Não há evidências de que o ibandronato de sódio seja metabolizado em animais ou em humanos.
Eliminação
A fração absorvida de ibandronato de sódio é retirada da circulação32 através de sequestro ósseo (40% a 50%), e o restante é eliminado sob forma inalterada pelos rins33. A fração não absorvida é eliminada inalterada pelas fezes.
A variação observada na meia-vida é ampla e dependente da dose e da sensibilidade do método de determinação, mas a meia-vida terminal geralmente encontra-se entre 10 – 72 horas. As concentrações plasmáticas iniciais caem rapidamente, atingindo 10% dos valores de pico dentro de três e oito horas após administração oral e intravenosa, respectivamente. A depuração total do ibandronato de sódio é baixa, com valores médios entre 84 e 160 mL/min. A depuração renal34 (cerca de 60 mL/min em mulheres sadias na pós-menopausa4) representa 50% -60% da depuração total e está relacionada com a depuração de creatinina35. Considera-se que a diferença entre a depuração aparente total e a depuração renal34 reflita a captação pelo osso.
Farmacocinética em populações especiais
Sexo: a biodisponibilidade e farmacocinética do ibandronato de sódio em homens e mulheres é semelhante.
Raça: não há evidências de diferenças interétnicas clinicamente relevantes ou entre a distribuição do ibandronato de sódio em indivíduos da raça amarela e branca; contudo, os dados em indivíduos da raça negra são escassos.
Pacientes com insuficiência renal36: a depuração do ibandronato de sódio em pacientes com vários graus de insuficiência renal36 se relaciona linearmente com a depuração de creatinina35.
Não há necessidade de ajuste de dose para pacientes37 com insuficiência renal36 leve a moderada (depuração de creatinina35 ≥ 30 mL/min), conforme demonstrado em estudo no qual a maioria dos pacientes se enquadrava nessas categorias (Estudo BM 16549).
Indivíduos com insuficiência renal36 grave (depuração de creatinina35 < 30 mL/min) em uso de ibandronato de sódio 10 mg por via oral diariamente, durante 21 dias, apresentaram concentrações plasmáticas duas a três vezes maiores que em indivíduos com função renal34 normal (depuração total = 129 mL/min). A depuração total do ibandronato de sódio foi reduzida para 44 mL/min nos indivíduos com disfunção renal34 grave. Após administração intravenosa de 0,5 mg, as depurações total, renal34 e não renal34 diminuíram em 67%, 77% e 50%, respectivamente, em indivíduos com disfunção renal34 grave. Entretanto, não houve redução da tolerabilidade associada com o aumento da exposição ao ibandronato de sódio.
Pacientes com insuficiência hepática38: não se dispõe de dados sobre o uso de ibandronato de sódio em pacientes com disfunção hepática39. O fígado40 não possui um papel importante na depuração do ibandronato de sódio, que não é metabolizado, eliminado apenas por excreção renal34 e por captação óssea. Portanto, não são necessários ajustes de dose em pacientes com disfunção hepática39. Além disso, como a ligação proteica do ibandronato de sódio é baixa (85%) nas concentrações terapêuticas, é improvável que a hipoproteinemia das hepatopatias graves leve a aumentos clinicamente significativos na concentração de substância livre no plasma41.
Pacientes idosos: em uma análise multivariada, a idade não foi um fator independente para nenhum dos parâmetros farmacocinéticos estudados. Como a função renal34 diminui com a idade, esse é o único fator a ser levado em consideração (vide itens “Pacientes com insuficiência renal36 e Advertências”).
Pacientes pediátricos: não há dados sobre o uso de Bonviva® em pacientes com menos de 18 anos.
Segurança pré-clínica
Os efeitos tóxicos em animais foram observados apenas com exposições consideradas suficientemente excessivas em relação à exposição terapêutica21 máxima em humanos, indicando pouca relevância para o uso clínico.
Carcinogenicidade
Não foi observada nenhuma indicação de potencial carcinogênico.
Mutagenicidade
Não foi observada nenhuma indicação de potencial genotóxico.
4. CONTRAINDICAÇÕES
Bonviva® é contraindicado a pacientes com conhecida hipersensibilidade ao ibandronato de sódio ou aos demais componentes da fórmula do produto e a pacientes com hipocalcemia42 não corrigida.
Tal como acontece com vários bisfosfonatos, Bonviva® é contraindicado a pacientes com anormalidades do esôfago43, como demora no esvaziamento esofágico, estenose44 ou acalasia (vide item “Advertências e Precauções”).
Bonviva® é contraindicado a pacientes que não conseguem ficar em pé ou sentados durante, pelo menos, 60 minutos (vide item “Advertências e Precauções”).
5. ADVERTÊNCIAS E PRECAUÇÕES
− Bonviva® é contraindicado a pacientes com hipocalcemia42 não corrigida. Antes de iniciar o tratamento com Bonviva®, deve-se tratar efetivamente a hipocalcemia42 e outros distúrbios do metabolismo31 ósseo e mineral. A ingestão adequada de cálcio e vitamina12 D é importante para todos os pacientes.
− Bisfosfonatos administrados por via oral podem causar irritação local da mucosa45 gastrintestinal superior.
Devido a esses possíveis efeitos irritantes e um potencial de agravamento da doença subjacente, cuidados devem ser tomados, quando Bonviva® é administrado a pacientes com problemas ativos no trato gastrintestinal superior29 (por exemplo, esôfago43 de Barrett, disfagia46, outras doenças do esôfago43, gastrite47, duodenite ou úlceras48).
− Experiências adversas, tais como esofagite49, úlceras48 esofágicas e erosões esofágicas, em alguns casos graves e que requerem hospitalização, raramente com sangramento ou seguidas por estenose44 esofágica ou perfuração,
têm sido reportadas em pacientes que recebem tratamento com bisfosfonatos. O risco de experiências adversas esofágicas graves parece ser maior para pacientes37 que não seguem as instruções de uso e / ou que continuaram a tomar bisfosfonatos por via oral após desenvolver sintomas50 sugestivos de irritação esofágica. Os pacientes devem prestar especial atenção e serem capazes de cumprir as instruções de administração (vide item “Posologia e Modo de usar”).
− Os médicos devem estar atentos a quaisquer sinais26 ou sintomas50 que sinalizem uma possível reação esofágica, e os pacientes devem ser instruídos a descontinuar Bonviva® e procurar ajuda médica, se desenvolverem disfagia46, odinofagia51, dor retroesternal e início ou agravamento de sintomas50 de pirose52.
− Embora nenhum aumento no risco tenha sido observado em ensaios clínicos53 controlados, houve relatos pós-comercialização de úlceras48 gástricas e duodenais com o uso de bisfosfonatos orais, algumas graves e com complicações.
− Considerando-se que anti-inflamatórios não esteroides e bisfosfonatos associam-se, ambos, à irritação gastrintestinal, recomenda-se cautela durante a administração concomitante de anti-inflamatórios não esteroides e Bonviva®.
− Osteonecrose de mandíbula54 foi relatada em pacientes tratados com bisfosfonatos. A maioria dos casos ocorreu em pacientes oncológicos submetidos a procedimentos dentários, mas alguns casos ocorreram em pacientes em tratamento para osteoporose3 pós-menopausa4 e outros diagnósticos. Fatores de risco conhecidos para osteonecrose de mandíbula54 incluem diagnóstico55 de câncer20, terapias concomitantes (por exemplo, quimioterapia56, radioterapia57 e corticosteroides) e distúrbios concomitantes (por exemplo, anemia58, coagulopatia, infecção59 e doença dentária pré-existente). A maioria dos casos foi relatada em pacientes tratados com bisfosfonatos de administração intravenosa, mas também em alguns pacientes tratados com bisfosfonatos orais.
− Em pacientes que desenvolvem osteonecrose de mandíbula54 durante a terapia com bisfosfonatos, cirurgias dentárias podem agravar a condição. Para pacientes37 que necessitem de procedimentos dentários, não há dados disponíveis indicativos de que a interrupção do tratamento com bisfosfonatos reduza o risco de osteonecrose de mandíbula54. O julgamento clínico do médico deve orientar o plano de tratamento sobre como proceder com cada paciente, com base na avaliação individual de risco / benefício.
− Embora a análise de subgrupos de pacientes com e sem doenças do trato gastrintestinal superior29 mostrou que o uso de ibandronato oral não aumentou o risco de eventos adversos no trato gastrintestinal superior29, em comparação ao placebo8 ou ao ibandronato, 2,5 mg por dia, em pacientes com histórico prévio de doenças gastrintestinais, recomenda-se cautela ao se administrar Bonviva® a pacientes com histórico de distúrbios no trato gastrintestinal superior29.
− Vários estudos de farmacologia60 clínica foram conduzidos para avaliar a segurança renal34 do ibandronato após administração IV, em indivíduos saudáveis e em pacientes com diversos graus de insuficiência renal36. Doses únicas de ibandronato de até 6 mg administradas por via intravenosa, durante 15 a 60 minutos, a indivíduos saudáveis foram bem toleradas, sem nenhum efeito aparente sobre a função renal34. Essa última dose representa, aproximadamente, quatro e oito vezes, respectivamente, a AUC61 e a Cmáx do esquema oral de 150 mg de ibandronato, considerando-se a biodisponibilidade oral de 0,6%. Em pacientes com insuficiência renal36 grave (depuração de creatinina35 < 30 mL/min), apesar de um aumento de duas a três vezes na exposição sistêmica média ao ibandronato para uma determinada dose, não houve redução da tolerabilidade ou aumento de efeitos renais adversos associados a esse aumento na exposição. Ibandronato foi bem tolerado por indivíduos com graus variados de insuficiência renal36, incluindo indivíduos com insuficiência renal36 grave (depuração de creatinina35 < 30 mL/min), insuficiência renal36 moderada (depuração de creatinina35 40 a 70 mL/min), e por pacientes com doença renal34 em estágio final. Entretanto, Bonviva® só deve ser usado por pacientes com insuficiência renal36 grave a critério do médico assistente e se os benefícios associados à administração justificarem os riscos.
− Relatos na literatura médica indicam que os bisfosfonatos podem estar associados à inflamação62 ocular, como uveíte63 e esclerite64. Em alguns casos, tais eventos não desapareceram até que o bisfosfonato tenha sido descontinuado.
Populações especiais
Pacientes pediátricos: vide item “Farmacocinética em populações especiais”.
Pacientes idosos: vide item “Farmacocinética em populações especiais”.
Pacientes com insuficiência renal36: vide item “Farmacocinética em populações especiais”.
Pacientes com insuficiência hepática38: vide item “Farmacocinética em populações especiais”.
Efeitos sobre a capacidade de dirigir veículos e operar máquinas
Não foram realizados estudos sobre os efeitos de Bonviva® sobre a capacidade de dirigir veículos e operar máquinas.
Gestação e lactação65
Categoria de risco na gravidez66: B. Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Não há evidências de efeito teratogênico67 ou efeito tóxico fetal do ibandronato de sódio em ratos e coelhos tratados diariamente por via oral, e não foram observados efeitos adversos sobre o desenvolvimento das crias das gerações F1 em ratos. Os efeitos adversos do ibandronato de sódio, em estudos de toxicidade68 reprodutiva em ratos, foram aqueles observados para os bisfosfonatos como classe e incluem diminuição do número de locais de implantação, interferência com o parto natural (distócia) e aumento nas variações viscerais (síndrome69 pelve70 / ureter71). Não foram realizados estudos específicos para o esquema de administração mensal. Não há experiência sobre o uso clínico de Bonviva® em mulheres durante a gestação.
Bonviva® não deve ser utilizado por mulheres que estejam amamentando sem orientação médica ou do cirurgiãodentista.
Em ratas lactantes72 tratadas com ibandronato de sódio na dose de 0,08 mg/kg/dia, i.v, a concentração mais elevada de ibandronato de sódio no leite foi de 8,1 ng/mL e foi observada dentro das duas primeiras horas após a administração intravenosa. Depois de 24 horas, a concentração no leite e no plasma41 foi semelhante e correspondeu a cerca de 5% das concentrações medidas após duas horas. Não se sabe se Bonviva® é excretado pelo leite humano.
Até o momento, não há informações de que o ibandronato de sódio possa causar doping.
6. INTERAÇÕES MEDICAMENTOSAS
Interações medicamentosas
É provável que suplementos à base de cálcio, antiácidos73 e alguns medicamentos orais que contenham cátions multivalentes (tais como alumínio, magnésio e ferro) interfiram na absorção de Bonviva®. Portanto, os pacientes devem esperar 60 minutos após ingerir Bonviva®, antes de tomarem outros medicamentos orais.
Foi demonstrada, em estudo de interação farmacocinética em mulheres na pós-menopausa4, a ausência de qualquer interação potencial com tamoxifeno ou tratamentos de reposição hormonal (estrogênio). Não se observou interferência quando Bonviva® foi administrado concomitantemente com melfalano / prednisolona em pacientes com mieloma74 múltiplo.
Em voluntários sadios masculinos e mulheres na pós-menopausa4, a ranitidina intravenosa causou aumento na biodisponibilidade do ibandronato de sódio de cerca de 20%, provavelmente como resultado da redução da acidez gástrica75. Entretanto, uma vez que esse aumento se manteve dentro da variação normal da biodisponibilidade do ibandronato de sódio, não é necessário ajuste de doses, quando Bonviva® for administrado com antagonistas dos receptores H2 ou outras substâncias que aumentem o pH gástrico.
Em relação à distribuição, não são consideradas prováveis interações medicamentosas clinicamente significativas, uma vez que o ibandronato de sódio não inibe as principais isoenzimas do sistema hepático do citocromo P450 humano e não induziu o sistema do citocromo P450 hepático em ratos. Além disso, a ligação às proteínas76 plasmáticas é baixa nas concentrações terapêuticas de ibandronato de sódio, e, portanto, é improvável o deslocamento de outras substâncias. O ibandronato de sódio é eliminado apenas por excreção renal34 e não sofre biotransformação. A via secretória parece não incluir sistemas de transporte ácidos ou básicos envolvidos na excreção de outras substâncias.
Em um estudo com duração de um ano com mulheres na pós-menopausa4 com osteoporose3 (BM 16549), a incidência9 de eventos do trato gastrintestinal superior29 em pacientes que receberam concomitantemente aspirina ou anti-inflamatórios não esteroides foi semelhante nas pacientes tratadas com Bonviva®, 2,5 mg, diariamente, ou 150 mg, uma vez por mês.
Em mais de 1.500 pacientes recrutadas no estudo BM 16549, que comparou a administração mensal e diária do ibandronato de sódio, 14% das pacientes usavam bloqueadores da histamina77 (H2) ou inibidores da bomba de prótons.
Entre essas pacientes, a incidência9 de eventos gastrintestinais nas pacientes tratadas com Bonviva®, 150 mg, mensalmente, foi semelhante à das pacientes tratadas com 2,5 mg diariamente.
Interações com alimentos
A presença de alimentos ou produtos que contenham cálcio e outros cátions (tais como alumínio, magnésio e ferro), incluindo leite e alimentos, provavelmente interferem com a absorção de Bonviva® consistentemente com os achados dos estudos em animais. Portanto, a ingestão de tais produtos e alimentos deve ser postergada em 60 minutos após a administração oral de Bonviva®.
7. CUIDADOS DE ARMAZENAMENTO DO MEDICAMENTO
Conservar em temperatura ambiente (entre 15 e 30 ºC).
Prazo de validade
Este medicamento possui prazo de validade de 36 meses a partir da data de fabricação.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Descarte de medicamentos não utilizados e/ou com data de validade vencida
O descarte de medicamentos no meio ambiente deve ser minimizado. Os medicamentos não devem ser descartados no esgoto, e o descarte em lixo doméstico deve ser evitado. Utilize o sistema de coleta local estabelecido, se disponível.
Os comprimidos de Bonviva® são oblongos, brancos a quase brancos.
Antes de usar, observe o aspecto do medicamento.
Todo medicamento deve ser mantido fora do alcance das crianças.
8. POSOLOGIA E MODO DE USAR
Modo de usar:
− Bonviva® deve ser administrado em jejum, 60 minutos antes da ingestão do primeiro alimento ou bebida do dia (exceto água) e antes da administração de qualquer outro medicamento ou suplemento, inclusive cálcio (vide item “Interações Medicamentosas”);
− os comprimidos devem ser deglutidos inteiros, com um copo cheio de água filtrada (180 a 240 mL), estando o paciente em posição ereta: sentado, em pé ou andando. O paciente não deverá deitar-se nos 60 minutos seguintes após tomar o medicamento;
− Bonviva® só deve ser tomado com água pura. Bonviva® não deve ser tomado com nenhum outro tipo de bebida, tais como água mineral, água com gás, café, chá, bebidas lácteas (como leite) ou suco. Águas minerais podem conter altas concentrações de cálcio e, por isso, não devem ser utilizadas;
− os comprimidos de Bonviva® não devem ser mastigados nem chupados, pois podem causar ulceração78 na garganta79.
Dose e duração do tratamento
A dose recomendada de Bonviva® é um comprimido revestido de 150 mg, uma vez por mês. Os comprimidos devem ser tomados sempre na mesma data a cada mês.
A dose máxima de Bonviva® é 150 mg por mês.
Bonviva® é um medicamento de uso contínuo, não havendo duração de tratamento determinada.
Os pacientes devem receber suplementação80 de cálcio e vitamina12 D, se a ingestão pela dieta for inadequada.
Conduta em caso de esquecimento
Caso a dose mensal seja esquecida, os pacientes devem ser instruídos a tomar um comprimido de Bonviva®150 mg, na manhã seguinte, após se lembrarem, a menos que o intervalo para a próxima dose prevista seja inferior a sete dias. Os pacientes devem, então, retomar o esquema de dose uma vez por mês na data originalmente planejada. Se a próxima administração planejada estiver dentro do período de sete dias, o paciente deve esperar sua próxima dose e então continuar a tomar um comprimido uma vez por mês, conforme originalmente planejado. Os pacientes não devem tomar dois comprimidos de 150 mg na mesma semana.
Instruções posológicas especiais
Pacientes idosos: não é necessário ajuste de dose. Considerando-se que pode haver diminuição da função renal34 em pacientes idosos, se houver caracterização de insuficiência renal36 grave, recomenda-se avaliar a relação risco/ benefício antes de administrar Bonviva® (vide item “Farmacocinética em populações especiais”).
Pacientes com insuficiência renal36: não é necessário ajuste de dose para pacientes37 com insuficiência renal36 leve a moderada e com depuração de creatinina35 ≥ 30 mL/min. Em pacientes com depuração de creatinina35 < 30 mL/min, a decisão de administrar Bonviva® deve ser baseada na avaliação individual da relação risco / benefício (vide item “Farmacocinética em populações especiais”).
Pacientes com insuficiência hepática38: não há necessidade de ajuste de dose para pacientes37 com insuficiência hepática38 (vide item “Farmacocinética em populações especiais”).
Este medicamento não deve ser partido ou mastigado.
9. REAÇÕES ADVERSAS
Tratamento da osteoporose3 pós-menopausa4
Administração diária
A segurança de Bonviva®, 2,5 mg, administrado diariamente foi avaliada em 1.251 pacientes tratadas em quatro estudos clínicos controlados com placebo8. Setenta e três por cento dessas pacientes eram provenientes de estudos preliminares de tratamento de três anos (MF 4411). O perfil de segurança global de Bonviva®, 2,5 mg, administrado diariamente, em todos esses estudos, foi semelhante ao do placebo8. A proporção geral de pacientes que apresentou eventos adversos com relação causal possível ou provável com o medicamento em avaliação no estudo preliminar (MF 4411) foi de 19,8% para Bonviva® e de 17,9% para o placebo8.
Administração mensal
Em um estudo de dois anos com mulheres na pós-menopausa4 com osteoporose3 (BM 16549), a segurança global de Bonviva®, 150 mg, uma vez ao mês, e de Bonviva®, 2,5 mg, uma vez ao dia, foi semelhante entre os dois esquemas de tratamento. A proporção global de pacientes que apresentaram reações adversas ao medicamento, isto é, eventos adversos com relação causal possível ou provável com o medicamento em estudo, foi de 22,7% e 25,0% para Bonviva®, 150 mg, uma vez por mês, e de 21,5% e 22,5% para Bonviva®, 2,5 mg, diariamente, após um e dois anos, respectivamente. A maioria das reações adversas foi de intensidade leve a moderada. Na maioria dos casos, a reação não levou à interrupção do tratamento.
As Tabelas 1 e 2 relacionam as reações adversas que ocorreram em mais de 1% dos pacientes tratados com Bonviva®, 150 mg, mensalmente, ou 2,5 mg, diariamente, no estudo BM 16549, e nas pacientes tratadas com Bonviva®, 2,5 mg, diariamente, no estudo MF 4411. As tabelas apresentam as reações adversas em dois estudos que ocorreram com incidência9 maior que nas pacientes tratadas com placebo8 no estudo MF 4411. Dentro de cada grupo de frequência, os efeitos indesejáveis são apresentados por ordem decrescente de gravidade.
Na Tabela 1, são apresentados os dados de um ano obtidos a partir do estudo BM 16549, e, na Tabela 2, os dados cumulativos de dois anos.
Tabela 1: reações adversas comuns (>1/100 e ≤ 1/10) nos estudos de fase III em osteoporose3 que foram consideradas pelo investigador como sendo possivelmente ou provavelmente relacionadas ao tratamento – dados de um ano provenientes do estudo BM 16549 e de três anos do estudo sobre fratura6 placebo8 controlado MF 4411.


(*) Foram relatados sintomas50 breves de síndrome69 influenza81-like com Bonviva®, 150 mg, uma vez ao mês, tipicamente em associação com a primeira dose. Tais sintomas50 geralmente foram de curta duração e de intensidade leve a moderada e desapareceram durante o tratamento sem necessidade de medidas corretivas. A síndrome69 influenza81-like inclui eventos relatados como reações de fase aguda ou sintomas50 tais como mialgia82, artralgia83, febre84, calafrios85, fadiga86, náusea87, perda de apetite ou dor óssea.
Tabela 2: reações adversas comuns cumulativas (> 1/100 e ≤ 1/10) nos estudos de fase III em osteoporose3 que foram consideradas pelo investigador como sendo possivelmente ou provavelmente relacionadas ao tratamento – dados de dois anos provenientes do estudo BM 16549 e de três anos do estudo sobre fratura6 placebo8 controlado MF 4411.
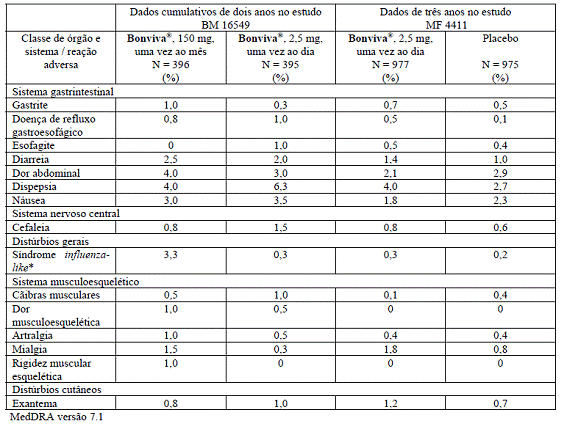
(*) Foram relatados sintomas50 breves de síndrome69 influenza81-like com Bonviva®, 150 mg, uma vez ao mês, tipicamente em associação com a primeira dose. Tais sintomas50 geralmente foram de curta duração e de intensidade leve a moderada e desapareceram durante o tratamento, sem necessidade de medicamentos para combatê-los. A síndrome69 influenza81-like inclui eventos relatados como reações de fase aguda ou sintomas50 tais como mialgia82, artralgia83, febre84, calafrios85, fadiga86, náusea87, perda de apetite ou dor óssea.
Reações adversas a medicamentos que ocorreram com uma frequência ≤ 1%
A lista a seguir fornece informações sobre reações adversas a medicamentos (consideradas possivelmente ou provavelmente relacionadas com o tratamento pelo investigador) relatadas no estudo MF 4411, que ocorreram mais frequentemente com Bonviva®, 2,5 mg, administrado diariamente, que com placebo8, e, no estudo BM 16549, que ocorreram mais frequentemente com Bonviva®, 150 mg, uma vez por mês, que com Bonviva®, 2,5 mg, administrado diariamente. Dentro de cada grupo de frequência, os efeitos indesejáveis são apresentados por ordem decrescente de gravidade:
Reação incomum (>1/1.000 e <1/100): distúrbios gastrintestinais (gastrite47, esofagite49, incluindo ulcerações88 esofágicas ou estenose44, vômitos89 e disfagia46), distúrbios do sistema nervoso90 (tonturas91), distúrbios musculoesqueléticos e do tecido conjuntivo92 (dor nas costas93).
Reação rara (>1/10.000 e <1/1.000): distúrbios gastrintestinais (duodenite), distúrbios do sistema imunológico94 (reações de hipersensibilidade), distúrbios da pele95 e do tecido subcutâneo96 (angioedema97, edema98 facial e urticária99).
Dose uma vez por mês
Pacientes com história pregressa de doença gastrintestinal, incluindo pacientes com úlcera péptica100 sem sangramento ou hospitalização recentes, e pacientes com dispepsia101 ou refluxo controlado por medicamentos foram incluídos no estudo de tratamento mensal. Para esses pacientes, não se observou diferença na incidência9 de eventos adversos no trato gastrintestinal superior29 com a dose de 150 mg mensal, em comparação com o esquema de dose diária de 2,5 mg.
O estudo BM 16549, com dois anos de duração, cujos resultados do primeiro ano sobre a incidência9 de eventos adversos gastrintestinais encontram-se descritos acima, mostrou que o número de eventos adversos esofágicos, que representou possível efeito local do ibandronato (esofagite49, dor esofagiana e erosão esofágica), foi baixo em todos os grupos. Aproximadamente 11% dos pacientes incluídos nesse estudo tinham história de distúrbio gastrintestinal superior. As porcentagens de eventos adversos gastrintestinais superiores foram mais altas em pacientes com história prévia de distúrbios gastrintestinais superiores (37% a 45,8%), em comparação aos pacientes sem história de queixas gastrintestinais superiores (13,1% a 18,4%). No grupo de tratamento 150 mg, a diferença entre os grupos foi menos acentuada, 19,6% em pacientes com história relevante apresentando um evento adverso gastrintestinal superior, em comparação a 16,5% em pacientes sem histórico de distúrbio gastrintestinal superior. Nesse estudo, eventos adversos potencialmente associados com sangramento gastrintestinal foram pouco comuns e não mais frequentes nos grupos de ibandronato mensal que no grupo 2,5 mg por dia.
A análise dos dados cumulativos de dois anos desse estudo mostrou que a incidência9 de perfuração, úlcera102 ou sangramento de origem gastrintestinal superior foi muito baixa (0,8% - 1,8%), sendo similar entre os grupos 2,5 mg por dia e 150 mg dose única mensal (ambos 0,8%), conforme a tabela abaixo:
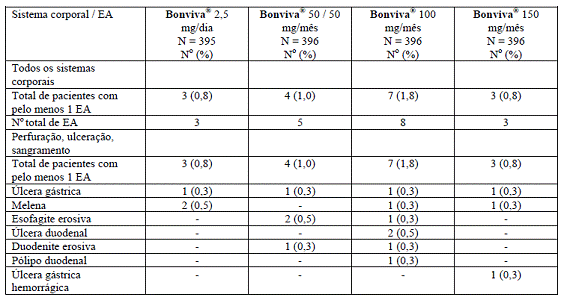

A proporção de pacientes com eventos adversos gastrintestinais graves, potencialmente fatais ou que levaram à retirada prematura foi semelhante entre os grupos de tratamento diário e mensal, com porcentagem discretamente maior no grupo 2,5 mg por dia, em comparação aos esquemas mensais.
Nesse estudo, 45% a 49% dos pacientes receberam aspirina ou anti-inflamatórios não hormonais (AINH’s) em algum momento do estudo. A frequência de eventos adversos gastrintestinais superiores tipicamente associados aos AINH’s encontra-se a seguir:

Em conclusão, não houve aumento na maioria dos eventos gastrintestinais em pacientes tratados concomitantemente com ibandronato e AINH’s, sugerindo não haver efeito adverso aditivo do ibandronato. Não houve um padrão de temporalidade consistente de ocorrência de eventos adversos gastrintestinais em nenhum dos grupos de tratamento no estudo BM 16549.
Eventos adversos do tipo influenza81-like: foram relatados sintomas50 de síndrome69 gripal com Bonviva®, 150 mg, uma vez ao mês, tipicamente em associação com a primeira dose, nos primeiros três dias de tratamento. Tais sintomas50 geralmente foram de curta duração e de intensidade leve a moderada e desapareceram durante o tratamento, sem necessidade de medicamentos para combatê-los.
Prevenção da osteoporose3 pós-menopausa4
O perfil de segurança de Bonviva®, 2,5 mg, administrado diariamente observado no estudo de fase II/III MF 4499, para prevenção (n = 163 pacientes com Bonviva®, 2,5 mg; n = 159 pacientes com placebo8), foi comparado quanto à consistência, aos dados de segurança do estudo preliminar sobre eficácia contra fraturas MF 4411 e não trouxe nenhuma informação adicional sobre segurança.
Achados laboratoriais anormais
No estudo preliminar de três anos com Bonviva®, 2,5 mg, diariamente (Estudo MF 4411), não houve diferenças em comparação com placebo8 no que diz respeito às anormalidades indicativas de disfunção hepática39 ou renal34, alterações hematológicas, hipocalcemia42 ou hipofosfatemia. Semelhantemente, não foram notadas diferenças entre os grupos no estudo BM 16549 após um e dois anos.
Experiência pós-comercialização
Desordens musculoesqueléticas e do tecido conjuntivo92: muito raramente, foram relatados casos de osteonecrose de mandíbula54 em pacientes tratados com ibandronato de sódio (vide item “Advertências e Precauções”).
Desordens oculares: foram relatados eventos de inflamação62 ocular, como uveíte63, episclerite e esclerite64, com o uso de bisfosfonatos, incluindo ibandronato de sódio. Em alguns casos, esses eventos não foram resolvidos até a descontinuação do uso do bisfosfonato.
Atenção: Este é um medicamento novo e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis para comercialização, efeitos indesejáveis e não conhecidos podem ocorrer. Neste caso, informe seu médico.
Atenção: este produto é um medicamento novo e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos imprevisíveis ou desconhecidas.
Nesse caso, notifique os eventos adversos pelo sistema Vigilância – NOTIVISA, disponível em www.anvisa.gov.br/hotsite/notivisa/index.htm, ou para a Vigilância Sanitária Estadual ou Municipal.
10. SUPERDOSE
Não se dispõe de informações específicas sobre o tratamento da superdose com Bonviva®. Entretanto, a superdose oral pode resultar em eventos adversos gastrintestinais, tais como mal-estar gástrico, queimação, esofagite49, gastrite47 ou úlcera102. Em caso de superdose, deve-se administrar leite ou antiácidos73 que, ao se ligarem ao ibandronato de sódio, prejudicarão a absorção desse. Por causa do risco de irritação esofágica, não se deve induzir o vômito103, e o paciente deve permanecer completamente na posição ereta, sentado ou em pé.
Em caso de intoxicação ligue para 0800 722 6001, se você precisar de mais orientações.
MS-1.0100.0646
Farm. Resp.: Guilherme N. Ferreira - CRF-RJ nº 4288
Fabricado por Produtos Roche Químicos e Farmacêuticos S.A.
Est. dos Bandeirantes, 2020 CEP 22775-109 - Rio de Janeiro - RJ
CNPJ: 33.009.945/0023-39
Indústria Brasileira
Serviço Gratuito de Informações – 0800 7720 289 R
www.roche.com.br
VENDA SOB PRESCRIÇÃO MÉDICA
Bonviva (Informações aos profissionais de saúde) - Laboratório
ROCHE
Av. Engenheiro Billings, 1729 - Jaguaré
São Paulo/SP
- CEP: 05321-900
Tel: 0800 7720 289
Fax: 0800 7720 292
Site: http://www.roche.com/
Estrada dos Bandeirantes, 2020
CEP: 22710-104
Rio de Janeiro - RJ
Ver outros medicamentos do laboratório "ROCHE"