

Immunine
BAXTER HOSPITALAR LTDA
IDENTIFICAÇÃO DO MEDICAMENTO
Immunine
fator IX de coagulação1 (humano)
Pó liofilizado2
APRESENTAÇÕES
Immunine é um concentrado preparado de plasma3 humano e contém o fator IX de coagulação1 (humano) na forma de pó liofilizado2, acompanhado de volume apropriado de diluente para reconstituição.
VIA INTRAVENOSA
USO ADULTO E PEDIÁTRICO
Cada embalagem contém:
Immunine – fator IX de coagulação1 (humano) 200 UI
- 1 Frasco-ampola contendo Immunine 200 UI
- 1 Frasco-ampola contendo 5mL de água estéril para injetáveis
- Conjunto de Reconstituição e infusão (1 agulha de transferência, 1 agulha de aeração, 1 agulha de filtração, 1 agulha descartável, 1 seringa4 descartável de 5mL e 1 scalp)
Immunine – fator IX de coagulação1 (humano) 600 UI
- 1 Frasco-ampola contendo Immunine 600 UI
- 1 Frasco-ampola contendo 5mL de água estéril para injetáveis
- Conjunto de Reconstituição e infusão (1 agulha de transferência, 1 agulha de aeração, 1 agulha de filtração, 1 agulha descartável, 1 seringa4 descartável de 5mL e 1 scalp)
Immunine – fator IX de coagulação1 (humano) 1.200 UI
- 1 Frasco-ampola contendo Immunine 1.200 UI
- 1 Frasco-ampola contendo 10mL de água estéril para injetáveis
- Conjunto de Reconstituição e infusão (1 agulha de transferência, 1 agulha de aeração, 1 agulha de filtração, 1 agulha descartável, 1 seringa4 descartável de 10mL e 1 scalp)
COMPOSIÇÃO
Cada frasco de pó liofilizado2 de Immunine – fator IX de coagulação1 (humano) após adequada reconstituição, utilizando todo o volume do diluente contido nas respectivas embalagens (água para injetáveis: 5mL para 200 UI e 600 UI, e 10mL para 1.200 UI) contém na solução obtida, pronta para uso, a seguinte composição:
|
|
200 UI |
600 UI |
1.200 UI |
|
Componentes ativos |
|||
|
Fator IX de coagulação1 (humano) |
200 UI* |
600 UI* |
1.200 UI* |
|
água para injetáveis |
5 mL |
5 mL |
10 mL |
atividade específica ≥ 50 UI/mg de proteína
Excipientes: citrato de sódio di-hidratado e cloreto de sódio.
*Determinou-se a potência de F IX empregando-se o ensaio de coagulação1 de um estágio, in vitro, calibrado contra o Padrão Internacional da Organização Mundial de Saúde5 (OMS) para Concentrados de F IX.
INFORMAÇÕES AO PACIENTE
PARA QUE ESTE MEDICAMENTO É INDICADO?
Immunine é indicado na terapia e profilaxia de episódios de sangramento decorrentes de deficiência congênita6 ou adquirida de fator IX (hemofilia7 B, hemofilia7 B com inibidor do fator IX, deficiência adquirida do fator IX devido ao desenvolvimento espontâneo do inibidor do fator IX).
COMO ESTE MEDICAMENTO FUNCIONA?
Immunine é um concentrado de fator IX de coagulação1 concentrado. Ele substitui o fator IX ausente ou o que não funciona adequadamente na Hemofilia7 B. Hemofilia7 B é uma doença hereditária ligada ao sexo que causa um defeito na coagulação1 devido à redução dos níveis de fator IX. Isto leva a um sangramento grave em articulações8, músculos9 e órgãos internos, espontaneamente ou como consequência de acidente ou trauma cirúrgico. A administração de Immunine corrige temporariamente a deficiência de fator IX e reduz a tendência de sangramento.
O tempo médio estimado para início da ação terapêutica10 do medicamento é de 10 a 30 minutos.
QUANDO NÃO DEVO USAR ESTE MEDICAMENTO?
Não utilizar Immunine em caso de:
- hipersensibilidade (alérgico) ao fator IX de coagulação1 humano ou a qualquer um dos componentes de Immunine
- coagulopatia de consumo e/ou hiperfibrinólise
Coagulopatia de consumo (CID, coagulação1 intravascular11 disseminada) é uma doença que pode levar à morte, onde ocorre coagulação1 do sangue12 em grande quantidade com formação de muitos coágulos nos vasos sanguíneos13. O que consequentemente leva ao consumo de fatores de coagulação1 de todo o corpo.
Hiperfibrinólise está presente quando a coagulação1 é reduzida, porque uma importante substância de coagulação1 (fibrina14) está degradada.
- alergia15 conhecida a heparina ou história de trombocitopenia16 induzida pela heparina
Trombocitopenia16 induzida pela heparina é uma diminuição anormal no número de células sanguíneas17 envolvidas na formação de coágulo18 de sangue12, que é causada pelo uso de heparina.
Após tratamento apropriado dessas condições, Immunine só deve ser utilizado caso o sangramento represente perigo de vida.
O QUE DEVO SABER ANTES DE USAR ESTE MEDICAMENTO?
Caso a alergia15 ocorra:
Existe uma rara possibilidade de ocorrer uma reação alérgica19 imediata e grave (reação anafilática20) à Immunine.
Portanto, deve-se estar atento aos sinais21 iniciais de uma reação alérgica19, como:
- vermelhidão na pele22
- erupção23 cutânea24
- urticária25
- coceira em todo o corpo
- inchaço26 nos lábios e língua27
- falta de ar
- dificuldade de respiração
- aperto no peito28
- indisposição geral
- tontura29
- queda da pressão sanguínea
- perda de consciência
Caso identifique um sintoma30 ou mais listados acima, a infusão deve ser interrompida imediatamente e o médico deve ser contatado. Os sintomas31 listados acima podem ser sinais21 iniciais de um choque anafilático32. Sintomas31 graves requerem tratamento de emergência33 imediato.
Monitoramento é necessário quando:
- Seu médico irá analisar seu sangue12 regularmente para garantir que a dose atual seja adequada e que o seu sangue12 receba fator IX suficiente
- Quando os concentrados de fator IX são administrados, coágulos de sangue12 (trombose34) podem desenvolver e podem ser levados para a corrente sanguínea, potencialmente causando coágulos em outro lugar (embolismo35). Portanto, o médico não aumentará o nível de fator IX em pacientes predispostos à trombose34 (não acima de 60% do normal). Além disso, o médico irá monitorar esses pacientes, assim como os pacientes que receberem altas doses de Immunine, com cuidado particular. Com monitoramento correto, possíveis complicações podem ser imediatamente reconhecidas e medidas apropriadas podem ser tomadas. Entre essas complicações, estão tromboembolismo36 e coagulopatia de consumo, por exemplo.
Caso o sangramento persista:
- Informar imediatamente o médico. Inibidores do fator IX podem ter se desenvolvido. Inibidores de fator IX são anticorpos37 (inibidores) no sangue12 que podem neutralizar o efeito do fator IX. Isto reduz a eficácia de Immunine no tratamento do sangramento. O médico realizará os testes necessários para confirmar isso.
- Existe a possibilidade de conexão entre a ocorrência de inibidores de fato IX e reações adversas. Pacientes com inibidores de fator IX podem estar com risco aumentado de anafilaxia38. Portanto, pacientes que desenvolvem uma reação alérgica19 devem ser testados para a presença de inibidor de fator IX.
Quando medicamentos são fabricados a partir do sangue12 ou plasma3 humano, algumas medidas são colocadas em prática para prevenir que infecções39 sejam passadas para os pacientes. Isto inclui:
- seleção cuidadosa dos doadores de sangue12 e plasma3 humano para garantir que indivíduos com risco de estarem infectados sejam excluídos;
- teste de cada doação e dos pools de plasma3 para sinais21 de vírus40/infecção41;
- inclusão de etapas no processo de plasma3 ou sangue12 que podem inativar ou remover vírus40. Apesar destas medidas, quando medicamentos fabricados a partir do sangue12 ou plasma3 humano são administrados, a possibilidade de transmissão de infecção41 não pode ser totalmente eliminada. Isto se aplica também aos patógenos de natureza desconhecida.
As medidas tomadas são consideradas eficazes para vírus40 encapsulados, como o vírus40 da imunodeficiência42 humana (HIV43), hepatite44 B e hepatite44 C, e para o vírus40 da hepatite44 A não encapsulado. Os procedimentos de inativação/remoção viral podem ter um valor limitado contra vírus40 não encapsulados tais como parvovírus B19 (vírus40 que causa vermelhidão na pele22 – eritema45 infeccioso). Infecção41 por Parvovírus B19 pode ser séria para mulheres grávidas (infecção41 fetal) e para indivíduos com imunodeficiência42 ou com aumento da metabolização de eritrócitos46 (por exemplo, na anemia hemolítica47).
O médico pode recomendar vacinação apropriada contra hepatite44 A e B para pacientes48 que recebem regularmente/repetidamente produtos derivados de plasma3 humano.
É fortemente recomendado que sempre que uma dose de Immunine for administrada o nome e o lote do produto sejam anotados para manter um registro dos lotes usados.
Estas informações devem ser levadas em consideração para pacientes48 em uma dieta baixa de sódio.
Condução e utilização de máquinas
Nenhum efeito na habilidade de dirigir e operar máquinas foram observados.
Gravidez49 e, lactação50 e fertilidade
Hemofilia7 B em mulheres é muito raro. Logo, até o momento, não há experiência referente ao uso de Immunine durante a gestação e lactação50. Também não há experiência com relação ao impacto de Immunine na fertilidade.
Informe o seu médico caso esteja grávida ou amamentando.
O médico irá decidir se você deve usar Immunine durante a gravidez49 e lactação50.
Categoria “C” de risco na gravidez49.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Interações medicamentosas
Não são conhecidas interações do produto com outros medicamentos.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento. Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde5.
ONDE, COMO E POR QUANTO TEMPO POSSO GUARDAR ESTE MEDICAMENTO?
O produto deve ser armazenado em uma geladeira (+2°C a +8°C). Não congelar. Mantenha o frasco na embalagem para protegê-lo da luz.
Número de lote e datas de fabricação e validade: vide embalagem. A data de validade refere-se ao último dia do mês.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Características físicas
Immunine é um pó branco ou amarelo claro para preparar a solução para injetáveis. Após reconstituição com o diluente fornecido (água estéril para injetáveis), a solução fica clara ou levemente opaca (opalescente). Recomenda-se não usar o produto caso apresente material particulado ou caso a solução fique descolorida ou escura, e contatar o Serviço de Atendimento da Baxter.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Após preparo, a solução deve ser utilizada imediatamente.
Os medicamentos não devem ser eliminados na água residual ou lixo doméstico. Perguntar ao farmacêutico como eliminar o medicamento que não será mais utilizado. Estas medidas ajudarão a proteger o ambiente.
Todo medicamento deve ser mantido fora do alcance das crianças.
COMO DEVO USAR ESTE MEDICAMENTO?
Rota e/ou Modo de usar
Immunine deve ser administrado lentamente via intravenosa após preparação da solução com o diluente fornecido.
Immunine não deve ser misturado com outro medicamento antes da administração. Isso pode prejudicar a eficácia e segurança do produto.
Seguir as orientações do médico.
A taxa de administração depende do nível de conforto do paciente e não deve exceder 2mL por minuto.
- Usar somente o conjunto de administração fechado. Caso outro conjunto de administração for utilizado, Immunine pode colar na parte interna do conjunto de infusão, o que pode levar a uma dose incorreta.
- Caso você esteja recebendo outros medicamentos por acesso venoso, deve-se lavar este acesso com uma solução adequada, como por exemplo, solução salina fisiológica51, antes e depois da administração de Immunine.
- Immunine deve ser reconstituído imediatamente antes da administração, e em seguida, utilizar a solução de imediato (a solução não contém conservantes).
- A solução para injeção52 é clara ou ligeiramente leitosa (opalescente). Não utilizar soluções turvas ou que possuam partículas visíveis.
- Descartar apropriadamente o produto dissolvido não utilizado.
Reconstituição do pó para preparar a solução para injetáveis:
A solução deve ser preparada sob condições limpas e estéreis.
- Aquecer o frasco fechado contendo o diluente (água estéril para injetáveis) à temperatura ambiente (máxima de 37°C).
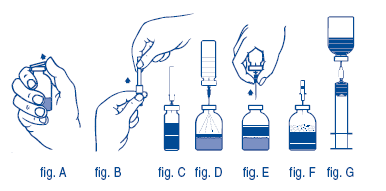
- Remover as tampas plásticas protetoras dos frascos do concentrado e do diluente (fig. A) e desinfetar as tampas de borracha de ambos os frascos.
- Remover a cobertura protetora de uma extremidade da agulha de ponta dupla (agulha de transferência), contida na embalagem, exercendo um movimento de torcer e puxar (fig. B). Inserir a agulha exposta através da tampa de borracha do frasco de diluente (fig. B e C).
- Remover a cobertura protetora da outra extremidade da agulha de transferência, tendo o cuidado de não tocar na extremidade exposta.
- Inverter o frasco de diluente sobre o frasco do concentrado e inserir a extremidade livre da agulha de transferência para dentro do frasco do concentrado (fig. D). O diluente será aspirado para dentro do frasco de concentrado por vácuo.
- Após todo o diluente ser transferido, desconectar os dois frascos removendo a agulha do frasco do concentrado (fig. E). Agitar suavemente ou girar o frasco do concentrado para acelerar a dissolução.
- Ao se completar a reconstituição do concentrado, inserir a agulha de aeração, contida na embalagem (fig. F), e qualquer espuma que tenha se formado desaparecerá. Remover a agulha de aeração.
Injeção52 / Infusão:
A solução deve ser preparada sob condições limpas e estéreis.
- Remover a cobertura de proteção da agulha de filtro contida na embalagem, girando a tampa, e colocar a agulha na seringa4 descartável estéril. Aspirar a solução para dentro da seringa4 (fig. G).
- Desconectar a agulha de filtro da seringa4 e, lentamente (máximo de 2 mL/min), injetar a solução por via intravenoso, usando um conjunto de infusão fechado (ou agulha descartável fechada).
Quando administrado por infusão, utilizar um conjunto descartável de infusão rápida com um filtro apropriado.
Posologia
I. Hemofilia7 B
Para calcular os níveis plasmáticos de fator IX da forma especificada abaixo, pressupõe-se que uma UI de Immunine – fator IX de coagulação1 (humano) por kg de peso corpóreo aumente o nível plasmático de fator IX em aproximadamente 0,8%.
Levando-se em consideração a atividade plasmática do fator IX antes da infusão, determina-se a dose requerida usando a seguinte fórmula:
Dose de Immunine – fator IX de coagulação1 (humano) (em UI de F IX) = peso corpóreo (em kg) x aumento desejado de F IX (em %) x 1,2
São necessárias determinações regulares do nível plasmático de fator IX do paciente para monitorar o curso da terapia e calcular as doses de manutenção apropriadas.
1. Hemorragias53 e Cirurgia
A tabela seguinte indica quais os níveis plasmáticos de fator IX necessários para o controle de hemorragias53 ou para a profilaxia cirúrgica e qual o tempo necessário a ser mantido:
|
Tipo de hemorragia54 ou de intervenção cirúrgica |
Nível plasmático de fator IX terapeuticamente necessário |
Período durante o qual é necessário manter o nível plasmático de fator IX |
|
De pequeno porte, por exemplo: hemorragias53 intra-articulares |
30% |
pelo menos 1 dia, dependendo da gravidade da hemorragia54 |
|
De grande porte, por exemplo: hemorragias53 intramusculares, hemorragias53 na cavidade oral55 e traumatismo56 craniano brando, extrações dentárias, intervenções cirúrgicas com baixo risco de hemorragia54 |
30-50% |
3-4 dias ou até a absorção da hemorragia54 tecidual ou da cicatrização adequada da ferida |
|
Representando perigo de vida, por exemplo: hemorragias53 gastrointestinais, intracranianas, intra-abdominais ou intratorácicas, fraturas, intervenções cirúrgicas de grande porte com elevado risco de hemorragia54 |
50-75% |
após 7 dias, pode-se abaixar os níveis de fator IX, contudo deve- se continuar a terapia durante pelo menos outros 7 dias ou até a absorção da hemorragia54 ou da cicatrização adequada da ferida |
Em geral, administra-se Immunine – fator IX de coagulação1 (humano) a cada 24 horas, em correspondência com a meia-vida biológica do fator IX. Para profilaxia cirúrgica, a dose inicial deve ser administrada uma hora antes da intervenção cirúrgica. No caso de intervenções cirúrgicas de grande porte, deve-se manter intervalos de tratamento de 12 horas durante os primeiros dias de pós-operatório.
2. Terapia de manutenção profilática
Na terapia de manutenção profilática da hemofilia7 B grave, uma dose de 20 – 30 UI/kg de peso corpóreo, duas vezes por semana, mostrou-se ser eficaz. Os regimes de dosagem profilática devem, no entanto, ser determinados em conformidade com as necessidades individuais.
II. Hemorragias53 com inibidor do fator IX
A terapia de substituição com fator IX é, em geral, eficaz somente em pacientes com baixa capacidade de resposta com um título de inibidor inferior a dez Unidades Bethesda.
Dado que a resposta ao Immunine – fator IX de coagulação1 (humano) depende do título do inibidor do paciente, os níveis de fator IX devem ser monitorados frequentemente e a dose deve ser ajustada de forma correspondente.
O QUE DEVO FAZER QUANDO EU ME ESQUECER DE USAR ESTE MEDICAMENTO?
- Não utilizar dose dupla para compensar uma dose esquecida
- Proceder com a próxima administração imediatamente e continuar com os intervalos regulares conforme recomendação médica.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
QUAIS OS MALES QUE ESTE MEDICAMENTO PODE ME CAUSAR?
Como qualquer outro medicamento, Immunine pode apresentar reações adversas, apesar de nem todos os pacientes apresentarem. Caso alguma reação se torne séria ou alguma outra reação adversa não listada neste folheto seja verificada informar o seu médico ou farmacêutico.
As reações adversas reportadas são baseadas em relatos de estudos clínicos e relatos pós-comercialização.
As reações adversas estão listadas pela frequência, iniciando pela mais frequente (categoria de frequência descrita ao final da lista das reações adversas observadas com Immunine).
Reações adversas incomum:
- Irritação e dor de garganta57 e tosse (seca)
- Rash58 e coceira (prurido59)
- Febre60 (pirexia61)
Reações adversas nas quais a frequência não pode ser estimada com os dados disponíveis
- anticorpos37 neutralizantes de fator IX (inibidores), coagulopatia de consumo (CID)
- reação alérgica19 perigosa (reação anafilática20), inchaço26 repentino da pele22 ou membrana mucosa62 com ou sem dificuldade para engolir ou respirar (angioedema63). Ocorreu na presença de inibidores: doença do soro64 e reação de hipersensibilidade
- dor de cabeça65, inquietação e formigamento
- ataque cardíaco (infarto do miocárdio66), palpitação67 do coração68 (taquicardia69)
- queda da pressão arterial70 (hipotensão71), eventos tromboembólicos, oclusão de um vaso pulmonar através de um coágulo18 de sangue12 (ex. embolismo35 pulmonar, trombose34 venosa, trombose34 arterial, trombose34 da artéria72 cerebral), formação de coágulo18 de sangue12 na veia (trombose34 venosa), rubor
- inspiração73 e/ou expiração74 prejudicada, devido à constrição75 das passagens respiratórias (respiração asmática), dificuldade para respirar (dispneia76)
- sensação de enjoo (náusea77), vômito78
- irritação em todo o corpo (urticária25)
- certo distúrbio no rim79 com sintomas31, como inchaço26 das pálpebras80, face81 e pernas com ganho de peso e perda de proteína via urina82 (síndrome nefrótica83)
- calafrios84, reações de hipersensibilidade, ardor85 e picadas no local da aplicação, letargia86, dificuldade para respirar (aperto no peito28).
As reações adversas incomum significa que a reação pode ocorrer em até 1 em cada 100 indivíduos, de acordo com a explicação de categoria de frequência descrita abaixo.
Desconhecida significa que a frequência não pode ser estimada com os dados disponíveis.
Muito comum: >1/10
Comum: > 1/100 e ≤ 1/10
Incomum: >1/1000 e ≤ 1/100
Rara: >1/10 000 e ≤ 1/1000
Muito rara: ≤ 1/10 000
Desconhecido: a frequência não pode ser estimada com os dados disponíveis.
Os seguintes efeitos adversos foram observados com produtos do mesmo grupo de produtos: Sensação anormal ou reduzida (parestesia87).
Em casos de eventos adversos, notifique ao Sistema de Notificações em Vigilância Sanitária – NOTIVISA, ou à Vigilância Sanitária Estadual ou Municipal.
Informe ao seu médico, cirurgião-dentista ou farmacêutico o aparecimento de reações indesejáveis pelo uso do medicamento. Informe também à empresa através do seu serviço de atendimento.
O QUE FAZER SE ALGUÉM USAR UMA QUANTIDADE MAIOR DO QUE A INDICADA DESTE MEDICAMENTO?
Nenhum sintoma30 de superdose foi relatado.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
DIZERES LEGAIS
VENDA SOB PRESCRIÇÃO MÉDICA
Reg. MS n° 1.0683.0158
Farm. Resp.: Jônia Gurgel Moraes CRF/SP 10.616
Fabricado por:
Baxter AG, Viena, Áustria
Importado por:
Baxter Hospitalar Ltda.
CNPJ: 49.351.786/0001-80
Rua Henri Dunant, 1.383
Torre B – 12° andar – CEP: 04709-110
São Paulo – SP
SAC: 08000 12 5522






