

Fuzeon
PRODUTOS ROCHE QUÍMICOS E FARMACÊUTICOS S.A.
IDENTIFICAÇÃO DO MEDICAMENTO
Fuzeon®
enfuvirtida
Injetável 90 mg/mL
FORMA FARMACÊUTICA E APRESENTAÇÃO:
Pó liofilizado1 para solução injetável
Kit com 60 frascos-ampola com 108 mg de enfuvirtida; 60 frascos-ampola com 2,0 mL de água estéril para injeção2; 60 seringas de 3 mL; 60 seringas de 1 mL; 180 sachês de algodão (embebidos em álcool); 1 recipiente para descartar seringas.
VIA SUBCUTÂNEA3
USO ADULTO E PEDIÁTRICO A PARTIR DE 6 ANOS
COMPOSIÇÃO:
Cada frascos-ampola de Fuzeon® contém:
| enfuvirtida | 108 mg |
Excipientes: carbonato de sódio, manitol, hidróxido de sódio e ácido clorídrico4.
Cada frascos-ampola de reconstituição contém:
| água estéril | 1,1 mL |
INFORMAÇÕES AO PACIENTE
PARA QUE ESTE MEDICAMENTO É INDICADO?
Fuzeon® é indicado para o tratamento da infecção5 por HIV6-1 em combinação com outros agentes antirretrovirais em pacientes com tratamento prévio e com evidência de replicação do HIV6-1 a despeito da terapia antirretroviral. Não há estudos sobre o uso de Fuzeon® em pacientes virgens de tratamento antirretroviral.
COMO ESTE MEDICAMENTO FUNCIONA?
Enfuvirtida é o primeiro membro da classe de medicação chamada inibidor de fusão. Liga-se especificamente a uma proteína do HIV6, bloqueando a entrada do vírus7 na célula8 do ser humano, que é onde ele se multiplica.
QUANDO NÃO DEVO USAR ESTE MEDICAMENTO?
Não utilize Fuzeon® se for alérgico (tiver hipersensibilidade) à enfuvirtida ou a qualquer um de seus componentes.
Este medicamento é contraindicado a menores de seis anos.
Existem dados insuficientes que estabeleçam a dose de Fuzeon® em crianças menores de seis anos de idade.
O QUE DEVO SABER ANTES DE USAR ESTE MEDICAMENTO?
Você deve descontinuar o tratamento com Fuzeon® e procurar avaliação médica imediatamente caso apresente sinais9 ou sintomas10 sugestivos de reações de hipersensibilidade (vide item “8. Quais os males que este medicamento pode me causar?”). A terapia com Fuzeon® não deve ser reiniciada após esses sinais9 e sintomas10.
Se você recebeu Fuzeon®, mas não está infectado pelo HIV6 (em tratamento preventivo11 pós-exposição, por exemplo), o medicamento pode induzir à formação de anticorpos12 antienfuvirtida. Isso pode provocar resultado falso positivo no teste sorológico anti-HIV6 ELISA.
Quando um paciente portador de HIV6 inicia tratamento antirretroviral eficaz, que faz que sua imunidade13 se recupere, pelo menos, parcialmente, ele pode começar a reagir contra infecções14 com que estava convivendo sem perceber (tuberculose15, pneumocistose, citomegalovírus16), porque não tinha reação nenhuma a elas. Esse aumento da reação do organismo contra essas infecções14 oportunistas pode provocar o que se chama de síndrome17 da reconstituição imune (também chamada de doença da restauração imune ou síndrome17 da inflamação18 reconstituinte imune). Se isso ocorrer, você poderá precisar de avaliação e tratamento médico imediatamente.
Distúrbios autoimunes19, como doença de Graves e síndrome17 de Guillain-Barré, também foram relatados na definição de reconstituição imunológica; entretanto, o tempo para o aparecimento dos sintomas10 é variável e pode ocorrer vários meses após o início do tratamento.
Você deve ser sempre bem orientado(a) quanto aos cuidados e manuseio correto de seringas e agulhas, sobre a importância do descarte desses materiais no recipiente adequado e sobre o local de devolução desse recipiente, para que seja submetido à destruição adequada.
Caso alguma outra pessoa o(a) auxilie a aplicar a medicação, ela deve ser orientada a utilizar luvas e a procurar serviço médico imediatamente caso sofra algum acidente com material pontiagudo e cortante.
Até o momento, não há informações de que enfuvirtida possa causar doping. Em caso de dúvidas, consulte o seu médico.
Efeitos sobre a capacidade de dirigir veículos e operar máquinas
Não foram realizados estudos sobre a capacidade de dirigir veículos ou de operar máquinas durante a administração de Fuzeon®. Não há evidências de que Fuzeon® possa alterar a capacidade de dirigir veículos e de operar máquinas, porém, você deve levar em conta o perfil de eventos adversos de Fuzeon® (vide item “8. Quais os males que este medicamento pode me causar?”).
Gravidez20 e amamentação21
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Informe ao seu médico a ocorrência de gravidez20 na vigência do tratamento ou após seu término.
Este medicamento não deve ser utilizado por mulheres que estão amamentando.
Não se sabe se Fuzeon® é excretado no leite humano, entretanto, as mães devem ser instruídas a não amamentar, não somente por eventuais efeitos adversos sobre a criança como também em função dos potenciais riscos de transmissão do HIV6.
Principais interações medicamentosas
Fuzeon®, na dose recomendada de 90 mg, duas vezes ao dia, não inibiu o metabolismo22 da dapsona, debrisoquina, cafeína, mefentoína e clorzoxazona.
Não foi observada interação entre Fuzeon® e ritonavir, saquinavir e rifampicina, quando administrados em conjunto.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento. Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde23.
ONDE, COMO E POR QUANTO TEMPO POSSO GUARDAR ESTE MEDICAMENTO?
Cuidados de conservação
Os frascos não abertos de Fuzeon® devem ser conservados em temperatura ambiente (entre 15 e 30°C) e protegidos da luz. Se não for possível garantir o controle da temperatura, recomenda-se armazenar sob refrigeração de 2 a 8°C.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Descarte de medicamentos não utilizados e/ou com data de validade vencida
O descarte de medicamentos no meio ambiente deve ser minimizado. Os medicamentos não devem ser descartados no esgoto, e o descarte em lixo doméstico deve ser evitado. Utilize o sistema de coleta local estabelecido, se disponível.
Após preparo, manter Fuzeon® sob refrigeração de 2 a 8°C por no máximo 24 horas.
Características físicas e organolépticas do produto
O frasco-ampola de Fuzeon® contém pó branco a quase branco, estéril, que precisa ser reconstituído em solução com água estéril para injeção2 que é apresentado no frasco-ampola com líquido transparente. A solução reconstituída de Fuzeon® é límpida, incolor a ligeiramente amarelada.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS.
COMO DEVO USAR ESTE MEDICAMENTO?
Fuzeon® deve ser administrado via injeção subcutânea24 (logo abaixo da pele25).
Recomenda-se que a primeira injeção2 ocorra sob a supervisão de um profissional da saúde23 devidamente qualificado. Um profissional da saúde23 deverá reavaliar periodicamente se os procedimentos estão sendo feitos corretamente.
Preparação
Aspiração da água para injeção2
Você deve lavar as mãos26 com água e sabão antes que os frascos sejam preparados. Devem ser usadas luvas descartáveis se outra pessoa estiver aplicando o medicamento em você. Se Fuzeon® estiver sendo armazenado em geladeira, retire-o com a ampola de água para injeção2 e aguarde-os até que atinjam a temperatura ambiente. Após retirar as tampas plásticas dos frascos de Fuzeon® e de água, faça antissepsia (limpeza para desinfecção27) nas tampas de borracha de cada frasco com o chumaço de algodão fornecido embebido em álcool fornecido e deixe secar naturalmente.
Retire a água estéril com a seringa28 de 3 mL:
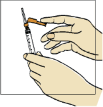
Pegue a seringa28 maior de 3 mL. Usando o dedo indicador, empurre para trás o protetor da agulha colorido em direção à seringa28.
Para remover a capa plástica incolor da agulha, empurre-a e puxe-a sem fazer muita força.
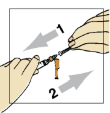
É preciso tomar cuidado durante os passos seguintes, para garantir que não se formem bolhas na solução e que não fique ar retido na seringa28 antes da injeção2.
Inicialmente aspire 1,1 mL de ar com a seringa28 de 3 mL. Introduza a agulha da seringa28 na tampa de borracha do frasco de água para injeção2 e aperte o êmbolo29 para injetar o ar da seringa28.
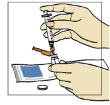
Vire o frasco de água para baixo, mantendo a ponta da agulha abaixo do nível da água. Puxe o êmbolo29 de volta lentamente até que a água chegue um pouco além da marca de 1,1 mL.
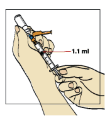
ATENÇÃO: O frasco contém 2 mL, ou seja, mais água que a quantidade necessária para a diluição. Você só deve aspirar 1,1 mL do frasco, para que a medicação seja preparada adequadamente.
Bata levemente na seringa28 para fazer que bolhas de ar, eventualmente presentes, subam para a superfície. Aperte suavemente o êmbolo29, para expelir o ar, e certifique-se de que exatamente 1,1 mL de água estéril ficou na seringa28.
Retire a agulha do frasco, tomando cuidado para não encostá-la nos dedos ou em qualquer outro objeto.
Descarte o frasco de água com o restante que não foi aspirado. A ÁGUA QUE SOBROU NO FRASCO DILUENTE NÃO DEVE SER REUTILIZADA.
Injetando água no frasco de Fuzeon® em pó
A água deve ser acrescentada ao frasco de Fuzeon®. Antes de injetá-la, bata levemente no frasco de
Fuzeon®, para que o pó se desprenda das paredes do frasco.
Introduza, com leve inclinação, a agulha da seringa28 através da tampa de borracha do frasco de Fuzeon®. Aperte lentamente o êmbolo29 fazendo que a água escorra lentamente pela lateral interna do frasco, para evitar formação de espuma. Depois de acrescentar toda a água, retire a seringa28 do frasco.
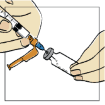
Para proteger a agulha, segure o corpo da seringa28 e pressione o protetor da agulha colorido contra a mesa. Você ouvirá um clique. Não use a outra mão30 para auxiliá-lo(a), tampouco cubra a agulha com a capa incolor, pois você pode se machucar durante essa tentativa.
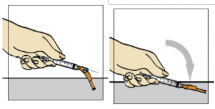
Despreze a seringa28 usada no recipiente fornecido para o seu descarte.
Misturando a água com o pó de Fuzeon®
Para misturar, bata com um dedo suavemente no frasco de Fuzeon®, para ajudar a dissolver o pó. A solução não deve ser agitada nem virada para misturar, porque isso provoca formação de bolhas.
Rodar o frasco suavemente entre as mãos26 pode ajudar a misturar.
Aguarde até que o pó se dissolva completamente e que eventuais bolhas restantes desapareçam. Isso habitualmente demora de dez a 20 minutos, mas pode demorar até 45 minutos. É muito importante que todo o pó do medicamento se dissolva, para que seja aplicada a dose. Avalie visualmente a solução e devolva o produto ao profissional da saúde23 antes de usar, caso a solução tenha partículas. Não deve haver aderências sólidas nas paredes ou na base do frasco. Caso persistam bolhas na solução, bata ligeiramente no frasco. Depois de reconstituído, Fuzeon® deve ser aplicado imediatamente. Você pode preparar um frasco com antecedência ou preparar dois frascos ao mesmo tempo. Nesse caso, não se esqueça de utilizar um kit diferente para cada frasco (água, seringas, agulhas e algodão). O frasco que será usado mais tarde deve ser colocado sob refrigeração de 2 a 8 ºC (nunca guarde Fuzeon® na seringa28) logo após a reconstituição, podendo ser utilizada em até 24 horas. Alguns minutos antes da aplicação, retire o frasco da geladeira, já que é necessário que ele fique em temperatura ambiente antes da aplicação da injeção2.
Uso de Fuzeon® diluído
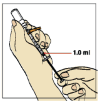
Use a seringa28 de segurança de 1 mL.
Proceda com a seringa28 de 1 mL da mesma forma que o orientado nas Figuras 1 e 2. Aspire 1 mL de ar. Cuidado para não ultrapassar a marca limite de 1 mL da seringa28.
Introduza a agulha na tampa de borracha do frasco de Fuzeon®, injete o ar da seringa28 e vire suavemente o frasco.
Mantenha a ponta da agulha abaixo da superfície da solução, para evitar bolhas de ar. Puxe o êmbolo29 lentamente até retirar o maior volume possível de solução de Fuzeon®. Cuidado para não ultrapassar a marca limite de 1 mL da seringa28.
Bata suavemente na seringa28 para fazer com que as bolhas de ar subam para a superfície. Aperte o êmbolo29 para expelir o ar de volta para o frasco, certificando-se de deixar 1 mL de Fuzeon® no corpo da seringa28.
Aplicação
O local de aplicação da injeção2 de Fuzeon® deve ser alternado para evitar injeções repetidas na mesma área. Os locais de injeção2 mais comuns são abdome31 (barriga), parte anterior da coxa32 e lateral externa do braço. Essas áreas tendem a apresentar mais gordura33 e, por isso, reduzem o risco de injetar inadvertidamente em local profundo demais (no músculo em vez de sob a pele25), o que pode provocar reações mais severas. Evite a área do abdome31 (barriga) em torno do umbigo34 e áreas que já apresentem reações. Não é recomendável que Fuzeon® seja injetado na face35.
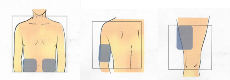
As aplicações nos períodos da manhã e da noite nunca devem ser feitas no mesmo local.
Limpe, com o chumaço de algodão fornecido embebido em álcool, a área em que a injeção2 será aplicada e pegue uma prega de pele25.
Introduza a agulha na pele25 fazendo um ângulo de 45º com a seringa28.
Ao introduzir metade da agulha na pele25, solte a prega da pele25 e passe a segurar o corpo da seringa28 para evitar que se desloque. Pressione lentamente o êmbolo29 para baixo para injetar Fuzeon®.
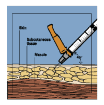
Após o término da aplicação da injeção2 de Fuzeon®, para proteger a agulha, segure o corpo da seringa28 e pressione o protetor da agulha colorido contra a mesa, conforme Figura 6. Você ouvirá um clique. Não use a outra mão30 para auxiliá-lo(a), tampouco cubra a agulha com a capa incolor, pois você pode se machucar durante essa tentativa. Despreze a seringa28 usada no recipiente fornecido para o seu descarte.
Não é permitido misturar qualquer outra substância à solução com Fuzeon® para ser injetada conjuntamente.
ATENÇÃO: CUIDADO! DESCARTE AS SERINGAS NO RECIPIENTE FORNECIDO.É expressamente proibido o descarte de seringas utilizadas e materiais sujos de sangue36 fora dos recipientes plásticos fornecidos em função dos riscos de transmissão de HIV6 e de outras doenças transmissíveis a outras pessoas. O descarte das seringas deve ser feito no recipiente fornecido e, quando atingida a sua capacidade volumétrica, ele deve ser recolhido à unidade de saúde23 mais próxima para a sua completa destruição, conforme orientação de seu médico. Mantenha o recipiente de descarte e o material do kit fora do alcance de crianças. Caso alguém que o esteja auxiliando a aplicar a medicação se machuque com a agulha da seringa28 de aplicação (1 mL), ele deve entrar em contato com um profissional da saúde23 imediatamente. Os frascos, tanto de Fuzeon® quanto de água, devem ser utilizados uma única vez. O que sobrar em qualquer um dos frascos deve ser descartado. |
Posologia
A dose recomendada de Fuzeon® é de 90 mg, duas vezes ao dia, injetada por via subcutânea3.
Fuzeon® deve ser administrado em conjunto com outros antirretrovirais para obter melhores resultados.
Instruções especiais de dosagem
Pacientes pediátricos: em pacientes pediátricos de seis a 16 anos de idade, a dose recomendada de Fuzeon® é de 2 mg/kg, duas vezes ao dia, até uma dose de, no máximo, 90 mg, duas vezes ao dia, injetada por via subcutânea3.
Pacientes com funcionamento inadequado dos rins37: não são recomendados ajustes de dose a pacientes com problemas nos rins37, incluindo aqueles que estejam recebendo hemodiálise38.
Pacientes com funcionamento inadequado do fígado39: não se encontram disponíveis dados para estabelecer a recomendação de dose para esses pacientes.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento. Não interrompa o tratamento sem o conhecimento do seu médico.
O QUE DEVO FAZER QUANDO EU ME ESQUECER DE USAR ESTE MEDICAMENTO?
Aplique Fuzeon® assim que se lembrar e depois aplique a dose seguinte no horário habitual. Não aplique a dose esquecida se faltarem menos de seis horas para a dose seguinte. Nunca utilize dose dobrada para compensar a dose esquecida.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
QUAIS OS MALES QUE ESTE MEDICAMENTO PODE ME CAUSAR?
Reações de hipersensibilidade (alergia40)
Um pequeno número de relatos de reações de hipersensibilidade (alergia40) sistêmica foi associado à terapia com Fuzeon®: ficar vermelho (ruborizado), febre41, náuseas42, vômitos43, calafrios44, tremores, hipotensão45 (pressão baixa), elevação de enzimas hepáticas46 (substâncias dosadas no sangue36 para verificar lesão47 do fígado39), reação primária de imunocomplexos48 (formação de aglomerados de anticorpos12 com outras substâncias), distúrbio respiratório e glomerulonefrite49 (inflamação18 dos glomérulos50, que ficam nos rins37). Houve o relato de um caso de síndrome17 de Guillain-Barré (doença em que a pessoa fica com paralisia51 em partes do corpo, por causa de alterações na condução do estímulo nos nervos) observado em estudos clínicos. Caso você apresente sinais9 ou sintomas10 sugestivos de reação de hipersensibilidade, descontinue o tratamento com Fuzeon® e procure atendimento médico imediatamente. A terapia com Fuzeon® não deve ser reiniciada após sinais9 e sintomas10 sugestivos de reação de hipersensibilidade relacionada ao uso de Fuzeon®. A eosinofilia52 (aumento de um tipo de glóbulo branco que indica alergia40 ou presença de vermes) emergente com o tratamento não foi associada a eventos clínicos de hipersensibilidade.
Reações no local de injeção2
As reações adversas relatadas com maior frequência após a administração de Fuzeon® foram reações no local de aplicação da injeção2 (RLIs), que ocorreram em 98% dos pacientes em dois estudos clínicos. Porém, somente 4% dos pacientes descontinuaram o uso de Fuzeon® por causa das reações no local de aplicação da injeção2. A grande maioria das reações no local de aplicação da injeção2 ocorreu dentro da primeira semana de
administração de Fuzeon® e sem limitação das atividades usuais. A gravidade da dor e do desconforto associada às reações no local de aplicação da injeção2 não aumentou com a continuação do tratamento. Os sinais9 e sintomas10 que caracterizam as reações no local de aplicação da injeção2 geralmente duraram até sete dias, e o número de lesões53 evidentes foi igual ou inferior a cinco em 72% dos pacientes que apresentavam lesões53 evidentes. As infecções14 no local de aplicação da injeção2 incluíram abscesso54 e celulite55, ocorrendo em menos de 1,5% dos pacientes.
A seguir, encontra-se a frequência dos sinais9 e sintomas10 que caracterizam reações no local de aplicação da injeção2:
Reação muito comum (ocorre em 10% dos pacientes que utilizam este medicamento): dor / desconforto, eritema56 (pele25 vermelha), endurecimento, nódulos e cistos, prurido57 (coceira), equimose58 (mancha roxa).
Outros eventos adversos
Os eventos adversos mais frequentes reportados em pacientes que receberam Fuzeon®, excluindo as reações no local de aplicação da injeção2, foram diarreia59 e náuseas42. A adição de Fuzeon® à terapia antirretroviral prévia geralmente não aumentou a frequência ou gravidade da maioria dos eventos adversos.
Esses eventos são classificados de acordo com a frequência, como podem ser verificados a seguir:
Reação muito comum (ocorre em 10% dos pacientes que utilizam este medicamento):
- Distúrbios do sistema nervoso60: neuropatia periférica61 (alteração dos ramos nervosos periféricos, geralmente resultando em alteração da sensibilidade).
- Investigações: perda de peso.
Reação comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento):
- Infecções14 e infestações: sinusite62, gripe63 (influenza64), papiloma cutâneo65 (tumor66 na pele25), pneumonia67, otite68 (inflamação18 da orelha69).
- Distúrbios do sangue36 e sistema linfático70: linfoadenopatia71 (linfonodos72 ou gânglios73 aumentados).
- Distúrbios do sistema imunológico74: hipersensibilidade (alergia40).
- Distúrbios do metabolismo22 e nutrição75: apetite diminuído, anorexia76 (falta de apetite), hipertrigliceridemia (elevação dos triglicérides77), diabetes78.
- Distúrbios psiquiátricos: ansiedade, pesadelos, irritabilidade.
- Distúrbios do sistema nervoso60: hipoestesia79 (diminuição da sensibilidade), distúrbios de atenção, tremores.
- Distúrbios oculares: conjuntivite80.
- Distúrbios da orelha69 e labirinto81: vertigens82 (tipo de tontura83 em que o paciente perde o equilíbrio).
- Distúrbios respiratórios, torácicos e do mediastino84: congestão nasal.
- Distúrbios gastrintestinais: pancreatite85 (inflamação18 do pâncreas86), doença do refluxo gastroesofágico87 (refluxo do alimento do estômago88 para o esôfago89).
- Distúrbios da pele e tecido subcutâneo90: pele25 seca, eczema91 seborreico (tipo de caspa), eritema56 (pele25 avermelhada), acne92 (espinhas).
- Distúrbios musculoesqueléticos e do tecido conjuntivo93: mialgia94 (dor muscular). Distúrbios do rim95 e vias urinárias: cálculo96 renal97.
- Distúrbios gerais e condições do local de administração: síndrome17 tipo influenza64 (gripal), fraqueza.
- Investigações: aumento dos triglicérides77 (gorduras do sangue36), hematúria98 (sangue36 na urina99).
Em estudos clínicos, observou-se maior índice de pneumonia67 entre os indivíduos tratados com Fuzeon® juntamente com outros antivirais. No entanto, devido ao fato de não estar claro se a incidência100 aumentada de pneumonia67 estava relacionada ao uso de Fuzeon®, um novo estudo foi realizado. Os resultados sugerem que a incidência100 de pneumonia67 está relacionada ao HIV6 e não ao tratamento com Fuzeon®.
Anormalidades laboratoriais
A maioria dos pacientes não apresentou mudança do grau de toxicidade101 de qualquer parâmetro laboratorial durante o estudo. A eosinofilia52 decorrente do tratamento (contagem de eosinófilos102 maior que o limite superior da normalidade de 0,7 × 109/L) ocorreu com incidência100 maior em pacientes tratados com Fuzeon® (12,9 pacientes por 100 pacientes/ano), em comparação com o braço de controle OB (5,6 pacientes por 100 pacientes/ano).
Eventos adversos adicionais
Os seguintes eventos adversos ou anormalidades laboratoriais foram reportados como ocorrendo em mais que 2% dos pacientes ou mais frequentemente nos pacientes que receberam Fuzeon®: candidíase103 oral (infecção5 da boca104 pelo fungo105 Candida albicans, popularmente conhecido como “sapinho”), herpes simples, foliculites (inflamação18 do folículo106 dos pelos), insônia, depressão, tonturas107 (excluindo vertigem108), distúrbios no paladar109, cefaleia110, tosse, dor na região superior do abdome31, constipação111 intestinal, dor de garganta112, prurido57 (coceira), sudorese113 noturna, sudorese113 excessiva, artralgia114 (dor nas articulações115), dor nas costas116, dor em membros, câimbras117 musculares, astenia118 (desânimo), aumentos da gama GT, amilase, lipase e AST (substâncias dosadas em exames de sangue36 para verificar se existem alterações do fígado39 e do pâncreas86). A relação causal desses eventos com Fuzeon® não foi estabelecida.
Pediátricos
As reações adversas observadas durante os estudos clínicos com Fuzeon® foram similares às observadas em adultos submetidos ao tratamento.
Experiência pós-comercialização
Distúrbios da pele e tecido subcutâneo90: amiloidose119 cutânea120 (depósitos na pele25 de uma proteína anormal) no local da injeção2.
Informe ao seu médico, cirurgião-dentista ou farmacêutico o aparecimento de reações indesejáveis pelo uso do medicamento. Informe também à empresa através do seu serviço de atendimento.
O QUE FAZER SE ALGUÉM USAR UMA QUANTIDADE MAIOR DO QUE A INDICADA DESTE MEDICAMENTO?
Não há antídoto121 específico para superdose de Fuzeon®, e o tratamento deve consistir de medidas gerais de suporte.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
DIZERES LEGAIS
USO SOB PRESCRIÇÃO MÉDICA
VENDA PROIBIDA AO COMÉRCIO
MS – 1.0100.0617
Farm. Resp.: Tatiana Tsiomis Díaz – CRF-RJ nº 6942
Fabricado para F. Hoffmann-La Roche Ltd., Basileia, Suíça, por Roche Diagnostics GmbH, Mannheim, Alemanha
Embalado por F. Hoffmann-La Roche Ltd., Kaiseraugst, Suíça e Ivers-Lee AG, Burgdorf, Suíça
Registrado, importado e distribuído no Brasil por
Produtos Roche Químicos e Farmacêuticos S.A
Est. dos Bandeirantes, 2.020 CEP 22775-109 – Rio de Janeiro /RJ
CNPJ 33.009.945/0023-39
SAC 0800 7720 289






