Copaxone
TEVA FARMACÊUTICA LTDA.
IDENTIFICAÇÃO DO MEDICAMENTO
COPAXONE®
acetato de glatirâmer
APRESENTAÇÕES
Solução injetável 20 mg/mL em seringa1 preenchida.
COPAXONE® (acetato de glatirâmer) é apresentado em embalagem contendo 28 seringas preenchidas de uso único (agulhas 29 G½”) com 1 mL de solução estéril para injeção2.
USO SUBCUTÂNEO3
USO ADULTO
COMPOSIÇÃO
Cada seringa1 preenchida de 1 mL de COPAXONE® (acetato de glatirâmer) contém:
| acetato de glatirâmer* | 20 mg |
| excipiente q.s.p. | 1 ml |
Excipientes: manitol, água para injetáveis.
Acetato de glatirâmer, a substância ativa de COPAXONE®, também conhecido como copolímero-1, é o sal acetato de polipeptídeos sintéticos, contendo 4 aminoácidos de ocorrência natural: ácido L-glutâmico, L-alanina, L-tirosina4 e L-lisina, em fração molar média de 0,141; 0,427; 0,095 e 0,338, respectivamente. O peso molecular médio do acetato de glatirâmer está entre 5.000 e 9.000 daltons.
Cada 20 mg de acetato de glatirâmer equivalem a 18 mg de glatirâmer.
O pH da solução injetável é de aproximadamente 5,5 a 7,0.
INFORMAÇÕES AO PACIENTE
Leia atentamente esta bula antes de começar a tomar este medicamento, pois ela contém informações importantes para você.
- Guarde esta bula. Você pode precisar ler novamente.
- Se você tiver qualquer dúvida, pergunte ao seu médico ou farmacêutico.
- Este medicamento foi receitado para você. Não o forneça a outras pessoas. Ele pode ser prejudicial para elas, mesmo que os sintomas5 delas sejam os mesmos que os seus.
- Se você tiver quaisquer efeitos indesejáveis, fale com seu médico ou farmacêutico. Isso inclui os possíveis efeitos indesejáveis não mencionados nesta bula.
PARA QUE ESTE MEDICAMENTO É INDICADO?
COPAXONE® (acetato de glatirâmer) é indicado na redução da frequência de recidivas6 (surtos) nos pacientes com esclerose múltipla7 remissiva recidivante8* (EMRR).
Os pacientes tratados com este medicamento tiveram poucas reincidências.
COPAXONE® também é indicado no tratamento de pacientes que tiveram um primeiro episódio clínico bem definido e que apresentem alto risco de desenvolver a esclerose múltipla7 clinicamente definida (EMCD).
O termo remissiva recidivante8 é equivalente ao termo remitente-recorrente.
COMO ESTE MEDICAMENTO FUNCIONA?
Estudos clínicos mostraram que COPAXONE® (acetato de glatirâmer) reduziu a frequência de recidivas6 nos pacientes com esclerose múltipla7 remissiva recidivante8. Acredita-se que ele atue no sistema nervoso central9 inibindo o processo inflamatório da esclerose múltipla7.
QUANDO NÃO DEVO USAR ESTE MEDICAMENTO?
COPAXONE® (acetato de glatirâmer) é contraindicado para pacientes10 com hipersensibilidade (alergia11) conhecida ao acetato de glatirâmer ou ao manitol.
O QUE DEVO SABER ANTES DE USAR ESTE MEDICAMENTO?
Advertências e Precauções
A administração deve ser feita exclusivamente por via subcutânea12 (injeção2 no tecido13 imediatamente abaixo da pele14). COPAXONE® (acetato de glatirâmer) não deve ser administrado por via intravenosa (injeção2 lenta na veia) ou via intramuscular (injeção2 aplicada no interior de um músculo).
Siga exatamente as instruções para auto aplicação, de acordo com as instruções de uso, para garantir a segurança de administração.
Baseado em dados atuais, não é necessária nenhuma precaução especial para pacientes10 envolvidos em atividades que necessitem de atenção, como dirigir veículos ou operar máquinas.
Uso em idosos, crianças e outros grupos de risco
Uso em Idosos: COPAXONE® não foi estudado especificamente em pacientes idosos.
Uso Pediátrico: A segurança e eficácia de COPAXONE® em crianças abaixo de 18 anos ainda não foram estabelecidas. Não foram realizados estudos clínicos em crianças ou adolescentes. Não existem informações suficientes sobre o uso de COPAXONE® em crianças com menos de 12 anos de idade que permita a recomendação deste uso. Portanto, COPAXONE® não deve ser utilizado nesta população.
Interação com outros medicamentos
As interações entre COPAXONE® e os demais fármacos ainda não foram integralmente avaliadas.
Não se conhece, até o momento, alguma interação possível de COPAXONE® com alimentos ou com exames laboratoriais.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento. Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde15.
Gravidez16 e Lactação17
Informe seu médico sobre a ocorrência de gravidez16 na vigência do tratamento ou após o seu término. COPAXONE® não é recomendado para uso durante a gravidez16. Informe ao médico se está amamentando. Não há informações sobre a passagem de COPAXONE® para o leite materno.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica.
Efeitos sobre a capacidade de dirigir e operar máquinas
Baseado nos dados atuais, não é necessária nenhuma precaução especial para pacientes10 envolvidos em atividades que requerem alerta mental, como dirigir veículos ou operar máquinas.
Interrupção do Tratamento
Não interromper o tratamento sem o conhecimento do seu médico.
Foi observado em estudo clínico que alguns pacientes abandonaram o tratamento devido a alguma reação adversa, sendo as mais comuns: reações no local da injeção2, dispneia18 (falta de ar), urticária19 (reação alérgica20 manifestada por alterações na pele14), vasodilatação (dilatação dos vasos sanguíneos21), hipersensibilidade, gravidez16 não programada, depressão, taquicardia22 (aceleração dos batimentos cardíacos), vertigem23 (tontura24) e tremor.
ONDE, COMO E POR QUANTO TEMPO POSSO GUARDAR ESTE MEDICAMENTO?
COPAXONE® (acetato de glatirâmer) deve ser conservado sob refrigeração (temperatura entre 2°C e 8°C), protegido da luz. O tempo e a condição de armazenamento são responsabilidades do paciente.
O medicamento não deve ser congelado. Se o medicamento for congelado, ele deve ser descartado.
Se o medicamento não puder ser armazenado sob refrigeração, ele pode ser armazenado em temperatura ambiente (entre 15ºC e 30ºC) por até um mês. O medicamento não deve ser mantido nesta temperatura por mais de um mês. Após este período de um mês, se o medicamento não for utilizado e estiver em sua embalagem original, ele deve ser armazenado novamente sob refrigeração (entre 2ºC e 8ºC).
Este medicamento é sensível à luz, mantenha-o dentro do cartucho.
Não utilize o medicamento caso ele apresente partículas.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Características físicas e organolépticas: solução límpida, incolor a levemente amarelada, estéril e apirogênica.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
COMO DEVO USAR ESTE MEDICAMENTO?
A solução injetável subcutânea12 de COPAXONE® (acetato de glatirâmer) é límpida, incolor a levemente amarelada e deve estar livre de partículas.
A dose recomendada para adultos é de 20 mg ao dia, (uma seringa1 preenchida de COPAXONE®) administrada por via subcutânea12. A dose e a frequência de administração devem ser indicadas pelo médico. A seringa1 preenchida de COPAXONE® solução injetável deve ser usada somente uma única vez.
COPAXONE® deve ser aplicado à mesma hora, todos os dias.
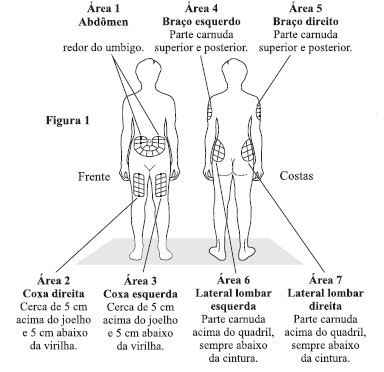
Os locais indicados para a auto injeção2 são os braços, abdômen, lombar e coxas25. Deve-se usar um local diferente para injeção2 a cada dia, sugerindo-se seguir o sentido horário ou anti-horário. O rodízio nos locais de injeção2 tem como objetivo reduzir a propensão a irritações locais ou dor resultante da injeção2.
Antes de utilizar COPAXONE® leia cuidadosamente todas as instruções de uso em bula.
Instruções de uso
- Remova somente um blister, contendo a seringa1 preenchida com a solução injetável, da embalagem e guarde todas as seringas não utilizadas novamente sob refrigeração (entre 2°C e 8°C).
- Aguarde, no mínimo 20 minutos, para que a seringa1 preenchida com solução atinja a temperatura ambiente.
- Lave suas mãos26 com água e sabão, para prevenir infecções27, e não toque em seu cabelo28 ou pele14 após a lavagem das mesmas.
- Remova a seringa1 preenchida do blister, retirando a película protetora. Antes do uso, observe o líquido da seringa1. Se o líquido estiver turvo ou apresentar alguma partícula, não utilize a seringa1 e ligue para o atendimento ao consumidor. Se o líquido estiver límpido, coloque a seringa1 em uma superfície limpa. Se você observar pequenas bolhas de ar dentro da seringa1, não tente expulsá-las antes de injetar o medicamento para evitar perdas de medicamento.
- Escolha o local da injeção2, utilizando a figura 1. Escolha o local de injeção2, considerando as 7 regiões descritas na figura 1.. Alterne o local de injeção2 todos os dias, isto reduz as chances de irritação ou dor no local da injeção2. Não aplique na mesma área mais que uma vez durante a semana. Existem alguns locais em seu corpo que dificultam a auto aplicação (como a parte de trás do braço), por isso você pode necessitar de ajuda.
- Limpe a área escolhida para a injeção2 com um algodão umedecido com álcool isopropílico 70% e deixe o local secar.
- Segure a seringa1 como se fosse uma caneta. Remova a proteção da agulha.
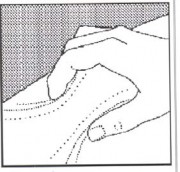
- Com a outra mão29, pince suavemente uma porção de aproximadamente 5 centímetros de sua pele14 entre o dedo indicador e o polegar (Figura 2).
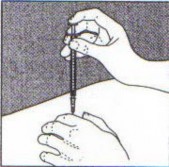
- Insira a agulha, sob um ângulo de 90º, dentro de pele14 (Figura 3). Injete o medicamento empurrando o êmbolo30 constantemente para baixo até a seringa1 se esvaziar. A aplicação deve durar aproximadamente 10 segundos.
- Puxe a seringa1 e a agulha até sair totalmente da pele14.
- Pressione um chumaço de algodão seco no local da injeção2 por alguns segundos. Não massageie o local da injeção2.
- Descarte a seringa1 no recipiente de descarte apropriado.
Descarte do material usado
Descarte a seringa1 preenchida com a agulha num recipiente resistente a perfurações e seguro.
Posologia
A dose recomendada para adultos de COPAXONE® para o tratamento de esclerose múltipla7 remissiva recidivante8 é de 20 mg/dia, injetada por via subcutânea12.
Não foi realizado nenhum estudo específico para avaliação da intercambialidade entre as duas concentrações (20 mg/mL e 40 mg/mL). Seu médico deverá orientá-lo sobre a concentração e posologia adequada para o seu tratamento.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento. Não interrompa o tratamento sem o conhecimento do seu médico.
O uso inadequado do medicamento pode mascarar ou agravar sintomas5.
Consulte um clínico regularmente. Ele avaliará corretamente a evolução do tratamento. Siga corretamente suas orientações.
O QUE DEVO FAZER QUANDO EU ME ESQUECER DE USAR ESTE MEDICAMENTO?
Se você se esquecer de aplicar uma dose, aplique assim que você se lembrar. Não dobre a dose para compensar a dose esquecida. Aplique a próxima dose somente após 24 horas.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
QUAIS OS MALES QUE ESTE MEDICAMENTO PODE ME CAUSAR?
Como todos os medicamentos, COPAXONE® (acetato de glatirâmer) pode causar reações adversas, embora nem todas as pessoas as apresentem.
Se você apresentar algum dos sintomas5 descritos abaixo, comunique seu médico imediatamente.
Avise seu médico de qualquer evento adverso que você tenha enquanto estiver fazendo uso de COPAXONE®.
As reações adversas mais frequentemente observadas nos estudos clínicos conduzidos com COPAXONE® foram reações no local da injeção2, tendo sido relatadas pela maioria dos pacientes em tratamento com COPAXONE®. Nos estudos clínicos controlados, a proporção de pacientes que relataram estas reações adversas, ao menos uma vez, após tratamento com COPAXONE® (70%) foi superior quando comparado com os pacientes que receberam placebo31 (37%). As reações no local da injeção2 mais comumente relatadas nos estudos clínicos e no período pós-comercialização foram: eritema32 (rubor), algia (dor), nódulo33, prurido34, edema35, inflamação36, hipersensibilidade (alergia11) e raras ocorrências de lipoatrofia37 (atrofia38 localizada do tecido gorduroso39 abaixo da pele14) e necrose40 de pele14 (lesão41 grave com morte de células42 da pele14).
Lipoatrofia37 e necrose40 de pele14
Nos locais de injeção2, lipoatrofia37 localizada e, raramente, necrose40 de pele14 foram relatadas após o período de comercialização. A lipoatrofia37 pode ocorrer no início do tratamento (algumas vezes após vários meses) e é considerada como sendo permanente. Não existe tratamento conhecido para lipoatrofia37. Para auxiliar na possível diminuição destes eventos, o paciente deve ser orientado a seguir adequadamente as técnicas de injeção2 e fazer rodízio dos locais de injeção2 diariamente.
Reação Imediata Pós-Injeção2
Reação adversa associada com ao menos um dos seguintes sintomas5 foi descrita como Reação Imediata Pós-Injeção2: vasodilatação (rubor), dor torácica (dor no peito43), dispneia18 (falta de ar), palpitação44 (batimento acelerado ou irregular do coração45) ou taquicardia22, ansiedade, sensação de fechamento da garganta46 e urticária19 (reação alérgica20 manifestada por alterações na pele14). Esta reação pode ocorrer em minutos após a aplicação de COPAXONE®. Ao menos um dos sintomas5 componentes da Reação Imediata Pós-Injeção¹ foi relatado ao menos uma vez por 31% dos pacientes em tratamento com COPAXONE®, comparada com 13% dos pacientes que receberam placebo31. Em geral, estes sintomas5 têm seu início vários meses após o início do tratamento, embora possam ocorrer no início do curso do tratamento e, certos pacientes podem apresentar um ou vários destes sintomas5. Não há certeza se o conjunto desses sintomas5 chega a constituir uma síndrome47 específica. Durante o período de pós-comercialização, houve relatos de pacientes com sintomas5 similares que receberam atendimento médico de emergência48. Não se sabe se estes episódios são mediados por um mecanismo imunológico ou não, ou se vários episódios similares observados em um dado paciente têm mecanismos idênticos ou não.
Dor torácica (dor no peito43)
Em 5 estudos clínicos controlados com placebo31, aproximadamente 13% dos pacientes com esclerose múltipla7 expostos ao acetato de glatirâmer comparados a 6% dos pacientes expostos ao placebo31 apresentaram, pelo menos, um episódio que foi descrito como dor torácica transitória. Enquanto alguns desses episódios ocorreram no contexto das reações imediatas após injeção2, descritas acima, alguns ocorreram em outros momentos. A relação temporal da dor torácica com a injeção2 do acetato de glatirâmer não foi estabelecida, embora a dor fosse passageira (geralmente durando apenas alguns minutos) e muitas vezes não relacionada a outros sintomas5, aparentemente sem consequências clinicas. Alguns pacientes apresentaram mais de um episódio, e os episódios normalmente começaram, pelo menos, um mês depois do início do tratamento. Não se conhece a patogênese49 do sintoma50.
Estudos Clínicos
Todas as reações adversas que foram mais frequentemente relatadas por pacientes tratados com COPAXONE® vs. pacientes que receberam placebo31 são apresentadas na tabela abaixo. Estes dados foram obtidos de quatro estudos clínicos pivotais, duplo-cegos, controlados por placebo31, nos quais 512 pacientes foram tratados com COPAXONE® e 509 pacientes receberam placebo31, por até 36 meses. Três estudos clínicos em esclerose múltipla7 remissiva recidivante8 (EMRR) incluíram 269 pacientes tratados com COPAXONE® e 271 pacientes receberam placebo31, por até 35 meses. O quarto estudo clínico, conduzido em pacientes que apresentaram primeiro episódio clínico bem definido e que apresentavam alto risco de desenvolver esclerose múltipla7 clinicamente definida (EMCD), incluiu 243 pacientes em tratamento com COPAXONE® e 238 pacientes recebendo placebo31, por até 36 meses.
Entre os 512 pacientes tratados com COPAXONE® em estudos controlados com placebo31, aproximadamente 5% deles abandonou o tratamento devido a uma reação adversa. As reações adversas mais comumente associadas à interrupção foram: reações no local da injeção2, dispneia18 (falta de ar), urticária19 (reação alérgica20 manifestada por alterações na pele14), vasodilatação (dilatação dos vasos sanguíneos21), hipersensibilidade (alergia11), gravidez16 não programada, depressão, taquicardia22 (aceleração dos batimentos cardíacos), vertigem23 (tontura24) e tremor. As reações adversas mais comuns foram: reações no local da injeção2, vasodilatação, vermelhidão na pele14, dispneia18, e dor torácica.
Uma vez que os estudos são realizados em condições bastante variadas, as taxas de reações adversas observadas durante os estudos clínicos de um medicamento não podem ser diretamente comparados às taxas de estudos com outro medicamento, além de poderem não refletir as taxas que são observadas na prática clínica.
¹ Os componentes individuais da Reação Imediata Pós-Injeção2 são listados na tabela abaixo da respectiva frequência.
As reações adversas relatadas a seguir estão classificadas de acordo com classes de sistemas de órgãos. O agrupamento por frequência das reações adversas é definido de acordo com a seguinte convenção: muito comum (≥ 1/10); comum (≥ 1/100, < 1/10); incomum (≥ 1/1.000, < 1/100); rara (≥ 1/10.000, < 1/1.000), muito rara (< 1/10.000), desconhecido: frequência não pôde ser estimada com base nos dados disponíveis.
|
Classe de Sistema |
Muito Comum |
Comum (> 1/100, ≤ 1/10) |
Incomum (> 1/1.000, ≤ 1/100) |
|
Infecções27 e Infestações |
Infecção51, gripe52 |
Bronquite, gastroenterite53 (inflamação36 |
Abscesso61 (acúmulo de pus62 no |
| Neoplasias71 benignas, malignas e inespecíficas (incluindo cistos e pólipos72) |
Neoplasia73 benigna de pele14 (tumor74 benigno de pele14), neoplasia73 (tumor74 benigno) |
Câncer75 de pele14 | |
| Distúrbios do sistema sanguíneo e linfático76 | Linfadenopatia* (crescimento de uma ou mais ínguas, especialmente das situadas em pescoço77, axilas e virilhas) |
Leucopenia78 (diminuição dos leucócitos79, células42 de defesa presentes no sangue80), esplenomegalia81 (aumento do baço82), trombocitopenia83 (diminuição do número de plaquetas84 no sangue80) |
|
| Distúrbios do sistema imune85 | Hipersensibilidade (alergia11) | ||
| Distúrbios endócrinos | Bócio86 (aumento do volume da glândula87 tireoide88), hipertireoidismo89 (doença caracterizada pelo excesso de produção de hormônio90 pela glândula87 tireoide88) |
||
| Distúrbios do metabolismo91 e nutrição92 | Aumento de peso* | Intolerância ao álcool, gota93 (distúrbio metabólico produzido pelo aumento na concentração de ácido úrico no sangue80) |
|
| Distúrbios psiquiátricos | Ansiedade*, depressão | Nervosismo | Sonhos anormais, alucinação94, hostilidade (agressividade), mania, tentativa de suicídio |
| Distúrbios do sistema nervoso95 | Disgeusia96 (alteração do paladar97), enxaqueca98, alterações da fala, síncope99 (desmaio), tremor* | Convulsão100, mioclonia101 (Contração muscular involuntária102), estupor (diminuição importante ou ausência dos movimentos voluntários e da reatividade normal a estímulos externos), defeitos de campo visual103 |
|
| Distúrbios oculares | Diplopia104 (visão105 dupla), distúrbios oculares* |
Catarata106 (lesão41 ocular que atinge e torna opaco o cristalino107, que é a lente natural existente no globo ocular responsável pela focalização da visão105 para longe e para perto), lesão41 de córnea108, secura ocular, ptose109 palpebral (situação em que a pálpebra superior cobre o olho110 mais do que o normal), midríase111 (dilatação da pupila) |
|
| Distúrbios cardíacos | Palpitações112*, taquicardia22* | Bradicardia113 sinusal (é quando o ritmo do coração45, em repouso, é mais lento que o normal) |
|
| Distúrbios vasculares114 | Vasodilatação* (dilatação dos vasos sanguíneos21) |
Veia varicosa (veias115 dilatadas, com volume aumentado, tornando-se tortuosas e alongadas com o decorrer do tempo) |
|
| Distúrbios respiratórios, torácicos e do mediastino116 | Dispneia18* (falta de ar) |
Tosse, rinite58 sazonal | Epistaxe117 (sangramento nasal), hiperventilação (aumento da quantidade de ar que ventila os pulmões118), laringoespasmo (fechamento da glote119 devido à contração dos músculos laríngeos120) |
| Distúrbios gastrintestinais | Náusea121* | Caries122 dentais, disfagia123 (dificuldade para engolir), vômito124* | Colite125 (inflamação36 do intestino grosso), eructação126 (arroto), ulceração127 esofageal (úlcera128 no esôfago129), hemorragia130 retal (sangramento retal), aumento das glândulas salivares131 |
| Distúrbios hepatobiliares132 | Teste anormal de função hepática133 | Colelitíase134 (pedra na vesícula135), hepatomegalia136 (fígado137 aumentado) |
|
| Distúrbios da pele e tecido subcutâneo138 | Rash139* | Hiperidrose140 (suor excessivo em algumas partes do corpo), prurido34 (coceira), distúrbios de pele14*, urticária19 (reação alérgica20 manifestada por alterações na pele14) | Angioedema141 (inchaço142 das partes mais profundas da pele14 ou da mucosa56, geralmente de origem alérgica), dermatite143 de contato (reação alérgica20 da pele14 por contato), eritema nodoso144 (inflamação36 dermatológica, caracterizada pelo aparecimento de nódulos dolorosos sob a pele14) |
| Distúrbios musculoesqueléticos e tecido conectivo145 | Artralgia146 (dor nas juntas), dorsalgia* (dor nas costas147) |
Artrite148, bursite149 (inflamação36 de uma pequena bolsa contendo líquido que envolve as articulações150), dor no flanco151, atrofia38 muscular | |
| Distúrbios renais e urinários | Urgência152 urinária (urgência152 para urinar), polaciúria (aumento da frequência urinária, sem grande relação com o volume de urina153 excretado) | Hematúria154 (presença de sangue80 na urina153), anormalidade urinária, nefrolitíase (pedra nos rins70) |
|
| Gravidez16, condições puerperais e perinatais | Aborto | ||
| Distúrbios do sistema reprodutivo e mamário | Ingurgitamento de mama155 (mamas156 com excesso de leite), disfunção erétil (impotência157 sexual), priapismo158 (ereção159 persistente e frequentemente dolorosa, com duração maior que 4 horas), hemorragia vaginal160 (sangramento vaginal), esfregaço anormal de colo161 de útero162 |
||
| Distúrbios gerais e condições no local de administração | Astenia163 (fraqueza), dor torácica* (dor no peito43), reações no local da injeção2*¹, dor* |
Calafrios164*, edema35 da face165*, atrofia38 no local da injeção², reação local*, edema35 periférico (inchaço142 nas extremidades do corpo), edema35 (inchaço142), pirexia166 (febre167) | Reação Imediata Pós-Injeção2, necrose40 no local da injeção2 |
Período Pós-Comercialização
A experiência pós-comercialização tem mostrado reações adversas similares às descritas acima. Uma vez que estes eventos são relatados voluntariamente a partir de uma população de tamanho não definido, não é sempre possível estimar de forma confiável a frequência destes sintomas5 ou estabelecer a relação causal com a exposição ao medicamento. Relatos sobre eventos adversos que ocorreram no tratamento com COPAXONE® não mencionadas acima, recebidas desde a introdução da medicação no mercado e que podem ter ou não uma relação causal com o fármaco168, incluem o seguinte:
Organismo como um todo: septicemia169 (infecção51 generalizada por todo o corpo causada por bactérias que infectam o sangue80), lúpus170 eritematoso171 sistêmico172 (doença autoimune173), hidrocefalia174 (aumento da quantidade de líquido cefalorraquidiano175 na cavidade craniana), aumento abdominal, hipersensibilidade no local da injeção2, reação alérgica20, reação anafilactóide (reação alérgica20 grave).
Sistema Cardiovascular176: trombose177 (formação de um coágulo178 sanguíneo em uma veia), doença vascular periférica179 (deficiência na circulação180 sanguínea dos membros), derrame181 pericárdico (acúmulo anormal de fluido na cavidade pericárdica), infarto do miocárdio182, tromboflebite183 profunda (flebite184 que evoluiu com a formação de um coágulo178 na veia impedindo a circulação180 do sangue80), oclusão coronária (obstrução da artéria185 coronária), insuficiência cardíaca congestiva186 (diminuição da função do coração45), cardiomiopatia (doença do músculo do coração45), cardiomegalia187 (aumento do tamanho do coração45), arritmia188 (alteração no ritmo ou mudança na frequência dos batimentos cardíacos), angina189 peitoral (dor muito forte no peito43, provocada pela diminuição do sangue80 que passa pelas artérias190 que irrigam o músculo cardíaco191).
Sistema Digestivo192: edema35 da língua193, úlcera128 estomacal, hemorragia130, anormalidades da função hepática133, dano hepático, hepatite194 (infecção51 do fígado137), eructação126 (arroto), cirrose195 hepática133, colelitíase134 (formação de pedras na vesícula135).
Sistema Sanguíneo e Linfático76: trombocitopenia83 (diminuição do número de plaquetas84 no sangue80), reação do tipo linfoma196 (grupo de doenças malignas que acomete o sistema linfático197), leucemia198 aguda (tumor74 de desenvolvimento rápido que afeta as células brancas do sangue199).
Alterações Metabólicas e Nutricionais: hipercolesterolemia200 (aumento do colesterol201)
Sistema Musculoesquelético: artrite reumatoide202, espasmo203 generalizado.
Sistema Nervoso95: mielite204 (inflamação36 da medula espinal205), meningite206 (infecção51 das meninges207, membrana que envolve o cérebro208 e a medula209), neoplasia73 (tumor74 benigno) do sistema nervoso central9, acidente vascular210 encefálico (derrame181 cerebral), edema35 cerebral, sonhos anormais, afasia211 (dificuldade ou perda de capacidade para falar, ou compreender a linguagem falada, escrita ou gestual), convulsões, neuralgia212 (dor que se manifesta com intensidade variável, no trajeto de um nervo sensitivo ou na região por este inervada).
Sistema Respiratório213: embolia214 pulmonar (formação de um coágulo178 no pulmão215), derrame181 pleural (acúmulo anormal de líquidos entre as pleuras), carcinoma216 (tumor74 maligno) pulmonar, febre do feno217 (reação alérgica20 ao pólen).
Sensações Especiais: glaucoma218 (doença ocular causada pelo aumento da pressão intraocular219 que provoca lesões220 no nervo óptico, comprometendo a visão105), cegueira, defeito no campo visual103.
Sistema Urogenital221: neoplasma222 urogenital221 (tumor74 do sistema urinário223 e/ou do sistema genital224), anormalidade da urina153, carcinoma216 (tumor74 maligno) ovariano, nefrose225 (doença renal226 caracterizada pela perda de proteínas227 pela urina153), insuficiência renal228, carcinoma216 (tumor74 maligno) de mama155, carcinoma216 (tumor74 maligno) na bexiga229, poliúria230 (aumento do volume urinário).
Informe ao seu médico, cirurgião-dentista ou farmacêutico o aparecimento de reações indesejáveis pelo uso do medicamento. Informe também à empresa através do seu serviço de atendimento.
O QUE FAZER SE ALGUÉM USAR UMA QUANTIDADE MAIOR DO QUE A INDICADA DESTE MEDICAMENTO?
Se utilizar uma grande quantidade deste medicamento de uma só vez, comunique seu médico imediatamente. Antes de procurar socorro médico, não ingerir nenhum tipo de substância na tentativa de alívio dos sintomas5.
As doses diárias de até 300 mg não foram associadas a outros eventos adversos, além daqueles já mencionados no item 8. Quais os males que este medicamento pode me causar?. Não há experiência com dosagens mais elevadas.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
DIZERES LEGAIS
USO SOB PRESCRIÇÃO MÉDICA
VENDA PROIBIDA AO COMÉRCIO.
MS nº: 1.5573.0001
Farm. Resp.: Carolina Mantovani Gomes Forti - CRF-SP n°: 34.304
Fabricado por:
Teva Pharmaceutical Industries Ltd.
Kfar Saba - Israel ou
Ivax Pharmaceuticals UK Runcorn - Reino Unido
Importado por:
Teva Farmacêutica Ltda.
Av. Guido Caloi, 1935 - Prédio B - 1ºAndar São Paulo - SP
CNPJ nº 05.333.542/0001-08
SAC 0800-772-2660

Complementos