Eligard
ZODIAC PRODUTOS FARMACÊUTICOS S/A
IDENTIFICAÇÃO DO MEDICAMENTO
Eligard®
acetato de leuprorrelina
APRESENTAÇÕES
Pó liófilo para suspensão injetável 7,5 mg: cartucho contendo duas seringas (Seringa1 “B” contém pó liófilo de acetato de leuprorrelina e Seringa1 “A” contém (diluente) sistema polimérico ATRIGEL®), agulha e sachês dessecantes para controle de umidade do produto.
Pó liófilo para suspensão injetável 22,5 mg: cartucho contendo duas seringas (Seringa1 “B” contém pó liófilo de acetato de leuprorrelina e Seringa1 “A” contém (diluente) sistema polimérico ATRIGEL®), agulha e sachês dessecantes para controle de umidade do produto.
Pó liófilo para suspensão injetável 45,0 mg cartucho contendo duas seringas (Seringa1 “B” contém pó liófilo de acetato de leuprorrelina e Seringa1 “A” contém (diluente) sistema polimérico ATRIGEL®), agulha e sachês dessecantes para controle de umidade do produto.
USO SUBCUTÂNEO2
USO ADULTO
COMPOSIÇÃO
Eligard 7,5 mg
Cada seringa1 “B” contém 7,5 mg* de acetato de leuprorrelina (equivalente a 7 mg de leuprorrelina base).
Cada seringa1 “A” contém diluente (sistema polimérico) ATRIGEL® com N-metil-2-pirrolidona e Poli (DL lactídeo-coglicolídeo).
*É fornecida uma quantidade superior de cada componente devido à retenção da suspensão injetável na seringa1 e na agulha, após a administração do produto no paciente. O desenvolvimento da formulação foi realizado de modo que seja administrado 7,5 mg de acetato de leuprorrelina para o paciente.
Eligard 22,5 mg
Cada seringa1 “B” contém 22,5 mg* de acetato de leuprorrelina (equivalente a 21 mg de leuprorrelina base).
Cada seringa1 “A” contém diluente (sistema polimérico) ATRIGEL® com N-metil-2-pirrolidona e Poli (DL lactídeo-co-glicolídeo).
*É fornecida uma quantidade superior de cada componente devido à retenção da suspensão injetável na seringa1 e na agulha, após a administração do produto no paciente. O desenvolvimento da formulação foi realizado de modo que seja administrado 22,5 mg de acetato de leuprorrelina para o paciente.
Eligard 45,0 mg
Cada seringa1 “B” contém 45 mg* de acetato de leuprorrelina (equivalente a 41,7 mg de leuprorrelina base).
Cada seringa1 “A” contém diluente (sistema polimérico) ATRIGEL® com N-metil-2-pirrolidona e Poli (DL lactídeo-co-glicolídeo).
*É fornecida uma quantidade superior de cada componente devido à retenção da suspensão injetável na seringa1 e na agulha, após a administração do produto no paciente. O desenvolvimento da formulação foi realizado de modo que seja administrado 45 mg de acetato de leuprorrelina para o paciente.
INFORMAÇÕES AO PACIENTE
PARA QUE ESTE MEDICAMENTO É INDICADO?
ELIGARD® atua sobre o câncer3 de próstata4 avançado atenuando seus sintomas5.
QUANDO NÃO DEVO USAR ESTE MEDICAMENTO?
Você não deve usar ELIGARD® se tiver hipersensibilidade (alergia6) aos hormônios estimulantes dos testículos7 (LH-RH), análogos agonistas (substâncias semelhantes) ao LH-RH ou a qualquer componente da formulação.
Este medicamento é contraindicado para uso por mulheres.
Este medicamento é contraindicado para uso por pacientes pediátricos.
Este medicamento não deve ser utilizado por mulheres grávidas ou que possam ficar grávidas durante o tratamento.
Este medicamento pode causar malformação8 ao bebê durante a gravidez9.
O QUE DEVO SABER ANTES DE USAR ESTE MEDICAMENTO?
ADVERTÊNCIAS E PRECAUÇÕES
Caso você apresente alguma das situações abaixo, seu médico irá tomar as medidas necessárias:
- se o câncer3 de próstata4 tiver se espalhado para as vértebras (metástases10 vertebrais),
- se houver obstrução do trato urinário11.
ELIGARD® causa, na primeira semana de tratamento, um aumento temporário nas concentrações de testosterona (hormônio12 sexual masculino) no sangue13.
Durante as primeiras semanas de tratamento você poderá apresentar piora dos sintomas5 da doença ou poderá apresentar novos sinais14 e sintomas5, incluindo dor óssea, neuropatia15 (dor e formigamento devido alteração no sistema nervoso16), hematúria17 (presença de sangue13 na urina18) ou obstrução do trato urinário11.
Foram observados casos isolados de obstrução da uretra19 e/ou compressão da medula espinhal20, que podem contribuir para paralisia21 (com ou sem complicações fatais), durante o tratamento paliativo22 do câncer3 de próstata4 avançado com agonistas de LH-RH. Caso haja desenvolvimento de compressão da medula espinhal20 ou alteração da função renal23, o tratamento padrão dessas complicações deverá ser instituído.
Hiperglicemia24 e diabetes25:
Hiperglicemia24 e um aumento no risco de desenvolvimento de diabetes25 são complicações que podem acontecer em homens recebendo análogos de GNRH. Monitoração dos níveis glicêmicos e manejo de acordo com a prática clínica deverão ser realizados.
Alterações nos exames laboratoriais:
Os resultados de exames das funções da hipófise26 e dos testículos7 realizados durante e após o tratamento com ELIGARD® podem ser afetados.
Eventos Cardiovasculares:
Foi observado aumento no risco de infarto do miocárdio27, morte súbita e acidente vascular cerebral28. Monitoração cuidadosa de eventos cardiovasculares e manejo de acordo com a prática clínica deverão ser realizados. A terapia com objetivo de reduzir os níveis de testosterona pode levar a uma alteração do exame de eletrocardiograma29 (ECG) chamado de prolongamento do intervalo QT/QTc. O médico deve avaliar se os benefícios dessa terapia superam os potenciais riscos em pacientes em situações clínicas específicas como os portadores de Síndrome30 congênita31 do QT longo, insuficiência cardíaca congestiva32, alterações eletrolíticas frequentes e nos pacientes que fazem uso de drogas com potencial conhecido de alargamento do intervalo QT. Distúrbios eletrolíticos devem ser corrigidos, devendo-se monitorar periodicamente o ECG e as dosagens de eletrólitos33.
Gravidez9 e amamentação34
Este medicamento não deve ser utilizado por mulheres grávidas ou que possam ficar grávidas durante o tratamento.
Este medicamento pode causar malformação8 ao bebê durante a gravidez9.
Este medicamento não é indicado para uso em mulheres e não se sabe se ele é excretado no leite materno. Como muitos medicamentos são excretados no leite materno e devido ao potencial de reações adversas sérias em lactentes35 (crianças em fase de amamentação34) expostos a esta droga, deve-se optar por parar a amamentação34 se não for possível parar o uso do medicamento. Essas possibilidades devem ser discutidas com seu médico.
Este medicamento pode causar doping.
INTERAÇÕES MEDICAMENTOSAS
Não existem informações sobre a interação de ELIGARD® com outros medicamentos.
Testes laboratoriais: seu médico acompanhará a resposta ao ELIGARD® realizando a medição periódica das concentrações de testosterona e antígeno36 prostático específico (PSA) em seu sangue13.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento. Não use medicamento sem o conhecimento de seu médico. Pode ser perigoso para sua saúde37.
ONDE, COMO E POR QUANTO TEMPO POSSO GUARDAR ESTE MEDICAMENTO?
ELIGARD® deve ser conservado sob refrigeração (2º a 8ºC).
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Após preparo, usar em até 30 minutos.
Depois deste período, a suspensão injetável não utilizada deverá ser descartada.
Características do medicamento
Após preparo a suspensão apresentará uma coloração amarela clara a amarela.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
COMO DEVO USAR ESTE MEDICAMENTO?
ELIGARD® deve ser administrado por via subcutânea38 na parede abdominal39 (barriga), onde formará um depósito sólido de liberação lenta do medicamento. O conteúdo da seringa1 é de dose única.
Assim como os demais medicamentos administrados por injeção subcutânea40, o local de injeção41 deverá ser alterado a cada aplicação.
ELIGARD® é preenchido e fornecido em duas seringas estéreis (livres de contaminação) separadas, cujo conteúdo deve ser misturado imediatamente antes da administração.
Importante: Deixe o produto atingir a temperatura ambiente antes de prepará-lo e utilizá-lo.
ELIGARD® possui 2 blísteres: um identificado como diluente contendo a seringa1 A estéril preenchida com o diluente (sistema polimérico) ATRIGEL®, um êmbolo42 branco longo reposicionável e sachê dessecante; o outro identificado como ELIGARD® contendo a seringa1 B estéril preenchida com pó liófilo de acetato de leuprorrelina, agulha estéril descartável para aplicação e sachê dessecante (figura 1).
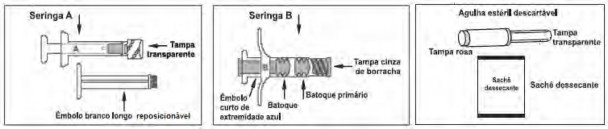
Figura 1: imagens das seringas de ELIGARD®
Você deve seguir as instruções abaixo para garantir a preparação adequada de ELIGARD® antes da administração:
Em um local limpo, abra todas as embalagens e retire seu conteúdo. Descarte o sache dessecante.
Puxe o êmbolo42 curto de extremidade azul da Seringa1 B. Este êmbolo42 curto deverá sair junto com o batoque cinza e o conjunto será descartado (Figura 2). Introduza suavemente o êmbolo42 branco longo reposicionável no batoque remanescente da Seringa1 B, girando-o no local (Figura 3).

Desrosqueie a tampa transparente da Seringa1 A (Figura 4). Remova a tampa cinza de borracha da Seringa1 B (Figura 5).

Conecte as duas seringas, girando-as até que estejam firmemente conectadas (Figura 6).
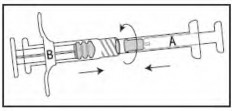
Misture totalmente o produto, empurrando o conteúdo das seringas para frente e para trás (durante aproximadamente 45 segundos) para obter uma suspensão uniforme (Figura 7). Depois de misturada de modo uniforme, a suspensão apresentará uma coloração de amarela clara a amarela.
Observação: O produto deverá ser misturado conforme descrito; a agitação não fornecerá a mistura adequada do produto.
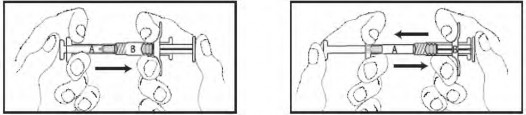
Segure as seringas em posição vertical, com a Seringa1 B para baixo. As seringas deverão permanecer acopladas firmemente. Transfira todo o conteúdo do produto misturado para a Seringa1 B (seringa1 curta e larga) pressionando o êmbolo42 da Seringa1 A e puxando levemente o êmbolo42 da Seringa1 B. Continue pressionando para baixo o êmbolo42 da Seringa1 A no momento que a mesma for desconectada (Figura 8). Observação: é aceitável que pequenas bolhas de ar permaneçam na formulação.
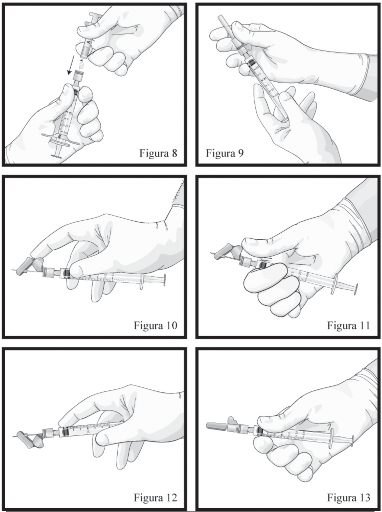
Mantenha a Seringa1 B em posição vertical. Conecte a agulha à extremidade da Seringa1 B (Figura 9) empurrando e girando o cartucho da agulha até que esteja firmemente acoplado. Não encaixe a agulha na seringa1 antes de remover sua tampa rosa. Remova o capuz protetor da agulha antes da administração (Figura 09). Após a administração, não tente desconectar a agulha, trave o dispositivo de segurança: com o dedo indicador (figura 10), com o dedo polegar (figura 11), ou em uma superfície plana (figura 12). Observe a posição travada por um “click” audível e tátil. A posição travada irá cobrir completamente a agulha (Figura 13), descarte todos os componentes de modo seguro em local adequado para materiais biológicos.
Procedimento de Administração
IMPORTANTE: Deixar o produto atingir temperatura ambiente antes de utilizá-lo. Uma vez misturado, o produto deve ser administrado em até 30 minutos.
1. Escolher o local da injeção41 no abdômen, parte superior das nádegas43 ou em qualquer lugar com quantidade adequada de tecido subcutâneo44 que não tenha pigmentação excessiva, nódulos, lesões45 ou pelos. Como você pode variar o local para uma injeção subcutânea40, escolha uma área que não tenha sido utilizada recentemente.
2. Limpe a área entorno do local da injeção41 com um algodão umedecido em álcool.
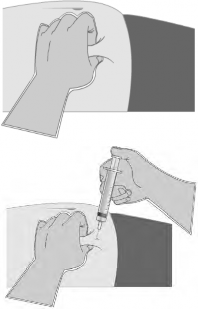
3. Utilizando o polegar e o dedo indicador da sua mão46 não dominante, aperte a área da pele47 ao redor do local da injeção41, formando uma prega conforme mostra a figura ao lado.
4. Utilizando a sua mão46 dominante, inserir a agulha rapidamente em um ângulo de 90°. O ângulo aproximado que você usar dependerá da quantidade e da plenitude do tecido subcutâneo44 e do comprimento da agulha. Após a agulha ser inserida, solte a pele47 da mão46 não dominante.
5. Injetar o medicamento usando uma pressão lenta e constante. Pressione o êmbolo42 até a seringa1 ser esvaziada.
6. Retirar rapidamente a agulha no mesmo ângulo utilizado para a inserção.
7. Descartar todos os componentes de modo seguro em um recipiente apropriado para materiais biológicos.
Posologia:
A dose recomendada de ELIGARD® 7,5 mg é mensal. O medicamento é administrado por via subcutânea38 formando um depósito sólido e fornece liberação contínua do medicamento por 1 mês.
A dose recomendada de ELIGARD® 22,5 mg é de uma injeção41 a cada 3 meses (trimestral). O medicamento é administrado por via subcutânea38 formando um depósito sólido e fornece liberação contínua do medicamento por 3 meses.
A dose recomendada de ELIGARD® 45 mg é de uma injeção41 a cada 6 meses (semestral). O medicamento é administrado por via subcutânea38, e fornece liberação contínua do medicamento por 6 meses.
A administração da suspensão injetável de ELIGARD® 7,5 mg fornece 7,5 mg de acetato de leuprorrelina ao paciente. A suspensão injetável de ELIGARD® 22,5 mg fornece 22,5 mg de acetato de leuprorrelina. A suspensão injetável de ELIGARD® 45 mg fornece 45 mg de acetato de leuprorrelina.
Uso em idosos: Até o momento, não foi comprovada a necessidade de ajuste de dosagem em pacientes idosos.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento. Não interrompa o tratamento sem o conhecimento do seu médico.
O QUE DEVO FAZER QUANDO EU ME ESQUECER DE USAR ESTE MEDICAMENTO?
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
QUAIS OS MALES QUE ESTE MEDICAMENTO PODE ME CAUSAR?
ELIGARD® causa na primeira semana de tratamento um aumento temporário nas concentrações de testosterona (hormônio12 sexual masculino) no sangue13.
Durante as primeiras semanas de tratamento você poderá apresentar piora dos sintomas5 da doença ou poderá apresentar novos sinais14 e sintomas5, incluindo dor óssea, neuropatia15 (problemas no sistema nervoso16), hematúria17 (presença de sangue13 na urina18) ou obstrução do trato urinário11.
O agravamento dessas condições pode levar a problemas neurológicos como fraqueza, parestesia48 (sensação de formigamento) dos membros inferiores (pernas) ou piora dos sintomas5 urinários.
Foram observados casos isolados de obstrução da uretra19 e/ou compressão da medula espinhal20, que podem contribuir para paralisia21 (com ou sem complicações fatais).
Poderá ocorrer dor no local da injeção41 reação como queimação, mais raramente prurido49 (coceira), endurecimento do local e ulceração50 (lesão51 na pele47).
Alterações na densidade óssea também foram relatadas.
No tratamento com ELIGARD® 7,5 mg, 22,5 mg e 45 mg foram relatadas as seguintes reações adversas:
|
Frequência das Reações Adversas |
7,5 mg1 |
22,5 mg2 |
45 mg3 |
|
Reação muito comum ocorre em 10% ou mais dos pacientes que utilizam este medicamento |
mal-estar, fadiga52 (cansaço), calores e sudorese53 (transpiração54). |
calores e sudorese53. |
calores, sudorese53 e fadiga52. |
|
Reação comum ocorre entre 1% e 10% dos pacientes que utilizam este medicamento |
tontura55, atrofia56 testicular (diminuição dos testículos7), gastroenterite57 (inflamação58 do estômago59 e intestino), colite60 (inflamação58 do cólon61). |
fadiga52 (cansaço), aumento da frequência de micções62 (aumento da frequência urinária), náusea63, prurido49 (coceira), artralgia64 (dor nas articulações65). |
fraqueza, atrofia56 testicular, ginecomastia66, suoresnoturnos, mialgia67 (dor muscular) e dor nos membros. |
|
1 Outras reações, relatadas em menos de 2% dos pacientes: insônia, síncope68 (desmaio), flatulência (gases), obstipação69 (prisão de ventre), redução da contagem de eritrócitos70 (células71 vermelhas do sangue13), hematócritos (volume total de eritrócitos70) e hemoglobina72 (veículo do oxigênio no sangue13), ganho de peso, tremores, dor nas costas73, dor articular, distúrbios de olfato e paladar74, depressão, vertigem75 (tontura55), alopecia76 (queda de cabelo77), sensibilidade testicular, impotência78, redução da libido79 (diminuição do desejo sexual), ginecomastia66 (aumento das glândulas80 mamárias no homem), sensibilidade mamária. |
|||
|
|
|||
|
2 Outras reações, relatadas em menos de 2% dos pacientes: dispepsia81 (dificuldade de digestão82), tremores, fraqueza, letargia83 (sonolência / lentidão), dificuldades ao urinar, dor ao urinar, micção84 curta, espasmos85 vesicais (contrações na bexiga86), hematúria17 (presença de sangue13 na urina18), retenção urinária87 (impossibilidade de urinar), maior sensibilidade mamária, atrofia56 testicular (diminuição dos testículos7), dor testicular, ginecomastia66 (aumento das glândulas80 mamárias no homem), impotência78, suores noturnos, hipertensão88 (pressão alta) e hipotensão89 (pressão baixa). |
|||
|
|
|||
|
3 Outras reações, relatadas em menos de 2% dos pacientes: dispepsia81 (dificuldade de digestão82), sonolência, impotência78 sexual, desejo de urinar durante o sono, bem como aumento da frequencia urinária durante o sono e perda de desejo sexual. |
|||
Eligard 7,5 mg e 22,5 mg
Atenção: este produto é um medicamento que possui nova forma farmacêutica no país e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos. Nesse caso, informe seu médico.
Eligard 45 mg
Atenção: este produto é um medicamento que possui nova concentração no país e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos. Nesse caso, informe seu médico.
O QUE FAZER SE ALGUÉM USAR UMA QUANTIDADE MAIOR DO QUE A INDICADA DESTE MEDICAMENTO?
Caso ocorra a aplicação de uma superdose recomendam-se medidas gerais de monitorização frequente dos sinais14 vitais e observação do paciente.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
DIZERES LEGAIS
VENDA SOB PRESCRIÇÃO MÉDICA
MS - 1.2214.0074
Resp. Téc.: Marcia da Costa Pereira - CRF-SP : nº 32.700
Importado por:
ZODIAC PRODUTOS FARMACÊUTICOS S/A.
Rodovia Vereador Abel Fabrício Dias, 3400 Pindamonhangaba - SP
C.N.P.J. 55.980.684/0001-27
Indústria Brasileira
Fabricado por:
Tolmar, Inc.
701 Centre Avenue Fort Collins, CO 80526
Estados Unidos
SAC 0800 166575