

Koate DVI (Bula do profissional de saúde)
GRIFOLS BRASIL LTDA
IDENTIFICAÇÃO DO MEDICAMENTO
Koate-DVI
Fator VIII de coagulação1 Humano
Injetável 250, 500 e 1.000 UI
FORMA FARMACÊUTICA E APRESENTAÇÃO:
Pó liofilizado2 injetável para solução intravenosa
Frascos de uso único de 250, 500 e 1.000 UI de atividade do Fator VIII
COMPOSIÇÃO:
| Fator VIII de Coagulação1 | 250 UI | 500 UI | 1000 UI |
| Albumina3 Humana | 0,025 g | 0,025 g | 0,050 g |
| Cloreto de Sódio | 0,044 g | 0,044 g | 0,088 g |
| L-Histidina | 0,016 g | 0,016 g | 0,031 g |
| Cloreto de Cálcio | 0,0007 g | 0,0007 g | 0,0015 g |
| Água para injeção4, USP | 5 mL | 5 mL | 10 mL |
Produzido a partir de plasma5 humano.
SOLUÇÃO INTRAVENOSA
USO ADULTO
INFORMAÇÕES TÉCNICAS AOS PROFISSIONAIS DE SAÚDE6
INDICAÇÕES
Koate-DVI é indicado para prevenção e controle de hemorragias7 em pacientes com deficiência de fator VIII, devido à hemofilia8 A (deficiência de Fator VIII hereditário), previamente tratados com produtos de fator VIII.
Limitação de uso
Apesar do conteúdo de fator von Willebrand neste produto, não há dados de ensaios clínicos9 que apoiem seu uso na doença de von Willebrand
RESULTADOS DE EFICÁCIA
A eficácia do Koate-DVI para o tratamento de episódios de sangramento foi demonstrada em um estudo clínico de 2 fases, de segurança, PK e eficácia. A fase I foi um estudo randomizado10, simples cego, de dose única, cruzado e de farmacocinética (PK), comparando o Koate-DVI tratado termicamente, com o Koate não tratado termicamente. Dezenove indivíduos foram randomizados e receberam uma dose única de 50 UI/kg de Koate-DVI aquecido ou Koate não tratado termicamente para avaliação de farmacocinética (PK). A fase II foi um estudo de segurança aberto de 6 meses realizado em dois centros de hemofilia8. Dezenove indivíduos receberam Koate-DVI, inclusive para tratamento sob demanda e controle de episódios de sangramento.. 306 episódios de sangramento foram tratados no total, dos quais 82% foram tratados com uma única infusão do Fator VIII.
CARACTERÍSTICAS FARMACOLÓGICAS
Mecanismo de ação
O Koate-DVI substitui temporariamente o fator VIII de coagulação1 faltante que é necessário para a hemostasia11 efetiva.
Farmacodinâmica
A hemofilia8 A é um distúrbio de sangramento caracterizado por uma deficiência do fator VIII de coagulação1 funcional, que resulta em um tempo prolongado de coagulação1 do plasma5, conforme medido pelo teste do tempo de tromboplastina12 parcial ativada (aPTT). O tratamento com Koate-DVI normaliza o aPTT durante o período de administração eficaz.
Farmacocinética
A farmacocinética (PK) de Koate-DVI foi avaliada em um estudo clínico prospectivo13 em duas fases de 20 pacientes previamente tratados (PTPs) com hemofilia8 A grave. Na fase I, os parâmetros de farmacocinética (PK) para 19 indivíduos basearam-se na atividade plasmática do Fator VIII após uma única infusão intravenosa de 50 UI/kg de Koate-DVI. A bioequivalência do Koate-DVI tratado termicamente ao Koate não tratado termicamente foi demonstrada pela comparação de Cmax e a área sob a curva, AUC0-48 (Tabela 3). A recuperação incremental in vivo dez minutos após a infusão de Koate-DVI tratado termicamente foi de 1,90% unidade/kg (a de Koate não tratado termicamente foi de 1,82% unidades/kg). A semivida biológica média foi de 16,1 horas.
Na fase II do estudo, os participantes receberam tratamentos Koate-DVI por seis meses em terapia domiciliar com uma média de 52 dias (intervalo de 23 a 94 dias). Ao final de 6 meses, a AUC0-48 média foi de 1471 ± 237 unidades*hora/100 mL, a Cmax foi de 99 ± 13 unidades/100 mL e o t1/2 foi de 16 ± 3,9 horas.
Tabela 3. Parâmetros PK de Koate-DVI (fase I do estudo cruzado)
|
Parâmetro |
Koate-DVI | Koate |
|
Tratado termicamente |
Não tratado termicamente |
|
|
AUC140-48 (UI h/mL) |
1432 ± 288 |
1477 ± 343 |
|
Cmax (UI/mL) |
103 ± 19 |
99 ± 20 |
|
Tmax (h) |
0.41 ± 0.26 |
0.43 ± 0.44 |
|
Meia-vida (h) |
16,1 ± 3,2 |
16,1 ± 5,1 |
CONTRAINDICAÇÕES
Koate-DVI é contraindicado para pacientes15 que tenham tido reações de hipersensibilidade, inclusive a anafilaxia16, a Koate-DVI e seus componentes.
ADVERTÊNCIAS E PRECAUÇÕES
Reações de Hipersensibilidade
Podem ocorrer reações de hipersensibilidade, inclusive a anafilaxia16. Entre os primeiros sinais17 de reações de hipersensibilidade, que podem progredir para a anafilaxia16, angioedema18, opressão no peito19, hipotensão20, erupção21 cutânea22, náuseas23, vômitos24, parestesia25, agitação, sibilância e dispneia26. Se ocorrerem sintomas27 de hipersensibilidade, interrompa imediatamente o uso do produto e administre o tratamento de emergência28 apropriado.
Anticorpos29 Neutralizantes
Pode ocorrer a formação de anticorpos29 neutralizantes (inibidores) do Fator VIII. Monitore todos os pacientes para observar se ocorre desenvolvimento de inibidores do Fator VIII por observações clínicas e testes laboratoriais apropriados. Se os níveis estimados de atividade do Fator VIII do plasma5 não forem atingidos, ou se o sangramento não for controlado com uma dose apropriada, realize um teste que meça a concentração do inibidor do Fator VIII.
Hemólise30 Intravascular31
Koate-DVI contém isoaglutininas de grupo sanguíneo que não são clinicamente significativas quando pequenas doses são usadas para tratar episódios leves de sangramento. No entanto, quando doses grandes e/ou frequentes de Koate-DVI são administradas a pacientes com grupos sanguíneos A, B ou AB, pode ocorrer anemia hemolítica32 aguda, resultando em aumento da tendência de sangramento ou hiperfibrinogenemia. Monitore esses pacientes para detectar sinais17 de hemólise30 intravascular31 e queda de hematócrito33. Caso esta condição ocorra, levando a anemia hemolítica32 progressiva, interrompa o Koate-DVI e considere a administração de glóbulos vermelhos tipo O sorologicamente compatíveis e ofereça terapia alternativa.
Agentes infecciosos transmissíveis
Devido ao fato de que o Koate-DVI é feito a partir de sangue34 humano, ele pode apresentar risco de transmissão de agentes infecciosos, por exemplo, vírus35, o agente da doença de Creutzfeldt-Jakob variante (vCJD) e, teoricamente, o agente da doença de Creutzfeldt-Jakob (CJD). Existe também a possibilidade de que agentes infecciosos desconhecidos estejam presentes no produto. O risco do produto transmitir vírus35 foi reduzido pela triagem de doadores de plasma5 quanto à exposição prévia a certos vírus35, por meio do teste de presença de certas infecções36 de vírus35 atuais e inativação e remoção de certos vírus35 durante a fabricação. Apesar destas medidas, este produto ainda pode potencialmente transmitir doenças.
Caso o médico suspeite de infecções36 possivelmente transmitidas por este produto, comunique-as à Grifols Brasil Ltda. SAC 0800 709 2444.
Monitoramentos: Testes de laboratório
- Monitore os níveis de atividade do Fator VIII do plasma5 realizando um teste validado (por exemplo, um teste de coagulação1 em estágio único) para confirmar que os níveis adequados de Fator VIII foram alcançados e mantidos.
- Monitore o desenvolvimento de inibidores do Fator VIII. Realize um teste de inibidor de Bethesda se os níveis plasmáticos do Fator VIII não forem atingidos, ou se o sangramento não for controlado com a dose esperada de Koate-DVI. Utilize unidades Bethesda (UB) para comunicar os níveis de inibidores.
- Faça monitoramento para verificar se ocorre hemólise30 intravascular31 e valores decrescentes de hematócrito33 em pacientes com grupos sanguíneos A, B ou AB que estejam recebendo doses altas ou frequentes de Koate-DVI.
Gravidez37 e Lactação38
Resumo de riscos: Não há dados com o uso de Koate-DVI em mulheres grávidas para informar sobre o risco associado ao medicamento. Estudos de reprodução39 animal não foram realizados usando Koate-DVI. Não se sabe se o Koate-DVI pode causar dano fetal quando administrado a uma mulher grávida ou pode afetar a capacidade de reprodução39.
Lactantes40: Não há informações sobre a presença de Koate-DVI no leite humano, os efeitos sobre o bebê amamentado ou os efeitos sobre a produção de leite. Os benefícios para o desenvolvimento e a saúde6 da amamentação41 devem ser considerados juntamente com a necessidade clínica de Koate-DVI da mãe e quaisquer efeitos adversos potenciais de Koate-DVI ou da condição materna subjacente sobre o bebê amamentado.
POPULAÇÕES ESPECIAIS
Uso Geriátrico: Os estudos clínicos de Koate-DVI não incluíram nenhum indivíduo com idade igual ou superior a 65 anos para determinar se eles respondem de forma diferente da forma com que respondem indivíduos mais jovens. Individualize a seleção de dose para pacientes15 geriátricos.
INTERAÇÕES MEDICAMENTOSAS
Não foram descritas interações medicamentos. O Koate-DVI deve ser administrado sozinho sem misturar com nenhum outro agente.
CUIDADOS DE ARMAZENAMENTO DO MEDICAMENTO
Cuidados de conservação
Armazene o Koate-DVI em sua embalagem original para protegê-lo da luz. Não o utilize após a data de validade.
Utilize imediatamente o Koate-DVI reconstituído ou dentro de 3 horas após a reconstituição. Não utilizar após a data de validade impressa na embalagem e na etiqueta.
Não congelar. Conservar de 2–8°C, sob refrigeração.
Descartar o conteúdo não utilizado devido ao risco de contaminação bacteriana. Número de lote e datas de fabricação e validade: vide embalagem.
Não use o medicamento com prazo de validade vencido.
Para sua segurança, mantenha o medicamento na embalagem original. Antes de usar observe o aspecto do medicamento.
Caso você observe alguma mudança no aspecto do medicamento que ainda esteja no prazo de validade, consulte o médico ou o farmacêutico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance e da visão42 das crianças.
Não contém látex. Componentes da embalagem não contêm látex de borracha natural
adicionada.
POSOLOGIA E MODO DE USAR
Somente para uso intravenoso após a reconstituição.
Dose
A dose e a duração do tratamento dependem da gravidade da deficiência de Fator VIII, localização e extensão do sangramento e condição clínica do paciente.
Cada frasco de Koate-DVI é rotulado com a potência real do Fator VIII em unidades internacionais (UI). O cálculo43 da dose necessária de Fator VIII baseia-se no dado empírico de que uma UI de Fator VIII por kg de peso corporal eleva a atividade plasmática do Fator VIII em aproximadamente 2% da atividade normal ou 2 UI/dL.
A dose requerida pode ser determinada pela seguinte fórmula:
Dose (UI) = Peso corporal (kg) × [Elevação desejada de Fator VIII / (% normal ou UI/dL)] × 0,5
Estimar o aumento esperado de pico in vivo no nível de Fator VIII, expresso como UI/dL (ou % normal), pela seguinte fórmula:
Estimativa de aumento de VIII (% normal ou UI/dL) = [Dose total (UI)/Peso corporal (kg)] × 2
Há variação entre os pacientes quanto à farmacocinética (por exemplo, meia-vida, in vivo) e respostas clínicas. Baseie a dose e a frequência na resposta clínica individual.
Controle e prevenção de episódios de sangramento
Orientações referentes à administração de Koate-DVI para controle e prevenção de episódios de sangramento estão disponíveis na tabela 1.Deve-se considerar a manutenção de uma atividade de Fator VIII na faixa do objetivo ou acima dela.
Tabela 1: Orientações de dosagem para pacientes15 com hemofilia8 A
|
Tipo de sangramento |
nível Fator VIII: C obrigatório (% de normal) |
Dosagens (UI/kg) |
Frequência de dosagens (horas) |
Duração da terapia (dias) |
|
Leve |
30 |
15 |
12 |
Até que a hemorragia45 pare e a cura tenha sido alcançada (1 a 2 dias). |
|
Moderado |
50 |
25 |
12 |
Até que a cura tenha sido alcançada (2 a 7 dias, em média). |
|
Grave |
80-100 |
Inicial: 40-50 |
12 |
Por pelo menos de 3 a 5 dias |
|
Manutenção: 25 |
Até que se alcance a cura por até 10 dias. A hemorragia45 intracraniana pode requerer tratamento profilático por até 6 meses. |
|||
|
Cirurgia |
Antes da cirurgia: 80-100 |
40-50 |
Uma vez |
Antes da cirurgia |
|
Após a cirurgia: 60-100 |
30-50 |
12 |
Nos próximos 7 a 10 dias, ou até que se alcance a cura. |
Preparo e Reconstituição
Use a técnica asséptica (limpa e desinfetada) e uma superfície de trabalho plana durante o procedimento de reconstituição.
Remova a faixa retrátil do frasco de Koate-DVI. Não use o Koate-DVI se a faixa retrátil estiver ausente ou apresentar sinais17 de adulteração, e notifique imediatamente a Grifols Brasil Ltda.
Preparação da Solução:
- Deixe o frasco e a seringa49 atingirem a temperatura ambiente (25°C).
- Encaixe o êmbolo50 da seringa49 de plástico contendo solvente.
- Remova o filtro de sua embalagem. Retire a tampa cinzenta entre a ponta da seringa49 e, em seguida, encaixe a seringa49 no filtro.
- Remova o adaptador de frasco da embalagem. Encaixe o adaptador de frasco na seringa49 montada no filtro. Retire o plástico da tampa flip-top do frasco concentrado e limpe a borracha exposta com o anti-séptico fornecido.
- Coloque o conjunto seringa49/filtro/adaptador sobre a parte superior do frasco concentrado e furar a tampa com a agulha do adaptador.
- Transfira toda a água para injetáveis para o frasco de concentrado, pressionando o êmbolo50 da seringa49.
- Agite vigorosamente por 10-15 segundos, depois gire continuamente até dissolver
- completamente. Evite a formação excessiva de espuma.
- Cuidadosamente separe o conjunto seringa49/filtro e frasco para liberar o vácuo.
- Inverta o frasco para concentrar e elaborar a solução através do filtro dentro da seringa49. Não usar se forem observadas partículas e descoloração.
- Prepare o local da injeção4, separe o filtro separado do adaptador de frasco da seringa49. Injetar a solução por via intravenosa, utilizando a agulha borboleta fornecida ou uma agulha estéril.
Se a dose exigir mais de um frasco para injetáveis de Koate-DVI, reconstitua cada frasco usando uma nova seringa49 pré-carregada, adaptador de frasco e filtro fornecidos.
IMPORTANTE: Ao usar a seringa49 de diluente com sistemas de infusão ou extensões de linha, verifique a compatibilidade do sistema. Em alguns casos, pode ser necessário um adaptador para garantir a administração adequada do produto.
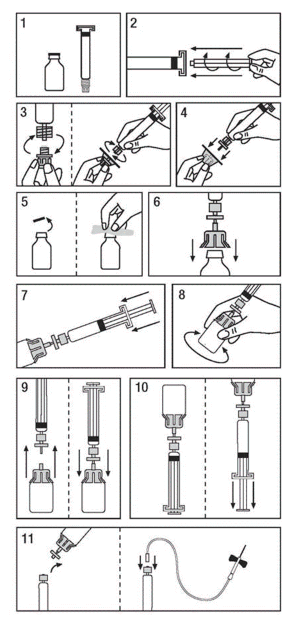
Administração
Apenas para administração intravenosa
Caso a dose requeira mais de um frasco de Koate-DVI:
- Reconstitua cada frasco com uma nova agulha de transferência.
- Puxe toda a solução em uma única seringa49.
- Antes da administração, inspecione visualmente a solução final em busca de partículas e descoloração, sempre que a solução e o recipiente o permitam. Não utilize a solução caso se observem material particulado ou descoloração.
- Conecte a seringa49 à extremidade do conector de um conjunto de infusão.
Administre a medição por via intravenosa. A taxa de administração deve ser determinada pelo nível de conforto do paciente, não devendo ser mais alta do que 10 mL por minuto.
REAÇÕES ADVERSAS
As reações adversas mais frequentes (frequência ≥ 5 % dos indivíduos) observadas no estudo clínico foram nervosismo, dor de cabeça51, dor abdominal, náuseas23, parestesia25 e visão42 turva.
Experiência com estudos clínicos
Como os estudos clínicos são conduzidos em condições amplamente variáveis, as taxas de reação adversas observadas não podem ser comparadas diretamente com as taxas de outros estudos clínicos e podem não refletir as taxas observadas na prática.
Imunogenicidade
Os indivíduos foram monitorados para detecção de anticorpos29 neutralizantes (inibidores) do Fator VIII pelo teste de Bethesda segundo a referência e em 8, 17 e 26 semanas. Não se observou evidência de formação de inibidores no estudo clínico.
A detecção da formação de anticorpos29 é altamente dependente da sensibilidade e especificidade do teste. Além disso, a incidência52 observada de positividade de anticorpos29 (incluindo anticorpos29 neutralizantes) em um teste pode ser influenciada por vários fatores, inclusive pela metodologia do teste, manuseio de amostras, tempo de coleta de amostras, medicamentos concomitantes e doença subjacente. Por estas razões, pode ser enganador comparar a incidência52 de anticorpos29 com Koate-DVI no estudo descrito acima com a incidência52 de anticorpos29 em outros estudos ou outros produtos.
Experiência com pós-comercialização
Como o relatório de pós-comercialização de reações adversas é voluntário e elaborado a partir de uma população de tamanho incerto, nem sempre é possível estimar de forma confiável a frequência dessas reações ou estabelecer uma relação causal com a exposição do produto.
- Transtornos do sistema sanguíneo e linfático53: Inibição do Fator VIII, anemia hemolítica32.
- Distúrbios do sistema imunológico54: Hipersensibilidade, inclusive a anafilaxia16, erupção21 cutânea22, prurido55.
- Lesões56, envenenamento e complicações processuais: Hemorragia45 pós-procedural.
- Distúrbios do sistema nervoso57: Convulsão58 tônico-clônica generalizada
Em casos de eventos adversos, notifique ao Sistema de Notificação de Eventos Adversos a Medicamentos – VIGIMED, ou para a Vigilância Sanitária Estadual ou Municipal.
SUPERDOSE
As consequências da superdosagem não são conhecidas.
Em caso de intoxicação ligue para 0800 709 2444, se você precisar de mais orientações sobre como proceder.
DIZERES LEGAIS
USO RESTRITO A HOSPITAIS
USO PROFISSIONAL
VENDA SOB PRESCRIÇÃO MÉDICA
Registro MS: 1.3641.0017.003-0 – 250 UI FVIII / 5 ml frasco de dose única
Registro MS: 1.3641.0017.002-2 – 500 UI FVIII / 5 ml frasco de dose única
Registro MS: 1.3641.0017.001-4 – 1000 UI FVIII / 10 ml de frasco de dose única
Responsável Técnico: Luiz C. de Almeida Neto – CRF/PR: 12968
Fabricado por:
Grifols Therapeutics LLC
Research Triangle Park, NC
27709 USA
U.S. License Nº 1871
Importado e Distribuído por:
Grifols Brasil, Ltda.
Avenida Gianni Agnelli, 1909.
83607-430– Campo Largo - PR
CGC: 02513899/0001-71
SAC 0800 709 2444






