Paxlovid (Bula do profissional de saúde)
WYETH INDÚSTRIA FARMACÊUTICA LTDA
IDENTIFICAÇÃO DO MEDICAMENTO
Paxlovid®
nirmatrelvir e ritonavir
Comprimidos 150 mg + 100 mg
FORMA FARMACÊUTICA E APRESENTAÇÃO:
Comprimidos revestidos
Embalagens contendo 5 blisters diários. Cada blister diário contém 4 comprimidos revestidos de nirmatrelvir e 2 comprimidos revestidos de ritonavir, totalizando 30 comprimidos revestidos por cartucho
VIA DE ADMINISTRAÇÃO: USO ORAL
USO ADULTO
COMPOSIÇÃO:
Cada comprimido de nirmatrelvir contém:
| nirmatrelvir | 150 mg |
| excipiente q.s.p. | 1 comprimido |
Excipientes: celulose microcristalina, lactose1 monoidratada, croscarmelose sódica, dióxido de silício coloidal, estearilfumarato de sódio, hipromelose (E464), dióxido de titânio (E171), macrogol (E1521) e óxido de ferro vermelho (E172).
Cada comprimido de ritonavir contém:
| ritonavir | 100 mg |
| excipiente q.s.p. | 1 comprimido |
Excipientes: copovidona, laurato de sorbitana, sílica coloidal anidra (E551), hidrogenofosfato de cálcio anidro, estearilfumarato de sódio, hipromelose (E464), dióxido de titânio (E171), macrogol (E1521), hidroxipropilcelulose (E463), talco (E553b), sílica coloidal anidra (E551) e polissorbato 80 (E433).
INFORMAÇÕES TÉCNICAS AOS PROFISSIONAIS DE SAÚDE2
INDICAÇÕES
Paxlovid é indicado para o tratamento de doença do coronavírus 2019 (COVID-19) leve a moderada em pacientes adultos com resultados positivos do teste viral direto para síndrome3 respiratória aguda grave por coronavírus 2 (SARS-CoV-2) e que têm alto risco de progressão para COVID-19 grave, incluindo hospitalização ou óbito4.
Limitações de Uso:
- Paxlovid não está autorizado para início de tratamento em pacientes que requerem hospitalização devido a COVID-19 grave ou crítico.
- Paxlovid não está autorizado para profilaxia pré-exposição5 ou pós-exposição para prevenção de COVID-19.
- Paxlovid não está autorizado para uso por mais de 5 dias.
RESULTADOS DE EFICÁCIA
Eficácia clínica
Eficácia em participantes em alto risco de progressão para doença COVID-19 grave (EPIC-HR)
A eficácia do Paxlovid é baseada na análise final do EPIC-HR, um estudo de fase 2/3, randomizado6, duplo-cego, controlado por placebo7 em participantes adultos sintomáticos não hospitalizados com diagnóstico8 de infecção9 por SARS-CoV-2 confirmado por laboratório. Os participantes elegíveis tinham 18 anos de idade ou mais e pelo menos 1 dos fatores de risco a seguir para progressão para doença grave: diabetes10, sobrepeso11 (IMC12 >25), doença pulmonar crônica (incluindo asma13), doença renal14 crônica, fumante atualmente, doença imunossupressora ou tratamento imunossupressor15, doença cardiovascular, hipertensão16, doença falciforme, transtornos do neurodesenvolvimento, câncer17 ativo, dependência tecnológica relacionada ao tratamento médico ou 60 anos de idade ou mais, independentemente de comorbidades18. Participantes com início dos sintomas19 de COVID-19 ≤ 5 dias foram incluídos no estudo.
Os participantes foram randomizados (1:1) para receber Paxlovid (nirmatrelvir/ritonavir 300 mg/100 mg) ou placebo7 por via oral a cada 12 horas por 5 dias. O estudo excluiu indivíduos com histórico de infecção9 prévia por COVID-19 ou vacinação. O desfecho de eficácia primário foi a proporção de participantes com hospitalização relacionada à COVID-19 ou óbito4 por qualquer causa até o Dia 28. O tempo para o alívio sustentado e a resolução sustentada de todos os sintomas19 alvo até o Dia 28 foram os principais objetivos secundários de eficácia. Estas análises foram feitas no conjunto de análise de intenção de tratar modificada (mITT) [todos os participantes tratados com início dos sintomas19 ≤ 3 dias que, na avaliação inicial, não receberam ou não era esperado que recebessem tratamento terapêutico com anticorpo20 monoclonal (mAb) para COVID-19], o conjunto de análise mITT1 (todos os participantes tratados com início dos sintomas19 ≤ 5 dias que, na avaliação inicial, não receberam ou não era esperado que recebessem tratamento terapêutico com mAb para a COVID-19) e o conjunto de análise mITT2 (todos os participantes com início dos sintomas19 ≤ 5 dias).
Um total de 2.113 participantes foi randomizado6 para receber Paxlovid ou placebo7. Na avaliação inicial, a idade média era de 45 anos; 51% eram mulheres; 71% eram brancos, 4% eram negros ou afro-americanos e 15% eram asiáticos; 41% eram hispânicos ou latinos; 67% dos participantes tiveram início dos sintomas19 ≤ 3 dias antes do início do tratamento do estudo; 49% dos participantes eram sorologicamente negativos na avaliação inicial. A carga viral média (DP) na avaliação inicial era de 4,71 log10 cópias/mL (2,89); 27% dos participantes tinham uma carga viral na avaliação inicial ≥ 7 log10 cópias/mL; 6% dos participantes receberam ou era esperado que recebessem tratamento terapêutico com mAb para COVID-19 no momento da randomização e foram excluídos das análises mITT e mITT1.
As características demográficas e da doença na avaliação inicial foram equilibradas entre os grupos de Paxlovid e placebo7.
A Tabela 1 fornece resultados do desfecho primário na população de análise de mITT1 demonstrando superioridade de Paxlovid em comparação ao placebo7 para hospitalização ou morte relacionada à COVID-19 por qualquer causa até o Dia 28. Para o desfecho primário, a redução de risco relativa na população de análise mITT1 para o Paxlovid comparada ao placebo7 foi de 86% [Intervalo de Confiança (IC) de 95%: 72%, 93%].
Tabela 1. Resultados de eficácia em adultos não hospitalizados com COVID-19 que foram medicados dentro de 5 dias do início dos sintomas19 e que não receberam tratamento com mAb para COVID-19 na avaliação inicial (conjunto de análise mITT1)
|
|
Paxlovid |
Placebo7 |
|
Hospitalização relacionada a COVID-19 ou óbito4 por qualquer causa até o Dia 28 |
||
|
n (%) |
9 (0,9%) |
64 (6,5%) |
|
Redução com relação ao placeboa (IC de 95%), % |
-5,64 (-7,31; -3,97) |
|
|
Valor p |
<0,0001 |
|
|
Mortalidade21 por todas as causas até a Semana 24, % |
0 |
15 (1,5%) |
Abreviações: IC = intervalo de confiança; COVID-19 = doença do coronavírus 2019; mAb = anticorpo20 monoclonal; mITT1 = intenção de tratar modificada 1 (todos os participantes designados aleatoriamente à intervenção do estudo, que tomaram pelo menos 1 dose de intervenção do estudo, com pelo menos 1 visita após a avaliação inicial até o Dia 28, que, na avaliação inicial, não receberam ou não era esperado que recebessem tratamento terapêutico com mAb para a COVID-19 e foram tratados ≤5 dias após o início dos sintomas19 de COVID-19).
A determinação da eficácia primária foi baseada em uma análise interina planejada de 754 participantes na população mITT. A redução de risco estimada foi de -6,5%, com um IC de 95% de (-9,3%; -3,7%) e valor p bilateral <0,0001.
a A proporção cumulativa estimada de participantes hospitalizados ou óbito4 até o Dia 28 foi calculada para cada grupo de tratamento usando o método de Kaplan-Meier, em que os participantes sem status de hospitalização e óbito4 até o Dia 28 foram verificados no momento da descontinuação do estudo.
Até a Semana 24, nenhum óbito4 foi relatado no grupo de Paxlovid em comparação a 15 óbitos no grupo de placebo7. As proporções de participantes que descontinuaram o tratamento devido a um evento adverso foram de 2,0% no grupo do Paxlovid e de 4,3% no grupo de placebo7.
Resultados consistentes foram observados nas populações de análise mITT e mITT2. Um total de 1318 participantes foram incluídos na população de análise mITT. As taxas de evento foram de 5/671 (0,75%) no grupo do Paxlovid e de 44/647 (6,80%) no grupo de placebo7.
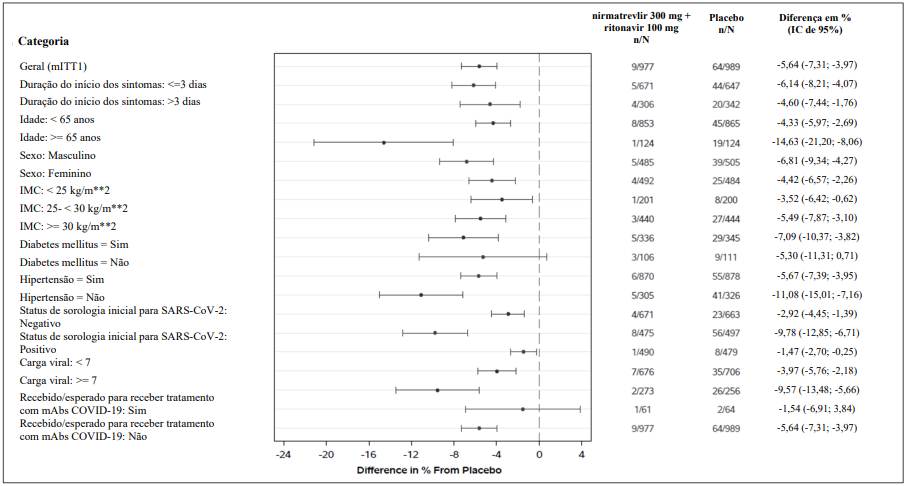
Tendências similares foram observadas em subgrupos de participantes (vide Figura 1).
Figura 1: Adultos com COVID-19 medicados dentro de 5 dias do início dos sintomas19 com hospitalização relacionada a COVID-19 ou óbito4 por qualquer causa até o Dia 28
Abreviações: IMC12 = índice de massa corporal22, COVID-19 = doença do coronavírus 2019; mAb = anticorpo20 monoclonal; mITT1 = intenção de tratar modificada 1 (todos os participantes designados aleatoriamente a intervenção do estudo, que tomaram pelo menos 1 dose de intervenção do estudo, com pelo menos 1 visita após a avaliação inicial até o Dia 28, que, na avaliação inicial, não receberam ou não era esperado que recebessem tratamento terapêutico com mAb para a COVID-19 e foram tratados ≤5 dias após o início dos sintomas19 de COVID- 19); N = número de participantes na categoria do conjunto de análise; SARS-COV-2 = síndrome3 respiratória aguda grave por coronavírus 2.
Todas as categorias são baseadas na população mITT1, exceto por tratamento com mAb para COVID-19, que é baseada na população mITT2.
A soropositividade foi definida se os resultados eram positivos em ensaio Elecsys anti SARS-CoV-2 S ou Elecsys SARS-CoV-2 (N).
A diferença das proporções nos 2 grupos de tratamento e seu intervalo de confiança de 95% com base em uma aproximação normal dos dados são apresentados.
Os participantes realizaram autoavaliações diárias de sintomas19 associados à COVID-19 de tosse, falta de ar ou dificuldade para respirar, sensação de febre23, calafrios24 ou tremores, dores musculares ou no corpo, diarreia25, náuseas26, vômitos27, dor de cabeça28, dor de garganta29, nariz30 entupido ou escorrendo. A severidade de cada sintoma31 foi classificada como ausente, leve, moderada ou grave. O alívio sustentado dos sintomas19 foi definido como o primeiro de 4 dias consecutivos em que todos os sintomas19 acima pontuados como moderados ou graves na entrada do estudo foram pontuados como leves ou ausentes, e todos os sintomas19 acima pontuados como leves ou ausentes na entrada do estudo foram pontuados como ausentes. A resolução sustentada dos sintomas19 foi definida como o momento em que todos os sintomas19 acima foram pontuados como ausentes por 4 dias consecutivos. A Tabela 2 apresenta os resultados referentes ao tempo para alívio sustentado dos sintomas19 e resolução sustentada dos sintomas19 na população mITT1. O grupo Paxlovid demonstrou superioridade em relação ao grupo placebo7 em ambas as análises.
Tabela 2. Análise do tempo para alívio sustentado dos sintomas19 e resolução sustentada dos sintomas19 ao longo de 28 Dias (conjunto de análise mITT1): EPIC-HR
|
|
Paxlovid |
Placebo7 |
|
Tempo para alívio sustentado dos sintomas19 (dias)a |
||
|
Mediana |
13 |
15 |
|
TR vs placebo7 (IC de 95%)b |
1,266 (1,134; 1,412) |
|
|
Valor p |
<0,0001 |
|
|
Tempo para resolução sustentada dos sintomas19 (dias)a |
||
|
Mediana |
16 |
19 |
|
TR vs placebo7 (IC de 95%)b |
1,200 (1,068; 1,348) |
|
|
Valor p |
0,0022 |
|
Abreviações: IC = intervalo de confiança; HR = razão de risco; COVID-19 = doença do coronavírus 2019; mAb = anticorpo20 monoclonal; mITT1 = intenção de tratar modificada 1 (todos os participantes designados aleatoriamente à intervenção do estudo, que tomaram pelo menos 1 dose de intervenção do estudo, com pelo menos 1 visita após a avaliação inicial até o Dia 28, que, na avaliação inicial, não receberam ou não era esperado que recebessem tratamento terapêutico com mAb para a COVID-19 e foram tratados ≤ 5 dias após o início dos sintomas19 de COVID-19); SARS-CoV-2 = coronavírus 2 da síndrome3 respiratória aguda grave.
a. Os participantes que foram hospitalizados para o tratamento de COVID-19 ou morreram durante o período de 28 dias foram considerados como não alcançando alívio sustentado dos sintomas19 ou resolução.
b. A avaliação foi feita em um modelo de risco proporcional de Cox com efeitos de tratamento e região geográfica como variáveis independentes e duração do início dos sintomas19 (≤3, >3 dias), status sorológico SARS-CoV-2 na avaliação inicial e carga viral na avaliação inicial (<4, ≥4 log10 cópias/mL) como covariáveis.
A proporção de participantes com qualquer sintoma31 COVID-19 severo associado foi de 22% no grupo Paxlovid e 19% no grupo placebo7 na avaliação inicial (Dia 1), 17% e 18%, respectivamente, durante o tratamento (do Dia 2 ao Dia 6) e 8% e 11%, respectivamente, após o tratamento (do Dia 7 ao Dia 28).
Eficácia em participantes vacinados com pelo menos 1 fator de risco32 para progressão para doença COVID-19 grave (EPIC-SR)
O EPIC-SR foi um estudo de Fase 2/3, randomizado6, duplo-cego, controlado por placebo7 em participantes adultos sintomáticos não hospitalizados com um diagnóstico8 confirmado em laboratório de infecção9 por SARS-CoV-2. Os participantes elegíveis tinham 18 anos de idade ou mais com início dos sintomas19 de COVID-19 ≤5 dias que estavam em risco padrão para progressão para doença grave. O estudo incluiu participantes não vacinados anteriormente sem fatores de risco ou participantes totalmente vacinados com pelo menos 1 dos fatores de risco para progressão para doença grave (conforme definição apresentada na Seção EPIC-HR acima e práticas e regulamentos locais). Um total de 1.296 participantes foi randomizado6 (1:1) para receber Paxlovid ou placebo7 por via oral a cada 12 horas por 5 dias; desses, 49% estavam vacinados na avaliação inicial com pelo menos 1 fator de risco32 para progressão para doença grave.
As análises de eficácia apresentadas abaixo são baseadas em participantes vacinados com pelo menos 1 fator de risco32 para progressão para doença grave. Em participantes vacinados, a Tabela 3 fornece os resultados da proporção de participantes com hospitalização relacionada à COVID-19 ou óbito4 por qualquer causa até o Dia 28 (desfecho secundário de EPIC-SR). A redução de risco relativa na população de análise mITT1 para o Paxlovid comparada ao placebo7 foi de 58%. O resultado não alcançou significância estatística.
Tabela 3. Resultados de eficácia em adultos vacinados não hospitalizados com pelo menos 1 fator de risco32 para progressão para COVID-19 grave que foram medicados dentro de 5 dias do início dos sintomas19 (conjunto de análise mITT1)
|
|
Paxlovid |
Placebo7 |
|
Hospitalização relacionada a COVID-19 ou óbito4 por qualquer causa até o Dia 28 |
||
|
n (%) |
3 (0,9%) |
7 (2,2%) |
|
Redução com relação ao placeboa (IC de 95%), % |
-1,292 (-3,255; 0,671) |
|
|
Mortalidade21 por todas as causas até o Dia 28, % |
0 |
1 (0,3%) |
Abreviações: IC = intervalo de confiança; COVID-19 = doença do coronavírus 2019; mITT1 = intenção de tratar modificada 1 (todos os participantes designados aleatoriamente à intervenção do estudo que tomaram pelo menos 1 dose de intervenção do estudo e com pelo menos 1 visita após a avaliação inicial até o Dia 28).
a. A proporção cumulativa estimada de participantes hospitalizados ou óbito4 até o Dia 28 foi calculada para cada grupo de tratamento usando o método de Kaplan-Meier, em que os participantes sem status de hospitalização e óbito4 até o Dia 28 foram verificados no momento da descontinuação do estudo.
Profilaxia pós-exposição (EPIC-PEP)
O EPIC-PEP foi um estudo de Fase 2/3, randomizado6, duplo-cego, duplo-simulado e controlado por placebo7 para avaliar a eficácia do Paxlovid (administrado por 5 dias ou 10 dias) na profilaxia pós-exposição da COVID-19 em contatos familiares de indivíduos sintomáticos infectados pelo SARS-CoV-2. Os participantes elegíveis eram adultos assintomáticos com 18 anos de idade ou mais que estavam negativos para SARS-CoV-2 na triagem e que moravam na mesma residência com indivíduos sintomáticos com um diagnóstico8 recente de SARS-CoV-2. Um total de 2.736 participantes foi randomizado6 (1:1:1) para receber Paxlovid por via oral a cada 12 horas por 5 dias, Paxlovid por via oral a cada 12 horas por 10 dias ou placebo7.
Em comparação ao placebo7, os regimes de Paxlovid de 5 dias e de 10 dias levaram a uma redução de risco relativo de 30% e 36%, respectivamente, no risco de desenvolver uma infecção9 sintomática33 por SARS-CoV-2 confirmada por transcriptase reversa–reação de polimerase em cadeia (RT-PCR34) ou teste rápido de antígeno35 (RAT) por contato familiar; esses resultados não alcançaram significância estatística. Em uma análise post hoc, o risco de desenvolver uma infecção9 por SARS-CoV-2 sintomática33 ou assintomática confirmada foi reduzido em 31% e 35% com os regimes de Paxlovid de 5 dias e 10 dias, respectivamente, em comparação ao placebo7 (Tabela 4).
Tabela 4. Resultados de eficácia em infecção9 por SARS-CoV-2 sintomática33 confirmada por RT-PCR34 ou RAT ou infecção9 por SARS-CoV-2 sintomática33 ou assintomática confirmada por RT-PCR34 ou RAT em participantes expostos ao SARS-CoV-2 por contato familiar (conjunto de análise mITT)
|
|
Paxlovid |
Placebo7 |
|
|
5 dias (N=844) |
10 dias (N=830) |
||
|
Infecção9 por SARS-CoV-2 sintomática33 confirmada por RT-PCR34 ou RAT até o Dia 14 |
|||
|
n (%) |
22 (2,6%) |
20 (2,4%) |
33 (3,9%) |
|
Redução de risco relativo vs. placebo7 (IC de 95%) |
0,298 (-0,167; 0,578) |
0,355 (-0,115; 0,627) |
|
|
Valor p |
0,1722 |
0,1163 |
|
|
Infecção9 por SARS-CoV-2 sintomática33 ou assintomática confirmada por RT-PCR34 ou RAT até o Dia 14a |
|||
|
n (%) |
39 (4,6%) |
36 (4,3%) |
59 (7,0%) |
|
Redução de risco relativo vs. placebo7 (IC de 95%) |
0,305 (-0,006; 0,520) |
0,347 (0,044; 0,554) |
|
|
Valor p |
0,0535 |
0,0284 |
|
Abreviações: IC = intervalo de confiança; mITT = todos os participantes randomizados para intervenção do estudo que tomaram pelo menos 1 dose da intervenção do estudo e tiveram resultado de RT-PCR34 negativo na avaliação inicial; RAT = teste rápido de antígeno35; RT-PCR34 = transcriptase reversa–reação de polimerase em cadeia; SARS-CoV-2 = síndrome3 respiratória aguda grave por coronavírus 2.
a. Análise post hoc.
Referências Bibliográficas:
- Hammond J, Leister-Tebbe H, Gardner A, et al. Oral nirmatrelvir for high-risk, nonhospitalized adults with Covid-19. N Engl J Med. 2022 Apr 14;386(15):1397-1408.
CARACTERÍSTICAS FARMACOLÓGICAS
Propriedades farmacodinâmicas
Mecanismo de ação
O nirmatrelvir é um inibidor de peptidomimético da protease principal do SARS-CoV-2 (Mpro), também chamada de protease tipo 3C (3CLpro) ou protease nsp5. A inibição do SARS-CoV-2 Mpro torna a proteína incapaz de processar precursores da poliproteína, levando à prevenção da replicação viral.
O ritonavir não é ativo contra o SARS-CoV-2 Mpro. O ritonavir inibe o metabolismo36 mediado por CYP3A do nirmatrelvir, fornecendo concentrações plasmáticas aumentadas do nirmatrelvir.
Atividade antiviral
Atividade antiviral in vitro
O nirmatrelvir demonstrou atividade antiviral contra infecção9 por SARS-CoV-2 de células37 epiteliais brônquicas humanas normais diferenciadas (dNHBE), uma linhagem celular epitelial alveolar pulmonar humana primária (valor de EC50 de 61,8 nM e valor de EC90 de 181 nM) após 3 dias de exposição ao medicamento.
A atividade antiviral de nirmatrelvir contra as subvariantes Ômicron BA.2, BA.2.12.1, BA.4, BA.4.6, BA.5, BF.7 (P252L+F294L), BF.7 (T243I), BQ.1.11, BQ.1 e XBB.1.5 foi avaliada em células37 Vero E6-TMPRSS2 na presença de um inibidor de P-gp. O nirmatrelvir teve um valor mediano de EC50 de 73 nM (intervalo: 39-146 nM) contra as subvariantes Ômicron, refletindo alterações no valor de EC50 ≤1,5 em relação ao isolado USA-WA1/2020.
Além disso, a atividade antiviral do nirmatrelvir contra as variantes SARS-CoV-2 Alpha, Beta, Gamma, Delta, Lambda, Mu e Ômicron BA.1 foi avaliada em células37 knockout Vero E6 P-gp. O nirmatrelvir teve um valor mediano de EC50 de 25 nM (intervalo: 16-141 nM). A variante Beta foi a variante menos suscetível testada, com uma mudança de valor EC50 de 3,7 em relação ao USA WA1/2020. As outras variantes tiveram alterações no valor EC50 ≤1,1 em relação aos USA WA1/2020.
Resistência antiviral em cultura de células37 e ensaios bioquímicos
Os resíduos do SARS-CoV-2 Mpro potencialmente associados à resistência ao nirmatrelvir foram identificados usando uma variedade de métodos, incluindo a seleção de resistência ao SARS-CoV-2, testes de vírus38 SARS-CoV- 2 recombinantes com substituições Mpro e ensaios bioquímicos com SARS-CoV-2 Mpro recombinantes contendo substituições de aminoácidos. A Tabela 5 indica substituições de Mpro e combinações de substituições de Mpro que foram observadas no SARS-CoV-2 selecionado com nirmatrelvir. As substituições individuais do Mpro são listadas independentemente de terem ocorrido isoladamente ou em combinação com outras substituições do Mpro. Nota-se que as substituições Mpro S301P e T304I se sobrepõem às posições P6 e P3 do local de clivagem nsp5/nsp6 localizado no terminal C do Mpro. Substituições em outros locais de clivagem Mpro não foram associadas à resistência ao nirmatrelvir em cultura de células37. O significado clínico dessas substituições é desconhecido.
Tabela 5. Substituição de aminoácido SARS-CoV-2 Mpro selecionados por nirmatrelvir em cultura de células37
|
Substituição única (Valor de EC50 vezes mudança) |
T21I (1,1-4,6), L50F (1,5-4,2), P108S (ND), T135I (ND), F140L (4,1), S144A (2,2-5,3), C160F (ND), E166A (3,3), E166V (25-288), L167F (ND), T169I (ND), H172Y (ND), A173V (0,9-1,7), V186A (ND), R188G (ND), A191V (ND), A193P (ND), P252L (5,9), S301P (ND) e T304I (1,4-5,5). |
|
Substituições ≥ 2 (Valor de EC50 vezes mudança) |
T21I+S144A (9,4), T21I+E166V (83), T21I+A173V (3,1), T21I+T304I (3,0-7,9), L50F+E166V (34-175), L50F+T304I (5,9), T135I+T304I (3,8), F140L+A173V (10,1), H172Y+P252L (ND), A173V+T304I (20,2), T21I+L50F+A193P+S301P (28,8), T21I+S144A+T304I (27,8), T21I+C160F+A173V+V186A+T304I (28,5), T21I+A173V+T304I (15) e L50F+F140L+L167F+T304I (54,7). |
Abreviações: ND=sem dados (substituição surgiu da seleção de resistência ao nirmatrelvir, mas não foi testada para determinação de EC50 em um ensaio antiviral).
Em um ensaio bioquímico usando SARS-CoV-2 Mpro recombinante contendo substituições de aminoácidos, as seguintes substituições de SARS-CoV-2 Mpro levaram a uma atividade reduzida ≥3 vezes (alteração de vezes com base nos valores de Ki) de nirmatrelvir: Y54A (25), F140A (21), F140L (7,6), F140S (230), G143S (3,6), S144A (46), S144E (480), S144T (170), H164N (6,7), E166A (35), E166G (6,2), E166V (7.700), P168del (9,3), H172Y
(250), A173S (4,1), A173V (16), R188G (38), Q192L (29), Q192P (7,8) e V297A (3,0). Além disso, as seguintes combinações de substituições de Mpro levaram a atividade de nirmatrelvir ≥3 vezes reduzida: T21I+S144A (20), T21I+E166V (11.000), T21I+A173V (15), L50F+E166V (4.500), E55L+S144A (56), T135I+T304I (5,1), F140L+A173V (95), S144A+T304I (28), E166V+L232R (5.700), P168del+A173V (170), H172Y+P252L (180), A173V+T304I (28), T21I+S144A+T304I (51), T21I+A173V+T304I (55), L50F+E166A+L167F (180), T21I+L50F+A193P+S301P (7,3), L50F+F140L+L167F+T304I (190) e T21I+C160F+A173V+V186A+T304I(28). As seguintes substituições e combinações de substituição surgiram na cultura celular, mas conferiram atividade de nirmatrelvir <3 vezes reduzida em ensaios bioquímicos: T21I (1,6), L50F (0,2), P108S (2,9), T135I (2,2), C160F (0,6), L167F (0,9), T169I (1,4), V186A (0,8), A191V (0,8), A193P (0,9), P252L (0,9), S301P (0,2), T304I (1,0), T21I+T304I (1,8) e L50F+T304I (1.3). O significado clínico dessas substituições é desconhecido.
A maioria das substituições de aminoácidos Mpro simples e algumas duplas identificadas que reduziram a suscetibilidade do SARS-CoV-2 ao nirmatrelvir resultaram em um deslocamento EC50 <5 vezes em comparação ao SARS-CoV-2 do tipo selvagem em um ensaio de células37 antivirais. O vírus38 contendo E166V mostra a maior redução na suscetibilidade ao nirmatrelvir e parece ter defeito de replicação, uma vez que não pôde ser gerado ou tinha uma titulação de vírus38 muito baixa. Em geral, substituições triplas e algumas duplas de aminoácidos Mpro levaram a alterações EC50 de >5 vezes às do tipo selvagem. O significado clínico precisa ser melhor compreendido, particularmente no contexto da alta exposição clínica do nirmatrelvir (≥5× EC90). Até o momento, essas substituições não foram identificadas como substituições emergentes do tratamento associadas à hospitalização ou morte nos estudos EPIC-HR ou EPIC-SR.
Substituições emergentes do tratamento foram avaliadas entre os participantes em ensaios clínicos39 EPIC-HR/SR com dados de sequência disponíveis tanto na consulta inicial quanto após a consulta inicial (n=907 participantes tratados com Paxlovid, n=946 participantes tratados com placebo7). As alterações de aminoácidos Mpro do SARS- CoV-2 foram classificadas como substituições emergentes do tratamento Paxlovid se estivessem ausentes na linha de base, ocorressem na mesma posição de aminoácidos em 3 ou mais participantes tratados com Paxlovid e fossem ≥2,5 vezes mais comuns em participantes tratados com Paxlovid do que os participantes tratados com placebo7 após a dose. Foram observadas as seguintes substituições Mpro emergentes do tratamento Paxlovid: T98I/R/del (n=4), E166V (n=3) e W207L/R/del (n=4). Nos locais de clivagem de Mpro, foram observadas as seguintes substituições emergentes do tratamento Paxlovid: A5328S/V (n=7) e S6799A/P/Y (n=4). Essas substituições de locais de clivagem não foram associadas à co-ocorrência de quaisquer substituições específicas de Mpro.
Nenhuma das substituições emergentes do tratamento listadas acima nos locais de clivagem de Mpro ou Mpro ocorreu em participantes tratados com Paxlovid que sofreram hospitalização. Assim, o significado clínico dessas substituições é desconhecido.
Rebote de carga viral
Aumentos pós-tratamento nos níveis de RNA nasal do SARS-CoV-2 (ou seja, rebote de RNA viral) foram observados no Dia 10 e/ou no Dia 14 em um subconjunto de indivíduos recebendo Paxlovid e placebo7 no EPIC- HR e EPIC-SR, independentemente dos sintomas19 de COVID-19. A frequência da detecção de rebote de RNA viral nasal pós-tratamento variou conforme os parâmetros de análise, mas foi similar de um modo geral entre os indivíduos recebendo Paxlovid e placebo7. Um percentual similar ou menor de indivíduos recebendo placebo7 em comparação àqueles recebendo Paxlovid tiveram resultados de RNA viral nasal < limite inferior de quantificação (LIDQ) em todos os pontos do tempo do estudo nos períodos de tratamento e pós-tratamento.
O rebote de RNA viral pós-tratamento não foi associado ao desfecho clínico primário de hospitalização relacionada à COVID-19 ou morte por qualquer causa até o Dia 28 após o curso único de 5 dias do tratamento Paxlovid. A relevância clínica dos aumentos pós-tratamento no RNA viral após tratamento com Paxlovid ou placebo7 é desconhecida.
O EPIC-HR e o EPIC-SR não foram projetados para avaliar o rebote sintomático40 do RNA viral, e a maioria dos episódios de rebote dos sintomas19 ocorreu após o Dia 14 (o último dia em que os níveis de RNA do SARS-CoV-2 foram avaliados rotineiramente). A frequência de rebote dos sintomas19 até o Dia 28, independentemente dos resultados do RNA viral, foi semelhante entre os recebedores de Paxlovid e placebo7.
Resistência cruzada
Não é esperada resistência cruzada entre o nirmatrelvir e remdesivir ou qualquer outro agente anti-SARS-CoV-2 com mecanismos diferentes de ação (ou seja, agentes que não são inibidores de Mpro).
Efeitos farmacodinâmicos
Eletrofisiologia cardíaca
Em 3 vezes o pico da concentração plasmática (Cmáx) no estado estacionário na dose recomendada, o nirmatrelvir não prolonga o intervalo QTc em qualquer extensão clinicamente relevante.
Efeitos sobre os níveis de RNA viral
Alterações com relação à avaliação inicial em comparação ao placebo7 no Dia 5 nos níveis de RNA viral em amostras nasofaríngeas estão resumidas por estudo na Tabela 6.
Tabela 6: Análise de alteração com relação à avaliação inicial até o Dia 5 em log10 (níveis de RNA viral, cópias/mL); EPIC-HR, EPIC-SR e EPIC-PEP (conjunto de análise mITT1)
|
|
EPIC-HR (mITT1a) |
EPIC-SR (mITT1b) |
EPIC-PEP (mITT1c) |
|||
|
|
Paxlovid |
Placebo7 |
Paxlovid |
Placebo7 |
Paxlovid |
Placebo7 |
|
VoC primáriad |
Delta (99%) |
Delta (79%) |
Ômicron (82%) |
|||
|
Avaliação inicial |
n=764 |
n=784 |
n=542 |
n=514 |
n=86e |
n=29 |
|
Mediana |
6,075 |
5,990 |
6,615 |
6,430 |
4,330 |
4,930 |
|
Média (DP) |
5,780 |
5,617 |
6,214 |
6,045 |
4,647 |
4,837 |
|
Dia 5 |
n=676 |
n=683 |
n=498 |
n=473 |
n=84 |
n=28 |
|
Mudança mediana da linha de base |
-2,990 |
-2,160 |
-3,680 |
-2,630 |
-3,020 |
-1,895 |
|
Redução mediana em relação ao placebo7 |
-0,830 |
|
-1,050 |
|
-1,125 |
|
|
Alteração ajustada com relação à avaliação inicial, média (IC de 95%) |
-3,087 |
-2,310 |
-3,419 |
-2,551 |
-3,279 |
-1,715 |
|
Redução média com relação ao placebo7, média (IC de 95%) |
-0,777 |
|
-0,868 |
|
-1,564 |
|
|
Valor p |
<0,0001 |
|
<0,0001 |
|
0,0004 |
|
Abreviações: IC = intervalo de confiança; COVID-19 = doença do coronavírus 2019; mAb = anticorpo20 monoclonal; mITT = intenção de tratar modificada; RT-PCR34 = transcriptase reversa–reação de polimerase em cadeia; DP = desvio padrão; VoC = variante de preocupação.
a. Todos os participantes tratados com início dos sintomas19 ≤5 dias e que, na avaliação inicial, não receberam ou não era esperado que recebessem tratamento terapêutico com mAb contra a COVID-19.
b. Todos os participantes tratados com pelo menos 1 visita após a avaliação inicial até o Dia 28; 57% desses participantes eram vacinados contra COVID-19 na avaliação inicial.
c. Todos os participantes tratados com um resultado de RT-PCR34 positivo na avaliação inicial.
d. O percentual de linhagem VoC está relacionado a todas as populações do estudo para EPIC-HR e EPIC-SR, e aos participantes infectados por COVID-19 nas populações de mITT e mITT1 do EPIC-PEP.
e. Participantes que receberam o Paxlovid por 5 dias e 10 dias estão combinados.
O grau de redução nos níveis de RNA viral com relação ao placebo7 após 5 dias de tratamento com Paxlovid foi similar entre os estudos, incluindo aqueles que inscreveram participantes não vacinados (EPIC-HR) e aqueles que inscreveram tanto participantes vacinados quanto não vacinados (EPIC-SR e EPIC-PEP).
Efeito sobre os lipídios
As alterações em lipídios no grupo tratado com nirmatrelvir/ritonavir não foram estatisticamente diferentes daquelas do grupo tratado com placebo7/ritonavir em uma análise exploratória de lipídios em múltiplas coortes de dose crescente em que participantes saudáveis foram randomizados para receber doses crescentes (75, 250 e 500 mg) de nirmatrelvir (n=4 por coorte41) ou placebo7 (n=2 por coorte41), potencializado com ritonavir 100 mg, duas vezes ao dia por 10 dias.
Em participantes recebendo placebo7/ritonavir duas vezes ao dia, foi observado um aumento modesto de colesterol42 (≤27,2 mg/dL43), colesterol42 LDL44 (≤23,2 mg/dL43), triglicerídeos (≤64,3 mg/dL43) e uma redução no colesterol42 HDL45 (≤4 mg/dL43). O significado clínico dessas alterações com tratamento de curto prazo é desconhecido.
Propriedades Farmacocinéticas
A farmacocinética do nirmatrelvir/ritonavir foi estudada em participantes saudáveis e em participantes com COVID-19 leve a moderada.
O ritonavir é administrado com o nirmatrelvir como um potenciador farmacocinético, resultando em concentrações sistêmicas mais altas e meia-vida mais longa do nirmatrelvir. Em participantes saudáveis no estado de jejum, a meia-vida (t1/2) média de uma dose única de 150 mg de nirmatrelvir, administrada isoladamente foi de aproximadamente 2 horas, em comparação a 7 horas após a administração de uma dose única de 250 mg/100 mg de nirmatrelvir/ritonavir, com isso embasando um regime de administração duas vezes ao dia.
Mediante a administração de uma dose única de nirmatrelvir/ritonavir 250 mg/100 mg em participantes saudáveis no estado de jejum, a concentração plasmática máxima (Cmáx) da média geométrica (CV%) e a área sob a curva de concentração plasmática em função do tempo de 0 até o momento da última medição (AUC46last) foi de 2,88 ug/mL (25%) e 27,6 ug*hr/mL (13%), respectivamente. Mediante dose repetida de nirmatrelvir/ritonavir 75 mg/100 mg, 250 mg/100 mg e 500 mg/100 mg, administrada duas vezes ao dia, o aumento da exposição sistêmica no estado estacionário parece ser menos que proporcional à dose. Doses múltiplas ao longo de 10 dias alcançaram o estado estacionário no Dia 2, com acumulação aproximada de 2 vezes. As exposições sistêmicas no Dia 5 foram similares às do Dia 10 em todas as doses. Exposições de dose repetida simuladas de nirmatrelvir/ritonavir 300 mg/100 mg administradas duas vezes ao dia em participantes adultos do EPIC-HR sugeriram que a AUC46tau média era de 30,4 µg*hr/mL, a Cmáx média era de 3,43 µg/mL e a Cmín média era de 1,57 µg/mL.
Absorção
Seguindo a administração oral de nirmatrelvir/ritonavir 300 mg/100 mg depois de uma dose única, a Cmáx da média geométrica (CV%) de nirmatrelvir e a área sob a curva de concentração plasmática-tempo de 0 a infinito (AUC46inf) em estado estacionário foi de 2,21 µg/mL (33) e 23,01 µg*hr/mL (23), respectivamente. O tempo médio (intervalo) para Cmáx (Tmáx) foi de 3,00 horas (1,02-6,00). A média aritmética (±DP) de meia-vida de eliminação terminal foi de 6,1 (1,8) horas.
Seguindo a administração oral de nirmatrelvir/ritonavir 300 mg/100 mg depois de uma dose única, a Cmáx da média geométrica (CV%) de ritonavir e a AUC46inf foi de 0,36 µg/mL (46) e 3,60 µg*hr/mL (47), respectivamente. O tempo médio (intervalo) para Cmáx (Tmáx) foi de 3,98 horas (1,48-4,20). A média aritmética (±DP) de meia-vida de eliminação terminal foi de 6,1 (2,2) horas.
Efeito da comida na absorção oral
A dosagem com uma refeição rica em gordura47 aumentou a exposição de nirmatrelvir (aumento de aproximadamente 61% na Cmáx média, e aumento de 20% na AUC46last média), em relação a condições de jejum, após a administração de 300 mg de nirmatrelvir (2 × 150 mg)/100 mg de ritonavir comprimidos.
Distribuição
A ligação do nirmatrelvir à proteína no plasma48 humano é de aproximadamente 69%. A ligação do ritonavir à proteína no plasma48 humano é de aproximadamente 98-99%.
Biotransformação
Estudos in vitro avaliando o nirmatrelvir sem ritonavir concomitante sugerem que o nirmatrelvir é metabolizado principalmente pelo CYP3A4. O nirmatrelvir não é um substrato de outras enzimas CYP. A administração de nirmatrelvir com ritonavir inibe o metabolismo36 do nirmatrelvir. No plasma48 humano, a única entidade relacionada ao medicamento quantificável foi nirmatrelvir inalterado.
Estudos in vitro utilizando microssomos do fígado49 humano demonstraram que o citocromo P450 3A (CYP3A) é a principal isoforma envolvida no metabolismo36 do ritonavir, embora o CYP2D6 também contribua para a formação do metabólito50 de oxidação M–2.
Doses baixas de ritonavir mostraram profundos efeitos sobre a farmacocinética de outros inibidores de protease (e outros produtos metabolizados pelo CYP3A4) e outros inibidores de protease podem influenciar na farmacocinética do ritonavir.
Eliminação
A principal rota de eliminação do nirmatrelvir quando administrado com o ritonavir foi a excreção renal14 de medicamento intacto. Aproximadamente 49,6% e 35,3% da dose administrada de nirmatrelvir 300 mg foi recuperada na urina51 e nas fezes, respectivamente. O nirmatrelvir foi a entidade relacionada ao medicamento predominante, com pequenas quantidades de metabólitos52 surgindo de reações de hidrólise na excreção.
Estudos em humanos com ritonavir com radiomarcação demonstraram que a eliminação do ritonavir ocorreu principalmente pelo sistema hepatobiliar53; aproximadamente 86% da radiomarcação foi recuperada das fezes, parte da qual se espera ser ritonavir não absorvido.
Populações específicas
Uma análise farmacocinética populacional foi realizada reunindo dados de 7 estudos de farmacologia54 clínica concluídos em voluntários saudáveis (idades 21-76 anos de idade) e um estudo de Fase 2/3, EPIC-HR (idades 18-86 anos de idade). Esta análise incluiu o efeito de várias covariáveis, incluindo idade, sexo e raça na farmacocinética de nirmatrelvir. Os estudos nos estudos de farmacologia54 clínica incluíram doses únicas de nirmatrelvir de 150-1500 mg, doses únicas de 100-2250 mg de nirmatrelvir com 100 mg de ritonavir e doses múltiplas de 75-500 mg de nirmatrelvir com 100 mg de ritonavir administrado duas vezes ao dia em durações de dosagem variando de 2-10 dias. No EPIC-HR, o regime de dosagem foi de 300 mg/100 mg duas vezes ao dia e a duração da dosagem foi de 5 dias. É importante observar que as informações incluídas em “Populações específicas” foram obtidas a partir da análise agrupada na avaliação farmacocinética populacional.
Idade e gênero: Na análise farmacocinética populacional, a idade e o gênero não afetaram a farmacocinética do nirmatrelvir.
Pacientes pediátricos: A farmacocinética do nirmatrelvir/ritonavir em pacientes pediátricos não foi avaliada.
Grupos raciais ou étnicos: A exposição sistêmica em participantes japoneses foi numericamente menor, mas não clinicamente significativo diferente daquela em participantes ocidentais. Na análise farmacocinética da população, a raça não afetou a farmacocinética do nirmatrelvir.
Pacientes com insuficiência renal55: Em comparação a controles saudáveis sem insuficiência renal55, a Cmáx e a AUC46inf do nirmatrelvir em participantes com insuficiência renal55 leve foram 30% e 24% maiores; em pacientes com insuficiência renal55 moderada foram 38% e 87% maiores; e em participantes com insuficiência renal55 grave foram 48% e 204% maiores, respectivamente.
Pacientes com insuficiência hepática56: Em comparação a controles saudáveis sem insuficiência hepática56, a farmacocinética do nirmatrelvir em participantes com insuficiência hepática56 moderada não foi significativamente diferente. As proporções das médias geométricas ajustadas (IC de 90%) da AUC46inf e da Cmáx do nirmatrelvir comparando insuficiência hepática56 moderada (teste) com função hepática57 normal (referência) foram de 98,78% (70,65%; 138,12%) e 101,96% (74,20%; 140,11%), respectivamente.
O nirmatrelvir/ritonavir não foi estudado em pacientes com insuficiência hepática56 grave.
Estudos de interações medicamentosas conduzidos com nirmatrelvir
Os dados in vitro indicam que o nirmatrelvir é um substrato para MDR1 glicoproteína-p (P-gp) e CYP3A4 humanos, mas não é um substrato para BCRP, MATE1, MATE2K, NTCP, OAT1, OAT2, OAT3, OCT1, OCT2, PEPT1, OATPs 1B1, 1B3, 2B1 ou 4C1 humanos.
O nirmatrelvir não inibe de modo irreversível CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19 ou CYP2D6 in vitro a concentrações clinicamente relevantes. O nirmatrelvir tem o potencial de inibir de modo reversível e dependente do tempo CYP3A4 e inibir MDR1 (P-gp) e OATP1B1.
O nirmatrelvir não induz nenhum CYP a concentrações clinicamente relevantes.
Estudos de interações medicamentosas conduzidos com ritonavir
Estudos in vitro indicam que o ritonavir é principalmente um substrato do CYP3A. O ritonavir também parece ser um substrato do CYP2D6, que contribui para a formação do metabólito50 de oxidação isopropiltiazol M-2.
O ritonavir é um inibidor do CYP3A e, em menor grau, do CYP2D6. O ritonavir parece induzir CYP3A, CYP1A2, CYP2C9, CYP2C19 e CYP2B6, bem como outras enzimas, incluindo glucuronosiltransferase.
Os efeitos da administração do Paxlovid com itraconazol (inibidor de CYP3A) e carbamazepina (inibidor de CYP3A) sobre a AUC46 e a Cmáx do nirmatrelvir são resumidos na Tabela 7.
Tabela 7. Efeito de medicamentos coadministrados sobre a farmacocinética do nirmatrelvir
|
Medicamento coadministrado |
Dose (cronograma) |
N |
Razão percentual dos parâmetros farmacocinéticos do nirmatrelvira (IC de 90%); |
||
|
Coadministrado |
nirmatrelvir/ ritonavir |
Cmáx |
AUC46b |
||
|
carbamazepinac |
300 mg |
300 mg/100 mg |
10 |
56,82 |
44,50 |
|
itraconazol |
200 mg |
300 mg/100 mg |
11 |
118,57 |
138,82 |
Abreviações: AUC46 = área sob a curva de concentração plasmática em função do tempo; IC = intervalo de confiança; Cmáx = concentrações plasmáticas máximas observadas.
a. Razão percentual de teste (ou seja, carbamazepina ou itraconazol em combinação a nirmatrelvir/ritonavir)/ referência (ou seja, nirmatrelvir/ritonavir sozinho).
b. Para carbamazepina, AUC46=AUC46inf; para itraconazol, AUC46=AUC46tau.
c. carbamazepina titulada até 300 mg duas vezes ao dia no Dia 8 ao Dia 15 (por exemplo, 100 mg duas vezes ao dia do Dia 1 ao Dia 3 e 200 mg duas vezes ao dia do Dia 4 ao Dia 7).
No estudo de interação de Fase 1 com carbamazepina, nirmatrelvir/ritonavir foi administrado em dose única diária (300 mg/100 mg), que difere da posologia aprovada na bula (300 mg/100 mg duas vezes ao dia).
Os efeitos da coadministração do Paxlovid com midazolam (substrato de CYP3A4) ou dabigatrana (substrato de P-gp) sobre a AUC46 e a Cmáx do midazolam e da dabigatrana, respectivamente, são resumidos na Tabela 8.
Tabela 8. Efeito do nirmatrelvir/ritonavir sobre a farmacocinética do medicamento coadministrado
|
Medicamento coadministrado |
Dose (cronograma) |
N |
Razão percentuala de teste/referência de médias geométricas (IC de 90%); |
||
|
Coadministrado |
nirmatrelvir/ ritonavir |
Cmáx |
AUC46b |
||
|
midazolamc |
2 mg |
300 mg/100 mg |
10 |
368,33 |
1430,02 |
|
dabigatranac |
75 mg |
300 mg/100 mg |
24 |
233,06 |
194,47 |
Abreviações: AUC46 = área sob a curva de concentração plasmática em função do tempo; IC = intervalo de confiança; Cmáx = concentrações plasmáticas máximas; P-gp = glicoproteína-p.
a. Razão percentual de teste (ou seja, midazolam ou dabigatrana em combinação a nirmatrelvir/ritonavir)/ referência (ou seja, midazolam ou dabigatrana sozinho).
b. AUC46 = AUC46inf para midazolam e dabigatrana.
c. Para o midazolam, Teste = nirmatrelvir/ritonavir mais midazolam, Referência = midazolam. O midazolam é um substrato de índice para o CYP3A4. Para dabigatrana, Teste = nirmatrelvir/ritonavir mais dabigatrana, Referência = dabigatrana. A dabigatrana é um substrato índice para P-gp.
Dados de segurança pré-clínicos
Toxicologia
Estudos de toxicidade58 de doses repetidas de até 1 mês de duração do nirmatrelvir em ratos e macacos não levaram a resultados adversos.
Estudos de toxicidade58 de doses repetidas do ritonavir em animais identificaram os principais órgãos-alvo, como fígado49, retina59, glândula60 tireoide61 e rins62. As alterações hepáticas63 envolveram elementos hepatocelulares, biliares e fagocíticos e foram acompanhadas por aumentos nas enzimas hepáticas64. Hiperplasia65 do epitélio66 pigmentar da retina59 e degeneração67 da retina59 foram observadas em todos os estudos com roedores realizados com o ritonavir, mas não foram observadas em cães. Evidência ultra estrutural sugere que essas alterações de retina59 podem ser secundárias à fosfolipidose. No entanto, estudos clínicos não revelaram evidência de alterações oculares induzidas por medicamento em humanos. Todas as alterações de tireoide61 foram reversíveis mediante a descontinuação do ritonavir. Investigação clínica em humanos não revelou alteração clinicamente significativa em testes de função da tireoide61.
Alterações renais, incluindo degeneração67 tubular, inflamação68 crônica e proteinúria69 foram observadas em ratos e são consideradas atribuíveis a doença espontânea específica da espécie. Além disso, nenhuma anormalidade renal14 clinicamente significativa foi observada em estudos clínicos.
Carcinogênese
O nirmatrelvir não foi avaliado quanto ao potencial de causar carcinogenicidade.
Estudos de carcinogenicidade de longo prazo do ritonavir em camundongos e ratos revelou potencial tumorigênico específico para essas espécies, mas não são considerados relevantes para humanos.
Genotoxicidade
O nirmatrelvir não foi genotóxico em uma bateria de ensaios, incluindo mutagenicidade bacteriana, aberração cromossômica usando células37 TK6 linfoblastoides humanas e em ensaios de micronúcleo de ratos in vivo.
O ritonavir foi considerado negativo para atividade mutagênica ou clastogênica em uma bateria de ensaios in vitro e in vivo incluindo o ensaio de mutação70 reversa bacteriana Ames usando S. typhimurium e E. coli, o ensaio de linfoma71 do camundongo, o teste de micronúcleo do camundongo e ensaios de aberração cromossômica em linfócitos humanos.
Toxicidade58 reprodutiva
– nirmatrelvir
Em um estudo de fertilidade e desenvolvimento embrionário inicial, nirmatrelvir foi administrado a ratos machos e fêmeas por alimentação por gavagem oral, em doses de 60, 200 ou 1.000 mg/kg/dia uma vez ao dia, começando 14 dias antes do acasalamento, durante a fase de acasalamento, e continuou até o Dia da Gestação (DG) 6 para as fêmeas, e para um total de 32 doses para os machos. Não houve efeitos do nirmatrelvir na fertilidade e no desempenho reprodutivo em doses de até 1.000 mg/kg/dia, representando 5× exposições clínicas na dose aprovada de Paxlovid.
Estudos de toxicidade58 de desenvolvimento embriofetal (EDF) foram conduzidos em ratas e coelhas grávidas, que receberam doses orais de nirmatrelvir de até 1.000 mg/kg/dia durante a organogênese [nos Dias de Gestação (DG) 6 a 17 em ratos e DG 7 a 19 em coelhos]. Não foram observados efeitos de desenvolvimento biologicamente significativos no estudo EDF em ratos. Na dose mais alta de 1.000 mg/kg/dia, a exposição sistêmica ao nirmatrelvir (AUC4624) em ratos foi aproximadamente 9× maior do que as exposições clínicas na dose humana aprovada de Paxlovid. No estudo de EDF de coelho, foram observados menores pesos corporais fetais (redução de 9%) a 1.000 mg/kg/dia na ausência de achados significativos de toxicidade58 materna. Em 1.000 mg/kg/dia, a exposição sistêmica (AUC4624) em coelhos foi aproximadamente 11× maior do que as exposições clínicas na dose humana aprovada de Paxlovid. Nenhuma outra toxicidade58 significativa do desenvolvimento (malformações72 e letalidade embriofetal) foram observadas até a dose mais alta testada, 1.000 mg/kg/dia. Não foram observados efeitos no desenvolvimento em coelhos em 300 mg/kg/dia, resultando em exposição sistêmica (AUC4624) aproximadamente 3× maior do que as exposições clínicas na dose humana aprovada de Paxlovid.
No estudo de desenvolvimento pré e pós-natal, foram observadas reduções de peso corporal (até 8%) na prole de ratas grávidas que receberam nirmatrelvir na exposição sistêmica materna (AUC4624) aproximadamente 9× maior do que as exposições clínicas na dose humana aprovada de Paxlovid. Não foram observadas alterações de peso corporal na prole na exposição sistêmica materna (AUC4624) aproximadamente 6× maior do que as exposições clínicas na dose humana aprovada de Paxlovid.
– ritonavir
O ritonavir não produziu efeitos na fertilidade dos ratos.
O ritonavir foi administrado por via oral a ratas grávidas (a 0, 15, 35 e 75 mg/kg/dia) e coelhas (a 0, 25, 50 e 110 mg/kg/dia) durante a organogênese (no DG 6 a 17 em ratos e 6 a 19 em coelhos). Não foi observada evidência de teratogenicidade devido ao ritonavir em ratos e coelhos na exposição sistêmica (AUC46) 5× (ratos) ou 8× (coelhos) maior do que a exposição na dose humana aprovada de Paxlovid. Incidências aumentadas de reabsorções precoces, atrasos de ossificação e variações de desenvolvimento, bem como pesos corporais fetais diminuídos, foram observados em ratos na presença de toxicidade58 materna na exposição sistêmica aproximadamente 10× maior do que a exposição na dose humana aprovada de Paxlovid. Em coelhos, foram observadas reabsorções, diminuição do tamanho da ninhada e diminuição do peso fetal em doses maternas tóxicas em exposições sistêmicas superiores a 8× maior do que a exposição da dose humana aprovada de Paxlovid. No estudo de desenvolvimento pré e pós-natal em ratos, a administração de 0, 15, 35 e 60 mg/kg/dia de ritonavir do DG 6 até o Dia 20 pós-natal não resultou em toxicidade58 para o desenvolvimento, em exposições sistêmicas superiores a 10× a exposição à dose humana aprovada de Paxlovid.
CONTRAINDICAÇÕES
Paxlovid é contraindicado em pacientes com histórico de hipersensibilidade clinicamente significativa aos princípios ativos (nirmatrelvir/ritonavir) ou a qualquer excipiente do produto.
Paxlovid é contraindicado com medicamentos altamente dependentes de CYP3A para depuração e para os quais concentrações elevadas estão associadas a reações graves e/ou com risco à vida (vide item 6. Interações Medicamentosas). Os medicamentos listados neste item e no item 6. Interações Medicamentosas são um guia e não são considerados uma lista abrangente de todos os medicamentos possíveis que podem ser contraindicados com o Paxlovid.
- Antagonista73 do adrenoreceptor alfa 1: alfuzosina
- Antianginal: ranolazina
- Antiarrítmicos: amiodarona, dronedarona, flecainida, propafenona, quinidina
- Antigota: colchicina
- Antipsicóticos: lurasidona, pimozida
- Agentes de hiperplasia65 prostática benigna: silodosina
- Agentes cardiovasculares: eplerenona, ivabradina
- Derivados de ergot: di-hidroergotamina, ergotamina, metilergonovina
- Inibidores da HMG-CoA redutase: lovastatina, sinvastatina
- Imunossupressores: voclosporina
- Inibidor da proteína de transferência de triglicerídeo microssomal: lomitapida
- Medicamentos para enxaqueca74: eletriptana, ubrogepanto
- Antagonistas dos receptores de mineralocorticoides: finerenona
- Antagonistas de opioides: naloxegol
- Inibidor de PDE5: sildenafila, quando usado para hipertensão arterial75 pulmonar (HAP)
- Sedativos/hipnóticos: triazolam, midazolam oral
- Agonista76 do receptor de serotonina 1A/antagonista73 do receptor de serotonina 2A: flibanserina
- Antagonistas do receptor de vasopressina: tolvaptano
Paxlovid é contraindicado com medicamentos que são indutores potentes de CYP3A em que concentrações plasmáticas do nirmatrelvir ou do ritonavir significativamente reduzidas podem estar associadas à perda potencial da resposta virológica e possível resistência. Paxlovid não pode ser iniciado imediatamente após a descontinuação de qualquer um dos medicamentos a seguir devido à compensação atrasada do indutor de CYP3A recentemente descontinuado (vide item 6. Interações Medicamentosas).
- Medicamentos anticâncer: apalutamida
- Anticonvulsivante: carbamazepina, fenobarbital, primidona, fenitoína
- Antimicobacterianos: rifampicina, rifapentina
- Potenciadores reguladores da condutância transmembrana da fibrose cística77: lumacaftor/ivacaftor
- Produtos fitoterápicos: erva de São João (Hypericum perforatum)
ADVERTÊNCIAS E PRECAUÇÕES
Risco de reações adversas graves devido a interações medicamentosas
O início do Paxlovid, um inibidor do CYP3A, em pacientes recebendo medicamentos metabolizados pelo CYP3A ou o início de medicamentos metabolizados pelo CYP3A em pacientes que já recebem o Paxlovid, pode aumentar as concentrações plasmáticas de medicamentos metabolizados pelo CYP3A.
O início de medicamentos que inibem ou reduzem o CYP3A pode aumentar ou diminuir as concentrações do Paxlovid, respectivamente.
Essas interações podem levar a:
- Reações adversas clinicamente significativas, potencialmente levando a eventos graves, com risco à vida ou fatais devido a exposições maiores de medicamentos concomitantes.
- Reações adversas clinicamente significativas devido à exposições maiores do Paxlovid.
- Perda do efeito terapêutico do Paxlovid e possível desenvolvimento de resistência viral.
Foram relatadas reações adversas severas, com risco de vida e fatais devido a interações medicamentosas em pacientes tratados com Paxlovid.
Veja a Tabela 9 para medicamentos contraindicados para uso concomitante com o nirmatrelvir/ritonavir e para interações potencialmente significativas com outros medicamentos (vide item 6. Interações Medicamentosas; vide item 4. Contraindicações para medicamentos contraindicados para uso concomitante). O potencial para interações medicamentosas deve ser considerado antes e durante a terapia com o Paxlovid; medicamentos concomitantes devem ser revisados durante a terapia com Paxlovid e o paciente deve ser monitorado quanto a reações adversas associadas a medicamentos concomitantes.
Coadministração de Paxlovid com inibidores de calcineurina e inibidores de mTOR
A consulta de um grupo multidisciplinar (por exemplo, envolvendo médicos, especialistas em terapia imunossupressora e/ou especialistas em farmacologia54 clínica) é necessária para lidar com a complexidade dessa coadministração, monitorando de perto e regularmente as concentrações séricas de imunossupressores e ajustando a dose do imunossupressor15 de acordo com as diretrizes mais recentes (vide item 6. Interações Medicamentosas).
Reações de hipersensibilidade
Anafilaxia78, reações de hipersensibilidade e reações cutâneas79 graves (incluindo necrólise epidérmica tóxica80 e síndrome de Stevens-Johnson81) foram relatadas com o Paxlovid (vide item 9. Reações Adversas). Se ocorrerem sinais82 e sintomas19 de reação de hipersensibilidade clinicamente significativa ou anafilaxia78, descontinue imediatamente Paxlovid e inicie medicamentos adequados e/ou cuidados de suporte.
Hepatotoxicidade83
Elevações de transaminase hepática57, hepatite84 clínica e icterícia85 ocorreram em pacientes recebendo ritonavir. Portanto, é preciso ter cuidado ao administrar o Paxlovid em pacientes com doenças hepáticas63 pré-existentes, anormalidades de enzima86 hepática57 ou hepatite84.
Risco de desenvolvimento de resistência do HIV87-1
Como o nirmatrelvir é coadministrado com o ritonavir, pode haver risco de o HIV87-1 desenvolver resistência aos inibidores de protease em indivíduos com infecção9 pelo HIV87-1 não controlada ou não diagnosticada.
Fertilidade, Gravidez88 e Lactação89
Mulheres com potencial para engravidar/Contracepção90 em homens e mulheres
Existem dados limitados em humanos sobre o uso do Paxlovid durante a gravidez88 para informar o risco associado ao medicamento de desfechos adversos de desenvolvimento; as mulheres com potencial para engravidar devem evitar engravidar durante o tratamento com Paxlovid e por 7 dias após completarem o tratamento com Paxlovid.
O uso de ritonavir pode reduzir a eficácia de contraceptivos hormonais combinados. Pacientes que utilizam contraceptivos hormonais combinados devem ser orientados a utilizar um método contraceptivo alternativo eficaz ou um método de contracepção90 de barreira adicional durante o tratamento com Paxlovid e até um ciclo menstrual após a interrupção do Paxlovid (vide item 6. Interações Medicamentosas).
Gravidez88
Existem dados limitados do uso de Paxlovid em mulheres grávidas. O Paxlovid deve ser usado durante a gravidez88 somente se os potenciais benefícios superarem os possíveis riscos para a mãe e o feto91.
Dados de animais com o nirmatrelvir mostraram toxicidade58 do desenvolvimento em coelhos (pesos corporais fetais 9% inferiores), mas não em ratos. Não houve efeito relacionado ao nirmatrelvir sobre a morfologia fetal ou a viabilidade embriofetal a qualquer dose testada em estudos de toxicidade58 no desenvolvimento embriofetal em ratos ou coelhos. Não houve efeitos adversos relacionados ao nirmatrelvir em um estudo de desenvolvimento pré e pós- natal em ratos (vide item 3. Características Farmacológicas – Dados de segurança pré-clínicos).
Um grande número (6.100 nascidos vivos) de mulheres grávidas foi exposto ao ritonavir durante a gestação; desses, 2.800 nascidos vivos foram expostos durante o primeiro trimestre. Esses dados se referem amplamente a exposições em que o ritonavir foi usado em terapia combinada92 e não a doses terapêuticas de ritonavir, mas a doses menores como aprimorador farmacocinético para outros inibidores de protease, simulares às doses de ritonavir usadas para nirmatrelvir/ritonavir. Esses dados não indicam aumento na taxa de defeitos de nascimento em comparação às taxas observadas nos sistemas de vigilância de defeitos de nascimento baseados na população.
Dados de animais com o ritonavir mostraram toxicidade58 reprodutiva (vide item 3. Características Farmacológicas – Dados de segurança pré-clínicos).
Paxlovid é um medicamento classificado na categoria B de risco de gravidez88. Portanto, este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Lactação89
Não há dados humanos sobre o uso de Paxlovid na lactação89.
Não se sabe se o nirmatrelvir está presente no leite humano ou animal, e os efeitos dele sobre o recém-nascido/bebê em aleitamento materno93 ou os efeitos sobre a produção de leite. Dados publicados limitados relatam que o ritonavir está presente no leite humano. Não há informações sobre os efeitos do ritonavir sobre o recém-nascido/bebê em aleitamento materno93 ou os efeitos do medicamento sobre a produção de leite. Um risco para o recém-nascido/bebê não pode ser excluído. O aleitamento materno93 deve ser interrompido durante o tratamento com Paxlovid e por 7 dias após a conclusão do tratamento com Paxlovid.
Fertilidade
Não existem dados humanos sobre o efeito do Paxlovid na fertilidade. Não existem dados humanos disponíveis sobre o efeito do nirmatrelvir na fertilidade. O nirmatrelvir não produziu efeitos sobre a fertilidade em ratos (vide item 3. Características Farmacológicas – Dados de segurança pré-clínicos).
Não existem dados humanos sobre o efeito do ritonavir na fertilidade. O ritonavir não produziu efeitos sobre a fertilidade em ratos.
Efeitos na habilidade de dirigir e operar máquinas
Não existem estudos clínicos que avaliaram os efeitos do Paxlovid sobre a capacidade de dirigir e operar máquinas.
Atenção: Este medicamento contém AÇÚCAR94, portanto, deve ser usado com cautela em portadores de Diabetes10.
INTERAÇÕES MEDICAMENTOSAS
Paxlovid (nirmatrelvir/ritonavir) é um inibidor forte de CYP3A e um inibidor de CYP2D6, P-gp e OATP1B1. A coadministração de Paxlovid com medicamentos que são metabolizados principalmente pelo CYP3A e CYP2D6 ou são transportados pela P-gp ou OATP1B1 pode resultar no aumento das concentrações plasmáticas de tais medicamentos e aumentar o risco de reações adversas.
Os medicamentos que são extensivamente metabolizados por CYP3A e, com alto metabolismo36 de primeira passagem, parecem ser mais suscetíveis a grandes aumentos de exposição quando coadministrados com nirmatrelvir/ritonavir. Assim, a coadministração de Paxlovid com medicamentos altamente dependentes de CYP3A para depuração e para os quais concentrações plasmáticas elevadas estão associadas a eventos graves e/ou com risco à vida, é contraindicada (vide item 4. Contraindicações).
A coadministração de outros substratos de CYP3A4 que podem levar a interação potencialmente significativa deve ser considerada apenas se os benefícios superarem os riscos (vide Tabela 9).
O nirmatrelvir e o ritonavir são substratos de CYP3A; portanto, os medicamentos que induzem CYP3A podem diminuir as concentrações plasmáticas de nirmatrelvir e ritonavir, e reduzir o efeito terapêutico do Paxlovid.
Os medicamentos listados na Tabela 9 são um guia e não são considerados uma lista exaustiva de todos os medicamentos possíveis que podem interagir com nirmatrelvir/ritonavir. O profissional de saúde2 deve consultar as referências adequadas para informações abrangentes.
Tabela 9. Interações medicamentosas estabelecidas e outras potencialmente significantes
|
Classe de medicamento |
Medicamentos dentro da classe |
Efeito na concentração |
Comentários clínicos |
|||
|
Antagonista73 do receptor adrenérgico95 alfa 1 |
alfuzosina |
↑ alfuzosina |
A coadministração é contraindicada devido à potencial hipotensão96 (vide item 4. Contraindicações). |
|||
|
tansulosina |
↑ tansulosina |
Evitar o uso concomitante com Paxlovid. |
||||
|
Antianginoso |
ranolazina |
↑ ranolazina |
A coadministração é contraindicada devido a possíveis reações graves e/ou com risco à vida (vide item 4. Contraindicações). |
|||
|
Antiarrítmicos |
amiodarona, dronedarona, flecainida, propafenona, quinidina |
antiarrítmico97 |
A coadministração é contraindicada devido ao potencial para arritmia98 cardíaca (vide item 4. Contraindicações). |
|||
|
lidocaína (sistêmica), disopiramida |
antiarrítmico97 |
É necessário cautela e o monitoramento da concentração terapêutica99 é recomendado para antiarrítmicos, se disponível. |
||||
|
Medicamentos anticâncer |
apalutamida |
↓ nirmatrelvir/ritonavir |
A coadministração é contraindicada devido à perda potencial de resposta virológica e possível resistência (vide item 4. Contraindicações). |
|||
|
abemaciclibe, ceritinibe, dasatinibe, encorafenibe, ibrutinibe, ivosidenibe, neratinibe, nilotinibe, venetoclax, vimblastina, vincristina |
↑ medicamentos anticâncer |
Evite a coadministração de encorafenibe ou ivosidenibe devido ao risco potencial de eventos adversos graves, como prolongamento do intervalo QT. Evite o uso de neratinibe, venetoclax ou ibrutinibe. A coadministração de vincristina e vimblastina pode levar a efeitos colaterais100 hematológicos ou gastrointestinais significativos. |
||||
|
Anticoagulantes101 |
varfarina |
↑↓ varfarina |
Monitore de perto a INR se for necessária coadministração com varfarina. |
|||
|
rivaroxabana |
↑ rivaroxabana |
Risco de sangramento aumentado com rivaroxabana. Evite o uso concomitante. |
||||
|
dabigatranaa |
↑ dabigatrana |
Risco de sangramento aumentado com dabigatrana. Dependendo da indicação da dabigatrana e da função renal14, reduzir a dose de dabigatrana ou evitar o uso concomitante. Consulte a bula do produto dabigatrana para obter mais informações. |
||||
|
apixabana |
↑ apixabana |
A combinação de P-gp e inibidores fortes de CYP3A4 aumentam os níveis sanguíneos de apixabana e aumentam o risco de sangramento. As recomendações posológicas para a coadministração de apixabana com Paxlovid dependem da dose de apixabana. Consulte a bula do produto apixabana para obter mais informações. |
||||
|
Anticonvulsivantes |
carbamazepinaa, fenobarbital, fenitoína, primidona |
↓ nirmatrelvir/ritonavir |
A coadministração é contraindicada devido à perda potencial de resposta virológica e possível resistência (vide item 4. Contraindicações). |
|||
|
clonazepam |
↑ anticonvulsivante |
Uma redução da dose pode ser necessária para clonazepam quando coadministrado com Paxlovid e monitoramento clínico é recomendado. |
||||
|
Antidepressivos |
bupropiona |
↓ bupropiona e hidroxibupropiona com metabólito50 ativo |
Monitorar para uma resposta clínica adequada à bupropiona. |
|||
|
trazodona |
↑ trazodona |
Reações adversas de náusea102, tontura103, hipotensão96 e síncope104 foram observadas após a coadministração de trazodona e ritonavir. Uma dose menor de trazodona deve ser considerada. Consulte a bula do produto trazodona para mais informações. |
||||
|
Antifúngicos |
voriconazol |
↓ voriconazol |
Evite o uso concomitante de voriconazol. |
|||
|
cetoconazol, sulfato de isavuconazônio, itraconazola |
↑ cetoconazol ↑ sulfato de isavuconazônio ↑ itraconazol
↑ nirmatrelvir/ritonavir |
Consulte as bulas dos produtos cetoconazol, sulfato de isavuconazônio e itraconazol para mais informações. |
||||
|
Antigota |
colchicina |
↑ colchicina |
A coadministração é contraindicada devido ao potencial de reações graves e/ou com risco à vida em pacientes com insuficiência hepática56 e/ou renal14 (vide item 4. Contraindicações). |
|||
|
Inibidores de protease anti-HIV87 |
atazanavir, darunavir, tipranavir |
↑ inibidor de protease |
Para mais informações, consulte as respectivas informações para prescrição de inibidores de protease.
Pacientes que estão tomando regimes para HIV87 contendo ritonavir ou cobicistate devem continuar o tratamento conforme indicado. Monitorar o aumento de eventos adversos do Paxlovid ou do inibidor de protease (vide item 8. Posologia e Modo de usar). |
|||
|
Anti-HIV87 |
efavirenz, maraviroque, nevirapina, zidovudina, bictegravir/entricitabina/tenofovir |
↑ efavirenz ↑ maraviroque ↑ nevirapina ↓ zidovudina ↑ bictegravir ↔ entricitabina ↑ tenofovir |
Para mais informações, consulte as respectivas informações para prescrição de medicamentos anti-HIV87. |
|||
|
Anti-infectivos |
claritromicina, eritromicina |
↑ claritromicina ↑ eritromicina |
Consulte as respectivas informações para prescrição para ajuste de dose de medicamentos anti-infectivos. |
|||
|
Antimicobacteriano |
rifampicina, rifapentina |
↓ nirmatrelvir/ritonavir |
A coadministração é contraindicada devido à perda potencial de resposta virológica e possível resistência. Medicamentos antimicobacterianos alternativos, como rifabutina, devem ser considerados (vide item 4. Contraindicações). |
|||
|
bedaquilina |
↑ bedaquilina |
Consulte a bula do produto bedaquilina para mais informações. |
||||
|
rifabutina |
↑ rifabutina |
Consulte a bula do produto rifabutina para mais informações sobre a redução da dose de rifabutina. |
||||
|
Antipsicóticos |
lurasidona, pimozida |
↑ lurasidona ↑ pimozida |
A coadministração é contraindicada devido a reações graves e/ou com risco à vida, como arritmias105 cardíacas (vide item 4. Contraindicações). |
|||
|
quetiapina |
↑ quetiapina |
Se a coadministração for necessária, reduza a dose de quetiapina e monitore reações adversas associadas à quetiapina. Consulte as informações para prescrição de quetiapina para recomendações. |
||||
|
clozapina |
↑ clozapina |
Se a coadministração for necessária, considerar a redução da dose de clozapina e monitorar reações adversas. |
||||
|
Agentes de hiperplasia65 prostática benigna |
silodosina |
↑ silodosina |
A coadministração é contraindicada devido ao potencial de hipotensão96 postural (vide item 4. Contraindicações). |
|||
|
Bloqueadores do canal de cálcio |
anlodipino, diltiazem, felodipino, nicardipina, nifedipina, verapamil |
↑ bloqueador do canal de cálcio |
É necessário cautela e o monitoramento clínico de pacientes é recomendado. Uma redução de dose pode ser necessária para esses medicamentos quando coadministrados com o Paxlovid. Se coadministrados, consulte a bula do produto bloqueador do canal de cálcio individual para mais informações. |
|||
|
Glicosídeos cardíacos |
digoxina |
↑ digoxina |
É necessário cuidado ao coadministrar o Paxlovid com a digoxina, com monitoramento adequado dos níveis séricos de digoxina. Consulte a bula do produto digoxina para mais informações. |
|||
|
Agentes cardiovasculares |
eplerenona |
↑ eplerenona |
A coadministração com eplerenona é contraindicada devido ao potencial de hipercalemia106 (vide item 4. Contraindicações). |
|||
|
ivabradina |
↑ ivabradina |
A coadministração com ivabradina é contraindicada devido ao potencial de bradicardia107 ou distúrbios de condução (vide item 4. Contraindicações). |
||||
|
alisquireno, ticagrelor, vorapaxar
clopidogrel, |
↑ alisqireno ↑ ticagrelor ↑ vorapaxar
metabólito50 ativo do clopidogrel |
Evite o uso concomitante com Paxlovid. |
||||
| cilostazol | ↑ cilostazol | Recomenda-se o ajuste da dose de cilostazol. Consulte a bula do produto cilostazol para obter mais informações. | ||||
|
Corticosteroides metabolizados principalmente pelo CYP3A |
betametasona, budesonida, ciclesonida, dexametasona, fluticasona, metilprednisolona, mometasona, triancinolona |
↑ corticosteroide |
A coadministração com corticosteroides (todas as vias de administração) cujas exposições são aumentadas significativamente por fortes inibidores do CYP3A pode aumentar o risco de síndrome de Cushing108 e supressão adrenal. No entanto, o risco de síndrome de Cushing108 e supressão adrenal associada ao uso a curto prazo de um forte inibidor de CYP3A4 é baixo. Corticosteroides alternativos devem ser considerados, incluindo beclometasona, prednisona e prednisolona. |
|||
|
Potenciadores reguladores da condutância transmembrana da fibrose cística77 |
lumacaftor/ivacaftor |
↓ nirmatrelvir/ritonavir |
A coadministração é contraindicada devido à potencial perda de resposta virológica e possível resistência (vide item 4. Contraindicações). |
|||
|
ivacaftor elexacaftor/ tezacaftor/ivacaftor tezacaftor/ivacaftor |
↑ ivacaftor ↑ elexacaftor/ tezacaftor/ivacaftor ↑ tezacaftor/ivacaftor |
Reduza a dosagem quando coadministrado com Paxlovid. Consulte as bulas dos produtos individuais para obter mais informações. |
||||
|
Inibidores de dipeptidil peptidase 4 (DPP4) |
saxagliptina |
↑ saxagliptina |
Recomenda-se o ajuste da dose de saxagliptina. Consulte a bula do produto saxagliptina para obter mais informações. |
|||
|
Receptor de endotelina antagonistas |
bosentana |
↑ bosentana |
Descontinue o uso de bosentana pelo menos 36 horas antes do início do Paxlovid.
Consulte a bula do produto bosentana para mais informações. |
|||
|
Derivados de ergot |
di-hidroergotamina, ergotamina, metilergonovina |
↑ di-hidroergotamina ↑ ergotamina ↑ metilergonovina |
A coadministração é contraindicada devido ao potencial de toxicidade58 aguda do ergot caracterizada por vasoespasmo e isquemia109 das extremidades e outros problemas, incluindo o sistema nervoso central110 (vide item 4. Contraindicações). |
|||
|
Antivirais de ação direta contra a hepatite84 C |
elbasvir/grazoprevir, |
↑ antiviral |
Concentrações maiores de grazoprevir podem resultar em elevações de ALT. |
|||
|
glecaprevir/pibrentasvir |
Evite o uso concomitante de glecaprevir/pibrentasvir com Paxlovid. |
|||||
|
ombitasvir/paritaprevir/ ritonavir e dasabuvir |
Consulte a bula do ombitasvir/paritaprevir/ritonavir e do dasabuvir para mais informações. |
|||||
|
sofosbuvir/velpatasvir/ voxilaprevir |
Consulte a bula do produto sofosbuvir/velpatasvir/voxilaprevirpara mais informações. Pacientes que estão tomando regimes para HCV contendo ritonavir devem continuar o tratamento conforme indicado. Monitorar o aumento de eventos adversos do medicamento HCV ou Paxlovid com o uso concomitante (vide item 8. Posologia e Modo de usar). |
|||||
|
Produtos fitoterápicos |
Erva de São João (Hypericum perforatum) |
↓ nirmatrelvir/ritonavir |
A coadministração é contraindicada devido à perda potencial de resposta virológica e possível resistência (vide item 4. Contraindicações). |
|||
|
Inibidores da HMG-CoA redutase |
lovastatina, sinvastatina |
↑ lovastatina ↑ sinvastatina |
A coadministração é contraindicada devido ao potencial para miopatia111, incluindo rabdomiólise112 (vide item 4. Contraindicações). Descontinue o uso de lovastatina e sinvastatina pelo menos 12 horas antes do início do Paxlovid, durante os 5 dias de tratamento com Paxlovid e durante 5 dias após completar Paxlovid. |
|||
|
atorvastatina, rosuvastatina |
↑ atorvastatina ↑ rosuvastatina |
Considere a descontinuação temporária de atorvastatina e rosuvastatina durante o tratamento com Paxlovid. A atorvastatina e a rosuvastatina não precisam ser mantidas antes ou depois de completar Paxlovid. |
||||
|
Contraceptivo hormonal |
etinilestradiol |
↓ etinilestradiol |
Um método contraceptivo adicional não hormonal deve ser considerado durante os 5 dias de tratamento com Paxlovid e até um ciclo menstrual após a interrupção do Paxlovid. |
|||
|
Imunossupressores |
voclosporina |
↑ voclosporina |
A coadministração é contraindicada devido ao potencial de nefrotoxicidade113 aguda e/ou crônica) (vide item 4. Contraindicações). |
|||
|
Inibidores de calcineurina: ciclosporina, tacrolimo
Inibidores de mTOR: everolimo, sirolimo |
↑ ciclosporina ↑ tacrolimo
↑ everolimo ↑ sirolimo |
Evite o uso concomitante de inibidores de calcineurina e inibidores de mTOR durante o tratamento com Paxlovid. Recomenda-se, durante e após o tratamento com Paxlovid, o ajuste da dose do imunossupressor15 e a monitorização próxima e regular das concentrações do imunossupressor15 e das reações adversas associadas ao imunossupressor15. Consulte a bula do produto imunossupressor15 individual e as diretrizes mais recentes para obter mais informações e obter consulta especializada de um grupo multidisciplinar (vide item 5. Advertências e Precauções). |
||||
|
Inibidores da Janus quinase (JAK) |
tofacitinibe |
↑ tofacitinibe |
Recomenda-se o ajuste da dose de tofacitinibe. Consulte a bula do produto tofacitinibe para obter mais informações. |
|||
|
upadacitinibe |
↑ upadacitinibe |
As recomendações posológicas para a coadministração de upadacitinibe com Paxlovid dependem da indicação de upadacitinibe. Consulte a bula do produto upadacitinibe para obter mais informações. |
||||
|
Agonista76 de receptores beta-adrenérgicos114 de ação prolongada |
salmeterol |
↑ salmeterol |
Evite o uso concomitante com Paxlovid. A combinação pode resultar em risco aumentado de eventos adversos cardiovasculares associados a salmeterol, incluindo prolongamento do QT, palpitações115 e taquicardia116 sinusal. |
|||
|
Inibidor da proteína de transferência de triglicerídeos microssomais (PTTM) |
lomitapida |
↑ lomitapida |
A coadministração é contraindicada devido ao potencial de hepatotoxicidade83 e reações adversas gastrointestinais (vide item 4. Contraindicações). |
|||
|
Medicamentos para enxaqueca74 |
eletriptana |
↑ eletriptana |
A coadministração de eletriptana dentro de pelo menos 72 horas após Paxlovid é contraindicada devido ao potencial de reações adversas graves, incluindo eventos cardiovasculares e cerebrovasculares (vide item 4. Contraindicações). |
|||
|
ubrogepanto |
↑ ubrogepanto |
A coadministração de ubrogepanto com Paxlovid é contraindicada devido ao potencial de reações adversas graves (vide item 4. Contraindicações). |
||||
|
rimegepanto |
↑ rimegepanto |
Evite o uso concomitante com Paxlovid. |
||||
|
Antagonistas dos receptores de mineralocorticoides |
finerenona |
↑ finerenona |
A coadministração é contraindicada devido ao potencial de reações adversas graves, incluindo hipercalemia106, hipotensão96 e hiponatremia117 (vide item 4. Contraindicações). |
|||
|
Antagonistas dos receptores muscarínicos |
darifenacina |
↑ darifenacina |
A dose diária de darifenacina não deve exceder 7,5 mg quando coadministrada com Paxlovid. Consulte a bula do produto darifenacina para obter mais informações. |
|||
|
Analgésicos118 narcóticos |
fentanila, hidrocodona, oxicodona, meperidina |
↑ fentanila ↑ hidrocodona, ↑ oxicodona, ↑ meperidina |
Recomenda-se monitoramento cuidadoso de efeitos terapêuticos e adversos (incluindo potencial depressão respiratória fatal) quando a fentanila, hidrocodona, oxicodona ou meperidina é administrada de modo concomitante com o Paxlovid. Se o uso concomitante com Paxlovid for necessário, considere uma redução da dosagem do analgésico119 narcótico e monitore os pacientes de perto em intervalos frequentes. Consulte a bula do produto individual para obter mais informações. |
|||
| metadona | ↓ metadona | Monitore pacientes mantidos em metadona de perto quanto a evidências de efeitos de abstinência e ajuste a dose de metadona de acordo. | ||||
|
Agentes neuropsiquiátricos |
suvorexanto |
↑ suvorexanto |
Evite o uso concomitante de suvorexanto com Paxlovid. |
|||
|
aripiprazol, brexpiprazol, cariprazina, iloperidona, lumateperona, pimavanserina |
↑ aripiprazol, ↑ brexpiprazol, ↑ cariprazina, ↑ iloperidona, ↑ lumateperona, ↑ pimavanserina |
Recomenda-se o ajuste da dose de aripiprazol, brexpiprazol, cariprazina, iloperidona, lumateperona e pimavanserina. Consulte a bula do produto individual para obter mais informações. |
||||
|
Agentes de hipertensão16 pulmonar [(inibidores de Fosfodiesterase (PDE5)]
Agentes de hipertensão16 pulmonar (estimuladores de GCs) |
sildenafila |
↑ sildenafila |
A coadministração de sildenafila com Paxlovid é contraindicada devido ao potencial para eventos adversos associados ao sildenafila, incluindo anomalias visuais, hipotensão96, ereção120 prolongada e síncope104 (vide item 4. Contraindicações). |
|||
|
tadalafila |
↑ tadalafila |
Evite o uso concomitante de tadalafila com Paxlovid. |
||||
|
riociguate |
↑ riociguate |
É recomendado ajuste de dose para riociguate. Consulte a bula do produto riociguate para obter mais informações. |
||||
|
Agentes de disfunção erétil (inibidores de PDE5) |
avanafila |
↑ avanafila |
Não use Paxlovid com avanafila porque um regime de dosagem de avanafila seguro e eficaz não foi estabelecido. |
|||
|
sildenafila tadalafila vardenafila |
↑ sildenafila ↑ tadalafila ↑ vardenafila |
É recomendado ajuste de dose para sildenafila, tadalafila ou vardenafila cm Paxlovid. Consulte a bula do produto individual para obter mais informações. | ||||
|
Antagonistas de opioides |
naloxegol |
↑ naloxegol |
A coadministração é contraindicada devido ao potencial de sintomas19 de abstinência de opioides (vide item 4. Contraindicações). |
|||
|
Sedativos/ hipnóticos |
triazolam, midazolam orala |
↑ triazolam ↑ midazolam |
Coadministração contraindicada devido ao potencial para depressão respiratória e sedação121 extremas (vide item 4. Contraindicações). |
|||
|
buspirona, clorazepato, diazepam, estazolam, flurazepam, zolpidem |
↑ sedativo/hipnótico |
Uma diminuição da dose pode ser necessária para esses medicamentos quando coadministrados com Paxlovid e monitoramento de eventos adversos. |
||||
| midazolam (administrado por via parenteral) | ↑ midazolam |
A coadministração do midazolam (parenteral) deve ser feita em um contexto que garanta monitoramento clínico de perto e gerenciamento médico adequado em caso de depressão respiratória e/ou sedação121 prolongada. A redução de dosagem para o midazolam deve ser considerada, especialmente se mais de uma única dose de midazolam for administrada. Consulte a bula do produto midazolam para mais informações. |
||||
|
Agonista76 do receptor de serotonina 1A/antagonista73 do receptor de serotonina 2A |
flibanserina |
↑ flibanserina |
A coadministração é contraindicada devido ao potencial de hipotensão96, síncope104 e depressão do SNC122 (vide item 4. Contraindicações). |
|||
|
Antagonistas do receptor de vasopressina |
tolvaptano |
↑ tolvaptano |
A coadministração é contraindicada devido ao potencial de desidratação123, hipovolemia124 e hipercalemia106 (vide item 4. Contraindicações). |
|||
a. Vide item 3. Características Farmacológicas – Propriedades Farmacocinéticas, estudos de interações medicamentosas conduzidos com nirmatrelvir e ritonavir.
CUIDADOS DE ARMAZENAMENTO DO MEDICAMENTO
Cuidados de conservação
Paxlovid deve ser conservado em temperatura ambiente (15–30°C). Paxlovid pode ser utilizado por 24 meses a partir da data de fabricação.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Características físicas e organolépticas do produto
- nirmatrelvir: Comprimido revestido rosa, oval, com uma dimensão de aproximadamente 17,6 mm de comprimento e 8,6 mm de largura, gravado com 'PFE' de um lado e '3CL' do outro lado.
- ritonavir: Comprimido revestido branco a esbranquiçado, em forma de cápsula, com uma dimensão de aproximadamente 17,1 mm de comprimento e 9,1 mm de largura, gravado com 'H' de um lado e 'R9' do outro lado.
Antes de usar, observe o aspecto do medicamento.
TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS.
POSOLOGIA E MODO DE USAR
Paxlovid é composto por compridos de nirmatrelvir embalados com comprimidos de ritonavir.
O nirmatrelvir deve ser coadministrado com o ritonavir. A falha na coadministração correta de nirmatrelvir com ritonavir pode resultar em níveis plasmáticos de nirmatrelvir insuficientes para atingir o efeito terapêutico desejado.
Posologia
A dosagem recomendada em pacientes adultos é de 300 mg de nirmatrelvir (dois comprimidos de 150 mg) com 100 mg de ritonavir (um comprimido de 100 mg), todos tomados juntos por via oral duas vezes ao dia, durante 5 dias. Paxlovid deve ser administrado assim que possível após o diagnóstico8 de COVID-19 ter sido feito e no prazo de 5 dias do início dos sintomas19, mesmo que os sintomas19 iniciais do COVID-19 sejam leves. A conclusão do curso de tratamento completo de 5 dias é recomendada mesmo que o paciente precise de hospitalização devido a COVID-19 grave ou crítica após começar o tratamento com Paxlovid.
Se o paciente perder uma dose do Paxlovid dentro de 8 horas da hora usual, o paciente deverá tomá-la assim que possível e retomar o cronograma de dosagem normal. Se o paciente perder uma dose por mais de 8 horas, o paciente não deverá tomar a dose perdida e, em vez disso, deverá tomar a próxima dose no horário normal agendado. O paciente não deve dobrar a dose para compensar uma dose perdida.
Seleção de pacientes
As seguintes condições médicas ou outros fatores colocam pacientes adultos em alto risco de progressão para COVID-19 grave:
- Idade avançada (por exemplo, 60 anos de idade ou mais)
- Obesidade125 ou sobrepeso11 [por exemplo, índice de massa corporal22 (IMC12) >25 kg/m2]
- Tabagista atual
- Doença renal14 crônica
- Diabetes10
- Doença imunossupressora ou tratamento imunossupressor15
- Doença cardiovascular (incluindo doença cardíaca congênita126) ou hipertensão16
- Doença pulmonar crônica [por exemplo, doença pulmonar obstrutiva crônica, asma13 (moderada a grave), doença pulmonar intersticial127, fibrose cística77 e hipertensão16 pulmonar]
- Doença falciforme
- Distúrbios do neurodesenvolvimento (por exemplo, paralisia128 cerebral, síndrome de Down129) ou outras condições que conferem complexidade médica (por exemplo, síndromes genéticas ou metabólicas e anomalias congênitas130 graves)
- Câncer17 ativo
- Dependência tecnológica relacionada ao tratamento médico não referente à COVID-19 (por exemplo, traqueostomia131, gastrostomia132 ou ventilação133 por pressão positiva)
Outras condições ou fatores médicos (por exemplo, raça ou etnia) também podem colocar pacientes individuais em alto risco de progressão para COVID-19 grave e o uso aprovado do Paxlovid não está limitado aos fatores ou às condições médicas listados acima. Profissionais de saúde2 devem considerar o risco benefício para um paciente individual.
Populações especiais
População pediátrica: A segurança e a eficácia do Paxlovid não foram estudadas em pacientes menores de 18 anos de idade.
Insuficiência renal55: Nenhum ajuste de dose é necessário em pacientes com insuficiência renal55 leve (TFG ≥60 a <90 mL/min).
Em pacientes com insuficiência renal55 moderada (TFG ≥30 a <60 mL/min), a dose do Paxlovid deve ser reduzida para nirmatrelvir/ritonavir 150 mg/100 mg duas vezes ao dia, por 5 dias.
Paxlovid não é recomendado em pacientes com insuficiência renal55 grave (TFG <30 mL/min) até que mais dados estejam disponíveis; a dosagem adequada para pacientes134 com insuficiência renal55 grave não foi determinada (vide item 3. Características Farmacológicas – Propriedades Farmacocinéticas).
Insuficiência hepática56: Nenhum ajuste de dose é necessário para pacientes134 com insuficiência hepática56 leve (Classe Child-Pugh A) ou moderada (Classe Child-Pugh B).
Nenhum dado farmacocinético ou de segurança estão disponíveis com relação ao uso de nirmatrelvir ou ritonavir em pacientes com insuficiência hepática56 grave (Classe Child-Pugh C); portanto, Paxlovid não é recomendado para uso em pacientes com insuficiência hepática56 grave (vide item 3. Características Farmacológicas – Propriedades Farmacocinéticas).
Terapia concomitante com esquema contendo ritonavir ou cobicistate
Nenhum ajuste de dose é necessário; a dose do Paxlovid é de 300 mg/100 mg duas vezes ao dia por 5 dias.
Pacientes diagnosticados com infecção9 pelo vírus38 da imunodeficiência135 humana (HIV87) ou pelo vírus38 da hepatite84 C (HCV) que estão recebendo esquema contendo ritonavir ou cobicistate devem continuar o tratamento conforme indicado.
Método de administração
Para uso oral.
Paxlovid pode ser tomado com ou sem alimentos (vide item 3. Características Farmacológicas – Propriedades Farmacocinéticas). Os comprimidos devem ser engolidos inteiros e não mastigados, partidos ou triturados.
Este medicamento não deve ser partido, aberto ou mastigado.
REAÇÕES ADVERSAS
Resumo do perfil de segurança
A segurança do Paxlovid foi baseada em dados de três estudos de Fase 2/3 randomizados, controlados por placebo7 em participantes adultos de 18 anos de idade ou mais (vide item 3. Características Farmacológicas – Propriedades Farmacodinâmicas):
- O Estudo C4671005 (EPIC-HR) e o Estudo C4671002 (EPIC-SR) investigaram o Paxlovid (nirmatrelvir/ritonavir 300 mg/100 mg) a cada 12 horas por 5 dias em participantes sintomáticos com um diagnóstico8 confirmado em laboratório de infecção9 por SARS-CoV-2. Os participantes precisavam apresentar COVID-19 leve a moderada na avaliação inicial.
- O Estudo C4671006 (EPIC-PEP) investigou o Paxlovid (nirmatrelvir/ritonavir 300 mg/100 mg) a cada 12 horas por 5 ou 10 dias em contato familiar assintomático de indivíduos com um diagnóstico8 recente de infecção9 por SARS-CoV-2. Os participantes precisavam ter um resultado negativo para SARS-CoV-2 na avaliação inicial.
Nos três estudos, 3.515 participantes receberam uma dose de Paxlovid e 2.585 participantes receberam uma dose de placebo7. As reações adversas mais comuns (≥1% de incidência136 no grupo de Paxlovid e ocorrendo a uma frequência maior que no grupo de placebo7) foram disgeusia137 (5,9% e 0,4%, respectivamente), diarreia25 (2,9% e 1,9%, respectivamente) e mialgia138 (1% e < 1%).
Resumo tabulado de reações adversas ao medicamento (RAMs)
As reações adversas ao medicamento na Tabela 10 são listadas abaixo pela classe de sistema de órgãos.
Tabela 10. Reações Adversas ao Medicamento (RAMs) por Classe de Sistema de Órgãos e Categoria de Frequência do Conselho de Organizações Internacionais de Ciências Médicas (CIOMS) listados em ordem de gravidade médica decrescente ou importância clínica dentro de cada categoria de frequência e Classe de Sistema de Órgãos (SOC).
|
Classe de Sistema de Órgãos |
Muito Comum |
Comum |
Incomum |
Rara |
Muito Rara |
Frequência desconhecida |
|
Distúrbios do sistema imune139 |
|
|
Hipersensibilidade* |
Anafilaxia78* |
|
|
|
Distúrbios do sistema nervoso140 |
|
Disgeusia137a Cefaleia141a |
|
|
|
|
|
Distúrbios vasculares142 |
|
|
Hipertensão16* |
|
|
|
|
Distúrbios gastrointestinais |
|
Diarreia25a Náusea102* |
Vômitos27a Dor abdominal* |
|
|
|
|
Distúrbios da pele e tecido subcutâneo143 |
|
|
|
Necrólise epidérmica tóxica80* Síndrome3 de Stevens- Johnson* |
|
|
|
Distúrbios gerais e situação no local de administração |
|
|
|
Mal-estar* |
|
|
* Reação adversa ao medicamento (RAM) identificada pós-comercialização.
a. Ocorrendo com uma frequência ≥1% no grupo do Paxlovid e a uma frequência maior que no grupo de placebo7 e/ou provavelmente associado ao Paxlovid baseado nos dados disponíveis e na avaliação de causalidade.
Em casos de eventos adversos, notifique ao Sistema de Notificação de Eventos Adversos a Medicamentos – VIGIMED, ou para a Vigilância Sanitária Estadual ou Municipal.
SUPERDOSE
O tratamento de superdosagem com o Paxlovid deve consistir em medidas de suporte gerais, incluindo o monitoramento de sinais vitais144 e observação do estado clínico do paciente. Não existe um antídoto145 específico para a superdosagem de Paxlovid.
Em caso de intoxicação, ligue para 0800 722 6001, se você precisar de mais orientações.
DIZERES LEGAIS
VENDA SOB PRESCRIÇÃO MÉDICA
MS – 1.2110.0496
Farmacêutica Responsável: Andrea T. Nichele – CRF-SP nº 44063
Registrado por:
Pfizer Brasil Ltda.
Rua Alexandre Dumas, 1.860 CEP 04717-904 – São Paulo – SP CNPJ nº 61.072.393/0001-33
Comprimido revestido de nirmatrelvir
Fabricado por:
Pfizer Manufacturing Deutschland GmbH Freiburg – Alemanha
Comprimido revestido de ritonavir
Fabricado por:
M/s. Hetero Labs Limited, Unit-III Telangana, Índia
Paxlovid
Embalado por:
Pfizer Italia S.r.L
Ascoli Piceno – Itália
Importado por:
Pfizer Brasil Ltda.
Rodovia Presidente Castelo Branco, nº 32501, km 32,5
CEP 06696-000 – Itapevi – SP
SAC 0800 770 1575