Ovestrion (Creme) (Bula do profissional de saúde)
SCHERING-PLOUGH INDÚSTRIA FARMACÊUTICA LTDA
IDENTIFICAÇÃO DO MEDICAMENTO
OVESTRION®
estriol
Creme
APRESENTAÇÕES
Creme vaginal
Bisnaga de 15 ou 50 g acompanhada de um aplicador
USO INTRAVAGINAL
USO ADULTO
COMPOSIÇÃO
Cada grama1 de creme contém:
| estriol | 1 mg |
| excipiente q.s.p. | 1 g |
Excipientes: octildodecanol, palmitato de cetila, glicerol, álcool cetílico, álcool estearílico, polissorbato 60, estearato de sorbitana, ácido láctico, dicloridrato de clorexidina, solução de hidróxido de sódio (para ajuste de pH) e água purificada.
INFORMAÇÕES TÉCNICAS AOS PROFISSIONAIS DE SAÚDE2
INDICAÇÕES
Terapia de Reposição Hormonal (TRH) para o tratamento da atrofia3 do trato geniturinário relacionada à deficiência estrogênica.
Tratamentos pré e pós-operatórios em mulheres na pós-menopausa4 submetidas à cirurgia vaginal.
Auxiliar diagnóstico5 em caso de esfregaço cervical atrófico duvidoso.
RESULTADOS DE EFICÁCIA
Atrofia3 do trato geniturinário inferior relacionado à deficiência estrogênica
Em 13 estudos clínicos, 445 mulheres foram tratadas com estriol creme,1, 2, 3, 4, 6, 7, 8, 9, 10, 11, 12, 14, 15 durante 2 semanas a 8,5 meses. Todas essas mulheres eram pós-menopáusicas, natural ou cirurgicamente induzidas e apresentaram queixas vaginais, 1, 2, 3, 4, 8, 7, 8, 9, 10, 11, 12, 14, 15 e/ou urinárias5, 7, 10, associadas a uma vagina6 atrófica7. Em um estudo9, as pacientes também foram indicadas para tratamento cirúrgico de um prolapso8 uterovaginal. A dosagem variou de 1 ou 0,5 mg de estriol por dia durante 1 a 4 semanas,1, 2, 3, 4, 6, 7, 8, 9, 10, 11, 12, 14 geralmente seguida por uma dosagem de manutenção de 1 ou 0,5 mg de estriol duas vezes por semana1, 2, 5, 6, 10, 11, 12 ou 1 mg a cada 2 dias7 durante 4 semanas até 8 meses.
Em todas as pacientes, as porcentagens de células9 basais/parabasais, células9 intermediárias e células9 superficiais revelaram uma troca acentuada em direção das células9 superficiais durante o tratamento com OVESTRION® intravaginal. Após 1 semana, a citologia vaginal já mostrava um efeito vaginotrófico nítido,7,8 enquanto após 2 a 3 semanas, pode ser demonstrada uma normalização completa do epitélio10 vaginal.2, 3, 4, 6, 7, 8, 9, 11 Todos os 8 casos de infecções11 vaginais que foram observadas no esfregaço vaginal no pré-tratamento, desapareceram sem nenhum outro tratamento.3
Exames colposcópicos geralmente mostraram o retorno de uma aparência normal da mucosa12 vaginal no curso do tratamento.2, 4, 6, 9, 11, 12. Palidez e petéquias13 desapareceram,4 a flora de Döderlein foi restabelecida e, dessa forma, o pH vaginal normal retornou7 e as úlceras14 vaginais foram curadas.7 Dentro de algumas semanas, uma recuperação completa de ectrópio15 uretral16 foi observada.7 Geralmente, as queixas vaginais mostraram uma nítida melhora no curso das primeiras 2 a 3 semanas de tratamento. As queixas como secura vaginal, irritação e dispareunia desapareceram ou melhoraram consideravelmente.1, 2, 3, 4, 6, 7, 9, 11, 12 Essa melhora das condições locais levou a um aumento da libido17 e atividade sexual em diversas pacientes.11
Comparado com placebo18, o tratamento com OVESTRION® Creme resultou em uma incidência19 reduzida de infecções11 do trato urinário20 (ITUs), reaparecimento de lactobacilos na vagina6 e uma redução da colonização vaginal com Enterobacteriaceae.10 Estrogênios administrados por via intravaginal em dose baixa podem também aumentar os benefícios locais da terapia sistêmica no tratamento da atrofia3 urogenital21.16 Mulheres tratadas com 17-beta-estradiol transdérmico (50 mcg/dia) mais acetato de medroxiprogesterona (5 mg/dia) e adicionalmente 0,5 mg/dia de estriol vaginal mostraram uma melhora mais rápida das queixas urinárias já a partir do primeiro mês de tratamento. Após quatro meses de tratamento, as mulheres tratadas com ou sem estriol vaginal mostraram resultados comparáveis do tratamento.
Os efeitos benéficos na mucosa12 vaginal e nas queixas vaginais geralmente foram comparáveis nos grupos de dosagem baixa e alta (0,5 mg de estriol/dia e 1 mg de estriol/dia, respectivamente),3, 6, 12 e nos grupos de creme e supositório.3, 7 Portanto, a dosagem eficaz mais baixa de 0,5 mg de estriol/dia é recomendada. A dosagem de manutenção de 0,5 mg de estriol, duas vezes por semana (creme) pareceu ser suficiente para manter o efeito terapêutico inicial.1, 2, 4, 6, 11, 12
Tratamento pré e pós-operatórios em mulheres na pós-menopausa4 submetidas à cirurgia vaginal
O efeito benéfico do estriol na vascularização vaginal, espessura da parede vaginal e processos inflamatórios tem um efeito positivo nas complicações pós-operatórias, no período de hospitalização e infecções11 pós-operatórias em mulheres pós-menopáusicas submetidas à cirurgia vaginal.
Em 2 estudos clínicos, um total de 43 mulheres pós-menopáusicas foi tratado com OVESTRION® Creme intravaginal, tanto antes quanto após a submissão à cirurgia para prolapso8 uterovaginal.9, 13 A dosagem foi de 0,5 mg de estriol por dia durante 4 semanas antes da cirurgia e após uma pausa de 1 semana, durante outras 4 semanas após a cirurgia. Todas as pacientes tinham uma mucosa12 vaginal atrófica7 antes do tratamento.
Após as primeiras 4 semanas de tratamento, um retorno da aparência e citologia normais da mucosa12 vaginal foi observado em todas as pacientes. Além disso, um efeito estimulador nítido no muco cervical foi observado. O curso da cirurgia e a recuperação foi normal em todas as pacientes,9, 13 o que não é sempre o caso em mulheres com uma mucosa12 vaginal atrófica7.
Uma vez que um efeito vaginotrófico nítido já é observado após 1 semana de tratamento com OVESTRION® intravaginal (em uma dosagem de 0,5 mg de estriol/dia) e uma completa normalização do epitélio10 vaginal após 2 a 3 semanas de tratamento diário, um período de tratamento de 2 semanas tanto antes quanto após a cirurgia pode realmente ser suficiente.
Um auxílio diagnóstico5 no caso de um esfregaço cervical atrófico duvidoso
A administração de estrogênios induz a maturação do epitélio10 escamoso22 normal, sem afetar a citomorfologia de células9 tumorais malignas possivelmente presentes.
Embora diversos autores mencionem os efeitos benéficos das preparações contendo estriol ou succinato de estriol, quase nenhum dado está disponível sobre creme de estriol ou pessários. O estriol foi administrado oral, intravaginal ou oralmente como seu succinato. A partir desses estudos, pode-se concluir que após uma semana de tratamento oral com 2 a 4 mg diários (isto é, metade da dosagem inicial recomendada para queixas de atrofia3 vaginal), um nítido efeito estrogênico no epitélio10 cervical pode ser observado em muitas pacientes. OVESTRION® Creme é considerado como sendo eficaz como um auxílio diagnóstico5 no caso de um esfregaço cervical atrófico duvidoso por causa de muitos anos de experiência clínica com estrogênios. A eficácia é apoiada por um estudo clínico,17 relatando tratamento de 492 mulheres na pós-menopausa4 com diferentes substâncias estrogênicas, principalmente DES, mas também incluindo OVESTRION®. Os resultados confirmam que a terapia com estrogênio em dosagem baixa é um método simples e econômico para o esclarecimento de um esfregaço de Papanicolau23 suspeito.
Tendo em vista que o efeito estrogênico do OVESTRION® intravaginal no trato urogenital21 inferior já é observado após 1 semana de terapia,7, 8 e já que estriol oral é eficaz como um auxílio diagnóstico5 em uma dosagem que é metade da dosagem inicial recomendada para queixas de atrofia3 vaginal, uma aplicação do creme (isto é, 0,5 mg de estriol/dia) em dias alternados na semana antes da coleta do próximo esfregaço, é considerada como um tratamento com estrogênio adequado para essa indicação.
Referências bibliográficas:
- Mattsson L-A, Cullberg G. A clinical evaluation of treatment with estriol vaginal cream versus suppository in postmenopausal women. Acta Obstet Gynecol Scand 1983b;62:397-401. B12
- Babuna C, Aksu MF, Erez R. Management of lower genital tract atrophy with a vaginal cream containing oestriol. In: Fioretti P, Martini L, Melis GB, Yen SSC, eds. The menopause; clinical, endocrinological and pathophysiological aspects. Proceedings of the Seronia Symposia, Vol. 39 Viareggio, May 26-28, 1980. London: Academic Press, 1982:557-62. B6
- Genazzani AR, Inaudi P, Rosa R La, et al. Oestriol and the menopause: clinical and endocrinological results of vaginal administration. In: Fioretti P, Martini L, Melis GB, Yen SSC, eds. The menopause; clinical, endocrinological and pathophysiological aspects. Proceedings of the Seronia Symposia, Vol. 39. Viareggio, May 26-28, 1980. London: Academic Press, 1982:539-50. B9
- Haspels AA, Luisi M, Kicovic PM. Endocrinological and clinical investigations in post-menopausal women following administration of vaginal cream containing oestriol. Maturitas 1981;3:321-7. B5
- Iosif CS. Effects of protracted administration of estriol on the lower genito urinary tract in postmenopausal women. Arch Gynecol Obstet 1992;251:115-20. B15
- Kicovic PM, Cortes-Prieto J, Milojevic S, Haspels AA, Aljinovic A. The treatment of postmenopausal vaginal atrophy with Ovestin vaginal cream or suppositories: clinical, endocrinological and safety aspects. Maturitas 1980;2:275-82. B2
- Lauritzen C. Erfahrungen mit einer Östriol-Vaginalcreme (Experiences with an estriol cream). Ther Gegenw 1979;118:567-77. B1
- Luisi M, Franchi F, Kicovic PM. A group-comparative study of effects of Ovestin cream versus Premarin cream in post- menopausal women with vaginal atrophy. Maturitas 1980;2:311-9. B3
- Milojevic S, Kicovic PM. Pre- and post-operative treatment of atrophic vaginal mucosa12 with Ovestin cream in postmenopausal women undergoing vaginal surgery. In: Bakel-Middelweerd JM van, ed. News and views on oestriol. Leiden, De Medicus B.V., 1985;31-7. B14
- Raz R, Stamm WE. A controlled trial of intravaginal estriol in postmenopausal women with recurrent urinary tract infections. N Engl J Med 1993;329:753-6. B16
- Trevoux R, Velden WHM van der, Popovic D. Ovestin vaginal cream and suppositories for the treatment of menopausal vaginal atrophy. Reproduccion 1982;6:101-6. B10
- Velden WHM van der, Trevoux R, Popovic D. Cream containing oestriol for the treatment of menopausal vaginal atrophy. In: Fioretti P, Martini L, Melis GB, Yen SSC, eds. The menopause; clinical, endocrinological and pathophysiological aspects. Proceedings of the Seronia Symposia, Vol. 39. Viareggio, May 26-28, 1980. London: Academic Press, 1982:535-8. B11
- Donnez J, Lecart C. The use of estriol cream in vaginal surgery in post-menopausal women (Abstract). In: Keep PA van, Utian WH, Vermeulen A, eds. The controversial climacteric. Lancester: MTP, 1982:179. B7
- Barentsen R, van de Weijer PHM, Schram JHN. Continuous low dose estradiol released from a vaginal ring versus estriol vaginal cream for urogenital21 atrophy. European Journal of Obstetrics & Gynecology and Reproductive Biology,1997; 71:73-80. B19
- Study E1686. The efficacy and safety of estriol vaginal cream (Ovestin) in the management of postmenopausal urogenital21 complaints.
- Palacios S, Castelo-Branco C, Cancelo MJ, Vazquez F. Low-dose, vaginally administered estrogens may enhance local benefits of systemic therapy in the treatment of urogenital21 atrophy in postmenopausal women on hormone therapy. Maturitas 2005, 50;98- 104.
- Clocuh YPA. Östrogengabe als hormonelle Aufhellung zur Abklärung atrophischer Zellabstriche (The administration of estrogen prior to the interpretation of doubtful atrophic cyfosmears). Geburtshilfe Frauenheilkd 1980;40:1121-9.
CARACTERÍSTICAS FARMACOLÓGICAS
Propriedades farmacodinâmicas
OVESTRION® pertence ao grupo farmacoterapêutico de estrogênios semissintéticos e naturais e apresenta como princípio ativo o estriol, hormônio24 natural feminino (código ATC: G03CA04). Diferentemente de outros estrogênios, o estriol apresenta ação de curta duração, uma vez que apresenta apenas um curto tempo de retenção nos núcleos das células9 endometriais.
É usado para repor a perda da produção de estrogênio em mulheres menopausadas e alivia os sintomas25 da menopausa4. O estriol é particularmente eficaz no tratamento dos sintomas25 geniturinários. No caso de atrofia3 do trato urogenital21 inferior, o estriol induz a normalização do epitélio10 urogenital21 e ajuda a restauração da microflora normal e do pH fisiológico26 da vagina6. Como resultado, o estriol aumenta a resistência das células9 epiteliais vaginais à infecção27 e inflamação28, diminuindo as queixas vaginais como dispareunia, secura, prurido29, infecções11 vaginais e urinárias, queixas relacionadas à micção30 e incontinência urinária31 moderada.
Informações do estudo clínico
- O alívio dos sintomas25 da menopausa4 foi alcançado durante as primeiras semanas de tratamento.
- Sangramento vaginal após o tratamento com OVESTRION® foi apenas raramente relatado.
Propriedades farmacocinéticas
A administração intravaginal do estriol proporciona concentração ótima no local de ação. O estriol é também absorvido pela circulação32 sistêmica, conforme demonstrado pelo aumento nítido nos níveis plasmáticos de estriol não conjugado. Os níveis plasmáticos máximos são atingidos de 1 a 2 horas após a aplicação. Após aplicação vaginal de 0,5 mg de estriol, os valores da Cmax , Cmin e Cmédia são aproximadamente de 100 pg/mL, 25 pg/mL e 70 pg/mL, respectivamente. Três semanas após a administração diária de 0,5 mg de estriol vaginal, a C média diminuiu para 40 pg/mL. Quase a totalidade de estriol (90%) se liga à albumina33 plasmática e, ao contrário dos outros estrogênios, não apresenta ligação à globulina34 transportadora de hormônios sexuais (SHBG). O metabolismo35 do estriol consiste principalmente na conjugação e na desconjugação na circulação32 entero-hepática36. O estriol, sendo um produto metabólico final, é excretado, principalmente, na urina37 sob a forma conjugada e apenas pequena fração (± 2%) é excretada pelas fezes sob a forma não conjugada.
CONTRAINDICAÇÕES
Este medicamento é contraindicado para uso por pessoas com:
- Diagnóstico5 atual, história anterior ou caso suspeito de câncer38 de mama39
- Suspeita ou casos confirmados de tumores malignos estrogênio-dependentes (ex. câncer38 endometrial)
- Sangramento vaginal sem diagnóstico5
- Hiperplasia endometrial40 não tratada
- Tromboembolia venosa atual ou prévia (trombose venosa profunda41, embolia42 pulmonar)
- Distúrbios trombofílicos conhecidos (por exemplo: deficiência de proteína C, proteína S, ou de antitrombina, ver item "5. ADVERTÊNCIAS E PRECAUÇÕES")
- Doença tromboembólica arterial recente ou ativa (ex. angina43, infarto do miocárdio44)
- Doença hepática36 aguda, ou história de doença hepática36 enquanto os testes de função hepática36 não retornarem aos níveis normais
- Hipersensibilidade conhecida aos componentes da fórmula
- Porfiria45
Este medicamento é contraindicado para uso por homens.
Este medicamento é contraindicado para uso por grávidas.
Caso ocorra gravidez46 durante o tratamento com OVESTRION®, o uso deve ser interrompido imediatamente. Os resultados dos estudos epidemiológicos relevantes mais atuais em relação à exposição fetal inadvertida aos estrogênios não indicaram efeitos teratogênicos47 ou fetotóxicos.
Este medicamento é contraindicado para uso durante a lactação48.
O estriol é excretado no leite materno e pode diminuir a sua produção.
ADVERTÊNCIAS E PRECAUÇÕES
Para o tratamento dos sintomas25 da pós-menopausa4, a TRH deve ser iniciada somente para os sintomas25 que afetam adversamente a qualidade de vida. Em todos os casos, uma cuidadosa avaliação dos riscos e benefícios deve ser realizada pelo menos anualmente e a TRH deve ser continuada enquanto os benefícios suplantarem os riscos.
Evidências sobre os riscos associados à TRH no tratamento da menopausa4 prematura são limitadas. Devido ao baixo índice de risco absoluto de mulheres jovens, no entanto, o equilíbrio entre os riscos e os benefícios para estas mulheres podem ser mais favoráveis do que em mulheres com idade avançada.
Exame médico/acompanhamento
Antes de iniciar ou reiniciar a TRH, deve ser realizada uma anamnese49 completa incluindo antecedentes pessoais e familiares da paciente. O exame médico (incluindo exame pélvico50 e das mamas51) deve ser guiado por esta anamnese49 e pelas contraindicações e advertências quanto ao uso. Durante o tratamento são recomendadas avaliações periódicas em frequência e natureza adaptadas individualmente. As mulheres devem ser orientadas sobre as alterações em suas mamas51 que devem ser relatadas ao seu médico ou enfermeiro (ver item “ Câncer38 de mama”). Investigações, incluindo ferramentas apropriadas de imagem por exemplo, mamografia52, devem ser realizadas de acordo com as práticas de verificação atualmente aceitas, modificadas para as necessidades clínicas individuais.
Condições que necessitam de monitoramento
Caso qualquer das condições mencionadas abaixo tenha ocorrido anteriormente, esteja presente e/ou tenha sido agravada durante a gravidez46 ou tratamento prévio com hormônios, a paciente deve ser cuidadosamente monitorada. Deve-se levar em consideração que estas condições podem recorrer ou serem agravadas durante o tratamento com OVESTRION®, em particular:
- Leiomioma53 (fibroma54 uterino) ou endometriose55
- Fatores de risco para distúrbios tromboembólicos (ver item “Tromboembolia venosa”)
- Fatores de risco para tumores estrogênio-dependentes, ex. 1° grau de hereditariedade56 para câncer38 de mama39
- Hipertensão57
- Distúrbios hepáticos (ex. adenoma58 hepático)
- Diabetes59 mellitus com ou sem envolvimento vascular60
- Colelitíase61
- Enxaqueca62 ou cefaleia63 (grave)
- Lúpus64 eritematoso65 sistêmico66
- História de hiperplasia endometrial40 (ver item “Hiperplasia endometrial”)
- Epilepsia67
- Asma68
- Otosclerose69
Razões para interrupção imediata da terapia
A Terapia deve ser descontinuada no caso de descoberta de alguma contraindicação e nas seguintes condições:
- Icterícia70 ou deterioração da função hepática36
- Aumento significativo da pressão arterial71
- Primeiro episódio de cefaleia63 do tipo enxaqueca62
- Gravidez46
Hiperplasia endometrial40 e carcinoma72
Para impedir a estimulação endometrial, a dose diária não deverá exceder uma aplicação (0,5 mg de estriol) e nem deverá ser empregada por mais de algumas semanas. Um estudo epidemiológico mostrou que o tratamento prolongado com baixas doses de estriol por via oral, mas não o estriol por via vaginal, pode aumentar o risco para câncer38 do endométrio73. O risco aumentou com a duração do tratamento e desapareceu após um ano de sua interrupção. O risco aumentado está relacionado principalmente a tumores menos invasivos e altamente diferenciados. Sangramento vaginal durante o tratamento deve ser sempre investigado. As pacientes devem ser orientadas a contatar o seu médico se ocorrerem sangramentos vaginais.
Câncer38 de mama39
A TRH pode aumentar a densidade mamográfica. Isto pode complicar a detecção radiológica do câncer38 de mama39. Estudos clínicos relataram que a probabilidade de desenvolvimento de densidade mamográfica aumentada foi mais baixa em pacientes tratadas com estriol do que em pacientes tratadas com outros estrogênios.
As evidências sugerem um aumento do risco de câncer38 de mama39 em mulheres que utilizam TRH com estrogênio combinado com progestagênio e possivelmente também TRH com estrogênio, que é dependente da duração da TRH.
Terapia com estrogênio combinado com progestagênio:
O estudo randomizado74 controlado com placebo18 Women’s Health Initiative (WHI) e estudos epidemiológicos, são consistentes na busca de um aumento do risco de câncer38 de mama39 em mulheres que utilizam TRH com estrogênio combinado com progestagênio em que se torna aparente após cerca de três anos (ver item "9. REAÇÕES ADVERSAS").
Terapia com estrogênio:
O estudo WHI não encontrou nenhum aumento do risco de câncer38 de mama39 em mulheres histerectomizadas submetidas à TRH com estrogênios. Estudos observacionais relataram, principalmente, um pequeno aumento do risco de ter câncer38 de mama39 diagnosticado, que é substancialmente menor do que o encontrado em usuárias de TRH com estrogênio combinado com progestagênio (ver item "9. REAÇÕES ADVERSAS").
O risco excedente torna-se aparente dentro de poucos anos de uso, mas retorna aos níveis basais dentro de poucos (no máximo cinco) anos após a interrupção da terapia.
É desconhecido se o OVESTRION® apresenta o mesmo risco. Em um estudo recente de controle de casos, baseado na população em 3345 mulheres com câncer38 de mama39 invasivo e 3454 controles, o estriol, diferentemente dos outros estrogênios, não foi associado com aumento do risco de câncer38 de mama39. Contudo, as implicações clínicas desses achados são desconhecidas até agora. Portanto, é importante que o risco de diagnosticar o câncer38 de mama39 seja discutido com a paciente e pesado contra os benefícios conhecidos da TRH.
Câncer38 de ovário75
O câncer38 de ovário75 é muito mais raro que o câncer38 de mama39. O uso a longo prazo (pelo menos 5 a 10 anos) de produtos para TRH com estrogênio está associado a um risco ligeiramente maior de câncer38 de ovário75 (ver item "9. REAÇÕES ADVERSAS"). Alguns estudos, incluindo o Women's Health Initiative (WHI), sugerem que o uso a longo prazo da TRH combinada pode conferir um risco semelhante, ou ligeiramente menor (ver item "9. REAÇÕES ADVERSAS"). É incerto se o uso a longo prazo de estrogênio de baixa dosagem (como OVESTRION®) confere um risco diferente do que outros produtos contendo estrogênio.
Tromboembolia venosa
A TRH está associada com risco de 1,3 a 3 vezes para o desenvolvimento de tromboembolia venosa (TEV), como trombose venosa profunda41 ou embolia42 pulmonar. A ocorrência de tal evento é mais provável no primeiro ano da TRH do que mais tarde (ver item "9. REAÇÕES ADVERSAS"). Estes estudos não incluíram o OVESTRION® e, na ausência de dados, é desconhecido se OVESTRION® apresenta o mesmo risco.
Pacientes em situação trombofílica conhecida têm um aumento do risco de TEV e a TRH pode aumentar este risco. A TRH é contraindicada nestas pacientes (ver item "4. CONTRAINDICAÇÕES").
Os fatores de risco geralmente reconhecidos para TEV incluem uso de estrogênios, idade avançada, cirurgia de grande porte, imobilização prolongada, obesidade76 (índice de massa corpórea > 30 kg/m2), gestação e puerpério77, lúpus64 eritematoso65 sistêmico66 (LES) e câncer38. Não existe consenso sobre o papel das veias78 varicosas no TEV.
Como em todos os pacientes no pós-operatório, medidas profiláticas devem ser consideradas para prevenção de TEV. Se a cirurgia eletiva79 é seguida de imobilização prolongada, a interrupção temporária da TRH de 4 a 6 semanas antes da cirurgia é recomendável. O tratamento não deve ser reiniciado até que a mulher esteja completamente mobilizada.
Se OVESTRION® for utilizado para "Tratamentos pré e pós-operatórios em mulheres na pós-menopausa4 submetidas à cirurgia vaginal", medidas profiláticas contra trombose80 devem ser consideradas.
Em mulheres sem antecedentes pessoais de tromboembolia venosa, mas que possuem um parente de primeiro grau com história de trombose80 em idade jovem, uma triagem pode ser oferecida após o aconselhamento cuidadoso sobre suas limitações (apenas uma proporção de defeitos trombofílicos é identificada pela triagem). Se um defeito trombofílico é identificado, o qual segrega membros da família com trombose80, ou se o defeito é "grave" (por exemplo, deficiência de antitrombina, proteína S, proteína C ou uma combinação de defeitos) a TRH é contraindicada.
Mulheres que já estão em tratamento com anticoagulante81 requerem consideração cuidadosa da relação risco-benefício do uso da TRH.
Caso ocorra o desenvolvimento de TEV após o início do tratamento com OVESTRION®, o medicamento deve ser descontinuado. As pacientes devem ser aconselhadas a contatar o seu médico imediatamente caso percebam sintomas25 tromboembólicos potenciais (ex. edema82 doloroso de uma perna, dor torácica repentina, dispneia83).
Doença arterial coronariana (DAC)
Não existem evidências em estudos controlados randomizados de proteção contra infarto do miocárdio44 em mulheres com ou sem DAC existentes que receberam TRH com estrogênio ou com estrogênio combinado com progestagênio.
TRH com estrogênio combinado com progestagênio
O risco relativo de DAC durante o uso da TRH com estrogênio combinado com progestagênio é ligeiramente maior. Como o risco de base absoluto de DAC é fortemente dependente da idade, o número de casos adicionais de DAC, devido à utilização de TRH com estrogênio combinado com progestagênio é muito baixo em mulheres saudáveis perto da menopausa4, mas aumentará a com idade.
TRH com estrogênio
Dados randomizados controlados não encontraram aumento do risco de DAC em mulheres histerectomizadas que utilizam TRH com estrogênio.
Acidente vascular cerebral84 isquêmico85 (AVC)
A TRH com estrogênio combinado com progestagênio e TRH com estrogênio estão associadas com um aumento de até 1,5 vezes maior do risco de AVC isquêmico85. O risco relativo não muda com a idade ou o tempo decorrido desde a menopausa4. No entanto, como o risco de base de AVC é fortemente dependente da idade, o risco total de AVC em mulheres que usam TRH irá aumentar com a idade (ver item "9. REAÇÕES ADVERSAS").
Uso concomitante de medicamentos para hepatite86 C
Durante os ensaios clínicos87 com o regime combinado de medicamentos contendo hidrato de ombitasvir/hidrato de paritaprevir/ritonavir com ou sem dasabuvir, elevações da ALT para valores superiores a 5 vezes o limite superior da normalidade foram significativamente mais frequentes em mulheres em uso de medicamentos que contêm etinilestradiol. Mulheres que usavam estrogênios que não o etinilestradiol, como estradiol, estriol e estrogênios conjugados, tiveram taxa de elevação da ALT semelhante à das que não utilizavam estrogênio; no entanto, devido ao número limitado de indivíduos que tomavam esses outros estrogênios, é preciso ter cautela na coadministração de OVESTRION® com o regime combinado de medicamentos contendo hidrato de ombitasvir/hidrato de paritaprevir/ritonavir com ou sem dasabuvir (ver item “ 6. INTERAÇÕES MEDICAMENTOSAS”).
-
Outras condições
- Os estrogênios podem causar retenção hídrica, portanto, pacientes com disfunção cardíaca ou renal88 devem ser cuidadosamente observadas.
- O estriol é um inibidor fraco de gonadotrofinas e não apresenta outros efeitos significativos sobre o sistema endócrino89.
- O uso de TRH não melhora a função cognitiva90. Existem algumas evidências de aumento do risco de provável demência91 em mulheres que iniciam o uso contínuo de TRH com estrogênio ou com estrogênio combinado com progestagênio após os 65 anos de idade.
- OVESTRION® contém álcool cetílico e álcool estearílico. Estes podem causar reações cutâneas92 locais (por ex., dermatite93 de contato).
Efeitos sobre a habilidade de dirigir e operar máquinas
Até onde é conhecido, OVESTRION® não apresenta efeito sobre o estado de alerta e a concentração.
INTERAÇÕES MEDICAMENTOSAS
Na prática clínica, não foi relatado nenhum exemplo de interação entre OVESTRION® e outros medicamentos, mas embora os dados sejam limitados, elas podem ocorrer. Foram descritas as seguintes interações com o uso de anticoncepcionais orais que também podem ser relevantes para o OVESTRION®.
O metabolismo35 dos estrogênios pode ser aumentado pelo uso concomitante de substâncias que induzem as enzimas que metabolizam fármacos, especificamente enzimas do citocromo P450, tais como anticonvulsivantes (ex. hidantoínas, barbituratos, carbamazepina) e antiinfecciosos (ex. griseofulvina, rifamicina e os agentes antivirais nevirapina e efavirenz) e preparações fitoterápicas contendo erva de São João (Hypericum Perforatum).
O ritonavir e nelfinavir, embora conhecidos como fortes inibidores, ao contrário, apresentam propriedades indutoras quando utilizados concomitantemente com hormônios esteroides.
Clinicamente, o metabolismo35 aumentado dos estrogênios pode levar à diminuição da eficácia de OVESTRION® e a alterações no padrão de sangramento uterino.
O estriol pode, possivelmente, aumentar os efeitos farmacológicos dos corticosteroides, succinilcolina (suxametônio), teofilinas e troleandromicina.
Durante os ensaios clínicos87 com o regime combinado de medicamentos contendo hidrato de ombitasvir/hidrato de paritaprevir/ritonavir com ou sem dasabuvir, elevações da ALT para valores superiores a 5 vezes o limite superior da normalidade foram significativamente mais frequentes em mulheres em uso de medicamentos que contêm etinilestradiol. Mulheres que usavam estrogênios que não o etinilestradiol, como estradiol, estriol e estrogênios conjugados, tiveram taxa de elevação da ALT semelhante à das que não utilizavam estrogênio; no entanto, devido ao número limitado de indivíduos que tomavam esses outros estrogênios, é preciso ter cautela na coadministração de OVESTRION® com o regime de combinação de medicamentos contendo hidrato de ombitasvir/hidrato de paritaprevir/ritonavir com ou sem dasabuvir (ver item “ 5. ADVERTÊNCIAS E PRECAUÇÕES”).
CUIDADOS DE ARMAZENAMENTO DO MEDICAMENTO
Conservar em temperatura ambiente (entre 15 e 30ºC). Proteger da luz.
O prazo de validade do medicamento é de 24 meses a partir da data de fabricação. Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Características físicas e organolépticas do produto
OVESTRION® creme é uma massa macia, homogênea, com consistência cremosa, branca a quase branca e odor fraco característico.
Antes de usar, observe o aspecto do medicamento.
Todo medicamento deve ser mantido fora do alcance das crianças.
POSOLOGIA E MODO DE USAR
Uma aplicação de OVESTRION® corresponde ao uso do aplicador cheio até a marca em anel, que contém 0,5 grama1 de creme contendo 0,5 mg de estriol.
- Tratamento da atrofia3 do trato geniturinário: 1 aplicação por dia durante as primeiras semanas, seguida de redução gradual de acordo com o alívio dos sintomas25, até atingir a dose de manutenção (por exemplo, 1 aplicação 2 vezes por semana).
- Tratamentos pré e pós-operatórios em mulheres na pós-menopausa4 submetidas à cirurgia vaginal: 1 aplicação por dia nas 2 semanas antes da cirurgia e 1 aplicação 2 vezes por semana durante as 2 semanas após a cirurgia.
- Auxiliar diagnóstico5 em caso de esfregaço cervical atrófico duvidoso: 1 aplicação em dias alternados, 1 semana antes da coleta do próximo esfregaço.
A dose máxima de uma aplicação por dia não deve ser usada por várias semanas.
Procedimento caso a paciente esqueça de usar OVESTRION®
Uma dose esquecida deve ser administrada assim que lembrada, desde que não seja no mesmo dia da próxima dose. Neste caso, a dose esquecida não deve ser aplicada e o esquema habitual de administração deve ser continuado.
Nunca administrar duas doses no mesmo dia.
Para o início e manutenção do tratamento dos sintomas25 da pós-menopausa4, usar a menor dose eficaz pelo menor período de tempo (ver item “ 5. ADVERTÊNCIAS E PRECAUÇÕES”).
Mulheres que não estão em TRH ou que estão substituindo um produto contínuo combinado podem iniciar a terapia com OVESTRION® em qualquer dia. Mulheres que estão substituindo um regime de TRH cíclico devem iniciar a terapia com OVESTRION® uma semana após completarem o ciclo.
Administração
OVESTRION® deve ser administrado, por via intravaginal, à noite na hora de deitar, com auxílio do aplicador calibrado que acompanha a bisnaga (um aplicador contém aproximadamente 0,5 g de creme). O aplicador tem uma marca na parte superior (anel). O êmbolo94 não deve ser “ puxado” além desta marca (anel).
Instruções de uso para a paciente
- Remover a tampa da bisnaga, virar a tampa ao contrário e encaixar no bocal da bisnaga para romper o lacre.
- Rosquear o bocal do aplicador na bisnaga. Não puxar o êmbolo94.
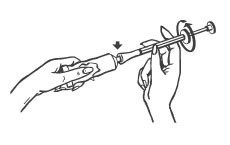
- Depois de rosquear, pressionar a bisnaga pela extremidade inferior para que o creme empurre o êmbolo94 até a marca vermelha (anel).

- Retirar o aplicador da bisnaga e tampá-la.
- Para aplicar o creme, deitar-se e introduzir profundamente o aplicador na vagina6.
- Empurrar o êmbolo94 vagarosamente até o fim, esvaziando todo o aplicador.
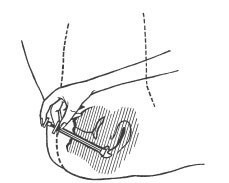
Depois do uso, retirar o êmbolo94 totalmente do corpo do aplicador, lavando-o com água morna e sabão e enxaguando-o bem. Não usar detergente.
NÃO COLOCAR O APLICADOR EM ÁGUA MUITO QUENTE OU FERVENTE.
REAÇÕES ADVERSAS
Os dados da literatura e da farmacovigilância relatam as seguintes reações adversas:
|
Classe de órgão e sistema |
Reações adversas |
|
Distúrbios gerais e condições no local de administração |
Irritação e prurido29 no local de aplicação |
|
Distúrbios do sistema reprodutor e mamas51 |
Dor e desconforto mamário |
Essas reações adversas são normalmente transitórias, mas também podem indicar doses elevadas.
Outras reações adversas associadas à terapia com estrogênio ou com estrogênio combinado com progestagênio foram relatadas.
- Neoplasias96 estrogênio-dependentes malignas e benignas, como câncer38 de endométrio73 (para maiores informações ver itens “ 4. CONTRAINDICAÇÕES” e “ 5. ADVERTÊNCIAS E PRECAUÇÕES”)
- Doença na vesícula biliar97
- Distúrbios na pele98 e no tecido subcutâneo99: cloasma100, eritema multiforme101, eritema nodoso102, púrpura103 vascular60
- Provável demência91 acima de 65 anos de idade (ver item “ 5. ADVERTÊNCIAS E PRECAUÇÕES”)
Risco de câncer38 de mama39
É relatado um aumento do risco de até 2 vezes de ter câncer38 de mama39 diagnosticado em mulheres em TRH com estrogênio combinado com progestagênio por mais de 5 anos.
Qualquer aumento do risco em usuárias de terapia com estrogênio é substancialmente menor do que o observado em usuárias de TRH com estrogênio combinado com progestagênio.
O nível de risco é dependente da duração do uso (ver item "5. ADVERTÊNCIAS E PRECAUÇÕES").
Resultados do maior estudo randomizado74 controlado com placebo18 (estudo WHI) e do maior estudo epidemiológico (MWS) são apresentados.
Estudo Million Women - Risco adicional estimado de câncer38 de mama39 após 5 anos de uso
|
Intervalo de idade (anos) |
Casos adicionais por 1000 de não-usuárias de TRH após um período de 5 anos* |
Razão de risco# |
Casos adicionais por 1.000 usuárias de TRH por mais de 5 anos (IC 95%) |
|
TRH com estrogênio |
|||
|
50 - 65 |
9 - 12 |
1,2 |
1-2 (0-3) |
|
TRH com estrogênio combinado com progestagênio |
|||
|
50 - 65 |
9 - 12 |
1,7 |
6 (5-7) |
#Taxa de risco total. A razão de risco não é constante, mas aumenta com o aumento da duração do uso
*Extraído de taxas de incidência19 de base em países desenvolvidos.
Estudo WHI realizado nos EUA - Risco adicional de câncer38 de mama39 após 5 anos de uso
|
Intervalo de idade (anos) |
Incidência19 por 1000 mulheres no braço placebo18 após 5 anos |
Razão de risco e IC 95% |
Casos adicionais por 1.000 usuárias de TRH por mais de 5 anos (IC 95%) |
|
CEE de estrogênio |
|||
|
50 - 79 |
21 |
0,8 (0,7 - 1,0) |
-4 (-6 - 0)* |
|
CEE+MPA de estrogênio combinado com progestagênio ‡ |
|||
|
50 - 79 |
14 |
1,2 (1,0 - 1,5) |
+4 (0 - 9) |
‡ Quando a análise foi restrita a mulheres que não utilizaram TRH antes do estudo, não houve aumento do risco aparente durante os primeiros cinco anos de tratamento: após 5 anos, o risco foi maior do que em não-usuárias.
*Estudo WHI em mulheres sem útero104, o qual não mostrou aumento do risco de câncer38 de mama39
Câncer38 de ovário75
O uso a longo prazo de TRH com estrogênio e com estrogênio combinado com progestagênio foi associado com um risco levemente maior de câncer38 de ovário75. O resultado foi de um caso adicional por 2500 usuárias durante os 5 anos do estudo Million Women de TRH.
Risco de tromboembolia venosa
A TRH está associada a um risco relativo de 1,3 a 3 vezes maior de desenvolver tromboembolia venosa (TEV), ou seja, trombose venosa profunda41 ou embolia42 pulmonar. A ocorrência de um evento como esse é mais provável no primeiro ano de uso da TRH (ver item “ 5. ADVERTÊNCIAS E PRECAUÇÕES”). Os resultados do estudo WHI são apresentados:
Estudo WHI - Risco adicional de TEV após 5 anos de uso
|
Intervalo de idade (anos) |
Incidência19 por 1000 mulheres no braço placebo18 após 5 anos |
Razão de risco e IC 95% |
Casos adicionais por 1.000 usuárias de TRH após 5 anos (IC 95%) |
|
Oral – estrogênio* |
|||
|
50 - 59 |
7 |
1,2 (0,6 - 2,4) |
1 (-3 - 10) |
|
Oral - estrogênio combinado com progestagênio |
|||
|
50 - 59 |
4 |
2,3 (1,2 - 4,3) |
5 (1 - 13) |
*Estudo em mulheres sem útero104
Risco de doença arterial coronariana
O risco de doença arterial coronariana é ligeiramente maior em usuárias de TRH com estrogênio combinado com progestagênio acima de 60 anos de idade (ver item “ 5. ADVERTÊNCIAS E PRECAUÇÕES”).
Risco de acidente vascular cerebral84 isquêmico85
O uso da terapia com estrogênio e com estrogênio combinado com progestagênio está associado a um risco relativo de até 1,5 vezes maior de AVC isquêmico85. O risco de AVC hemorrágico105 não aumenta durante o uso da TRH. O risco relativo não depende de idade ou por tempo de uso, mas como o risco de base é fortemente dependente da idade, o risco total de AVC em mulheres que utilizam TRH aumentará com a idade (ver item “ 5. ADVERTÊNCIAS E PRECAUÇÕES”).
Estudos WHI combinado - Risco adicional de acidente vascular cerebral84 isquêmico85* após 5 anos de uso
|
Intervalo de idade (anos) |
Incidência19 por 1000 mulheres no braço placebo18 após 5 anos |
Razão de risco e IC 95% |
Casos adicionais por 1.000 usuárias de TRH após 5 anos (IC 95%) |
|
50 - 59 |
8 |
1,3 (1,1 - 1,6) |
3 (1 - 5) |
* nenhuma diferenciação foi feita entre AVC isquêmico85 e hemorrágico105.
Em casos de eventos adversos, notifique ao Sistema de Notificações em Vigilância Sanitária - NOTIVISA ou à Vigilância Sanitária Estadual ou Municipal.
SUPERDOSE
A toxicidade106 aguda de estriol em animais é muito baixa. É improvável a ocorrência de superdose de OVESTRION® após administração vaginal. No entanto, se houver ingestão de grandes quantidades, os possíveis sintomas25 são: náuseas107, vômito108 e sangramento de privação em mulheres. Não existe antídoto109 específico. Se necessário, pode-se instituir tratamento sintomático110.
Em caso de intox icação ligue para 0800 722 6001, se você precisar de mais orientações.
DIZERES LEGAIS
VENDA SOB PRESCRIÇÃO MÉDICA
MS 1.0171.0030
Farm. Resp.: Marcos C. Borgheti – CRF-SP n°15.615
Registrado e fabricado por:
Schering-Plough Indústria Farmacêutica Ltda. Rua João Alfredo, 353 – São Paulo/SP
CNPJ 03.560.974/0001-18 – Indústria Brasileira
OU
Registrado por:
Schering-Plough Indústria Farmacêutica Ltda. Rua João Alfredo, 353 – São Paulo/SP
CNPJ 03.560.974/0001-18 – Indústria Brasileira
Fabricado por:
Eurofarma Laboratórios S.A. – Itapevi/SP
SAC 0800 708 1818