

Terconazol (Creme 8 mg/g) (Bula do profissional de saúde)
EMS S/A
IDENTIFICAÇÃO DO MEDICAMENTO
terconazol
Creme 8 mg/g
Medicamento genérico Lei n° 9.787, de 1999.
FORMA FARMACÊUTICA E APRESENTAÇÃO:
Creme vaginal
Bisnaga com 30 g de creme, acompanhada de 5 aplicadores ginecológicos para 5 gramas de creme.
USO INTRAVAGINAL
USO ADULTO
COMPOSIÇÃO:
Cada grama1 do terconazol contém:
| terconazol | 8 mg |
| excipiente q.s.p. | 1 g |
Excipientes: álcool cetoestearílico, petrolato líquido, álcool cetoestearílico etoxilado, metilparabeno, propilparabeno, butil-hidroxitolueno, simeticona, propilenoglicol, oleato de decila e água purificada.
INFORMAÇÕES TÉCNICAS AOS PROFISSIONAIS DE SAÚDE2
INDICAÇÕES
O terconazol é indicado no tratamento da candidíase3 vulvovaginal (monilíase).
RESULTADOS DE EFICÁCIA
Em seis estudos envolvendo 236 mulheres que usaram creme vaginal de terconazol 0,8% por 5 dias, as taxas de cura micológicas foram de 89% e 92% após uma e quatro semanas, respectivamente. Noventa e dois por cento das participantes apresentaram ausência de sinais4 de eritema5 vaginal ou vulvar ou edema6 em uma semana, e 94% apresentaram ausência destes sinais4 em quatro semanas.
Referência bibliográfica:
J. Kell Williams, M.D. Clinical Evaluation of Terconazole: Efficacv and Safety. The Journal of Clinical Practice in Sexuality (Special Issue), p. 24-31, 1991.
CARACTERÍSTICAS FARMACOLÓGICAS
PROPRIEDADES FARMACODINÂMICAS
Mecanismo de ação
O terconazol é um agente antifúngico sintético triazólico. Em concentrações fungistáticas, terconazol inibe a transformação das células7 leveduriformes em micélio8 e inibe a síntese de ergosterol dependente do citrocromo P-450, que é um componente vital da membrana celular9 do fungo10.
Microbiologia
O terconazol é ativo “in vitro” contra várias cepas11 de Candida albicans.
PROPRIEDADES FARMACOCINÉTICAS
Absorção
A maior parte da dose de terconazol aplicada por via intravaginal (média > 60%) permanece na área vaginal. A absorção pela circulação12 sistêmica é lenta e limitada (< 20%). A concentração plasmática máxima de terconazol ocorre de 5 a 10 horas após a aplicação do creme. A exposição sistêmica ao medicamento é aproximadamente proporcional à dose aplicada. A taxa e a extensão da absorção de terconazol é similar em pacientes com candidíase3 vulvovaginal (grávidas ou não-grávidas) e em pacientes saudáveis.
Distribuição
O terconazol é altamente ligado às proteínas13 (94,9%), e o grau de ligação é independente da concentração do medicamento.
Metabolismo14
O terconazol é absorvido sistemicamente e é extensivamente metabolizado (> 95%).
Eliminação
Através de vários estudos, a média da meia-vida de eliminação do plasma15 de terconazol não metabolizado variou de 6,4 a 8,5 horas. A excreção a partir da circulação12 sistêmica após a aplicação de uma dose intravaginal radioativa ocorre tanto por via renal16 (3 a 10%) quanto fecal (2 a 6%).
Administração de doses múltiplas
Não há um aumento significativo na concentração plasmática máxima ou na exposição global [área sob a curva (AUC17)] após aplicações múltiplas diárias de creme.
Dados de estudos pré-clínicos
Teratogenicidade: Não houve evidências de teratogenicidade quando terconazol foi administrado por via oral até 40 mg/kg/dia (25 x a dose humana intravaginal recomendada da formulação do supositório, 50 x a dose humana intravaginal recomendada da formulação de creme vaginal a 0,8%, e 100 x a dose humana intravaginal da formulação de creme vaginal a 0,4%) em ratos, ou 20 mg/kg/dia em coelhos, ou em ratos por via subcutânea18 até 20 mg/kg/dia.
Dosagens iguais ou inferiores a 10 mg/kg/dia não produziram embriotoxicidade; entretanto, houve um atraso na ossificação fetal com doses de 10 mg/kg/dia em ratos. Houve certa evidência de embriotoxicidade em coelhos e ratos com doses de 20-40 mg/kg. Em ratos, isto refletiu como uma redução no tamanho da ninhada e no número de jovens viáveis e redução do peso fetal. Houve também um atraso na ossificação e uma incidência19 aumentada de variantes esqueléticas.
A dose sem efeito de 10 mg/kg/dia resultou em um nível médio de pico plasmático de terconazol em ratas grávidas de 0,176 mcg/mL, que excede em 44 e 30 vezes, respectivamente, o nível médio de pico plasmático encontrado em indivíduos normais após administração intravaginal do creme vaginal de terconazol a 0,4% (0,004 mcg/mL) e a 0,8% (0,006 mcg/mL), e em 17 vezes o nível médio do pico plasmático (0,010 mcg/mL) encontrado em indivíduos normais após administração intravaginal de supositório vaginal de 80 mg de terconazol.
Essa avaliação de segurança não leva em conta uma possível exposição do feto20 através da transferência direta de terconazol de uma vagina21 irritada por difusão através das membranas amnióticas.
Carcinogênese: Não foram realizados estudos para determinação do potencial carcinogênico de terconazol.
Mutagênese: O terconazol não se mostrou mutagênico quando testado “in vitro” para indução de mutações microbianas pontuais (teste de Ames) ou para indução de transformação celular, ou “in vivo” por quebras cromossômicas (teste do micronúcleo) ou mutações dominantes letais em células germinativas22 de camundongo.
Comprometimento da fertilidade: Não ocorreu comprometimento da fertilidade quando foram administradas doses orais de até 40 mg/kg/dia de terconazol em ratas fêmeas por um período de 3 meses.
Tempo para início da ação terapêutica23
Estudos demonstraram que 42,4% das pacientes apresentaram alívio nos sintomas24 após três dias de tratamento com terconazol. Como este foi o primeiro dia em que se analisou o alívio dos sintomas24, não é possível saber, com base nos dados disponíveis, se o alívio dos sintomas24 ocorre anteriormente.
CONTRAINDICAÇÕES
O terconazol é contraindicado para pacientes25 que apresentam hipersensibilidade ao terconazol, a outros derivados imidazólicos ou a qualquer um dos excipientes.
ADVERTÊNCIAS E PRECAUÇÕES
O terconazol é indicado apenas para uso tópico26 na vulva27 ou intravaginal, não sendo indicado para uso oral ou oftálmico.
Anafilaxia28 e necrólise epidérmica tóxica29 foram relatadas durante o tratamento com terconazol. Caso essas reações ocorram, o tratamento deve ser descontinuado.
Descontinuar o uso e não submeter a novo tratamento com terconazol as pacientes que apresentarem sensibilidade, irritação, febre30, calafrios31 ou sintomas24 semelhantes aos da gripe32 durante o uso.
O terconazol contém um ingrediente de base oleosa que pode danificar diafragmas contraceptivos de borracha ou preservativos de látex e diminuir sua eficácia. Portanto, produtos com base oleosa, tais como terconazol, óleo mineral, óleos vegetais ou vaselina não devem ser usados concomitantemente ao diafragma33 ou preservativo de látex.
Testes laboratoriais
Na ausência de resposta ao tratamento com terconazol, devem-se realizar estudos microbiológicos34 adequados (exame direto do esfregaço vaginal, clarificado com KOH e/ou cultura), para se confirmar o diagnóstico35 e excluir outros patógenos.
Menstruação36
O efeito terapêutico de terconazol não é afetado pela menstruação36.
Uso durante a gravidez37 – Categoria C: Não há estudos adequados em mulheres. Em experiências animais ocorreram alguns efeitos colaterais38 no feto20, mas o benefício do produto pode justificar o risco potencial durante a gravidez37.
Os estudos clínicos conduzidos com terconazol intravaginal, com doses de até 240 mg incluíram pacientes grávidas e não grávidas. Nos recém-nascidos não foram reveladas reações adversas atribuíveis ao medicamento. Os estudos em animais com doses de até 40 mg/kg, por via oral, não revelaram efeitos tóxicos sobre os fetos. Devido à absorção intravaginal, o terconazol não deve ser usado no primeiro trimestre de gravidez37, a menos que o médico considere essencial para o bem-estar da paciente.
O terconazol pode ser usado durante o segundo e terceiro trimestre de gravidez37 se o potencial benefício superar os possíveis riscos ao feto20.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Uso durante a lactação39
Não se sabe se terconazol é excretado no leite materno. Portanto, deve-se ter cautela quando o terconazol for utilizado durante a lactação39. Caberá ao médico decidir entre suspender a amamentação40 ou prescrever terconazol à mãe, considerando a importância desta terapia na sua situação atual.
Fertilidade
Não ocorreu comprometimento da fertilidade quando terconazol até 40 mg/kg/dia foi administrado por via oral a ratas fêmeas por um período de três meses.
Uso pediátrico
A eficácia e a segurança de terconazol em crianças ainda não foram estabelecidas.
Medidas de higiene
Deve-se ter uma higiene pessoal rigorosa, com as seguintes medidas: lavar sempre e cuidadosamente as mãos41; após cada micção42, enxugar a vulva27 sem friccionar o papel higiênico; evitar contaminação fecal com o órgão genital externo; trocar diariamente as roupas íntimas, lavando-as com agentes detergentes.
Efeito sobre a capacidade de dirigir veículos e operar máquinas
Não são conhecidos os efeitos sobre a capacidade de dirigir veículos e operar máquinas.
INTERAÇÕES MEDICAMENTOSAS
O efeito terapêutico de terconazol não é afetado pelo uso de anticoncepcionais orais.
Os níveis de estradiol e progesterona não diferiram significativamente quando o creme vaginal de terconazol a 0,8% foi administrado a voluntárias sadias em uso de contraceptivos orais de baixa dosagem.
CUIDADOS DE ARMAZENAMENTO DO MEDICAMENTO
Cuidados de conservação
O terconazol deve ser conservado em temperatura ambiente (15°C a 30°C). Proteger da luz e da umidade. O terconazol tem validade de 24 meses a partir da data de fabricação.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Características físicas e organolépticas do produto
O terconazol é apresentado na forma de creme homogêneo, na cor branca, isento de grumos e impurezas.
Antes de usar, observe o aspecto do medicamento.
TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS.
POSOLOGIA E MODO DE USAR
O terconazol é um medicamento de uso intravaginal.
Posologia
Um aplicador completamente preenchido com aproximadamente 5 g de creme a 0,8%, conforme indicado na figura a seguir, deve ser inserido profundamente na vagina21, uma vez ao dia, ao deitar-se, durante cinco dias consecutivos.
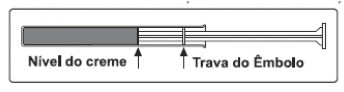
Modo de uso
- Retire a tampa da bisnaga.
- Perfure o lacre da bisnaga introduzindo o pino perfurante da tampa.
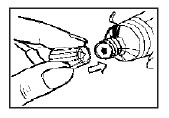
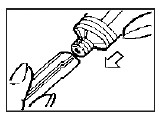
- Adapte o aplicador ao bocal da bisnaga, garantido que o aplicador alcance o final da rosca do bocal.
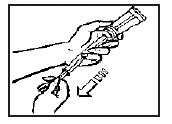
- Em posição horizontal, aperte a base da bisnaga com os dedos, de maneira a forçar a entrada do creme no aplicador até travar o êmbolo43. Tenha cuidado para que o creme não extravase a posição em que o êmbolo43 travou.
A parte sombreada da figura do aplicador indica a quantidade máxima de creme a ser administrada.

- Retire o aplicador e feche novamente a bisnaga
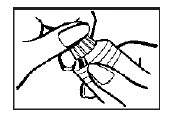
- Introduza delicadamente o aplicador na vagina21, o mais profundamente possível, e empurre o êmbolo43 para dentro, até esvaziar o aplicador.
- A aplicação faz-se com maior facilidade estando a paciente deitada de costas44, com as pernas dobradas.
- Quando utilizado seguindo as instruções, o aplicador cheio contém a dose adequada (5 g de creme), considerando-se ainda o resíduo que permanece no aplicador.
REAÇÕES ADVERSAS
Reações adversas são eventos adversos que são considerados razoavelmente associados ao uso de terconazol, com base na avaliação das informações sobre eventos adversos disponíveis. Uma relação causal com terconazol não pode ser estabelecida de forma confiável em casos individuais. Adicionalmente, como os estudos clínicos são conduzidos sob condições amplamente variáveis, as taxas de reação adversa observadas nos estudos clínicos do medicamento não podem ser diretamente comparadas às taxas nos estudos clínicos de outros medicamentos e podem não refletir as taxas observadas na prática clínica.
Dados de estudos clínicos
A segurança de terconazol creme vaginal e supositórios vaginais foi avaliada em 3287 pacientes mulheres que participaram de 30 estudos clínicos para o tratamento de vulvovaginite45. Os 30 estudos incluíram 8 estudos clínicos de fase aberta e 22 estudos duplo-cego e avaliaram a segurança dos esquemas posológicos usando supositórios vaginais de terconazol de 40 mg e 80 mg e creme vaginal de terconazol de 0,4% e 0,8%.
Reações adversas relatadas por ≥ 1% das pacientes tratadas com terconazol nestes 30 estudos clínicos são apresentadas na Tabela 1.
Tabela 1: Reações adversas relatadas por ≥ 1% das pacientes tratadas com terconazol em 30 estudos clínicos.
|
Classe de Sistema/Órgão |
terconazol |
|
Distúrbios do Sistema Nervoso46 |
|
|
Cefaleia47 |
13,3 |
|
Distúrbios do Sistema Reprodutivo e das Mamas48 |
|
|
Sensação de queimação genital |
3,9 |
|
Dismenorreia49 |
3,0 |
|
Prurido50 genital |
2,6 |
|
Desconforto genital |
2,0 |
|
Dor genital |
1,2 |
|
Distúrbios Gerais e Condições do Local de Administração |
|
|
Dor |
2,6 |
Reações adversas relatadas por < 1% das pacientes tratadas com terconazol em 30 estudos clínicos são apresentadas na Tabela 2.
Tabela 2: Reações adversas relatadas por < 1% das pacientes tratadas com terconazol em 30 estudos clínicos.
|
Classe de Sistema/Órgão |
|
Distúrbios Gerais e Condições do Local de Administração |
|
Calafrios31 |
| Pirexia51 |
Dados de pós-comercialização
Em adição às reações adversas relatadas durante os estudos clínicos e listadas anteriormente, foram identificadas as reações adversas listadas a seguir por categoria de frequência estimada de taxas de relatos espontâneos durante o período de pós-comercialização com terconazol
Reação muito rara (≤ 1/10.000):
- Distúrbios do Sistema Imunológico52: anafilaxia28, edema6 de face53, hipersensibilidade.
- Distúrbios do Sistema Nervoso46: tontura54.
- Distúrbios Respiratórios, Toráxicos e Mediastinais: broncoespasmo55.
- Distúrbios Gastrintestinais: dor abdominal.
- Distúrbios da Pele56 e do Tecido Subcutâneo57: necrólise epidérmica tóxica29, erupção58 cutânea59, urticária60.
- Distúrbios Gerais e Condições do Local de Administração: sintomas24 de gripe32a, astenia61.
a Sintomas24 de gripe32 englobam outros eventos, incluindo náusea62, vômitos63, mialgia64, artralgia65 e mal-estar, assim como febre30 e calafrios31.
Em casos de eventos adversos, notifique ao Sistema de Notificações em Vigilância Sanitária – NOTIVISA ou à Vigilância Sanitária Estadual ou Municipal.
SUPERDOSE
No caso de ingestão oral do creme, devem ser tomadas medidas de suporte e sintomáticas. Se o creme for acidentalmente aplicado nos olhos66, lave com água limpa ou salina e procure orientação médica se persistirem os sintomas24.
Em caso de intoxicação ligue para 0800 722 6001, se você precisar de mais orientações.
DIZERES LEGAIS
VENDA SOB PRESCRIÇÃO MÉDICA
Registro M.S. nº. 1.0235.0941
Farm. Resp. Dr. Ronoel Caza de Dio CRF-SP nº. 19.710
EMS S/A
Rodovia Jornalista Francisco Aguirre Proença, s/n°, Km 08 - Chácara Assay
CEP 13186-901, Hortolândia – SP
CNPJ: 57.507.378/0003-65
INDÚSTRIA BRASILEIRA
SAC 0800 191914






