Beriplex P/N
CSL BEHRING COMÉRCIO DE PRODUTOS FARMACÊUTICOS LTDA
IDENTIFICAÇÃO DO MEDICAMENTO
Beriplex® P/N
concentrado de complexo protrombínico
Injetável 500 UI
FORMA FARMACÊUTICA E APRESENTAÇÃO:
Pó liofilizado1 para solução injetável
Embalagem contendo 1 frasco-ampola de concentrado, 1 frasco-ampola com 20 mL de água para injetáveis e 1 dispositivo de transferência com filtro
VIA INTRAVENOSA
USO ADULTO E PEDIÁTRICO
COMPOSIÇÃO:
Cada mL de Beriplex® P/N contém:
| fator II de coagulação2 | 20–48 UI |
| fator VII de coagulação2 | 10–25 UI |
| fator IX de coagulação2 | 20–31 UI |
| fator X de coagulação2 | 22–60 UI |
| proteína C | 15–45 UI |
| proteína S | 12–38 |
| excipiente q.s.p. | 1 mL |
Excipientes: heparina, albumina3 humana, antitrombina III, cloreto de sódio, citrato de sódio e ácido clorídrico4 ou hidróxido de sódio (em pequenas quantidades para ajuste de pH). Diluente: água para injetáveis.
O teor de proteína total é de 6–14 mg/mL de solução reconstituída.
A atividade específica do fator IX de coagulação2 é de 2,5 UI/mg de proteína total.
As atividades de todos os fatores de coagulação2, bem como das proteínas5 C e S (antígeno6) foram testadas de acordo com os padrões internacionais atuais válidos da OMS.
Os componentes da embalagem primária (frasco-ampola, tampa de borracha, lacre), bem como os itens do kit de transferência, não contêm látex.
INFORMAÇÕES AO PACIENTE
PARA QUE ESTE MEDICAMENTO É INDICADO?
Este medicamento é indicado ao:
- Tratamento de hemorragias7 (sangramento) e profilaxia perioperatória de hemorragias7 (prevenção de sangramento do período antes, durante e depois de uma cirurgia) em pacientes apresentando deficiência adquirida de fatores de coagulação2 do complexo protrombínico, como a deficiência causada pelo tratamento com medicamentos antagonistas da vitamina8 K, ou em caso de superdose de antagonistas da vitamina8 K, quando for necessária uma correção rápida da deficiência.
- Tratamento de hemorragias7 (sangramento) e profilaxia perioperatória de hemorragias7 (prevenção de sangramento do período antes, durante e depois de uma cirurgia) em pacientes com deficiência congênita9 (ou seja, desde o nascimento) de qualquer um dos fatores de coagulação2 dependentes de vitamina8 K, quando produtos de fator de coagulação2 purificados específicos não estão disponíveis.
COMO ESTE MEDICAMENTO FUNCIONA?
Beriplex® P/N contém os fatores de coagulação2 do sangue10 II, VII, IX e X (complexo protrombínico) e as proteínas5 C e S.
Em condições normais, os fatores de coagulação2 II, VII, IX e X são sintetizados no fígado11 com a ajuda da vitamina8 K, e participam do processo de coagulação2 do sangue10. As proteínas5 C e S são inibidoras da coagulação2 dependentes da vitamina8 K.
Beriplex® P/N irá repor os fatores de coagulação2 II, VII, IX e X (complexo protrombínico) em pacientes com deficiência destes fatores, elevando seus níveis no sangue10. Dessa forma, Beriplex® P/N pode corrigir temporariamente o defeito de coagulação2 dos pacientes com deficiência de um ou vários desses fatores.
QUANDO NÃO DEVO USAR ESTE MEDICAMENTO?
Você não deve utilizar Beriplex® P/N se tiver história de hipersensibilidade (alergia12) a qualquer um dos componentes do produto. No caso de coagulação2 intravascular13 disseminada, as preparações de complexo protrombínico somente podem ser aplicadas após o término do estado de consumo.
Você não deve utilizar Beriplex® P/N se tiver história conhecida de trombocitopenia14 (diminuição no número de plaquetas15) induzida por heparina.
O QUE DEVO SABER ANTES DE USAR ESTE MEDICAMENTO?
A terapia deve ser acompanhada por um especialista com experiência no tratamento de distúrbios de coagulação2.
Em pacientes com deficiência adquirida de fatores de coagulação2 dependentes de vitamina8 K (por exemplo, deficiência induzida pelo tratamento com antagonistas da vitamina8 K), Beriplex® P/N deve ser utilizado somente quando for necessária uma rápida correção dos níveis do complexo protrombínico como em hemorragias7 maiores ou cirurgia de emergência16. Em outros casos, a redução da dose do medicamento antagonista17 da vitamina8 K e / ou a administração de vitamina8 K é geralmente suficiente.
Os pacientes que estão em tratamento com um antagonista17 da vitamina8 K podem apresentar um estado oculto de coagulação2 excessiva, o qual pode ser agravado pelo uso do complexo protrombínico.
Na deficiência congênita9 de qualquer um dos fatores dependentes da vitamina8 K, deve-se utilizar, quando disponível, produtos contendo fatores de coagulação2 específicos.
Se você apresentar reações do tipo alérgica ou anafilática, seu médico descontinuará imediatamente a administração de Beriplex® P/N e iniciará um tratamento adequado. As medidas terapêuticas dependem do tipo e da gravidade dos efeitos indesejáveis. Os padrões médicos atuais para o tratamento de choque18 devem ser observados.
Quando os pacientes com deficiência congênita9 ou adquirida são tratados com complexo protrombínico humano, particularmente com doses repetidas, há um risco de trombose19 ou coagulação2 intravascular13 disseminada. O risco pode ser maior no tratamento da deficiência isolada do fator VII de coagulação2, uma vez que os outros fatores de coagulação2 dependentes de vitamina8 K podem se acumular em níveis consideravelmente mais elevados do que o normal. Os pacientes em tratamento com complexo protrombínico humano serão observados cuidadosamente quanto aos sinais20 ou sintomas21 de coagulação2 intravascular13 disseminada ou trombose19.
Devido ao risco de complicações tromboembólicas, um acompanhamento minucioso será realizado quando se administra Beriplex® P/N em pacientes:
- Com histórico de doença cardíaca coronária ou infarto do miocárdio22
- Com doença hepática23 (no fígado11)
- No peri ou pós-operatório
- Recém-nascidos
- Sob risco de eventos tromboembólicos, coagulação2 intravascular13 disseminada ou deficiência de inibidor simultânea.
Em cada uma destas situações, o benefício do tratamento com Beriplex® P/N deve ser ponderado contra o risco de tais complicações. A substituição dos fatores de coagulação2 do complexo protrombínico pode ser necessária em pacientes com coagulação2 intravascular13 disseminada. Entretanto, esta substituição só pode ser realizada após o término do estado de consumo (por exemplo, tratamento da causa subjacente, normalização persistente do nível de antitrombina III).
A reversão de antagonistas da vitamina8 K expõe os pacientes ao risco tromboembólico da doença subjacente. O reinício da anticoagulação deve ser cuidadosamente considerado o mais breve possível.
Reações indesejáveis podem incluir o desenvolvimento de trombocitopenia14 induzida por heparina, tipo II (TIH, tipo II). Os sinais20 característicos da TIH são uma queda na contagem de plaquetas15 > 50% e/ou a ocorrência de novas ou inexplicáveis complicações tromboembólicas durante o tratamento com heparina. O início é tipicamente de 4 a 14 dias após o começo da terapia com heparina, mas pode ocorrer dentro de 10 horas em pacientes recentemente expostos (nos últimos 100 dias) à heparina.
Foi relatada síndrome nefrótica24 em casos isolados após tentativa de indução de tolerância imunológica em pacientes com hemofilia25 B com inibidores do fator IX e história de reação alérgica26.
Não existem dados disponíveis sobre o uso de Beriplex® P/N em caso de hemorragia27 perinatal devido à deficiência de vitamina8 K em recém-nascidos.
Beriplex® P/N contém até 343 mg de sódio (aproximadamente 15 mmol) por 100 mL. Isto deve ser levado em consideração no caso de pacientes com uma dieta controlada de sódio.
Segurança viral
Quando medicamentos são feitos a partir de plasma28 ou sangue10 humano, algumas medidas são tomadas para prevenir a transmissão de infecções29 aos pacientes. Estas incluem:
- Seleção cuidadosa de doadores de plasma28 e sangue10 para se ter certeza que aqueles em risco de portar infecções29 sejam excluídos
- Teste de cada doador e mistura de plasma28 para sinais20 de vírus30/infecções29
Fabricantes destes produtos também incluem etapas no processamento de sangue10 ou plasma28 que podem inativar ou remover vírus30.
Apesar disto, quando medicamentos preparados a partir de sangue10 ou plasma28 humano são administrados, a possibilidade de transmissão de infecção31 não pode ser totalmente excluída. Isto também se aplica a vírus30 desconhecidos ou emergentes e outros agentes patogênicos.
As medidas tomadas são consideradas eficazes para vírus30 envelopados como o vírus30 da imunodeficiência32 humana (HIV33, o vírus30 da AIDS), vírus30 da hepatite34 B (HBV), vírus30 da hepatite34 C (HCV) e para os vírus30 não envelopados da hepatite34 A e parvovírus B19.
Seu médico pode recomendar a vacinação contra hepatite34 A e B se você recebe produtos derivados de plasma28 regularmente/repetidamente.
É altamente recomendável que toda vez que Beriplex® P/N for administrado, seu médico registre o número do lote, o volume injetado e a data de administração.
Gravidez35 e Lactação36
A segurança de Beriplex® P/N para uso durante a gravidez35 e durante a lactação36 não foi estabelecida. Os estudos em animais não são adequados para avaliar a segurança em relação à gravidez35, desenvolvimento do embrião ou feto37, parto ou desenvolvimento após o nascimento. Portanto, Beriplex® P/N deve ser usado durante a gravidez35 e lactação36 somente se claramente indicado.
Categoria B: este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Fertilidade
Não há dados disponíveis.
Efeitos na habilidade de dirigir e usar máquinas
Não foram realizados estudos sobre os efeitos na habilidade de dirigir e utilizar máquinas.
Doping
Atenção atletas: este medicamento contém albumina3 humana, que é considerada um agente mascarante do doping conforme lista de referência do COI.
Interações medicamentosas
Os produtos contendo complexo protrombínico humano anulam o efeito do tratamento com antagonista17 da vitamina8 K, mas não são conhecidas interações com outros medicamentos.
Na realização de testes de coagulação2 sensíveis à heparina, em pacientes recebendo altas doses de complexo protrombínico humano, deve-se levar em conta a heparina presente no medicamento administrado.
Beriplex® P/N não deve ser misturado com medicamentos, diluentes ou solventes que não estejam mencionados no item “6. Como Devo Usar Este Medicamento?”.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde38.
ONDE, COMO E POR QUANTO TEMPO POSSO GUARDAR ESTE MEDICAMENTO?
Cuidados de conservação
Beriplex® P/N deve ser conservado em temperatura ambiente não superior a 25°C. Não congelar. Mantenha o frasco dentro da embalagem original, a fim de protegê-lo da luz. O prazo de validade é de 36 meses a partir da data de fabricação, quando armazenado conforme recomendado.
A estabilidade físico-química após reconstituição foi demonstrada durante 24 horas à temperatura ambiente (máx. 25°C). No entanto, do ponto de vista microbiológico39, o produto deve ser usado imediatamente.
O produto não utilizado ou os resíduos devem ser eliminados de acordo com as exigências locais.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com prazo de validade vencido. Guarde-o em sua embalagem original.
Características físicas e organolépticas do produto
- Pó: pó branco ou com suave coloração.
- Solução reconstituída: a solução reconstituída de Beriplex® P/N é clara ou levemente opalescente. O produto não deve ser utilizado se a solução estiver turva ou apresentar depósito de partículas.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS.
COMO DEVO USAR ESTE MEDICAMENTO? POSOLOGIA
São dadas abaixo apenas orientações gerais sobre a dosagem do medicamento. O tratamento deve ser iniciado sob a supervisão de um médico experiente no tratamento de distúrbios de coagulação2. A dose e a duração da terapia de substituição dependem da indicação do tratamento, da gravidade da doença, da localização e extensão da hemorragia27 e do estado clínico do paciente.
A quantidade e a frequência de administração devem ser calculadas de modo individual para cada paciente. Para isso, seu médico determinará os níveis dos fatores de coagulação2 em seu sangue10 e monitorará seu estado clínico.
Em caso de grandes cirurgias, é essencial o acompanhamento preciso do tratamento por meio de testes de coagulação2.
Uso em idosos
A posologia e o modo de administração em pacientes idosos (> 65 anos) são iguais às recomendações gerais.
Tratamento e profilaxia perioperatória de hemorragias7 durante a terapia com antagonista17 da vitamina8 K.
A dose vai depender do índice internacional normalizado (RNI) antes do tratamento e da RNI pretendida. A RNI pré-tratamento deve ser mensurada o mais próximo possível da administração de modo a calcular a dose apropriada de Beriplex® P/N. Na tabela a seguir são apresentadas as doses aproximadas, necessárias para a normalização da RNI em diferentes níveis da RNI inicial. As doses são dadas em mL por kg de peso corporal do produto reconstituído e UI de fator IX de coagulação2 / kg de peso corporal.
|
RNI pré-tratamento |
2,0–3,9 |
4,0–6,0 |
> 6,0 |
|
Dose aproximada em mL/kg de peso corporal |
1 |
1,4 |
2 |
|
Dose aproximada em UI (fator IX de coagulação2) / kg de peso corporal |
25 |
35 |
50 |
A dose é baseada no peso corporal até 100 kg. Para pacientes40 com peso superior a 100 kg a dose única máxima (UI de fator IX de coagulação2), portanto, não deve ultrapassar 2500 UI de um RNI de 2,0–3,9, 3500 UI de um RNI de 4,0–6,0 e 5000 UI de um RNI > 6,0.
A correção do distúrbio da hemostasia41, induzido por antagonista17 da vitamina8 K, é geralmente alcançada, em aproximadamente 30 minutos após a injeção42. As administrações simultâneas de vitamina8 K devem ser consideradas em paciente que recebem Beriplex® P/N para reversão urgente do antagonista17 da vitamina8 K, uma vez que os efeitos da vitamina8 K ocorrem geralmente dentro de 4–6 horas. A administração de doses repetidas de Beriplex® P/N em pacientes que requerem reversão urgente do tratamento com antagonista17 da vitamina8 K não é sustentada por dados clínicos e, portanto não é recomendada.
Estas recomendações são baseadas em dados de estudos clínicos com um número limitado de indivíduos. A recuperação e a duração do efeito podem variar, portanto a monitorização da RNI durante o tratamento é obrigatória.
Hemorragias7 e profilaxia perioperatória na deficiência congênita9 de qualquer um dos fatores de coagulação2 dependentes da vitamina8 K, quando produtos contendo fatores de coagulação2 específicos não estão disponíveis.
O cálculo43 da dose necessária de concentrado de complexo protrombínico é baseado em dados de estudos clínicos:
- Para a dose de 1 UI de fator IX de coagulação2 por kg de peso corporal está prevista uma elevação da atividade do fator IX plasmático de 1,3% (0,013 UI/mL) do valor normal.
- A dose de 1 UI de fator VII de coagulação2 por kg de peso corporal eleva a atividade do fator VII plasmático em 1,7% (0,017 UI/mL) do valor normal.
- A dose de 1 UI de fator II de coagulação2 por kg de peso corporal eleva a atividade do fator II plasmático em 1,9% (0,019 UI/mL) do valor normal.
- A dose de 1 UI de fator X de coagulação2 por kg de peso corporal eleva a atividade do fator X plasmático em 1,9% (0,019 UI/mL) do valor normal.
A dose de um fator específico administrado é expressa em unidades internacionais (UI), relacionadas com o atual padrão da OMS, para cada fator. A atividade no plasma28 de um fator de coagulação2 específico é expressa em percentagem (em relação ao plasma28 normal) ou em Unidades Internacionais (em relação ao padrão internacional para o fator de coagulação2 específico).
Uma Unidade Internacional (UI) de uma atividade do fator de coagulação2 é equivalente à quantidade em um mL de plasma28 humano normal.
Por exemplo, o cálculo43 da dose necessária de fator X de coagulação2 é baseado na constatação de que 1 Unidade Internacional (UI) de fator X de coagulação2 por kg de peso corporal aumenta a atividade do fator X de coagulação2 plasmático em 0,019 UI/mL.
A dose necessária é determinada usando a seguinte fórmula:
Unidades necessárias = peso corporal [kg] x aumento desejado do fator X [UI / mL] x 53, onde 53 (mL / kg) é a recíproca da recuperação estimada.
Observe que o cálculo43 é baseado em dados de pacientes que receberam antagonistas da vitamina8 K. Um cálculo43 baseado em dados de indivíduos saudáveis forneceria uma estimativa mais baixa da dose necessária.
Se a recuperação individual for conhecida, esse valor deve ser utilizado para o cálculo43.
Informações específicas do produto estão disponíveis a partir de estudos clínicos em voluntários sadios (N = 15), na reversão do tratamento de antagonista17 de vitamina8 K para o tratamento de hemorragia27 aguda importante ou profilaxia perioperatória de hemorragia27 (N = 98, N = 43).
MODO DE USAR
Instruções gerais
A solução deve ser clara ou levemente opalescente. Após a filtração / aspiração e antes da aplicação, o produto reconstituído deve ser inspecionado visualmente para verificar se há partículas ou se a cor está alterada. Não use soluções turvas ou que apresentem depósito. A reconstituição e aspiração do produto para a seringa44 devem ser realizadas sob condições assépticas.
Reconstituição
Deixar o diluente atingir a temperatura ambiente. Assegurar que as tampas “flip-off” dos frascos do produto e do diluente foram retiradas, as tampas de borracha foram tratadas com solução antisséptica e secas antes da abertura da embalagem do dispositivo de transferência “Mix2Vial”.
|
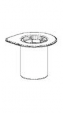 |
1. Abra a embalagem do “Mix2Vial” retirando a tampa selo. Não remova o “Mix2Vial” da embalagem externa. |
|
 |
2. Coloque o frasco do diluente sobre uma superfície plana e limpa e segure o frasco firmemente. Pegue o “Mix2Vial” junto com a embalagem externa e empurre a ponta azul diretamente através da tampa de borracha do frasco do diluente. |
|
 |
3. Remova cuidadosamente a embalagem externa do conjunto “Mix2Vial” segurando na borda e empurrando verticalmente para cima. Assegure que somente a embalagem seja retirada e não o conjunto “Mix2Vial”. |
|
 |
4. Coloque o frasco do produto sobre uma superfície plana e firme. Inverta o frasco de diluente com o conjunto “Mix2Vial” conectado e empurre o adaptador transparente através da tampa de borracha do frasco do produto. O diluente irá fluir automaticamente para o frasco do produto. |
|
 |
5. Com uma mão45 segure o lado do produto do conjunto “Mix2Vial” e com a outra mão45 segure o lado do diluente e desconecte no sentido anti-horário o conjunto em duas partes. Descartar o frasco de diluente com o adaptador azul conectado. |
|
 |
6. Gire suavemente o frasco do produto até que a substância seja completamente dissolvida. NÃO AGITE. |
|
 |
7. Puxe o ar em uma seringa44 vazia e estéril. |
Aspiração e aplicação
|
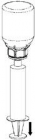 |
8. Mantendo o êmbolo46 da seringa44 pressionado, inverta o sistema de cabeça47 para baixo e aspire o concentrado para dentro da seringa44 puxando o êmbolo46 lentamente para trás. |
|
 |
9. Uma vez transferido o concentrado para a seringa44, segure firmemente o corpo da seringa44 (mantendo o êmbolo46 da seringa44 para baixo) e desconecte o adaptador do “Mix2Vial” da seringa44 desconectando no sentido anti-horário. |
Cuidados devem ser tomados para que o sangue10 não entre na seringa44 com o produto, pois há risco do sangue10 coagular48 na seringa44 e ocorrer a administração de coágulos de fibrina49 ao paciente.
No caso de mais de um frasco de Beriplex® P/N ser necessário, é possível reunir vários frascos para uma única aplicação através de um dispositivo de infusão comercialmente disponível.
A solução de Beriplex® P/N não deve ser diluída.
A solução reconstituída deve ser administrada por via intravenosa através de injeção42 lenta a uma taxa que não exceda 3 UI/kg/min., máx. 210 UI/min, aproximadamente 8 mL/min.
Qualquer produto não utilizado ou material residual deve ser eliminado em conformidade com os requisitos locais.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento. Não interrompa o tratamento sem o conhecimento do seu médico.
O QUE DEVO FAZER QUANDO EU ME ESQUECER DE USAR ESTE MEDICAMENTO?
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
QUAIS OS MALES QUE ESTE MEDICAMENTO PODE ME CAUSAR?
Resumo do perfil de segurança
As reações alérgicas, ou do tipo anafilática foram raramente observadas, incluindo reações anafiláticas50 graves (ver item “4. O que devo saber antes de usar este medicamento?”).
A terapia de substituição pode levar à formação de anticorpos51 circulantes que inibem um ou mais dos fatores do complexo protrombínico humano. Se esses inibidores ocorrerem, esta condição irá manifestar-se como uma má resposta clínica. Nesses casos, recomenda-se entrar em contato com um centro de hemofilia25 especializado, para orientação. Reações anafiláticas50 foram observadas em pacientes com anticorpos51 contra fatores contidos no Beriplex® P/N.
Aumento da temperatura corporal foi comumente observado.
Existe o risco de episódios tromboembólicos após a administração do complexo protrombínico humano (ver item “4. O que devo saber antes de usar este medicamento?”).
Lista tabulada das reações adversas de Beriplex® P/N
As reações adversas seguintes estão baseadas em dados de estudos clínicos, na experiência pós-comercialização, bem como na literatura científica.
Informe seu médico ou farmacêutico se você apresentar alguma das reações abaixo, ou outras reações não listadas nessa bula.
A tabela apresentada a seguir está de acordo com a classificação de sistemas de órgãos MedDRA (CSO e Nível Termo Preferencial). As frequências foram baseadas em dados de ensaios clínicos52, de acordo com a seguinte convenção: muito comum (≥ 1/10); comum (≥ 1/100 a < 1/10); incomum (≥ 1/1.000 a < 1/100); raro (≥ 1/10.000 a < 1/1.000); muito raro (< 1/ 10.000) ou não conhecido (não pode ser estimado a partir dos dados disponíveis).
|
Classificação Padrão de Sistemas de Órgãos (CSO) MedDRA |
Reações Adversas por termo preferencial |
Frequência |
|
Distúrbios Vasculares53 e outras CSOs |
Eventos tromboembólicos* |
comum |
|
Distúrbios do Sangue10 e Sistema Linfático54 |
Coagulação2 intravascular13 disseminada |
não conhecida |
|
Distúrbios do Sistema Imunológico55 |
Reações de hipersensibilidade ou alérgicas |
incomum |
|
Reações anafiláticas50 incluindo choque anafilático56 |
não conhecida |
|
|
Desenvolvimento de anticorpos51 |
não conhecida |
|
|
Distúrbios do Sistema Nervoso57 |
Dor de cabeça47 |
comum |
|
Distúrbios Gerais e condições no local da administração |
Aumento da temperatura corporal |
comum |
* incluindo casos com desfecho fatal
Para informações acerca da segurança viral, ver item “4. O que devo saber antes de usar este medicamento?”.
Uso pediátrico
Não há dados disponíveis sobre o uso de Beriplex® P/N em crianças.
Relatos de suspeitas de reações adversas
Relatos de suspeitas de reações adversas após a aprovação do medicamento são importantes. Eles permitem o monitoramento contínuo da relação risco/benefício do medicamento. Os profissionais de saúde38 são solicitados a relatar quaisquer suspeitas de reações adversas.
Informe ao seu médico, cirurgião-dentista ou farmacêutico o aparecimento de reações indesejáveis pelo uso do medicamento. Informe também à empresa através do seu serviço de atendimento.
O QUE FAZER SE ALGUÉM USAR UMA QUANTIDADE MAIOR DO QUE A INDICADA DESTE MEDICAMENTO?
Para evitar uma superdose é aconselhável que seu médico monitore regularmente o estado da coagulação2 durante o tratamento, uma vez que o uso de doses altas de concentrado de complexo protrombínico tem sido associado com ocorrência de infarto do miocárdio22, coagulação2 intravascular13 disseminada, trombose19 venosa e embolia58 pulmonar. No caso de superdose, o risco de complicações tromboembólicas ou coagulação2 intravascular13 disseminada é aumentado em pacientes sob risco de sofrer estas complicações.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
DIZERES LEGAIS
USO RESTRITO A HOSPITAIS
VENDA SOB PRESCRIÇÃO MÉDICA
MS 1.0151.0117
Farm. Resp.: Cristina J. Nakai CRF-SP 14.848
Fabricado por:
CSL Behring GmbH Marburg - Alemanha
Importado por:
CSL Behring Comércio de Produtos Farmacêuticos Ltda.
Rua Gomes de Carvalho, 1195 - Cj. 32 CEP 04547-004 - São Paulo - SP
CNPJ 62.969.589/0001-98
SAC 0800 6008810