Arava (Bula do profissional de saúde)
SANOFI MEDLEY FARMACÊUTICA LTDA.
IDENTIFICAÇÃO DO MEDICAMENTO
Arava®
leflunomida
Comprimidos 20 mg e 100 mg
FORMA FARMACÊUTICA E APRESENTAÇÃO:
Comprimido revestido
embalagem com 3 ou 30 comprimidos
USO ORAL
USO ADULTO
COMPOSIÇÃO:
Cada comprimido de Arava® 20 mg contém:
| leflunomida | 20 mg |
| excipiente q.s.p. | 1 comprimido |
Excipientes: lactose1 monoidratada, amido de milho, povidona K25, dióxido de silício, estearato de magnésio, crospovidona, hipromelose, macrogol 8000, dióxido de titânio, óxido férrico amarelo e talco.
Cada comprimido de Arava® 100 mg contém:
| leflunomida | 100 mg |
| excipiente q.s.p. | 1 comprimido |
Excipientes: lactose1 monoidratada, amido de milho, povidona K25, dióxido de silício, estearato de magnésio, crospovidona, hipromelose, macrogol 8000, dióxido de titânio e talco.
INFORMAÇÕES TÉCNICAS AOS PROFISSINAIS DE SAÚDE2
INDICAÇÕES
Arava é indicado para o tratamento da artrite reumatoide3 ativa, reduzindo os sinais4 e sintomas5, inibindo a destruição das articulações6 e melhorando as funções físicas e de saúde2 relacionadas à qualidade de vida.
Arava é também indicado para o tratamento da artrite7 psoriática ativa.
RESULTADOS DE EFICÁCIA
Artrite Reumatoide3
A eficácia de Arava no tratamento da artrite reumatoide3 (AR) foi demonstrada em três estudos clínicos controlados mostrando redução dos sinais4 e sintomas5 e inibição dos danos estruturais. Em dois destes três estudos clínicos controlados, a eficácia também foi demonstrada na melhora da função física.
Em todos os estudos de monoterapia com Arava, uma dose inicial de ataque de 100 mg/dia por três dias só foi utilizada seguida de 20 mg por dia, após estes três primeiros dias de dose de ataque.
US301
O estudo US301, um estudo placebo8-controlado de 2 anos, randomizou 482 pacientes com AR ativa com pelo menos 6 meses de duração para receber 20 mg/dia de leflunomida (n = 182), 7,5 mg/semana de metotrexato aumentando para 15 mg/semana (n = 182), ou placebo8 (n = 118). Todos os pacientes receberam 1 mg de folato duas vezes ao dia. A análise primária foi realizada após 52 semanas com tratamento cego até 104 semanas.
De maneira geral, 235 dos 508 pacientes randomizados (482 na análise primária de dados e mais 26 pacientes adicionais), continuaram o tratamento duplo-cego por mais 12 meses (98 recebendo leflunomida, 101 recebendo metotrexato e 36 recebendo placebo8). A dose de leflunomida continuou com 20 mg /dia e a dose de metotrexato poderia ser aumentada até um máximo de 20 mg/semana. No total, 190 pacientes (83 recebendo leflunomida, 80 recebendo metotrexato e 27 recebendo placebo8) completaram os dois anos de tratamento duplo-cego.
MN301/303/305
O estudo MN301, um estudo placebo8-controlado, randomizou 358 pacientes com AR ativa para receber 20 mg/dia de leflunomida (n = 133), 2,0 g/dia de sulfassalazina (n = 133) ou placebo8 (n = 92). A duração do tratamento foi de 24 semanas. Uma extensão do estudo foi uma continuação opcional do estudo MN301, sem o grupo placebo8, resultando em uma comparação de 12 meses de leflunomida e sulfassalazina (estudo MN 303).
Dos 168 pacientes que completaram 12 meses de tratamento nos estudos MN301 e MN303, 146 pacientes (87%) entraram em um estudo de extensão de 1 ano sem o grupo placebo8, de tratamento ativo duplo-cego (MN305: 60 recebendo leflunomida, 60 recebendo sulfassalazina e 26 recebendo placebo8/sulfassalazina). Os pacientes continuaram com a mesma dose diária de leflunomida ou sulfassalazina que eles estavam tomando quando eles completaram os estudos MN301/303.
Um total de 121 pacientes (53 recebendo leflunomida, 47 recebendo sulfassalazina e 21 recebendo placebo8/sulfassalazina) completou os dois anos de tratamento duplo-cego.
MN302/304
O estudo MN302, um estudo controlado ativo sem o grupo placebo8, randomizou 999 pacientes com AR ativa para receber 20 mg/dia de leflunomida (n = 501) ou 7,5 mg/semana de metotrexato aumentando para 15 mg/semana (n = 498). O suplemento de folato foi usado em 10% dos pacientes. A duração do tratamento foi de 52 semanas.
Dos 736 pacientes que completaram as 52 semanas de tratamento no estudo MN302, 612 (83%) entraram no estudo de extensão de 1 ano duplo-cego MN304 (292 recebendo leflunomida, 320 recebendo metotrexato). Os pacientes continuaram recebendo a mesma dose diária de leflunomida ou metotrexato que eles estavam recebendo quando completavam o estudo MN302. Quinhentos e trinta e três pacientes (256 recebendo leflunomida, 277 recebendo metotrexato) completaram os 2 anos de tratamento duplo-cego.
Sinais4 e Sintomas5 da Artrite Reumatoide3
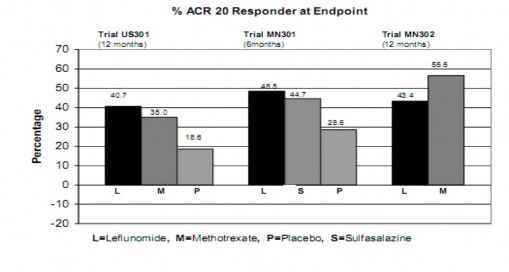
O alívio dos sinais4 e sintomas5 foi avaliado utilizando-se o Índice de Respondedores ACR20 do American College of Rheumatology, composto de medições clínicas, laboratoriais e funcionais da artrite reumatoide3. Um “Respondedor ACR20” é um paciente que apresentou uma melhora ≥ 20%, tanto na contagem de articulações6 tumefactas como na contagem de articulações6 dolorosas, além de uma melhora em 3 dos 5 seguintes critérios: avaliação global realizada pelo médico, avaliação global realizada pelo paciente, medição da habilidade funcional [Modified Health Assessment Questionnaire (MHAQ)], Escala Visual Analógica de dor, e taxa de sedimentação eritrócitária ou proteína C-reativa. Um “Respondedor ACR20 no Desfecho” é um paciente que completou o estudo e foi um “Repondedor ACR20” ao final do estudo.
As taxas do Respondedor ACR20 no desfecho são apresentadas na Figura 1. Estatisticamente, o tratamento com Arava foi significativamente superior ao placebo8 na redução dos sinais4 e sintomas5 da AR, segundo a análise de eficácia primária, Respondedor ACR20 no desfecho, nos estudos US301 (desfecho primário de 12 meses) e MN301 (desfecho de 6 meses). As taxas do Respondedor ACR20 no desfecho com tratamento com Arava foram consistentes ao longo dos estudos de 6 e 12 meses (41–49%). Não foram demonstradas diferenças consistentes entre leflunomida e metotrexato, ou entre leflunomida e sulfassalazina. O efeito do tratamento com Arava mostrou-se evidente após 1 mês, estabilizando-se entre os meses 3–6, e continuando ao longo do tratamento, conforme apresentado na Figura 2.
Figura 1
|
|
Comparações |
Intervalo de confiança |
Valor p |
|
US301 |
Leflunomida vs. Placebo8 |
(12, 32) |
< 0,0001 |
|
Metotrexato vs. Placebo8 |
(8, 30) |
< 0,0001 |
|
|
Leflunomida vs. Metotrexato |
(-4, 16) |
NS |
|
|
MN301 |
Leflunomida vs. Placebo8 |
(7, 33) |
0,0026 |
|
Sulfassalazina vs. Placebo8 |
(4, 29) |
0,0121 |
|
|
MN302 |
Leflunomida vs. Sulfassalazina |
(-8, 16) |
NS |
|
Leflunomida vs. Metotrexato |
(-19, -7) |
<0,0001 |
Figura 2
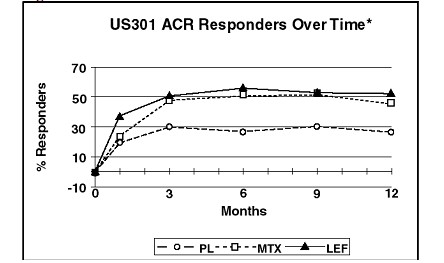
*Última observação realizada
Os Respondedores ACR50 e ACR70 são definidos de maneira análoga ao Respondedor ACR20, mas utilizam melhoras de 50% ou 70%, respectivamente (Tabela 1). A alteração média dos componentes individuais do Índice de Respondedores ACR é apresentada na Tabela 2.
Tabela 1. Resumo das Taxas de Resposta ACR*
|
Grupo de Estudo e Tratamento |
ACR20 |
ACR50 |
ACR70 |
|
Estudos Placebo8-Controlados |
|||
|
Leflunomida (n=178)† |
52,2‡ |
34,3‡ |
20,2‡ |
|
Placebo8 (n=118)† |
26,3 |
7,6 |
4,2 |
|
Metotrexato (n=180)† |
45,6 |
22,8 |
9,4 |
|
Estudos Placebo8-Controlados |
|||
|
Leflunomida (n=130)† |
54,6‡ |
33,1‡ |
10,0§ |
|
Placebo8 (n=91)† |
28,6 |
14,3 |
2,2 |
|
Sulfassalazina (n=132)† |
56,8 |
30,3 |
7,6 |
|
Estudos sem grupo placebo8 |
|||
|
Leflunomida (n=495)† |
51,1 |
31,1 |
9,9 |
|
Metotrexato (n=489)† |
65,2 |
43,8 |
16,4 |
*Análise por intenção de tratamento (ITT) utilizando a técnica da Última Observação Realizada (LOCF), para pacientes9 que interromperam o tratamento precocemente.
† N é o número de pacientes ITT para os quais havia dados adequados disponíveis para cálculo10 das taxas indicadas.
‡ p > 0,001 leflunomida vs. placebo8
§ p > 0,02 leflunomida vs. placebo8
A Tabela 2 apresenta os resultados dos componentes dos critérios de resposta ACR para os estudos US301, MN301 e MN302. O tratamento com Arava foi significativamente superior ao placebo8 em todos os componentes dos critérios de resposta ACR nos estudos US301 e MN301. Além disso, o tratamento com Arava foi significativamente superior ao placebo8 na melhora da rigidez matinal, um indicador da atividade de AR, não incluída nos critérios de resposta ACR. Não foram demonstradas diferenças consistentes entre o tratamento com Arava e os comparadores ativos.
Tabela 2. Alteração Média nos Componentes do Índice de Respondedores ACR*
|
Componentes |
Estudos Placebo8-Controlados |
Estudo Não-Placebo8 Controlado |
||||||
|
US301 (12 meses) |
MN301 - Não-EUA (6 meses) |
MN302 - Não-EUA (12 meses) |
||||||
|
Leflunomida |
Metotrexato |
Placebo8 |
Leflunomida |
Sulfassal azina |
Placebo8 |
Leflunomida |
Metotrexato |
|
|
Contagem de articulação11 dolorosa1 |
-7,7 |
-6,6 |
-3,0 |
-9,7 |
-8,1 |
-4,3 |
-8,3 |
-9,7 |
|
Contagem de articulação11 tumefacta121 |
-5,7 |
-5,4 |
-2,9 |
-7,2 |
-6,2 |
-3,4 |
-6,8 |
-9,0 |
|
Avaliação global do paciente2 |
-2,1 |
-1,5 |
0,1 |
-2,8 |
-2,6 |
-0,9 |
-2,3 |
-3,0 |
|
Avaliação global do médico2 |
-2,8 |
-2,4 |
-1,0 |
-2,7 |
-2,5 |
-0,8 |
-2,3 |
-3,1 |
|
Função física /desabilidade (MHAQ/HAQ) |
-0,29 |
-0,15 |
0,07 |
-0,50 |
-0,29 |
-0,04 |
-0,37 |
-0,44 |
|
Intensidade da dor2 |
-2,2 |
-1,7 |
-0,5 |
-2,7 |
-2,0 |
-0,9 |
-2,1 |
-2,9 |
|
Taxa de sedimentação eritrocitária |
-6,26 |
-6,48 |
2,56 |
-7,48 |
-16,56 |
3,44 |
-10,12 |
-22,18 |
|
Proteína C- reativa |
-0,62 |
-0,50 |
0,47 |
-2,26 |
-1,19 |
0,16 |
-1,86 |
-2,45 |
|
Não incluído no Índice de Respondedores ACR |
||||||||
|
Rigidez matinal (min) |
-101,4 |
-88,7 |
14,7 |
-93,0 |
-42,4 |
-6,8 |
-63,7 |
-86,6 |
* Última observação realizada; Alterações negativas indicam melhoras
1 Com base na contagem de 28 articulações6
2 Escala Visual Analógica: 0 = Melhor; 10 = Pior
Manutenção do efeito
Após completar 12 meses de tratamento, os pacientes que continuaram o tratamento do estudo foram avaliados por 12 meses adicionais, em tratamento duplo-cego (período total de 2 anos de tratamento) nos estudos US301, MN305 e MN304. As taxas de Respondedores ACR nos 12 meses foram mantidas ao longo de 2 anos na maioria dos pacientes que continuaram com um segundo ano de tratamento. A melhora a partir do baseline nos componentes individuais dos critérios de resposta ACR também foi mantida na maioria dos pacientes durante o segundo ano do tratamento com Arava, em todos os três estudos.
Inibição do dano estrutural
A inibição do dano estrutural comparada ao controle foi avaliada através do Escore Sharp, um escore composto de erosões ao raio-X e redução do espaço articular, nas mãos13/pulsos e frente dos pés.
A alteração na progressão da doença estrutural, a partir da linha basal até o desfecho, conforme medida pelo escore Sharp de raio-X, é apresentada na Figura 3. Estatisticamente, o estudo com Arava foi significativamente superior ao placebo8 na inibição da progressão da doença pelo escore de Sharp. Não foram demonstradas diferenças consistentes entre a leflunomida e o metotrexato, ou entre a leflunomida e a sulfassalazina.
Figure 3
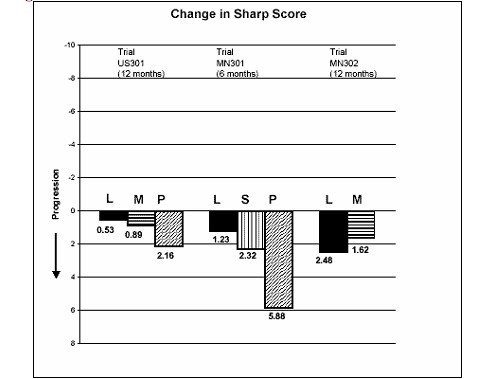
L = leflunomida; M = metotrexato; S = sulfassalazina; P = placebo8
|
Comparações |
Intervalo de Confiança 95% |
Valor p |
||
|
US301 |
Leflunomida vs. Placebo8 |
(-4,0 |
, -1,1) |
0,0007 |
|
Metotrexato vs. Placebo8 |
(-2,6 |
, -0,2) |
0,0196 |
|
|
Leflunomida vs. Metotrexato |
(-2,3 |
, 0,0) |
0,0499 |
|
|
MN301 |
Leflunomida vs. Placebo8 |
(-6,2 |
, -1,8) |
0,0004 |
|
Sulfassalazina vs. Placebo8 |
(-6,9 |
, 0,0) |
0,0484 |
|
|
Leflunomida vs. Sulfassalazina |
(-3,3 |
, 1,2) |
NS |
|
|
MN302 |
Leflunomida vs. Metotrexato |
(-2,2 |
, 7,4) |
NS |
Melhora na função física
A melhora na função física foi avaliada utilizando-se o Questionário de Avaliação de Saúde2 (HAQ) e o Formulário resumido de resultados médicos (SF-36). O questionário HAQ avalia a função física de um paciente e o grau de desabilidade. A alteração média na habilidade funcional, a partir da linha basal, medida pelo Índice de Desabilidade HAQ (HAQ DI), nos estudos placebo8 e ativo controlado de 6 e 12 meses é apresentada na Figura 4. Estatisticamente, o tratamento com Arava foi significativamente superior ao placebo8 na melhora da função física. A superioridade em relação ao placebo8 foi demonstrada consistentemente em todas as oito subescalas HAQ D1 (ações de vestir, levantar-se, comer, andar, higiene, extensão do braço, ato de segurar e atividades) em ambos os estudos placebo8-controlados.
O Formulário resumido de resultados médicos (SF-36), um questionário genérico de qualidade de vida relacionada à saúde2, trata de maneira adicional a função física. No estudo US301, no mês 12, o tratamento com Arava apresentou melhoras estatisticamente significante em comparação ao placebo8 no escore do sumário do componente físico (PCS).
Figura 4
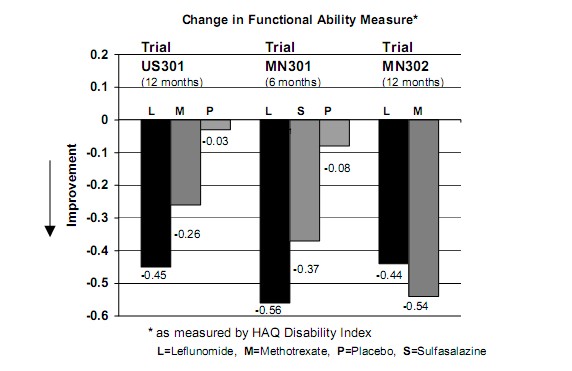
|
Comparações |
Intervalo de Confiança 95% |
Valor p |
|
|
US301 |
Leflunomida vs. Placebo8 |
(-0,58 , -0,29) |
0,0001 |
|
Leflunomida vs. Metotrexato |
(-0,34 , -0,07) |
0,0026 |
|
|
MN301 |
Leflunomida vs. Placebo8 |
(-0,67 , -0,36) |
< 0,0001 |
|
Leflunomida vs. Sulfassalazina |
(-0,33 , -0,03) |
0,0163 |
|
|
MN302 |
Leflunomida vs. Metotrexato |
(0,01 , 0,16) |
0,0221 |
Manutenção do efeito
A melhora na função física demonstrada nos meses 6 e 12 foi mantida por dois anos. Nos pacientes que continuaram a terapia por um segundo ano, essa melhora na função física, medida pelo HAQ e SF-36 (PCS), foi mantida.
Artrite7 Psoriática
Pacientes adultos com Artrite7 Psoriática (PsA) foram randomizados para receber leflunomida ou placebo8. A duração do tratamento foi de 6 meses, com dose de 100 mg/dia de leflunomida por três dias, seguida de 20 mg/dia no período restante. No grupo da leflunomida, dos pacientes totalmente analisáveis (n=186), 59,0% apresentaram uma melhora nos Critérios de Resposta ao Tratamento de Artrite7 Psoriática (PsARC), tratando-se do desfecho primário, comparada a 29,7% no grupo recebendo placebo8 (p<0,0001). O PsARC é uma medida que combina uma avaliação global realizada pelo médico, uma autoavaliação global realizada pelo paciente, um escore de articulação11 dolorosa e um escore de articulação11 tumefacta12. A melhora no PsARC é definida como uma diminuição ≥ 30% nos escores de articulações6 e ≥1 ponto nas avaliações globais. Para ser considerado um respondedor, o paciente deveria apresentar uma melhora em pelo menos duas das medidas relacionadas acima, sendo uma delas de escore de articulação11 dolorosa ou tumefacta12, e não apresentar piora em nenhuma das quatro medidas (vide tabela 3).
Tabela 3. Alteração Média nos Componentes do Índice de Respondedores PsARC*
|
Componentes |
Estudo placebo8-controlado (6 meses) |
||
|
Leflunomida (n=95) |
Placebo8 (n=91) |
Valores de p |
|
|
Escore de articulação11 dolorosa* |
-9,1 |
-4,6 |
0,0022 |
|
Escore de articulação11 tumefacta12* |
-6,8 |
-4,2 |
0,0013 |
|
Avaliação global do médico – com melhora em pelo menos uma categoria1 |
52,6% |
34,1% |
< 0,0001 |
|
Auto-avaliação global do paciente – com melhora em pelo menos uma categoria1 |
31,6% |
30,8% |
0,0036 |
* Alterações negativas indicam melhoras
1 escala Likert de 5 pontos: 1 = Muito bom; 5 = Muito pobre
Alterações no Índice de Área e Severidade da Psoríase14 (PASI) refletem alterações na extensão e severidade das lesões15 de psoríase14, julgadas por eritema16, descamação17 e infiltração. A leflunomida resultou em uma melhora significativa nos escores PASI ao longo das 24 semanas do estudo, em comparação ao grupo placebo8, com uma melhora média (± DP) de 22,4% (± 51,6%) no grupo da leflunomida, comparada à uma deterioração de 2,2% (± 70,4%) no grupo recebendo placebo8 (p=0,0030). Em comparação com o grupo placebo8, uma proporção significativamente maior de pacientes do grupo recebendo leflunomida apresentou uma redução ≥50% nos escores PASI (PASI 50; 18,9% vs. 30,4%; p=0,050) e uma redução ≥75% nos escores PASI a partir da linha basal (PASI 75; 7,8% vs. 17,4%; p=0,048).
Os eventos adversos observados no estudo clínico realizado em pacientes PsA foram comparáveis aos eventos adversos observados nos estudos clínicos realizados em pacientes com Artrite Reumatoide3.
Exposição durante a gravidez18
A leflunomida não deve ser utilizada em gestantes, ou em mulheres em idade fértil que não estejam utilizando um método contraceptivo confiável durante o tratamento com leflunomida. A possibilidade de gravidez18 deve ser descartada antes do início do tratamento com leflunomida. Caso exista qualquer razão de suspeita de gravidez18, as pacientes devem ser aconselhadas a notificar seus médicos para realizar um teste de gravidez18, e se positivo, discutir os riscos relacionados com o resultado da gravidez18. Os procedimentos de eliminação do fármaco19 para reduzir rapidamente o nível sanguíneo do metabólito20 ativo da leflunomida podem reduzir o risco ao feto21 (vide “Contraindicações” e “Gravidez e Lactação”).
Um estudo prospectivo22 do resultado da gravidez18 foi conduzido pela Organização dos Especialistas em Informação Teratológica (OTIS) para estimar o risco de defeitos de nascença e outros resultados adversos da gravidez18 em decorrência da exposição inadvertida à leflunomida no primeiro trimestre da gravidez18. As gestantes foram incluídas em um de três grupos: mulheres com diagnóstico23 de artrite reumatoide3 que tomaram pelo menos uma dose de leflunomida (n=64), um grupo de comparação com a mesma patologia24 sem a exposição à leflunomida durante a gravidez18 (n=108) ou um grupo de comparação de gestantes saudáveis (n=78). A exposição inadvertida de leflunomida durante o primeiro trimestre da gravidez18 seguido de descontinuação do tratamento com o fármaco19, mais um procedimento de “washout” com colestiramina resultou em grandes defeitos estruturais em 5,4% dos nascidos vivos comparado com os dois grupos comparativos (4,2% no grupo de comparação com a mesma patologia24 e 4,2% no grupo das gestantes saudáveis).
O resultado deste estudo, que foi descontinuado prematuramente devido a uma declinação no recrutamento, não altera a contraindicação inicial do uso de leflunomida durante a gravidez18. Em particular, o estudo não lidou com possíveis riscos associados com o uso da leflunomida durante o período completo de desenvolvimento embrionário, uma vez que todos os indivíduos do grupo exposto a leflunomida descontinuaram a medicação após a identificação da gravidez18. Aproximadamente todas foram submetidas a pelo menos um procedimento de eliminação do fármaco19 e a maioria das pacientes não foram expostas a leflunomida por um período maior que três semanas após a concepção25.
Estudos pós-comercialização
Um estudo multicêntrico, randomizado26 e controlado avaliou a taxa de resposta de eficácia clínica em pacientes virgens de tratamento com DMARD (n = 121) com início de AR tratado com leflunomida, usando o critério de ACR20 avaliado em três meses como desfecho primário em grupos de tratamento posológico de dose inicial (com e sem dose de ataque). Durante o período duplo-cego inicial de três dias, dois grupos paralelos receberam 20 mg ou 100 mg de leflunomida com placebo8 correspondente. O período inicial foi seguido por um período aberto de manutenção de três meses, durante o qual ambos os grupos receberam leflunomida 20 mg ao dia. A eficácia da leflunomida foi confirmada neste estudo, mas nenhum benefício adicional foi observado na população estudada com o uso da dose de ataque. No final do estudo, a taxa de resposta ACR20 foi 58,5% no grupo com a dose de ataque, contra 77,8% no grupo sem dose de ataque (p = 0,025). Para as variáveis secundárias analisadas (ACR50, ACR70, DAS28), não foram observadas diferenças significativas entre os dois grupos de tratamento em um limite de probabilidade de 0,05. Uma resposta clínica foi observada durante o primeiro mês de tratamento em mais da metade dos pacientes, sem diferença significativa em 30 dias, entre os grupos de tratamento para todos os critérios de eficácia. Os dados de segurança obtidos a partir dos dois grupos de tratamento foram consistentes com o conhecido perfil de segurança de leflunomida, no entanto, a incidência27 de eventos adversos gastrintestinais e o aumento das enzimas hepáticas28 tende a ser maior em pacientes recebendo a dose de ataque de 100 mg leflunomida.
Referências
- Strand V, et al. Treatment of active rheumatoid arthritis with leflunomide compared with placebo8 and methotrexate. Leflunomide Rheumatoid Arthritis Investigators Group. Arch Intern Med. 1999 Nov;159(21):2542–50.
- Smolen JS, et al. Efficacy and safety of leflunomide compared with placebo8 and sulphasalazine in active rheumatoid arthritis: a double-blind, randomised, multicentre trial. Lancet. 1999 Jan;353(9149):259–66.
- Emery P, et al. A comparison of the efficacy and safety of leflunomide and methotrexate for the treatment of rheumatoid arthritis. Rheumatology (Oxford). 2000 Jun;39(6):655–65.
- Smolen JS, et al. A randomized, double-blind study of leflunomide vs sulfasalazine in rheumatoid arthritis 1-year update. Ann Rheum Dis. 1999; 58(Abstr Suppl): 103. Abs: 397.
- Kalden JR, et al. Multinational Leflunomide Study Group Leflunomide vs sulfasalazine in rheumatoid arthritis 24-month update of a randomized, double-blind study. Arthritis Rheum. 1999; 42(9 Suppl): S271. Abs: 1202.
- Cohen S, et al. Two-year treatment of active rheumatoid arthritis (RA) with leflunomide (LEF) compared with placebo8 (PL) or methotrexate (MTX). Arthritis Rheum. 1999; 42(9 Suppl): S271. Abs: 1201.
CARACTERÍSTICAS FARMACOLÓGICAS
Propriedades Farmacodinâmicas
Farmacologia29 humana: A leflunomida é um agente antirreumático com propriedades antiproliferativas. A leflunomida demonstrou melhorar os sinais4 e sintomas5 e reduzir o progresso da destruição das articulações6 na artrite reumatoide3 ativa. Nos estudos realizados, a maioria dos pacientes estava utilizando concomitantemente AINEs ou baixas doses de corticosteroides.
Farmacologia29 animal: Em modelos animais, a leflunomida demonstrou ser efetiva em artrites, outras doenças autoimunes30 e transplantes. A leflunomida possui características imunomoduladoras/ imunossupressoras, age como agente antiproliferativo e apresenta propriedades anti-inflamatórias.
“In vivo”, a leflunomida é rapidamente e quase completamente metabolizada em seu metabólito20 ativo (A771726), que é ativo “in vitro” e se presume ser o responsável por toda a ação farmacológica do Arava.
Em modelos animais de doenças autoimunes30, a leflunomida apresentou os melhores efeitos protetores quando administrada logo na fase inicial da doença. Em modelos animais de rejeição a órgãos transplantados e doença crônica enxerto31 versus hospedeiro, a leflunomida prolongou o tempo de rejeição ou até mesmo reverteu reações de rejeição já instaladas. Além disso, a leflunomida demonstrou atividades anti-inflamatórias, ainda que com atividades analgésica e antipirética fracas ou ausentes. Em um modelo de septicemia32 experimental, a leflunomida não alterou a resistência de camundongos à infecção33 por bactérias patogênicas.
Mecanismo de Ação: O A771726, metabólito20 ativo da leflunomida, reduz a progressão das células34-alvo atuando em diferentes fases do ciclo celular.
“In vitro”, após a estimulação da mitose, o metabólito20 ativo A771726 inibe a proliferação de células34 T e a síntese de DNA. O metabólito20 ativo inibe também a proliferação estimulada por mitose de células34 mononucleadas de sangue35 periférico humano e a proliferação de linhagens de células34 humanas e murinas de forma dose-dependente.
Esta atividade antiproliferativa é revertida pela adição de uridina na cultura celular, indicando que o A771726 age na biosíntese de pirimidina. Estudos de ligação utilizando substâncias radiomarcadas, demonstraram que o metabólito20 ativo se liga e inibe a enzima36 humana di-hidroorotato desidrogenase (DHODH).
Em conjunto, estes dados sugerem que “in vivo”, as concentrações plasmáticas alcançáveis em pacientes recebendo a leflunomida podem inibir a síntese "de novo" de pirimidina em linfócitos e outras células34 com alta velocidade de divisão.
Além disso, foi relatado que o A771726 é capaz de inibir a enzima36 tirosina37 quinase, “in vitro” e “in vivo”. A atividade “in vitro” não parece ser mediada diretamente através de inibição enzimática, ocorrendo somente em concentrações bem mais altas do que as necessárias para a inibição da di-hidroorotato desidrogenase.
Propriedades Farmacocinéticas
A leflunomida é rapidamente convertida no seu metabólito20 ativo (A771726), através de metabolismo38 de primeira passagem na parede intestinal e fígado39. Não foi detectada leflunomida inalterada no plasma40, urina41 ou fezes em um estudo realizado com leflunomida radiomarcada com C14, em três voluntários saudáveis. Em outros estudos, as concentrações de leflunomida inalterada detectadas no plasma40 foram raramente detectadas, na ordem de ng/mL. O único metabólito20 plasmático radiomarcado detectado foi o A771726. Este metabólito20 é responsável por praticamente toda a atividade “in vivo” de Arava.
Absorção: Os dados de excreção gerados através de estudos com C14 indicaram que pelo menos cerca de 82 a 95% da dose é absorvida. O tempo para atingir o pico de concentração plasmática do A771726 é muito variável. Os picos plasmáticos podem ocorrer entre 1 e 24 horas após administração única.
A leflunomida pode ser administrada com alimentos, uma vez que a extensão da absorção é comparável tanto nos estados de jejum ou pós-alimentação.
Devido à longa meia-vida do metabólito20 ativo (aproximadamente 2 semanas), uma dose de ataque de 100 mg, durante 3 dias, foi utilizada nos estudos clínicos para facilitar a rápida obtenção do estado de equilíbrio do A771726. Estima-se que, sem o recurso da dose de ataque, seriam necessários aproximadamente 2 meses de administração de Arava para atingir o estado de equilíbrio. Em estudos que utilizaram doses múltiplas de leflunomida em pacientes com artrite reumatoide3, os parâmetros farmacocinéticos do A771726 permaneceram lineares dentro da faixa de variação de dose de 5 a 25 mg. Nestes estudos, o efeito clínico foi estreitamente relacionado à concentração plasmática do A771726 e às doses diárias de leflunomida. Na dose de 20 mg/dia, a concentração plasmática média do A771726 no estado de equilíbrio é de aproximadamente 35 μg/mL. Os níveis plasmáticos no estado de equilíbrio acumulam aproximadamente 33 a 35 vezes mais metabólito20 ativo quando comparado à administração de dose única.
Distribuição: Em humanos, o A771726 é extensivamente ligado às proteínas42 plasmáticas, principalmente à albumina43. A fração não ligada corresponde a aproximadamente 0,62%.
A ligação do A771726 varia linearmente conforme a concentração terapêutica44, apresentando-se levemente reduzida e mais instável no plasma40 de pacientes com artrite reumatoide3 ou insuficiência renal45 crônica.
A ampla ligação do A771726 às proteínas42 plasmáticas pode levar ao deslocamento de outros medicamentos altamente ligados a estas proteínas42. Entretanto, estudos "in vitro" de interação de ligação às proteínas42 plasmáticas com varfarina em concentrações clinicamente relevantes, não demonstraram nenhuma interação entre a varfarina e o A771726. Estudos similares demonstraram que o ibuprofeno e o diclofenaco não foram capazes de deslocar o A771726 das proteínas42 plasmáticas, enquanto que a fração não ligada do metabólito20 ativo aumentou cerca de 2 a 3 vezes na presença de tolbutamida. O A771726 foi capaz de deslocar tanto o ibuprofeno quanto o diclofenaco e a tolbutamida, porém a fração não ligada destes fármacos aumentou apenas de 10 a 50%. Não existem indicações da relevância clínica destes efeitos. O A771726 tem um volume aparente de distribuição baixo (aproximadamente 11L), o que é consistente com sua extensiva ligação às proteínas42 plasmáticas. Não existe absorção diferenciada pelos eritrócitos46.
Metabolismo38: A leflunomida é metabolizada ao metabólito20 ativo primário (A771726) e vários outros metabólitos47 secundários, incluindo TFMA (4-trifluormetilanilina). A biotransformação metabólica da leflunomida em A771726 e o metabolismo38 subsequente do A771726 não são controlados por uma única enzima36 e demonstraram ocorrer em frações celulares microssomais e citossólicas. Estudos de interações utilizando cimetidina (inibidor inespecífico do citocromo P450) e rifampicina (indutor inespecífico do citocromo P450) demonstraram que “in vivo”, estes sistemas enzimáticos estão envolvidos na metabolização da leflunomida somente numa pequena extensão.
Eliminação: A eliminação do metabólito20 ativo é lenta e caracterizada por um “clearance” aparente de cerca de 31 mL/h. A meia-vida de eliminação nos pacientes é de aproximadamente 2 semanas. Após a administração de uma dose radiomarcada de leflunomida, radioatividade foi excretada igualmente nas fezes, provavelmente devido à eliminação biliar, e na urina41. O A771726 continuou sendo detectado na urina41 e nas fezes até 36 dias após administração única. Os principais metabólitos47 urinários foram glucoronídeos derivados da leflunomida (principalmente nas amostras coletadas no período de 0 a 24 horas) e um derivado do ácido oxanílico do metabólito20 ativo. O principal componente fecal foi o A771726.
Foi demonstrado no homem que a administração de uma suspensão oral de carvão ativado ou colestiramina leva a um aumento rápido e significativo da taxa de eliminação do A771726 e consequentemente redução das suas concentrações plasmáticas.
Este fato parece ser explicado pelo mecanismo de diálise48 gastrintestinal e/ou pela interrupção da reciclagem êntero-hepática49.
Parâmetros farmacocinéticos na insuficiência renal45: A leflunomida foi administrada em dose única oral de 100 mg a três pacientes em hemodiálise50 e três pacientes em diálise peritoneal51 contínua.
A farmacocinética do A771726 em pacientes em CAPD (diálise peritoneal51 contínua) pareceu ser similar à encontrada em voluntários saudáveis. Uma eliminação mais rápida do A771726 foi observada em pacientes sob hemodiálise50, a qual não foi em decorrência da extração do fármaco19 no dialisado, mas sim devido ao deslocamento da ligação à proteína. Análise cinética52 da população total desses 6 pacientes demonstrou que, embora o “clearance” do A771726 esteja aumentado em aproximadamente 2 vezes, a meia-vida terminal de eliminação é similar àquela encontrada em indivíduos saudáveis, visto que o volume de distribuição também está aumentado.
Parâmetros farmacocinéticos na insuficiência hepática53: Não existem dados disponíveis sobre o tratamento de pacientes com insuficiência hepática53. O metabólito20 ativo A771726 é extensivamente ligado às proteínas42 plasmáticas e eliminado através de metabolismo38 hepático e secreção biliar. Estes processos podem ser afetados por alteração hepática49.
Influência da idade: A farmacocinética em crianças e adolescentes não foi estudada. Até o momento, os dados farmacocinéticos em idosos (>65 anos) são limitados, mas consistentes com a farmacocinética em pacientes adultos jovens.
Fumantes: A análise farmacocinética de uma população durante os estudos de Fase III, indicou que os fumantes tiveram 38% de aumento nos valores do “clearance” em relação aos não-fumantes; entretanto, nenhuma diferença na eficácia clínica foi observada entre os fumantes e não-fumantes.
CONTRAINDICAÇÕES
Arava é contraindicado em pacientes que apresentam hipersensibilidade à leflunomida, teriflunomida ou a qualquer um dos componentes da fórmula.
Arava é contraindicado também para mulheres grávidas ou que possam vir a engravidar e não estejam utilizando métodos contraceptivos eficazes durante o tratamento com leflunomida ou que após o tratamento estejam com níveis plasmáticos do metabólito20 ativo (A771726) acima de 0,02 mg/L. A possibilidade de gravidez18 deve ser excluída antes de se iniciar o tratamento.
Categoria de risco na gravidez18: X – Estudos revelaram anormalidades no feto21 ou evidências de risco para o feto21. Os riscos durante a gravidez18 são superiores aos potenciais benefícios. Não usar em hipótese alguma durante a gravidez18.
Este medicamento não deve ser utilizado por mulheres grávidas ou que possam ficar grávidas durante o tratamento.
ADVERTÊNCIAS E PRECAUÇÕES
Geral
Devido à meia-vida prolongada do metabólito20 ativo da leflunomida A771726, reações adversas podem ocorrer ou persistir mesmo após a interrupção do tratamento com leflunomida (vide “Reações Adversas”).
Caso ocorra uma reação adversa severa com leflunomida, ou se por qualquer outra razão for necessário eliminar rapidamente o A771726 do organismo, deve-se iniciar a administração de colestiramina ou carvão ativado, e se clinicamente necessário, continuar ou repetir a administração. Em caso de suspeita de reação imunológica e/ou alérgica severa, pode ser necessário prolongar a administração de colestiramina ou carvão ativado para se obter a eliminação rápida e suficiente do A771726 (vide “Superdose”).
A coadministração de teriflunomida com leflunomida não é recomendada, uma vez que a leflunomida é o composto de origem da teriflunomida.
Sistema Hepático
A leflunomida deve ser utilizada com cautela em pacientes com função hepática49 prejudicada devido ao possível risco de hepatotoxicidade54, visto que o metabólito20 ativo da leflunomida, A771726, apresenta alta taxa de ligação às proteínas42 plasmáticas e é eliminado do organismo através de metabolismo38 hepático e secreção biliar. O uso de leflunomida é desaconselhado em pacientes com insuficiência hepática53 significativa ou com doença hepática49 preexistente.
Deve-se monitorar o nível de TGP antes do início do tratamento e no mínimo em intervalos mensais durante os seis primeiros meses de tratamento, e posteriormente, em intervalos de 6–8 semanas.
As diretrizes para ajuste posológico ou interrupção do tratamento com base na severidade e persistência da elevação de TGP estão descritas abaixo:
Para elevações confirmadas dos níveis de TGP entre 2 a 3 vezes o limite superior da normalidade (LSN), uma redução na dose de Arava de 20 mg para 10 mg/dia pode possibilitar a continuação da administração de leflunomida, desde que sob cuidadoso monitoramento.
Se as elevações dos níveis de TGP entre 2–3 vezes o LSN persistirem ou caso se confirmem elevações de TGP acima de 3 vezes o LSN, deve-se interromper o tratamento com a leflunomida. Deve ser administrada colestiramina ou carvão ativado para reduzir mais rapidamente os níveis de A771726.
Durante o tratamento com leflunomida foram relatados raros casos de dano hepático grave, com consequência fatal em casos isolados. A maioria dos casos ocorreu durante os seis primeiros meses de tratamento. Embora não tenha sido estabelecida uma relação causal com a leflunomida e múltiplos fatores geradores de dúvida estivessem presentes na maioria dos casos, considera-se essencial que as recomendações de monitoramento sejam rigorosamente seguidas.
Sistema Imunológico55 e Hematopoiético
Em pacientes com anemia56 preexistente, leucopenia57 e/ou trombocitopenia58, bem como em pacientes com alteração da função da medula óssea59 ou naqueles que apresentam risco de supressão da medula óssea59, o risco da ocorrência de reações hematológicas é aumentado (vide “Interações Medicamentosas”).
Antes do início do tratamento com leflunomida deve-se realizar hemograma completo, incluindo a contagem diferencial de leucócitos60 e plaquetas61, bem como, mensalmente nos primeiros seis meses de tratamento e posteriormente a cada 6–8 semanas.
Os pacientes descritos abaixo devem ser submetidos ao monitoramento hematológico frequente (hemograma completo, incluindo leucograma e contagem de plaquetas61):
- pacientes que receberam ou estejam recebendo tratamento com medicamentos imunossupressores ou hematotóxicos, e quando o tratamento com leflunomida for seguido por tais substâncias sem que se observe o período adequado de eliminação do mesmo;
- pacientes com histórico de alterações hematológicas importantes;
- pacientes com alterações hematológicas importantes no início do tratamento, sem relação causal com a doença artrítica.
Ver o item “Superdose” para ações a serem seguidas em caso de reações hematológicas severas.
Devido ao potencial imunossupressor62, embora não exista experiência clínica, o uso de leflunomida é desaconselhado para pacientes9 com:
- imunodeficiência63 severa (por exemplo: AIDS);
- alteração significativa da função da medula óssea59;
- infecções64 graves.
Infecções64
Medicamentos como leflunomida que apresentam potencial imunossupressor62 podem aumentar a susceptibilidade65 dos pacientes às infecções64, incluindo infecções64 oportunistas (vide “Reações Adversas”). Infecções64 podem ser mais severas que o normal e requerem, portanto, tratamento precoce e rigoroso. Caso ocorra uma infecção33 grave, pode ser necessário interromper o tratamento com leflunomida e utilizar procedimentos de eliminação do fármaco19 (vide “Superdose”).
Medicamentos imunossupressores podem ativar focos primários de tuberculose66. Os médicos que acompanham pacientes sob imunossupressão67 devem estar alertas quanto à possibilidade de surgimento de doença ativa, tomando, assim, todos os cuidados para diagnóstico23 precoce e tratamento.
Antes de iniciar o tratamento, todos os pacientes devem ser avaliados para diagnóstico23 de tuberculose66 (ativos e inativos - “latente”), de acordo com as recomendações locais. Pacientes com história de tuberculose66 devem ser cuidadosamente monitorados devido à possibilidade de reativação da infecção33.
Sistema respiratório68
Foi raramente relatada doença intersticial69 pulmonar durante tratamento com leflunomida (vide “Reações Adversas”). O risco desta ocorrência é aumentado em pacientes com histórico de doença intersticial69 pulmonar. A doença intersticial69 pulmonar é um distúrbio potencialmente fatal, que pode ocorrer de forma aguda durante a terapia. Sintomas5 pulmonares, como tosse e dispneia70, podem ser motivos para a interrupção do tratamento e para investigações adicionais, se necessário.
Neuropatia Periférica71
Foram relatados casos de neuropatia periférica71 em pacientes submetidos a tratamento com leflunomida. A maioria dos pacientes apresentou melhora após a descontinuação do tratamento com leflunomida, porém alguns deles apresentaram sintomas5 persistentes. Idade superior a 60 anos, medicações neurotóxicas concomitantes e diabetes72 podem aumentar o risco de neuropatia periférica71. Se o paciente em tratamento com leflunomida desenvolver neuropatia periférica71, deve ser considerada a descontinuação do tratamento com leflunomida e realizado os procedimentos de eliminação do fármaco19 (vide “Superdose”).
Insuficiência Renal45
Até o momento não há dados suficientes para se recomendar ajuste posológico em pacientes com insuficiência renal45. Recomenda-se cautela na administração de leflunomida neste grupo de pacientes. Deve-se levar em consideração a alta taxa de ligação do metabólito20 ativo (A771726) às proteínas42 plasmáticas.
Reações cutâneas73
Casos de síndrome de Stevens-Johnson74, necrólise epidérmica tóxica75 e reação ao medicamento com eosinofilia76 e sintomas5 sistêmicos77 (DRESS) foram relatados em pacientes tratados com leflunomida (vide “Reações Adversas”). Se um paciente que está usando leflunomida desenvolve qualquer uma destas condições cutâneas73, a terapia deve ser interrompida e os procedimentos de eliminação do medicamento devem ser iniciados imediatamente (vide “Superdose”).
Pressão Sanguínea
A pressão sanguínea deve ser verificada antes do início e periodicamente durante o tratamento com leflunomida.
Abuso e dependência
Não é conhecido o potencial de leflunomida para abuso ou causar dependência.
Gravidez18 e Lactação78
Uso em Mulheres com Possibilidade de Engravidar
Não foram realizados estudos clínicos para avaliar os riscos do uso de leflunomida em mulheres grávidas. Entretanto, o metabólito20 ativo da leflunomida, A771726, mostrou ser teratogênico79 em ratas e coelhas e pode causar dano fetal em humanos.
O uso de leflunomida é contraindicado em mulheres grávidas ou mulheres com possibilidade de engravidar que não estejam utilizando métodos contraceptivos adequados (vide “Interações Medicamentosas”) durante o tratamento, e enquanto os níveis plasmáticos do metabólito20 ativo A771726, forem superiores a 0,02 mg/L. Deve-se excluir a possibilidade de gravidez18 antes do início do tratamento com leflunomida.
A paciente deve ser informada que caso haja qualquer suspeita de gravidez18, como por exemplo, atraso na menstruação80, o médico deve ser notificado imediatamente para que seja realizado um teste de gravidez18. Em caso de resultado positivo, o médico e a paciente devem discutir juntos os riscos da gravidez18. A rápida diminuição da concentração sanguínea do A771726, através do procedimento de eliminação do fármaco19, descrito abaixo, pode reduzir os riscos para o feto21 com relação à leflunomida, se o procedimento for realizado logo após a constatação do atraso menstrual.
Para as mulheres recebendo tratamento com leflunomida e que queiram engravidar, recomenda-se a adoção de um dos procedimentos de eliminação do fármaco19, descritos abaixo:
- Após a suspensão do tratamento com leflunomida, administrar 8 g de colestiramina, 3 vezes ao dia, durante 11 dias; ou
- Após a suspensão do tratamento, administrar 50 g de carvão ativado, 4 vezes ao dia, durante 11 dias.
Não se faz necessária a realização deste procedimento em 11 dias consecutivos, a não ser em caso de necessidade de redução rápida da concentração plasmática do A771726.
Em ambos os casos, a concentração plasmática do A771726 deve ser inferior a 0,02 mg/L (0,02 μg/mL) e deve ser confirmada através de 2 testes isolados com um intervalo mínimo de 14 dias.
Com base nos dados disponíveis, concentrações de metabólito20 ativo inferiores a 0,02 mg/L podem ser consideradas de risco mínimo.
Sem a utilização do procedimento de eliminação do fármaco19, podem ser necessários até 2 anos para que se alcance valores de concentrações plasmáticas de A771726 inferiores a 0,02 mg/L devido às variações individuais nas taxas de depuração do fármaco19. Contudo, mesmo após este período, é necessário verificar se os níveis de A771726 são inferiores a 0,02 mg/L através de dois testes isolados com intervalo mínimo de 14 dias.
Caso não seja possível aguardar um período de 2 anos após o término do tratamento, sob o uso de contracepção81 confiável, os procedimentos de eliminação do fármaco19 devem ser adotados, como medida profilática.
A eficácia dos contraceptivos orais não pode ser garantida durante os procedimentos de eliminação do fármaco19 com colestiramina ou carvão ativado. Recomenda-se o uso de métodos contraceptivos alternativos.
O risco de má formação fetal e outros resultados adversos na gravidez18 que ocorre em mulheres que engravidaram de forma não intencional durante o tratamento com leflunomida por qualquer período de tempo, no primeiro trimestre da gravidez18 estão descritos no item “Propriedades Farmacodinâmicas”.
Lactação78: estudos com animais indicam que a leflunomida e seus metabólitos47 são excretados no leite materno, não sendo conhecido, entretanto, se a sua excreção ocorre ou não em humanos. Não é recomendado, portanto, que lactantes82 amamentem seus filhos durante o tratamento com leflunomida. A decisão de se iniciar o tratamento ou de se amamentar deve ser baseada na importância do medicamento para a mãe.
Populações especiais
Uso em Homens: As informações disponíveis não indicam associação entre a leflunomida e o aumento do risco de toxicidade83 fetal mediada pelo pai. Entretanto, não foram realizados até o momento, estudos em animais para avaliar especificamente este risco. Para minimizar eventuais riscos, homens que desejam ter filhos devem considerar a interrupção do tratamento e a utilização do procedimento de eliminação da leflunomida (vide “Gravidez e Lactação”).
Idosos: Não é necessário ajuste de dose em pacientes com mais de 65 anos de idade.
Crianças e Adolescentes: A segurança e eficácia de Arava na população pediátrica não foram estabelecidas; portanto o seu uso em pacientes menores de 18 anos de idade não é recomendado.
Efeitos na habilidade de dirigir e operar máquinas
Não há informações relevantes sobre os efeitos de Arava na capacidade de dirigir ou operar máquinas.
Dados de segurança pré-clínica
Toxicidade83 aguda: Foram estudados dados sobre a toxicidade83 aguda da leflunomida, administrada via oral e intraperitoneal em ratos e camundongos. O valor da DL50 para administração oral variou de 200 a 500 mg/Kg em camundongos e de 100 a 250 mg/Kg em ratos. Após a administração intraperitonial, o valor da DL50 foi de aproximadamente 400 mg/Kg em camundongos e entre 200 e 400 mg/kg em ratos.
Toxicidade83 crônica: A administração oral repetida de leflunomida em doses de 0,5 e 0,8 mg/Kg/dia em ratos e cães, respectivamente, por um período de até 6 meses, revelou ausência de efeito.
Doses maiores, entretanto, causaram alterações patológicas em ratos, tais como: hipoplasia84 da medula óssea59, redução da trombocitopoiese esplênica85, atrofia86 do timo87, hemorragias88 no sistema gastrintestinal e outros tecidos e óbito89.
Em doses iguais ou superiores a 1 mg/Kg/dia, foram constatadas anemia56 e eritropoiese90 esplênica85 extramedular. Em cães, foram observados os parâmetros de eritrócitos46 reduzidos e presença de corpos de Heinz91 e/ou corpos de Howell-Jolly, hematopoiese extramedular e hemossiderose92. Ocorreram óbitos entre os cães que receberam 8 mg/Kg/dia.
Devido à sua atividade farmacodinâmica, a leflunomida inibe a proliferação e diferenciação celular. De acordo com este fato, foram encontrados efeitos sobre os órgãos reprodutivos de camundongos durante estudos de administração repetida utilizando-se altas doses de leflunomida (com 30 mg/Kg de peso corpóreo, os camundongos apresentaram degeneração93 e atrofia86 de testículos94, próstata95 e vesícula seminal96; com 100 mg/Kg de peso corpóreo, ocorreram atrofias97 de útero98 e ovário99). Em um estudo, com duração de 3 meses em cães foi observada redução da próstata95 e da massa testicular no grupo recebendo altas doses (8 mg/kg de peso corpóreo).
Mutagenicidade
A leflunomida não foi mutagênica no teste de Ames, teste de síntese de DNA indeterminada, ou no teste de mutação100 do gene HGPRT. Além disso, a leflunomida não foi clastogênica no teste do micronúcleo de camundongos "in vivo" e teste de citogenicidade em células da medula óssea101 de hamster chinês.
Entretanto, o 4-trifluormetilanilina (TFMA), um metabólito20 secundário da leflunomida, apresentou resultado positivo de mutagenicidade no teste de Ames, no teste de mutação100 do gene HGPRT e foi clastogênica no teste "in vitro" de aberrações cromossômicas de células34 de hamster chinês. O TFMA não demonstrou ser clastogênico nos testes citogenéticos "in vivo" com células da medula óssea101 de hamster chinês ou com micronúcleos de camundongos.
Carcinogenicidade
Não foi observada nenhuma evidência de que a leflunomida possua características carcinogênicas em um bioestudo com duração de 2 anos realizado em ratos, utilizando-se a dose máxima tolerada de 6 mg/Kg (aproximadamente 1/40 da exposição sistêmica máxima baseada na AUC102). Entretanto, camundongos machos exibiram aumento da incidência27 de linfomas durante um bioestudo com 2 anos de duração, com administração oral de doses de 15 mg/Kg (a mais alta dose estudada: 1,7 da exposição sistêmica máxima baseada na AUC102). Durante o mesmo estudo, foi observado aumento dose-relacionado da incidência27 de adenoma103 bronco-alveolar e carcinomas a partir de doses de 1,5 mg/Kg (aproximadamente 1/10 da exposição sistêmica máxima baseada na AUC102) em camundongos fêmeas. O significado destas observações em camundongos, relacionado ao uso clínico da leflunomida, ainda não é conhecido.
Antigenicidade
A leflunomida não mostrou ser antigênica no teste de anafilaxia104 sistêmica ativa e cutânea105 passiva em cobaias e demonstrou ausência de propriedades sensibilizantes.
Teratogenicidade
O metabólito20 ativo da leflunomida é teratogênico79 em ratas e coelhas. A leflunomida, quando administrada por via oral em ratas durante a organogênese, em doses de 15 mg/Kg, foi teratogênica106 (mais notavelmente anoftalmia ou microftalmia e hidrocefalia107).
A exposição sistêmica das ratas nesta dose foi aproximadamente 1/10 da exposição sistêmica máxima humana, baseada na AUC102. Sob estas condições de exposição, a leflunomida também causou diminuição do peso corpóreo materno e aumento do número de óbitos fetais, diminuindo o peso corpóreo dos fetos sobreviventes.
Em coelhas, o tratamento oral com 10 mg/Kg de leflunomida durante a organogênese resultou em esternebras fundidas e displásicas. O nível de exposição nesta dose foi praticamente equivalente ao nível máximo de exposição humana, baseado na AUC102. Na dose de 1 mg/Kg, a leflunomida não foi teratogênica106 em ratas e coelhas.
Quando ratas foram tratadas com uma dose de 1,25 mg/Kg de leflunomida, iniciada 14 dias antes da reprodução108 e mantida até o final da lactação78, os filhotes apresentaram diminuição marcante (>90%) na taxa de sobrevida109 pós-natal. A exposição sistêmica com esta dose correspondeu a aproximadamente 1/100 do nível de exposição humana, baseada na AUC102.
INTERAÇÕES MEDICAMENTOSAS
Se o paciente já estiver utilizando anti-inflamatórios não-esteroidais (AINEs) e/ou corticosteroides de baixa dosagem, tais tratamentos podem ser mantidos após o início do tratamento com Arava.
Pode ocorrer aumento das reações adversas no caso de uso recente ou concomitante de Arava e substâncias hepatotóxicas (incluindo álcool), hematotóxicas ou imunossupressoras. Este fato também deve ser considerado quando o tratamento com leflunomida é seguido da administração de tais substâncias sem que se observe o período adequado de eliminação do mesmo (vide “Advertências e Precauções”).
Metotrexato: em um pequeno estudo (n = 30) em pacientes com artrite reumatoide3 com coadministração de leflunomida (10 a 20 mg por dia) com metotrexato (10 a 25 mg por semana), observou-se elevação de 2 a 3 vezes nas enzimas hepáticas28 em 5 dos 30 pacientes. Estas elevações normalizaram-se em dois pacientes mantendo-se a administração dos dois fármacos e em três pacientes com a interrupção da leflunomida. Observou-se elevação de mais de 3 vezes nas enzimas hepáticas28 em outros 5 pacientes. Estes pacientes também voltaram ao estado normal, dois dos quais com a continuação da administração dos dois fármacos e três dos quais após a interrupção da leflunomida. Portanto, embora não seja necessário um período de aguardo, é recomendado um monitoramento cuidadoso das enzimas hepáticas28 durante a fase inicial da substituição de leflunomida para metotrexato.
Vacinas: não existem dados clínicos disponíveis sobre a eficácia e segurança de vacinações durante o tratamento com leflunomida. Entretanto, a utilização de vacinas vivas atenuadas é desaconselhada.
A meia-vida prolongada da leflunomida deve ser considerada quando da administração de vacina110 viva atenuada após a interrupção da leflunomida.
Varfarina: foram relatados casos de aumento do tempo de protrombina111, quando leflunomida e varfarina foram coadministradas. A interação farmacodinâmica com varfarina foi observada com A771726 em um estudo de farmacologia29 clínica (vide abaixo). Portanto, quando a varfarina é coadministrada, é recomendado um acompanhamento cuidadoso e monitoramento da RNI (Razão Normalizada Internacional).
Alimento
A absorção da leflunomida pelo sistema gastrintestinal não é afetada quando administrada com alimentos
Efeito de outros medicamentos sobre a leflunomida
Estudos de inibição “in vitro” em microssomas hepáticos humanos sugerem que o citocromo P450 (CYP) 1A2, 2C19 e 3A4 estão envolvidos no metabolismo38 da leflunomida. Um estudo de interação “in vivo” com leflunomida e cimetidina (inibidor fraco inespecífico do citocromo P450 (CYP)) não demonstrou interação significativa sobre a exposição do A771726.
A administração concomitante de uma dose única de leflunomida em indivíduos recebendo doses múltiplas de rifampicina (indutor inespecífico do citocromo P450) aumentou os níveis máximos de A771726 em aproximadamente 40%, enquanto que a AUC102 (área sob a curva) não foi significativamente alterada. O mecanismo deste efeito não é claro. Deve-se considerar o potencial de aumento dos níveis de leflunomida com doses múltiplas em pacientes recebendo concomitantemente leflunomida e rifampicina.
A administração de colestiramina ou carvão ativado provoca a diminuição rápida e significativa da concentração plasmática de A771726. O mecanismo parece ser a interrupção do ciclo êntero-hepático e/ou a diálise48 gastrintestinal do A771726 (vide “Gravidez e Lactação” e “Superdose”).
Efeito da leflunomida sobre outros medicamentos
Substratos BCRP (proteína resistente ao câncer112 de mama113): apesar de uma interação farmacocinética com um substrato BCRP (rosuvastatina) ter sido observada com o A771726 (vide estudo abaixo), não foi demonstrada interação farmacocinética entre a leflunomida (10 a 20 mg por dia) e o metotrexato (um substrato BCRP; 10 a 25 mg por semana) em 12 pacientes.
Estudos de interação “in vivo” não demonstraram interações medicamentosas significativas entre leflunomida e contraceptivos orais trifásicos.
Em um estudo, no qual a leflunomida foi administrada juntamente a um contraceptivo oral trifásico contendo 30 μg de etinilestradiol a voluntárias saudáveis, não houve redução da atividade do contraceptivo e a farmacocinética do A771726 esteve dentro dos valores previstos. Uma interação farmacocinética com contraceptivos orais foi observada com A771726 (vide estudo abaixo).
Os seguintes estudos de interação farmacocinética e farmacodinâmica foram realizados com A771726 (principal metabólito20 ativo da leflunomida). Como interações medicamentosas semelhantes não podem ser excluídas para a leflunomida em doses recomendadas, os seguintes resultados do estudo e recomendações devem ser considerados em pacientes tratados com leflunomida:
Efeito sobre a repaglinida (substrato CYP2C8): houve um aumento nas médias de Cmax e AUC102 (1,7 e 2,4 vezes, respectivamente) da repaglinida, após administração de doses repetidas de A771726, sugerindo que o A771726 é um inibidor de CYP2C8 “in vivo”. Portanto, uma vez que pode ter maior exposição, é recomendado o monitoramento de pacientes com o uso concomitante de medicamentos metabolizados pelo CYP2C8, como a repaglinida, paclitaxel, pioglitazona ou rosiglitazona.
Efeito sobre a cafeína (substrato CYP1A2): doses repetidas de A771726 diminuíram as médias de Cmax e AUC102 da cafeína (substrato CYP1A2) em 18% e 55%, respectivamente, sugerindo que o A771726 pode ser um indutor fraco do CYP1A2 “in vivo”. Portanto, medicamentos metabolizados pelo CYP1A2 (como a duloxetina, alosetrona, teofilina e tizanidina) devem ser usados com precaução durante o tratamento concomitante, uma vez que pode levar à redução da eficácia destes produtos.
Efeito sobre os substratos do transportador de ânion orgânico 3 (OAT3): houve um aumento nas médias de Cmax e AUC102 (1,43 e 1,54 vezes, respectivamente) do cefaclor, doses repetidas seguidas de A771726 sugerem que o A771726 é um inibidor do OAT3 “in vivo”. Portanto, recomenda-se cautela quando coadministrada com substratos de OAT3, tais como cefaclor, benzilpenicilina, ciprofloxacino, indometacina, cetoprofeno, furosemida, cimetidina, metotrexato, zidovudina.
Efeito sobre os substratos do BCRP e/ou do polipeptídeo transportador de ânion orgânico B1 e B3 (OATP1B1/B3): houve um aumento nas médias de Cmax e AUC102 (2.65 e 2,51 vezes, respectivamente) da rosuvastatina, após doses repetidas de A771726. No entanto, não houve impacto aparente deste aumento na exposição da rosuvastatina no plasma40 na atividade da HMG-CoA redutase. Se utilizados em conjunto, a dose de rosuvastatina não deve exceder 10 mg uma vez por dia. Para outros substratos da BCRP (por exemplo, metotrexato, topotecana, sulfassalazina, daunorrubicina, doxorrubicina) e da família da OATP especialmente os inibidores da HMG-CoA redutase (por exemplo, sinvastatina, atorvastatina, pravastatina, metotrexato, nateglinida, repaglinida, rifampicina) a administração concomitante também deve ser feita com cautela. Os pacientes devem ser cuidadosamente monitorados quanto aos sinais4 e sintomas5 de exposição excessiva aos medicamentos e deve ser considerada a redução da dose destes medicamentos.
Efeito sobre o contraceptivo oral (0,03 mg de etinilestradiol e 0,15 mg de levonorgestrel): houve um aumento nas médias de Cmax e AUC0-24 (1,58 e 1,54 vezes, respectivamente) do etinilestradiol e Cmax e AUC0-24 (1,33 e 1,41 vezes, respectivamente) do levonorgestrel após doses repetidas de A771726. Embora não se espere que afete negativamente a eficácia dos contraceptivos orais, deve-se considerar o tipo de tratamento contraceptivo oral.
Efeito sobre a varfarina: doses repetidas de A771726 não tiveram efeito sobre a farmacocinética da S-varfarina, indicando que o A771726 não é um inibidor ou indutor de CYP2C9. No entanto, uma redução de 25 % no pico da razão normalizada internacional (RNI) foi observada quando A771726 foi coadministrado com a varfarina, em comparação com a varfarina isoladamente. Portanto, quando a varfarina é coadministrada, é recomendado um acompanhamento cuidadoso e monitoramento da RNI.
A administração de leflunomida concomitante a antimaláricos114 comumente utilizados no tratamento de doenças reumáticas (por exemplo: cloroquina e hidroxicloroquina), ouro intramuscular ou oral, D-penicilamina, azatioprina e outros medicamentos imunossupressores (por exemplo: ciclosporina, metotrexato), não foi adequadamente estudada.
CUIDADOS DE ARMAZENAMENTO DO MEDICAMENTO
Cuidados de conservação
Arava deve ser mantido em temperatura ambiente (entre 15 e 30°C), na sua embalagem original seguramente fechada.
Prazo de validade: Arava 20 mg: 18 meses a partir da data de fabricação. Arava 100 mg: 36 meses a partir da data de fabricação.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Características físicas e organolépticas do produto
Arava 20 mg: Comprimidos revestidos, triangulares esféricos, de coloração amarelada a ocre. Arava 100 mg: Comprimidos revestidos, biconvexos, redondos, brancos a quase brancos.
Antes de usar, observe o aspecto do medicamento.
TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS.
POSOLOGIA E MODO DE USAR
Tomar os comprimidos inteiros com líquido, por via oral.
O tratamento com Arava deve ser iniciado e acompanhado por médicos com experiência no tratamento de artrite reumatoide3.
Para consultar as recomendações sobre monitoramento, verificar item Advertências e Precauções.
O tratamento com Arava para artrite reumatoide3 é geralmente iniciado com uma dose de ataque de 100 mg uma vez ao dia, durante 3 dias. A omissão da dose de ataque pode reduzir o risco de reações adversas. Para informações adicionais a respeito do uso da dose de ataque em pacientes com artrite reumatoide3. (vide item Resultados de Eficácia). A dose de manutenção recomendada é de 20 mg de Arava uma vez ao dia.
Se a dose de 20 mg não for clinicamente tolerada, a dose pode ser reduzida a critério médico.
O tratamento com Arava para artrite7 psoriática é iniciado também com uma dose de ataque de 100 mg uma vez ao dia, durante 3 dias. A dose de manutenção é de 20 mg de Arava uma vez ao dia.
O resultado do tratamento pode ser evidenciado após 4 semanas e pode melhorar de 4 a 6 meses após o seu início. O tratamento com Arava é geralmente de longa duração.
Não há estudos dos efeitos de Arava administrado por vias não recomendadas. Portanto, por segurança e para garantir a eficácia deste medicamento, a administração deve ser somente por via oral.
Populações especiais
Crianças e Adolescentes: Arava não é recomendado para o uso em crianças e adolescentes com idade inferior a 18 anos, uma vez que a segurança e eficácia nestes grupos ainda não foram estabelecidas.
Idosos: não é necessário ajuste de dose em pacientes acima de 65 anos de idade.
Pacientes com Insuficiência renal45 e/ou hepática49: recomenda-se cautela na administração de leflunomida neste grupo de pacientes, vide “Advertências e Precauções”.
Este medicamento não deve ser partido ou mastigado.
REAÇÕES ADVERSAS
As reações podem ser classificadas em:
|
Categoria |
Frequência |
|
Muito comum |
≥ 10% |
|
Comum |
≥ 1% e < 10% |
|
Incomum |
≥ 0,1% e < 1% |
|
Raro |
≥ 0,01% e < 0,1% |
|
Muito raro |
< 0,01% |
|
Desconhecida |
Não pode ser estimada pelos dados disponíveis |
Sistemas Gastrintestinal e hepático:
- Comum: diarreia115, náusea116, vômitos117, anorexia118, distúrbios da mucosa119 oral (por exemplo: estomatite120 aftosa, ulcerações121 na boca122), dor abdominal, elevação dos parâmetros laboratoriais hepáticos (por exemplo: transaminases, menos frequentemente gama-GT, fosfatase alcalina123, bilirrubina124), colite125 incluindo colite125 microscópica;
- Rara: hepatite126, icterícia127/colestase128;
- Muito rara: dano hepático severo, como insuficiência hepática53 e necrose129 hepática49 aguda, que pode ser fatal; pancreatite130.
Sistema Cardiovascular131:
- Comum: elevação da pressão sanguínea.
- Desconhecida: hipertensão132 pulmonar.
Sistema Hematológico e Linfático133:
- Comum: leucopenia57 com contagem de leucócitos60 > 2 x 109/L (>2 g/L);
- Incomum: anemia56, trombocitopenia58 com contagem de plaquetas61 <100 x 109/L (<100 g/L);
- Rara: leucopenia57 com contagem de leucócitos60 < 2 x 109/L (<2 g/L), eosinofilia76 ou pancitopenia134.
O uso recente, concomitante ou consecutivo de agentes potencialmente mielotóxicos pode estar associado ao maior risco de efeitos hematológicos.
Sistema Nervoso135:
- Comum: cefaleia136, vertigem137 e parestesia138; Incomum: distúrbios do paladar139 e ansiedade;
- Muito rara: neuropatia periférica71.
Reações alérgicas, pele140 e anexos141:
- Comum: reações alérgicas leves (incluindo exantema142 maculopapular143 e outros), prurido144, eczema145, pele140 ressecada, aumento da perda de cabelo146;
- Incomum: urticária147;
- Muito rara: reações anafiláticas148/anafilactoides severas, síndrome de Stevens-Johnson74 (eritema multiforme149 grave) e necrólise epidérmica tóxica75.
Nos casos relatados não foi possível estabelecer uma relação causal com o tratamento com leflunomida, entretanto esta hipótese não pode ser excluída.
Vasculite150, incluindo vasculite150 cutânea105 necrotizante. Devido à doença subjacente, uma relação causal não pôde ser estabelecida.
Infecção33:
- Rara: infecções64 severas e sepsis, que podem ser fatais.
A maioria dos casos relatados foi confundida por tratamento imunossupressor62 concomitante e/ou doença comórbida, em adição à artrite reumatoide3, que pode predispor os pacientes à infecção33.
Medicamentos como leflunomida que apresentam potencial imunossupressor62 podem levar os pacientes a serem mais susceptíveis a infecções64, incluindo infecções64 oportunistas (vide “Advertências e Precauções”).
Em estudos clínicos, a incidência27 de rinite151 e bronquite (5% vs. 2%) e pneumonia152 (3% vs. 0%) foi levemente aumentada em pacientes tratados com leflunomida, comparativamente ao placebo8, enquanto que a incidência27 geral de infecções64 foi comparável entre os dois grupos.
Distúrbios do mediastino153, torácicos e respiratórios:
- Rara: doença intersticial69 pulmonar (incluindo pneumonite154 intersticial69), que pode ser fatal.
Distúrbios da pele e tecido subcutâneo155
- Desconhecida: lúpus156 eritematoso157 cutâneo158, psoríase14 pustulosa ou piora da psoríase14, reações ao medicamento com eosinofilia76 e sintomas5 sistêmicos77 (DRESS) (vide “Advertências e Precauções”).
Outras reações:
- Comum: perda de peso e astenia159;
- Incomum: hipopotassemia160.
Pode ocorrer hiperlipidemia161 leve. As concentrações de ácido úrico geralmente diminuem devido ao efeito uricosúrico.
Outras observações laboratoriais encontradas cuja relevância clínica não foi estabelecida, foram: pequenos aumentos das taxas de LDH e creatina quinase e pequenas reduções no fosfato.
Foram reportados alguns casos de tenossinovites e ruptura de tendão162 como efeitos adversos sob o tratamento com leflunomida; no entanto, não foi possível estabelecer uma relação causal entre o fármaco19 e os casos citados.
Pequena diminuição (reversível) na concentração de espermatozoide163, contagem total de espermatozoide163 e na motilidade progressiva rápida, não podem ser excluídas.
O risco de malignidade, particularmente distúrbios linfoproliferativos, também é conhecido por estar aumentado com o uso de alguns fármacos imunossupressores.
Em casos de eventos adversos, notifique pelo Sistema VigiMed, disponível no Portal da Anvisa.
SUPERDOSE
Sinais4 e Sintomas5
Foram relatados casos de superdosagem crônica em pacientes sob tratamento com Arava, com doses diárias 5 vezes superiores à dose diária recomendada e relatos de superdosagem aguda em adultos e crianças. Não houve eventos adversos relatados na maioria dos casos de superdosagem. Os eventos adversos foram consistentes com o perfil de segurança para Arava (vide “Reações Adversas”). Os eventos adversos mais frequentemente observados foram diarreia115, dor abdominal, leucopenia57, anemia56 e elevação nos testes de função hepática49.
Procedimento em caso de superdose
Caso ocorra superdosagem ou toxicidade83 relevante, recomenda-se a administração de colestiramina ou carvão ativado para acelerar a eliminação da leflunomida. A administração de colestiramina por via oral, na dose de 8 g, três vezes ao dia, durante 24 horas a três voluntários sadios, diminuiu os níveis plasmáticos do metabólito20 ativo (A771726) em aproximadamente 40% nas primeiras 24 horas e em 49% a 65% em 48 horas. A administração de carvão ativado (em suspensão) por via oral ou através de uma sonda nasogástrica164 (50 g a cada 6 horas durante 24 horas) demonstrou reduzir as concentrações plasmáticas do metabólito20 ativo em 37% após 24 horas e em 48% em 48 horas.
Estes procedimentos de eliminação podem ser repetidos caso seja clinicamente necessário.
Estudos, tanto com hemodiálise50 quanto com CAPD (diálise peritoneal51 contínua) indicaram que A771726, o metabólito20 primário de leflunomida, não é dialisável.
Em caso de intoxicação ligue para 0800 722 6001, se você precisar de mais orientações.
DIZERES LEGAIS
RISCO PARA GRAVIDEZ18. PODE CAUSAR MÁ FORMAÇÃO FETAL
VENDA SOB PRESCRIÇÃO MÉDICA
SÓ PODE SER VENDIDO COM RETENÇÃO DA RECEITA
MS 1.8326.0442
Farm. Resp.: Ricardo Jonsson CRF-SP: 40.796
Registrado e importado por:
Sanofi Medley Farmacêutica Ltda.
Rua Conde Domingos Papaiz, 413 - Suzano– SP
CNPJ 10.588.595/0010-92
Indústria Brasileira
Fabricado por:
Sanofi Winthrop Industrie 56, route de Choisy-au-Bac 60205 – Compiègne – França
SAC 0800 703 0014