Poemmy (Bula do profissional de saúde)
LIBBS FARMACÊUTICA LTDA
IDENTIFICAÇÃO DO MEDICAMENTO
Poemmy®
fulvestranto
Injetável 250 mg/5 mL
Medicamento similar equivalente ao medicamento de referência.
FORMA FARMACÊUTICA E APRESENTAÇÃO:
Solução injetável
Embalagem com 2 seringas preenchidas contendo 5 mL cada, acompanhadas de 2 agulhas descartáveis estéreis
VIA INTRAMUSCULAR
USO ADULTO
COMPOSIÇÃO:
Cada seringa1 preenchida contém:
| de fulvestranto | 250 mg |
| veículo q.s.p. | 5 mL |
Veículo: álcool etílico, álcool benzílico, benzoato de benzila e óleo de rícino.
INFORMAÇÕES TÉCNICAS AOS PROFISSIONAIS DE SAÚDE2
INDICAÇÕES
Monoterapia
Poemmy® é indicado para o tratamento de câncer3 de mama4 localmente avançado ou metastático em mulheres de qualquer idade e que estejam na pós-menopausa5 que:
- não foram previamente tratadas com terapia endócrina, com câncer3 receptor hormonal6 (RH) positivo e receptor do fator de crescimento epidérmico humano 2 (HER-2) negativo ou;
- previamente tratadas com terapia endócrina (terapia com antiestrógeno ou inibidor de aromatase), com câncer3 receptor hormonal6 (RH) positivo independente se o estado pós-menopausal ocorreu naturalmente ou foi induzido artificialmente.
Terapia em combinação com palbociclibe
Poemmy® é indicado em combinação com palbociclibe para o tratamento de mulheres portadoras de câncer3 de mama4 localmente avançado ou metastático positivo para o receptor hormonal6 (RH) e negativo para o receptor do fator de crescimento epidérmico humano 2 (HER-2) previamente tratadas com terapia endócrina.
RESULTADOS DE EFICÁCIA
Efeitos no tecido7 de câncer3 de mama4 in vivo
Estudos clínicos em mulheres na pós-menopausa5 com câncer3 de mama4 primário e com tumores com receptor de estrógeno8 (RE) positivo mostraram que o fulvestranto suprimiu significativamente a expressão dos RE, de modo dose dependente. Houve também diminuição significativa da expressão dos receptores de progesterona (RP – um marcador da ação estrogênica), consistente com os dados pré- clínicos, que demonstraram que fulvestranto não tem atividade estrogênica agonista9 intrínseca (Howell A et al. J Clin Oncol. 2002;20(16):3396-403, Wakeling AE et al Cancer3 Res 1991;(51):3867).
Estas alterações nas expressões de RE e RP foram acompanhadas de redução na expressão de Ki67, um marcador de proliferação da célula10 tumoral, que também foi relacionado à dose de fulvestranto 500 mg que teve efeito melhor que a dose de 250 mg (Osborne CK et al. J Clin Oncol. 2002;20(16):3386-95).
Efeitos no câncer3 de mama4 avançado
Um estudo clínico de fase III (Estudo D6997C00002 - CONFIRM) foi finalizado, com 736 mulheres na pós-menopausa5 com câncer3 de mama4 avançado que tiveram recorrência11 da doença ou após terapia endócrina adjuvante ou progrediu após terapia endócrina para doença avançada (Di Leo, A et al. Cancer3
Res 2009;69(24 Suppl):Abs 25). O estudo incluiu 423 pacientes, que apresentaram recorrência11 ou progressão da doença durante terapia antiestrogênio (subgrupo AE) e 313 pacientes com recorrência11 ou progressão durante terapia com inibidor de aromatase (subgrupo AI). Este ensaio comparou a eficácia e segurança de fulvestranto 500 mg (n=362) com fulvestranto 250 mg (n=374). A sobrevida12 livre de progressão (SLP) foi o desfecho primário. Os desfechos secundários de eficácia incluíram: taxa de resposta objetiva (ORR), taxa de benefício clínico (CBR) e sobrevida12 global (SG).
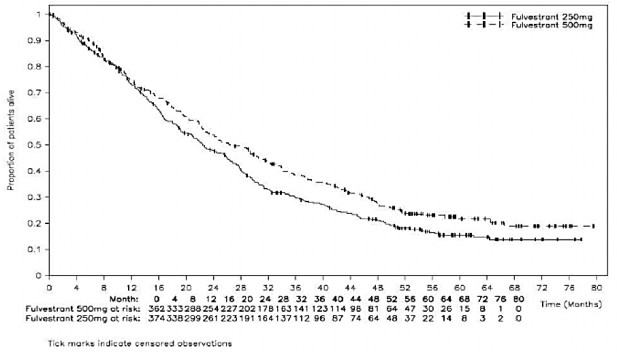
A sobrevida12 livre de progressão para fulvestranto 500 mg foi significativamente mais longa que para fulvestranto 250 mg (mediana de 6,5 meses para fulvestranto 500 mg e 5,5 meses para fulvestranto 250 mg; HR=0,80; IC 95%: 0,68 a 0,94; p=0,006).
A análise final da sobrevida12 global, com 75% de maturidade, demonstrou que fulvestranto 500 mg foi associado a um aumento de 4,1 meses na mediana de sobrevida12 global e a uma redução de 19% no risco de morte, em comparação à fulvestranto 250 mg (HR=0,81;IC 95%: 0,69 – 0,96; p=0,016 (valor nominal, uma vez que não foi feito ajuste para multiplicidade). Os resultados de eficácia são resumidos na Tabela 1.
Tabela 1. Resumo dos resultados de desfecho primário (SLP) e desfechos de eficácia secundários no estudo CONFIRM zzzz
|
Variável |
Tipo de avaliação; |
fulvestranto 500 mg |
fulvestranto 250 mg |
Comparação entre grupos (fulvestranto 500 mg/ fulvestranto 250 mg) |
||
|
Taxa de risco |
IC 95% |
Valor de p |
||||
|
SLP |
Mediana de K-M (meses); taxa de risco |
|
|
|
|
|
|
Todas pacientes |
6,5 |
5,5 |
0,80 |
0,68, 0,94 |
0,006 |
|
|
Subgrupo AE (n= 423) |
8,6 |
5,8 |
0,76 |
0,62, 0,94 |
0,013 |
|
|
Subgrupo AI (n=313)a |
5,4 |
4,1 |
0,85 |
0,67, 1,08 |
0,195 |
|
|
SG atualizadab |
Mediana de K-M (meses); taxa de risco |
|
|
|
||
|
Todas pacientes |
26,4 |
22,3 |
0,81 |
0,69, 0,96 |
0,016c |
|
|
Subgrupo AE (n= 423) |
30,6 |
23,9 |
0,79 |
0,63, 0,99 |
0,038c |
|
|
Subgrupo AI (n=313)a |
24,1 |
20,8 |
0,86 |
0,67, 1,11 |
0,241c |
|
|
Variável |
Tipo de avaliação; comparação do tratamento |
fulvestranto 500 mg |
fulvestranto 250 mg |
Comparação entre grupos (fulvestranto 500 mg/ fulvestranto 250 mg) |
||
|
Diferença absoluta (%) |
IC 95% |
|||||
|
ORRd |
% de pacientes com OR; diferença absoluta (%) |
|
|
|
||
|
Todas pacientes |
13,8 |
14,6 |
-0,8 |
-5,8, 6,3 |
||
|
Subgrupo AE (n= 296) |
18,1 |
19,1 |
-1,0 |
-8,2, 9,3 |
||
|
Subgrupo AI (n=205)a |
7,3 |
8,3 |
-1,0 |
-5,5, 9,8 |
||
|
CBRe |
% de pacientes com CB; diferença absoluta (%) |
|
|
|
||
|
Todas pacientes |
45,6 |
39,6 |
6,0 |
- 1,1, 13,3 |
||
|
Subgrupo AE (n= 423) |
52,4 |
45,1 |
7,3 |
- 2,2, 16,6 |
||
|
Subgrupo AI (n=313)a |
36,2 |
32,3 |
3,9 |
- 6,1, 15,2 |
||
a Poemmy® é indicado para pacientes13 com recorrência11 ou progressão da doença com terapia antiestrogênio. Os resultados no subgrupo AI são inconclusivos.
b SG (Sobrevida12 global) é apresentada para as análises atualizada e madura de sobrevida12 (75%)
c Valor nominal de p, sem ajustes para multiplicidade, entre as análises iniciais de SG a 50% de maturidade e as análises atualizadas de sobrevida12 a 75% de maturidade (acompanhamento mínimo de 50 meses)
d ORR (taxa de resposta objetiva) foi analisada em pacientes passíveis de avaliação de resposta na linha basal, isto é, aqueles com doença mensurável na linha basal: 240 pacientes no grupo de fulvestranto 500 mg e 261 pacientes no grupo de fulvestranto 250 mg.
e Pacientes com a melhor resposta objetiva da resposta completa, resposta parcial ou doença estável ≥ 24 semanas
SLP: Sobrevida12 livre de progressão (tempo entre a randomização e a primeira progressão ou morte por qualquer causa. Duração mínima de acompanhamento de 18 meses); OR: Resposta objetiva; CBR: taxa de benefício clínico; CB: benefício clínico; K-M: Kaplan-Meier; IC: Intervalo de Confiança; AI: inibidor de aromatase; AE: antiestrogênio
A Figura 1 representa um gráfico Kaplan-Meier dos dados atualizados de SG para o estudo CONFIRM.
FALCON (Estudo D699BC00001) foi um estudo de fase III randomizado14, duplo-cego, duplicado, multicêntrico, de fulvestranto 500 mg versus anastrozol 1 mg, conduzido em mulheres na pós- menopausa5, com câncer3 de mama4 metastático ou localmente avançado positivo para RE e/ou PR, que não foram previamente tratadas com nenhuma terapia hormonal (Robertson JFR et al. Lancet 2016;388(10063):2997-3005). Um total de 462 pacientes foram randomizadas 1:1 para receber fulvestranto 500 mg ou anastrozol 1 mg como tratamento hormonal. Este estudo comparou a eficácia e segurança de fulvestranto 500 mg e de anastrozol 1 mg.
A randomização foi estratificada pela definição da doença (localmente avançada ou metastática), quimioterapia15 prévia para a doença avançada e doença mensurável.
O desfecho primário de eficácia do estudo foi a sobrevida12 livre de progressão (SLP) avaliada pelo investigador de acordo com RECIST 1.1 (Response Evaluation Criteria in Solid Tumors - Critérios de Avaliação de Resposta em Tumores Sólidos). Os principais desfechos secundários de eficácia incluíram sobrevida12 global (SG), taxa de resposta objetiva (ORR), duração da resposta (DoR), duração esperada da resposta (EDoR), taxa de benefício clínico (CBR), duração do benefício clínico (DoCB), duração esperada do benefício clínico (EDoCB) e qualidade de vida relacionada à saúde2 (QVRS).
As pacientes incluídas neste estudo tinham idade mediana de 63 anos (intervalo 36-90). A maioria das pacientes (87,0%) apresentava doença metastática16 na linha basal. Cinquenta e cinco por cento (55,0%) das pacientes apresentavam metástase17 visceral na linha basal. Um total de 17,1% das pacientes receberam um regime de quimioterapia15 anterior para a doença avançada; 84,2% das pacientes apresentavam doença mensurável. Os locais de metástase17 ocorreram conforme segue: ossos/locomotor 58,7%, linfonodos18 50,2%, respiratório 40,0%, fígado19 (incluindo vesícula biliar20) 18,4% e apenas ossos/locomotor 10,4%.
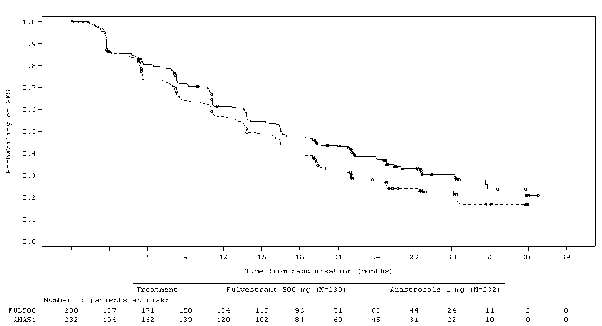
Observou-se uma melhora estatisticamente significante na SLP para o braço fulvestranto em relação ao braço anastrozol [HR=0,797 (IC 95%: 0,637-0,999; 2-sided p=0,0486). A SLP mediana foi de 16,6 meses (IC 95%: 13,83-20,99) no braço fulvestranto e 13,8 meses (IC 95%: 11,99-16,59) no braço anastrozol. Resultados consistentes foram observados na maioria dos subgrupos de pacientes pré- especificados. Para o subgrupo de pacientes com doença limitada a metástase17 não visceral (n=208), a HR foi de 0,592 (IC 95%: 0,419-0,837) para o braço fulvestranto comparado ao braço anastrozol. Para o subgrupo de pacientes com metástase17 visceral (n=254), a HR foi de 0,993 (IC 95%: 0,740-1,331) para o braço fulvestranto comparado ao braço anastrozol.
Tabela 2 - Resumo dos resultados do desfecho primário de eficácia (SLP) e principais desfechos secundários de eficácia (avaliação do investigador, população com intenção de tratar) – estudo FALCON
|
|
Fulvestranto 500 mg |
Anastrozol 1 mg |
|
Sobrevida12 Livre de Progressão |
||
|
Número de eventos de SLP (%) |
143 (62,2%) |
166 (71,6%) |
|
Taxa de Risco da SLP (IC 95%) e valor de p |
HR 0,797 (0,637 - 0,999) |
|
|
Número de eventos de SG* |
67 (29,1%) |
75 (32,3%) |
|
Taxa de Risco da SG (IC 95%) e valor de p |
HR 0,875 (0,629 - 1,217) |
|
|
ORR** |
89 (46,1%) |
88 (44,9%) |
|
Diferença absoluta (%) da ORR (IC 95%) e valor de p |
OR 1,074 (0,716 - 1,614) |
|
|
DoR Mediana (meses) |
20,0 |
13,2% |
|
CBR |
180 (78,3%) |
172 (74,1%) |
|
Diferença absoluta (%) da CBR (IC 95%) e valor de p |
OR 1,253 (0,815 - 1,932) |
|
*(31% maturidade) – análise de SG não final
**para pacientes13 com a doença mensurável
Figura 2 - Gráfico de Kaplan-Meier da Sobrevida12 Livre de Progressão (avaliação do investigador, população com intenção de tratar) – estudo FALCON
Estudos clínicos fase III (9238IL/0020 e 9238IL/0021) compararam a segurança e eficácia de fulvestranto 250 mg com um inibidor da aromatase de terceira geração, o anastrozol.
Estes dois estudos clínicos de fase III foram finalizados com um total de 851 mulheres na pós- menopausa5 com câncer3 de mama4 avançado que tiveram recorrência11 da doença durante ou após terapia endócrina adjuvante ou progressão após terapia endócrina para doença avançada (Howell A et al. J Clin Oncol. 2002;20 (16):3396-403, Kuter I et al. Breast Cancer3 Res Treat. 2007;106(Suppl 1):Abs 23). No estudo 9238IL/0021 o tempo para progressão (TTP) para a comparação entre o fulvestranto 250 mg vs anastrozol foi como se segue: taxa de risco (IC 95,14%) = 0,92 (0,74 a 1,14) p=0,43. No estudo 9238IL/0020 o TTP para a comparação de fulvestranto 250 mg vs anastrozol foi como se segue: taxa de risco (IC 95,14%) = 0,98 (0,80 a 1,21), p=0,84 (Howell A et al. J Clin Oncol. 2002; 20(16):3396-403, Kuter I et al. Breast Cancer3 Res Treat. 2007;106(Suppl 1):Abs 23).
Em geral, fulvestranto de 250 mg foi, pelo menos, tão eficaz quanto o anastrozol em termos de resposta objetiva, benefício clínico, tempo para progressão, tempo para falha de tratamento e qualidade de vida.
O fulvestranto 250 mg mostrou maior duração de resposta em ambos os estudos. No estudo norte americano (Estudo 9238IL/0021), a duração mediana da resposta foi de 19,3 meses para fulvestranto 250 mg e 10,5 meses para anastrozol. No outro estudo (Estudo 9238IL/0020 – resto do mundo), a duração mediana da resposta foi de 14,3 e 14,0 para fulvestranto 250 mg e anastrozol, respectivamente (Howell A. et al. J Clin Oncol 2002; 20 (16):3396; Osborne CK et al. J Clin Oncol 2002; 20 (16): 3386).
Terapia em combinação com palbociclibe
PALOMA-3 foi um estudo randomizado21, duplo-cego, de grupo paralelos e multicêntrico de fulvestranto 500 mg com palbociclibe 125 mg versus fulvestranto 500 mg com placebo22, conduzido em mulheres portadoras de câncer3 de mama4 positivo para o receptor hormonal6 (RH), negativo para o receptor do fator de crescimento epidérmico humano 2 (HER-2) e localmente avançado não passível de ressecção ou terapia de radiação com intenção curativa ou metastático, independentemente do estado menopausal, cuja doença progrediu após terapia endócrina prévia no cenário (neo) adjuvante ou metastático (Cristofanilli M. et al. Lancet 2016; 17 (4):425).
Um total de 521 mulheres pré/peri e pós-menopáusicas que progrediram em ou dentro de 12 meses após a conclusão da terapia endócrina adjuvante ou em ou dentro de 1 mês após a terapia endócrina prévia para doença avançada foram randomizadas 2:1 para fulvestranto com palbociclibe ou fulvestranto com placebo22 e estratificadas por sensibilidade documentada à terapia hormonal prévia, estado menopausal ao entrar no estudo (pré/peri versus pós-menopausa5), e presença de metástases23 viscerais. As mulheres pré/peri-menopáusicas receberam gosserrelina, agonista9 da LHRH. Pacientes com disseminação visceral, sintomática24, avançada/metastática que corriam o risco de complicações com risco à vida no curto prazo [incluindo pacientes com derrames maciços não controlados (pleural, pericárdico, peritoneal), linfangite25 pulmonar e mais de 50% de envolvimento hepático] não eram elegíveis para a inclusão no estudo.
As pacientes continuaram a receber o tratamento atribuído até a progressão objetiva da doença, deterioração sintomática24, toxicidade26 inaceitável, morte ou retirada do consentimento, o que ocorreu primeiro. Não foi permitido o cruzamento entre os braços de tratamento.
As pacientes foram bem balanceadas para dados demográficos basais e características prognósticas entre o braço de fulvestranto com palbociclibe e o braço fulvestranto com placebo22. A idade mediana das pacientes incluídas neste estudo foi de 57 anos (faixa entre 29 e 88). Em cada braço de tratamento a maioria das pacientes era branca, tinha sensibilidade documentada à terapia hormonal prévia e estava na pós-menopausa5.
Aproximadamente 20% das pacientes eram pré/perimenopáusicas. Todas as pacientes receberam terapia sistêmica prévia e a maioria das pacientes em cada grupo de tratamento receberam um regime de quimioterapia15 prévio para seu diagnóstico27 primário. Mais da metade (62%) apresentaram PS-ECOG igual a 0, das quais 60% apresentaram metástases23 viscerais, e 60% receberam mais de 1 regime hormonal prévio para o diagnóstico27 primário.
O objetivo primário do estudo foi a SLP avaliada pelo investigador e analisada de acordo com o RECIST 1.1. As análises de suporte da SLP foram baseadas em uma Revisão Radiológica Central Independente. Os desfechos secundários incluíram SG, OR, resposta de benefício clínico (CBR), segurança e tempo para a deterioração no desfecho de dor.
O estudo atingiu o seu objetivo primário de prolongar a SLP avaliada pelo investigador na análise interina realizada com 82% dos eventos da SLP planejados; os resultados cruzaram o limite de eficácia pré-especificado de Haybittle-Peto (alfa=0,00135), demonstrando um prolongamento estatisticamente significativo na SLP e um efeito de tratamento clinicamente significativo. Uma atualização mais madura dos dados de eficácia é relatada na Tabela 3.
Tabela 3 - Resultados da eficácia - Estudo PALOMA-3 (avaliação do investigador, população com intenção de tratar)
|
|
Análise atualizada |
||
|
fulvestranto com palbociclibe |
fulvestranto com placebo22 |
||
|
Sobrevida12 Livre de Progressão |
|
||
|
Mediana [meses (IC 95%)] |
11,2 (9,5; 12,9) |
4,6 (3,5; 5,6) |
|
|
Taxa de Risco (IC 95%) e valor p |
0,497 (0,398; 0,620), p <0,000001 |
||
|
Desfechos secundários* |
|||
|
OR [% (IC 95%)] |
21,0 (16,9; 25,7) |
8,6 (4,9; 13,8) |
|
|
OR (doença mensurável) [% (IC 95%)] |
27,3 (22,1; 33,1) |
10,9 (6,2; 17,3) |
|
|
DDR (doença mensurável) [meses (IC 95%)] |
10,4 (8,3; NE) |
9,0 (5,6; NE) |
|
|
CBR [% (IC 95%)] |
66,3 (61,0; 71,2) |
39,7 (32,3; 47,3) |
|
* Desfechos de resposta baseados nas respostas confirmadas.
N=número de pacientes; IC=intervalo de confiança; NE=não estimável; OR=resposta objetiva; CBR=resposta de benefício clínico; DDR=duração da resposta; SLP=sobrevida12 livre de progressão.
Figura 3 - Gráfico de Kaplan-Meier da sobrevida12 livre de progressão (avaliação do investigador, população com intenção de tratar) – Estudo PALOMA-3
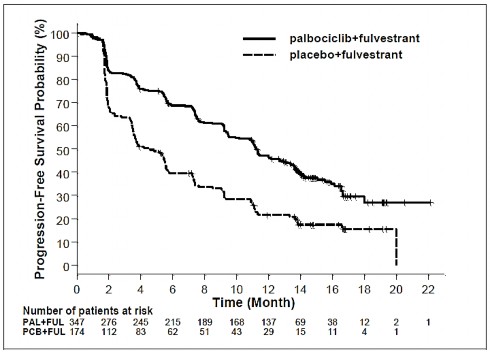
FUL=fulvestranto; PAL=palbociclibe; PCB=placebo22.
Foi observada uma redução no risco de progressão da doença ou de morte no braço de fulvestranto com palbociclibe em todos os subgrupos individuais de pacientes definidos por fatores de estratificação e características de linha de base. Isso foi evidente para as mulheres pré/ peri-menopáusicas (HR de 0,46 [IC 95%: 0,28; 0,75]) e mulheres pós-menopáusicas [HR de 0,52 (IC 95%: 0,40; 0,66)] e pacientes com localização visceral de doença metastática16 [HR de 0,50 (IC 95%: 0,38; 0,65)] e sítio não visceral de doença metastática16 [HR de 0,48 (IC 95%: 0,33; 0,71)]. O benefício também foi observado independentemente das linhas de terapia prévias no grupo metastático, seja 0 [HR de 0,59 (IC 95%: 0,37; 0,93)], 1 [HR de 0,46 (IC 95%: 0,32; 0,64)], 2 [HR de 0,48 (IC 95%: 0,30; 0,76)], ou ? 3 linhas [HR de 0,59 (IC 95%: 0,28, 1,22)]. As medidas de eficácia adicionais (OR e TTR) avaliadas nos subgrupos de pacientes com ou sem doença visceral são apresentadas na Tabela 4.
Tabela 4 - Resultados de eficácia em doenças viscerais e não viscerais do estudo PALOMA-3 (população com intenção de tratar)
|
|
Doença visceral |
Doença não visceral |
||
|
|
fulvestranto com palbociclibe |
fulvestranto com placebo22 |
fulvestranto com palbociclibe |
fulvestranto com placebo22 |
|
OR [% (IC 95%)] |
28,0 (21,7; 34,3) |
6,7 (2,7; 13,3) |
11,3 (6,6; 17,8) |
11,6 (5,1; 21,6) |
|
TTR*, Mediana [meses (variação)] |
3,8 (3,5; 14,0) |
3,6 (3,5; 7,4) |
3,7 (1,9; 5,7) |
3,6 (3,4; 3,7) |
*Resultados de resposta baseados nas respostas confirmadas.
N=número de pacientes; IC=intervalo de confiança; OR= resposta objetiva; TTR= tempo para a primeira resposta do tumor28.
Os sintomas29 relatados pelo paciente foram avaliados utilizando-se o questionário de Qualidade de Vida (QLQ)-C30 da Organização Europeia para Pesquisa e Tratamento do Câncer3 (EORTC) e seu módulo para câncer3 de mama4 (EORTC QLQ-BR23). Um total de 335 pacientes no braço de fulvestranto com palbociclibe e 166 pacientes no braço fulvestranto com placebo22 completaram o questionário na linha de base e em pelo menos 1 visita pós linha de base.
O tempo para deterioração foi pré-especificado como o tempo entre a linha de base e a primeira ocorrência de ? 10 pontos de aumento a partir da linha de base na pontuação de sintomas29 de dor. A adição de palbociclibe ao fulvestranto resultou em um benefício de sintoma30 ao atrasar significativamente o tempo para deterioração do sintoma30 de dor em comparação ao fulvestranto com placebo22 [mediana de 8,0 meses versus 2,8 meses, HR de 0,64 (IC 95%: 0,49; 0,85); p <0,001].
Efeitos no endométrio31 na pós-menopausa5
Os dados pré-clínicos de fulvestranto sugerem que ele não terá efeito estimulador no endométrio31 na pós- menopausa5 (Wakeling AE et al Cancer3 Res 1991; (51): 3867).
Um estudo em voluntárias saudáveis na pós-menopausa5 mostrou que, em comparação ao placebo22, o pré- tratamento com fulvestranto 250 mg resultou em significativa redução da estimulação do endométrio31 na pós-menopausa5 em voluntárias tratadas com 20 mcg por dia de etinilestradiol. Isso demonstra o potente efeito antiestrogênico no endométrio31 na pós-menopausa5 (Addo S, Yates RABr J Cancer3. 2002;87(12):1354-9).
Tratamento neoadjuvante de duração de até 16 semanas em pacientes com câncer3 de mama4 tratadas tanto com fulvestranto 500 mg ou fulvestranto 250 mg não resultaram em alterações significativas na espessura do endométrio31, indicando falta de efeito agonista9 (Kuter I et al. Breast Cancer3 Res Treat. 2007;106 (Suppl 1):Abs 23). Não há evidências de efeitos adversos no endométrio31 das pacientes com câncer3 de mama4 estudadas.
Efeitos nos ossos
Tratamento neoadjuvante por até 16 semanas em pacientes com câncer3 de mama4 tratadas tanto com fulvestranto 500 mg ou fulvestranto 250 mg não resultou em alterações clinicamente significativas nos marcadores séricos de recaptação de massa óssea. Não houve evidência de efeitos adversos ósseos nos estudos em pacientes com câncer3 de mama4 (Kuter I et al. Breast Cancer3 Res Treat. 2007;106 (Suppl 1): Abs 23).
CARACTERÍSTICAS FARMACOLÓGICAS
Propriedades Farmacodinâmicas
Estudos de farmacologia32 e mecanismo de ação estabeleceram que o fulvestranto é o primeiro agente de uma nova classe de antiestrogênicos que leva à supressão dos receptores de estrogênio (RE), e pode, portanto, ser descrito como supressor33.
O fulvestranto exerce seus efeitos farmacológicos pela ligação de alta afinidade ao receptor de estrogênio alfa (RE-alfa) e possui um novo mecanismo de ação que induz uma rápida perda de proteína do RE-alfa das células34 de câncer3 de mama4.
O fulvestranto é um inibidor potente e reversível do crescimento in vitro das células34 de câncer3 de mama4 humano sensível ao estrogênio e tem maior potência e eficácia do que o tamoxifeno.
O fulvestranto inibe o crescimento de xenoenxertos do câncer3 de mama4 humano sensível ao estrogênio no camundongo nu, é mais efetivo que o tamoxifeno na prevenção do surgimento de tumores das células34 de câncer3 de mama4 humano do xenoenxerto e suprime o crescimento de tumores de mama4 por até duas vezes mais do que o tamoxifeno. O fulvestranto inibe o crescimento in vitro de células34 de câncer3 de mama4 resistentes ao tamoxifeno e in vivo de tumores de mama4 resistentes ao tamoxifeno.
Propriedades Farmacocinéticas
Após administração intravenosa ou intramuscular, fulvestranto é rapidamente depurado a uma taxa próxima do fluxo sanguíneo hepático (nominalmente 10,5 mL de plasma35/min/kg).
Entretanto, a injeção intramuscular36 de longa ação de fulvestranto mantém as concentrações plasmáticas de fulvestranto em uma faixa estreita (de até 3 vezes) por um período de pelo menos 28 dias após a injeção37.
A administração de fulvestranto 500 mg alcança níveis de exposição no ou perto do estado de equilíbrio dentro do primeiro mês de dose (média [CV]: AUC38 475 (33,4%) ng.dias/mL Cmáx 25,1 (35,3%) ng/mL, Cmín 16,3 (25,9%) ng/mL, respectivamente).
Os resultados dos estudos de fulvestranto em dose única são preditivos da farmacocinética com múltiplas doses.
Nenhuma diferença no perfil farmacocinético de fulvestranto foi detectada com relação à idade (faixa de 33 a 89 anos).
Nenhuma diferença no perfil farmacocinético de fulvestranto foi detectada com relação aos grupos étnicos.
Absorção: O fulvestranto não é administrado oralmente.
Distribuição: O fulvestranto mostrou distribuição rápida e extensiva e o volume aparente de distribuição no estado de equilíbrio foi extenso (de aproximadamente 3 a 5 L/kg), o que sugere que a distribuição do composto é, em sua maior parte, extravascular39. O fulvestranto teve alta ligação às proteínas40 plasmáticas (99%) quando em concentrações maiores do que aquelas para uso clínico.
Frações lipoproteicas de VLDL, LDL41 e HDL42 parecem ser os principais componentes ligantes.
O papel da globulina43 de ligação do hormônio44 sexual, se existente, não pôde ser determinado. Nenhum estudo foi conduzido sobre interações fármaco45-fármaco45 de ligação protéica competitiva, como a maioria das interações relatadas deste tipo, envolvendo a ligação de albumina46 e alfa-1-glicoproteína ácida.
Metabolismo47: A biotransformação e a disponibilidade de fulvestranto em humanos foram determinadas após administração intramuscular e intravenosa de fulvestranto marcado com 14C. O metabolismo47 de fulvestranto parece envolver combinações de uma série de possíveis vias análogas de biotransformação às dos esteroides endógenos, incluindo oxidação, hidroxilação aromática e conjugação com ácido glicurônico e/ou sulfato nas posições 2-, 3- e 17- dos núcleos esteroidais e oxidação da cadeia sulfóxido. O metabolismo47 de fulvestranto em humanos apresenta um perfil similar de metabólitos48 aos encontrados em outras espécies. Os metabólitos48 identificados são menos ativos ou exibem atividade similar ao fulvestranto em modelos antiestrogênicos. Estudos usando preparações hepáticas49 humanas e enzimas humanas recombinadas indicam que a CYP3A4 é a única isoenzima do citocromo P450 envolvida na oxidação de fulvestranto, entretanto, as vias não-P450 parecem ser mais predominantes in vivo.
Excreção: O fulvestranto foi rapidamente depurado pelas vias hepatobiliares50, sendo a taxa global determinada pelo modo de administração. A excreção foi por via fecal e a eliminação renal51 do material fármaco45 relacionado foi desprezível (menor que 1%).
Populações especiais
Insuficiência hepática52
A farmacocinética do fulvestranto foi avaliada em estudos clínicos de dose única conduzidos em mulheres com insuficiência hepática52 categoria A e B de Child-Pugh devido à cirrose53, usando uma alta dose de uma formulação de curta duração de injeção intramuscular36.
Houve uma redução 1,3 e 2 vezes na média da depuração em mulheres com insuficiência hepática52 categoria A e B de Child-Pugh, respectivamente, comparado com mulheres sadias, a qual conduziu a um similar aumento na AUC38. Não foram avaliados pacientes com categoria C de Child-Pugh.
Concentrações plasmáticas médias do estado de equilíbrio de modelos intramusculares do fulvestranto em mulheres com insuficiência hepática52 categoria A e B de Child-Pugh estão dentro da maior taxa de concentração esperada para pacientes13 com função hepática54 normal que receberam formulação intramuscular. Devido ao perfil de segurança conhecido do fulvestranto, o ajuste de dose não é considerado necessário.
Dados de segurança pré-clínica
Toxicidade26 aguda: A toxicidade26 aguda de fulvestranto é baixa. Em roedores, a dose letal mediana foi maior que 70 mg/kg após administração intramuscular (mais que 400 vezes a dose clínica), maior que 50 mg/kg após administração intravenosa e maior que 2000 mg/kg após administração oral.
Toxicidade26 crônica: O fulvestranto foi bem tolerado em todas as espécies animais nas quais foi testado. Nos estudos de toxicidade26 com doses intramusculares múltiplas em ratos e cachorros, a atividade antiestrogênica de fulvestranto foi responsável pela maioria dos efeitos observados, particularmente no sistema reprodutor das fêmeas, mas também em outros órgãos sensíveis a hormônios em ambos os sexos. Não houve evidência de outra toxicidade26 sistêmica em ratos com doses de até 10 mg/rato a cada 15 dias por 6 meses ou em cachorros com doses de até 40 mg/kg a cada 28 dias por 12 meses.
Em estudos com cachorros, após administração oral e intravenosa, foram observados efeitos no sistema cardiovascular55 (elevações discretas do segmento S-T no ECG com dose oral e parada sinusal em um cachorro com dose intravenosa), mas esses efeitos ocorreram em animais expostos a doses bem mais altas de fulvestranto do que aquelas administradas em pacientes (Cmáx > 15 vezes) e foram, então, consideradas insignificantes para a segurança da dose clínica em humanos.
Mutagenicidade: O fulvestranto não mostrou potencial genotóxico.
Toxicologia reprodutiva: O fulvestranto mostrou efeitos sobre a reprodução56 e o desenvolvimento embrionário/fetal consistentes com sua atividade antiestrogênica, em doses similares à dose clínica. Em ratos, o fulvestranto causou redução reversível da fertilidade das fêmeas e da sobrevida12 do embrião em doses de 0,01 mg/kg/dia e acima, distócia e incidência57 aumentada de anormalidades fetais, incluindo curvatura do tarso58. As coelhas que receberam fulvestranto em dose ? 1 mg/kg/dia não mantiveram a gravidez59 e, em doses de até 0,25 mg/kg/dia, foram observados aumento do peso placentário e perda pós-implantação, mas sem efeito no desenvolvimento fetal.
Carcinogenicidade: Um estudo de carcinogenicidade em ratos, por dois anos (administração intramuscular), mostrou aumento da incidência57 de células34 tumorais granulosas benignas de ovário60 em fêmeas que receberam altas doses, 10 mg/rato/15 dias.
Em um estudo de oncogenicidade de dois anos em camundongos, a administração oral foi associada a aumento da incidência57 de tumores do estroma61 do cordão sexual no ovário60 (tanto benignos, quanto malignos) com doses de 150 mg/kg/dia e 500 mg/kg/dia. Os níveis de exposição sem efeitos adversos observados (NOEL) para estes achados foram de 10 mg/rato/30 dias em ratos e 20 mg/kg/dia em camundongos, respectivamente.
A indução nestes tumores é consistente com as alterações do mecanismo regulador (feedback) endócrino62 farmacológico-relacionado a níveis gonadotrópicos causados por antiestrogênico nos ciclos dos animais. Portanto, estes achados não são considerados relevantes para o uso de fulvestranto em mulheres na pós- menopausa5 com câncer3 de mama4 avançado.
CONTRAINDICAÇÕES
Poemmy® é contraindicado a pacientes com conhecida hipersensibilidade ao fulvestranto ou a qualquer componente da fórmula.
Terapia em combinação com palbociclibe: vide bula do palbociclibe.
ADVERTÊNCIAS E PRECAUÇÕES
O fulvestranto é metabolizado primariamente no fígado19.
Deve-se ter cuidado ao usar Poemmy® em pacientes com insuficiência hepática52, pois a depuração pode ser reduzida (ver itens “Posologia e Modo de Usar” e “Características Farmacológicas – Propriedades Farmacocinéticas”).
Deve-se ter cuidado antes de tratar os pacientes que tenham depuração de creatinina63 menor que 30 mL/min (ver item “Características Farmacológicas – Propriedades Farmacocinéticas”).
Deve-se ter cuidado antes de tratar pacientes com sangramento ou trombocitopenia64 ou em uso de anticoagulante65, devido à via de administração.
Eventos relacionados ao local da injeção37, incluindo dor ciática, neuralgia66, dor neuropática67, e neuropatia periférica68 têm sido relatados com a injeção37 de Poemmy®. Deve-se tomar cuidado ao administrar Poemmy® na região dorsoglútea devido à proximidade ao nervo ciático69 subjacente (ver itens: “Posologia e Modo de Usar” e “Reações Adversas”).
Este medicamento pode causar doping.
Terapia em combinação com palbociclibe: vide bula do palbociclibe
Efeitos na habilidade de dirigir e operar máquinas
É improvável que Poemmy® interfira na capacidade de dirigir veículos e operar máquinas. Entretanto, durante o tratamento com Poemmy® foi relatada astenia70, e deve-se observar com cuidado os pacientes que apresentam esse sintoma30 ao dirigir veículos ou operar máquinas.
Gravidez59 e Lactação71
Categoria de risco na gravidez59: D – Há evidências de risco em fetos humanos. Só usar se o benefício justificar o risco potencial. Em situação de risco de vida ou em caso de doenças graves para as quais não se possa utilizar drogas mais seguras, ou se estas drogas não forem eficazes.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica. Informe imediatamente seu médico em caso de suspeita de gravidez59.
Como esperado com um antiestrogênico potente, estudos em animais têm mostrado toxicidade26 reprodutiva (ver item “Características Farmacológicas - Toxicologia reprodutiva”). O fulvestranto é encontrado no leite de ratas em níveis significativamente maiores do que os níveis plasmáticos. O risco potencial para humanos é desconhecido. Portanto, o uso de Poemmy® deve ser evitado em gestantes ou lactantes72. Pacientes com potencial para engravidar devem usar contraceptivo efetivo durante o tratamento com Poemmy® e por 2 anos após receberem a última dose do medicamento.
INTERAÇÕES MEDICAMENTOSAS
O fulvestranto não inibe significativamente quaisquer isoenzimas principais do citocromo P450 (CYP) in vitro, e resultados de um estudo de farmacocinética clínica envolvendo coadministração de fulvestranto com midazolam também sugerem que doses terapêuticas de fulvestranto não terão efeito inibitório na CYP3A4. Em adição, embora o fulvestranto possa ser metabolizado pela CYP3A4 in vitro, um estudo clínico com rifampicina não mostrou alterações na depuração de fulvestranto como um resultado da indução da CYP3A4. Resultados de um estudo clínico com cetoconazol, um potente inibidor da CYP3A4, também indicaram que não há alterações clinicamente relevantes na depuração de fulvestranto. Não é necessário ajuste de dose em pacientes recebendo inibidores ou indutores da CYP3A4.
Devido à similaridade estrutural entre o fulvestranto e o estradiol, o fulvestranto pode interferir nos ensaios de doseamento de estradiol baseados em anticorpo73, podendo resultar em nível de estradiol falsamente elevado.
CUIDADOS DE ARMAZENAMENTO DO MEDICAMENTO
Cuidados de conservação
Poemmy® deve ser conservado sob refrigeração (2–8°C).
Poemmy® tem validade de 24 meses a partir da data de fabricação.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Características físicas e organolépticas do produto
Poemmy® é apresentado em seringa1 de vidro contendo solução injetável, levemente amarelada, límpida e isenta de partículas visíveis.
Antes de usar, observe o aspecto do medicamento.
TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS.
POSOLOGIA E MODO DE USAR
Posologia
Monoterapia: Mulheres adultas (incluindo idosas): a dose recomendada de Poemmy® é de 500 mg, a ser administrada por via intramuscular em duas injeções de 5 mL, uma em cada nádega (área dos glúteos74), no intervalo de 1 mês com uma dose adicional de 500 mg dada 2 semanas após a dose inicial. É recomendado que a injeção37 seja administrada lentamente.
Terapia em combinação com palbociclibe: Quando Poemmy® for usado em combinação com palbociclibe, para Poemmy®, seguir as instruções de dose recomendadas para a monoterapia. Para palbociclibe, seguir a bula do palbociclibe. Antes de iniciarem o tratamento com a combinação de Poemmy® com palbociclibe e ao longo de sua duração as mulheres pré/perimenopáusicas devem ser tratadas com agonistas de LHRH de acordo com a prática clínica local.
Deve-se tomar cuidado com a injeção37 de Poemmy® na região dorsoglútea devido à proximidade ao nervo ciático69 subjacente.
Dosagens especiais
Crianças: não é recomendado o uso em crianças ou adolescentes, já que a segurança e a eficácia não foram estabelecidas nestes grupos etários.
Pacientes com insuficiência renal75: não é recomendado ajuste de dose para pacientes13 com depuração de creatinina63 maior que 30 mL/min. A segurança e a eficácia não foram avaliadas em pacientes com depuração de creatinina63 menor que 30 mL/min (ver item “Advertências e Precauções”).
Pacientes com insuficiência hepática52: não é recomendado ajuste de dose para pacientes13 com insuficiência hepática52 categoria A e B de Child-Pugh. O uso de Poemmy® não foi avaliado em pacientes com insuficiência hepática52 categoria C de Child-Pugh (ver itens “Advertências e Precauções” e “Características Farmacológicas – Propriedades Farmacocinéticas”).
Idosos: não é necessário ajuste de dose para pacientes13 idosas.
Interações que necessitam ajuste de dose: não existem interações medicamento-medicamento conhecidas que necessitem ajuste de dose.
Modo de usar
Poemmy® deve ser administrado por via intramuscular nas nádegas76, por um profissional de saúde2, sob supervisão médica. É recomendado que a injeção37 seja administrada lentamente.
Administrar a injeção37 de acordo com as diretrizes locais para a realização de injeções de grande volume intramuscular.
NOTA: Devido à proximidade do nervo ciático69 subjacente, deve-se tomar cuidado ao administrar
Poemmy® na região dorsoglútea (ver item “Advertências e Precauções”).
Atenção: não autoclavar a agulha com dispositivo de segurança antes do uso (agulha hipodérmica com dispositivo de segurança). As mãos77 devem permanecer atrás da agulha em todos os momentos durante o uso e descarte.
Para cada seringa1:
- Remova a seringa1 de vidro da embalagem e verifique se não está danificada.
- Rosqueie o embolo78 no corpo da seringa1 de vidro, a fim de unir as duas partes.
- Soluções parenterais devem ser inspecionadas visualmente quanto à presença de partículas e descoloração antes da administração.
- Quebre o selo de plástico branco que cobre o conector Luer-Lok da seringa1 para remover a borracha de proteção.
Na ausência de estudos de incompatibilidade, este medicamento não deve ser misturado a outros produtos medicinais.
- Retire a agulha com dispositivo de segurança da embalagem.
- Gire para fixar a agulha ao conector Luer-Lok.
- Coloque a agulha com dispositivo de segurança no conector Luer-Lok.
- Gire até que fique firmemente fixado.
- Puxe o envoltório até o final da agulha para evitar danificar a ponta da agulha.
- Transporte a seringa1 preenchida até o ponto de administração.
- Retire o envoltório da agulha.
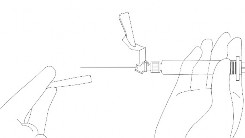
- Soluções parenterais devem ser inspecionadas visualmente quanto à presença de partículas e descoloração antes da administração.
- Retire o excesso de ar da seringa1.
- Administrar lentamente por via intramuscular (1-2 minutos/injeção37) na nádega (área do glúteo). Para uso conveniente, o bisel deve ser orientado para cima.
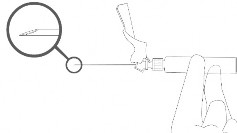
- Após injeção37, ative imediatamente o sistema de proteção da agulha após a aplicação, empurrando a alavanca para ativar o mecanismo de cobertura.
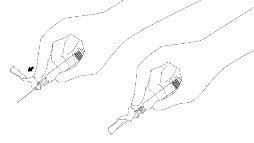
NOTA: ativar o sistema de proteção da agulha longe de si e dos outros. Ouça um clique e confirme visualmente que o dispositivo está protegendo completamente a agulha.
Poemmy® deve ser utilizado até o médico definir quando deve ser interrompido o uso deste medicamento.
Se por alguma razão o paciente não puder comparecer na data marcada para fazer uso da medicação,
Poemmy® pode ser administrado 3 dias antes ou 3 dias depois dessa data.
Para segurança e eficácia do medicamento, Poemmy® não deve ser administrado por vias não recomendadas. A administração deve ser feita somente pela via intramuscular.
REAÇÕES ADVERSAS
Monoterapia
As categorias de frequências de reações adversas a medicamentos (RAMs) a seguir foram calculadas com base no grupo de tratamento de fulvestranto 500 mg em uma análise conjunta de segurança dos estudos que compararam fulvestranto 500 mg com fulvestranto 250 mg [estudos CONFIRM (Estudo D6997C00002), FINDER 1 (Estudo D6997C00004), FINDER 2 (Estudo D6997C00006), e NEWEST
(Estudo D6997C00003)]; ou do estudo FALCON (Estudo D699BC00001) isolado, que comparou fulvestranto 500 mg com anastrozol 1 mg. Quando as frequências diferem entre a análise conjunta de segurança e o FALCON, a maior frequência é apresentada. As frequências na tabela a seguir foram baseadas em todos os eventos relatados, independentemente da avaliação do investigador sobre a causalidade.
Tabela 5 - Resumo das Reações Adversas observadas em estudos clínicos para fulvestranto 500 mg
|
Frequência |
Sistema de Classificação de Órgãos |
Reação Adversa |
|
Muito comum |
Distúrbios gerais do local de administração |
Reações no local de administraçãoa, astenia70 |
|
Distúrbios hepatobiliares50 |
Aumento das enzimas hepáticas79 (ALT, AST, ALP)b |
|
|
Distúrbios gastrointestinais |
Náusea80 |
|
|
Distúrbios do sistema imune81 |
Reações de hipersensibilidadee |
|
|
Afecções82 musculoesqueléticas e dos tecidos conjuntivos |
Artralgia83 e dor musculoesqueléticad |
|
|
Afecções82 da pele e tecido subcutâneo84 |
Erupção85 cutânea86e |
|
|
Distúrbios vasculares87 |
Ondas de calore |
|
|
Comum |
Distúrbios do sistema nervoso88 |
Cefaleia89 |
|
Distúrbios hepatobiliares50 |
Bilirrubina90 elevadab |
|
|
Sangue91 e sistema linfático92 |
Contagem reduzida de plaquetas93e |
|
|
Distúrbios gastrointestinais |
Vômito94 e diarreia95 |
|
|
Distúrbios de metabolismo47 e nutrição96 |
Anorexia97 |
|
|
Infecções98 e infestações |
Infecções98 do trato urinário99 |
|
|
Incomum |
Distúrbios hepatobiliares50 |
Insuficiência hepática52c,f, hepatite100f, gama-GT elevadaf |
a Incluindo reação ciática mais grave, neuralgia66 e dor neuropática67 e neuropatia periférica68 relacionada com o local da injeção37.
b Baseado em qualquer alteração grau CTC a partir da linha basal.
c A reação adversa não foi observada nos estudos clínicos principais (CONFIRM, FINDER1, FINDER2, NEWEST). A frequência foi calculada usando o limite superior do intervalo de confiança de 95% para a estimativa pontual. Frequência calculada como 3/560 (onde 560 é o número de pacientes nos estudos clínicos principais), o que equivale à categoria “Incomum”.
d Inclui: artralgia83 e, menos frequentemente, dor musculoesquelética, dorsalgia, mialgia101 e dor nas extremidades.
e Categoria da frequência difere entre a análise conjunta de segurança e o FALCON.
f RAM não observada no FALCON.
Com base nos dados obtidos dos estudos clínicos, não há nenhuma evidência de uma relação causal entre fulvestranto e eventos relatados como incomuns ou raros.
Terapia em combinação com palbociclibe: vide bula do palbociclibe.
Atenção: este produto é um medicamento que possui uma nova indicação terapêutica102 no país e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos. Nesse caso, notifique ao Sistema de Notificação de Eventos Adversos a Medicamentos - VigiMed, disponível no Portal da Anvisa.
SUPERDOSE
Há casos raros de superdosagem de fulvestranto em humanos. Caso ocorra superdosagem, as pacientes devem ser tratadas sintomaticamente. Estudos em animais não mostram outros efeitos além daqueles relacionados direta ou indiretamente à atividade antiestrogênica, que foram evidentes com doses altas de fulvestranto.
Em caso de intoxicação ligue para 0800 722 6001, se você precisar de mais orientações.
DIZERES LEGAIS
USO RESTRITO A HOSPITAIS
VENDA SOB PRESCRIÇÃO MÉDICA
MS nº: 1.0033.0201
Farmacêutica responsável: Cintia Delphino de Andrade – CRF-SP nº: 25.125
Registrado por:
Libbs Farmacêutica Ltda. Rua Josef Kryss, 250 – São Paulo – SP CNPJ: 61.230.314/0001-75
Fabricado por:
Libbs Farmacêutica Ltda.
Rua Alberto Correia Francfort, 88 – Embu das Artes – SP
Indústria brasileira
SAC 0800 0135044