Fanclomax
BLAU FARMACÊUTICA S.A.
IDENTIFICAÇÃO DO MEDICAMENTO
Fanclomax®
fanciclovir
Comprimidos 125 e 250 mg
FORMA FARMACÊUTICA E APRESENTAÇÃO:
Comprimido simples
Cartucho contendo 1 blister com 3, 7 ou 10 comprimidos
VIA DE ADMINISTRAÇÃO: ORAL
USO ADULTO
COMPOSIÇÃO:
Cada comprimido de Fanclomax® 125 mg contém:
| fanciclovir | 125 mg |
| excipiente q.s.p. | 1 comprimido |
Excipientes: lactose1, povidona, amidoglicolato de sódio, celulose microcristalina, estearato de magnésio.
Cada comprimido de Fanclomax® 250 mg contém:
| fanciclovir | 250 mg |
| excipiente q.s.p. | 1 comprimido |
Excipientes: lactose1, povidona, amidoglicolato de sódio, celulose microcristalina, estearato de magnésio.
INFORMAÇÕES AO PACIENTE
PARA QUE ESTE MEDICAMENTO É INDICADO?
Indicado para o tratamento:644
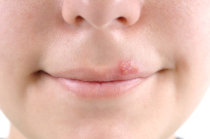
- Herpes zoster2 agudo3;
- Infecções4 por Herpes simplex: tratamento ou supressão do herpes genital recorrente em pacientes imunocompetentes (com imunidade5 normal);
- Infecções4 por Herpes simplex: tratamento de infecções4 mucocutâneas recorrentes em pacientes imunocompetentes (com imunidade5 normal).
COMO ESTE MEDICAMENTO FUNCIONA?
Fanclomax® contém como princípio ativo o fanciclovir, a forma oral de penciclovir. Fanciclovir é rapidamente convertido in vivo em penciclovir que se dirige às células6 infectadas pelos vírus7, onde é rápida e eficientemente convertido em trifosfato (mediado via timidina quinase induzida pelo vírus7).
O trisfosfato de penciclovir permanece nas células6 infectadas por mais de 12 horas, onde inibe a reprodução8 de DNA do vírus7.
Após administração oral, fanciclovir é rápido e extensivamente absorvido e rapidamente convertido ao componente ativo, penciclovir.
QUANDO NÃO DEVO USAR ESTE MEDICAMENTO?
Fanclomax® é contraindicado a pacientes que apresentem hipersensibilidade ao fanciclovir e aos componentes da formulação e nos casos de hipersensibilidade conhecida ao penciclovir.
O QUE DEVO SABER ANTES DE USAR ESTE MEDICAMENTO?
O herpes genital é uma doença sexualmente transmissível. O risco de transmissão é aumentado durante episódios agudos. Os pacientes devem evitar relações sexuais quando os sintomas9 estiverem agudos ou quando os sintomas9 estiverem presentes, mesmo se o tratamento com um antivirótico já tiver sido iniciado.
Informações importantes sobre um dos componentes do medicamento
Atenção: Este medicamento contém AÇÚCAR10, portanto, deve ser usado com cautela em portadores de Diabetes11.
Este medicamento contém LACTOSE1. Pacientes com problemas hereditários raros de intolerância à galactose12 (deficiência Lapp de lactase ou má absorção de glicose13-galactose12), não devem tomar Fanclomax®, pois ele possui lactose1 em sua formulação.
Populações especiais
Deve-se ter uma atenção especial a pacientes com função renal14 comprometida, quando for necessário ajustar a dose. Atualmente, os dados sobre a segurança e eficácia de fanciclovir em crianças com menos de 18 anos são insuficientes e, portanto, o seu uso em crianças não é recomendado.
Não são necessárias precauções especiais para pacientes15 com insuficiência hepática16 ou idosos.
Gravidez17 e Lactação18
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Embora estudos em animais não tenham demonstrado quaisquer efeitos embriotóxicos ou teratogênicos19 com fanciclovir ou penciclovir, a segurança de fanciclovir na gravidez17 humana não foi estabelecida. Assim, fanciclovir não deve ser usado durante a gravidez17 ou em mulheres que estejam amamentando, a menos que os benefícios potenciais do tratamento compensem qualquer possibilidade de risco. Estudos em ratos mostram que penciclovir é excretado pelo leite de fêmeas lactantes20 recebendo fanciclovir por via oral. Não há informações sobre a excreção pelo leite humano.
Interações medicamento – medicamento
Nenhuma interação farmacocinética clinicamente significativa foi identificada. Probenecida e outras drogas podem afetar os níveis plasmáticos de penciclovir.
Os efeitos de algumas drogas podem mudar se tomadas em combinação com outras drogas ou produtos à base de plantas. Isto pode aumentar o risco de efeitos secundários graves ou pode causar a sua medicação não funcione corretamente. Essas interações são possíveis, mas nem sempre ocorrem. O seu médico ou farmacêutico pode prevenir ou gerenciar interações, mudando a forma como você usa seus medicamentos ou por acompanhamento de perto.
Para ajudar o seu médico ou farmacêutico dar-lhe os melhores cuidados, não se esqueça de informar o seu médico ou farmacêutico sobre todos os produtos que você usa (incluindo medicamentos, drogas sem receita, e os produtos à base de plantas), antes de iniciar o tratamento com este produto. Embora a utilização deste medicamento, não iniciar, parar ou mudar a dose de outros medicamentos que você está usando sem a aprovação do seu médico.
Manter uma lista de todos os produtos que você usa.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento. Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde21.
ONDE, COMO E POR QUANTO TEMPO POSSO GUARDAR ESTE MEDICAMENTO?
Cuidados de conservação
Fanclomax® comprimidos deve ser mantido a temperatura ambiente (15–30°C). Proteger da umidade.
Prazo de validade: 24 meses a partir da data de fabricação.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com prazo de validade vencido. Guarde-o em sua embalagem original.
Características físicas e organolépticas do produto
Comprimido de 125 mg: comprimido circular de coloração branca.
Comprimido de 250 mg: comprimido circular de coloração branca.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo
TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS.
COMO DEVO USAR ESTE MEDICAMENTO?
Fanclomax® comprimidos deve ser usado via oral com ou sem alimentos.
Herpes zoster2
A dose recomendada é de 500 mg a cada 8 horas durante 7 dias. O tratamento deve ser iniciado tão breve a Herpes zoster2 seja diagnosticada.
Infecções4 por Herpes simplex
Primeiro episódio de infecções4 por herpes genital: 250 mg três vezes ao dia por cinco dias. Recomenda-se que o tratamento seja iniciado o mais cedo possível após o início das lesões22.
Herpes genital recorrente: A dose recomendada é de 125 mg duas vezes ao dia durante 5 dias. Recomenda-se iniciar o tratamento ao primeiro sinal23 ou sintoma24 do herpes genital. A eficácia de fanciclovir não foi estabelecida quando o tratamento é iniciado após 6 horas do início dos sintomas9 ou lesões22.
Supressão do herpes genital recorrente: A dose recomendada é de 250 mg duas vezes ao dia durante 1 ano. A segurança e eficácia do tratamento com fanciclovir por mais de 1 ano não foi estabelecida.
Pacientes infectados pelo HIV25: A dose recomendada é de 500 mg duas vezes ao dia durante 7 dias para o tratamento de infecções4 orolabial recorrente ou Herpes simplex genital.
Pacientes com insuficiência renal26: Modificação da dose é habitualmente desnecessária em pacientes com discreta alteração da função renal14.
Em pacientes com comprometimento moderado a severo da função renal14, a frequência de administração deve ser diminuída proporcionalmente ao grau de comprometimento avaliado pelo clearance de creatinina27. As seguintes alterações são recomendadas.
|
Indicação e Dose de fanciclovir |
Clearance de creatinina27 (mL/min) |
Ajuste de Dose |
Intervalo |
|
Herpes Zoster2 |
> 60 |
500 mg |
A cada 8 horas |
|
40 a 69 |
500 mg |
A cada 12 horas |
|
|
20 a 39 |
500 mg |
A cada 24 horas |
|
|
< 20 |
250 mg |
A cada 24 horas |
|
|
HD* |
500 mg |
Após cada diálise28 |
|
|
Herpes genital recorrente |
? 40 |
125 mg |
A cada 12 horas |
|
20 a 39 |
125 mg |
A cada 24 horas |
|
|
< 20 |
125 mg |
A cada 24 horas |
|
|
HD* |
125 mg |
Após cada diálise28 |
|
|
Supressão do Herpes genital recorrente |
? 40 |
250 mg |
A cada 12 horas |
|
20 a 39 |
125 mg |
A cada 12 horas |
|
|
< 20 |
125 mg |
A cada 24 horas |
|
|
HD* |
125 mg |
Após cada diálise28 |
|
|
Herpes genital ou orolabial recorrente em pacientes infectados pelo HIV25 |
? 40 |
500 mg |
A cada 12 horas |
|
20 a 39 |
500 mg |
A cada 24 horas |
|
|
< 20 |
250 mg |
A cada 24 horas |
|
|
HD* |
250 mg |
Após cada diálise28 |
* Hemodiálise29
Uso Pediátrico: Atualmente, os dados sobre a segurança e eficácia de fanciclovir em crianças com menos de 18 anos são insuficientes e, portanto, o seu uso em crianças não é recomendado.
Pacientes Idosos: Não são necessários ajustes de dosagens, a menos que a função renal14 esteja comprometida.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento. Não interrompa o tratamento sem o conhecimento do seu médico.
Este medicamento não deve ser partido, aberto ou mastigado.
O QUE DEVO FAZER QUANDO EU ME ESQUECER DE USAR ESTE MEDICAMENTO?
Tome a dose assim que se lembrar dela. Entretanto, se estiver próximo o horário da dose seguinte, salte a dose esquecida e continue o tratamento conforme prescrito. Não utilize o dobro da dose para compensar uma dose esquecida.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
QUAIS OS MALES QUE ESTE MEDICAMENTO PODE ME CAUSAR?
O fanciclovir foi bem tolerado em estudos realizados no homem. Cefaleia30 e náusea31 foram relatadas em estudos clínicos. Estas reações foram de natureza leve a moderada e ocorreram com incidência32 similar em pacientes recebendo tratamento com placebo33.
Reação muito comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento): transtorno de cefaleia30 (dor de cabeça34).
Reações incomuns (ocorrem entre 0,1% e 1% dos pacientes que utilizam este medicamento): diarreia35, tonturas36, fadiga37 (fraqueza), flatulência (gases), irritação gastrintestinal, náuseas38, parestesia39 (sensações cutâneas40 como frio e calor), prurido41 de pele42 (coceira intensa), pele42 Rash43 (vermelhidão na pele42).
Reações raras (ocorrem entre 0,01% e 0,1% dos pacientes que utilizam este medicamento): testes de função hepática44 anormal, sonolência (sono), dismenorreia45 (falta de memória), eritema multiforme46 (reação imunológica das mucosas47 e da pele42), alucinações48, hiperbilirrubinemia (aumento da bilirrubina49), disfunções cognitivas (dificuldade de pensar/concentrar), icterícia50 (coloração amarelada de pele42 e mucosas47), leucopenia51 (diminuição de glóbulos brancos do sangue52), enxaqueca53, desordem neutropênica, síndrome de Stevens-Johnson54 (bolhas de coloração avermelhada), síndrome55 trombocitopênica (diminuição do número das plaquetas56 no sangue52), necrólise epidérmica tóxica57 (doença demartológicas), urticária58 (coceira), vômitos59.
Informe ao seu médico, cirurgião-dentista ou farmacêutico o aparecimento de reações indesejáveis pelo uso do medicamento. Informe também à empresa através do seu Serviço de Atendimento.
O QUE FAZER SE ALGUÉM USAR UMA QUANTIDADE MAIOR DO QUE A INDICADA DESTE MEDICAMENTO?
Não há relatos de superdosagem aguda com fanciclovir. Tratamento sintomático60 e de suporte devem ser administrados, se apropriado. Insuficiência renal26 aguda foi relatada raramente em pacientes com doença renal14 latente, onde a dose de fanciclovir não foi apropriadamente reduzida para o nível da função renal14.
Caso seja ingerida uma quantidade maior do que a indicada, procure um centro de intoxicação ou uma emergência61 imediatamente.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
DIZERES LEGAIS
VENDA SOB PRESCRIÇÃO MÉDICA
Reg. MS nº 1.1637.0035
Farm. Resp.: Satoro Tabuchi - CRF-SP n° 4.931
Registrado por:
Blau Farmacêutica S.A.
CNPJ 58.430.828/0001-60
Rodovia Raposo Tavares 30,5 km n° 2833 – Prédio 100
CEP 06705-030 – Cotia – SP
Indústria Brasileira
Fabricado por:
Blau Farmacêutica S.A.
CNPJ 58.430.828/0002-40
Av. Ivo Mario Isaac Pires nº 7.602
CEP: 06720-480 – Cotia –SP
Indústria Brasileira
SAC 0800 701 6399