

Natrecor
JANSSEN- CILAG FARMACÊUTICA LTDA.
Natrecor®
Informações ao Paciente
nesiritida peptídeo natriurético do tipo B humano recombinante (BNPh)Pó liófilo para infusão intravenosa
Forma Farmacêutica e apresentação
Pó liófilo injetável em frasco-ampola de uso único. Embalagem contendo 1, 2 e 3 frascos.
Uso intravenoso
Uso adulto
Informações Gerais
Marca Comercial: Natrecor®Princípio Ativo: nesiritida
Composição
Cada frasco-ampola contém 1,5 mg de nesiritida (1,58 mg de citrato de BNPh). Excipientes: ácido cítrico monoidratado, citrato de sódio diidratado e manitol.Como este medicamento funciona?
O BNPh suprime o sistema renina-angiotensina-aldosterona e tem efeitos natriuréticos e diuréticos1. Em estudos realizados em seres humanos, a nesiritida produziu reduções dose-dependentes da pressão capilar2 pulmonar em cunha (PCP) e da pressão arterial3 sistêmica em pacientes com insuficiência cardíaca4.Por que este medicamento foi indicado?
Natrecor® é indicado para o tratamento de pacientes com insuficiência cardíaca4 agudamente descompensada que apresentem dispnéia5 em repouso ou aos mínimos esforços. Nesta população, o uso de Natrecor® reduziu a pressão capilar2 pulmonar em cunha e melhorou a dispnéia5. Natrecor® deve ser utilizado como terapia adicional nas situações em que a terapia convencional6 como, por exemplo: diuréticos1 e nitratos, não for suficiente, e onde o suporte vasodilatador for necessário.Quando não devo usar este medicamento?
Contra-indicaçõesNatrecor® é contra-indicado em pacientes que apresentam hipersensibilidade a qualquer um de seus componentes. Natrecor® não deve ser usado como tratamento primário em pacientes com choque7 cardiogênico ou em pacientes com pressão arterial sistólica8 < 90 mmHg ao início do tratamento.
Advertências
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica.
Natrecor® deve ter seu emprego restrito a pacientes com insuficiência cardíaca4 descompensada, com dispnéia5 de repouso (classe IV NYHA) e congestão pulmonar ou sistêmica, admitidos em unidades de terapia intensiva9 ou semi-intensiva, que disponham de monitorização não invasiva ou invasiva da pressão arterial3.
Natrecor® não deve ser utilizado para substituir diuréticos1.
Natrecor® não deve ser utilizado:
a. Com o objetivo de melhorar a função renal10.
b. Com o objetivo de aumentar a diurese11.
Natrecor® não deve ser utilizado em infusão intermitente12 agendada eletivamente.
A administração parenteral de fármacos protéicos ou derivados da E.coli deve ser acompanhada de precauções apropriadas para o caso de uma reação alérgica13 ou inesperada.
A administração de Natrecor® deve ser evitada em pacientes com suspeita, ou que apresentem baixa pressão de enchimento cardíaco.
Natrecor® não é recomendado em pacientes para os quais agentes vasodilatadores não sejam apropriados, tais como, pacientes com estenose14 valvar significativa, cardiomiopatia restritiva ou obstrutiva, pericardite15 constritiva, tamponamento pericárdico ou outras condições em que o débito cardíaco16 seja dependente do retorno venoso17, ou para pacientes18 com suspeita de ter baixas pressões de enchimento cardíaco.
Cardiovascular
Natrecor® pode causar hipotensão19. Em amplo estudo duplo-cego20, controlado, pacientes que receberam a dose recomendada com ou sem ajuste da mesma, a incidência21 de hipotensão19 sintomática22 nas primeiras 24 horas foi similar para Natrecor® (4%) e para nitroglicerina EV (5%). Quando a hipotensão19 ocorreu, a duração da hipotensão19 sintomática22 foi maior com Natrecor® (média de 2,2 horas) do que com a nitroglicerina (média de 0,7 horas).
Em outro estudo clínico controlado, quando Natrecor® foi iniciado em doses maiores que a recomendada (0,015 e 0,03 mcg/Kg/min precedido de pequeno bolus23), existiram mais episódios de hipotensão19 de intensidade e duração maiores.
A taxa de hipotensão19 sintomática22 pode ser aumentada nos pacientes com pressão arterial3 < 100 mmHg na condição de base e Natrecor® deve ser usado com cautela nestes pacientes.
O potencial para hipotensão19 pode ser aumentado com a combinação de Natrecor® a outros medicamentos que possam causar hipotensão19 (como, por exemplo, inibidores da ECA) ou pelo início da administração em doses maiores que a dose recomendada (vide Posologia).
Natrecor® deve ser administrado apenas em ambientes nos quais a pressão sangüínea24 pode ser cuidadosamente monitorada, e a dose de Natrecor® deve ser reduzida ou descontinuada em pacientes que desenvolvam hipotensão19.
Renal10
Natrecor® pode afetar a função renal10 em indivíduos suscetíveis. Em pacientes com insuficiência cardíaca4 grave cuja função renal10 possa depender da atividade do sistema renina-angiotensina-aldosterona, o tratamento com Natrecor® pode estar associado ao aumento da creatinina25 sérica. Quando Natrecor® foi iniciado em doses maiores que as recomendadas, houve uma maior taxa de elevação da creatinina25 sérica sobre valores basais, embora a taxa de insuficiência renal26 aguda e a necessidade de diálise27 não tenham aumentado. No trigésimo dia do período de acompanhamento, em um grande estudo duplo-cego20 controlado, 2% (5/216 pacientes) no grupo de nitroglicerina EV e 3% (9/273 pacientes) no grupo de Natrecor® necessitaram de diálise27 pela primeira vez.
Gravidez28 (Categoria C) e Lactação29
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica.
Gravidez28: Não foi relatado até o momento se Natrecor® causa danos fetais quando administrado a mulheres grávidas. Um estudo de desenvolvimento de toxicidade30 reprodutiva foi conduzido em coelhas prenhas utilizando doses de 1440 mcg/Kg/dia administrada por infusão constante durante 13 dias. Considerando esse nível de exposição (baseado na AUC31, aproximadamente 500 vezes o valor em relação a dose recomendada para exposição humana). Não foram observados eventos adversos seja nos recém-nascidos ou durante o desenvolvimento fetal. Natrecor® deve ser usado durante a gravidez28 somente se os benefícios potenciais justificarem os possíveis riscos ao feto32.
Amamentação33: Não se sabe até o momento se o medicamento é excretado no leite materno. Portanto, deve-se ter cautela quando Natrecor® for administrado a mulheres que estejam amamentando.
Efeitos sobre a capacidade de dirigir veículos e operar máquinas
Não aplicável.
Como devo usar este medicamento?
Natrecor® é um pó liofilizado34 branco a quase branco, para administração intravenosa após a reconstituição. Natrecor® deve ser administrado exclusivamente pela via intravenosa. Existem poucas experiências da administração de Natrecor® por mais de 48 horas. A pressão sangüínea24 deve ser monitorada durante a administração de Natrecor® .Onde e como devo guardar este medicamento?
Conserve sob refrigeração (2°C a 8°C). Proteger da luz. Não congelar.TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS.
Uso em idosos, crianças e outros grupos de risco
Não há recomendações especiais de ajustes de doses para o uso de Natrecor® em pacientes idosos (> 65 anos) ou portadores de insuficiência renal26 ou hepática35. A segurança e a eficácia da nesiritida não foram estabelecidas em crianças (< 18 anos).Precauções
Natrecor® deve ser administrado exclusivamente pela via intravenosa, após a reconstituição. A solução reconstituída deve ser utilizada dentro de 24 horas.
Ingestão concomitante com outras substâncias:
Não foram conduzidos estudos específicos para avaliar o potencial de interações medicamentosas de Natrecor® . Não foram detectadas interações medicamentosas nos estudos, exceto por um aumento da hipotensão19 sintomática22 nos pacientes que receberam inibidores da ECA via oral.
Durante os estudos clínicos, Natrecor® foi administrado concomitantemente com outros medicamentos, incluindo: diuréticos1, digoxina, inibidores VO da ECA, anticoagulantes36, nitratos VO, HMG-CoA inibidores da redutase, agentes antiarrítmicos da classe III, betabloqueadores, dobutamina, bloqueadores do canal de cálcio, antagonistas de receptor de angiotensina II e dopamina37. Embora interações farmacocinéticas não tenham sido especificamente avaliadas, não parece haver evidência sugerindo qualquer interação farmacocinética clinicamente significante.
A segurança e a eficácia de Natrecor® não foram estabelecidas em crianças (< 18 anos).
Informe ao médico o aparecimento de reações indesejáveis.
Informe ao médico se você está fazendo uso de algum outro medicamento.
Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde38.
Posologia
A dose recomendada de Natrecor® é 2 mcg/Kg em bolus23 intravenoso, seguido por infusão contínua de 0,01 mcg/kg/min. Natrecor® não deve ser iniciado em dose acima da dose recomendada. (Veja instruções no item Modo de Usar) Se ocorrer hipotensão19 durante a administração, a dose de Natrecor® deve ser reduzida ou a administração deve ser interrompida e outras medidas para manter a pressão arterial3 devem ser adotadas (alterações na posição corporal, fluidos EV). Em estudos clínicos, Natrecor® foi descontinuado quando ocorreu hipotensão19 sintomática22 e pôde ser reiniciado em uma dose reduzida em 30% (sem administração em bolus23) uma vez que o paciente estivesse estabilizado. Devido à hipotensão19 causada por Natrecor® poder se prolongar (média de 2,2 horas, em um grande estudo duplo-cego20 controlado) um período de observação pode ser necessário antes de se reiniciar seu uso.Ajuste de dose
A hipotensão19 é o evento adverso limitante da dose de Natrecor® . Não inicie a administração de Natrecor® com doses superiores à dose em bolus23 recomendada de 2 mcg/Kg seguida de infusão de 0,01 mcg/Kg/min. Existe limitada experiência, em estudos clínicos, com o aumento da dose de Natrecor® acima da dose recomendada (23 pacientes, todos com monitoramento hemodinâmico central). Nestes pacientes, a infusão de Natrecor® foi aumentada em 0,005 mcg/Kg/min (precedido de bolus23 de 1mcg/Kg), não mais freqüente do que a cada 3 horas, até uma dose máxima de 0,03 mcg/Kg/min. Natrecor® não deve ser titulado em intervalos mais freqüentes.
Pacientes pediátricos (<18 anos)
A segurança e a eficácia de Natrecor® não foram estabelecidas em crianças.
Pacientes idosos (>65 anos)
Não é necessário ajustar a dose de Natrecor® para esta população de pacientes.
Pacientes com insuficiência renal26
Não é necessário ajustar a dose de Natrecor® para esta população de pacientes.
Pacientes com insuficiência hepática39
Não é necessário ajustar a dose de Natrecor® para esta população de pacientes.
Modo de usar
SOMENTE PARA USO INTRAVENOSO
Preparação para injeção40 em bolus23 ou infusão EV
Natrecor® para administração em bolus23 deve ser extraído da bolsa preparada de infusão.
1- Reconstitua um frasco de Natrecor® adicionando 5 mL de diluente retirado de uma bolsa plástica preenchida com 250 mL de solução para administração EV sem conservantes, tais como: soro41 glicosado 5%; cloreto de sódio 0,9%; soro41 glicosado 5% e cloreto de sódio 0,45% ou soro41 glicosado 5% e cloreto de sódio 0,2%.
2- Não agite o frasco. Gire o frasco cuidadosamente até que todas as superfícies, incluindo a tampa, entrem em contato com o diluente permitindo a completa reconstituição do conteúdo. Use apenas se a solução estiver límpida e incolor.
3- Retire todo conteúdo reconstituído do frasco de Natrecor® e o adicione a uma bolsa com 250 mL de diluente. A bolsa de infusão deverá ser invertida várias vezes para assegurar uma completa mistura da solução. Isto fornecerá uma solução com concentração aproximada de 6 mcg/mL de nesiritida.
4- Inspecione visualmente a solução para verificar a existência de partículas ou descoloração. USAR A SOLUÇÃO RECONSTITUÍDA DENTRO DE 24 HORAS.
5- Prepare o equipo que será utilizado para a infusão com 5 mL da solução preparada, antes de conectar ao acesso vascular42 do paciente e antes de administrar o bolus23 ou de iniciar a infusão.
Administração da injeção40 em bolus23 e da infusão EV
Os dois passos seguintes descrevem a administração da dose recomendada de Natrecor® :
Administração Intravenosa do bolus23
Retire o volume do bolus23 (Tabela 1) da solução de infusão de Natrecor® e administre-o durante aproximadamente 60 segundos através de um acesso intravenoso.
Volume do Bolus23 (mL) = Peso do Paciente (Kg)/3
| Tabela 1: Volume do bolus23 do Natrecor® Ajustado pelo Peso Corporal, Administrado Durante 60 Segundos (Concentração Final = 6 mcg/mL) | |
| Peso do paciente (kg) | Volume do bolus23 (mL) |
| 60 | 20,0 |
| 70 | 23,3 |
| 80 | 26,7 |
| 90 | 30,0 |
| 100 | 33,3 |
| 110 | 36,7 |
Imediatamente após a administração do bolus23, inicie a infusão de Natrecor® na velocidade de 0,1 mL/Kg/h, o que irá fornecer uma dose de infusão de 0,01 mcg/kg/min. Para calcular a velocidade da taxa de infusão paraofertar uma dose de 0,01 mcg/Kg/min, use a fórmula abaixo (Tabela 2).
Taxa de velocidade de infusão ajustada pelo peso:
Velocidade de Infusão (mL/hora) = Peso do Paciente (Kg) x 0,1
| Tabela 2: Velocidade de Infusão de Natrecor® Ajustada pelo Peso Corporal, para uma Dose de 0,01 mcg/Kg/min, depois do bolus23 (Concentração Final = 6 mcg/mL) | |
| Peso do paciente (Kg) | Taxa de Fluxo de Infusão (mL/h) |
| 60 | 6 |
| 70 | 7 |
| 80 | 8 |
| 90 | 9 |
| 100 | 10 |
| 110 | 11 |
Interações
O conservante metabissulfito de sódio é incompatível com Natrecor® . Assim, medicamentos injetáveis que contenham o metabissulfito de sódio não devem ser administrados na mesma via de infusão de Natrecor® .
A nesiritida é fisicamente e/ou quimicamente incompatível com formulações injetáveis de heparina, insulina43, etacrinato de sódio, bumetanida, enalaprilato, hidralazina e furosemida. Estes fármacos não devem ser administrados concomitantemente em infusão com Natrecor® em um mesmo cateter intravenoso.
Natrecor® liga-se à heparina e, portanto, pode ligar-se à superfície heparinizada de um cateter, diminuindo a quantidade de nesiritida ofertada ao paciente durante algum tempo. Portanto, Natrecor® não deve ser administrado através de um cateter heparinizado, ou cateter de múltiplas vias contendo heparina em qualquer uma delas. A administração concomitante de heparina em infusão em um cateter separado é aceitável. A administração concomitante de heparina e Natrecor® na mesma veia não é aceitável.
O cateter deve ser lavado entre a administração de Natrecor® e o uso de drogas incompatíveis.
Medicamentos parenterais devem ser inspecionados antes da administração para a verificação de existência de partículas ou descoloração, sempre que o frasco permita.
Siga a orientação do seu médico, respeitando sempre os horários, as doses e a duração do tratamento.
Não interrompa o tratamento sem o conhecimento do seu médico.
Não use o medicamento com o prazo de validade vencido. Antes de usar observe o aspecto do medicamento.
Reaçõe adversas
Atenção: este é um medicamento novo e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis para comercialização, efeitos indesejáveis e não conhecidos podem ocorrer. Neste caso, informe seu médico.Experiência de estudos clínicos
As reações adversas que ocorreram com freqüência de pelo menos 3% durante as primeiras 24 horas de infusão de Natrecor® estão na Tabela 3.
Tabela 3: Reações adversas relatadas com freqüência = 3% durante as primeiras 24 horas após o início da infusão em estudos clínicos controlados de Natrecor®
| Reações adversas | Amplo estudo duplo-cego20 controlado | Outros estudos de infusão prolongada*** | |||
| Nitroglicerina EV (n=216) | Natrecor® Dose recomendada* (n=273) | (n=256) | Natrecor® mcg/kg/min | ||
| 0,015 (n=253) | 0,03 (n=246) | ||||
| Cardiovascular | |||||
| Hipotensão19 | 12% | 11% | 8% | 22% | 35% |
| Hipotensão19 sintomática22 | 5% | 4% | 3% | 11% | 17% |
| Hipotensão19 assintomática | 8% | 8% | 5% | 12% | 20% |
| Bradicardia44 | < 1% | 1% | < 1% | 3% | 5% |
| Organismo como um todo | |||||
| Cefaléia45 | 20% | 8% | 9% | 9% | 7% |
| Sistema nervoso | |||||
| Tontura46 | 2% | 3% | 3% | 6% | 5% |
| Sistema digestivo | |||||
| Náusea47 | 6% | 4% | 5% | 9% | 13% |
| Vômito48 | 2% | 1% | 1% | 2% | 4% |
* inclui ajuste de dose em 23 pacientes como descrito no item posologia
** inclui dobutamina, milrinona, nitroglicerina, placebo49, dopamina37, nitroprussiato ou amrinona
***estudos em que Natrecor® foi administrado em infusão contínua por 24 horas
As reações adversas que não estão descritas na tabela acima, e que ocorreram em pelo menos 1% dos pacientes que receberam qualquer das doses de Natrecor® mencionadas acima foram: aumento da creatinina25, sudorese50, prurido51 e rash52.
Exames laboratoriais
A elevação da creatinina25 sérica > 0,5 mg/dL53 (44,2 µmol/L) acima da linha de base em qualquer período foi de 28% nos pacientes tratados com Natrecor® vs 21% no grupo de pacientes tratados com nitroglicerina EV (sem diferença estatística).
Efeito na mortalidade54
Natrecor® não foi avaliado em estudo concebido ou com poder estatístico para avaliar a mortalidade54 com desfecho primário ou secundário grave.
Um grande estudo duplo-cego20 controlado incluiu 273 pacientes recebendo Natrecor® e 216 pacientes recebendo nitroglicerina EV. A taxa de mortalidade54 em trinta dias por qualquer causa não foi significativamente diferente entre Natrecor® e o controle, e foi de 8,1% no braço de Natrecor® e de 5,1% no braço da nitroglicerina (risco relativo de 1,56 [95% IC: 0,75-3,24]). A taxa de mortalidade54 em seis meses em pacientes recebendo Natrecor® ou nitroglicerina foi de 25,1% e 20,8% respectivamente (risco relativo de 1,22 [95% IC: 0,83-1,79]).
Em uma análise agrupada de estudos clínicos adequados e bem controlados, não foi observada nenhuma diferença estatística significante em trinta dias (7 estudos), quando a mortalidade54 de qualquer causa com Natrecor® foi comparada com o tratamento controle (risco relativo de 30 dias 1,34 [95% IC: 0,85-2,11]). Dos 1059 pacientes tratados com Natrecor® nestes 7 estudos, 58 morreram em 30 dias por diferentes causas (estimativa de Kaplan-Meier de 5,5%) enquanto ocorreram 28 mortes dos 658 pacientes do controle (estimativa de Kaplan-Meier de 4,3%).
Não há diferença estatística significante na mortalidade54 por qualquer causa nos 5 estudos em que dados de mortalidade54 foram coletados no dia 180 (risco relativo de 180 dias 1,08 [95% IC: 0,85-1,37]). No centésimo octogésimo dia de acompanhamento (5 estudos), 178/844 pacientes tratados com Natrecor® (estimativa de Kaplan-Meier de 21,5%) e 114/560 pacientes controle (estimativa Kaplan-Meier de 20,7%) morreram por diferentes causas.
Ocorreram poucas mortes nestes estudos, assim os limites de confiança ao redor das taxas de risco foram amplos. Os estudos foram pequenos e alguns potenciais e importantes desequilíbrios entre os grupos de tratamento ao início do estudo podem ter gerado efeitos cujas implicações são desconhecidas.
Experiência pós-comercialização
Adicionalmente aos dados dos estudos clínicos de segurança anteriormente mencionados, relatos espontâneos de reações adversas provenientes da experiência pós-comercialização mundial de Natrecor® estão listados abaixo. As reações adversas estão classificadas pela frequência usando a seguinte convenção:
| Muito Comum | (>1/10) |
| Comum | (>1/100, <1/10) |
| Incomum | (>1/1000, <1/100) |
| Raro | (>1/10000, <1/1000) |
| Muito raro | (<1/10000), incluindo relatos isolados. |
Relatos espontâneos de reações adversas na experiência pós-comercialização incluem:
Distúrbios do sistema imunológico55: muito raro – reações de hipersensibilidade.
Conduta em caso de superdose
A superdose reportada primariamente para o tratamento com Natrecor® foi decorrente de uma dose mal calculada ou um erro como um mal funcionamento da bomba de infusão ou de uma programação incorreta da mesma bomba. O evento adverso relatado com mais frequência na superdose de Natrecor® é a hipotensão19, a qual pode ser assintomática e muitas vezes controlada com a suspensão da medicação, embora, em alguns casos ela pode persistir por muitas horas após essa suspensão. O tratamento da superdose de Natrecor® deve incluir a interrupção do tratamento e a administração de medidas de suporte.Informações Técnicas aos Profissionais de Saúde38
nesiritida peptídeo natriurético do tipo B humano recombinante (BNPh)Pó liófilo para infusão intravenosa
Forma Farmacêutica e apresentação
Pó liófilo injetável em frasco-ampola de uso único. Embalagem contendo 1, 2 e 3 frascos.
Uso intravenoso
Uso adulto
Informações Gerais
Marca Comercial: Natrecor®Princípio Ativo: nesiritida
Composição
Cada frasco-ampola contém 1,5 mg de nesiritida (1,58 mg de citrato de BNPh). Excipientes: ácido cítrico monoidratado, citrato de sódio diidratado e manitol.Caracterêsticas Farmacolígicas
A nesiritida é um peptídeo recombinante natriurético do tipo B humano (BNPh) produzido pela E. coli através da utilização de tecnologia de DNA recombinante. A nesiritida possui a mesma seqüência de 32 aminoácidos do peptídeo endógeno, que é produzido pelo ventrículo miocárdico.Mecanismo de Ação
O BNP humano (BNPh) é secretado pelo ventrículo miocárdico em resposta ao esforço e existe em diversas isoformas no corpo humano56. Níveis elevados de BNP foram associados à insuficiência cardíaca4 avançada e são considerados como mecanismo de compensação nesta doença. O BNPh circulante pode possuir menor bioatividade do que a nesiritida. O BNP humano exerce seus efeitos na vasculatura, no coração57 e rins58. O BNPh liga-se ao receptor particulado guanilato ciclase do músculo liso vascular59 e células60 endoteliais, levando ao aumento das concentrações intracelulares de monofosfato de guanosina 3’5’ cíclico (GMPc) e relaxamento das células60 do músculo liso61. O GMP cíclico serve como um segundo mensageiro para dilatar veias62 e artérias63. A nesiritida demonstrou relaxar preparações isoladas dos tecidos arterial e venoso humano que foram pré-contraídas pela endotelina-1 ou pelo agonista64 alfa-adrenérgico65, fenilefrina. O BNPh também suprime o sistema renina-angiotensina-aldosterona e tem efeitos natriuréticos e diuréticos1.
Efeitos farmacodinâmicos
A nesiritida produz reduções dose-dependentes na pressão capilar2 pulmonar em cunha (PCP) e na pressão arterial3 sistêmica em pacientes com insuficiência cardíaca4.
Com o esquema posológico recomendado 60% do efeito de 3 horas na redução da PCP, é obtido dentro de 15 minutos após o bolus23, atingindo 95% do efeito de 3 horas na 1a hora de uso da medicação. Aproximadamente 70% do efeito da redução da pressão arterial sistólica8 (PAs), de 3 horas, é alcançado dentro dos mesmos 15 minutos. A meia-vida farmacodinâmica de surgimento e desaparecimento do efeito hemodinâmico de Natrecor® é maior do que a meia-vida farmacocinética de 18 minutos poderia pressupor. Por exemplo, em pacientes que desenvolveram hipotensão19 sintomática22, metade da recuperação da pressão arterial sistólica8 para o valor da condição basal foi observada após 60 minutos da descontinuação ou redução da dose de Natrecor® . Quando ocorreu a infusão de doses maiores de Natrecor® , a duração da hipotensão19 foi de várias horas em alguns casos. Após a descontinuação de Natrecor® , a PCP a valores dentro de 10% da condição basal em 2 horas, sem efeito rebote da PCP para níveis acima do estado basal. Não há evidência de taquifilaxia para os efeitos hemodinâmicos de Natrecor® .
Farmacocinética
Distribuição
Em pacientes com insuficiência cardíaca4 Natrecor® administrado por via endovenosa (EV) na forma de infusão ou bolus23, exibiu um comportamento bifásico no plasma66 com volume médio de distribuição no estado de equilíbrio de 0,19 L/Kg.
Eliminação
A meia-vida de eliminação terminal média da nesiritida é de aproximadamente 18 minutos. O clearance médio é de aproximadamente 9,2 mL/min/Kg.
A nesiritida é eliminada da circulação67 de maneira similar ao clearence endógeno do BNP através de três mecanismos independentes: ligação a receptores de clearance da superfície celular com subsequente internalização celular e proteólise lisossomal; clivagem proteolítica do peptídeo pelas endopeptidases, tal como a endopeptidase neutra, que está presente na superfície do endotélio68 do lúmen69 vascular42; e filtração renal10.
A análise da farmacocinética mostrou que o clearance da nesiritida é proporcional ao peso corporal, suportando a posologia de Natrecor® ajustada em função do peso corpóreo (mcg/kg/min).
Farmacocinética em Populações Especiais
Insuficiência Renal26: Embora a nesiritida seja eliminada, em parte, pelo clearance renal10, os dados clínicos sugerem que não são necessários ajustes da posologia nos pacientes com insuficiência renal26. Os efeitos da nesiritida na pressão capilar2 pulmonar, índice cardíaco (IC) e pressão arterial sistólica8 (PAS) não foram significativamente diferentes nos pacientes com insuficiência renal26 crônica [creatinina25 sérica basal variando de 2 mg/dL53 (176,8 µmol/L) a 4,3 mg/dL53 (380,1µmol/L)] quando comparados aos pacientes com função renal10 normal.
Outros: O clearance não foi influenciado significativamente pela idade, sexo, raça/etnia, concentração de BNPh endógena basal, gravidade da insuficiência cardíaca4 (conforme indicada pela pressão capilar2 pulmonar basal, IC basal ou classificação da New York Heart Association [NYHA]), ou pela administração concomitante de um inibidor da ECA.
Resultados de Eficácia
Estudos Clínicos Em um grande estudo duplo-cego20 controlado com 489 pacientes (246 pacientes requerendo cateter cardíaco direito), que necessitaram de hospitalização para o tratamento da ICC agudamente descompensada, os efeitos de Natrecor® foram comparados ao placebo49 e à nitroglicerina EV quando associada ao tratamento de base (diuréticos1 EV e orais, medicamentos cardíacos não EV, dobutamina e dopamina37). Os pacientes com síndrome70 coronária - aguda, função sistólica preservada, arritmia71 e insuficiência renal26, não foram excluídos. Os desfechos primários do estudo foram: a alteração na PCP em cunha em relação à condição de base e a alteração na dispnéia5 em relação à condição de base, avaliada depois de três horas. A ocorrência e persistência de hipotensão19, quando observada, é relativamente mais longa com a administração de nesiritida (se comparada com a da nitroglicerina), foi também estudada.Natrecor® foi administrado em bolus23 de 2 mcg/Kg durante, aproximadamente, 60 segundos, seguido pela infusão contínua da dose fixa de 0,01 mcg/Kg/min. Após um período de 3 horas, controlado por placebo49, os pacientes recebendo placebo49 passaram a receber Natrecor® ou nitroglicerina de forma duplo-cega. A dose da nitroglicerina foi titulada a critério médico. Foi permitido aumentar a dose de Natrecor® (62 dos 124 pacientes) depois das 3 primeiras horas do tratamento se a PCP em cunha fosse ≥ 20 mmHg e a PAS fosse ≥ 100 mmHg, no subgrupo de pacientes tratados com o Natrecor® que estavam com monitoramento hemodinâmico central. Aumentos da dose (1 mcg/Kg em bolus23 seguidos por um aumento da dose de infusão em 0,005 mcg/Kg/min) foram permitidos a cada 3 horas, até uma dose máxima de 0,03 mcg/Kg/min. No geral, 23 pacientes deste subgrupo tiveram a dose do Natrecor® aumentada.
Em um estudo de dose-resposta duplo-cego, 127 pacientes que necessitaram hospitalização para IC sintomática22 foram randomizados para receber placebo49 ou uma das duas doses de Natrecor® (0,015 mcg/Kg/min precedidos por um bolus23 EV de 0,3 mcg/kg e 0,03 μg/kg/min precedidos por um bolus23 EV de 0,6 mcg/Kg). O desfecho primário do estudo foi a alteração na PCP em cunha comparada à condição basal até 6 horas. Os efeitos sobre os sintomas72 também foram avaliados.
Efeitos nos Sintomas72
Em um grande estudo duplo-cego20 controlado, os pacientes que receberam a dose recomendada de Natrecor® relataram uma maior melhora em sua dispnéia5 em 3 horas que os pacientes que receberam placebo49 (p = 0,034).
No estudo de dose-resposta duplo-cego, os pacientes que receberam as duas doses de Natrecor® (0,015 mcg/Kg/min precedida de administração EV em bolus23 de 0,3 mcg/Kg e 0,03 mcg/Kg/min precedida por administração EV em bolus23 de 0,6 mcg/ Kg) relataram melhora na dispnéia5 em 6 horas maior que os pacientes que receberam o placebo49 (p < 0,001).
Efeitos Hemodinâmicos
A pressão capilar2 pulmonar em cunha (PCP), a pressão atrial direita (PAD), o índice cardíaco (IC) e as outras variáveis hemodinâmicas foram monitoradas em 246 pacientes cateterizados de um estudo duplo-cego20 controlado. Houve uma redução na PCP em cunha média nos 15 minutos do início da infusão de Natrecor® , sendo que a maioria dos efeitos observados em 3 horas, foram atingidos nos primeiros 60 minutos da infusão.
A tabela e o gráfico abaixo resumem as alterações na PCP em cunha e em outras medidas durante as três primeiras horas.
| Alteração Hemodinâmica73 Média em Relação à Condição Basal | |||
| Efeito em 3 Horas | Placebo49 (n=62) | Nitroglicerina (n=60) | Natrecor® (n=124) |
| Pressão Capilar2 Pulmonar em cunha (mmHg) | -2,0 | -3,8 | -5,8‡ |
| Pressão Atrial Direita (mmHg) | 0,0 | -2,6 | -3,1‡ |
| Índice Cardíaco (L/min/M2) | 0,0 | 0,2 | 0,1 |
| Pressão Arterial Pulmonar Média (mmHg) | -1,1 | -2,5 | -5,4‡ |
| Resistência Vascular42 Sistêmica (dynes*seg*cm-5) | -44 | 105 | -144 |
| Pressão Arterial Sistólica† (mmHg) | -2,5 | -5,7‡ | -5,6‡ |
| † Baseado em todos os pacientes tratados: placebo49 n=142; nitroglicerina n=143; Natrecor® n=204. ‡ p<0,05 comparado com o placebo49. | |||
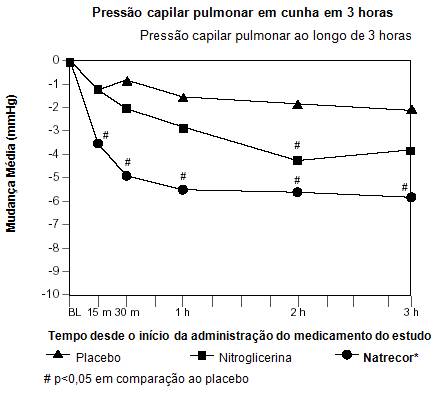
Este estudo não constitui uma comparação de eficácia adequada com a nitroglicerina. Neste estudo, o grupo nitroglicerina forneceu um padrão de tratamento em regime usual.
Depois da descontinuação de Natrecor® , a PCP em cunha retornou a menos de 10% do valor da condição basal em 2 horas, e não ocorreu aumento rebote para níveis acima dos observados no pré-tratamento. Não houve evidência de taquifilaxia aos efeitos hemodinâmicos de Natrecor® .
Efeito no Débito Urinário74
Em um grande estudo duplo cego20 controlado, no qual o uso de diuréticos1 não foi restringido, a alteração média no status de volume (débito menos crédito) durante as primeiras 24 horas nos grupos nitroglicerina e Natrecor® , foi semelhante: 1279 ± 1455 mL e 1257 ± 1657, respectivamente.
Indicações
Natrecor® é indicado para o tratamento de pacientes com insuficiência75 cardíacaagudamente descompensada que apresentem dispnéia5 em repouso ou aos mínimos esforços. Nesta população, o uso de Natrecor® reduziu a pressão capilar2 pulmonar em cunha e melhorou a dispnéia5. Natrecor® deve ser utilizado como terapia adicional nas situações em que a terapia convencional6 como, por exemplodiuréticos e nitratos, não for suficiente e onde o suporte vasodilatador for necessário.Contra Indicações
Natrecor® é contra-indicado em pacientes que apresentam hipersensibilidade a qualquer um de seus componentes. Natrecor® não deve ser usado como tratamento primário em pacientes com choque7 cardiogênico ou em pacientes com pressão arterial sistólica8 < 90 mmHg ao início do tratamento.Modo de usar e cuidados de conservação depois de aberto
SOMENTE PARA USO INTRAVENOSOPreparação para injeção40 em bolus23 ou infusão EV
Natrecor® para administração em bolus23 deve ser extraído da bolsa preparada de infusão.
1- Reconstitua um frasco de Natrecor® adicionando 5 mL de diluente retirado de uma bolsa plástica preenchida com 250 mL de solução para administração EV sem conservantes, tais como: soro41 glicosado 5%; cloreto de sódio 0,9%; soro41 glicosado 5% e cloreto de sódio 0,45% ou soro41 glicosado 5% e cloreto de sódio 0,2%.
2- Não agite o frasco. Gire o frasco cuidadosamente até que todas as superfícies, incluindo a tampa, entrem em contato com o diluente permitindo a completa reconstituição do conteúdo. Use apenas se a solução estiver límpida e incolor.
3- Retire todo conteúdo reconstituído do frasco de Natrecor® e o adicione a uma bolsa com 250 mL de diluente. A bolsa de infusão deverá ser invertida várias vezes para assegurar uma completa mistura da solução. Isto fornecerá uma solução com concentração aproximada de 6 mcg/mL de nesiritida.
4- Inspecione visualmente a solução para verificar a existência de partículas ou descoloração. USAR A SOLUÇÃO RECONSTITUÍDA DENTRO DE 24 HORAS.
5- Prepare o equipo que será utilizado para a infusão com 5 mL da solução preparada, antes de conectar ao acesso vascular42 do paciente e antes de administrar o bolus23 ou de iniciar a infusão.
Administração da injeção40 em bolus23 e da infusão EV
Os dois passos seguintes descrevem a administração da dose recomendada de Natrecor® :
Administração Intravenosa do bolus23
Retire o volume do bolus23 (Tabela 4) da solução de infusão de Natrecor® , e administre-o durante aproximadamente 60 segundos através de um acesso intravenoso.
Volume do Bolus23 (mL) = Peso do Paciente (kg)/3
| Tabela 4: Volume do bolus23 do Natrecor® Ajustado pelo Peso Corporal, Administrado Durante 60 Segundos (Concentração Final = 6 mcg/mL) | |
| Peso do paciente (kg) | Volume do bolus23 (mL) |
| 60 | 20,0 |
| 70 | 23,3 |
| 80 | 26,7 |
| 90 | 30,0 |
| 100 | 33,3 |
| 110 | 36,7 |
Imediatamente após a administração do bolus23, inicie a infusão de Natrecor® na velocidade de 0,1 mL/Kg/h, o que irá fornecer uma dose de infusão de 0,01 mcg/Kg/min.
Para calcular a velocidade da taxa de infusão para ofertar uma dose de 0,01 mcg/Kg/min, use a fórmula abaixo (Tabela 5).
Taxa de velocidade de infusão ajustada pelo peso:
Velocidade de Infusão (mL/hora) = Peso do Paciente (kg) x 0,1
| Tabela 5: Velocidade de Infusão de Natrecor® Ajustada pelo Peso Corporal, para uma Dose de 0,01 mcg/kg/min, depois do bolus23 (Concentração Final = 6 mcg/mL) | |
| Peso do paciente (kg) | Volume do bolus23 (mL) |
| 60 | 6 |
| 70 | 7 |
| 80 | 8 |
| 90 | 9 |
| 100 | 10 |
| 110 | 11 |
Interações
O conservante metabissulfito de sódio é incompatível com Natrecor® . Assim, medicamentos injetáveis que contenham o metabissulfito de sódio não devem ser administrados na mesma via de infusão de Natrecor® .
A nesiritida é fisicamente e/ou quimicamente incompatível com formulações injetáveis de heparina, insulina43, etacrinato de sódio, bumetanida, enalaprilato, hidralazina e furosemida. Estes fármacos não devem ser administrados concomitantemente em infusão com Natrecor® em um mesmo cateter intravenoso. O conservante metabissulfito de sódio é incompatível com nesiritida. Assim, medicamentos injetáveis que contenham o metabissulfito de sódio não devem ser administrados na mesma via de infusão do Natrecor® .
Natrecor® liga-se à heparina e, portanto, pode ligar-se à superfície heparinizada de um cateter, diminuindo a quantidade de nesiritida ofertada ao paciente durante algum tempo. Portanto, Natrecor® não deve ser administrado através de um cateter heparinizado ou cateteres de múltiplas vias contendo heparina em qualquer uma delas. A administração concomitante de heparina em infusão em um cateter separado é aceitável. A administração concomitante de heparina e Natrecor® na mesma veia não é aceitável.O cateter deve ser lavado entre a administração de Natrecor® e o uso de drogas incompatíveis. Medicamentos parenterais devem ser inspecionados antes da administração para a verificação de existência de partículas ou descoloração, sempre que o frasco permita.
Posologia
A dose recomendada de Natrecor® é 2 mcg/Kg em bolus23 intravenoso, seguido por infusão contínua de 0,01 mcg/kg/min. Natrecor® não deve ser iniciado em dose acima da dose recomendada. (Veja instruções no item Modo de Usar). Se ocorrer hipotensão19 durante a administração, a dose de Natrecor® deve ser reduzida ou a administração deve ser interrompida e outras medidas para manter a pressão arterial3 devem ser adotadas (alterações na posição corporal, fluidos EV).Em estudos clínicos, Natrecor® foi descontinuado quando ocorreu hipotensão19 sintomática22 e pôde ser reiniciado em uma dose reduzida em 30% (sem administração em bolus23) uma vez que o paciente estivesse estabilizado. Devido à hipotensão19 causada por Natrecor® poder se prolongar (média de 2,2 horas, em um grande estudo duplo-cego20 controlado) um período de observação pode ser necessário antes de se reiniciar seu uso.
Ajuste de dose
A hipotensão19 é o evento adverso limitante da dose de Natrecor® . Não inicie a administração de Natrecor® com doses superiores à dose em bolus23 recomendada de 2 mcg/Kg seguida de infusão de 0,01 mcg/Kg/min. Existe limitada experiência, em estudos clínicos, com o aumento da dose de Natrecor® acima da dose recomendada (23 pacientes, todos com monitoramento hemodinâmico central). Nestes pacientes, a infusão de Natrecor® foi aumentada em 0,005 mcg/Kg/ min (precedido de bolus23 de 1 mcg/Kg), não mais freqüente do que cada 3 horas, até uma dose máxima de 0,03 mcg/Kg/min. Natrecor® não deve ser titulado em intervalos mais frequentes.
Pacientes pediátricos (<18 anos)
A segurança e a eficácia de Natrecor® não foram estabelecidas em crianças.
Pacientes idosos (>65 anos)
Não é necessário ajustar a dose de Natrecor® para esta população de pacientes.
Pacientes com insuficiência renal26
Não é necessário ajustar a dose de Natrecor® para esta população de pacientes.
Pacientes com insuficiência hepática39
Não é necessário ajustar a dose de Natrecor® para esta população de pacientes.
Advertências
Natrecor® deve ter seu emprego restrito a pacientes com insuficiência cardíaca4 descompensada, com dispnéia5 de repouso (classe IV NYHA) e congestão pulmonar ou sistêmica, admitidos em unidades de terapia intensiva9 ou semi-intensiva, que disponham de monitorização não invasiva ou invasiva da pressão arterial3.Natrecor® não deve ser utilizado para substituir diuréticos1.
Natrecor® não deve ser utilizado:
a. Com o objetivo de melhorar a função renal10.
b. Com o objetivo de aumentar a diurese11.
Natrecor® não deve ser utilizado em infusão intermitente12 agendada eletivamente.
A administração parenteral de fármacos protéicos ou derivados da E.coli deve ser acompanhada de precauções apropriadas para o caso de uma reação alérgica13 ou inesperada.
A administração de Natrecor® deve ser evitada em pacientes com suspeita, ou que apresentem baixa pressão de enchimento cardíaco.
Natrecor® não é recomendado em pacientes para os quais agentes vasodilatadores não sejam apropriados, tais como pacientes com estenose14 valvar significativa, cardiomiopatia restritiva ou obstrutiva, pericardite15 constritiva, tamponamento pericárdico ou outras condições em que o débito cardíaco16 seja dependente do retorno venoso17, ou para pacientes18 com suspeita de ter baixas pressões de enchimento cardíaco.
Cardiovascular
Natrecor® pode causar hipotensão19.
Em amplo estudo duplo-cego20, controlado pacientes que receberam a dose recomendada com ou sem ajuste da mesma, a incidência21 de hipotensão19 sintomática22 nas primeiras 24 horas foi similar para Natrecor® (4%) e para nitroglicerina EV (5%). Quando a hipotensão19 ocorreu, a duração da hipotensão19 sintomática22 foi maior com Natrecor® (média de 2,2 horas) do que com a nitroglicerina (média de 0,7 horas).
Em outro estudo clínico controlado, quando Natrecor® foi iniciado em doses maiores que a recomendada (0,015 e 0,03 mcg/Kg/min precedido de pequeno bolus23), existiram mais episódios de hipotensão19 de intensidade e duração maiores.
A taxa de hipotensão19 sintomática22 pode ser aumentada nos pacientes com pressão arterial3 < 100 mmHg na condição de base e Natrecor® deve ser usado com cautela nestes pacientes. O potencial para hipotensão19 pode ser aumentado com a combinação de Natrecor® a outros medicamentos que possam causar hipotensão19 (como, por exemplo, inibidores da ECA) ou pelo início da administração em doses maiores que a dose recomendada (vide Posologia).
Natrecor® deve ser administrado apenas em ambientes nos quais a pressão sangüínea24 pode ser cuidadosamente monitorada, e a dose de Natrecor® deve ser reduzida ou descontinuada em pacientes que desenvolvam hipotensão19.
Renal10
Natrecor® pode afetar a função renal10 em indivíduos suscetíveis. Em pacientes com insuficiência cardíaca4 grave cuja função renal10 possa depender da atividade do sistema renina-angiotensina-aldosterona, o tratamento com Natrecor® pode estar associado ao aumento da creatinina25 sérica. Quando Natrecor® foi iniciado em doses maiores que as recomendadas, houve uma maior taxa de elevação da creatinina25 sérica sobre os valores basais, embora a taxa de insuficiência renal26 aguda e a necessidade de diálise27 não tenham aumentado. No trigésimo dia do período de acompanhamento, em um grande estudo duplo-cego20 controlado, 2% (5/216 pacientes) no grupo de nitroglicerina EV e 3% (9/273 pacientes) no grupo de Natrecor® necessitaram diálise27 pela primeira vez.
Gravidez28 (Categoria C) e Lactação29
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica.
Gravidez28: Não foi relatado até o momento se Natrecor® causa danos fetais quando administrado a mulheres grávidas. Um estudo de desenvolvimento de toxicidade30 reprodutiva foi conduzido em coelhas prenhas utilizando doses de 1440 mcg/Kg/dia administrada por infusão constante durante 13 dias. Considerando esse nível de exposição (baseado no AUC31, aproximadamente 500 vezes o valor em relação a dose recomendada para exposição humana). Não foram observados eventos adversos seja nos recém-nascidos ou durante o desenvolvimento fetal. Natrecor® deve ser usado durante a gravidez28 somente se os benefícios potenciais justificarem os possíveis riscos ao feto32.
Amamentação33: Não se sabe até o momento se o medicamento é excretado no leite materno. Portanto, deve-se ter cautela quando Natrecor® for administrado a mulheres que estejam amamentando.
Efeitos sobre a capacidade de dirigir veículos e operar máquinas
Não aplicável.
Uso em idosos, crianças e outros grupos de pessoas
Não há recomendações especiais de ajustes de doses para o uso de Natrecor® em pacientes idosos (> 65 anos) ou portadores de insuficiência renal26 ou hepática35. A segurança e a eficácia da nesiritida não foram estabelecidas em crianças (< 18 anos).Interações Medicamentosas
Não foram conduzidos estudos específicos para avaliar o potencial de interações medicamentosas de Natrecor® . Não foram detectadas interações medicamentosas nos estudos, exceto por um aumento da hipotensão19 sintomática22 nos pacientes que receberam inibidores da ECA via oral.Durante os estudos clínicos, Natrecor® foi administrado concomitantemente com outros medicamentos, incluindo: diuréticos1, digoxina, inibidores VO da ECA, anticoagulantes36, nitratos VO, HMG-CoA inibidores da redutase, agentes antiarrítmicos da classe III, betabloqueadores, dobutamina, bloqueadores do canal de cálcio, antagonistas de receptor de angiotensina II e dopamina37. Embora interações farmacocinéticas não tenham sido especificamente avaliadas, não parece haver evidência sugerindo qualquer interação farmacocinética clinicamente significante.
Reações Adversas a Medicamentos
Atenção: este é um medicamento novo e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis para comercialização, efeitos indesejáveis e não conhecidos podem ocorrer. Neste caso, informe seu médico.Experiência de estudos clínicos
As reações adversas que ocorreram com freqüência de pelo menos 3% durante as primeiras 24horas de infusão de Natrecor® estão na Tabela 6.
Tabela 6: Reações adversas relatadas com frequência = 3% durante as primeiras 24 horas após o início da infusão em estudos clínicos controlados de Natrecor®
| Reações adversas | Amplo estudo duplo-cego20 controlado | Outros estudos de infusão prolongada)*** | |||
| Nitroglicerina EV (n=216) | Natrecor® Dose recomendada* (n=273) | Natrecor® mcg/kg/min | |||
| 0,015 (n=253) | 0,03 (n=246) | ||||
| Cardiovascular | |||||
| Hipotensão19 | 12% | 11% | 8% | 22% | 35% |
| Hipotensão19 sintomática22 | 5% | 4% | 3% | 11% | 17% |
| Hipotensão19 assintomática | 8% | 8% | 5% | 12% | 20% |
| Bradicardia44 | < 1% | 1% | < 1% | 3% | 5% |
| Organismo como um todo | |||||
| Cefaléia45 | 20% | 8% | 9% | 9% | 7% |
| Sistema nervoso | |||||
| Tontura46 | 2% | 3% | 3% | 6% | 5% |
| Sistema digestivo | |||||
| Náusea47 | 6% | 4% | 5% | 9% | 13% |
| Vômito48 | 2% | 1% | 1% | 2% | 4% |
** inclui dobutamina, milrinona, nitroglicerina, placebo49, dopamina37, nitroprussiato ou amrinona
***estudos em que Natrecor® foi administrado em infusão contínua por 24 horas
As reações adversas que não estão descritas na tabela acima, e que ocorreram em pelo menos 1% dos pacientes que receberam qualquer das doses de Natrecor® mencionadas acima foram: aumento da creatinina25, sudorese50, prurido51 e rash52.
Exames laboratoriais
A elevação da creatinina25 sérica > 0,5 mg/dL53 (44,2 µmol/L) acima da linha de base em qualquer período foi de 28% nos pacientes tratados com Natrecor® vs 21% no grupo de pacientes tratados com nitroglicerina EV (sem diferença estatística).
Efeito na mortalidade54
Natrecor® não foi avaliado em estudo concebido ou com poder estatístico para avaliar a mortalidade54 com desfecho primário ou secundário grave.
Um grande estudo duplo-cego20 controlado incluiu 273 pacientes recebendo Natrecor® e 216 pacientes recebendo nitroglicerina EV. A taxa de mortalidade54 em trinta dias por qualquer causa não foi significativamente diferente entre Natrecor® e o controle, e foi de 8,1% no braço de Natrecor® e de 5,1% no braço da nitroglicerina (risco relativo de 1,56 [95% IC: 0,75-3,24]). A taxa de mortalidade54 em seis meses em pacientes recebendo Natrecor® ou nitroglicerina foi de 25,1% e 20,8%, respectivamente (risco relativo de 1,22 [95% IC: 0,83-1,79]).
Em uma análise agrupada de estudos clínicos adequados e bem controlados, não foi observada nenhuma diferença estatística significante em trinta dias (7 estudos), quando a mortalidade54 de qualquer causa com Natrecor® foi comparada com o tratamento controle (risco relativo de 30 dias de 1,34 [95% IC: 0,85-2,11]). Dos 1059 pacientes tratados com Natrecor® nestes 7 estudos, 58 morreram em 30 dias por diferentes causas (estimativa Kaplan-Meier de 5,5%) enquanto ocorreram 28 mortes dos 658 pacientes do controle (estimativa Kaplan-Meier de 4,3%).
Não há diferença estatística significante na mortalidade54 por qualquer causa nos 5 estudos em que dados de mortalidade54 foram coletados no dia 180 (risco relativo de 180 dias 1,08 [95% IC: 0,85-1,37]). No centésimo octogésimo dia de acompanhamento (5 estudos), 178/844 pacientes tratados com Natrecor® (estimativa Kaplan-Meier de 21,5%) e 114/560 pacientes do controle (estimativa Kaplan-Meier de 20,7%) morreram por diferentes causas.
Ocorreram poucas mortes neste estudo, assim o limite de confiança ao redor da taxa de risco foi amplo. Os estudos foram pequenos e alguns potenciais e importantes desequilíbrios entre os grupos de tratamento ao início do estudo podem ter gerado efeitos cujas implicações são desconhecidas.
Dados de estudos pré-clínicos
Os dados não clínicos não revelam nenhum perigo especial para os seres humanos baseados em estudos convencionais de segurança farmacológica, toxicidade30 com dose sequencial, desenvolvimento de toxicidade30 reprodutiva e genotoxicidade.
Estudos de carcinogenicidade não foram conduzidos com nesiritida.
Experiência pós-comercialização
Adicionalmente aos dados dos estudos clínicos de segurança anteriormente mencionados, relatos espontâneos de reações adversas provenientes da experiência pós-comercialização mundial de Natrecor® estão listados abaixo. As reações adversas estão classificadas pela frequência usando a seguinte convenção:
| Muito Comum | (>1/10) |
| Comum | (>1/100, <1/10) |
| Incomum | (>1/1000, <1/100) |
| Raro | (>1/10000, <1/1000) |
| Muito raro | (<1/10000), incluindo relatos isolados. |
Relatos espontâneos de reações adversas na experiência pós-comercialização incluem:
Distúrbios do sistema imunológico55: muito raro – reações de hipersensibilidade
Superdose
A superdose reportada primariamente para o tratamento com Natrecor® foi decorrente de uma dose mal calculada ou um erro como um mal funcionamento da bomba de infusão ou de uma programação incorreta da mesma bomba. O evento adverso relatado com mais frequência na superdose de Natrecor® é a hipotensão19, a qual pode ser assintomática e muitas vezes controlada com a suspensão da medicação, embora, em alguns casos ela pode persistir por muitas horas após essa suspensão. O tratamento da superdose de Natrecor® deve incluir a interrupção do tratamento e a administração de medidas de suporte.Armazenagem
As embalagens de Natrecor* devem ser mantidas sob refrigeração (2°C a 8°C), protegidas da luz e não devem ser congeladas.Natrecor - Laboratório
JANSSEN- CILAG FARMACÊUTICA LTDA.
Rod. Presidente Dutra, km 154
São José dos Campos/SP
Tel: 08007011851
Ver outros medicamentos do laboratório "JANSSEN- CILAG FARMACÊUTICA LTDA."






