

Diprospan (Bula do profissional de saúde)
COSMED INDUSTRIA DE COSMETICOS E MEDICAMENTOS S.A.
IDENTIFICAÇÃO DO MEDICAMENTO
DIPROSPAN®
dipropionato de betametasona + fosfato dissódico de betametasona
Suspensão Injetável
APRESENTAÇÕES
Suspensão injetável
DIPROSPAN® - Suspensão injetável 5mg/mL + 2mg/mL em embalagem com uma ampola e seringa1 descartável esterilizada.
DIPROSPAN® - Suspensão injetável 5mg/mL + 2mg/mL conjunto HYPAK® descartável em embalagem com blister contendo: seringa1 com produto DIPROSPAN® e êmbolo2 de borracha esterilizados, agulha esterilizada e haste plástica.
VIA DE ADMINISTRAÇÃO: INJETÁVEL (INTRAMUSCULAR, INTRA-ARTICULAR, PERIARTICULAR, INTRABÚRSICA, INTRADÉRMICA, INTRALESIONAL3 E EM TECIDOS MOLES).
USO ADULTO E PEDIÁTRICO ACIMA DE 15 ANOS
COMPOSIÇÃO
Cada mL da suspensão injetável contém:
| dipropionato de betametasona (equivalente a 5mg de betametasona) | 6,43mg |
| fosfato dissódico de betametasona (equivalente a 2mg de betametasona) | 2,63mg |
| veículo q.s.p | 1mL |
(fosfato de sódio dibásico, cloreto de sódio, edetato dissódico, polissorbato 80, álcool benzílico, metilparabeno, propilparabeno, carmelose sódica, macrogol, ácido clorídrico4, água)
INFORMAÇÕES TÉCNICAS AOS PROFISSIONAIS DE SAÚDE5
INDICAÇÕES
DIPROSPAN® está indicado para o tratamento de doenças agudas e crônicas que respondem aos corticoides. A terapia hormonal com corticosteroide é coadjuvante6 e não substitui a terapêutica7 convencional.
DIPROSPAN® é indicado para os seguintes quadros clínicos:
Alterações osteomusculares e de tecidos moles: Artrite reumatoide8, osteoartrite9, bursite10, espondilite anquilosante, espondilite radiculite11, dor no cóccix12, ciática, lumbalgo, torcicolo13, exostose14, fascite.
Condições alérgicas: Asma15 brônquica crônica (inclusive terapia adjuvante para o estado de mal asmático), rinite16 alérgica devida a pólen, edema angioneurótico17, bronquite alérgica, rinite16 alérgica sazonal ou perene, hipersensibilidade à droga, doença do soro18, picadas de insetos.
Condições dermatológicas: Dermatite19 atópica, neurodermatite circunscrita (líquen simples crônico20), dermatite19 de contato, dermatite19 solar grave, urticária21, líquen plano hipertrófico, necrobiose lipoídica associada com diabetes mellitus22, alopecia areata23, lúpus24 eritematoso25 discoide, psoríase26, queloides, pênfigo, dermatite19 herpetiforme, acne27 cística.
Doenças do colágeno28: Lúpus24 eritematoso25 sistêmico29, esclerodermia, dermatomiosite, poliarterite nodosa.
Tumores Malignos: Para o tratamento paliativo30 de leucemias e linfomas em adultos, leucemia31 aguda da infância.
Outras condições: Síndrome32 adrenogenital, colite33 ulcerativa, ileíte34 regional, doença celíaca, afecções35 dos pés (bursite10, hallux36 rigidus, 5º dedo varo37), afecções35 necessitando de injeções subconjuntivais, transtornos hematológicos que respondem aos corticosteroides, síndrome nefrítica38 e síndrome nefrótica39.
A insuficiência40 adrenocortical primária ou secundária poderá ser tratada com DISPROPAN®, mas deverá haver suplementação41 com mineralocorticoides.
DISPROPAN® é recomendado para:
- injeções intramusculares para doenças que respondem aos corticoides sistêmicos42;
- injeções diretamente nos tecidos moles afetados, quando indicado;
- injeções intra-articulares e periarticulares em artrites;
- injeções intralesionais para várias condições dermatológicas e
- injeções locais para certos transtornos inflamatórios e císticos dos pés.
RESULTADOS DE EFICÁCIA
ASMA15
Jacyna e colaboradores realizaram um estudo aberto envolvendo 30 pacientes com asma15 brônquica. Os pacientes receberam doses intramusculares de 1 a 2 mL de DIPROSPAN® (5mg de dipropionato de betametasona mais 2 mg de fosfato de betametasona por mL) e foram avaliados semanalmente durante 6 semanas. Observou-se alívio dos sintomas43 de asma15 já do primeiro ao segundo dia da aplicação em 73% dos pacientes. Além disso, 40% dos pacientes ficaram livres de recidivas44 durante as seis semanas de acompanhamento. Não foram relatados eventos adversos neste estudo de curta duração.1
Ljaljevic e colaboradores compararam os efeitos de uma dose única de 1 mL de DIPROSPAN® (5 mg de dipropionato de betametasona mais 2 mg de fosfato de betametasona) com uma dose de 1 mL de acetato de metilprednisolona (40 mg), ambas por via intramuscular, em pacientes com asma15 crônica. O tempo para início do alívio dos sintomas43 foi igual nos dois grupos (2,4 dias). Contudo, os pacientes alocados para o tratamento com DIPROSPAN® tiveram maior duração de alívio dos sintomas43 (27 dias versus 8,5 dias para o grupo acetato de metilprednisolona, P< 0,002). Consequentemente, aquele grupo necessitou de número maior de injeções para o controle dos sintomas43 durante o período do estudo de seis semanas (1,1 versus 2,4 injeções, P< 0,002). O percentual de pacientes que respondeu positivamente foi superior no grupo DIPROSPAN® (100% versus 77,8%, P = 0,046) e a taxa de eventos adversos (cefaleia45, sonolência e mal-estar) foi igual nos dois grupos. 2
Mazzei e colaboradores realizaram um estudo aberto envolvendo 51 pacientes com asma15 brônquica com idade entre 15 e 71 anos. Cada paciente recebeu uma dose de 1 mL de DIPROSPAN® por via intramuscular (5mg de dipropionato de betametasona mais 2 mg de fosfato de betametasona), após a primeira avaliação. Foram então acompanhados com visitas semanais durante 6 semanas. Resposta clínica considerada boa ou excelente foi obtida em 96% dos pacientes, sendo que 43% e 88% dos indivíduos apresentaram remissão completa dos sintomas43 na primeira e na segunda semana após a dose, respectivamente. A duração do efeito variou de 14 a 46 dias, com uma média de 42 dias. As reações adversas ao tratamento foram leves e passageiras (aumento de apetite e astenia46). 3
DOENÇAS REUMATOLÓGICAS
Foi realizado um estudo duplo-cego47 controlado que comparou a eficácia e a segurança de injeções intra- articulares de DIPROSPAN® (5mg de dipropionato de betametasona mais 2 mg de fosfato de betametasona por mL) com acetato de metilprednisolona (40 mg/mL). Quarenta e nove pacientes com artrite reumatoide8 (idades de 27 a 73 anos) foram distribuídos aleatoriamente para tratamento com DIPROSPAN® ou acetato de metilprednisolona por injeção48 intra-articular. As articulações49 tratadas foram joelho (n=40), cotovelo (n=3), tornozelo50 (n=4) e ombro (n=2). Apenas 4/26 pacientes do grupo DIPROSPAN® necessitaram uma segunda aplicação após 2-3 semanas da primeira, enquanto 12/23 pacientes do grupo acetato de metilprednisolona necessitaram uma segunda dose de corticoide. Os sintomas43 de dor, inchaço51, disfunção e limitação motora melhoraram com ambos os tratamentos, porém de forma mais pronunciada após o uso de DIPROSPAN®. Os eventos adversos relatados foram dois casos de ruborização após aplicação de DIPROSPAN®, que desapareceram após 6 horas. 4
Rosenthal e colaboradores avaliaram, em estudo aberto, os efeitos da aplicação intra-articular de DIPROSPAN® para pacientes52 com afecções35 inflamatórias dos joelhos. Quarenta e um pacientes com artrite53 aguda no joelho foram submetidos a aplicação intra-articular de DIPROSPAN® sem anestésico local. Melhora considerável e moderada ocorreram em 46,3% e 21,9% dos pacientes, respectivamente. Melhora leve ocorreu em 29,3% e ausência de efeito em apenas 1 paciente (2,4%). Foi observado alívio da dor e dos sintomas43 em menos de 24 horas em 75% dos pacientes, que persistiu por um tempo médio de 4,34 semanas. Não foram observados eventos adversos locais em nenhum paciente. Aumento do apetite, poliúria54, sintomas43 gástricos moderados e eritema55 facial foram efeitos adversos sistêmicos42 observados após a administração intra-articular de DIPROSPAN®. Todos os eventos adversos desapareceram espontaneamente e não necessitaram tratamento específico. 5
DOENÇAS ALÉRGICAS
A febre do feno56 (rinite16 alérgica sazonal devida a pólen) é uma afecção57 alérgica comum que responde ao tratamento com corticosteroides. Laursen e colaboradores compararam DIPROSPAN® intramuscular com beclometasona spray nasal e placebo58 num estudo duplo-cego47 e duplo-dummy. Trinta adultos com rinoconjuntivite59 sazonal foram distribuídos aleatoriamente para aplicação diária de 100 μg de beclometasona spray em cada narina ou a uma aplicação intramuscular de 2 mL de DIPROSPAN® (5 mg de dipropionato de betametasona mais 2 mg de fosfato de betametasona por mL) imediatamente antes da estação de pólen do vidoeiro. Os pacientes do grupo placebo58 e aqueles tratados com beclometasona spray apresentaram aumento dos sintomas43 de obstrução nasal, rinorreia60, espirros e congestão ocular. Em contrapartida, aqueles tratados com DIPROSPAN® apresentaram redução da intensidade de todos os sintomas43 durante as seis semanas de acompanhamento. Em conclusão, uma única injeção48 de DIPROSPAN® imediatamente antes da estação de pólen foi superior ao tratamento com corticosteroides tópicos no alívio de sintomas43 de rinoconjuntivite59 sazonal. 6
Kronholm realizou um estudo em pacientes com rinoconjuntivite59 alérgica sazonal, que foram distribuídos aleatoriamente para tratamento com DIPROSPAN® (10 mg de dipropionato de betametasona mais 4 mg de fosfato de betametasona por via intramuscular) ou acetato de metilprednisolona (80 mg por via intramuscular). Ambos os tratamentos reduziram significativamente os sintomas43 oculares e nasais dos pacientes. Contudo, os escores de sintomas43 foram significativamente menores naqueles pacientes tratados com DIPROSPAN®. Nenhum paciente apresentou eventos adversos no período de observação. Em conclusão, DIPROSPAN® foi superior ao acetato de metilprednisolona no controle de sintomas43 de rinoconjuntivite59 alérgica sazonal. 7
Referências Bibliográficas:
- Jacyna K. Clinical evaluation of a new betamethasone preparation (‘Diprospan’) in the treatment of bronchial asthma. Pharmatherapeutica. 1977;1(10): 673-8.
- Ljaljevic M. Comparison of a prolonged-acting betamethasone phosphate-dipropionate preparation (DIPROSPAN) with methylprednisolone acetate. A trial in chronic asthmatic patients. Clinical Trials Journal. 1976; 13(4):124-8.
- Mazzei C, Lasala FG, Ambrosio JA. Efectos del dipropionato de betametasona inyetable en el asma15 bronquial crônica. Inv Med Internac. 1981; 8: 263-8.
- Sorensen K. Intraarticular treatment of rheumatoid arthritis patients with steroids: a double-blind trial of Schering 263/1 vs Depo-Medrol®. Curr Ther Res. 1978; 23(2):173-86.
- Rosenthal M. Diprophos für die intraartikuläre therapie arthritischer affektionen. Schweiz Rundschau Med (PRAXIS). 1978; 67: 169-70.
- Laursen LC, Faurschou P,Munch EP. Intramuscular betamethasone dipropionate vs. topical beclomethasone dipropionate and placebo58 in hay fever. Allergy 1988; 43 (6):420-4.
- Kronholm A. Injectable depot cortosteroid therapy in hay fever. J Int Med Res 1979; 7(4): 314-7.
CARACTERÍSTICAS FARMACOLÓGICAS
DIPROSPAN® é uma associação de ésteres de betametasona que produz efeito anti-inflamatório, antialérgico a antirreumático. A atividade terapêutica7 imediata é fornecida pelo éster solúvel, fosfato dissódico de betametasona, que é rapidamente absorvido após a administração. A atividade prolongada é promovida pelo dipropionato de betametasona que, por ser de absorção lenta, controla os sintomas43 durante longo período. O tamanho reduzido do cristal de dipropionato de betametasona permite o uso de agulha de fino calibre (até calibre 25) para administração intradérmica e intralesional3.
DIPROSPAN® é uma suspensão aquosa injetável estéril de dipropionato de betametasona e fosfato dissódico de betametasona. Cada mL de DIPROSPAN® contém 5 mg de betametasona como dipropionato e 2 mg de betametasona como fosfato dissódico, em veículo estéril tamponado e conservado.
Os glicocorticoides, como a betametasona, causam profundos e variados efeitos metabólicos e modificam a resposta imunológica do organismo à diversos estímulos. A betametasona possui grande atividade glicocorticoide e pequena atividade mineralocorticoide61.
CONTRAINDICAÇÕES
A exemplo dos outros corticoides, DIPROSPAN® está contraindicado em pacientes com infecções62 sistêmicas por fungos, em pacientes com hipersensibilidade ao dipropionato de betametasona, fosfato de dissódico de betametasona, a outros corticoides ou a qualquer um dos componentes da fórmula. DIPROSPAN® não deverá ser administrado por via intramuscular em pacientes com púrpura63 trombocitopênica idiopática64.
Este medicamento é contraindicado para menores de 15 anos.
ADVERTÊNCIAS E PRECAUÇÕES
DIPROSPAN® NÃO deverá ser usado por via intravenosa ou subcutânea65. Técnica estritamente asséptica é mandatória com uso de DIPROSPAN®.
Agite antes de usar.
DIPROSPAN® contém dois ésteres de betametasona, um dos quais, o fosfato dissódico de betametasona, desaparece rapidamente do local da injeção48. O potencial para efeitos sistêmicos42 produzidos por esta porção solúvel de DIPROSPAN® deverá ser considerada pelo médico ao usar este preparado.
A administração intramuscular de corticoides deverá ser feita profundamente em grandes massas musculares para evitar atrofia66 tissular67 local.
As injeções em tecidos moles, intralesionais e intra-articulares podem produzir efeitos sistêmicos42 locais.
É necessário o exame do líquido sinovial68 para excluir um processo infeccioso. Deve-se evitar a injeção48 local em uma articulação69 previamente infectada. O aumento da dor e do edema70 local, restrição maior dos movimentos articulares, febre71 e mal-estar são sugestivos da artrite53 séptica. Se a infecção72 for confirmada, deverá ser instituída terapia antimicrobiana apropriada.
Corticosteroides não deverão ser injetados em articulações49 não estáveis, áreas infectadas ou espaços intervertebrais. Injeções repetidas em articulações49 com osteoartrite9 podem aumentar a destruição articular. Evitar injetar corticosteroides diretamente nos tendões73 devido a relatos de ruptura tardia do tendão74. Em seguida à terapia corticoide intra-articular, o paciente deverá ser alertado quanto a evitar o uso excessivo da articulação69 na qual foi obtido benefício sintomático75.
Devido à ocorrência de raros casos de reações anafiláticas76 com o uso parenteral de corticoides, deverão ser tomadas medidas apropriadas de precaução antes da administração, especialmente se o paciente apresentar histórico de alergia77 medicamentosa.
Com o tratamento prolongado, deverá ser considerada a transferência da administração parenteral para a oral, depois da avaliação dos potenciais benefícios e riscos.
Reajustes posológicos poderão ser necessários para remissões ou exacerbações do processo posológico, conforme a resposta individual de cada paciente sob tratamento e quando ocorrer exposição do paciente a situações de estresse, isto é, infecção72 grave, cirurgia ou traumatismo78. Após o término de um tratamento prolongado com corticoides em altas doses, poderá ser necessária monitorização por até um ano.
Os corticoides podem mascarar sinais79 de infecção72, e novas infecções62 podem surgir durante o seu uso. Quando os corticoides são usados, podem ocorrer diminuição da resistência e dificuldade de localizar o sítio de uma nova infecção72.
O uso prolongado de corticoides pode produzir catarata80 subcapsular posterior, especialmente em crianças, glaucoma81 com possível dano ao nervo óptico, podendo ocorrer aumento da incidência82 de infecções62 oculares secundárias devidas a fungos ou vírus83.
Altas doses de corticoides podem causar elevação da pressão arterial84 e retenção hidrossalina, assim como aumento da excreção de potássio. Esses efeitos ocorrem com menos frequência com os derivados sintéticos, exceto quando usados em altas doses.
Deve ser considerada uma dieta com restrição a sal e suplementação41 de potássio. Todos os corticoides aumentam a excreção de cálcio.
Enquanto em tratamento com corticosteroide, os pacientes não deverão ser vacinados contra varíola. Alguns procedimentos de imunização85 não deverão ser realizados em pacientes recebendo corticosteroides, principalmente em altas doses, devido ao provável risco de complicações neurológicas e falta de resposta por anticorpos86. Quando o corticosteroide estiver sendo utilizado como terapia de reposição (por exemplo, Doença de Addison), os procedimentos de imunização85 poderão ser realizados normalmente.
Pacientes em uso de doses imunossupressoras de corticosteroides deverão ser alertados a evitar a exposição a pessoas portadoras de varicela87 ou sarampo88, e, se forem expostas, deverão procurar orientação médica, principalmente no caso de crianças.
O tratamento com corticosteroides em pacientes com tuberculose89 ativa deverá ser restrito aos casos de tuberculose89 fulminante ou disseminada, nos quais o corticosteroide é usado em associação com um esquema antituberculoso apropriado.
Se os corticoides forem indicados em pacientes com tuberculose89 latente ou com reatividade tuberculina, será necessária uma observação cuidadosa, uma vez que poderá ocorrer reativação da doença. Durante tratamento prolongado, estes pacientes deverão receber quimioprofilaxia. O uso da rifampicina no programa de quimioprofilaxia, devido o seu efeito de estimulação da depuração dos glicocorticoides, poderá impor um reajuste na dose empregada.
A menor dose possível de corticoide deverá ser usada para controlar a condição sob tratamento. Quando a redução da dose for possível, deverá ser gradual.
Insuficiência40 adrenocortical secundária, induzida pelo medicamento, poderá resultar da retirada muito rápida do corticoide, podendo ser minimizada pela redução gradual da dose. Essa insuficiência40 poderá persistir por meses após a descontinuação do tratamento, portanto, se ocorrer estresse durante este período, a corticoterapia deverá ser reinstituída. Se o paciente já estiver recebendo corticosteroides, a dose deverá ser aumentada. Uma vez que a secreção mineralocorticoide61 pode estar prejudicada, devem ser administrados sal e/ou mineralocorticosteroides concomitantemente.
Os efeitos dos corticoides são aumentados em pacientes com hipotireoidismo90 e em pacientes com cirrose91 hepática92.
Aconselha-se cautela ao se usar corticoides em pacientes com herpes simples ocular devido à possibilidade de perfuração da córnea93.
Podem ocorrer transtornos psíquicos com a terapia corticosteroide. Os corticoides podem agravar instabilidade emocional ou tendências psicóticas preexistentes.
Corticoides deverão ser usados com cautela em colite33 ulcerativa não especificada, quando houver probabilidade de perfuração iminente, abscesso94 ou outra infecção72 piogênica, em diverticulite95, anastomose96 intestinal recente, úlcera péptica97 ativa ou latente, insuficiência renal98, hipertensão arterial99, osteoporose100 e miastenia101 gravis.
Como as complicações do tratamento com corticosteroides são dependentes da dose e duração do tratamento, uma decisão baseada na relação risco/benefício deverá ser tomada para cada caso individual.
O crescimento e desenvolvimento de crianças e lactentes102 fazendo uso prolongado de corticoides deverão ser acompanhados cuidadosamente, pois pode haver distúrbio no crescimento e inibição da produção endógena de cortisol.
O tratamento com corticosteroides pode alterar a motilidade e o número de espermatozoides103.
A administração intra-articular e/ou intralesional3 pode produzir efeitos sistêmicos42 e locais, o que deverá ser levado em consideração em pacientes tratados concomitantemente com corticosteroides oral e/ou parenteral.
Uso durante a gravidez104 e lactação105
Como não foram feito estudos controlados de reprodução106 humana com corticosteroides, o uso de DIPROSPAN® durante a gravidez104 ou em mulheres em idade fértil exige que os possíveis benefícios do fármaco107 sejam pesados contra os potenciais riscos para a mãe, o feto108 e o lactente109. Crianças nascidas de mães que receberam doses substanciais de corticoides durante a gestação deverão ser observadas cuidadosamente para a detecção de sinais79 de hipoadrenalismo.
Os corticosteroides atravessam a barreira placentária e são detectados no leite materno.
Devido à ocorrência de passagem transplacentária110 dos corticosteroides, as crianças nascidas de mães que receberam corticosteroides durante a gravidez104 devem ser examinadas cuidadosamente para a verificação da rara ocorrência de catarata80 congênita111.
Mulheres grávidas que receberam corticosteroides durante a gravidez104 devem ser monitoradas durante e após o parto para verificação de qualquer indicação de ocorrência de insuficiência40 adrenal devido ao estresse associado ao nascimento da criança.
Categoria de Risco C: Não foram realizados estudos em animais e nem em mulheres grávidas; ou então, os estudos em animais revelaram risco, mas não existem estudos disponíveis realizados em mulheres grávidas.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Devido à possibilidade de surgirem efeitos adversos indesejáveis com o uso do DIPROSPAN® em lactentes102, deverá ser tomada a decisão de descontinuar a amamentação112 ou o tratamento, levando-se em consideração a importância do medicamento para a mãe.
Este medicamento pode causar doping.
INTERAÇÕES MEDICAMENTOSAS
Interações medicamento-medicamento
O uso concomitante de fenobarbital, rifampicina, fenitoína ou efedrina pode aumentar o metabolismo113 do corticosteroide, reduzindo, assim, seus efeitos terapêuticos.
Pacientes que estejam recebendo corticosteroides e estrogênios concomitantemente deverão ser observados devido a possível ocorrência de exacerbação dos efeitos dos corticosteroides.
O uso concomitante de corticosteroides com diuréticos114 depletores de potássio pode aumentar a hipocalemia115.
O uso concomitante de corticoides com glicosídeos cardíacos pode aumentar a possibilidade de arritmias116 ou intoxicação digitálica associada à hipocalemia115.
Os corticoides podem aumentar a depleção117 de potássio causada pela anfotericina B. Em todos os pacientes em uso de digitálicos, diuréticos114 depletores de potássio e anfotericina B, as concentrações dos eletrólitos118 séricos, principalmente os níveis de potássio, deverão ser monitorizadas cuidadosamente.
O uso concomitante de corticosteroides com anticoagulantes119 cumarínicos pode aumentar ou diminuir os efeitos anticoagulantes119, havendo necessidade de ajustes posológicos.
Os corticosteroides podem diminuir as concentrações sanguíneas dos salicilatos. O ácido acetilsalicílico deve ser utilizado com cuidado em associação aos corticosteroides em pacientes com hipoprotrombinemia. Quando os corticosteroides forem administrados a diabéticos, poderão ser necessários reajustes posológicos dos antidiabéticos orais120 e da insulina121.
Terapia concomitante com glicocorticoides pode inibir a resposta à somatotropina.
Interações medicamento-álcool
Os efeitos combinados de anti-inflamatórios não esteroides ou álcool com corticoides podem resultar em aumento da ocorrência ou da gravidade de ulcerações122 gastrintestinais.
Interações medicamento-exames laboratoriais
Os corticoides podem afetar o teste de “nitroblue tetrazolium” para infecção72 bacteriana e produzir resultados falso-negativos.
CUIDADOS DE ARMAZENAMENTO DO MEDICAMENTO
Conservar em temperatura ambiente (entre 15 e 30ºC). Proteger da luz.
O prazo de validade da DIPROSPAN® (ampola) é de 24 meses após a data de sua fabricação.
O prazo de validade da DIPROSPAN® conjunto HYPAK® é de 18 meses após a data de sua fabricação.
Número de lote e datas de fabricação e validade vide embalagem. Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Características físicas e organolépticas do produto
DIPROSPAN® suspensão injetável apresenta-se como um líquido levemente viscoso, contendo partículas brancas de fácil ressuspensão, límpido, incolor e livre de partículas estranhas.
Antes de usar, observe o aspecto do medicamento.
Todo medicamento deve ser mantido fora do alcance das crianças.
POSOLOGIA E MODO DE USAR
PARA ADMINISTRAÇÃO INTRAMUSCULAR, INTRA-ARTICULAR, PERIARTICULAR, INTRABÚRSICA, INTRADÉRMICA, INTRALESIONAL3 E EM TECIDOS MOLES
Não está indicado para uso intravenoso ou subcutâneo123.
Este produto só poderá ser injetado por via intramuscular profunda na região glútea124 usando exclusivamente agulha calibre 30/7.
Por se tratar de uma suspensão injetável, o DIPROSPAN® deve ser aplicado por um profissional de saúde5.
Agite antes de usar. Técnica estritamente asséptica é mandatória para o uso do produto.
As necessidades posológicas são variáveis e deverão ser individualizadas com base na doença específica, na gravidade do quadro e na resposta do paciente ao tratamento.
A dose inicial deverá ser mantida ou ajustada até que uma resposta satisfatória seja obtida. Se uma resposta clínica satisfatória não ocorrer após um período de tempo razoável, o tratamento com DIPROSPAN® deverá ser descontinuado e deverá ser iniciada outra terapia apropriada.
Administração sistêmica
Para o tratamento sistêmico29, DIPROSPAN® deverá ser iniciado com 1 a 2 mL na maioria das condições, repetindo-se a terapia, quando necessário. A administração é através de injeção intramuscular125 (IM) profunda na região glútea124. A dosagem e a frequência das administrações irão depender da gravidade da condição do paciente e da resposta terapêutica7. Em doenças graves, como lúpus24 eritematoso25 sistêmico29 ou estado de mal asmático já controlados por medidas de emergência126, 2 mL poderão ser necessários inicialmente.
Grandes variedades de condições dermatológicas respondem à administração IM de corticoides. Uma injeção48 de 1 mL, repetida de acordo com a resposta terapêutica7, foi considerada como eficaz.
Em doenças do trato respiratório, o início da melhora dos sintomas43 ocorre dentro de poucas horas após a injeção intramuscular125 de DIPROSPAN®. O controle efetivo dos sintomas43 com 1 a 2 mL é obtido na asma15 brônquica, febre do feno56, bronquite alérgica e rinite16 alérgica.
No tratamento da bursite10 aguda ou crônica, resultados excelentes foram obtidos com 1 a 2 mL de DIPROSPAN® administrados por via intramuscular, repetidos se necessário.
Administração local
O uso de anestésicos locais raramente é necessário. Se isto for desejável, DIPROSPAN® poderá ser misturado (na seringa1 e não no frasco) com lidocaína ou procaína 1% a 2% ou anestésicos locais similares. Devem ser evitadas formulações que contenham metilparabeno, propilparabeno e fenol.
A dose necessária de DIPROSPAN® é transferida para a seringa1 e, em seguida, o anestésico. A mistura na seringa1 deve ser agitada levemente.
Em bursites agudas subdeltoides, subcromiais, olecraniais e pré-patelares, uma injeção48 intrabúrsica de 1 a 2 mL de DIPROSPAN® poderá aliviar a dor e restaurar a completa movimentação dentro de poucas horas. A bursite10 crônica poderá ser tratada com doses reduzidas, assim que os sintomas43 agudos estejam controlados. Em tenossinovite aguda, tendinite127 e peritendinite, uma injeção48 de DIPROSPAN® poderá trazer alívio, Em formas crônicas destas doenças, poderão ser necessárias injeções repetidas, de acordo com as necessidades do paciente.
Após administração intra-articular de 0,5 mL a 2 mL de DIPROSPAN®, ocorre alívio da dor, da sensibilidade e rigidez associadas à osteoartrite9 e à artrite reumatoide8 dentro de 2 a 4 horas. A duração do alívio, que varia amplamente nas duas condições, é de 4 semanas ou mais, na maioria dos casos.
Uma injeção48 intra-articular de DIPROSPAN® é bem tolerada pela articulação69 e pelos tecidos periarticulares. As doses recomendadas para injeção48 intra-articular são:
- Grandes articulações49 (joelho, bacia, ombro): 1 – 2 mL
- Médias articulações49 (cotovelo, punho, tornozelo50): 0,5 – 1 mL
- Pequenas articulações49 (pé, mão128, tórax129): 0,25 – 0,5 mL
Afecções35 dermatológicas poderão responder à administração intralesional3 de DIPROSPAN®. A resposta de algumas lesões130 não tratadas diretamente poderá ser devida a um leve efeito sistêmico29 do fármaco107. No tratamento intralesional3, é recomendada uma dose intradérmica de 0,2mL/cm² de DIPROSPAN® distribuída igualmente com uma seringa1 do tipo tuberculina e agulha de calibre 26. A quantidade total de DIPROSPAN® aplicada em todas as áreas não deverá exceder 1mL por semana.
DIPROSPAN® poderá ser usado eficazmente em afecções35 do pé que sejam suscetíveis aos corticoides. Bursite10 sob heloma duro ou mole poderá ser controlada com duas injeções sucessivas de 0,25 mL cada. Em algumas condições, como hallux36 rigidus, 5º dedo varo37 e artrite53 gotosa aguda, a melhora dos sintomas43 poderá ser rápida. Uma seringa1 do tipo tuberculina e uma agulha de calibre 25 são adequadas para a maioria das injeções. As doses recomendadas, em intervalos de aproximadamente uma semana, são: bursite10 sob heloma duro ou mole, 0,25 mL – 0,5 mL; bursite10 sob esporão de calcâneo131, 0,5 mL; bursite10 sobre hallux36 rigidus, 0,5mL; bursite10 sobre o 5º dedo varo37, 0,5 mL; cisto sinovial, 0,25 mL – 0,5 mL; neuralgia132 de Morton (metatarsalgia), 0,25 mL – 0,5 mL; tenossinovite, 0,5 mL; periostite do cuboide, 0,5 mL; artrite53 gotosa aguda, 0,5 mL – 1 mL.
Depois de obtida uma resposta favorável, a dosagem de manutenção deverá ser determinada através da diminuição da dose inicial em decréscimos graduais, a intervalos apropriados, até que seja encontrada a dose mínima capaz de manter uma resposta clínica adequada.
A exposição do paciente à situações de estresse não relacionadas à doença em curso poderá necessitar de aumento da dose de DIPROSPAN®. Se for necessária a descontinuação do fármaco107 após tratamento prolongado, a dose deverá ser reduzida gradualmente.
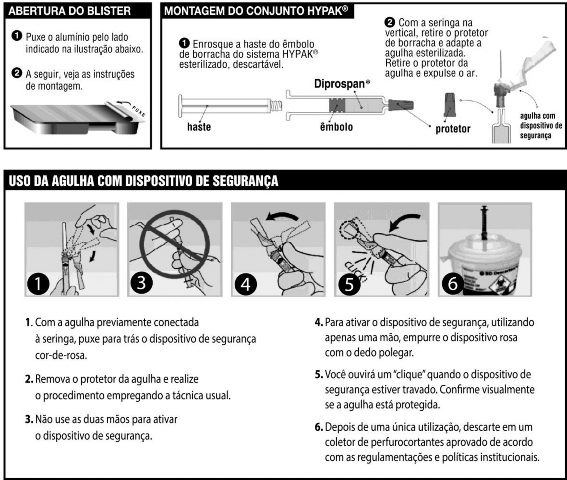
Instruções de uso do conjunto seringa1 e agulha com sistema de segurança (vide figuras explicativas abaixo):
- Se a agulha já estiver previamente conectada, puxe para trás o dispositivo de segurança azul.
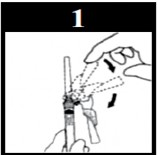
- Caso a agulha não esteja conectada, conecte-a à seringa1 com firmeza.
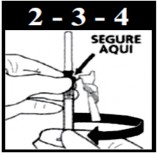
- Se precisar girar o dispositivo de segurança para orientar o bisel ou ler a escala, segure o dispositivo azul de segurança no ponto em que ele se conecta com a seringa1 com uma das mãos133 e gire a seringa1 com a outra mão128.
- Remova o protetor da agulha e realize o procedimento de aspiração da suspensão de Diprospan® da ampola normalmente.
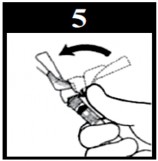
Atenção: Não use as duas mãos133 para fechar o dispositivo azul de segurança após aplicação

- Após a aplicação, empurre o dispositivo azul com o dedo.
- Continue a apertar até que a agulha esteja totalmente coberta pelo dispositivo e o dispositivo esteja travado. Você ouvirá um clique quando o dispositivo de segurança azul estiver travado.
Confirme visualmente se a agulha está coberta
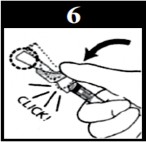
- Aperte o êmbolo2 para quebra-lo, impedindo assim a sua reutilização.
- Após o único uso, descarte o conjunto agulha + seringa1 mediatamente num recipiente aprovado para objetos cortantes, conforme normas de segurança.
ADVERTÊNCIAS
A quebra do dispositivo pode causar respingos. Assegure-se de que a seringa1 esteja vazia antes de quebrar o êmbolo2. Para maior segurança, ao quebrar o êmbolo2, segure a seringa1 voltada para baixo, longe de si próprio e dos outros.Caso o êmbolo2 quebre prematuramente durante a injeção48, continue a apertá-lo até que a dose seja completamente administrada.
Instruções de uso (conjunto HYPAK®) (vide figuras explicativas abaixo):
Atenção: o produto depois de aberto não pode ser reutilizado. O conteúdo restante não deve ser utilizado em outras aplicações. Caso houver sobra, seu conteúdo deve ser descartado.
A seringa1 após a aplicação não deve ser reutilizada. Deve ser descartada em recipiente apropriado.
Informe seu médico o aparecimento de reações desagradáveis, como alterações osteomusculares, gastrintestinais, dermatológicas, neurológicas, psiquiátricas, hiper ou hipopigmentação, atrofia66 cutânea134 e subcutânea65, abscessos135 estéreis, rubor local pós-injeção48 (em seguida ao uso intra-articular).
ADVERTÊNCIAS
A quebra do dispositivo pode causar respingos.
Assegure-se de que a seringa1 esteja vazia antes de quebrar o êmbolo2. Para maior segurança, ao quebrar o êmbolo2, segure a seringa1 voltada para baixo, longe de si próprio e dos outros.
Caso o êmbolo2 quebre prematuramente durante a injeção48, continue a apertá-lo até que a dose seja completamente administrada.
REAÇÕES ADVERSAS
Reações adversas ao DIPROSPAN®, como aos demais corticosteroides, estão relacionadas com a posologia e a duração do tratamento. Geralmente estas reações podem reverter-se ao mínimo com a redução da posologia, o que é geralmente preferível à suspensão do tratamento farmacológico.
Embora a incidência82 de reações adversas a DIPROSPAN® seja baixa, a possível ocorrência de efeitos colaterais136 conhecidos dos corticoides deverá ser considerada.
As reações adversas relacionadas ao uso de DIPROSPAN®, de acordo com a frequência de ocorrência e o sistema acometido são:
Reações comuns (> 1/100 e < 1/10)
- Sistema nervoso central137: insônia.
- Sistema gastrintestinal: dispepsia138; aumento de apetite.
- Organismo como um todo: aumento da incidência82 de infecções62
Reações incomuns (>1/1.000 e < 1/100)
- Pele139: dificuldade de cicatrização; telangectasias; piodermites; atrofia66 cutânea134; foliculites; prurido140 cutâneo141.
- Sistema endócrino142: diabetes mellitus22; síndrome de Cushing143 exógena.
- Sistema musculoesquelético: osteoporose100
- Sistema gastrintestinal: sangramento gastrintestinal.
- Sistema geniturinário: hipocalemia115; retenção de sódio e água; irregularidade menstrual.
Reações raras (> 1/10.000 e < 1/1.000)
- Pele139: estrias; hematomas144; reação de hipersensibilidade; acne27; urticária21; sudorese145 excessiva; rash146 cutâneo141; hiperemia147 da face148 e pescoço149 após aplicação; sintomas43 e sinais79 no local de aplicação; hipertricose150; hipopigmentação cutânea134.
- Sistema nervoso central137: depressão; convulsões; tontura151; cefaleia45; confusão mental; euforia; distúrbio de personalidade; alteração de humor.
- Sistema gastrintestinal: úlcera péptica97; hepatomegalia152; distensão abdominal; alteração em provas de função hepática92.
- Sistema geniturinário: oligospermia.
- Sistema musculoesquelético: miopatia153 por corticosteroide; fraqueza muscular; mialgias154.
- Olhos155: aumento da pressão intraocular156; catarata80.
- Sistema cardiovascular157: hipertensão arterial99 sistêmica; arritmias116 cardíacas; insuficiência cardíaca congestiva158; edema70 agudo159 do pulmão160; trombose venosa profunda161; vasculite162.
- Organismo como um todo: ganho de peso; infecção72 fúngica163.
Reações cuja incidência82 não está determinada
Soluços, alcalose164 hipocalêmica, perda de massa muscular, fraturas, necrose165 asséptica da cabeça166 do fêmur167 e do úmero168, fratura169 patológica dos ossos longos170, ruptura de tendão74, instabilidade articular decorrente de repetidas injeções intra-articulares, pancreatite171, esofagite172 ulcerativa, adelgaçamento cutâneo141, petéquias173 e equimose174, eritema55 facial, diminuição ou supressão da reação aos testes cutâneos, edema angioneurótico17, aumento da pressão intracraniana com edema de papila175 (pseudotumor cerebral), diminuição do crescimento na infância e no período intrauterino, falta de resposta adrenocortical e pituitária, particularmente em períodos de estresse, como trauma, cirurgias ou doenças; diminuição da tolerância aos carboidratos, manifestações clínicas de diabetes mellitus22 latente, aumento das necessidades diárias de insulina121 ou agentes hipoglicemiantes orais176 em diabéticos, glaucoma81, balanço nitrogenado negativo devido ao catabolismo177 proteico, manifestações psicóticas, reações anafiláticas76, hipotensão arterial178, choque179, dermatite19 alérgica, exoftalmia, agravamento dos sintomas43 na miastenia101 gravis.
Reações adversas relacionadas ao tratamento corticoide parenteral
Casos raros de cegueira associados ao tratamento intralesional3 da face148 e da cabeça166; hiper ou hipopigmentação, atrofia66 cutânea134 e subcutânea65; abscessos135 estéreis; área de rubor pós injeção48 (em seguida ao uso intra-articular); artropatia180 do tipo Charcot.
Em casos de eventos adversos, notifique ao sistema de Notificação em Vigilância Sanitária NOTIVISA ou para a Vigilância Sanitária Estadual ou Municipal.
SUPERDOSE
Sintomas43 – A superdose aguda de corticosteroides não leva à situações de risco de vida. Exceto nos casos de doses muito elevadas, alguns dias de dosagem excessiva não parecem produzir resultados prejudiciais na ausência de contraindicações específicas, como em pacientes com diabetes mellitus22, glaucoma81, úlcera péptica97 ativa ou em pacientes que estejam fazendo uso de medicamentos como digitálicos, anticoagulantes119 cumarínicos ou diuréticos114 depletores de potássio.
Tratamento – Complicações resultantes dos efeitos metabólicos dos corticosteroides ou dos efeitos deletérios da doença de base, ou concomitante, ou resultante de interações medicamentosas deverão ser tratadas apropriadamente.
Manter ingestão adequada de líquidos e monitorizar os eletrólitos118 séricos e urinários, com especial atenção ao balanço de sódio e potássio. Tratar o desequilíbrio eletrolítico, se necessário.
Em caso de intoxicação ligue para 0800 722 6001, se você precisar de mais orientações.
DIZERES LEGAIS:
VENDA SOB PRESCRIÇÃO MÉDICA
Registro M.S.: nº 1.7817.0801
Farm. Responsável: Luciana Lopes da Costa
CRF-GO nº 2.757
Registrado por:
Cosmed Indústria de Cosméticos e Medicamentos S.A.
Avenida Ceci, nº 282, Módulo I – Tamboré
Barueri – SP – CEP 06460-120
C.N.P.J.: 61.082.426/0002-07
Indústria Brasileira
Fabricado por:
Brainfarma Indústria Química e Farmacêutica S.A
VPR 1 – Quadra 2-A – Módulo 4 – DAIA
Anápolis – GO – CEP 75132-020
SAC 0800 97 99 900






