Comirnaty (Bula do profissional de saúde)
WYETH INDÚSTRIA FARMACÊUTICA LTDA
IDENTIFICAÇÃO DO MEDICAMENTO
Comirnaty™
vacina1 covid-19
Injetável 30 µg
FORMA FARMACÊUTICA E APRESENTAÇÃO:
Suspensão injetável (6 doses/frasco)
Embalagens com 195 frascos
VIA DE ADMINISTRAÇÃO: USO INTRAMUSCULAR
USO ADULTO E PEDIÁTRICO (A PARTIR DE 12 ANOS DE IDADE)
COMPOSIÇÃO:
Cada dose da vacina1 diluída (0,3 mL) contém:
| vacina1 covid-19* | 30 µg |
| veículo q.s.p. | 0,3 mL |
Veículo: di-hexildecanoato de di-hexilaminobutanol, ditetradecilmetoxipolietilenoglicolacetamida, levoalfafosfatidilcolina distearoila, colesterol2, sacarose, cloreto de sódio, cloreto de potássio, fosfato de sódio dibásico di-hidratado, fosfato de potássio monobásico, água para injetáveis.
*Comirnaty™ é composto de RNA mensageiro (mRNA) de cadeia simples com estrutura 5-cap altamente purificado, produzido usando transcrição in vitro sem células3 a partir dos modelos de DNA correspondentes, codificando a proteína S (spike) do coronavírus 2 vírus4 da síndrome5 respiratória aguda grave (SARS-CoV-2).
INFORMAÇÕES TÉCNICAS AOS PROFISSIONAIS DE SAÚDE6
INDICAÇÕES
Comirnaty™ é indicado para a imunização7 ativa para prevenir a doença COVID-19 causada pelo vírus4 SARS-CoV-2 em indivíduos com idade igual ou superior a 12 anos.
A utilização desta vacina1 deve seguir as recomendações oficiais.
RESULTADOS DE EFICÁCIA
Eficácia
O Estudo 2 é um estudo de Fase 1/2/3 multicêntrico, multinacional, randomizado8, controlado por placebo9, com ocultação do observador, para seleção de vacina1-candidata, e determinação da dose e eficácia com participantes de idade igual ou superior a 12 anos. A randomização foi estratificada por idade: 12 a 15 anos de idade, 16 a 55 anos de idade, ou idade igual ou superior a 56 anos, com um mínimo de 40% dos participantes no estrato ≥ 56 anos. O estudo excluiu participantes imunocomprometidos e que tinham diagnóstico10 clínico ou microbiológico11 prévio da COVID-19. Foram incluídos participantes com doença pré-existente estável, definida como doença que não necessitou de alteração significativa no tratamento ou hospitalização por agravamento da doença durante as 6 semanas anteriores à inclusão, bem como participantes com infeção estável conhecida, como o vírus4 da imunodeficiência12 humana (HIV13), vírus4 da hepatite14 C (HCV) ou vírus4 da hepatite14 B (HBV).
Eficácia em participantes com idade igual ou superior a 16 anos
Na Fase 2/3 do Estudo 2, com base em dados acumulados até 14 de novembro de 2020, foram randomizados igualmente aproximadamente 44.000 participantes com idade igual ou superior a 12 anos para receber 2 doses da vacina1 de mRNA contra COVID-19 ou placebo9, com um intervalo de 21 dias. As análises de eficácia incluíram participantes que tinham recebido a segunda dose no prazo de 19 a 42 dias após a primeira administração. A maioria (93,1%) dos participantes que receberam a vacina1 recebeu a segunda dose 19 dias a 23 dias após a Dose 1. Está previsto o acompanhamento dos participantes até 24 meses após a Dose 2, para avaliações de segurança e eficácia contra a COVID-19. No estudo clínico, os participantes tinham de cumprir um intervalo mínimo de 14 dias antes e depois da administração de uma vacina1 contra a gripe15, para poderem receber a vacina1 de mRNA contra COVID-19 ou placebo9. No estudo clínico, os participantes tinham de cumprir até o final do estudo, um intervalo mínimo de 60 dias antes ou depois de receberem produtos sanguíneos/plasmáticos ou imunoglobulinas16 para poderem receber a vacina1 de mRNA contra COVID-19 ou placebo9.
A população para a análise do desfecho primário de eficácia incluiu 36.621 participantes com idade igual ou superior a 12 anos (18.242 no grupo da vacina1 de mRNA contra COVID-19 e 18.379 no grupo de placebo9), sem evidência de infeção prévia pelo vírus4 SARS-CoV-2 até 7 dias após a segunda dose. Além disso, 134 participantes tinham entre 16 e 17 anos de idade (66 no grupo da vacina1 de mRNA contra COVID-19 e 68 no grupo de placebo9) e 1.616 participantes tinham 75 anos de idadeou mais (804 no grupo da vacina1 de mRNA contra COVID-19 e 812 no grupo de placebo9). A Tabela 1 apresenta as características demográficas específicas da população estudada.
Tabela 1. Demografia (População para o Desfecho Primário de Eficácia)a
|
|
Comirnaty™ |
Placebo9 |
|
Sexo |
||
|
Masculino |
9318 (51,1) |
9225 (50,2) |
|
Feminino |
8924 (48,9) |
9154 (49,8) |
|
Idade (anos) |
||
|
Média (DP) |
50,6 (15,70) |
50,4 (15,81) |
|
Mediana |
52,0 |
52,0 |
|
Mín., máx. |
(12, 89) |
(12, 91) |
|
Grupo etário |
||
|
12 a 15 anos |
46 (0,3) |
42 (0,2) |
|
16 a 17 anos |
66 (0,4) |
68 (0,4) |
|
16 a 64 anos |
14 216 (77,9) |
14 299 (77,8) |
|
65 a 74 anos |
3176 (17,4) |
3226 (17,6) |
|
≥ 75 anos |
804 (4,4) |
812 (4,4) |
|
Raça |
||
|
Branco |
15.110 (82,8) |
15.301 (83,3) |
|
Negro ou Afro-Americano |
1617 (8,9) |
1617 (8,8) |
|
Índio Americano ou Nativo do Alasca |
118 (0,6) |
106 (0,6) |
|
Asiático |
815 (4,5) |
810 (4,4) |
|
Havaiano Nativo ou outra Ilha do Pacífico |
48 (0,3) |
29 (0,2) |
|
Outrosb |
534 (2,9) |
516 (2,8) |
|
Etnia |
||
|
Hispânico ou Latino |
4886 (26,8) |
4857 (26,4) |
|
Não Hispânico ou Latino |
13.253 (72,7) |
13.412 (73,0) |
|
Não reportado |
103 (0,6) |
110 (0,6) |
|
Comorbidades17c |
||
|
Sim |
8432 (46,2) |
8450 (46,0) |
|
Não |
9810 (53,8) |
9929 (54,0) |
a Todos os participantes randomizados elegíveis que recebem todas as vacinas como randomizadas dentro da janela predefinida, não têm outros desvios importantes do protocolo, conforme determinado pelo médico, e não têm evidência de infecção18 por SARS-CoV- 2 antes dos 7 dias após a Dose 2.
b Inclui multirraciais e não reportados.
c Número de participantes que têm 1 ou mais co-morbidades que aumentam o risco de COVID-19 grave.
- Doença pulmonar crônica (por exemplo, enfisema19 e bronquite crônica20, fibrose21 pulmonar idiopática22 e fibrose cística23) ou asma24 moderada a grave.
- Doença cardíaca significativa (por exemplo, insuficiência cardíaca25, doença arterial coronariana, doença cardíaca congênita26, cardiomiopatias e hipertensão27 pulmonar).
- Obesidade28 (índice de massa corporal29 ≥30 kg/m2).
- Diabetes30 (Tipo 1, Tipo 2 ou gestacional).
- Doença hepática31.
- Infecção18 pelo Vírus4 da Imunodeficiência12 Humana (HIV13) (não incluída na avaliação da eficácia).
No momento da análise primária de eficácia, os participantes tinham sido acompanhados para COVID-19 sintomática32 em pelo menos 2.214 pessoa-anos no grupoda vacina1 de mRNA contra COVID-19 e em pelo menos 2.222 pessoa-anos no grupo de placebo9.
Não houve diferenças clínicas significativas na eficácia globalda vacina1 em participantes com risco de COVID-19 grave, incluindo aqueles com 1 ou mais comorbidades17 que aumentem o risco de COVID-19 grave (ex., asma24, índice de massa corporal29 (IMC33) ≥ 30 kg/m2, doença pulmonar crônica, diabetes30 mellitus, hipertensãoarterial).
As informações sobre a eficácia da vacina1 estãoapresentadas na Tabela 2.
Tabela 2. Eficácia da vacina1 – Primeira ocorrência de COVID-19 a partir de 7 dias após a Dose 2, por subgrupo etário – participantes sem evidência de infeção e participantes com ou sem evidência de infecção18 no período antes de 7 dias após a Dose 2 – população com eficácia avaliável (7 dias)
|
Primeira ocorrência de COVID-19 no período de 7 dias após a Dose 2 em participantes sem evidência de infeção prévia pelo vírus4 SARS-CoV-2* |
|||
|
Subgrupo |
Comirnaty™ |
Placebo9 |
Eficácia da vacina1 |
|
Todos os participantes |
8 |
162 |
95,0 (90,3; 97,6) |
|
16 a 64 anos |
7 |
143 |
95,1 (89,6; 98,1) |
|
≥ 65 anos |
1 |
19 |
94,7 (66,7; 99,9) |
|
65 a 74 anos |
1 |
14 |
92,9 (53,1; 99,8) |
|
≥75 anos |
0 |
5 |
100,0 (-13,1, 100,0) |
|
Primeira ocorrênciade COVID-19 no período de 7 dias após a Dose 2 em participantes com ou sem* evidência de infecção18 prévia pelo vírus4 SARS-CoV-2 |
|||
|
Subgrupo |
Comirnaty™ |
Placebo9 |
Eficácia da Vacina1% |
|
Todos os participantese |
9 |
169 |
94,6 |
|
16 a 64 anos |
8 |
150 |
94,6 |
|
≥ 65 anos |
3 |
19 |
94,7 |
|
65 a 74 anos |
1 |
14 |
92,9 |
|
≥ 75 anos |
0 |
5 |
100,0 |
Nota: Os casos confirmados foram determinados por transcrição reversa associada a reação em cadeia da polimerase (RT-PCR34) e, pelo menos, 1 sintoma35 consistente com COVID-19 (sintomas36 incluídos: febre37, surgimento ou agravamentode tosse, surgimento ou agravamento de falta de ar, calafrios38, surgimento ou agravamento de dor muscular, perda de paladar39 ou olfato recente, dor de garganta40, diarreia41 ou vômitos42).
Abreviações: NAAT = teste de amplificação de ácido nucleico; SARS-CoV-2 = coronavírus 2 da síndrome5 respiratória aguda grave; EV= eficácia da vacina1.
* Foram incluídos na análise participantes que não tinham evidência de infeção prévia pelo SARS-CoV-2 [ou seja, anticorpos43 com N ligante (soro44) negativos na Visita 1 e SARS-CoV-2 não detectado por NAAT (exsudadonasal) nas Visitas 1 e 2], e com NAAT (exsudado nasal) negativo em qualquer visita não programada no período antes de 7 dias após a Dose 2.
a N = número de participantes no grupo especificado.
b n1 = número de participantes que correspondem à definição do desfecho de avaliação.
c Tempo total de vigilância em 1000 pessoa-anos para o desfecho de avaliação especificado em todos os participantes dentro de cada grupo sob risco para o desfecho de avaliação. O período de tempo para número acumulado de casos de COVID-19 corresponde a 7 dias após a Dose 2 até ao final do período de vigilância.
d n2 = Número de indivíduos sob risco para o desfecho de avaliação.
e Não foram identificados casos confirmados nos adolescentes com 12 a 15 anos de idade.
f O intervalo de credibilidade bilateral para a eficácia da vacina1 (EV) foi calculado utilizando um modelo beta-binomial com um beta (0,700102,1) anterior para Θ=r(1-EV)/(1+r(1-EV)), em que r é a relação entre o tempo de vigilância no grupo da vacina1 ativa e o do grupo placebo9
g O intervalo de confiança (IC) para a EV é determinado com base no método de Clopper e Pearson ajustado para o tempo de vigilância. IC não ajustado para multiplicidade.
h O intervalo de confiança (IC) bilateral para a EV é determinado com base no método de Clopper e Pearson ajustado para o tempo de vigilância.
A análise do subgrupo da eficácia da vacina1 incluindo características demográficas é apresentada na Tabela 3.
Tabela 3. Análise do Subgrupo da Eficáciada Vacina1 – Participantes Sem Evidência de Infecção18* Antes dos 7 Dias Após a Dose 2 – População de Eficácia Avaliável
|
Subgrupo |
Comirnaty™ |
Placebo9 |
Eficácia da Vacina1 % |
|
Casos |
Casos |
||
|
Sexo |
|||
|
Feminino |
5 |
81 |
93,7 |
|
Masculino |
3 |
81 |
96,4 |
|
Etnia |
|||
|
Hispânico ou Latino |
3 |
53 |
94,4 |
|
Não Hispânico ou Latino |
5 |
109 |
95,4 |
|
Raça |
|||
|
Negro ou Afro- Americano |
0 |
7 |
100,0 |
|
Branco |
7 |
146 |
95,2 |
|
Todos os outrosf |
1 |
9 |
89,3 |
|
* Foram incluídos na análise participantes que não tinham evidência de infeção prévia pelo SARS-CoV-2 [ou seja, anticorpos43 com N ligante (soro44) negativos na Visita 1 e SARS-CoV-2 não detectado por NAAT (exsudado nasal) nas Visitas 1 e 2], e com NAAT (exsudado nasal) negativo em qualquer visita não programada no período antes de 7 dias após a Dose 2. |
|||
a N = número de participantes no grupo especificado.
b n1 = número de participantes que correspondem à definição do desfecho de avaliação.
c Tempo total de vigilância em 1000 pessoa-anos para o desfecho de avaliação especificado em todos os participantes dentro de cada grupo sob risco para o desfecho de avaliação. O período de tempo para o número acumulado de casos de COVID-19 corresponde a 7 dias após a Dose 2 até ao final do período de vigilância.
d n2 = Número de participantes sob risco para o desfecho de avaliação.
e O intervalo de confiança (IC) para a eficácia da vacina1 é determinado com base no método Clopper e Pearson ajustado ao tempo de vigilância.
f Todos os outros = Índio Americano ou Nativo do Alasca, Asiático, Nativo Havaiano ou outro habitante da Ilha do Pacífico, multirraciais e categorias raciais não reportadas.
As análises de eficácia atualizadas foram realizadas com casosadicionais de COVID-19 confirmados acumulados durante o acompanhamentocego controladopor placebo9 até 13 de março de 2021, representandoaté 6 meses de acompanhamentoapós a Dose 2 para participantes na populaçãode eficácia.
As informações atualizadas sobre a eficácia da vacina1 são apresentadas na Tabela 4.
Tabela 4. Eficácia da Vacina1 - Primeira ocorrência de COVID-19 a partir de 7 dias após a Dose 2, por subgrupo etário - Participantes sem evidência de infecção18 e Participantes com ou sem evidência de infecção18 antes de 7 dias após a Dose 2 - População de Eficácia Avaliável (7 dias) durante o período de acompanhamento controlado por placebo9
|
Primeira ocorrênciade COVID- 19 a partir de 7 dias após a Dose 2 em participantes sem evidência de infecção18 prévia por SARS-CoV-2* |
|||
|
Subgrupo |
Comirnaty™ |
Placebo9 |
Eficácia da vacina1% |
|
Todos os participantesf |
77 |
850 |
91,3 |
|
16 a 64 anos |
70 |
710 |
90,6 |
|
65 anos ou mais |
7 |
124 |
94,5 |
|
65 a 74 anos |
6 |
98 |
94,1 |
|
75 anos ou mais |
1 |
26 |
96,2 |
|
Primeira ocorrênciade COVID- 19 a partir de 7 dias após a Dose 2 em participantes com ou sem* evidência de infecção18 prévia por SARS-CoV-2 |
|||
|
Subgrupo |
Comirnaty™ |
Placebo9 |
Eficácia da Vacina1% |
|
Todos os participantesf |
81 |
873 |
91,1 |
|
16 a 64 anos |
74 |
727 |
90,2 |
|
65 anos ou mais |
7 |
128 |
94,7 |
|
65 a 74 anos |
6 |
102 |
94,3 |
|
75 anos ou mais |
1 |
26 |
96,2 |
|
Nota: Os casos confirmados foram determinados por transcrição reversa associada a reação em cadeia da polimerase (RT-PCR34) e, pelo menos, 1 sintoma35 consistente com COVID-19 (sintomas36 incluídos: febre37, surgimento ou agravamento de tosse, surgimento ou agravamento de falta de ar, calafrios38, surgimento ou agravamento de dor muscular, perda de paladar39 ou olfato recente, dor de garganta40, diarreia41 ou vômitos42). * Foram incluídos na análise participantes que não tinham evidência de infeção prévia pelo SARS-CoV-2 [ou seja, anticorpos43 com N ligante (soro44) negativos na Visita 1 e SARS-CoV-2 não detectado por NAAT (exsudado nasal) nas Visitas 1 e 2], e com NAAT (exsudado nasal) negativo em qualquer visita não programada no períodoantes de 7 dias após a Dose 2. |
|||
a N = número de participantes no grupo especificado.
b n1 = número de participantes que correspondem à definição do desfecho de avaliação.
c Tempo total de vigilância em 1000 pessoa-anos para o desfecho de avaliação especificado em todos os participantes dentro de cada grupo sob risco para o desfecho de avaliação. O período de tempo para número acumulado de casos de COVID-19 corresponde a 7 dias após a Dose 2 até ao final do período de vigilância.
d n2 = Número de participantes sob risco para o desfecho de avaliação.
e O intervalo de confiança (IC) bilateral para a eficácia da vacina1 é determinado com base no método de Clopper e Pearson ajustado para o tempo de vigilância.
f Casos confirmados incluídos em participantes de 12 a 15 anos de idade: 0 no grupo Comirnaty™ (sem e com ou sem evidência de infecção18 prévia por SARS-CoV-2); 16 e 18 no grupo de placebo9 (sem e com ou sem evidência de infecção18 prévia por SARS-CoV-2, respectivamente).
As análises atualizadas do subgrupo da eficácia da vacina1 por características demográficas são apresentadas na Tabela 5 e na Tabela 6.
Tabela 5. Eficácia da Vacina1 - A primeira ocorrência de COVID-19 a partir de 7 dias após a Dose 2 - Participantes sem evidência de infecção18* antes de 7 dias após a Dose 2 por características demográficas – Populaçãode Eficácia Avaliável (7 dias) durante operíodode acompanhamento controlado por placebo9
|
Subgrupo |
Comirnaty™ |
Placebo9 |
Eficácia da Vacina1% |
|
Sexo |
|||
|
Masculino |
42 |
399 |
90,1 |
|
Feminino |
35 |
451 |
92,4 |
|
Etnia |
|||
|
Hispânico ou Latino |
29 |
241 |
88,5 |
|
Não Hispânico ou Latino |
47 |
609 |
92,6 |
|
Raça |
|||
|
Negro ou Afro-Americano |
4 |
48 |
91,9 |
|
Branco |
67 |
747 |
91,3 |
|
Todos os outrosf |
6 |
55 |
90,0 |
|
País |
|||
|
Argentina |
15 |
108 |
86,5 |
|
Brasil |
12 |
80 |
86,2 |
|
Alemanha |
0 |
1 |
100,0 |
|
África do Sul |
0 |
9 |
100,0 |
|
Turquia |
0 |
5 |
100,0 |
|
Estados Unidos |
50 |
647 |
92,6 |
|
Nota: Os casos confirmados foram determinados por transcrição reversa associada a reação em cadeia da polimerase (RT-PCR34) e, pelo menos, 1 sintoma35 consistente com COVID-19 (sintomas36 incluídos: febre37, surgimento ou agravamentode tosse, surgimento ou agravamento de falta de ar, calafrios38, surgimento ou agravamento de dor muscular, perda de paladar39 ou olfato recente, dor de garganta40, diarreia41 ou vômitos42). Casos confirmados incluídos em participantes de 12 a 15 anos de idade: 0 no grupo Comirnaty™; 16 no grupo de placebo9. * Foram incluídos na análise participantes que não tinham evidência de infeção prévia pelo SARS-CoV-2 [ou seja, anticorpos43 com N ligante (soro44) negativos na Visita 1 e SARS-CoV-2 não detectado por NAAT (exsudado nasal) nas Visitas 1 e 2], e com NAAT (exsudado nasal) negativo em qualquer visita não programada no período antes de 7 dias após a Dose 2. |
|||
- a N = número de participantes no grupo especificado.
- b n1 = número de participantes que correspondem à definição do desfecho de avaliação.
- c Tempo total de vigilância em 1000 pessoa-anos para o desfecho de avaliação especificado em todos os participantes dentro de cada grupo sob risco para o desfecho de avaliação. O período de tempo para número acumulado de casos de COVID-19 corresponde a 7 dias após a Dose 2 até ao final do período de vigilância.
- d n2 = Número de participantes sobrisco pa ra o desfecho de avaliação.
- e O intervalo de confiança (IC) bilateral para a eficácia da vacina1 é determinado com base no método de Clopper e Pearson ajustado para o tempode vigilância.
- f Todos os outros = Índio Americano ou nativo do Alasca, Asiático, nativo Havaiano ou outro habitante das Ilhas do Pacífico, multirraciais e não reportados em categorias raciais.
Tabela 6. Eficácia da vacina1 – Primeira ocorrência de COVID-19 a partir de 7 dias após a Dose 2 – Participantes com ou sem evidência de infecção18 antes de 7 dias após a Dose 2 por características demográficas – População de Eficácia Avaliável (7 dias) durante o período de acompanhamento controlado por placebo9
|
Subgrupo |
Comirnaty™ |
Placebo9 |
Eficácia da Vacina1% |
|
Sexo |
|||
|
Masculino |
44 |
411 |
89,9 |
|
Feminino |
37 |
462 |
92,1 |
|
Etnia |
|||
|
Hispânico ou Latino |
32 |
245 |
87,4 |
|
Não Hispânico ou Latino |
48 |
628 |
92,6 |
|
Raça |
|||
|
Negro ou Afro-Americano |
4 |
49 |
92,0 |
|
Branco |
69 |
768 |
91,3 |
|
Todos os outrosf |
8 |
56 |
86,8 |
|
País |
|||
|
Argentina |
16 |
110 |
85,7 |
|
Brasil |
14 |
82 |
84,2 |
|
Alemanha |
0 |
1 |
100,0 |
|
África do Sul |
0 |
10 |
100,0 |
|
Turquia |
0 |
6 |
100,0 |
|
Estados Unidos |
51 |
664 |
92,6 |
|
Nota: Os casos confirmados foram determinados por transcrição reversa associada a reação em cadeia da polimerase (RT-PCR34) e, pelo menos, 1 sintoma35 consistente com COVID-19 (sintomas36 incluídos: febre37, surgimento ou agravamentode tosse, surgimento ou agravamento de falta de ar, calafrios38, surgimento ou agravamentode dor muscular, perda de paladar39 ou olfato recente, dor de garganta40, diarreia41 ou vômitos42). Casos confirmados incluídosem participantes de 12 a 15 anos de idade: 0 no grupo Comirnaty™; 18 no grupode placebo9. * Foram incluídos na análise participantes que não tinham evidência de infeção prévia pelo SARS-CoV-2 [ou seja, anticorpos43 com N ligante (soro44) negativos na Visita 1 e SARS-CoV-2 não detectado por NAAT (exsudado nasal) nas Visitas 1 e 2], e com NAAT (exsudado nasal) negativo em qualquer visita não programada no período antes de 7 dias após a Dose 2. |
|||
a N = número de participantes no grupo especificado.
b n1 = númerode participantes que correspondem à definição do desfecho de avaliação.
c Tempo total de vigilância em 1000 pessoa-anos para o desfecho de avaliação especificado em todos os participantes dentro de cada grupo sob risco para o desfecho de avaliação. O período de tempo para número acumulado de casos de COVID-19 corresponde a 7 dias após a Dose 2 até ao final do período de vigilância.
d n2 = Número de participantes sob risco para o desfecho de avaliação.
e O intervalo de confiança (IC) bilateral para a eficácia da vacina1 é determinado com base no método de Clopper e Pearson ajustado para o tempo de vigilância.
f Todos os outros= Índio Americano ou nativo do Alasca, Asiático, nativo Havaiano ou outro habitante das Ilhas do Pacífico, multirraciais e não reportados em categorias raciais.
A análise do subgrupo da eficácia da vacina1 por situação de risco nos participantes são apresentadas na Tabela 7.
Tabela 7. Eficáciada Vacina1 – Primeira ocorrência de COVID-19 a partir de 7 dias após a Dose 2, por situação de risco – Participantes sem evidência de infecção18* antes de 7 dias após a Dose 2 – População de Eficácia Avaliável (7 dias)
|
Desfecho de Eficácia |
Comirnaty™ |
Placebo9 |
Eficácia da Vacina1% |
|
Primeira ocorrência de COVID-19 a partir de 7 dias após a Dose 2 |
|||
|
De risco |
|||
|
Sim |
4 |
86 |
95,3 |
|
Não |
4 |
76 |
94,7 |
|
Grupo etário (anos) e de risco |
|||
|
16 a 64 e não de risco |
4 |
69 |
94,2 |
|
16 a 64 e de risco |
3 |
74 |
95,9 |
|
≥65 e não de risco |
0 |
7 |
100,0 |
|
≥65 e de risco |
3 |
12 |
91,7 |
|
Obesog |
|||
|
Sim |
3 |
67 |
95,4 |
|
|
|
|
|
|
Não |
5 |
95 |
94,8 |
|
Grupo etário (anos) e obesos |
|||
|
16 a 64 e não obeso |
4 |
83 |
95,2 |
|
16 a 64 e obeso |
3 |
60 |
94,9 |
|
≥65 e não obeso |
3 |
12 |
91,8 |
|
≥65 e obeso |
0 |
7 |
100,0 |
Abreviações: IMC33 = índicede massa corporal; Ligação N = ligação nucleoproteica ao SARS-CoV-2; NAAT = teste de amplificação do ácido nucleico; SARS-CoV-2 = coronavírus 2 da síndrome5 respiratória aguda grave; EV = eficácia da vacina1.
* Foram incluídos na análise indivíduos que não tinham evidências sorológicas ouvirológicas (antes de 7 dias após receber a última dose) de infecção18 prévia por SARS-CoV-2 [ou seja, anticorpos43 de ligação N (soro44) negativos na Visita 1 e SARS-CoV-2 não detectado pela NAAT (exsudado nasal) nas Visitas 1 e 2] e com NAAT negativo (exsudado nasal) em qualquer visita não programada no período antes de 7 dias após a Dose 2.
a N = número de participantes no grupo especificado.
b n1 = número de participantes que correspondem à definição do desfecho de avaliação.
c Tempo total de vigilância em 1000 pessoa-anos para o desfecho de avaliação especificado em todos os participantes dentro de cada grupo sob risco para o desfecho de avaliação. O período de tempo para o número acumulado de casos de COVID-19 corresponde a 7 dias após a Dose 2 até ao final do período de vigilância.
d n2 = Número de participantes sob risco para o desfecho de avaliação.
e O intervalo deconfiança (IC) para EV é calculado com base no método Clopper e Pearson ajustado para o tempo de vigilância.
f De risco é definido como tendo pelo menos 1 da categoria no Índice de Comorbidade45 de Charlson (ICC) ou obesidade28 (IMC≥30 kg/m2).
g Obeso é definido como IMC33 ≥30 kg/m2.
A eficácia da vacina1 de mRNA contra COVID-19 em prevenir a primeira ocorrência de COVID-19 a partir do períodode 7 dias após a Dose 2, em comparação com placebo9 foide 94,6% (intervalo de confiança 95% de 89,6% a 97,6%) em participantes com idade igual ou superior a 16 anos com ou sem evidência de infecção18 prévia pelo SARS-CoV-2.
Além disso, os resultados de eficácia primária analisados em subgrupos mostraram estimativas de pontos de eficácia semelhantes entre sexos, grupos étnicos, e participantes com comorbidades17 clínicas associadas a um risco elevadode COVID-19 grave.
As análises atualizadas do subgrupo da eficácia da vacina1 por situação de risco nos participantes acompanhados até 6 meses após a Dose 2 (com uma data de corte de 13 de março de 2021) são apresentadas nas Tabelas 8 e 9.
Tabela 8. Eficácia da Vacina1 – Primeira ocorrência de COVID-19 a partir de 7 dias após a Dose 2, por situação de risco – Participantes sem evidência de infecção18* antes de 7 dias após a Dose 2 – População de Eficácia Avaliável (7 dias) durante o período de acompanhamento controlado por placebo9
|
Subgrupo |
Comirnaty™ |
Placebo9 |
Eficácia da Vacina1% |
|
Primeira ocorrência de COVID-19 a partir de 7 dias após a Dose 2f |
77 |
850 |
91,3 |
|
Em riscog |
|||
|
Sim |
35 |
401 |
91,6 |
|
Não |
42 |
449 |
91,0 |
|
Grupo etário (anos) e situação de risco |
|||
|
16 a 64 e não em risco |
41 |
385 |
89,8 |
|
16 a 64 e em risco |
29 |
325 |
91,5 |
|
65 anos ou mais e não em risco |
1 |
53 |
98,1 |
|
65 anos ou mais e em risco |
6 |
71 |
91,8 |
|
Obesoh |
|||
|
Sim |
27 |
314 |
91,6 |
|
Não |
50 4,143 (13.911) |
536 3,952 (13.833) |
91,1 (88,1, 93,5) |
|
Grupo etário (anos) e situação de obesidade28 |
|||
|
16 a 64 e não obeso |
46 |
444 |
90,1 |
|
16 a 64 e obeso |
24 |
266 |
91,3 |
|
≥65 anos ou mais e não obeso |
4 |
79 |
95,2 |
|
≥65 anos ou mais e obeso |
1 |
45 |
93,2 |
Nota: Os casos confirmados foram determinados por transcrição reversa associada a reação em cadeia da polimerase (RT-PCR34) e, pelomenos, 1 sintoma35 consistente com COVID-19 (sintomas36 incluídos: febre37, surgimento ou agravamento de tosse, surgimento ou agravamento de falta de ar, calafrios38, surgimento ou agravamento de dor muscular, perda de paladar39 ou olfato recente, dor de garganta40, diarreia41 ou vômitos42).
* Foram incluídos na análise participantes que não tinham evidência de infeção prévia pelo SARS-CoV-2 [ou seja, anticorpos43 com N ligante (soro44) negativos na Visita 1 e SARS-CoV-2 não detectado por NAAT (exsudado nasal) nas Visitas 1 e 2], e com NAAT (exsudado nasal) negativo em qualquer visita não programada no período antes de 7 dias após a Dose 2.
a n1 = número de participantes que correspondem à definição do desfecho de avaliação.N = número de participantes no grupo especificado.
b Tempo total de vigilância em 1000 pessoa-anos para o desfecho de avaliação especificado em todos os participantes dentro de cada gruposob risco para o desfecho deavaliação. Operíodode tempo para número acumuladode casos de COVID-19 correspondea 7 dias após a Dose 2 atéaofinaldo períodode vigilância.
c n2 = Número de participantes sobrisco pa ra o desfechode avaliação.
d O intervalo de confiança (IC) bilateral para a eficácia da vacina1 é determinado com base no método de Clopper e Pearson ajustado para o tempode vigilância.
e Casos confirmados incluídos em participantes de 12 a 15 anos de idade: 0 no grupo Comirnaty™; 16 nogrupo placebo9.
f De risco é definidocomotendopelo menos 1 da categoria no Índice de Comorbidade45 de Charlson (ICC) ou obesidade28 [IMC33 ≥ 30 kg/m2 ou IMC≥95º percentil(12 a 15 anos de idade)].
g Obeso é definido como IMC33 ≥30 kg/m2. Para o grupo de 12 a 15 anos de idade, a obesidade28 é definida como um IMC33 no percentil 95º ou superior. Consulte os gráficos de crescimento CDC em https://www.cdc.gov/growthcharts/html_charts/bmiagerev.htm.
Tabela 9. Eficácia da Vacina1 – Primeira ocorrência de COVID-19 a partir de 7 dias após a Dose 2, por situação de risco – Participantes com ou sem* evidênciade infecção18 antes de 7 dias após a Dose 2 – População de Eficácia Avaliável (7 dias) durante o períodode acompanhamento controlado por placebo9
|
Subgrupo |
Comirnaty™ |
Placebo9 |
Eficácia da Vacina1 % |
|
Primeira ocorrência de COVID-19 a partir de 7 dias após a Dose 2f |
81 |
873 |
91,1 |
|
Em riscog |
|||
|
Sim |
36 |
410 |
91,6 |
|
Não |
45 |
463 |
90,6 |
|
Grupo etário (anos) e situação de risco |
|||
|
16 a 64 e não em risco |
44 |
397 |
89,3 |
|
16 a 64 e em risco |
30 |
330 |
91,3 |
|
65 anos oumais e não em risco |
1 |
55 |
98,2 |
|
65 anos ou mais e em risco |
6 |
73 |
92,1 |
|
Obesoh |
|||
|
Sim |
28 |
319 |
91,4 |
|
Não |
53 |
554 |
90,8 |
|
Grupo etário (anos) e situação de obesidade28 |
|||
|
16 a 64 e não obeso |
49 |
458 |
89,8 |
|
16 a 64 e obeso |
25 |
269 |
91,0 |
|
65 anos ou mais e não obeso |
4 |
82 |
93,3 |
|
65 anos ou mais e obeso |
1 |
46 |
93,4 |
|
Nota: Os casos confirmados foram determinados por transcrição reversa associada a reação em cadeia da polimerase (RT-PCR34) e, pelo menos, 1 sintoma35 consistente com COVID-19 (sintomas36 incluídos: febre37, surgimento ou agravamento de tosse, surgimento ou agravamento de falta de ar, calafrios38, surgimento ou agravamento de dor muscular, perda de paladar39 ou olfato recente, dor de garganta40, diarreia41 ou vômitos42). * Foram incluídos na análise participantes que não tinham evidência de infeção prévia pelo SARS-CoV-2 [ou seja, anticorpos43 com N ligante (soro44) negativos na Visita 1 e SARS-CoV-2 não detectado por NAAT (exsudado nasal) nas Visitas 1 e 2], e com NAAT (exsudado nasal) negativo em qualquer visita não programada no período antes de 7 dias após a Dose 2. |
|||
a N = número de participantes no grupo especificado.
b n1 = número de participantes que correspondem à definição do desfecho de avaliação.
c Tempo total de vigilância em 1000 pessoa-anos para o desfecho de avaliação especificado em todos os participantes dentro de cada grupo sob risco para o desfecho de avaliação. O período de tempo para número acumulado de casos de COVID-19 corresponde a 7 dias após a Dose 2 até ao final do período de vigilância.
d n2 = Número de participantes sob risco para o desfechode avaliação.
e O intervalo de confiança (IC) bilateral para a eficácia da vacina1 é determinado com base no método de Clopper e Pearson ajustado para o tempo de vigilância.
f Casos confirmados incluídos em participantes de 12 a 15 anos de idade: 0 no grupo Comirnaty™; 18 no grupo placebo9.
g De risco é definido como tendo pelo menos 1 da categoria no Índice de Comorbidade45 de Charlson (ICC) ou obesidade28 [IMC≥30 kg/m2 ou IMC≥95º percentil (12 a 15 anos de idade)].
h Obeso é definido como IMC≥30 kg/m2. Para o grupo de 12 a 15 anos de idade, a obesidade28 é definida como um IMC33 no percentil 95º ou superior. Consulte os gráficos de crescimento CDC em https://www.cdc.gov/growthcharts/html_charts/bmiagerev.htm.
Eficácia contra COVID-19 grave
Análises secundárias de eficácia sugeriram o benefício da vacina1 de mRNA contra COVID-19 na prevenção de COVID-19 grave.
A partir de 14 de novembro de 2020, a eficácia contra COVID-19 grave (tal como definida no protocolo do estudo) ocorrida após a primeira dose foi de 88,9% (IC 95%: 20,1, 99,7) (1 caso no grupo da vacina1 de mRNA contra COVID-19 e 9 casos no grupo placebo9), com uma eficácia estimada da vacina1 de 75,0% (95% IC: - 152,6, 99,5) (1 caso no grupo da vacina1 de mRNA contra COVID-19 e 4 casos no grupo placebo9) contra COVID-19 grave ocorrendo pelo menos 7 dias após a Dose 2.
A eficácia contra COVID-19 grave, definida pelos Centros de Controle e Prevenção de Doenças como hospitalização, admissão à Unidade de Terapia Intensiva46, intubação ou ventilação47 mecânica, ou morte, foi após a primeira dose, de 92,9% (IC 95%: 53,2, 99,8) (1 caso n ogrupo da vacina1 de mRNA contra COVID-19 e 14 casos no grupo placebo9).
A partir de 13 de março de 2021, a eficácia da vacina1 contra a COVID-19 grave é apresentada apenas para participantes com ou sem infecção18 prévia por SARS-CoV-2 (Tabela 10), uma vez que a contagem de casos de COVID-19 em participantes sem infecção18 prévia por SARS-CoV-2 foi idêntica à dos participantes com ou sem infecção18 prévia por SARS-CoV-2 em ambos os grupos, placebo9 e Comirnaty™.
Tabela 10. Eficácia da Vacina1 – Primeira ocorrência grave de COVID-19 em participantes com ou sem* infecção18 prévia por SARS-CoV-2 com base na definição do FDA† ou dos Centros de Controle e Prevenção de Doenças (CDC)‡ após a Dose 1 ou a partir de 7 Dias após a Dose 2 no acompanhamento controlado por placebo9
|
Eficácia da Vacina1 - Primeira ocorrência grave de COVID-19 com base na definição do FDA |
|||
|
|
Comirnaty™ |
Placebo9 |
Eficácia da Vacina1% |
|
Após a Dose 1d |
1 |
30 |
96,7 |
|
7 dias após a Dose 2f |
1 |
21 |
95,3(70,9, 99,9) |
|
Após a dose 1d |
1 |
45 |
97,8 |
|
7 dias após a Dose 2f |
0 |
32 |
100 |
Nota: Os casos confirmados foram determinados por transcrição reversa associada a reação em cadeia da polimerase (RT-PCR34) e, pelo menos, 1 sintoma35 consistente com COVID-19 (sintomas36 incluídos: febre37, surgimento ou agravamento de tosse, surgimento ou agravamento de falta de ar, calafrios38, surgimento ou agravamento de dor muscular, perda de paladar39 ou olfato recente, dor de garganta40, diarreia41 ou vômitos42).
Foram incluídos na análise participantes quenãotinham evidência de infeçãoprévia pelo SARS-CoV-2 [ouseja, anticorpos43 com Nligante (soro44) negativos na Visita 1 e SARS-CoV-2 nãodetectadopor NAAT (exsudadonasal) nas Visitas 1 e 2], e com NAAT (exsudado nasal) negativo em qualquer visita não programada no períodoantes de 7 dias após a Dose 2.
† Doença grave de COVID-19, tal como definida pelo FDA, é COVID-19 confirmada e presença de pelo menos 1 dos seguintes:
- Sinais48 clínicos em repouso indicativos de doença sistêmica grave (frequência respiratória ≥ 30 respirações por minuto, frequência cardíaca ≥ 125 batimentos por minuto, saturação de oxigênio ≥ 93% no ar ambiente ao nível do mar, ou relação entre a pressão parcial de oxigênio arterial e o oxigênio inspirado fracionário <300 mm Hg);
- Insuficiência respiratória49 [definida como a necessidade de oxigênio de fluxo elevado, ventilação47 não invasiva, ventilação47 mecânica ou oxigenação da membrana extracorpórea (ECMO)];
- Prova de choque50 (pressão arterial sistólica51 <90 mm Hg, pressão arterial diastólica52 <60 mm Hg, ou que requeira vasopressores);
- Disfunção renal53, hepática31 ou neurológica aguda significativa;
- Admissão a uma Unidade de Cuidados Intensivos;
- Morte.
‡ Doença grave de COVID-19, tal como definida pelo CDC, é COVID-19 confirmada e presença de pelo menos 1 dos seguintes:
- Hospitalização;
- Admissão à Unidadede Cuidados Intensivos;
- Intubação ou ventilação47 mecânica;
- Morte.
a n1 = número de participantes que correspondem à definição do desfecho de avaliação.
b n2 = número de participantes sob risco para o desfecho de avaliação.
c O intervalo de confiança (IC) bilateral para a eficácia da vacina1 é determinado com base no método de Clopper e Pearson ajustado para o tempo de vigilância.
d Eficácia avaliada com base na população de Dose 1 com eficácia total (intenção de tratar modificada) que incluiu todos os participantes randomizados que receberam pelo menos 1 dose de intervenção do estudo.
e Tempo total de vigilância em 1000 pessoa-anos para o desfecho de avaliação especificado em todos os participantes dentro de cada grupo sob risco para o desfecho de avaliação. O período de tempo para a acumulaçãode casos de COVID-19 é a partir da Dose 1 até o final do período de vigilância.
f A eficácia avaliada com base na população de eficácia avaliável (7 dias) que incluiu todos os participantes randomizados elegíveis que receberam todas as doses de intervenção do estudo de forma randomizada dentro da janela predefinida, não têm outros desvios importantes de protocolo, conforme determinado pelo médico.
g Tempo total de vigilância em 1000 pessoa-anos para o desfecho de avaliação especificado em todos os participantes dentro de cada grupo sob risco para o desfecho de avaliação. O período de tempo para a acumulaçãode casos de COVID-19 é a partir de 7 dias após a Dose 2 até ao final do período de vigilância.
Eficácia e imunogenicidade em adolescentes entre 12 e 15 anos de idade
Foi realizada uma análise do Estudo 2 em adolescentes entre 12 e 15 anos de idade até a data de corte de 13 de marçode 2021.
A informação sobre a eficácia da vacina1 em adolescentes entre 12 e 15 anos de idade é apresentada na Tabela 11.
Tabela 11. Eficácia da Vacina1 – Primeira ocorrência de COVID-19 a partir de 7 dias após a Dose 2, sem evidênciade infecção18 e com ou sem evidência de infecção18 antes de 7 dias após a Dose 2 – Período de acompanhamento controlado por placebo9 cego, População de Eficácia Avaliável (7 dias) adolescentes entre 12 e 15 anos de idade
|
Primeira ocorrência de COVID-19 a partir dos 7 dias após a Dose 2 em adolescentes entre 12 e 15 anos de idade sem evidência de infecção18 prévia por SARS-CoV-2* |
|||
|
|
Comirnaty™ |
Placebo9 |
Eficácia da Vacina1% |
|
Adolescentes entre 12 e 15 anos deidade |
0 |
16 |
100,0 |
|
Primeira ocorrência de COVID-19 a partir de 7 dias após a Dose 2 em adolescentes entre 12 e 15 anos de idade com ou sem evidência de infecção18 prévia por SARS-CoV-2 |
|||
|
|
Comirnaty™ |
Placebo9 |
Eficácia da Vacina1% |
|
Adolescentes entre 12 e 15 anos deidade |
0 |
18 |
100,0 |
Nota: Os casos confirmados foram determinados por transcriçã oreversa associada a reação em cadeia da polimerase (RT-PCR34) e pelo menos 1 sintoma35 consistente com COVID-19 (sintomas36 incluídos: febre37, surgimento ou agravamento de tosse, surgimento ou agravamento de falta de ar, calafrios38, surgiment oou agravamento de dor muscular, perda de paladar39 ou olfato recente, dor de garganta40, diarreia41 ou vômitos42).
* Foram incluídos na análise participantes que não tinham evidência de infeção prévia pelo SARS-CoV-2 [ou seja, anticorpos43 com N ligante (soro44) negativos na Visita 1 e SARS-CoV-2 não detectado por NAAT (exsudado nasal) nas Visitas 1 e 2], e com NAAT (exsudado nasal) negativo em qualquer visita não programada no período antes de 7 dias após a Dose 2.
a N = número de participantes no grupo especificado.
b n1 = número de participantes que correspondem à definição do desfecho de avaliação.
c Tempo total de vigilância em 1000 pessoa-anos para o desfecho de avaliação especificado em todos os participantes dentro de cada grupo sob risco para o desfecho de avaliação. O período de tempo para número acumulado de casos de COVID-19 corresponde a 7 dias após a Dose 2 até ao final do período de vigilância.
d n2 = Número de indivíduos sob risco para o desfecho de avaliação.
e O intervalo de confiança (IC) para a eficácia da vacina1 é determinado com base no método de Clopper e Pearson ajustado para o tempo de vigilância.
Em uma análise do Estudo 2 realizada em adolescentes de 12 a 15 anos de idade sem evidência de infecção18 anterior, não houve casos em 1.005 participantes que receberam a vacina1 e 16 casos de 978 que receberam placebo9. A estimativa pontual de eficácia é de 100% (intervalo de confiança de 95% 75,3, 100,0). Nos participantes com ou sem evidência de infecção18 anterior, houve 0 casos em 1119 que receberam a vacina1 e 18 casos em 1110 participantes que receberam placebo9. Isso também indica que a estimativa pontual para eficácia é de 100% (intervalo de confiança de 95% 78,1, 100,0).
No Estudo 2, uma análise dos títulos neutralizantes de SARS-CoV-2 1 mês após a Dose 2 foi realizada em um subgrupo de participantes selecionados aleatoriamente que não tinham evidências sorológicas ou virológicas de infecção18 anterior por SARS CoV-2 até 1 mês após a Dose 2, comparando a resposta entre adolescentes de 12 a 15 anos de idade (n = 190) com participantes de 16 a 25 anos de idade (n = 170).
A relação dos títulos médios geométricos (GMT) na faixa de 12 a 15 anos para a faixa de 16 a 25 anos foi de 1,76, com um IC de 95% bilateral entre 1,47 e 2,10. Portanto, o critério de não inferioridade de 1,5 vezes foi atendido, pois o limite inferior do IC de 95% bilateral para a relação média geométrica [GMR] foi> 0,67.
Análise de imunogenicidade
Para os resultados de imunogenicidade dos títulos de neutralização ao SARS-CoV-2, e das concentrações de IgG de ligação S1 ou RBD, o GMT ou GMCs foram calculados com os intervalos de confiança (ICs) de 95% na população avaliável para imunogenicidade para a Dose 2.
Os resultados de imunogenicidade de 360 participantes na Fase 2 deste estudo demonstraram que a vacina1 na dose de 30μg induziu resposta robusta de anticorpos43 neutralizantes e IgGligantes a S1 pa ra SARS-CoV-2 ao fim de 1 mês após a Dose 2 semelhantes às previamente observadas na Fase 1 do estudo. Notavelmente, os títulos neutralizantes para SARS-CoV-2 (GMTs/GMCs) eram mais elevados nos participantes mais jovens (18 a 55 anos de idade) do que nos participantes mais velhos (56 a 85 anos de idade).
Tabela 12. Resumo da Média Geométrica dos Títulos/Concentrações – População de Imunogenicidade – Fase 2 – Dose 2
|
|
Grupo da vacina1 (como randomizado8) |
||||||||
|
BNT162b2 (30 μg) |
Placebo9 |
||||||||
|
18–55 anos |
56–85 anos |
18–85 anos |
18–85 anos |
||||||
|
Teste |
Dose/ Tempo de amostragema |
nb |
GMT/GMCc (IC 95%c) |
nb |
GMT/GMCc (IC 95%c) |
nb |
GMT/GMCc (IC 95%c) |
nb |
GMT/GMCc (IC 95%c) |
|
Teste de neutralização de SARS- CoV-2-NT50 (título) |
1/Prevax |
80 |
10,1 |
88 |
10,3 |
168 |
10,2 |
167 |
10,4 |
|
2/1 Mês |
80 |
399,4 |
87 |
255,0 |
167 |
316,1 |
167 |
10,6 |
|
|
Teste de níveis de IgG para ligação S1 (U/mL) |
1/Prevax |
80 |
0,8 |
88 |
0,8 |
168 |
0,8 |
167 |
0,8 |
|
2/1 Mês |
80 |
7122,8 |
87 |
3960,7 |
167 |
5246,5 |
167 |
1,0 |
|
|
Abreviações: GMC = concentração média geométrica; GMT= título médio geométrico; IgG = imunoglobulina54 G; LLOQ= limite inferior de quantificação; NT50 = título neutralizante a 50%; S1 = subunidade da proteína S1 do spike; SARS-CoV-2 = coronavírus 2 da síndrome5 respiratória aguda grave. |
|||||||||
a Cronograma especificado pelo protocolo para a coleta de amostras de sangue55.
b n = Númerodeindivíduos com resultados dodoseamentoválidose determinantes para odoseamentoespecificado no tempode dose/hora de amostragem indicado.
c Os GMTs, GMCs e limites do IC 95% foram calculados pela exponenciação do logaritmomédio dos títulos ou concentrações e os ICs correspondentes (com basena distribuição t de Student). Os resultados dodoseamentoabaixo do LLOQforam definidos para 0,5 × LLOQ.
As GMFRs dos títulos de neutralização sérica ao SARS-CoV-2 a 50% e as concentrações de IgG com ligação S1 desde antes da vacinação até 1 mês após a Dose 2 (Dia 52) da vacina1 foram robustas, com GMFRs mais elevadas observadas em participantes mais jovens doqueem participantes mais velhos.
Tabela 13. Resumo dos Aumentos das Medias Geométricas Desde Antes da Vacinação para Cada Tempo – População de Imunogenicidade Avaliável Dose 2 - Fase 2
|
|
Grupo da vacina1 (como randomizado8) |
||||||||
|
BNT162b2 (30 μg) |
Placebo9 |
||||||||
|
18–55 anos |
56–85 anos |
18–85 anos |
18–85 anos |
||||||
|
Teste |
Dose/ Tempo de amostragema |
nb |
GMFRc |
nb |
GMFRc |
nb |
GMFRc |
nb |
GMFRc |
|
Teste de neutralização ao SARS-CoV-2-NT50 (título) |
2/1 Mês |
80 |
39,4 |
86 |
24,9 |
166 |
31,1 |
167 |
1,0 |
|
Teste de níveis de IgG para ligação S1 (U/mL) |
2/1 Mês |
80 |
9167,2 |
86 |
4975,5 |
166 |
6679,4 |
167 |
1,2 |
Abreviações: GMFR = aumento da média geométrica; IgG = imunoglobulina54 G; LLOQ = limite inferior de quantificação; NT50 = título neutralizante a 50%; S1 = subunidade da proteína S1 spike; SARS-CoV-2 = coronavírus 2 da síndrome5 respiratória aguda grave.
a Cronograma especificadopelo protocolo para a coleta de amostras de sangue55.
b n = Número deindivíduos com resultados de doseamento válidos e determinados para o doseamento especificado tanto nopontode pré-vacinaçãocomonoponto dedose/amostragem indicado.
c As GMFR e os correspondenteslimites do IC 95% foram calculadaspela exponenciaçãodologaritmomédio dos aumentos das dobragens e as IC correspondentes (com base na distribuição t de Student). Os resultados do ensaio abaixodo LLOQforam definidos para 0,5 × LLOQ.
Alguns participantes na população avaliável para imunogenicidade com a Dose 2, eram pacientes com status positivo para SARS-CoV2 no momento inicial do estudo: um total de 9 participantes com dados de imunogenicidadeno tempode pré-vacinação (5 participantes que receberam vacina1 e 4 que receberam placebo9) e 7 participantes (3 que receberam vacina1 e 4 que receberam placebo9) com dados de imunogenicidade no período de 1 mês após a Dose 2. Em geral, 1 mês após a Dose 2 entre os que receberam vacina1, os GMT neutralizantes para SARS-CoV-2 a 50% em participantes com um status inicialpositivo para SARS-CoV-2 (n=3) e GMCs IgG com ligação S1 em participantes com um status inicial positivo pa ra SARS-CoV- 2 foram numericamente superiores aos observados nos participantes com um status inicialnegativo para SARS-CoV-2 (n=163).
Tabela 14. Resumo dos Títulos Geométricos Médios/Concentrações por Status Inicial ao SARS-CoV-2 – Fase 2 – População de Imunogenicidade Avaliação coma56 Dose 2
|
|
Grupo da vacina1 (comorandomizado) |
|||||||||
|
BNT162b2 (30 μg) |
Placebo9 |
|||||||||
|
18–55 anos |
56–85 anos |
18–85 anos |
18–85 anos |
|||||||
|
Teste |
Dose/ Tempo de amostrage ma |
Status inicial ao SARS-CoV-2b |
nb |
GMT/GM Cc |
nb |
GMT/GM Cc |
nb |
GMT/GM Cc |
nb |
GMT/GM Cc |
|
Teste de neutralizaç ão ao SARS- CoV-2-NT50 (título) |
1/Prevax |
POS |
1 |
31,0 (NE, NE) |
4 |
18,1 |
5 |
20,2 |
4 |
38,4 |
|
NEG |
7 |
10,0 |
8 |
10,0 |
16 |
10,0 |
16 |
10,1 |
||
|
2/1 Mês |
POS |
1 |
4233,0 |
2 |
3469,9 |
3 |
3707,6 |
4 |
53,2 |
|
|
NEG |
7 |
387,6 |
8 |
237,7 |
16 |
301,3 |
16 |
10,2 |
||
|
Teste de níveis de IgG para ligação S1 (U/mL) |
1/Prevax |
POS |
1 |
246,1 |
4 |
36,9 |
5 |
53,9 |
4 |
153,0 |
|
NEG |
7 |
0,7 |
8 |
0,7 |
16 |
0,7 |
16 |
0,7 |
||
|
2/1 Mês |
POS |
1 |
45474,1 |
2 |
23255,3 |
3 |
29080,6 |
4 |
144,4 |
|
|
NEG |
7 |
6957,6 |
8 |
3759,2 |
16 |
5066,1 |
16 |
0,8 |
||
Abreviações: GMC = concentração média geométrica; GMT= título médio geométrico; IgG = imunoglobulina54 G; LLOQ = limite inferior de quantificação; NAAT = teste de amplificação do ácido nucleico; NE = não estimável; NEG = negativo; NT50 = título neutralizante a 50%; POS = positivo; S1 = subunidade da proteína S1 spike; SARS-CoV-2 = coronavírus 2 da síndrome5 respiratória aguda grave.
Nota: Os indivíduos cujo status inicial ao SARS-CoV-2 não pode ser determinado devido à ausência de anticorpos43 de ligação N ou NAAT na Visita 1 não foram incluídos na análise.
a Cronograma especificado pelo protocolo para a coleta de amostras de sangue55.
b Positivo = Anticorpo57 de ligação N positivo na Visita 1, ou NAAT positivo na Visita 1, ou teve história clínica de COVID-19. Negativo= Anticorpo57 negativo de ligação N na Visita 1 e NAAT negativo na Visita 1.
c n = Número de indivíduos com resultados de doseamento válidos e determinantes para o doseamento especificado no ponto de dose/hora de amostragem indicado.
d Os GMTs, GMCs e os limites do IC 95% foram calculados pela exponenciação do logaritmo médio dos títulos ou da concentraçãoe as IC correspondentes (com base na distribuição t de Student). Os resultados do doseamento abaixodo LLOQ foram definidos para 0,5 × LLOQ.
CARACTERÍSTICAS FARMACOLÓGICAS
Propriedades farmacodinâmicas
Mecanismode ação: O RNA mensageiro com nucleosídeo modificado em Comirnaty™ está formulado em nanopartículas lipídicas, permitindo que o RNA não replicante entre nas células3 hospedeiras para permitir a expressão transitória do antígeno58 S do vírus4 SARS-CoV-2. O mRNA codifica a proteína S integralligada à membrana, com duas mutações pontuais na hélice central. A mutação59 destes dois aminoácidos para a prolina bloqueia a proteína S numa conformação pré-fusão antigenicamente preferida. A vacina1 induz imunidade60 celular e produção de anticorpos43 neutralizantes contra o antígeno58 spike (S), o que pode contribuir para a proteção contra a COVID-19.
Propriedades farmacocinéticas
Não aplicável.
Dados de segurançapré-clínica
Os dados não clínicos não revelam riscos especiais para o ser humano, segundo estudos convencionais de toxicidade61 de dose repetida e toxicidade61 reprodutiva e para o desenvolvimento.
Toxicidade61 geral
Os ratos que receberam Comirnaty™ por via intramuscular (3 doses humanas totais uma vez por semana, gerando níveis relativamente superiores nos ratos devido às diferenças de peso corporal) demonstraram algum edema62 e eritema63 no local de injeção64 e aumento dos leucócitos65 (incluindo basófilos e eosinófilos66) consistente com uma resposta inflamatória, bem como vacuolização dos hepatócitos portais sem evidência de lesãohepática. Todos os efeitos foram reversíveis.
Genotoxicidade/Carcinogenicidade
Não foram realizados estudos de genotoxicidadenem decarcinogenicidade. Nãose espera que os componentesda vacina1 (lípidos e mRNA) tenham potencialgenotóxico.
Toxicidade61 reprodutiva
A toxicidade61 reprodutiva e para o desenvolvimento foram investigadas em ratos num estudo combinado de fertilidade e de toxicidade61 para o desenvolvimento em que ratas receberam Comirnaty™ por via intramuscular antes do acasalamento e durante a gestação (tendo recebido 4 doses humanas completas, que geram níveis relativamente superiores nos ratos devido a diferenças de peso corporal, entre o dia 21 antes do acasalamento e o dia 20 de gestação). As respostas de anticorpos43 neutralizantes do SARS-CoV-2 estiveram presentes em animais maternas desde antes do acasalamento até ao final do estudo, no dia 21 pós-natal, bem como nos fetos e na ninhada. Não houve efeitos relacionados com a vacinação na fertilidade da fêmea, na gravidez67, ou no desenvolvimento embrionário-fetal ou no desenvolvimento da ninhada. Não existem dados disponíveis sobre Comirnaty™ quanto à transferência placentária da vacina1 ou excreção no leite.
CONTRAINDICAÇÕES
Comirnaty™ não deve ser administrada a indivíduos com hipersensibilidade ao princípio ativo ou a qualquer um dos excipientes da vacina1.
ADVERTÊNCIAS E PRECAUÇÕES
Rastreabilidade
De modo a melhorar a rastreabilidade dos medicamentos biológicos, o nome e o número de lote do medicamento administrado devem ser registados de forma clara.
Recomendações gerais
Hipersensibilidade e anafilaxia68: Foram notificados eventos de anafilaxia68. Assim como com todas as vacinas injetáveis, devem estar imediatamente disponíveis tratamento médico e supervisão na eventualidade de um evento anafilático após a administração da vacina1.
Recomenda-se uma observação atenta durante, pelo menos, 15 minutos após a vacinação. Não deve administrar- se uma segunda dose da vacina1 a indivíduos que apresentaram anafilaxia68 à primeira dose de Comirnaty™.
Reações relacionadas com ansiedade: Podem ocorrer reações relacionadas com ansiedade, incluindo reação vasovagal (síncope69), hiperventilação, ou reação relacionada com stress, em associação à vacinação como uma resposta psicogênica70 à injeção64 da agulha. É importante que sejam tomadas precauções para evitar lesões71 causadas por desmaio.
Miocardite72 e pericardite73: Casos muito raros de miocardite72 e pericardite73 foram relatados após vacinação com Comirnaty™. Normalmente, os casos ocorreram com mais frequência em homens mais jovens e após a segunda dose da vacina1 e em até 14 dias após a vacinação. Geralmente são casos leves e os indivíduos tendem a se recuperar dentro de um curto período de tempo após o tratamento padrão e repouso. Os profissionais de saúde6 devem estar atentos aos sinais48 e sintomas36 de miocarditee pericardite73 em vacinados.
Comorbidades17: A vacinação deve ser adiada em indivíduos que apresentem doença febril aguda grave ou infeção aguda. A presença de uma infeção ligeira e/ou febre37 baixa não deve causar o adiamento da vacinação.
Trombocitopenia74 e distúrbios da coagulação75: Tal como em outras injeções intramusculares, a vacina1 deve ser administrada com cautela em indivíduos que estejam recebendo tratamento anticoagulante76 ou que apresentem trombocitopenia74 ou qualquer distúrbio da coagulação75 (tal como hemofilia77), uma vez que pode ocorrer hemorragia78 ou hematoma79 após uma administração intramuscular nestes indivíduos.
Indivíduos imunocomprometidos: A eficácia, a segurança e a imunogenicidade da vacina1 não foram avaliadas em indivíduos imunocomprometidos, incluindo aqueles recebendo tratamento imunossupressor80. A eficácia de Comirnaty™ pode ser inferior em indivíduos imunocomprometidos.
Duração da proteção: Desconhece-se a duração da proteçãoproporcionada pela vacina1, uma vez que esta ainda está sendodeterminada por ensaios clínicos81 em curso.
Respostas relacionadas ao estresse do processode vacinação: Alguns indivíduos podem apresentar respostas relacionadas ao estresse associadas ao próprio processo de vacinação. As respostas relacionadas ao estresse são temporárias e se resolvem por conta própria. Eles podem incluir tonturas82, desmaios, palpitações83, aumento da frequência cardíaca, alterações na pressão arterial84, sensação de falta de ar, sensação de formigamento, suor e/ou ansiedade. Os indivíduos devem ser aconselhados a levar os sintomas36 à atenção do fornecedor da vacinação para avaliação e devem ser tomadas precauções para evitar ferimentos causados por desmaios.
Limitações da eficáciada vacina1: Tal como em qualquer vacina1, é possível que a vacinação com Comirnaty™ não proteja todos os indivíduos que receberem a vacina1. É possível que os indivíduos não fiquem totalmente protegidos até 7 dias após a segunda dose da vacina1.
Excipientes
Esta vacina1 contém menos de 1 mmol de POTÁSSIO (39 mg) por dose, ou seja, é praticamente“isenta de potássio”. Esta vacina1 contém menos de 1 mmol de SÓDIO (23 mg) por dose, ou seja, é praticamente “isenta de sódio”.
Atenção: Este medicamento contém AÇÚCAR85, portanto, deve ser usado com cautela em portadores de Diabetes30.
Efeitos na habilidade de dirigir e operar máquinas
Os efeitos de Comirnaty™ sobre a capacidade de dirigir e utilizar máquinas são nulos ou desprezíveis. Contudo, alguns dos efeitos mencionados no item 9. Reações Adversas podem afetar temporariamente a capacidade de conduzir ou utilizar máquinas.
Fertilidade, Gravidez67 e Lactação86
Os dados disponíveis sobre a utilização de Comirnaty™ em mulheres grávidas são limitados. Os estudos em animais não indicam efeitos prejudiciais, diretos ou indiretos, no que diz respeito à gravidez67, ao desenvolvimento embrionário/fetal, ao parto ou desenvolvimento pós-natal (vide item 3. Ca racterísticas Farmacológicas - Dados de segurança pré-clínica). A administração de Comirnaty™ durante a gravidez67 apenas deve ser considerada se os potenciais benefícios superarem quaisquer potenciais riscos para a mãe e para o feto87.
Desconhece-se se Comirnaty™ é excretado noleite humano.
Não se sabe se Comirnaty™ tem impacto na fertilidade. Os estudos com animais não indicam efeitos prejudiciais, diretos ou indiretos, no que diz respeito à fertilidade feminina ou toxicidade61 reprodutiva (vide item 3. Características Farmacológicas - Dados de segurança pré-clínica).
Comirnaty™ é um medicamento classificado na categoria B de risco de gravidez67. Portanto, este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Esta vacina1 não deve ser usada por mulheres grávidas, ou que estejam amamentando, sem orientação médica ou do cirurgião-dentista.
INTERAÇÕES MEDICAMENTOSAS
Não foram realizados estudos de interação.
A administração concomitante de Comirnaty™ com outras vacinas não foi estudada. Não misture Comirnaty™ com outras vacinas/produtos na mesma seringa88.
CUIDADOS DE ARMAZENAMENTO DO MEDICAMENTO
Cuidados de conservação
Conservar no congelador a uma temperatura entre -90 °C e -60 °C. Conservar na embalagem originalpara proteger da luz.
Durante a conservação, minimizar a exposição à luz ambiente e evitar a exposição à luz solar direta e à luz ultravioleta.
Os frascos descongelados podem ser manuseados em condições de luz ambiente.
Quando estiver pronto para descongelar ou usar a vacina1:
- As bandejas com tampas abertas contendo os frascos, ou as bandejas contendo menos de 195 frascos, quando retiradas do compartimento de congelamento (< -60 °C) podem permanecer à temperatura ambiente (< 25 °C) por até 3 minutos para retirada dos frascos oupara a transferência entre ambientes de temperatura ultrabaixa.
- Uma vez retiradoda bandeja, o frascodeve ser descongelado para utilização.
- Após exposiçãoà temperatura ambiente, quando as bandejas de frascos retornarem ao compartimento de congelamento, elas devem permanecer no compartimento de congelamento durante, pelo menos, 2 horas antes de serem removidas novamente.
Para condições de conservação após descongelamentoe diluição do medicamento, vide subitem Prazo de validade.
Prazo de validade
Frasco fechado: 6 meses a temperatura entre -90 °C e -60 °C.
Alternativamente, os frascos fechados podem ser armazenados e transportados entre -25 °C a -15 °C por um período único de até 2 semanas e podem retornar a -90 °C a -60 °C.
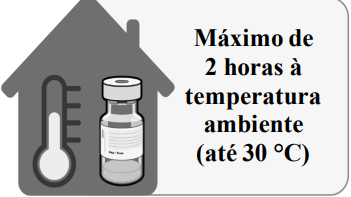
Uma vez retirada do congelador, a vacina1 fechada pode ser armazenada por até 1 mês entre 2 °C e 8 °C. Dentro do prazo de validade de 1 mês a 2 °C a 8 °C, até 12 horas podem ser usadas para o transporte. Antes do uso, a vacina1 fechada pode ser armazenada por até 2 horas a temperatura até 30 °C.
Uma vez descongelada, a vacina1 não deve ser congeladanovamente.
Tratamento de variações de temperatura, uma vez removido do congelador:
Os dados de estabilidade indicamque o frasco fechadoé estávelpor até:
- 24 horas quando armazenado em temperaturas de -3°C a 2°C.
- um total de 4 horas quando armazenado em temperaturas de 8°C a 30°C; isto inclui as 2 horas a temperatura até 30°C como detalhado acima.
Essas informações têm como objetivo orientar os profissionais de saúde6 apenas em caso de variação temporária de temperatura.
Transferência entre ambientes de temperatura ultrabaixa:
- As bandejas de frascos com tampa fechada, contendo 195 frascos, quando removidas do compartimento de congelamento (≤60°C) podem permanecer em temperatura ambiente (<25 °C) por até 5 minutos para transferência entre ambientes de temperatura ultrabaixa.
- Após exposiçãoà temperatura ambiente, quando as bandejas de frascos retornarem ao compartimento de congelamento, elas devem permanecer no compartimento de congelamento durante, pelo menos, 2 horas antes de serem removidas novamente.
Transferência de frascos congelados armazenados entre -25°C a -15°C
- As bandejas de frascos com tampa fechada, contendo 195 frascos, quandoremovidas do compartimento de congelamento(-25 °C a -15 °C) podem permanecer em temperatura de até 25 °C por até 3 minutos.
- As bandejas de frascos com tampa aberta ou bandejas de frascos contendo menos de 195 frascos, removidos do compartimento de congelamento (-25°C a -15°C), podem permanecer em temperatura de até 25 °C por até 1 minuto.
Uma vez que o frasco é removido da bandeja de frascos, ele deve ser descongelado para uso.
Medicamento diluído
A estabilidade química e física, incluindo durante o transporte, foi demonstrada durante 6 horas a uma temperatura entre 2°C e 30°C após diluição em solução injetável de cloreto de sódio 9 mg/mL (0,9%). Do ponto de vista microbiológico11, a vacina1 deve ser utilizada imediatamente. O produto diluído não utilizado no período de 6 horas deverá ser descartado.
Número do lote e datas de fabricaçãoe validade: vide embalagem.
Não use medicamento como prazo de validade vencido. Guarde-o em sua embalagem original.
Características físicas e organolépticas do produto
Dispersão congelada branca a esbranquiçada.
Antes de usar, observe o aspecto do medicamento.
TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS.
POSOLOGIA E MODO DE USAR
Posologia
Indivíduos com idade igual ou superior a 12 anos
Comirnaty™ é administrada por via intramuscular após a diluição como uma série de 2 doses (0,3 mL cada) com um intervalo recomendado de 21 dias (3 semanas), vide item 2. Resultados de Eficácia.
Não existem dados disponíveis sobre a intercambialidade de Comirnaty TM com outras vacinas contra COVID-19 para completar a série de vacinação. Os indivíduos que tenhamrecebido umadosede Comirnaty™ devem receber uma segunda dose de Comirnaty™ para completar a série de vacinação.
Os indivíduos podem nãoestar protegidos até pelo menos 7 dias após a segunda doseda vacina1. Para mais informações sobre eficácia, vide item 2. Resultados de Eficácia.
População pediátrica
A segurança e eficácia de Comirnaty™ em crianças e adolescentes com menos de 12 anos de idade ainda não foram estabelecidas. Os dados disponíveis sãolimitados.
Idosos
Não são necessários ajustes da dose para idosos com idade ≥ 65 anos.
Os estudos clínicos de Comirnaty™ incluem participantes com 65 anos de idade oumais e seus dados contribuem para a avaliação geral de segurança e eficácia. Do número total de indivíduos que receberam Comirnaty™ no Estudo 2 (N = 22.026), 16,5% (n = 3627) foram 65 a 74 anos de idadee 4,2% (n = 925) tinham 75 anos de idade ou mais (vide item 2. Resultados de Eficácia).
Modo de administração
Comirnaty™ deve ser administrada por via intramuscular após diluição (vide subitem Precauções especiais para descarte e outros manuseios).
Após diluição, os frascos de Comirnaty™ contêm seis doses de vacina1, de 0,3 mL por dose. Para extrair seis doses de um único frasco, devem ser usadas seringas e/ou agulhas de baixo volume morto. A combinação de seringa88 de baixo volume morto e agulha deve ter um volume morto não superior a 35 microlitros. Se seringas e agulhas padrão forem usadas, pode não haver volume suficiente para extrair a sexta dose de um mesmo frasco.
Independentemente do tipode seringa88 e agulha:
- Cada dose deve conter 0,3 mL de vacina1.
- Se a quantidade de vacina1 remanescente no frasco não puder fornecer uma dose completa de 0,3 mL, descarte o frasco e qualquer volume remanescente.
- Não junte o remanescente de vacina1 de vários frascos.
O local de aplicação preferencial é o músculo deltoide89 do braço.
Não injete a vacina1 por via intravascular90, subcutânea91 ou intradérmica.
A vacina1 não deve ser misturada na mesma seringa88 com quaisquer outras vacinas ou medicamentos. Para precauções antes da administração da vacina1, vide item 5. Advertências e Precauções.
Para instruções sobre descongelamento, manuseio e descarte da vacina1, vide subitem Precauções especiais para descarte e outros manuseios.
Incompatibilidades
Este medicamento não pode ser misturado com outros medicamentos, exceto aqueles indicados para seu preparo.
Precauções especiais para descarte e outros manuseios Instruções de manuseioComirnaty™ deve ser preparada por um profissional de saúde6 usando técnica asséptica para assegurar a esterilidade92 da dispersão preparada. |
|
|
DESCONGELAMENTO ANTES DA DILUIÇÃO |
|
|
 |
|
|
DILUIÇÃO |
|
|
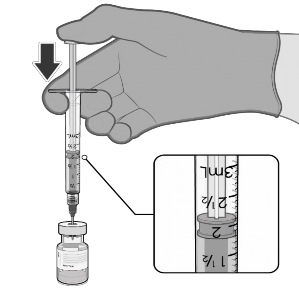 1.8 mL de solução injetável de cloreto de sódio 0.9% |
|
|
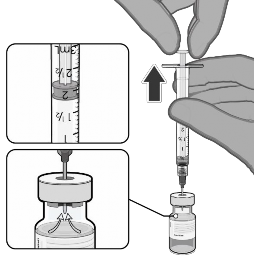 Puxar o êmbolo93 até 1,8 mL para retirar o ar do frasco |
|
|
 Inverter suavemente × 10 |
|
|
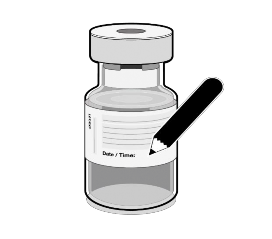 Registar a data e hora apropriada. Usar no prazo de 6 horas após a diluição. |
|
|
PREPARAÇÃO DE DOSES INDIVIDUAIS DE 0,3 ML DE COMIRNATY™ |
|
|
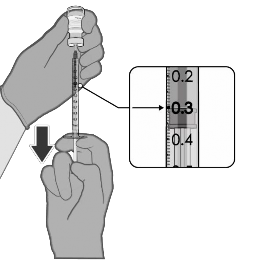 0.3 mL de vacina1 diluída |
|
Descarte
Qualquer medicamento não utilizado ou resíduos devem ser descartados de acordo com as exigências locais.
REAÇÕES ADVERSAS
Resumo do perfil de segurança
A segurança de Comirnaty™ foi avaliada em participantes com idade igual ou superior a 12 anos em 2 estudos clínicos conduzido nos Estados Unidos, Europa, Turquia, África do Sul e América do Sul. O Estudo BNT162-01 (Estudo 1) envolveu 60 participantes, de 18 a 55 anos de idade e 36 participantes, de 56 a 85 anos de idade. O Estudo C4591001 (Estudo 2) envolveu aproximadamente 46.000 participantes, com 12 anos de idade ou mais.
A segurança de Comirnaty™ foi avaliada em participantes com 12 anos de idade ou mais em 2 estudos clínicos que incluíram 22.875 participantes (composto por 21.744 participantes com 16 anos de idade ou mais e 1.131 adolescentes com 12 a 15 anos de idade) que receberam pelo menos uma dose de Comirnaty™.
O perfil de segurança geral de Comirnaty™ em adolescentes de 12 a 15 anos de idade foi semelhante ao observado em participantes de 16 anos de idade ou mais.
Participantes com idade igual ou superior a 16 anos
No Estudo 2, um total de 22.026 participantes com idade igual ou superior a 16 anos receberam, pelo menos, 1 dose de Comirnaty™ e um total de 22.021 participantes com idade igual ou superior a 16 anos receberam placebo9 (incluindo 138 e 145 adolescentes com 16 e 17 anos de idade nos grupos da vacina1 e de placebo9, respetivamente). Um total de 20.519 participantes com idade igualou superior a 16 anos receberam 2 doses de Comirnaty™.
No momento da análise do Estudo 2, um total de 19.067 participantes (9.531 participantes que receberam Comirnaty™ e 9.536 participantes que receberam placebo9) com idade igual ou superior a 16 anos foram avaliados quanto à segurança durante, pelo menos, 2 meses após a segunda dose de Comirnaty™. Esta análise incluiu 10.727 participantes (5.350 participantes que receberam Comirnaty™ e 5.377 participantes que receberam placebo9) com idade entre os 16 e os 55 anos, e 8.340 participantes (4.181 participantes que receberam Comirnaty™ e 4.159 participantes que receberam placebo9) com idade igualou superior a 56 anos.
As reações adversas mais frequentes em participantes com idade igual ou superior a 16 anos (em ordem das frequências mais altas para as mais baixas) foram dor no local de injeção64 (> 80%), fadiga95 (> 60%), cefaleias96 (> 50%), mialgia97 (> 40%), calafrios38 (> 30%), artralgia98 (> 20%), pirexia99 e inchaço100 no local de injeção64 (> 10%) e geralmente foram de intensidade leve ou moderada e resolveram-se alguns dias após a vacinação. Uma frequência inferior de reatogenicidade foi associada à idade mais avançada.
O perfil de segurança em 545 indivíduos que receberam Comirnaty™, e que eram soropositivos para o vírus4 SARS-CoV-2 no início do estudo, foi semelhante ao observado na população em geral.
O Estudo 2 também incluiu 200 participantes com infecção18 pelo vírus4 da imunodeficiência12 humana estável (HIV13) confirmada. O perfil de segurança dos participantes que receberam Comirnaty™ (n = 100) nos indivíduos com infecção18 estável por HIV13 foi semelhante ao observado na população em geral.
Adolescentes de 12 a 15 anos de idade
Em uma análise do Estudo 2, com base em dados até a data de cortede 13 de março de 2021, 2.260 adolescentes (1.131 Comirnaty™; 1.129 placebo9) tinham de 12 a 15 anos de idade. Destes, 1.308 adolescentes (660 Comirnaty™ e 648 placebo9) foram acompanhados por pelo menos 2 meses após a segunda dosede Comirnaty™. A avaliação de segurança no Estudo 2 está em andamento.
As reações adversas mais frequentes em adolescentes de 12 a 15 anos de idade foram dor no local da injeção64 (>90%), fadiga95 e cefaleia101 (>70%), mialgia97 e calafrios38 (>40%), artralgia98 e febre37 (>20%).
Lista tabelada de reações adversas em estudos clínicos e experiência pós-autorização em indivíduos com 12 anos de idade ou mais
As reações adversas observadas durante os estudos clínicos estão listadas abaixo de acordo com as seguintes categorias de frequência:
Tabela 15: Reações adversas em estudos clínicos com Comirnaty™ e experiência pós-autorização em indivíduos com 12 anos de idade ou mais
|
Classe de sistemas de órgãos |
Muito comuns |
Comuns |
Incomuns |
Raros |
Desconhecido |
|
Distúrbios do sangue55 e do sistema linfático102 |
|
|
Linfadenopatia |
|
|
|
Distúrbios do sistema imunitário103 |
|
|
Reações de hipersensibilidade (por exemplo, erupção104 cutânea105, prurido106, urticária107a,c, angioedema108a,c) |
|
Anafilaxia68c |
|
Distúrbios do metabolismo109 e nutricionais |
|
|
Diminuição de apetite |
|
|
|
Distúrbios do foro psiquiátrico |
|
|
Insônia |
|
|
|
Distúrbios do sistema nervoso110 |
Cefaleia101 |
|
Letargia111 |
Paralisia112 facial periférica agudab |
|
|
Distúrbios gastrointestinais |
Diarreia41c |
Náusea113; vômito114c |
|
|
|
|
Distúrbios da pele e tecido subcutâneo115 |
|
|
Hiperidrose116; suor noturno |
|
|
|
Distúrbios musculoesqueléticos e dos tecidos conjuntivos |
Artralgia98; mialgia97 |
|
Dor nas extremidadesd |
|
|
|
Distúrbios gerais e alterações no local de administração |
Dor no local de injeção64; fadiga95; arrepios; pirexia99e; inchaço100 no local de injeção64 |
Rubor no local de injeção64 |
Astenia117; mal-estar geral; prurido106 no local de injeção64 |
|
|
a A frequência para as categorias urticária107 e angioedema108 foi rara.
b Durante o período de acompanhamento de segurança do ensaio clínico até 14 de Novembro de 2020, foi notificada a ocorrência de paralisia112 facial periférica aguda (ou paralisia112) em quatro participantes no grupo da vacina1 de mRNA contra COVID-19. O início da paralisia112 facial ocorreu no Dia 37 após a Dose 1 (o participante não recebeu a Dose 2) e nos Dias 3, 9, e 48 após a Dose 2. Não foram notificados casos de paralisia112 facial periférica aguda (ou paralisia112) no grupo de placebo9.
c Reações adversas determinadas pós-autorização.
d Relacionado ao braço que recebeu a vacina1.
e Observou-se uma maior frequência de pirexia99 após a segundadose.
Notificação de suspeitas de reações adversas
A notificação de suspeitas de reações adversas após a autorização do medicamento é importante. Isto permite um monitoramento contínuo da relação risco-benefício do medicamento. Pede-se aos profissionais de saúde6 que notifiquem quaisquer suspeitas de reações adversas e queincluam o número delote se disponível.
Atenção: este produtoé um medicamentonovoe, emboraas pesquisas tenhamindicadoeficáciae segurança aceitáveis, mesmoque indicado e utilizadocorretamente, podem ocorrereventos adversos imprevisíveis ou desconhecidos. Nesse caso, notifique os eventos adversos pelo Sistema VigiMed, disponível no Portal da Anvisa.
SUPERDOSE
Estão disponíveis dados sobre a sobredosagem de 52 participantes incluídos no ensaio clínico que, devido a um erro na diluição, receberam 58 microgramas de Comirnaty™. Os indivíduos vacinados não apresentaram qualquer aumento na reatogenicidade ou reações adversas.
Em caso de sobredosagem, recomenda-se a monitoramento dos sinais vitais118 e o possível tratamento sintomático119.
Em caso de intoxicação ligue para 08007226001, se você precisar de mais orientações.
DIZERES LEGAIS
VENDA SOB PRESCRIÇÃO MÉDICA
MS – 1.2110.0481
Farmacêutica Responsável:
Liliana R. S. Bersan – CRF-SP nº 19167
Registrado por:
Wyeth Indústria Fa rmacêutica Ltda.
Rua Alexandre Dumas, 1.860
CEP 04717-904 – São Paulo – SP
CNPJ nº 61.072.393/0001-33
Fabricado por:
Polymun Scientific
Immunbiologische Forschung GmbH, Donaustraße 99
3400 Klosterneuburg - Áustria
Pfizer Manufacturing Belgium NV
Rijksweg 12, Puurs, 2870
Bélgica
mibe GmbH Arzneimittel
Münchener Straße 15, 06796
Brehna - Alemanha
Embalado por:
Pfizer Manufacturing Belgium NV
Rijksweg 12, Puurs, 2870
Bélgica
OU
Fabricado e Embalado por:
Pharmacia & Upjohn Company LLC
Kalamazoo – EUA
OU
Fabricado e Embalado por:
Hospira, Inc.
McPherson – EUA
Importado por:
Wyeth Indústria Farmacêutica Ltda.
Rodovia Presidente Castelo Branco, nº 32501, km 32,5
CEP 06696-000 – Itapevi– SP
SAC 0800 0160625