Vagifem (Bula do profissional de saúde)
BESINS HEALTHCARE BRASIL COMERCIAL E DISTRIBUIDORA DE MEDICAMENTOS LTDA
IDENTIFICAÇÃO DO MEDICAMENTO
Vagifem
estradiol hemi-hidratado
Comprimidos vaginais 10 mcg
FORMA FARMACÊUTICA E APRESENTAÇÃO:
Comprimido vaginais
Embalagem com 18 comprimidos acompanhados de aplicadores individuais
VIA VAGINAL
USO ADULTO
COMPOSIÇÃO:
Cada comprimido vaginal de Vagifemcontém:
| estradiol hemi-hidratado | 10 mcg |
| excipiente q.s.p. | 1 comprimido |
Excipientes: Interior do comprimido: hipromelose, lactose1 monoidratada, amido, estearato de magnésio. Película de revestimento: hipromelose, macrogol.
INFORMAÇÕES TÉCNICAS AOS PROFISSIONAIS DE SAÚDE2
INDICAÇÕES
Vagifem® é destinado ao tratamento de atrofia3 vaginal devido à deficiência de estrógenos em mulheres na pós-menopausa4.
RESULTADOS DE EFICÁCIA
Um estudo multicêntrico de 12 meses, duplo cego, randomizado5, com grupo paralelo, controlado por placebo6 foi conduzido para avaliar a eficácia e segurança de Vagifem® 10 microgramas no tratamento dos sintomas7 de atrofia3 vaginal pós-menopausa4.
Após 12 semanas de tratamento com Vagifem® 10 microgramas, a mudança da linha basal, em comparação com o tratamento com placebo6, demonstrou melhorias significativas nos 3 objetivos primários: Índice e Valor de Maturação Vaginal, normalização do pH vaginal e alívio dos sintomas7 urogenitais moderados/graves considerados mais incômodos pelas pacientes.
Índice de maturação vaginal1
Vagifem® 10 mcg demonstrou vantagens significativas no índice de maturação vaginal, quando comparada ao do grupo placebo6, na 12ª semana de tratamento:
- A proporção média de células8 superficiais aumentou em 13% comparado a um aumento de 4% para o placebo6 [IC 95% (6,2– 13,8), (p< 0,001)];
- A proporção média de células8 intermediárias aumentou em 24% comparado a um aumento de 5% para o placebo6 [IC 95% (12,3–25,0), (p< 0,001)];
- A proporção média de células8 parabasais diminuiu em 37% comparado a uma diminuição de 9% para o placebo6 [IC 95% (- 34,6–22,8), (p< 0,001)].
Valor de maturação vaginal
O valor de maturação vaginal foi significativamente maior no grupo Vagifem® 10 mcg (31,6), comparado ao grupo placebo6 (8,3), (p < 0,001), após 2 semanas de tratamento. A melhora significativa foi mantida até a 12ª semana de tratamento [IC 95% (15.5–23.2), (p< 0,001)].
pH vaginal
Após a 12ª semana de tratamento, a redução do pH vaginal no grupo Vagifem® foi significativamente maior quando comparada ao do grupo placebo6 [IC 95% (-1,08 – -0,55), (p< 0,001)]. As diferenças significativas entre os níveis de pH vaginal do grupo Vagifem® 10 mcg foram mantidas até a 52ª semana de tratamento [IC 95% (-1,04 – -0,47), (p< 0,001)].
Sintomas7 mais incômodos
Após a 12ª semana de tratamento, os escores médios de intensidade dos sintomas7 urogenitais mais incômodos tiveram uma redução média significativa no grupo Vagifem® 10 mcg quando comparada a do grupo placebo6, sendo de -0,87 para o grupo placebo6 e – 1,23 para o grupo Vagifem® 10 mcg [IC 95%([–0.55 - –0.12), (p=0.003)].
O alívio dos sintomas7 com o tratamento com Vagifem® 10 mcg eram aparentes na 4ª semana de tratamento (p=0,053) e foram estatisticamente significantes na 8ª semana (-0,91 para o grupo placebo6 e –1,20 para o grupo Vagifem® 10 mcg, p=0.014).
A segurança endometrial de Vagifem® 10 mcg foi avaliada no ensaio acima mencionado e em um segundo ensaio multicêntrico aberto. No total, 386 mulheres foram submetidas à biópsia9 endometrial no início e no final do tratamento de 52 semanas. A incidência10 de hiperplasia11 e/ou carcinoma12 foi 0,52% [IC 95% [(0,06%-1,86%)], sugerindo não haver aumento de risco.
Referências bibliográficas:
- Simon, J., Nachtigall, L., Gut, R., Lang, E., Archer, D.F., and Utian, W. Obstet Gynecol 2008; 112:1053–1060 Ulrich; L.S.G., Naessen, T., Elia, D., Goldstein, J.A., and Eugster-Hausmann, M. Climacteric 2010; 13:228–237
CARACTERÍSTICAS FARMACOLÓGICAS
Grupo farmacoterapêutico: estrógenos naturais e semissintéticos, simples.
Código ATC: G03CA03.
Farmacodinâmica
O ingrediente ativo, 17β-estradiol sintético, é quimicamente e biologicamente idêntico ao estradiol endógeno humano. O 17β-estradiol endógeno induz e mantém as características sexuais femininas primárias e secundárias. O efeito biológico do 17β-estradiol é realizado por meio de receptores específicos de estrógenos. O complexo esteroide-receptor liga-se ao DNA das células8 e induz à síntese de proteínas13 específicas.
A maturação do epitélio14 vaginal é dependente de estrógenos que aumentam o número de células8 superficiais e intermediárias e diminuem o número de células8 basais no esfregaço vaginal.
Os estrógenos mantêm o pH vaginal em torno da faixa de normalidade (4,5), o que aumenta a flora bacteriana normal.
Farmacocinética
Absorção: Os estrógenos são bem absorvidos através da pele15, das membranas mucosas16 e do trato gastrointestinal. Após a administração
vaginal, o estradiol é absorvido, evitando o metabolismo17 de primeira passagem hepática18.
Um ensaio de 12 semanas, em centro único, randomizado5, aberto, de doses múltiplas e com grupos paralelos foi conduzido para avaliar a extensão da absorção sistêmica de estradiol do comprimido de Vagifem® 10 mcg. As pacientes foram randomizadas 1:1 para receber 10 microgramas ou 25 microgramas de Vagifem®. Os níveis plasmáticos de estradiol (E2), estrona (E1) e sulfato de estrona (E1S) foram determinados. A AUC19(0–24) para os níveis plasmáticos de E2 aumentou quase proporcionalmente após a administração de 10 microgramas e 25 microgramas de Vagifem®. A AUC19(0–24) indicou níveis sistêmicos20 de estradiol mais elevados para o comprimido de E2 de 10 microgramas, em comparação com a linha basal, nos dias de tratamento 1, 14 e 83, sendo estatisticamente significante nos dias 1 e 14 (Tabela 1). No entanto, as concentrações médias plasmáticas de E2 (Cave (0–24)), em todos os dias avaliadoss, mantiveram-se dentro da faixa normal de pós-menopausa4 em todas as pacientes. Os dados dos dias 82 e 83, comparados com a linha basal, indicam que não há efeito cumulativo durante a terapia de manutenção duas vezes por semana.
Tabela 1. Valores de parâmetros farmacocinéticos de concentrações plasmáticas de estradiol (E2):
|
Vagifem® 10 microgramas |
||
|
|
AUC19(0–24) pg.h/ml |
Cave(0–24) pg/ml |
|
Dia -1 |
75.65 |
3.15 |
|
Dia 1 |
225.35 |
9.39 |
|
Dia 14 |
157.47 |
6.56 |
|
Dia 82 |
44.95 |
1.87 |
|
Dia 83 |
111.41 |
4.64 |
Os níveis de estrona e sulfato de estrona vistos após 12 semanas de administração de Vagifem® 10 microgramas não excederam os níveis basais, ou seja, nenhum acúmulo de estrona ou sulfato de estrona foi observado.
Distribuição: A distribuição dos estrógenos exógenos é semelhante à dos estrógenos endógenos. Os estrógenos são amplamente distribuídos no corpo e são geralmente encontrados em concentrações mais elevadas nos órgãos-alvo do hormônio21 sexual. Os estrógenos circulam no sangue22 em grande parte ligados à globulina23 ligadora de hormônios sexuais (SHBG) e albumina24.
Biotransformação: Os estrógenos exógenos são metabolizados da mesma maneira que os estrógenos endógenos. As transformações metabólicas ocorrem principalmente no fígado25. O estradiol é convertido reversivelmente em estrona, e ambos podem ser convertidos em estriol, que é o principal metabolito26 urinário. Em mulheres na pós-menopausa4, uma parcela significativa dos estrógenos circulantes existe como conjugados de sulfato, especialmente sulfato de estrona, que serve como reservatório circulante para a formação de estrógenos mais ativos.
Eliminação: Estradiol, estrona e estriol são excretados na urina27 junto com os conjugados glicuronídeos e sulfatos.
Grupos de pacientes especiais: A extensão da absorção sistêmica de estradiol durante o tratamento com Vagifem® 10 microgramas foi avaliada somente em mulheres na pós-menopausa4 com idade entre 60–70 anos (idade média de 65,4).
CONTRAINDICAÇÕES
- Câncer28 de mama29 conhecido, passado ou suspeito;
- Tumores malignos dependentes de estrógenos conhecidos, passados ou suspeitos (ex.: câncer28 de endométrio30);
- Sangramento genital não diagnosticado;
- Hiperplasia endometrial31 não tratada;
- Tromboembolismo32 venoso anterior ou atual (trombose venosa profunda33, embolia34 pulmonar);
- Transtornos trombofílicos conhecidos (ex.: deficiência de proteína C, proteína S ou antitrombina);
- Doença tromboembólica arterial ativa ou anterior (ex.: angina35, infarto do miocárdio36);
- Doença hepática18 aguda, histórico de doença hepática18, ou enquanto os testes de função hepática18 não retornarem ao normal;
- Hipersensibilidade conhecida aos componentes ativos ou a qualquer dos excipientes;
- Porfiria37.
Este medicamento é contraindicado para uso por lactantes38.
ADVERTÊNCIAS E PRECAUÇÕES
Para o tratamento de sintomas7 pós-menopausa4, a TRH só deve ser iniciada para sintomas7 que afetem negativamente a qualidade de vida. Em todos os casos, uma avaliação cuidadosa dos riscos e benefícios deve ser realizada pelo menos anualmente e a TRH somente deve ser continuada enquanto o benefício compensar o risco.
As evidências sobre os riscos associados à TRH no tratamento da menopausa4 prematura são limitadas. No entanto, devido ao baixo nível de risco absoluto em mulheres mais jovens, o equilíbrio de riscos e benefícios para estas mulheres pode ser mais favorável do que em mulheres mais velhas.
Exames/acompanhamentomédico
Antes de iniciar ou retomar a terapia hormonal um histórico médico pessoal e familiar completo deve ser obtido. Exames físicos (incluindo pélvico39 e de mama29) devem ser orientados nesse sentido e pelas contraindicações e advertências de uso. Durante o tratamento, são recomendados exames periódicos, de frequência e natureza adaptados individualmente. As mulheres devem estar cientes que as mudanças em seus seios40 devem ser comunicadas ao seu médico. As investigações incluindo ferramentas apropriadas de imagem, como por exemplo, mamografias, devem ser efetuadas de acordo com as práticas atualmente aceitas de rastreio, modificadas para as necessidades clínicas de cada paciente.
O perfil farmacocinético de Vagifem® mostra que há uma absorção sistêmica muito baixa do estradiol durante o tratamento, no entanto, sendo um produto de TRH, o seguinte precisa ser considerado, especialmente para o uso a longo prazo ou repetido deste produto.
Condições que necessitam supervisão
Se qualquer uma das seguintes condições estiverem presentes, tiver ocorrido anteriormente, e/ou tiver sido agravada durante a gravidez41 ou tratamento hormonal anterior, a paciente deve ser supervisionada de perto. Deve ser considerado que estas condições podem reaparecer ou serem agravadas durante o tratamento com estrógenos, em particular:
- Leiomioma42 (miomas uterinos) ou endometriose43;
- Fatores de risco para distúrbios tromboembólicos;
- Fatores de risco para tumores dependentes de estrógenos, ex.: 1º grau de hereditariedade44 para câncer28 de mama29;
- Hipertensão45;
- Distúrbios hepáticos (ex.: adenoma46 de fígado25);
- Diabetes mellitus47 com ou sem envolvimento vascular48;
- Colelitíase49;
- Enxaqueca50 ou dor de cabeça51 severa;
- Lúpus52 eritematoso53 sistêmico54;
- Histórico de hiperplasia endometrial31;
- Epilepsia55;
- Asma56;
- Otosclerose57.
O perfil farmacocinético de Vagifem® mostra que há muito baixa absorção de estradiol durante o tratamento. Devido a isto, a recorrência58 ou agravamento das condições acima mencionadas é menos provável do que com o tratamento sistêmico54 com estrógenos.
Razões para a retirada imediata da terapia:
A terapia deve ser descontinuada caso uma contraindicação seja descoberta e nas seguintes situações:
- Icterícia59 ou deterioração da função hepática18;
- Aumento significativo da pressão arterial60;
- Aparecimento de dor de cabeça51 tipo enxaqueca50;
- Gravidez41.
Vagifem® é uma preparação de estradiol de dose baixa e ação local e, portanto, a ocorrência das condições abaixo mencionadas é menos provável do que com o tratamento sistêmico54 com estrógenos.
Hiperplasia endometrial31 e carcinoma12
Mulheres com útero61 intacto com sangramento anormal de etiologia62 desconhecida ou mulheres com útero61 intacto que tenham sido previamente tratadas com estrógenos sem oposição (ex.: sem progesterona combinada) devem ser examinadas com cuidado especial, de forma a excluir a hiperestimulação/malignidade do endométrio30 antes do início do tratamento com Vagifem®.
Em mulheres com útero61 intacto os riscos de hiperplasia endometrial31 e carcinoma12 são aumentados quando os estrógenos são administrados sozinhos por períodos prolongados. O aumento relatado no risco de câncer28 endometrial entre usuárias de estrógeno63 isolado sistêmico54 varia de 2 a 12 vezes em comparação com as não usuárias, dependendo da duração do tratamento e da dose de estrógenos. Após a interrupção do tratamento, o risco pode permanecer elevado por pelo menos 10 anos.
Durante o tratamento com Vagifem®, um grau menor de absorção sistêmica pode ocorrer em algumas pacientes, especialmente durante as duas primeiras semanas de administração diária. No entanto, as concentrações médias plasmáticas de E2 (Cave (0–24)), em todos os dias avaliados, permaneceram dentro da faixa de normalidade na pós-menopausa4 em todas as pacientes.
A segurança endometrial em longo prazo (mais de um ano) ou o uso repetido de estrógeno63 administrado por via vaginal é incerta. Portanto, se repetido, o tratamento deve ser avaliado pelo menos anualmente, com especial atenção dada a quaisquer sintomas7 de hiperplasia endometrial31 ou carcinoma12.
Como regra geral, a terapia de reposição de estrógeno63 não deve ser prescrita por mais de um ano sem realizar outro exame físico, incluindo os ginecológicos.
Se ocorrer sangramento ou sangramento de escape a qualquer momento durante a terapia, a razão deve ser investigada, o que pode incluir biópsia9 endometrial para excluir malignidade endometrial.
A mulher deve ser aconselhada a contatar o seu médico caso ocorra sangramento ou sangramento de escape durante o tratamento com Vagifem®.
A estimulação estrogênica sem oposição pode levar à transformação pré-maligna ou maligna nos focos residuais da endometriose43. Portanto, é aconselhável ter cuidado ao usar este produto em mulheres que sofreram histerectomia64 por causa de endometriose43, especialmente se possuem endometriose43 residual.
Câncer28 de mama29
A evidência geral sugere um risco aumentado de câncer28 de mama29 em mulheres que utilizam estrógeno63 e progestágeno combinados e possivelmente também TRH de estrógeno63 isolado, o que é dependente da duração da TRH.
O ensaio WHI não constatou aumento no risco de câncer28 de mama29 em mulheres histerectomizadas usando TRH de estrogênica isolada. Estudos observacionais relataram, em sua maioria, um pequeno aumento no risco de ter câncer28 de mama29 diagnosticado, o que é substancialmente menor do que o encontrado em usuárias de combinações de estrógeno63 e progestágeno. O risco adicional torna-se aparente dentro de alguns anos de uso, mas retorna à linha basal dentro de poucos anos (no máximo cinco) após a interrupção do tratamento.
Uma relação entre o risco de câncer28 de mama29 e a terapia com baixa dose de estrógeno63 vaginal é incerta.
A TRH, especialmente o tratamento combinado de estrógeno63 e progestágeno, aumenta a densidade das imagens mamográficas, o que pode afetar adversamente a detecção radiológica do câncer28 de mama29.
Câncer28 de ovário65
O câncer28 de ovário65 é muito mais raro do que o câncer28 de mama29. O uso prolongado (pelo menos de 5 a 10 anos) de produtos de TRH de estrógeno63 isolado tem sido associado a um risco ligeiramente aumentado de câncer28 de ovário65. Alguns estudos, incluindo o ensaio WHI, sugerem que o uso em longo prazo de TRH combinada pode proporcionar um risco semelhante ou um pouco menor.
Uma relação entre o risco de câncer28 de ovário65 e a terapia local com baixa dose de estrógeno63 vaginal é incerta.
Tromboembolismo32 venoso
A TRH está associada a um risco de 1,3 a 3 vezes de desenvolver tromboembolismo32 venoso (TEV), ou seja, trombose venosa profunda33 ou embolia34 pulmonar. A ocorrência de tal evento é mais provável no primeiro ano de TRH do que mais tarde.
As pacientes com estados trombofílicos conhecidos têm um risco maior de TEV e a TRH pode aumentar esse risco. Portanto, a TRH é contraindicada para estas pacientes.
Fatores de risco geralmente reconhecidos para TEV incluem o uso de estrógenos, idade avançada, cirurgia de grande porte, imobilização prolongada, obesidade66 (IMC67 > 30 kg/m²), período de gravidez41/pós-parto, lúpus52 eritematoso53 sistêmico54 (LES) e câncer28. Não há consenso sobre o possível papel das veias68 varicosas na TEV.
Uma relação entre tromboembolismo32 venoso e terapia com baixa dose de estrógeno63 vaginal é incerta.
Como em todas as pacientes no pós-operatório, medidas profiláticas devem ser consideradas para prevenir TEV após cirurgia. Se a imobilização prolongada for seguida de cirurgia eletiva69, é recomendado parar temporariamente a TRH de 4 a 6 semanas antes. O tratamento não deve ser reiniciado até que a mulher tenha a sua mobilidade recuperada.
Em mulheres sem histórico pessoal de TEV, mas com familiar de primeiro grau com histórico de trombose70 em idade jovem, o exame pode ser oferecido após aconselhamento cuidadoso sobre suas limitações (apenas uma proporção de problemas trombofílicos é identificada pelo exame).
Se for identificado um problema trombofílico que segregue com trombose70 em membros da família, ou se o problema for 'grave' (por exemplo, deficiência de antitrombina, proteína S ou proteína C, ou uma combinação de problemas) a TRH é contraindicada. As mulheres já em tratamento crônico71 com anticoagulante72 requerem uma análise cuidadosa do risco-benefício do uso da TRH. Caso se desenvolva TEV após iniciar a terapia, o medicamento deve ser descontinuado. As pacientes devem ser avisadas para entrar imediatamente em contato com seus médicos quando perceberem um sintoma73 tromboembólico (por exemplo, inchaço74 doloroso de uma perna, dor súbita no peito75, dispneia76).
Doença arterial coronária (DAC)
Não há evidências de ensaios clínicos77 randomizados, controlados e de proteção contra infarto do miocárdio36 em mulheres com ou sem DAC existente, que receberam terapia combinada78 de estrógeno63 e progestágeno ou de estrógeno63 isolado.
Os dados controlados randomizados não indicaram risco aumentado de DAC em mulheres histerectomizadas usando a terapia de estrógeno63 isolado.
Acidente vascular cerebral79 isquêmico80
As terapias combinadas de estrógeno63 e progestágeno e de estrógeno63 isolado estão associadas a um aumento de até 1,5 vez no risco de AVC isquêmico80. O risco relativo não muda com a idade ou o tempo desde a menopausa4. No entanto, como o risco de AVC é fortemente dependente da idade, o risco geral de AVC em mulheres que usam a TRH aumenta com a idade.
Uma relação entre AVC isquêmico80 e a terapia local com baixa dose de estrógeno63 vaginal é incerta.
Outras condições
Estrógenos podem causar retenção de líquidos, e, portanto, as pacientes com disfunção cardíaca ou renal81 devem ser cuidadosamente observadas.
Mulheres com hipertrigliceridemia preexistente devem ser seguidas de perto durante a terapia de reposição estrogênica ou de reposição hormonal, uma vez que foram relatados casos raros de grandes aumentos de triglicérides82 plasmáticos, levando à pancreatite83, com a terapia de estrógeno63.
A relação entre a hipertrigliceridemia pré-existente e a terapia com baixa dose de estrógeno63 vaginal é desconhecida.
Os estrógenos aumentam a globulina23 ligadora de tiroxina (TBG), levando a um aumento do hormônio21 tireoidiano circulante total, T3 e T4. As concentrações de T3 e T4 livre permanecem inalteradas. Outras proteínas13 ligadoras podem estar elevadas no soro84, como a globulina23 ligadora de corticosteroide (CBG) e a globulina23 ligadora de hormônios sexuais (SHBG), ocasionando aumento de corticosteroides e esteroides sexuais circulantes, respectivamente. As concentrações de hormônio21 livre ou biologicamente ativo permanecem inalteradas. Outras proteínas13 do plasma85 podem ser aumentadas (substrato de angiotensina/renina, alfa-1 antitripsina, ceruloplasmina).
A absorção sistêmica mínima do estradiol com a administração vaginal local é provável que resulte em efeitos menos pronunciados nas proteínas13 ligadoras plasmáticas, do que com hormônios sistêmicos20.
A TRH não melhora a função cognitiva86. Há algumas evidências do ensaio WHI do aumento do risco de provável demência87 em mulheres que começam a utilizar a TRH contínua combinada ou de estrógeno63 isolado após a idade de 65 anos. O aplicador intravaginal pode causar pequenos traumas locais, especialmente em mulheres com atrofia3 vaginal grave.
Efeitos na habilidade de dirigir e operar máquinas
Não há efeitos conhecidos.
Gravidez41 e Lactação88
Vagifem® não é indicado durante a gravidez41. Caso ocorra a gravidez41 durante tratamento com Vagifem®, o tratamento deve ser retirado imediatamente. Os resultados da maioria dos estudos epidemiológicos até a atualidade relevantes para a exposição fetal inadvertida aos estrógenos não indicam efeitos teratogênicos89 ou fetotóxicos.
Categoria X de risco na gravidez41: Este medicamento não deve ser utilizado por mulheres grávidas ou que possam ficar grávidas durante o tratamento.
Vagifem® não é indicado durante a lactação88.
INTERAÇÕES MEDICAMENTOSAS
Como o estrógeno63 no Vagifem® é administrado de forma intravaginal, e devido aos baixos níveis de estradiol liberados, é improvável que quaisquer interações medicamentosas clinicamente relevantes ocorram com Vagifem®. No entanto, o metabolismo17 de estrógenos pode ser aumentado pelo uso concomitante de substâncias conhecidas por induzir enzimas metabolizadoras de medicamentos, especificamente as enzimas do citocromo P450, tais como anticonvulsivantes (por exemplo, fenobarbital, fenitoína, carbamazepina) e anti-infecciosos (por exemplo, rifampicina, rifabutina, nevirapina, efavirenz).
Ritonavir e nelfinavir, embora conhecidos como fortes inibidores, por contraste apresentam propriedades indutoras quando utilizados concomitantemente com hormônios esteroides. As preparações à base de plantas contendo erva de São João (Hypericum perforatum) podem induzir o metabolismo17 dos estrógenos.
CUIDADOS DE ARMAZENAMENTO DO MEDICAMENTO
Cuidados de armazenamento
Vagifem® deve ser conservado em temperatura ambiente (15–30°C). Não refrigerar.
Prazo de validade: 24 meses após a data de fabricação impressa no cartucho.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Características físicas e organolépticas do produto
Comprimido branco, biconvexo, revestido por película, gravado com NOVO 278 em um dos lados. Diâmetro de 6 mm. Cada comprimido individual está contido em um aplicador descartável, de uso único, de polietileno/polipropileno. Os aplicadores são embalados separadamente em blisters de PVC/folha de alumínio.
Antes de usar, observe o aspecto do medicamento.
TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS.
POSOLOGIA E MODO DE USAR
Posologia
Dose inicial: Um comprimido vaginal de 10 mcg diariamente por 2 semanas.
Dose de manutenção: Um comprimido vaginal duas vezes por semana.
O tratamento pode ser iniciado em qualquer dia, que seja conveniente.
Para o início e continuidade do tratamento de sintomas7 da pós-menopausa4, deve-se utilizar a mínima dose eficaz, pelo período mais curto.
Vagifem® é uma terapia vaginal local e em mulheres com um útero61 intacto, não é necessário tratamento progestagênico.
Vagifem® pode ser utilizado em mulheres com ou sem útero61 intacto.
Infecções90 vaginais devem ser tratadas antes do início da terapia com Vagifem®. A experiência no tratamento de mulheres acima de 65 anos é limitada.
Este medicamento não deve ser partido, aberto ou mastigado.
Modo de Usar
- Vagifem® é administrado de forma intravaginal, como terapia local de estrogênio com uso de aplicador.
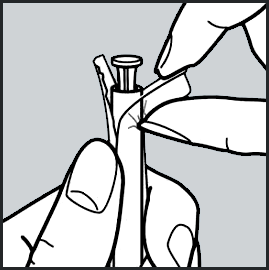
- Rasgue uma única embalagem do blister.
- Abra a extremidade do êmbolo91, como mostrado na figura.
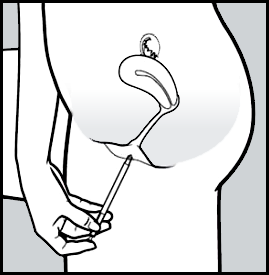
- Introduza o aplicador cuidadosamente na vagina92.
- Pare quando puder sentir alguma resistência (8 a 10 cm).
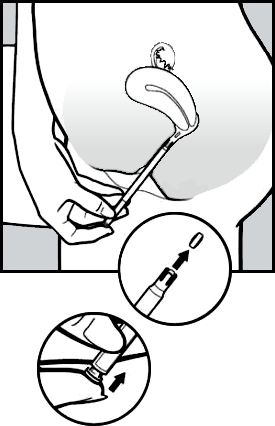
- Para liberar o comprimido, pressione suavemente o botão até sentir um clique.
O comprimido irá, imediatamente, aderir na parede da vagina92. Não cairá se você ficar de pé ou andar.

- Retire o aplicador e jogue-o fora.
REAÇÕES ADVERSAS
Mais de 673 pacientes foram tratadas com Vagifem® 10 microgramas em ensaios clínicos77, incluindo mais de 497 pacientes tratadas por até 52 semanas.
Eventos adversos relacionados ao estrógeno63, como dor na mama29, edema93 periférico e sangramentos pós-menopausa4 foram relatados em taxas muito baixas com Vagifem® 10 microgramas, semelhantes ao placebo6. Quando ocorreram estiveram geralmente presentes apenas no início do tratamento. Os eventos adversos observados com maior frequência em pacientes tratadas com Vagifem® 10 microgramas, em comparação com o placebo6, e que possivelmente estão relacionados ao tratamento são apresentados abaixo.
|
Classe de órgão do sistema |
Comum |
Incomum |
Raro |
|
Infecções90 e infestações |
|
Infecção94 micótica vulvovaginal |
|
|
Distúrbios do sistema nervoso95 |
Dor de cabeça51 |
|
|
|
Distúrbios gastrointestinais |
Dor abdominal |
Náuseas96 |
|
|
Distúrbios do sistema reprodutivo e da mama29 |
Hemorragia vaginal97, corrimento vaginal ou desconforto vaginal |
|
|
|
Distúrbios de pele15 e do tecido subcutâneo98 |
|
Erupção99 cutânea100 |
|
|
Investigações |
|
Aumento de peso |
|
|
Distúrbios vasculares101 |
|
Ondas de calor Hipertensão45 |
|
Reações Adversas Medicamentosas de fontes de pós-comercialização
Além das reações adversas medicamentosas mencionadas acima, aquelas apresentadas a seguir têm sido relatadas espontaneamente em pacientes tratadas com Vagifem® 25 microgramas e são consideradas como possivelmente relacionadas ao tratamento. A taxa de relatos destas reações adversas espontâneas é muito rara (< 1/10.000 paciente-anos).
- Neoplasias102 benignas e malignas (incluindo cistos e pólipos103): câncer28 de mama29, câncer28 de endométrio30;
- Distúrbios do sistema imunológico104: reações de hipersensibilidade generalizada (ex.: reação/choque anafilático105);
- Distúrbios do metabolismo17 e nutrição106: retenção de líquidos;
- Transtornos psiquiátricos: insônia;
- Distúrbios do sistema nervoso95: enxaqueca50 agravada;
- Distúrbios vasculares101: trombose venosa profunda33;
- Distúrbios gastrointestinais: diarreia107;
- Distúrbios de pele15 e do tecido subcutâneo98: urticária108, erupção99 cutânea100 eritematosa109, erupção99 cutânea100 pruriginosa, prurido110 genital;
- Distúrbios do sistema reprodutivo e da mama29: hiperplasia endometrial31, irritação vaginal, dor vaginal, vaginismo, ulceração111 vaginal;
- Distúrbios gerais e condições do local de administração: ineficácia terapêutica112;
- Investigações: aumento de peso, aumento do estrógeno63 sanguíneo.
Outras reações adversas foram relatadas em associação com o tratamento com estrógeno63. As estimativas de risco foram delineadas a partir da exposição sistêmica e não se sabe como estas se aplicam aos tratamentos locais:
- Infarto do miocárdio36, doença cardíaca congestiva;
- Acidente vascular cerebral79;
- Doença da vesícula biliar113;
- Distúrbios de pele15 e subcutâneos: cloasma114, eritema multiforme115, eritema nodoso116, púrpura117 vascular48;
- Aumento no tamanho de miomas;
- Epilepsia55;
- Transtorno de libido118;
- Deterioração da asma56;
- Provável demência87 acima dos 65 anos.
Risco de câncer28 de mama29
As estimativas de risco foram delineadas a partir da exposição sistêmica e não se sabe como estas se aplicam aos tratamentos locais.
Relata-se aumento em até 2 vezes n o risco de ter câncer28 de mama29 diagnosticado em mulheres que utilizam a terapia combinada78 de estrógeno63 e progestágeno por mais de 5 anos.
Qualquer risco aumentado em usuárias de terapia de estrógeno63 isolado é substancialmente mais baixo do que a observada em usuárias de terapia combinada78 de estrógeno63 e progestágeno.
O nível de risco é dependente da duração do uso.
São apresentados resultados do maior ensaio randomizado5 controlado por placebo6 (estudo WHI) e maior estudo epidemiológico (MWS).
Estudo de um Milhão de Mulheres – Risco adicional estimado de câncer28 de mama29 após 5 anos de uso
|
Faixa etária (anos) |
Incidência10 por 1.000 nunca usuárias de TRH durante um período mais de 5 anos* |
Taxa de risco e IC 95% # |
Casos adicionais por 1.000 usuárias TRH por mais de 5 anos (IC 95%) |
|
TRH de estrógeno63 isolado |
|||
|
50 – 65 |
9 – 12 |
1,2 |
1 – 2 (0 – 3) |
|
Estrógeno63-progestagênio combinados |
|||
|
50 – 65 |
9 – 12 |
1,7 |
6 (5 – 7) |
* Considerado das taxas de incidência10 basais nos países desenvolvidos.
# Taxa de risco geral. A taxa de risco não é constante, mas aumentará com o aumento da duração do uso.
Nota: visto que a incidência10 de antecedentes de câncer28 de mama29 difere por país da UE, o número de casos adicionais de câncer28 de mama29 também irá mudar proporcionalmente.
Estudos de WHI nos EUA – risco adicional de câncer28 de mama29 após uso de 5 anos
|
Faixa etária (anos) |
Incidência10 por 1.000 mulheres no braço placebo6 por mais de 5 |
Taxa de risco e IC 95% |
Casos adicionais por 1.000 usuárias de TRH por mais de 5 anos (IC 95%) |
|
CEE estrógeno63 isolado |
|||
|
50 – 79 |
21 |
0,8 (0,7 – 1,0) |
-4 (-6 – 0)* |
|
CEE+MPA estrógeno63 e progestagênio‡ |
|||
|
50 – 79 |
17 |
1,2 (1,0–1,5) |
+4 (0–9) |
* Estudo de WHI em mulheres sem útero61, que não mostraram um aumento no risco de câncer28 de mama29.
‡Quando a análise se restringiu às mulheres que não haviam utilizado TRH anteriormente ao estudo não houve risco aumentado aparente durante os primeiros 5 anos de tratamento: após 5 anos o risco era maior do que em não usuárias.
Risco de câncer28 endometrial
Mulheres na pós-menopausa4 com útero61
O risco de câncer28 endometrial é de cerca de 5 em cada 1.000 mulheres com útero61 não utilizando TRH.
Em mulheres com útero61, o uso de TRH sistêmica de estrógeno63 isolado não é recomendado, porque aumenta o risco de câncer28 endometrial.
Dependendo da duração do uso de terapia sistêmica de estrógeno63 isolado e da dosagem de estrógeno63, o aumento no risco de câncer28 endometrial em estudos epidemiológicos variou entre 5 e 55 casos extras diagnosticados em cada 1.000 mulheres entre idades de 50 e 65 anos.
A adição de um progestágeno à terapia sistêmica de estrógeno63 durante pelo menos 12 dias por ciclo pode evitar este risco aumentado. No Estudo de um Milhão de Mulheres, a utilização de cinco anos da TRH combinada (sequencial ou contínua) não aumentou o risco de câncer28 endometrial [(RR de 1,0 (0,8–1,2)].
Câncer28 de ovário65
As estimativas de risco foram delineadas a partir da exposição sistêmica e não se sabe como estas se aplicam aos tratamentos locais.
O uso prolongado de TRH com estrógeno63 isolado e com estrógeno63 e progestágeno combinados tem sido associado a um risco ligeiramente aumentado de câncer28 de ovário65. No Estudo de um Milhão de Mulheres, 5 anos de TRH resultou em 1 caso extra a cada 2.500 usuárias.
Risco de tromboembolismo32 venoso
As estimativas de risco foram delineadas a partir da exposição sistêmica e não se sabe como estas se aplicam aos tratamentos locais.
A TRH está associada a um risco relativo aumentado de 1,3 a 3 vezes de desenvolver tromboembolismo32 venoso (TEV), ou seja, trombose venosa profunda33 ou embolia34 pulmonar. A ocorrência de tal evento é mais provável no primeiro ano do uso de TRH. Resultados dos estudos de WHI são apresentados:
Estudos de WHI – Risco adicional de TEV com uso por mais de 5 anos
|
Faixa etária (anos) |
Incidência10 por 1.000 mulheres no braço placebo6 por mais de 5 anos |
Taxa de risco e IC 95% |
Casos adicionais por 1.000 usuárias de TRH |
|
Estrógeno63 isolado oral* |
|||
|
50 – 59 |
7 |
1,2 (0,6 – 2,4) |
1 (-3 – 10) |
|
Estrógeno63-progestagênio orais combinados |
|||
|
50 – 59 |
4 |
2,3 (1,2 – 4,3) |
5 (1 – 13) |
* Estudo em mulheres sem útero61.
Risco de doença arterial coronariana
As estimativas de risco foram delineadas a partir da exposição sistêmica e não se sabe como estas se aplicam aos tratamentos locais.
O risco de doença arterial coronariana é ligeiramente aumentado em usuárias de TRH combinada de estrógeno63 e progestágeno em idade superior a 60 anos.
Risco de AVC isquêmico80
As estimativas de risco foram delineadas a partir da exposição sistêmica e não se sabe como estas se aplicam aos tratamentos locais.
O uso de terapia de estrógeno63 isolado e de estrógeno63 e progestágeno associados está associado com um aumento de risco relativo de até 1,5 vezes de acidente vascular cerebral79 isquêmico80. O risco de AVC hemorrágico119 não é aumentado durante o uso da TRH.
Este risco relativo não é dependente da idade ou duração do uso, mas como o risco basal é fortemente dependente da idade, o risco geral de acidente vascular cerebral79 em mulheres que usam TRH irá aumentar com a idade.
Estudos combinados de WHI – Risco adicional de AVC isquêmico80* com uso por mais de 5 anos
|
Faixa etária (anos) |
Incidência10 por 1.000 mulheres no braço placebo6 por mais de 5 anos |
Taxa de risco e IC 95% |
Casos adicionais por 1.000 usuárias de TRH por mais de 5 anos |
|
50 – 59 |
8 |
1,3 (1,1 – 1,6) |
3 (1 – 5) |
* Nenhuma diferenciação foi feita entre AVC isquêmico80 e hemorrágico119.
- Risks and Benefits of Estrogen Plus Progestin in Healthy Postmenopausal Women Principal Results from the Women’s Health Initiative Randomized Controlled Trial. JAMA July 17, 2002.
- Breast cancer28 and hormone-replacement therapy in the Million Women Study. Lancet August 9, 2003.
População pediátrica
Não há dados clínicos sobre uso em crianças.
Atenção: este produto é um medicamento que possui nova forma farmacêutica no país, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos. Em casos de eventos adversos, notifique pelo Sistema VigiMed, disponível no Portal da Anvisa.
SUPERDOSE
A superdose de estradiol por via oral pode causar: náuseas96 e vômitos120. Vagifem® destina-se ao uso intravaginal e a dose de estradiol é muito baixa. A superdose, portanto, é improvável, mas se isso ocorrer, o tratamento consiste na suspensão do medicamento e cuidados sintomáticos.
Em caso de intoxicação ligue para 0800 722 6001, se você precisar de mais orientações.
DIZERES LEGAIS
VENDA SOB PRESCRIÇÃO MÉDICA
Reg. MS. 1.8759.0007
Farm. Resp.: Talita Tonelato Menezes - CRF/SP 74.229
Registrado e importado por:
Besins Healthcare Brasil Com. Dist. Med. Ltda.
Rua Alexandre Dumas, 1658 - São Paulo/SP
CNPJ: 11.082.598/0001-21
Fabricado e embalado por:
Novo Nordisk A/S
Novo Allé - DK-2760 Maaloev - Dinamarca
SAC 0800 777 24 30