Gaudy (Bula do profissional de saúde)
EMS S/A
IDENTIFICAÇÃO DO MEDICAMENTO
Gaudy®
bromidrato de galantamina
Cápsulas 8 mg; 16 mg e 24 mg
Medicamento similar equivalente ao medicamento de referência.
FORMA FARMACÊUTICA E APRESENTAÇÃO:
Cápsulas dura de liberação prolongada
Embalagens contendo 7, 14, 28 e 56 cápsulas. Embalagem Hospitalar contendo 100 e 200 cápsulas.
USO ORAL
USO ADULTO
COMPOSIÇÃO:
Cada cápsula de Gaudy® 8 mg contém:
| bromidrato de galantamina (equivalente a 8 mg de galantamina) | 10,25 mg |
| excipiente q.s.p. | 1 cápsula |
Excipiente: celulose microcristalina, hipromelose, etilcelulose, ftalato de etila.
Cada cápsula de Gaudy® 16 mg contém:
| bromidrato de galantamina (equivalente a 16 mg de galantamina) | 20,51 mg |
| excipiente q.s.p. | 1 cápsula |
Excipiente: celulose microcristalina, hipromelose, etilcelulose, ftalato de etila.
Cada cápsula de Gaudy® 24 mg contém:
| bromidrato de galantamina (equivalente a 24 mg de galantamina) | 30,76 mg |
| excipiente q.s.p. | 1 cápsula |
Excipiente: celulose microcristalina, hipromelose, etilcelulose, ftalato de etila.
INFORMAÇÕES TÉCNICAS AOS PROFISSIONAIS DE SAÚDE1
INDICAÇÕES
Gaudy® é indicado para o tratamento sintomático2 da demência3 do tipo Alzheimer4 de intensidade leve a moderada e tratamento sintomático2 da demência3 de Alzheimer4 de intensidade leve a moderada com doença vascular5 cerebral relevante.
RESULTADOS DE EFICÁCIA
As doses de bromidrato de galantamina que se mostraram eficazes em estudos clínicos controlados em pacientes com doença de Alzheimer6 foram 16, 24 e 32 mg/dia. Destas doses, 16 e 24 mg/dia foram consideradas como tendo a melhor relação benefício/risco e são as doses recomendadas. A eficácia da galantamina foi estudada usando quatro medidas específicas de desfecho clínico: a ADAS-cog (uma medida da função cognitiva7 baseada no desempenho), a CIBIC-plus (uma avaliação global por médico independente baseada em entrevista clínica com o paciente e o cuidador), várias medidas das atividades diárias e o Questionário Neuropsiquiátrico (NPI, uma escala que mede os transtornos do comportamento).
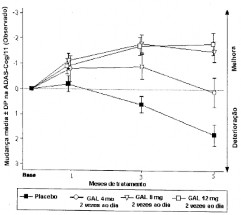
Em estudos clínicos, o desempenho dos pacientes tratados com galantamina de acordo com a ADAS-cog (veja o gráfico) e a CIBIC-plus foi consistente e significativamente melhor que o dos pacientes tratados com placebo8. Os pacientes que foram tratados por 6 meses com galantamina tiveram pontuações da ADAS-cog significativamente melhores comparado as suas pontuações basais. Comparado aos pacientes não tratados, houve benefício substancial e prolongado do funcionamento cognitivo9. O tratamento com galantamina também melhorou de forma significativa as atividades diárias como vestir-se, higiene, preparo das refeições, que foram avaliadas usando a “Disability Assessment in Dementia” (DAD) e o Questionário sobre as atividades da vida diária (AVD) da ADCS (“Alzheimer’s Disease Cooperative Study”), avaliações realizadas pelo cuidador. A galantamina, nas doses de 16 mg e 24 mg ao dia, manteve a pontuação da NPI ao longo do período de observação, ao passo que a pontuação dos pacientes que receberam placebo8 apresentou deterioração clara como resultado do aparecimento de transtornos do comportamento.
Figura 1. Mudança média (± DP) em relação ao valor basal na pontuação da ADAS-Cog/11 com o passar do tempo (dados observados) (dados agrupados dos estudos GAL-USA 1 e GAL-INT-1).

Figura 2. Mudança média (± DP) em relação ao valor basal na pontuação da ADAS-Cog/11 com o passar do tempo (todos os pacientes, dados observados) (estudo GAL-USA-10)
O tratamento a longo prazo (combinação de 6 meses de tratamento em duplo-cego seguido por 6 meses de tratamento aberto) sugeriu que o desempenho cognitivo10 e funcional dos pacientes foi mantido por um ano inteiro.
A eficácia de bromidrato de galantamina cápsula de liberação prolongada foi avaliada na doença de Alzheimer6 em estudo um randomizado11, duplo- cego, controlado com placebo8. Pacientes receberam galantamina 8 mg/dia por 4 semanas, seguidos de galantamina 16 mg/dia por 4 semanas. Na 8ª semana, a dose poderia ser aumentada para 24 mg/dia baseado na segurança e tolerabilidade, e poderia ser reduzida a 16 mg /dia na 12ª semana. A dose final na 12ª semana foi mantida para o restante dos 6 meses. Na análise da eficácia primária especificada no protocolo para os dois desfechos (ADAS-cog/11 e CIBIC-plus) aos 6 meses simultaneamente, bromidrato de galantamina cápsula de liberação prolongada mostrou melhora estatisticamente significante na ADAS-cog/11 em comparação com placebo8. Além disso, bromidrato de galantamina cápsula de liberação prolongada foi melhor que placebo8, alcançando significância estatística, na melhora das atividades diárias (ADCS-ADL), uma medida secundária importante da eficácia. Os resultados de eficácia foram similares para bromidrato de galantamina cápsula de liberação prolongada e bromidrato de galantamina comprimido, que serviu como controle ativo nesse estudo.
Doença de Alzheimer6 com doença cerebrovascular12 (DA + DCV) (demência3 mista)
A eficácia e segurança de galantamina em pacientes com doença de Alzheimer6 e doença cerebrovascular12 significativa (DA+DCV) foram investigadas em um estudo duplo-cego13, controlado com placebo8. Neste estudo 282 pacientes, 48% da população total do estudo (n=592), atingiram o critério para DA+DCV.
Embora o estudo clínico não tenha tido análise de subgrupo, os pacientes tratados com galantamina apresentaram uma melhora estatisticamente significante, comparados aos pacientes do grupo placebo8, em ambos resultados esperados [cognição14: ADAS-cog/11 (p<0,001); avaliação clínica global: CIBIC-plus (p<0,001) e na medida de atividades de vida diária (AVD) (p=0,003)]. Em geral, a segurança e a tolerabilidade da galantamina em pacientes com DA+DCV foi semelhante àquela observada nos estudos anteriores em doença de Alzheimer6. O evento adverso mais frequentemente relatado pelos pacientes foi náusea15 (19% dos pacientes do grupo galantamina e 11% dos pacientes do grupo placebo8), Outros eventos relatados por >5% dos pacientes com DA+DCV e relatados mais frequentemente no grupo galantamina do que no grupo placebo8 foram tontura16, vômito17, dor abdominal, diarreia18 e fadiga19. A incidência20 de “distúrbios cerebrovasculares” (por exemplo, acidente vascular cerebral21) foi maior em pacientes do grupo placebo8 [5/96 (5%) pacientes do grupo placebo8; 2/186 (1%) pacientes do grupo galantamina].
Em geral, o perfil de segurança em DA+DCV foi consistente com o observado em estudos de galantamina em pacientes com doença de Alzheimer6. Dois estudos clínicos randomizados adicionais, GAL-INT-6 e GAL-INT-26, foram completados.
O estudo GAL-INT-6 foi randomizado11, duplo-cego, controlado ou placebo8, de 26 semanas de duração, para avaliar a segurança e a eficácia da galantamina no tratamento da demência3 de intensidade leve a moderada em indivíduos preenchendo os critérios da NINDS-AIREN para doença vascular5 cerebral relevante e critérios clínicos para possível doença de Alzheimer6 (DA+DCV) ou provável Demência3 Vascular5 (VaD).
O tratamento com 24 mg/dia de galantamina resultou em melhora cognitiva7 e funcional significativamente maior em relação ao placebo8, medida pelos parâmetros primários de eficácia, ADAS-cog/11 e CIBIC-plus. A galantamina mostrou-se segura nesta população de pacientes. No subgrupo DA+DCV de pacientes, o tratamento com galantamina resultou em melhora estatisticamente significante nas medidas do desempenho cognitivo10, atividades de vida diária e funcionamento global em comparação ao placebo8. O tratamento com galantamina resultou em melhora cognitiva7 e funcional significativamente maior em comparação ao placebo8, medida por ambos os parâmetros primários de eficácia. Aos 6 meses, houve uma redução média (melhora) na pontuação da ADAS-cog/11 de 1,7 pontos no grupo galantamina em comparação a um aumento de 1,0 ponto no grupo placebo8 (p<0,001). Resultados similares estatisticamente significantes foram obtidos na análise tradicional da última observação realizada e nos dados clássicos de intenção de tratamento. Os resultados da ADAS-cog/13, cog/10 e cog/mem, pontuação total DAD e pontuação total NPI também demonstraram que pontuação significativamente melhores estão associados com a galantamina versus placebo8. No subgrupo VaD, as pontuações para o grupo galantamina foram, de forma consistente, numericamente maiores que o placebo8 para todas as quatro variáveis de eficácia. As diferenças entre os grupos de tratamento em pacientes com VaD não atingiram significância estatística, embora o valor de p tenha alcançado significância estatística para ADAS-cog/11 (p=0,06).
O estudo GAL-INT-26 foi randomizado11, duplo-cego, controlado com placebo8, com 26 semanas de duração, para avaliar a eficácia da galantamina em demência3 vascular5 (VaD). A tolerabilidade e a segurança da galantamina estavam alinhadas com o observado para a doença de Alzheimer6 com menos eventos adversos vasculares22 cerebrais relatados em pacientes tratados com galantamina em comparação com placebo8. Embora tenha sido observado benefício cognitivo9 significante, neste estudo não houve benefício significante no funcionamento.
Segurança e eficácia de longa duração (2 anos) em demência3 do tipo Alzheimer4 de intensidade leve a moderada
Um estudo multicêntrico, randomizado11, duplo-cego, controlado com placebo8, paralelo avaliou em longa duração (2 anos) a eficácia e segurança de galantamina em cápsulas de liberação prolongada no tratamento de pacientes com demência3 do tipo Alzheimer4 de intensidade leve a moderada. Mil e vinte e três pacientes foram randomizados para o grupo placebo8 e 1028 para o grupo galantamina cápsulas de liberação prolongada. As características demográficas e de linha da base eram similares entre os grupos.
A maioria dos pacientes eram mulheres (65%) e brancas (99,9%). A idade mediana foi de 74 anos e na linha de base a pontuação do “Mini-Exame do Estado Mental” (MMSE) foi 19.
No desfecho primário de eficácia (definido como mudança a partir da linha de base na pontuação MMSE no mês 24) houve significativamente menos deterioração cognitiva7 no grupo galantamina comparado com o placebo8 na mudança da linha de base no MMSE, no mês 24 (-1,41 versus -2,14; p<0,001). No desfecho secundário de eficácia (definido como mudança no MMSE no mês 6 e mudança na pontuação DAD no mês 24) houve melhora significativamente maior na mudança da linha de base do MMSE no mês 6 no grupo galantamina comparado com placebo8 (mudança média de 0,15 versus -0,28; p<0,001) e significativamente menos deterioração na pontuação DAD no mês 24 no grupo galantamina comparado ao placebo8 (-8,2 versus -10,8; p=0,002).
No desfecho primário de segurança (mortalidade23) houve um total de 89 óbitos; 56 (5,5%) óbitos no grupo placebo8 e 33 (3,2%) óbitos no grupo galantamina. Isto representa uma taxa de morte significativamente maior no grupo placebo8 comparado com galantamina [taxa de risco e intervalo de confiança 95% de 0,58 (0,37–0,89) (p=0,011)].
Transtorno Cognitivo9 Leve (TCL)
Dois estudos controlados de 2 anos com pacientes com TCL não atingiram dois desfechos primários de eficácia. Embora a mortalidade23 fosse baixa (0,7%), mais mortes foram observadas inicialmente nos indivíduos randomizados para galantamina (13/1026) do que com placebo8 (1/1022), mas a incidência20 de eventos adversos sérios foi idêntica (19%) entre os grupos de tratamento.
Na análise de 24 meses por intenção de tratar houve 20 mortes entre os pacientes randomizados para o grupo placebo8 comparado a 34 mortes apresentadas entre os pacientes randomizados para galantamina (risco relativo [95% IC] = 1,70 [1,00; 2,90]; p = 0,051). Dos pacientes que morreram dentro do período especificado pelo protocolo de 30 dias de avaliação duplo-cego, havia 14 no grupo da galantamina e 3 no grupo do placebo8 (risco relativo [95% IC] = 4,08 [1,57; 10,57]; p = 0,004). Treze mortes no grupo do placebo8 e 20 mortes no grupo da galantamina foram identificadas como estando relacionadas diretamente aos eventos adversos que ocorreram enquanto os pacientes foram expostos à droga no estudo duplo-cego13 (risco relativo [95% IC] = 1,54 (0,78; 3,04); p = 0,218).
Mais indivíduos tratados com placebo8 do que tratados com galantamina interromperam o estudo antes da morte, o que pode esclarecer a diferença na mortalidade23 apresentada inicialmente. Quando os dados recuperados da grande proporção dos pacientes em ambos os grupos do tratamento que interromperam antes da conclusão do período duplo-cego (GAL-COG-3002) foram incluídos, um total de 102 mortes foram identificadas, 56 no grupo da galantamina e 46 no grupo do placebo8 (risco relativo [95% IC] =1,24 [0,84;1,83]; p = 0,274).
As mortes foram devido às várias causas que podem ocorrer em uma população idosa, com aproximadamente a metade das mortes em ambos os grupos foi devido às causas vasculares22.
Referências Bibliográficas
- Bickel U, Thomsen T, Weber W, Fischer JP, Bachus R, Nitz M, Kewitz H. Pharmacokinetics of galantamine in humans and corresponding cholinesterase inhibition. Clinical Pharmacology and Therapeutics 50 (4), p.420-428, 1991.
- Clinical Study Report GAL-NPH-101. An open-label, randomized, crossover study to evaluate the in-vitro/ in-vivo correlation of galantamine controlled-release formulations. January 2005.
- Tonkopii VD, Prozorovskii VB, Suslova IM. Interaction of reversible inhibitors with catalytic centers and allosteric site of cholinesterases. Bull Exp Bio Med 1976;82:1180-1183.
- Van Bortel L, Van Osselaer N, Van Hest A, Janssens L, De Smedt H, Le Moing JP, Van Peer A, De Beukelaar F, Van De Poel S. Oral bioavailability of galantamine after single 8-mg doses as two sustained-release formulations in comparison with a 4-mg immediate-release tablet administered B.I.D. in healthy subjects. Clinical Study Report on R113675, GAL-BEL-19, (republish of Clinical Research Report, May 2000), November 2002.
CARACTERÍSTICAS FARMACOLÓGICAS
Farmacodinâmica
A galantamina, um alcaloide24 terciário, é um inibidor seletivo, competitivo e reversível da acetilcolinesterase. Além disso, a galantamina aumenta a ação intrínseca da acetilcolina25 sobre os receptores nicotínicos, provavelmente através de ligação a um sítio alostérico do receptor. Como consequência, uma atividade aumentada do sistema colinérgico26 associada à melhora da função cognitiva7 pode ser obtida em pacientes com demência3 do tipo Alzheimer4.
Os sintomas27 da demência3 do tipo Alzheimer4 diminuem gradativamente depois de algumas semanas.
Farmacocinética
Absorção: Após a ingestão oral de uma dose única de 8 mg de galantamina na forma de comprimidos, a absorção é rápida, com um pico de concentração plasmática de 43 ± 13 ng/mL, que é atingido depois de 1,2 horas e uma AUC28∞ de 427 ± 102 ng.h/mL. A biodisponibilidade oral absoluta da galantamina é de 88,5%. A sua administração por via oral de comprimidos junto com alimentos torna mais lenta a sua taxa de absorção (Cmáx reduzido em cerca de 25%), mas não afeta a extensão de sua absorção (AUC28).
Após várias doses orais de 12 mg de galantamina, duas vezes por dia, as médias das concentrações plasmáticas mínima e de pico oscilaram entre 30 e 90 ng/mL. A galantamina apresenta farmacocinética linear na faixa de 4 a 16 mg, duas vezes por dia.
Distribuição: A galantamina tem um volume de distribuição moderado (Vdss de 175 L).
A ligação da galantamina às proteínas29 plasmáticas é baixa: 17,7 ± 0,8%. No sangue30 total, a galantamina é distribuída principalmente para as células sanguíneas31 (52,7%) e para o compartimento aquoso do plasma32 (39,0%), enquanto que a fração de galantamina ligada às proteínas29 plasmáticas é de apenas 8,4%. A razão da concentração sangue30-plasma32 da galantamina é 1,17.
Metabolismo33: As principais vias metabólicas foram N-oxidação, N-desmetilação, O-desmetilação, glicuronidação e epimerização. A O-desmetilação foi muito mais importante nos metabolizadores rápidos da CYP 2D6.
Os níveis de excreção da radioatividade total na urina34 e nas fezes não foram diferentes entre os metabolizadores lentos e os rápidos. Estudos “in vitro” confirmaram que as isoenzimas 2D6 e 3A4 do citocromo P450 foram as principais isoenzimas envolvidas no metabolismo33 da galantamina.
No plasma32 dos metabolizadores lentos e rápidos, a galantamina inalterada e seu metabólito35 glicuronídeo foram responsáveis pela maior parte da radioatividade da amostra. No plasma32 dos metabolizadores rápidos, o glicuronídeo da O-desmetilgalantamina também foi importante.
Nenhum dos metabólitos36 ativos da galantamina (norgalantamina, O-desmetilgalantamina e O-desmetil-norgalantamina) puderam ser detectados nas suas formas não conjugadas no plasma32 dos metabolizadores lentos ou rápidos, após administração de doses únicas. A norgalantamina foi detectável no plasma32 dos pacientes após administração de doses múltiplas, mas não representou mais que 10% dos níveis de galantamina.
Eliminação: A galantamina é um fármaco37 de baixa depuração (depuração plasmática de aproximadamente 300 mL/min). A eliminação da galantamina é biexponencial, com uma meia-vida terminal em torno de 7–8 horas.
Sete dias após uma dose oral única de 4 mg de 3H-galantamina, 90 a 97% da radioatividade foi recuperada na urina34 e 2,2 a 6,3% nas fezes. Depois da administração i.v. e oral, 18 a 22% da dose foi excretada na urina34 como galantamina inalterada em 24 horas, com depuração renal38 de cerca de 65 mL/min, que representa 20 a 25% da depuração plasmática total.
Características em pacientes com doença de Alzheimer6: Os dados dos estudos clínicos em pacientes indicam que as concentrações plasmáticas da galantamina nos indivíduos com doença de Alzheimer6 são 30 a 40% maiores do que nos indivíduos jovens saudáveis.
Insuficiência hepática39: A farmacocinética da galantamina em pacientes com insuficiência hepática39 leve (pontuação Child-Pugh de 5-6) foi comparável com a de indivíduos saudáveis. Nos pacientes com insuficiência hepática39 moderada (pontuação Child-Pugh de 7-9), a AUC28 e a meia-vida da galantamina foram aumentadas em cerca de 30%.
Insuficiência renal40: A disposição da galantamina foi estudada em indivíduos jovens com graus variáveis de função renal38. A eliminação da galantamina diminuiu com o decréscimo da depuração da creatinina41. Houve aumento de 38% das concentrações plasmáticas da galantamina em pacientes com insuficiência renal40 moderada (depuração de creatinina41= 52-104 mL/min) ou de 67% em pacientes com insuficiência renal40 grave (depuração de creatinina41 = 9-51 mL/min) comparado com indivíduos saudáveis pareados para idade e peso (depuração de creatinina41 >= 121 mL/min). Uma análise farmacocinética da população e simulações indicaram que não são necessários ajustes da dose em pacientes com Alzheimer4 com insuficiência renal40 desde que a depuração de creatinina41 seja de pelo menos 9 mL/min, uma vez que a depuração da galantamina é menor na população com Alzheimer4.
Biodisponibilidade da formulação de liberação imediata versus liberação prolongada: No estudo de biodisponibilidade no estado de equilíbrio, bromidrato de galantamina cápsulas de liberação prolongada, 24 mg uma vez ao dia, mostrou-se equivalente a 12 mg duas vezes ao dia, comprimido de liberação imediata, no que diz respeito a AUC24h e Cmin. O valor de Cmáx após administração de 24 mg uma vez ao dia em cápsula de liberação prolongada, que é atingido após 4,4 h, é cerca de 24% menor que o valor obtido após administração de 12 mg duas vezes ao dia em comprimido de liberação imediata. O alimento não teve efeito sobre a biodisponibilidade de 24 mg uma vez ao dia em cápsula de liberação prolongada. Em estudo de proporcionalidade de doses, bromidrato de galantamina cápsula de liberação prolongada em idosos saudáveis e adultos mais jovens, o estado de equilíbrio de concentrações plasmáticas foi atingido em 6 dias com todas as doses (8 mg, 16 mg e 24 mg) em ambos os grupos etários. A farmacocinética no estado de equilíbrio foi proporcional à dose dentro do intervalo posológico estudado de 8 mg a 24 mg em ambos os grupos etários.
Figura 3: Gráfico linear comparativo dos perfis de concentração plasmática média de galantamina em função do tempo

CONTRAINDICAÇÕES
Gaudy® não deve ser administrado aos pacientes que apresentam hipersensibilidade ao bromidrato de galantamina ou a qualquer um dos componentes do produto.
ADVERTÊNCIAS E PRECAUÇÕES
Tipos de demência3 outras que não do tipo Alzheimer4
Gaudy® é indicado no tratamento da demência3 do tipo Alzheimer4 de intensidade leve a moderada.
O benefício de Gaudy® aos pacientes com outros tipos de demência3 ou outros tipos de comprometimento de memória não foi demonstrado.
Reações cutâneas42 graves
Reações cutâneas42 graves (síndrome de Stevens-Johnson43 e pustulose exantemática generalizada aguda) foram relatadas em pacientes recebendo bromidrato de galantamina. Recomenda-se que os pacientes sejam informados sobre os sinais44 de reações graves na pele45 e que o uso de Gaudy® deve ser interrompido no primeiro sinal46 de erupção47 cutânea48.
Monitoramento do peso
Pacientes com doença de Alzheimer6 perdem peso. O tratamento com inibidores da colinesterase, incluindo a galantamina, tem sido associado com perda de peso nestes pacientes. Durante o tratamento, o peso do paciente deve ser monitorado.
Condições que requerem cuidados
Como para outros colinomiméticos, Gaudy® deve ser administrado com cautela nas seguintes condições:
Condições cardiovasculares: devido à sua ação farmacológica, os colinomiméticos podem apresentar efeitos vagotônicos sobre a frequência cardíaca, incluindo bradicardia49 e todos os tipos de bloqueio de nódulo atrioventricular50 (vide Reações Adversas).O potencial para esta ação pode ser particularmente importante em pacientes com doença do nódulo sinusal51 ou outros distúrbios supraventriculares da condução cardíaca ou para os pacientes que utilizam concomitantemente fármacos que reduzem significativamente a frequência cardíaca, como a digoxina e os betabloqueadores. Em estudos clínicos, o uso de bromidrato de galantamina foi associado à síncope52 e, raramente, a bradicardia49 grave.
Condições gastrintestinais: os pacientes com risco aumentado de desenvolver úlceras53 pépticas, por exemplo, aqueles com história de doença ulcerativa ou os predispostos a estas condições, incluindo aqueles recebendo concomitantemente anti-inflamatórios não esteroidais, devem ter os sintomas27 monitorados. Entretanto, os estudos clínicos com bromidrato de galantamina não mostraram aumento, em relação ao placebo8, na incidência20 de doença péptica ulcerativa ou de sangramento gastrintestinal. O uso de Gaudy® não é recomendado nos pacientes com obstrução gastrintestinal ou em recuperação de cirurgia gastrintestinal.
Condições neurológicas: convulsões têm sido reportadas com o uso de bromidrato de galantamina (vide Reações Adversas – Dados pós- comercialização). A atividade convulsiva também pode ser uma manifestação da Doença de Alzheimer6. Um aumento no tônus colinérgico26 pode piorar sintomas27 relacionados a distúrbios extrapiramidais (vide “Reações Adversas” – “Dados pós-comercialização”).
Condições pulmonares: os colinomiméticos devem ser prescritos com cautela para pacientes54 com história de asma55 grave ou com doença pulmonar obstrutiva, devido à sua ação colinomimética.
Geniturinárias: o uso de Gaudy® não é recomendado nos pacientes com obstrução urinária ou em recuperação de cirurgia da bexiga56.
Segurança em pacientes com Transtorno Cognitivo9 Leve (TCL)
Gaudy® não é indicado para indivíduos com o Transtorno Cognitivo9 Leve (TCL), isto é, aqueles que demonstram um comprometimento isolado de memória maior que o esperado para sua idade e instrução, mas não apresenta critérios para a Doença de Alzheimer6.
Dois estudos controlados de 2 anos com pacientes com TCL não apresentaram dois desfechos primários de eficácia. Embora a mortalidade23 em ambos os braços do tratamento fosse baixa, mais mortes foram inicialmente observadas em pacientes randomizados com galantamina do que com placebo8, porém a incidência20 de eventos adversos sérios foi idêntica entre grupos do tratamento. As mortes foram devidas a várias causas que podem ocorrer em uma população idosa. Quando os dados recuperados da grande proporção dos pacientes que interromperam antes da conclusão no período duplo-cego foram incluídos, não houve evidência de um risco aumentado de morte em pacientes tratados com Gaudy® durante esse período. Mais pacientes do grupo placebo8 do que do grupo da galantamina interromperam o estudo antes da morte, o que pode esclarecer a diferença na mortalidade23 apresentada inicialmente.
Os resultados do estudo do TCL são discrepantes daqueles observados nos estudos da doença de Alzheimer6. Em estudos agrupados (“pooled studies”) na doença de Alzheimer6 (n=4614), a taxa de mortalidade23 foi numericamente mais elevada no placebo8 do que o grupo de bromidrato de galantamina.
Efeitos na habilidade de dirigir e operar máquinas
A Doença de Alzheimer6 pode causar um prejuízo gradual da capacidade de dirigir ou comprometer a habilidade de operar máquinas. Além disto, tal como outros colinomiméticos, Gaudy® pode causar reações adversas (como tontura16 e sonolência) que poderiam afetar a habilidade de dirigir ou operar máquinas, especialmente durante as primeiras semanas depois do início do tratamento.
Gravidez57 e Lactação58
Categoria B – Não há estudos adequados em mulheres. Em experiência em animais não foram encontrados riscos, mas foram encontrados efeitos colaterais59 que não foram confirmados nas mulheres, especialmente durante o último trimestre de gravidez57.
Estudos de reprodução60 conduzidos em ratas prenhes com doses de até 16 mg/kg (ou cerca de 25 vezes a dose terapêutica61 para o homem) e em coelhas prenhes com doses de até 40 mg/kg (ou cerca de 63 vezes a dose terapêutica61 para o homem) não mostraram qualquer evidência de um potencial teratogênico62. Um aumento não significativo da incidência20 de anormalidades ósseas menores foi observada em ratas com a dose de 16 mg/kg.
Não há nenhum estudo sobre o uso do bromidrato de galantamina em gestantes. Gaudy® só deve ser utilizado durante a gestação se o benefício potencial justificar o risco potencial para o feto63.
Não foi estabelecido se o bromidrato de galantamina é excretado no leite humano e não existem estudos em mulheres amamentando. Portanto, as mulheres recebendo bromidrato de galantamina não devem amamentar.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
INTERAÇÕES MEDICAMENTOSAS
Interações Farmacodinâmicas
Devido ao seu mecanismo de ação, a galantamina não deve ser administrada concomitantemente com outros colinomiméticos. A galantamina antagoniza o efeito de medicamentos anticolinérgicos. Como esperado para os colinomiméticos, é possível a ocorrência de uma interação farmacodinâmica com drogas que reduzem significativamente a frequência cardíaca (ex. digoxina e betabloqueadores).
A galantamina, por ser um colinomimético, provavelmente exacerba o relaxamento muscular produzido por fármacos do tipo succinilcolina durante a anestesia64.
Interações Farmacocinéticas
Na eliminação da galantamina estão envolvidas várias vias metabólicas e a excreção renal38. Com base em estudos “in vitro”, CYP2D6 e CYP3A4 foram as principais enzimas envolvidas no metabolismo33 da galantamina. A inibição da secreção gástrica ácida não prejudica a absorção da galantamina.
Outros fármacos que afetam o metabolismo33 da galantamina
Fármacos que são inibidores potentes da CYP2D6 ou CYP3A4 podem aumentar a AUC28 da galantamina.
Estudos farmacocinéticos de dose múltipla demonstraram que a AUC28 da galantamina aumentou 30% e 40% respectivamente durante a administração concomitante de cetoconazol e paroxetina. Quando administrada com eritromicina, outro inibidor da CYP3A4, a AUC28 da galantamina aumentou apenas 10%. A análise farmacocinética na população com Doença de Alzheimer6 mostrou que a depuração da galantamina diminuiu cerca de 25-33% com a administração concomitante de amitriptilina, fluoxetina, fluvoxamina, paroxetina e quinidina, inibidores conhecidos da CYP2D6.
Portanto, no início do tratamento com inibidores potentes da CYP2D6 ou da CYP3A4 os pacientes podem apresentar aumento da incidência20 de efeitos colaterais59 colinérgicos, principalmente náusea15 e vômito17. Nestas circunstâncias, uma redução da dose de manutenção da galantamina pode ser considerada, com base na tolerabilidade do paciente.
A memantina, um antagonista65 do receptor N-metil-D-aspartato (NMDA), na dose de 10 mg/dia por 2 dias seguidos de 10 mg duas vezes ao dia por 12 dias não apresenta efeito na farmacocinética da galantamina com 16 mg/dia no estado de equilíbrio.
Efeito da galantamina no metabolismo33 de outras drogas
Doses terapêuticas da galantamina (12 mg duas vezes por dia) não produzem efeitos sobre a cinética66 da digoxina e da varfarina. A galantamina não afeta o tempo aumentado da protrombina67 induzido pela varfarina.
Estudos “in vitro” indicaram que a inibição potencial da galantamina em relação às principais formas do citocromo P450 humano é muito baixa.
CUIDADOS DE ARMAZENAMENTO DO MEDICAMENTO
Cuidados de conservação
Conservar em temperatura ambiente (15–30°C). Proteger da luz e manter em lugar seco. Este medicamento tem validade de 24 meses a partir da data de sua fabricação.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Características físicas e organolépticas do produto
- Gaudy® 8 mg: cápsula de gelatina dura, corpo branco e tampa verde, contendo pellets esféricos brancos ou quase brancos.
- Gaudy® 16 mg: cápsula de gelatina dura, corpo branco e tampa branca, contendo pellets esféricos brancos ou quase brancos.
- Gaudy® 24 mg: cápsula de gelatina dura, corpo branco e tampa azul, contendo pellets esféricos brancos ou quase brancos.
Antes de usar, observe o aspecto do medicamento.
TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS.
POSOLOGIA E MODO DE USAR
Gaudy® cápsula dura de liberação prolongada deve ser administrado por via oral uma vez ao dia, pela manhã, de preferência com alimentos. Deve- se garantir que quantidade adequada de líquidos seja ingerida durante o tratamento.
Dose Inicial
A dose inicial recomendada é de 8 mg/dia.
Conversão de tratamento de liberação imediata para as cápsulas de liberação prolongada
Pacientes em tratamento com bromidrato de galantamina comprimidos podem passar para Gaudy® cápsula dura de liberação prolongada tomando sua última dose de bromidrato de galantamina comprimidos à noite e começando o tratamento com Gaudy® cápsula dura de liberação prolongada uma vez ao dia na manhã seguinte. Ao se fazer a conversão dos comprimidos duas vezes ao dia para Gaudy® cápsula dura de liberação prolongada uma vez ao dia, a mesma dose diária total deve ser administrada.
Dose de Manutenção
A dose de manutenção inicial é de 16 mg/dia (cápsulas de 16 mg uma vez ao dia) e os pacientes devem ser mantidos com 16 mg/dia durante pelo menos 4 semanas.
Um aumento para a dose máxima de manutenção recomendada de 24 mg/dia (cápsulas de 24 mg uma vez ao dia) deve ser considerado após avaliação apropriada, incluindo avaliação do benefício clínico e da tolerabilidade.
Não há efeito rebote após a interrupção abrupta do tratamento (ex.: preparo para uma cirurgia).
Crianças
O uso de Gaudy® em crianças não é recomendado. Não existem dados disponíveis sobre o uso do bromidrato de galantamina em pacientes pediátricos.
Insuficiência renal40
As concentrações plasmáticas da galantamina podem estar aumentadas em pacientes com insuficiência renal40 moderada (depuração de creatinina41 = 52–104 mL/min) a grave (depuração de creatinina41 = 9-51 mL/min).
Para pacientes54 com depuração da creatinina41 ≥ 9 mL/min, não é necessário ajustar a dose.
O uso de bromidrato de galantamina não é recomendado em pacientes com depuração da creatinina41 < 9 mL/min ), pois não existem dados disponíveis nesta população de pacientes.
Insuficiência hepática39
As concentrações plasmáticas da galantamina podem estar aumentadas em pacientes com insuficiência hepática39 moderada a grave.
Em pacientes com função hepática68 moderadamente comprometida (pontuação Child-Pugh 7–9), com base no modelo farmacocinético, o tratamento deve ser iniciado com Gaudy® cápsula dura de liberação prolongada de 8 mg uma vez ao dia, de preferência pela manhã, durante pelo menos uma semana. Depois disso, os pacientes devem prosseguir com 8 mg ao dia durante pelo menos 4 semanas.
Nestes pacientes, as doses diárias totais não devem exceder 16 mg ao dia.
Em pacientes com insuficiência hepática39 grave (pontuação Child-Pugh > 9), o uso de bromidrato de galantamina não é recomendado.
Tratamento concomitante
Nos pacientes tratados com inibidores potentes da CYP2D6 ou da CYP3A4, reduções da dose podem ser consideradas.
O perfil de liberação da formulação de galantamina de liberação controlada é caracterizado por uma taxa de liberação inicial de 27% por hora. Posteriormente há um declínio contínuo, atingindo uma taxa de 12% por hora na segunda hora e diminuindo em torno de 3% por hora a cada 2 horas para lentamente aproximar-se de um platô após 8 horas.
Este medicamento não deve ser partido, aberto ou mastigado.
REAÇÕES ADVERSAS
As reações adversas são apresentadas nesta seção. Reações adversas são eventos adversos que foram considerados razoavelmente associados ao uso de bromidrato de galantamina, com base na avaliação abrangente das informações de eventos adversos disponíveis. Em casos individuais, uma relação causal com bromidrato de galantamina não pode ser estabelecida com confiança. Portanto, pelo fato de que os estudos clínicos são conduzidos em condições amplamente variadas, as taxas de reações adversas observadas nos estudos clínicos de um medicamento não podem ser comparadas com as taxas nos estudos clínicos de outros medicamentos e podem não refletir as taxas observadas na prática clínica.
Dados de estudos clínicos
Dados de estudos duplo-cegos - Reações adversas ao fármaco37 relatadas com frequência ≥ 1%
A segurança de bromidrato de galantamina foi avaliada em 6502 indivíduos com demência3 do tipo Alzheimer4 leve ou moderadamente grave que participaram em 8 estudos clínicos duplo-cegos placebo8 controlados. A informação apresentada nesta seção é derivada de dados destes estudos.
As reações adversas relatadas por >1% dos pacientes tratados com bromidrato de galantamina nestes estudos clínicos estão na Tabela 1.
Tabela 1. Reações adversas relatadas por ≥ 1% dos indivíduos tratados com bromidrato de galantamina em 8 estudos clínicos duplo-cegos controlados com placebo8
|
Sistemas/Classes de órgãos |
bromidrato de galantamina |
Placebo8 |
|
Distúrbios do Metabolismo33 e da Nutrição69 |
||
|
Diminuição do apetite |
7,4 |
2,1 |
|
Distúrbios Psiquiátricos |
||
|
Depressão |
3,6 |
2,3 |
|
Distúrbios do Sistema Nervoso70 |
||
|
Vertigem71 |
6,8 |
2,9 |
|
Cefaleia72 |
7,1 |
5,5 |
|
Tremor |
1,6 |
0,7 |
|
Síncope52 |
1,4 |
0,6 |
|
Letargia73 |
1,3 |
0,4 |
|
Sonolência |
1,5 |
0,8 |
|
Distúrbios Cardíacos |
||
|
Bradicardia49 |
1,0 |
0,3 |
|
Distúrbios Gastrintestinais |
||
|
Náusea15 |
20,7 |
5,5 |
|
Vômito17 |
10,5 |
2,3 |
|
Diarreia18 |
7,4 |
4,9 |
|
Dor abdominal |
2,0 |
0,6 |
|
Dor no abdômen superior |
1,9 |
1,4 |
|
Dispesia |
1,5 |
1,0 |
|
Desconforto abdominal |
2,1 |
0,7 |
|
Distúrbios Musculoesqueléticos e do Tecido Conectivo74 |
||
| Espasmos75 musculares | 1,2 | 0,5 |
|
Distúrbios Gerais e Condições no local da aplicação |
||
|
Fadiga19 |
3,5 |
1,8 |
|
Astenia76 |
2,0 |
1,5 |
|
Indisposição |
1,1 |
0,5 |
|
Investigações |
||
|
Perda de peso |
4,7 |
1,5 |
|
Lesões77, intoxicações e complicações de procedimento |
||
|
Queda |
3,9 |
3,0 |
|
Laceração |
1,1 |
0,5 |
Em um estudo clínico randomizado11 duplo-cego e controlado com placebo8, o perfil de segurança do tratamento uma vez ao dia de O bromidrato de galantamina, cápsulas de liberação prolongada, foi similar em frequência e natureza do que os observados com os comprimidos simples.
Náusea15 e vômito17 foram os eventos adversos mais frequentes e ocorreram principalmente durante o período de titulação da dose e permaneceram durante menos de uma semana na maioria dos casos e a maioria dos pacientes apresentaram apenas 1 episódio. A prescrição de antieméticos78 e ingestão adequada de fluídos podem ser úteis para estes casos.
Dados de estudos duplo-cegos e abertos - Reações Adversas relatadas com frequência <1%.
Adicionalmente aos estudos duplo-cego, a segurança de bromidrato de galantamina foi avaliada em 1454 indivíduos com demência3 do tipo Alzheimer4 leve ou moderadamente grave que participaram em 5 estudos clínicos abertos.
Reações adversas adicionais não relatadas na Tabela 1 que ocorreram em <1% dos indivíduos (n=5410) tratados com bromidrato de galantamina em 8 estudos duplo-cegos e 5 estudos abertos estão listadas na Tabela 2.
Tabela 2. Reações adversas relatadas por <1% dos indivíduos tratados com bromidrato de galantamina nos estudos clínicos duplo-cegos ou abertos
|
Sistemas/Classes de órgãos |
bromidrato de galantamina |
|
Distúrbios do Metabolismo33 e da Nutrição69 |
|
|
Desidratação79 |
0,96 |
|
Distúrbios do Sistema Nervoso70 |
|
|
Disgeusia80 |
0,31 |
|
Hipersonia |
0,55 |
|
Parestesia81 |
0,33 |
|
Distúrbios Oftalmológicos |
|
|
Visão82 embaçada |
0,31 |
|
Distúrbios Cardíacos |
|
|
Bloqueio átrio-ventricular de primeiro grau |
0,30 |
|
Palpitação83 |
0,41 |
|
Bradicardia49 sinusal |
0,55 |
|
Extrassístoles supraventriculares |
0,46 |
|
Distúrbios Vasculares22 |
|
|
Rubor |
0,24 |
| Hipotensão84 |
0,52 |
|
Distúrbios gastrintestinais |
|
|
Ânsia de vômito17 |
0,22 |
|
Distúrbios na Pele45 e Tecidos Subcutâneos |
|
|
Hiperidrose85 |
0,85 |
|
Distúrbios Musculoesqueléticos e do Tecido Conectivo74 |
|
| Fraqueza muscular | 0,61 |
Dados pós-comercialização
Em adição as reações adversas relatadas durante os estudos clínicos, as seguintes reações adversas foram relatadas durante a experiência pós-comercialização.
Reação muito rara (< 1/10.000, incluindo relatos isolados):
- Distúrbios do sistema imune86: hipersensibilidade;
- Distúrbios psiquiátricos: alucinação87, alucinação87 visual, alucinação87 auditiva;
- Distúrbios do sistema nervoso70: convulsão88, distúrbios extrapiramidais;
- Distúrbios auditivos e do labirinto89: tinido;
- Distúrbios cardíacos: bloqueio atrioventricular total;
- Distúrbios vasculares22: hipertensão90;
- Distúrbios hepatobiliares91: hepatite92;
- Distúrbios da pele e tecido subcutâneo93: síndrome94 de Stevens Johnson, pustulose exantemática generalizada aguda, eritema multiforme95.
- Investigações: aumento das enzimas hepáticas96.
Em casos de eventos adversos, notifique pelo Sistema VigiMed, disponível no Portal da Anvisa.
SUPERDOSE
Sintomas27
Os sinais44 e os sintomas27 esperados para a superdose significativa da galantamina são semelhantes aos sinais44 e sintomas27 da superdose de outros colinomiméticos. Estes efeitos geralmente envolvem o sistema nervoso central97, o sistema nervoso70 parassimpático e a junção neuromuscular98. Além da fraqueza muscular ou das fasciculações99 musculares, podem ocorrer alguns ou todos os sinais44 de crise colinérgica100: náusea15 grave, vômito17, cólicas101 gastrintestinais, salivação, lacrimejamento, incontinência urinária102 e fecal, sudorese103, bradicardia49, hipotensão84, colapso104 e convulsões. O aumento da fraqueza muscular junto com hipersecreções traqueais e broncoespasmo105 podem levar a um comprometimento vital das vias aéreas.
Durante o período de pós-comercialização foram relatados casos de “Torsade de Pointes” prolongamento do intervalo QT, bradicardia49, taquicardia106 ventricular e breve perda de consciência associada à ingestão acidental de galantamina. Em um dos casos foi relatada a ingestão de 8 comprimidos de 4 mg (total de 32 mg) em um único dia.
Dois casos adicionais de ingestão acidental de 32 mg (náusea15, vômito17, boca107 seca; náusea15, vômito17 e dor torácica subesternal) e um de 40 mg (vômito17), resultaram em hospitalização breve para observação com recuperação completa. Um paciente, com história de alucinações108 nos dois anos anteriores, para o qual foi prescrita dose de 24 mg/dia, recebeu erroneamente 24 mg duas vezes ao dia por 34 dias e desenvolveu alucinações108 que exigiram hospitalização. Outro paciente, para o qual foram prescritos 16 mg/dia de solução oral, ingeriu inadvertidamente 160 mg (40 mL), apresentou sudorese103, vômito17, bradicardia49 e quase síncope52 uma hora mais tarde e foi hospitalizado. Os sintomas27 desapareceram em 24 horas.
Tratamento
Como em qualquer caso de superdose, devem ser utilizadas medidas gerais de suporte. Nos casos graves, anticolinérgicos como a atropina podem ser utilizados como antídoto109 geral para os colinomiméticos. Recomenda-se uma dose inicial de 0,5 a 1,0 mg via intravenosa, sendo as doses subsequentes baseadas na resposta clínica.
Como estratégias para a conduta na superdose estão continuamente em desenvolvimento, é aconselhável contatar um centro de controle toxicológico para determinar as últimas recomendações para a conduta de uma superdose.
Em caso de intoxicação ligue para 0800 722 6001, se você precisar de mais orientações.
DIZERES LEGAIS
VENDA SOB PRESCRIÇÃO MÉDICA
SÓ PODE SER VENDIDO COM RETENÇÃO DA RECEITA
Registro M.S. nº. 1.0235.1308
Farm. Resp.: Dra Telma Elaine Spina CRF-SP nº 22.234
EMS S/A
Rod. Jornalista Francisco Aguirre Proença, Km 08 Bairro Chácara Assay
Hortolândia – SP/ CEP: 13186-901
CNPJ: 57.507.378/0003-65
Industria Brasileira
SAC 0800 019 19 14