Parinex (Bula do profissional de saúde)
HIPOLABOR FARMACEUTICA LTDA
IDENTIFICAÇÃO DO MEDICAMENTO
Parinex®
heparina sódica suína
Injetável 5.000 U.I./mL e 5.000 U.I./0,25 mL
FORMA FARMACÊUTICA E APRESENTAÇÃO:
Solução injetável
Ampola de 0,25 mL e frascos-ampola de 5 mL
USO INTRAVENOSO (Solução injetável 5000 UI/mL)
USO SUBCUTÂNEO1 (Solução injetável 5000 UI/0,25 mL)
USO ADULTO
COMPOSIÇÃO:
Cada ampola de Parinex 0,25 mL contém:
| heparina sódica suína | 5.000 UI |
| veículo q.s.p | 0,25 mL |
Veículo: água para injetáveis.
Cada frasco-ampola de Parinex 5 mL contém:
| heparina sódica suína | 5.000 UI |
| veículo q.s.p. | 1,0 mL |
Veículo: álcool benzílico, cloreto de sódio e água para injetáveis.
INFORMAÇÕES TÉCNICAS AOS PROFISSIONAIS DE SAÚDE2
INDICAÇÕES
Parinex solução injetável é indicado para a inibição da coagulação3 ao utilizar a circulação4 extracorpórea ou a hemodiálise5. Parinex solução injetável é também indicado na terapêutica6 anticoagulante7 na profilaxia e tratamento da trombose8 venosa e a sua extensão, na prevenção de trombose8 venosa pós- operatória e tromboembolismo9 pulmonar em doentes submetidos a cirurgias.
RESULTADOS DE EFICÁCIA
Estudo clínico randomizado10, aberto, paralelo, prospectivo11 e controlado por comparador ativo, realizado com objetivo de avaliar a segurança e não inferioridade do Parinex em relação ao medicamento comparador da APP Pharmaceticals na prevenção do desenvolvimento de Tromboembolismo9 Venoso (TEV) em pacientes submetidos a cirurgias de médio risco para o desenvolvimento desta patologia12. Também foram avaliados o surgimento de eventos adversos com o uso de ambos medicamentos. 116 pacientes foram submetidos a avaliação, 60 pacientes utilizaram o medicamento teste e 56 o medicamento referência. Os pacientes foram acompanhados por 28 dias e foi observado que a incidência13 de tromboembolismo9 venoso foi de apenas 1% (distribuídos homogeneamente entre os dois grupos), demonstrando, portanto, a não inferioridade do grupo tratado com Parinex com o grupo referência. Similarmente, a presença de eventos adversos não esperados nos dois grupos foi muito baixa, demonstrando a segurança do medicamento teste.1
Estudo clínico duplo cego, randomizado10, de não inferioridade clínica, realizado com objetivo de avaliar a não inferioridade e segurança do Parinex em pacientes com insuficiência renal14 submetidos a circulação4 extracorpórea em hemodiálise5. Através do controle de hemostasia15, verificada pela alteração do volume útil dos capilares16 pela formação de trombos17 durante o procedimento dialítico e pela coagulação3 total do sistema, Parinex demonstrou não inferioridade após o final de 12 sessões analisadas. Os eventos adversos mostraram intercambialidade entre o medicamento teste e referência. Neste estudo 56 pacientes foram tratados com o medicamento teste e 56 com o medicamento referência e conforme já relatado ambos os medicamentos são equivalentes no que diz respeito aos parâmetros avaliados.2
Não inferioridade clínica da heparina sódica produzido pela Hipolabor Farmacêutica Ltda em relação à heparina sódica suína do Laboratório APP Pharmaceuticals na profilaxia de tromboembolismo9 venoso em pacientes cirúrgicos, de médio risco para o desenvolvimento de tromboembolismo9. (HEPHIP0509PRO)
Estudo clínico randomizado10 de não inferioridade clínica da heparina sódica produzido pela Hipolabor Farmacêutica (Parinex) em relação à heparina sódica suína do Laboratório APP Pharmaceuticals em pacientes com insuficiência renal14. (HEPHIP0509)
CARACTERÍSTICAS FARMACOLÓGICAS
Propriedades farmacodinâmicas
A heparina é constituída por uma mistura de ésteres polissulfúricos de um mucopolissacarídeo18. Seu efeito anticoagulante7 é exercido por intermédio da antitrombina III que, como co-fator, neutraliza vários fatores ativados da coagulação3 (calicreína, XIIa, XIa, IXa, Xa e trombina19). Além disso, a heparina promove o aumento da hidrólise dos triglicerídeos, dos quilomícrons e das VLDL através da liberação e estabilização de lipases-lipoprotéicas presentes nos tecidos.
A heparina inibe reações que levam à coagulação3 do sangue20 e a formação de coágulos de fibrina21. Pequenas quantidades de heparina em combinação com antitrombina III podem inibir a trombose8 pela inativação do fator Xa e inibição da conversão da protrombina22 em trombina19. Uma vez que a trombose8 é desenvolvida, maiores quantidades de heparina podem inibir novos coágulos. A heparina impede também a formação de um coágulo23 de fibrina21 estável através da inibição da ativação do fator estabilizador de fibrina21.
Propriedades farmacocinéticas
Absorção: A heparina sódica não é absorvida após administração oral sendo utilizada por via intravenosa, intramuscular ou subcutânea24. A heparina liga-se reversivelmente aos seus locais de ação, antitrombina e as outras proteases séricas envolvidas na coagulação3, especialmente o fator X ativado (Fator Xa). Também se liga a outras proteínas25 do plasma26, incluindo o fibrinogênio27, a plasmina, a albumina28, e as lipases. O volume de distribuição da heparina é então, na maioria das circunstâncias, limitado ao volume do plasma26.
Distribuição: Sua distribuição nos tecidos não é de grande importância clínica, pois a heparina atua diretamente no sistema sanguíneo, com uma ampla ligação às proteínas25 plasmáticas principalmente às lipoproteínas de baixa densidade, globulinas29 e fibrinogênio27. A concentração eficaz é de cerca de 0,6 ± 0,3 U.I./mL de plasma26 na terapêutica6 e de 0,05 - 0,2 U.I./mL de plasma26 na profilaxia. A heparina sódica não atravessa a barreira placentária nem passa para o leite materno. Por esta razão, é considerado o anticoagulante7 de eleição durante a gravidez30 e lactação31.
Metabolismo32: A heparina tem uma meia-vida muito curta, cerca de 1,5 horas, que é dependente da dose e varia de acordo com o método de ensaio utilizado para as suas medições. Pode ser maior em pacientes com insuficiência renal14, disfunção hepática33 e obesidade34 e diminuir em pacientes com embolismo35 pulmonar e infecções36. Não é eliminada por via enzimática ou por filtração glomerular ou por secreção tubular renal37. É altamente provável que o anticoagulante7 seja transferido para as células38 retículo - endoteliais, que também podem fornecer os meios para a sua degradação.
Seus metabólitos39 são inativos e a biotransformação é hepática33.
Quando administrada de forma intermitente40, o efeito anticoagulante7 ocorre dentro de 5 a 10 minutos após a injeção41 e permanece aproximadamente por 3 horas e as injeções devem ser repetidas a cada 4–6 horas.
Eliminação: O endotélio vascular42 e o sistema retículo endotelial captam e provavelmente promovem a degradação da heparina sódica. Os metabólitos39 são inativados e eliminados por via renal37.
A meia-vida biológica depende da dose administrada e é de uma hora com 100 UI/kg e 2,5 horas com 400 UI/kg. Em situações especiais, como na insuficiência hepática43 e/ou renal37 grave, pode ocorrer o acúmulo de heparina.
O tratamento com heparina é geralmente controlado com o tempo de tromboplastina44 parcial ativado (TTPA). A dose é considerada adequada se o TTPA estiver 1,5 a duas vezes acima do valor normal ou se o tempo de coagulação3 do sangue20 total situar-se 2,5 a três vezes acima do valor controle. O tratamento com doses baixas (5.000 U.I., de 8 a 12 horas), não necessita de controle laboratorial, uma vez que o TTPA não é prolongado.
As doses máximas de heparina prolongam o tempo parcial de tromboplastina44, o tempo de trombina19, o tempo de coagulação3 do sangue20 total e o tempo de coagulação3 ativa do sangue20 total.
Toxicologia
- Toxicologia aguda: para ratos a DL50 por via oral é de 779.000 U.I./kg, via subcutânea24 a DL50 é de 46.715 U.I./kg e intravenosa a DL50 é de 39.1821 U.I./kg.
- Toxicologia crônica: os ratos não evidenciaram sinais45 de toxicidade46 após um mês de administração da heparina.
CONTRAINDICAÇÕES
Parinex é contraindicado em pacientes com hipersensibilidade à heparina, trombocitopenia47 severa, endocardite48 bacteriana subaguda49, suspeita de hemorragia50 intracraniana, hemorragia50 ativa incontrolável (exceto quando associada à coagulação3 intravascular51 disseminada), hemofilia52, retinopatia, quando não houver condições para realização de testes de coagulação3 em intervalos adequados (esta contraindicação refere-se a dose total de heparina, geralmente não há necessidade de monitorar parâmetros de coagulação3 em pacientes que recebem baixa dose de heparina), nas desordens que implicam em danos ao sistema vascular53 (ex. úlcera54 gastrointestinal, hipertensão55 diastólica maior que 105 mm Hg).
Também é contraindicado nas diástases hemorrágicas56, cirurgias de medula espinhal57 (aumento do risco de hemorragias58 secundárias), aborto iminente, coagulopatias graves, na insuficiência hepática43 e renal37 grave, em presença de tumores malignos com permeabilidade59 capilar60 elevada do aparelho digestivo61 e, algumas púrpuras62 vasculares63. Pacientes com histórico de trombocitopenia47 induzida por heparina e trombose8.
Gestantes não devem utilizar medicamento à base de heparina contendo álcool benzílico em sua formulação, nestes casos é recomendável o uso de heparina isenta de conservantes.
ADVERTÊNCIAS E PRECAUÇÕES
Devem ser tomadas precauções ao se administrar Parinex em pacientes que apresentem algum sinal64 ou queixa de hepatopatia (com hipersensibilidade a heparina) ou após intervenções da próstata65, fígado66 e vias biliares67.
Os pacientes que desenvolvem trombocitopenia47 com tendência a tromboses68 arteriais, pela administração da heparina, podem receber heparina convencional e de baixo peso molecular somente após testes de agregação plaquetária in vitro. Em caso de resultado positivo, Parinex está contraindicado. Nestes casos, se a administração de heparina for absolutamente necessária, a mesma poderá ser reiniciada independentemente de sua administração inicial, após a obtenção de um teste negativo de agregação plaquetária in vitro, porém a quantidade de plaquetas69 deve ser monitorada.
Parinex deve ser utilizado com muita cautela em pacientes com risco de valvulopatias, endocardite48 bacteriana subaguda49, púrpura70 vascular53, hemofilia52.
Pacientes sob tratamento com Parinex podem apresentar hemorragia50 em qualquer parte do corpo. Uma queda inexplicável no hematócrito71, queda da pressão sanguínea ou qualquer outro sintoma72 inexplicado pode estar relacionado a um evento hemorrágico73. Qualquer alteração nos exames de sangue20 (hematócrito71) ou uma queda inexplicada da pressão arterial74 deve ser comunicada ao médico.
Também podem ocorrer hemorragias58 em caso de lesões75 ulcerativas gastrointestinais e durante ou imediatamente após anestesia76 na coluna, grandes cirurgias especialmente, do cérebro77, coluna e olhos78.
Parinex deve ser usado com extrema precaução nos casos em que há um aumento do risco de hemorragia50. A tabela 1, descreve condições que podem acentuar o perigo de hemorragia50.
Tabela 1. Condições que podem acentuar o risco de hemorragia50.
|
Condição |
Descrição |
|
Cardiovascular |
Endocardite48 bacteriana, hipertensão55 grave. |
|
Cirúrgica |
Durante e imediatamente após: punção lombar ou anestesia76 raquidiana ou cirurgia de grande porte, especialmente que envolve o cérebro77, medula espinhal57 ou olho79. |
|
Hematológica |
As condições associadas com o aumento da tendência hemorrágica80, tais como a hemofilia52, trombocitopenia47. |
|
Gastrointestinal |
As lesões75 ulcerativas e tubo de drenagem81 contínua do estômago82 ou do intestino delgado83. |
|
Outras |
Menstruação84, pacientes com idade superior a 60 anos principalmente mulheres, pacientes com insuficiência hepática43 e insuficiência renal14. |
A heparina também deve ser utilizada com cuidado nos pacientes com diabetes mellitus85, acidose86 ou que utilizam concomitantemente fármacos poupadores de potássio, pois há risco de hiperpotassemia.
Trombocitopenia47 induzida por heparina
A Trombocitopenia47 Induzida por Heparina (TIH) é uma síndrome87 imuno-hematológica que cursa com ativação plaquetária na presença de heparina, induzindo à sua agregação, podendo provocar graves complicações trombóticas88. A frequência de TIH nos pacientes que recebem heparina por mais de 5 dias é de 1 a 6%.
A TIH é classificada em tipo I e tipo II. A TIH tipo I, uma trombocitopenia47 não imune associada à heparina, é a forma mais frequente, podendo ocorrer em até 30% dos pacientes. Caracteriza-se por uma supressão não imunológica, benigna, transitória e moderada, da produção e do número de plaquetas69. O diagnóstico89 clínico e laboratorial é definido nos 2 primeiros dias após o início da terapia com heparina, quando ocorre uma moderada trombocitopenia47. Raramente a contagem plaquetária é inferior a 100.000 mm3. A queda na contagem plaquetária não apresenta significância clínica, e o número de plaquetas69 pode se normalizar, mesmo que a administração da heparina seja mantida. A TIH tipo II, também denominada trombocitopenia47 imunológica induzida por heparina, é uma síndrome87 imuno-hematológica
mediada por um anticorpo90 que causa ativação plaquetária na presença de heparina e induz à agregação plaquetária. Após a primeira exposição à heparina, entre o quinto e o 14º dia de terapia, a contagem plaquetária pode sofrer redução igual ou superior a 50% em relação à contagem plaquetária pré-heparina (geralmente inferior a 100.000/mm3) e pode estar associada a graves complicações trombóticas88, com chance de levar à morte. A TIH não é uma complicação muito frequente, mas deve sempre ser lembrada, com estabelecimento de rotina de contagens plaquetárias antes e a cada dois dias depois do tratamento anticoagulante7 com heparinas.
Resistência à heparina
Sugere-se ocorrência de resistência à heparina nos casos em que há necessidade de utilização de doses crescentes de heparina e não se observa alteração no tempo de tromboplastina44 parcial ativado (TTPA). A resistência à heparina pode ser manifestada por meio de sintomas91 como febre92, trombose8, tromboflebite93, infecções36 com tendências trombóticas88, infarto do miocárdio94, câncer95, em pacientes pós-operatórios e pacientes com deficiência de antitrombina III. É recomendado um monitoramento rigoroso dos testes de coagulação3 nestes casos. Nestes casos, devem-se ajustar as doses de heparina com base nos níveis de antifator Xa.
Gravidez30 e Lactação31
Não foram conduzidos estudos em animais com Parinex e os estudos clínicos conduzidos não incluíram mulheres gravidas ou lactantes96. Na literatura, não há dados disponíveis em mulheres grávidas que informam sobre um risco associado ao medicamento de defeitos maiores no nascimento e aborto. Há dados que indicam que a exposição à heparina durante a gravidez30 não demonstrou evidência de um aumento no risco de desfechos adversos nas mães ou nos fetos em humanos. Não foi observado teratogenicidade, mas morte embriofetal prematura em estudos de reprodução97 em animais com administração de heparina sódica em altas doses a ratas e coelhas grávidas durante a organogênese.
O uso de Parinex durante a gravidez30 deve ser considerado apenas quando os benefícios do tratamento superarem os riscos potenciais às mulheres grávidas e seus fetos.
O uso de heparina livre de conservante é recomendado em caso de necessidade de uso durante a gravidez30. Não há informação sobre a presença de heparina no leite humano, efeitos no lactente98 ou os efeitos na produção de leite. Devido ao seu alto peso molecular, não é esperado que heparina seja excretada no leite, assim como não haveria a absorção de heparina por via oral pelo lactente98. O álcool benzílico presente no soro99 materno tem potencial de ir para o leite materno e ser absorvido pelo lactente98.
Categoria de risco na gravidez30: C – Não há estudos adequados em mulheres. Em experiências animais ocorreram alguns efeitos colaterais100 no feto101, mas o benefício do produto pode justificar o risco potencial durante a gravidez30.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião- dentista.
Populações especiais
Pacientes idosos: Pode haver maior risco de sangramento em pacientes idosos.
Pacientes pediátricos: Não foram conduzidos estudos clínico utilizando Parinex em pacientes pediátricos.
Pacientes diabéticos ou com insuficiência hepática43 e/ou renal37: A insuficiência hepática43 e/ou renal37 grave pode causar o acúmulo de heparina. Pode ocorrer hipercalcemia em pacientes diabéticos e/ou com insuficiência renal14.
Em pacientes com insuficiência renal14, hepática33 ou da coagulação3, o tratamento com heparina sódica deve ser instituído levando-se em consideração as provas de coagulação3. Entretanto, a heparina sódica está contraindicada em pacientes com insuficiência hepática43 e renal37 grave.
INTERAÇÕES MEDICAMENTOSAS
O uso concomitante do ácido acetilsalicílico e da heparina potencializa as propriedades anticoagulantes102 da heparina, aumentando o risco de sangramento. O ácido acetilsalicílico inibe a agregação plaquetária. Se for imprescindível à administração de ácido acetilsalicílico associado a anticoagulantes102 deve ser monitorada o tempo parcial de tromboplastina44. Como alternativa, em caso de febre92 e dor moderada o ácido acetilsalicílico pode ser substituído por paracetamol, que não afeta função plaquetária.
Fármacos como dextrano, fenilbutazona, ibuprofeno, indometacina, dipiridamol, cloroquina, tienopiridinas, celecoxibe, antagonistas da glicoproteína IIb /IIIa (incluindo abciximabe, eptifibatide e tirofiban) e outros que interferem nas reações de agregação plaquetária, devem ser usados com precaução nos pacientes que utilizam heparina, pois podem induzir o sangramento nesses pacientes.
Antitrombina III: o efeito anticoagulante7 da heparina é aumentado na administração concomitante com antitrombina. A diminuição do efeito da heparina pode ocorrer em casos de administração concomitante de anti-histamínicos, digitálicos, tetraciclinas e em relação aos abusos de administração de nitroglicerina como também de nicotina.
Pacientes que ingerem maior quantidade de álcool possuem maior risco de apresentar hemorragia50 grave relacionada à heparina.
Quando necessária a substituição da terapia com heparina para a terapia com varfarina oral, é desejável a sobreposição de ambos os tratamentos por cerca de 4 a 5 dias, a terapia de dose plena de heparina é mantida até a varfarina alcançar o tempo de protrombina22 desejado. Sendo necessário a monitorização mais frequente do tempo de protrombina22. A heparina prolonga o tempo de protrombina22. Quando a heparina for coadministrada com a varfarina, a menos que usando infusão IV contínua de heparina, deve-se aguardar pelo menos 5 horas após a última dose de heparina em bolus103 IV (ou 24 horas após a última dose de heparina subcutânea24) antes mensurar o tempo de protrombina22. A heparina quando utilizada concomitantemente com anticoagulantes102 aumentam o risco de sangramento.
CUIDADOS DE ARMAZENAMENTO DO MEDICAMENTO
Cuidados de conservação
Parinex solução injetável deve ser conservado em temperatura ambiente (15–30°C), protegido da luz.
Número de lote e datas de fabricação e validade: vide embalagem. O prazo de validade é de 18 meses a partir da data de fabricação impressa na embalagem.
Após a reconstituição com solução de glicose104 a 5% ou solução de cloreto de sódio 0,9%, a solução obtida deve ser conservada em temperatura ambiente (entre 15 e 30°C) e armazenada por no máximo 24 horas.
Características físicas e organolépticas do produto
- Parinex apresenta-se em ampola de vidro transparente contendo 0,25 mL de solução ou em frasco-ampola de vidro transparente contendo 5mL de solução.
- Parinex apresenta-se na forma de solução incolor a levemente amarelada com odor característico.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original. Antes de usar, observe o aspecto do medicamento.
TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS.
POSOLOGIA E MODO DE USAR
Para evitar problemas de contaminação, utilize técnicas assépticas.
A heparina sódica não é eficaz por administração oral e deve ser administrada por via parenteral, infusão intravenosa intermitente40, infusão intravenosa ou subcutânea24. A via de administração intramuscular deve ser evitada devido à frequente ocorrência de hematoma105 no local da injeção41.
Quando Parinex for administrado por via subcutânea24 na região abdominal subdiafragmática, utilizar agulha tão fina quanto possível. Levantar uma prega cutânea106 e inserir a agulha horizontalmente com precaução, após administração da dose, retirar a agulha sempre na posição horizontal.
Quando Parinex for adicionado a uma solução de infusão, a bolsa ou frasco contendo solução deve ser vertido por pelo menos seis vezes. Este procedimento assegura a homogeneização adequada da heparina na solução.
A solução de infusão apresentou-se compatível e estável, quando diluída exclusivamente em solução de glicose104 a 5% e solução de cloreto de sódio 0,9%.
A posologia da heparina sódica deve sempre ser ajustada às circunstâncias especiais de cada caso (tipo e evolução da patologia12, peso corpóreo e idade do paciente, efeitos secundários, etc). É necessária atenção especial à dosagem, pois com uma posologia demasiadamente baixa, o processo trombótico107 pode continuar a progredir com o risco de uma embolia108 fatal. A posologia deve ser estabelecida com base nos resultados das provas de coagulação3 (tempo de trombina19, tempo parcial de tromboplastina44, tempo parcial de tromboplastina44 ativada) que permitem também determinar a hora da próxima dose de heparina. Em pacientes com insuficiência109 funcional renal37, hepática33 ou da coagulação3, o tratamento com heparina sódica deve ser instituído levando-se em consideração as provas de coagulação3.
A posologia da heparina pode variar segundo as indicações. Embora a dosagem possa ser ajustada para cada paciente, a seguir são apresentados os esquemas de posologia sugeridos:
Administração subcutânea24 (apresentação 5.000 UI/0,25mL)
Profilaxia do tromboembolismo9 venoso
Duas horas antes do procedimento cirúrgico, administrar 5.000 UI por via subcutânea24 (uma ampola de 0,25mL de Parinex, e em seguida de 12 e 12 horas por 07 dias a partir da primeira administração. A dose poderá ser modificada com aumento ou diminuição de 25% da dose inicial, como descrito a seguir:
Aumento da dose: sinais45 de não ativação do sistema de coagulação3, ou seja, não alteração do TTPa.
Diminuição da dose: sinais45 de ativação exagerada do sistema de coagulação3, ou seja, alteração do TTPa, com RNI acima de 2,0 ou sinais45 de sangramento ou formação de hematomas110, ou qualquer outro sinal64 do aumento da ativação do sistema de coagulação3.
Administração intravenosa (apresentação 5.000 UI/mL)
Circulação4 extracorpórea em hemodiálise5 na insuficiência renal14
Parinex, quando utilizado para prevenção de trombos17 no circuito de diálise111, deve ser administrado na dose de 150 UI/kg, diretamente no equipamento do circuito de diálise111, no início da sessão. Habitualmente, a dose recomendada é suficiente para a anticoagulação eficaz durante o tempo da sessão de hemodiálise5. Se necessário, incrementos nesta dose devem ser realizados para que os níveis de TTPa se situem dentro da faixa ideal.
Dosgens especiais
Uso em Idosos: É recomendável que a dose de heparina seja reduzida e monitorada em idosos.
Caso seja necessário utilizar Parinex apesar de uma das suas contraindicações mencionadas, é prudente controlar os efeitos pela medida do tempo de trombina19 (também chamado tempo de antitrombina) ou por um teste global (tempo de recalcificação, por exemplo). A determinação do tempo de tromboplastina44 (o tempo de protrombina22) não convém ao controle do tratamento pela heparina.
Modo de usar
Posição adequada para retirada da tampa plástica do frasco-ampola

Deixar o frasco-ampola na posição de aproximadamente 90°. Com a ponta do dedo polegar, pressione a tampa plástica para cima, cuidadosamente, até o seu desprendimento.
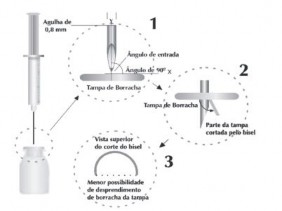
Com a finalidade de evitar o aparecimento de partículas de borracha após a inserção da agulha no frasco-ampola, proceder da seguinte forma:
- Encaixar uma agulha de injeção41 de no máximo 0,8 mm de calibre;
- Encher a seringa112 com o diluente apropriado;
- Segurar a seringa112 verticalmente à borracha;
- Perfurar a tampa dentro da área marcada, deixando o frasco-ampola firmemente na posição vertical;
- É recomendado não perfurar mais de 4 vezes na área marcada. (ISO 7864).
Posição adequada para abertura da ampola com anel de ruptura (VIBRAC)
- Deixar a ampola na posição de aproximadamente 45° (minimizando o risco de que partículas caiam dentro da ampola).

- Com a ponta do dedo polegar fazer apoio no estrangulamento.

Com o dedo indicador envolver a parte superior da ampola (balão), pressionando-a para trás.
REAÇÕES ADVERSAS
As reações adversas foram ordenadas segundo frequência, usando a seguinte convenção: Reação muito comum (≥ 1/10); Reação comum (≥ 1/100 e <1/10), Reação incomum (≥ 1/1.000 e <1/100), Reação rara (≥ 1/10.000 e <1/1.000) e Reação muito rara (<1/10.000).
Reação muito comum (≥1/10): trombocitopenia47, que ocorre em cerca de 30% dos pacientes e aumento do nível das transaminases hepáticas113. Embora muitas vezes leve e sem significado clínico evidente, a trombocitopenia47 pode ser acompanhada por complicações tromboembólicas graves, como necrose114 de pele115, gangrena116 das extremidades que podem levar à amputação117, enfarte do miocárdio118, embolia108 pulmonar, acidente vascular cerebral119, e possivelmente a morte.
Reação comum (≥1/100 e <1/10): hemorragia50 (5% a 10%), trombocitopenia47 induzida pela heparina (1% a 10%),
Reação incomum (≥ 1/1.000 e <1/100): trombocitopenia47 induzida pela heparina com trombose8 (menos de 1%) e reações de hipersensibilidade.
Após a injeção subcutânea120 de heparina sódica pode ocorrer irritação local, eritema121, dor leve, hematoma105 ou ulceração122. Têm sido relatadas reações de hipersensibilidade, como calafrios123, febre92 e urticária124 associados ao uso de heparina. Outras manifestações são asma125, rinite126, lacrimejamento, dor de cabeça127, náuseas128 e vômitos129, e reações anafilactóides, incluindo choque130, que ocorre mais raramente. Pode ocorrer também prurido131 e ardor132, especialmente no lado plantar do pé.
A hemorragia50 é a principal complicação resultante da terapia com heparina. O tempo de coagulação3 excessivamente prolongado ou pequenos sangramentos durante a terapia geralmente pode ser controlado com a suspensão do tratamento.
Durante o tratamento com anticoagulante7 a ocorrência de sangramentos gastrointestinais ou no trato urinário133, pode indicar a presença de lesões75 ocultas. O sangramento pode ocorrer em qualquer local, mas algumas complicações hemorrágicas56 específicas podem ser difíceis de detectar: (1) hemorragia50 supra-renal134, pode ocasionar insuficiência109 adrenal aguda. Em pacientes que apresentarem sinais45 e sintomas91 de hemorragia50 e insuficiência renal14 aguda o tratamento com o anticoagulante7 deve ser interrompido; (2) hemorragia50 ovariana, afeta algumas mulheres em idade fértil que receberam tratamento com heparina; (3) hemorragia50 retroperitoneal135.
Foram relatados após a administração em longo prazo de doses elevadas de heparina casos de osteoporose136, necrose114 cutânea106, de supressão da síntese de aldosterona, alopecia137 transitória, priapismo138 e hiperlipemia rebote, com a interrupção da heparina sódica.
Em casos de eventos adversos, notifique pelo Sistema VigiMed, disponível no Portal da Anvisa.
SUPERDOSE
A hemorragia50 é o principal sinal64 de superdosagem com heparina, hemorragias58 nasais, sangue20 na urina139 ou fezes podem ser os primeiros sinais45. A formação de hematomas110 ou petéquias140 também pode preceder a hemorragia50. As medidas a serem tomadas em caso de hemorragia50 consistem em: redução da dose, interrupção do tratamento e, em casos graves, neutralização com protamina.
Quando a circunstância clínica de hemorragia50 exigir a reversão da heparinização, deve- se utilizar sulfato de protamina (1% solução) por infusão lenta para neutralizar a heparina sódica. Não deve ser administrado mais de 50 mg de protamina em período de 10 minutos. Cada 1 mg de sulfato de protamina neutraliza cerca de 100 unidades USP de heparina. A meia vida da protamina após administração intravenosa é cerca de meia hora.
As protaminas são proteínas25 básicas de baixo peso molecular que se ligam firmemente à heparina in vitro e, dessa forma, neutralizam seu efeito anticoagulante7. In vivo, a protamina também interage com as plaquetas69, o fibrinogênio27 e outras proteínas25 plasmáticas e pode causar efeito anticoagulante7 por si mesma. A protamina é utilizada rotineiramente para reverter o efeito da heparina após cirurgias cardíacas e outros procedimentos vasculares63.
A administração de sulfato de protamina pode provocar reações graves de hipotensão141 e anafilaxia142. Como essas reações podem ser fatais, a droga deve ser administrada apenas quando as técnicas e tratamento de choque anafilático143 e ressuscitação estiverem prontamente disponíveis.
Em caso de intoxicação ligue para 0800 722 6001, se você precisar de mais orientações.
DIZERES LEGAIS
VENDA SOB PRESCRIÇÃO MÉDICA
USO RESTRITO A HOSPITAIS
MS: 1.1343.0200
Farm. Resp. Dr. Renato Silva CRF-MG: 10.042
HIPOLABOR FARMACÊUTICA LTDA.
Rod BR 262 - Km 12,3 Borges /Sabará - MG
CEP: 34.735-010
CNPJ: 19.570.720/0001-10
Indústria Brasileira
SAC 0800 031 1133