

Libtayo (Bula do profissional de saúde)
SANOFI MEDLEY FARMACÊUTICA LTDA.
IDENTIFICAÇÃO DO MEDICAMENTO
Libtayo®
cemiplimabe
Solução para infusão 350 mg/7 mL (50 mg/mL)
FORMA FARMACÊUTICA E APRESENTAÇÃO:
Solução para diluição para infusão
Embalagem contendo 1 frasco-ampola com 7 mL
USO INTRAVENOSO (IV)
USO ADULTO
COMPOSIÇÃO:
Cada mL de Libtayo® solução para diluição para infusão contém:
| cemiplimabe | 50 mg |
| veículo q.s.p. | 1 mL |
Veículo: histidina, cloridrato de histidina monoidratado, sacarose, prolina, polissorbato 80 e água para injetáveis.
INFORMAÇÕES TÉCNICAS AOS PROFISSINAIS DE SAÚDE1
INDICAÇÕES
Carcinoma2 cutâneo3 de células4 escamosas (CEC)
Libtayo® é indicado para o tratamento de pacientes com carcinoma2 cutâneo3 de células4 escamosas metastático ou pacientes com carcinoma2 cutâneo3 de células4 escamosas localmente avançado que não são candidatos a cirurgia ou radioterapia5 curativas.
Carcinoma2 basocelular (CBC)
Libtayo® é indicado para o tratamento de pacientes com carcinoma2 basocelular (CBC) localmente avançado ou metastático previamente tratado com inibidor da via Hedgehog ou para os quais um inibidor da via Hedgehog não é adequado.
RESULTADOS DE EFICÁCIA
Carcinoma2 cutâneo3 de células4 escamosas (CEC)
A eficácia e segurança de Libtayo® em pacientes com carcinoma2 cutâneo3 de células4 escamosas (também denominado Carcinoma2 Espinocelular - CEC) metastático (nodal ou distante) ou carcinoma2 cutâneo3 de células4 escamosas (CEC) localmente avançado que não eram candidatos a cirurgia foram estudadas em um estudo clínico prospectivos, Estudo 1540. O estudo 1540 foi um estudo fase II, multicêntrico, aberto que incluiu 193 pacientes com CEC metastático ou CEC localmente avançado no momento do corte de dados em 30 de junho de 2018, com um tempo médio de acompanhamento de 7,4 meses.
Dados de eficácia de suporte foram obtidos em um estudo fase I, multicêntrico, aberto (Estudo 1423) em pacientes com tumores sólidos, dentre os quais os pacientes com CEC (n = 26) que se enquadraram na definição de CEC avançado utilizado no estudo pivotal (corte de dados em 30 de junho de 2018). Com uma duração média de acompanhamento de 13,3 meses (intervalo: 1,1-21,0 meses), a taxa de resposta objetiva (TRO) confirmada por revisão central independente foi de 50% (13 respostas de 26 pacientes) e o Intervalo de Confiança de 95% foi de 29,9-70,1%. A duração mediana estimada da resposta foi de 20,3 meses e a variação observada foi de 1,0 a 20,3 meses. A duração da resposta foi ≥ 6 meses para 84,6% dos pacientes (11 dos 13 respondedores).
Ambos os estudos excluíram pacientes com doença autoimune6 que necessitaram de terapia sistêmica com agentes imunossupressores dentro de 5 anos; história de transplante de órgão sólido; história de pneumonite7 dentro de 5 anos, tratamento prévio com anti-PD-1 / PD-L1 ou outra terapia inibidora de checkpoints imunológicos; infecção8 por HIV9, hepatite10 B ou hepatite10 C; metástase11 cerebral ou escore de desempenho ECOG ≥ 2.
No Estudo 1540, os pacientes receberam Libtayo® até progressão inequívoca da doença, toxicidade12 inaceitável ou conclusão do tratamento planejado (3 mg/kg a cada 2 semanas durante 96 semanas ou 350 mg a cada 3 semanas durante 54 semanas). Os pacientes poderiam continuar o tratamento além da progressão inicial, a critério do investigador. Se os pacientes com doença localmente avançada apresentassem resposta suficiente ao tratamento, a cirurgia com intenção curativa era permitida. As avaliações da resposta tumoral foram realizadas a cada 8 ou 9 semanas (para pacientes13 que receberam 3 mg/kg a cada 2 semanas ou 350 mg a cada 3 semanas, respectivamente). O desfecho primário do Estudo 1540 foi confirmado - taxa de resposta objetiva (TRO), conforme avaliado por revisão central independente (RCI). Para pacientes13 com CEC metastático sem lesões14 alvo visíveis externamente, a TRO foi determinada pelos Critérios de Avaliação de Resposta em Tumores Sólidos (RECIST 1.1). Para pacientes13 com lesões14 alvo externamente visíveis (CEC localmente avançado e CEC metastático), a TRO foi determinada por um endpoint composto que integrou as avaliações de RCI de dados radiológicos (RECIST 1.1) e fotografia médica digital (critérios da OMS). O desfecho secundário principal foi a duração da resposta (DR). Outros desfechos secundários foram sobrevida15 livre de progressão (SLP), sobrevida15 global (SG), taxa de resposta completa (TRC) e mudança nas pontuações nos resultados relatados pelos pacientes no Questionário de Qualidade de Vida da Organização Europeia de Pesquisa e Tratamento do Câncer16 (EORTC).
Os resultados são apresentados dos 167 pacientes do Estudo 1540. Destes 167 pacientes, 103 eram CEC metastático e 64 eram CEC localmente avançado com uma idade média de 72 anos (variação: 38 a 96). Sessenta e cinco (38,9%) pacientes tinham 75 anos ou mais, 60 pacientes (35,9%) tinham de 65 a menos de 75 anos, e 42 pacientes (25,1%) tinham menos de 65 anos. Um total de 139 (83,2%) pacientes eram do sexo masculino e 162 (97%) eram brancos; o escore de desempenho do ECOG foi 0 (46,1%) ou 1 (53,9%). Trinta e seis e meio por cento (36,5%) dos pacientes havia recebido pelo menos uma terapia sistêmica anticâncer anterior, 91% dos pacientes haviam recebido cirurgia prévia relacionada ao câncer16 e 69,5% dos pacientes haviam recebido radioterapia5 prévia. Entre os pacientes com CEC metastático, 75,7% tinham metástases17 à distância e 23,3% tinham apenas metástases17 nodais.
Os resultados de eficácia do Estudo 1540 estão apresentados na Tabela 1 e Figura 1.
Tabela 1. Resultados de eficácia (Estudo 1540) - CEC metastático, CEC localmente avançado e CEC combinado.
|
Desfechos de Eficáciaa |
CEC |
CEC |
CEC |
|
Taxa de Resposta Objetiva Confirmada (TRO) |
|||
|
TRO % |
44,7% |
45,3% |
44,9% |
|
95% IC |
(34,9; 54,8) |
(32,8; 58,3) |
(37,2; 52,8) |
|
Taxa de Resposta Completa (TRC)b |
8,7% |
10,9% |
9,6% |
|
Taxa de Resposta Parcial (TRP) |
35,9% |
34,4% |
35,3% |
|
Duração da Resposta (DR)c |
|||
|
Média (meses) |
NA |
NA |
NA |
|
Variação (meses) |
2,1 – 20,7+ |
1.9 – 22.4+ |
1.9 – 22.4+ |
|
Pacientes com DR ≥ 6 meses, % |
69,6% |
62,1% |
66,7% |
|
Tempo de Resposta (meses) |
|||
|
Média |
2,0 |
2,1 |
2,0 |
|
Extensão (meses) |
(1,7; 9,1) |
(1,8; 8,8) |
(1,7; 9,1) |
|
Taxa de Controle de Duração de Doenças (TCDD) em 16 semanas |
|||
|
TCDD % |
59,2% |
59,4% |
59,3% |
|
(95% IC) |
(49,1; 68,8) |
(46,4;71,5) |
(51,4; 66,8) |
IC: intervalo de confiança; NA: não alcançado; +: indica em andamento na última avaliação com 3 ou mais avaliações
a Inclui apenas pacientes com cicatrização completa do comprometimento cutâneo3 prévio; pacientes com CEC localmente avançado no Estudo 1540 necessitaram de biópsia18 para confirmar a resposta completa.
b Nos grupos metastático e localmente avançado, a duração média de acompanhamento foi de 9,0 e 8,8 meses, respectivamente.
Figura 1: Alteração percentual da lesão19 alvo da linha de base*
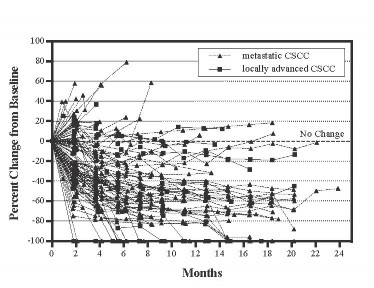
* Baseado nos critérios RECIST 1.1 ou OMS, cada linha representa a mudança individual do paciente na lesão19 alvo em 87 dos 108 pacientes que tiveram pelo menos uma avaliação tumoral avaliável.
Carcinoma2 basocelular (CBC)
A eficácia e a segurança de Libtayo® em pacientes com carcinoma2 basocelular (CBC) avançado (localmente avançado irressecável (CBCla) ou metastático (nodal ou distante) (CBCm)) que progrediram durante a terapia com inibidor da via Hedgehog (HHI), foram intolerantes à terapia prévia com HHI, ou não apresentaram melhora além da doença estável (DE) após 9 meses sob terapia com HHI (exclusivo das pausas de tratamento), foram avaliadas no Estudo 1620, um estudo aberto, multicêntrico, não randomizado20. O estudo excluiu pacientes com doença autoimune6 que necessitaram de terapia sistêmica com agentes imunossupressores dentro de 5 anos; histórico de transplante de órgãos sólidos; tratamento prévio com terapia anti-PD-1/PD-L1 ou outra terapia com inibidor de checkpoint imunológico; infecção8 por HIV9, hepatite10 B ou hepatite10 C; ou escore de desempenho ECOG (PS) ≥ 2.
Os pacientes receberam Libtayo® 350 mg por via intravenosa (IV) a cada 3 semanas por 5 ciclos de 9 semanas seguidos por 4 ciclos de 12 semanas até 93 semanas de tratamento. O tratamento continuou até a progressão da doença, toxicidade12 inaceitável ou conclusão do tratamento planejado. As avaliações tumorais foram realizadas a cada 9 semanas durante os ciclos 1 a 5 e a cada 12 semanas durante os ciclos de 6 a 9. Os principais desfechos de eficácia foram a taxa de resposta objetiva confirmada (TRO) e duração da resposta (DR) avaliadas por revisão central independente (RCI). Os desfechos de eficácia secundários incluíram TRO e DR pela avaliação do investigador (AI), sobrevida15 livre de progressão (SLP), sobrevida15 global (SG), resposta completa (RC) pela RCI, tempo de resposta tumoral (TRT), taxa de controle de doença (TCD) , TCD durável pela RCI, escore EORTC QLQ-C30 e Skindex-16. Para os pacientes com CBCm sem lesões14 alvo visíveis externamente, a TRO foi determinada pelos Critérios de Avaliação de Resposta em Tumores Sólidos (RECIST 1.1). Para os pacientes com lesões14 alvo visíveis externamente (CBCla e CBCm), a TRO foi determinada por um desfecho composto que integrava as avaliações de dados radiológicos (RECIST 1.1) e fotografia médica digital (critérios da OMS) pela RCI.
Um total de 112 pacientes com CBC avançado foi incluído na análise de eficácia do Estudo 1620. Destes, 25% tinham CBCm e 75% tinham CBCla. Consulte a Tabela 2 para obter um resumo das características basais do paciente e da doença.
|
|
CBCm |
CBCIa |
CBC avançado |
|
CARACTERÍSTICAS DO PACIENTE |
|||
|
Idade mediana anos |
65,5 |
70,0 |
68,0 |
|
< 65 |
13 (46%) |
31 (37%) |
44 (39%) |
|
≥ 65 |
15 (54%) |
53 (63%) |
68 (61%) |
|
Gênero: Masculino |
23 (82%) |
56 (67%) |
79 (71%) |
|
Raça: Branca |
22 (79%) |
57 (68%) |
79 (71%) |
|
Situação de desempenho ECOG |
|||
|
0 |
16 (57%) |
51 (61%) |
67 (60%) |
|
1 |
12 (43%) |
33 (39%) |
45 (40%) |
|
TRATAMENTOS ANTERIORES |
|||
|
Cirurgia anterior relacionada ao câncer16 |
|||
|
Pacientes com pelo menos 1 cirurgia anterior relacionada ao câncer16, n (%) |
23 (82%) |
70 (83%) |
93 (83%) |
|
Pacientes com > 3 cirurgias anteriores relacionadas ao câncer16, n (%) |
11 (39%) |
29 (35%) |
40 (36%) |
|
Número mediano de cirurgias anteriores relacionadas ao câncer16 (intervalo) |
3,0 |
3,0 |
3 |
|
Radioterapia5 anticâncer anterior |
|||
|
Pacientes com pelo menos 1 radioterapia5 anticâncer anterior, n (%) |
17 (61%) |
42 (50%) |
59 (53%) |
|
Número mediano de regimes de radioterapia5 anticâncer anterior (Intervalo) |
1,0 |
1,0 |
1,0 |
|
Tratamento anterior com um HHIa |
28 (100%) |
84 (100%) |
112 (100%) |
|
Tratamento anterior com vismodegibe e sonidegibe (como linhas de terapia separadas), n (%) |
3 (11%) |
9 (11%) |
12 (11%) |
|
Motivo para descontinuação do HHI |
|||
|
Progressão da doença/falta de respostab, n (%) |
26 (93%) |
63 (75%) |
89 (80%)c |
|
Intolerância à terapia com HHI, n (%) |
2 (7%) |
21 (25%) |
23 (21%) |
a Soma superior a 100% pois alguns pacientes foram transferidos de um HHI para outro
b A falta de resposta foi definida como não melhor do que doença estável após 9 meses de terapia com HHI
c Oito de 89 (9%) pacientes tiveram falta de resposta
O tempo médio para resposta foi de 3,2 meses (intervalo de 2,1 a 10,5 meses) para o grupo de CBCm, 4,2 meses (intervalo: 2,1 a 13,4 meses) para o grupo de CBCla, e de 4,2 meses no geral (intervalo: 2,1 a 13,4 meses).
Trinta e dois pacientes (28,6%) com CBC avançado tiveram resposta completa (RC) ou resposta parcial (RP).
Os desfechos de TRO e SLP pela avaliação do investigador (IA) foram consistentes com os resultados da revisão central independente (ICR). As taxas de resposta foram semelhantes, independentemente do motivo para a descontinuação da terapia prévia com HHI.
Os resultados de eficácia estão apresentados na Tabela 3.
|
Desfechos de eficácia |
CBC metastático Libtayo® 350 mg a cada 3 semanas |
CBC localmente avançado Libtayo® 350 mg a cada 3 semanas |
CBC avançado |
|
N=28 |
N=84 |
N=112 |
|
|
RCI |
RCI |
RCI |
|
|
Melhor Resposta Global (BOR)a |
|||
|
Taxa de resposta objetiva (TRO: RC + RP) (95% CI) |
6 (21,4%) |
26 (31,0%)b |
32 (28,6%)b |
|
Taxa de resposta completa (RC)c (IC 95%) |
0% |
5 (6,0%) |
5 (4,5%) |
|
Taxa de resposta parcial (RP) (IC 95%) |
6 (21,4%) |
21 (25,0%) |
27 (24,1%) |
|
Taxa de doença estável (DE) |
10 (35,7%) |
41 (48,8%) |
51 (45,5%) |
|
Taxa de progressão da doença (PD) |
7 (25,0%) |
9 (10,7%) |
16 (14,3%) |
|
Duração da resposta (DR) |
|||
|
Medianad (meses) (IC 95%) |
NR |
NR |
NR |
|
Intervalo (observado) (meses) |
9,0 - 23,0+ |
2,1 - 21,4+ |
2,1 - 23,0+ |
|
Pacientes com DR > 6 meses, % |
100% |
90,9% |
92,9% |
|
Tempo até a resposta (TTR) |
|||
|
Mediana (meses) |
3,2 |
4,2 |
4,2 |
|
Sobrevida15 livre de progressãod |
|||
|
6 meses |
58,1% |
76,3% |
71,7% |
|
Sobrevida15 gerald, e |
|||
|
12 meses |
92,6% |
92,3% |
92,3% |
|
Taxa de controle da doença (TCD) e TCD durável |
|||
|
TCDf n, % |
19 (67,9%) |
67 (79,8%) |
86 (76,8%) |
|
TCD durávelg n, % |
13 (46,4%) |
50 (59,5%) |
63 (56,3%) |
|
Duração mediana do |
9,5 |
15,1 |
13,3 |
ICR: Revisão Central Independente; IC: intervalo de confiança; NR: Não alcançado; NE: não avaliável; +: Denota em andamento na última avaliação
a Pacientes não avaliáveis e sem RC/sem PD não são apresentados nos resultados de BOR.
b Inclui 2 pacientes que alcançaram RP antes da corte de dados; avaliações confirmatórias foram obtidas após o ponto de corte dos dados.
c Os pacientes com CBC localmente avançado no Estudo 1620 necessitaram de biópsia18 para confirmar a resposta completa.
d Com base nas estimativas de Kaplan Meier.
e A SG não exige revisão central.
f TCD: proporção de pacientes com RC, RP, DE ou sem RC/sem PD na primeira avaliação tumoral avaliável ocorrendo não antes do Dia 56.
g TCD durável: proporção de pacientes com RC, RP, DE ou sem RP/sem PD por pelo menos 182 dias sem DP.
Situação de eficácia e PD-L1
A atividade clínica foi observada independentemente do estado de expressão da PD-L1 tumoral.
CARACTERÍSTICAS FARMACOLÓGICAS
Propriedades farmacodinâmicas
Agente antineoplásico. Anticorpo21 monoclonal.
O cemiplimabe é um anticorpo21 monoclonal recombinante humano imunoglobulina22 G4 (IgG4) que se liga à PD-1 e bloqueia sua interação com PD-L1 e PD-L2, contrariando a inibição mediada pela PD-1 da resposta imune, incluindo a resposta imune antitumoral. Em modelos de tumor23 de ratos singênicos o bloqueio da atividade de PD-1 resultou na diminuição do crescimento do tumor23.
A ligação de PD-L1 e PD-L2, à PD-1 nas células4 T, inibe a proliferação de células4 T e a produção de citocinas24. Esta via pode contribuir para a inibição da vigilância imune ativa das células4 T dos tumores.
O cemiplimabe é produzido por tecnologia de DNA recombinante em cultura de suspensão de células4 de ovário25 de hamster chinês (CHO).
A maioria dos pacientes com CEC que recebeu cemiplimabe teve redução das lesões14 alvo, com relação ao valor basal de 20 a 100%.
Propriedades farmacocinéticas
Os dados de concentrações foram combinados em uma análise farmacocinética da população em 1062 pacientes com vários tumores sólidos, que receberam o cemiplimabe. Nos regimes de dosagem de 1 mg/kg a 10mg/kg a cada 2 semanas e incluindo 350 mg a cada 3 semanas, a farmacocinética do cemiplimabe foi linear e proporcional à dose, sugerindo saturação da via mediada pelo alvo durante o intervalo de dosagem.
Com 350 mg a cada 3 semanas, os valores da concentração mediana do cemiplimabe no estado de equilíbrio variou entre Cmáx de 171 mg/L e Cvale de 61 mg/L. A exposição no estado de equilíbrio é alcançada após aproximadamente 4 meses de tratamento.
Em pacientes com CEC, a exposição ao cemiplimabe no estado de equilíbrio com as doses 350 mg a cada 3 semanas (Q3W) (N = 53) e a 3 mg / kg a cada 2 semanas (Q2W) (N = 135) é semelhante.
Distribuição: O cemiplimabe é distribuído principalmente no sistema vascular26 com um volume de distribuição no estado estacionário de 5,3 L.
Eliminação: A depuração do cemiplimabe é linear nas doses de 1 mg/kg a 10 mg/kg a cada duas semanas. A depuração de cemiplimabe após a primeira dose é de aproximadamente 0,29L/dia. A depuração total de cemiplimabe parece diminuir em aproximadamente 29% ao longo do tempo, resultando em uma depuração no estado de equilíbrio (CLSS) de 0,20L/dia; a diminuição do CL não é considerada clinicamente relevante. A meia-vida do intervalo de dosagem no estado de equilíbrio é de 20,3 dias.
Populações especiais
Uma análise farmacocinética populacional sugere que os seguintes fatores não têm efeito clinicamente significativo na exposição do cemiplimabe: idade, sexo, peso corporal, raça, tipo de câncer16, carga tumoral, nível de albumina27, insuficiência renal28 e insuficiência hepática29 leve a moderada.
Uso geriátrico: Nenhuma diferença geral de segurança ou eficácia foi observada entre pacientes idosos e pacientes mais jovens.
Dos 455 pacientes tratados com Libtayo® em monoterapia nos estudos clínicos, 37,8% (172/455) tinham menos de 65 anos, 29,7% (135/455) tinham de 65 a menos de 75 anos e 32,5% (148/455) tinham 75 anos ou mais. Eventos adversos de Grau ≥ 3 ocorreram em 42,2% (57/135) dos pacientes de 65 a menos de 75 anos e 54,1% (80/148) dos pacientes de 75 anos ou mais.
Nos 167 pacientes com CEC avançado avaliados para eficácia, a taxa de resposta objetiva (95% IC) foi de 42,9% (27,7%, 59%) em pacientes com menos de 65 anos, 48,3% (35,2%, 61,6%) em pacientes que tinham de 65 a menos de 75 anos, e 43,1% (30,8%, 56,0%) em pacientes com 75 anos ou mais.
Nos 112 pacientes com CBC avançado na análise de eficácia, a taxa de resposta objetiva (TRO) por Revisão Central Independente (RCI) (IC de 95%) foi de 29,5% (16,8, 45,2) em 44 de 112 pacientes com menos de 65 anos, 21,4% (8,3, 41,0) em 28 de 112 pacientes de 65 a menos de 75 anos, e 27,5% (14,6, 43,9) em 40 de 112 pacientes de 75 anos ou mais.
Insuficiência renal28: O efeito do comprometimento renal30 sobre a exposição de Libtayo® foi avaliado por uma análise farmacocinética populacional em pacientes com insuficiência renal28 leve (CLcr 60 a 89 ml / min; n = 396), moderada (CLcr 30 a 59 ml / min; n = 166), ou severa (CLcr 15 a 29 mL / min; n = 7). Não foram encontradas diferenças clinicamente importantes na exposição de Libtayo® entre pacientes com insuficiência renal28 e pacientes com função renal30 normal.
Insuficiência hepática29: O efeito do comprometimento hepático na exposição de Libtayo® foi avaliado pela análise farmacocinética populacional em pacientes com insuficiência hepática29 leve (n=22) (bilirrubina31 total [BT] superior a 1,0 a 1,5 vezes o limite superior normal [LSN] e qualquer AST) e pacientes com insuficiência hepática29 moderada (n = 3) (bilirrubina31 total > 1,5 vezes LSN até 3,0 vezes LSN) e qualquer AST e não foram encontradas diferenças clinicamente importantes na exposição de Libtayo® entre pacientes com insuficiência hepática29 leve a moderada e pacientes com função hepática32 normal. Libtayo® não foi estudado em pacientes com insuficiência hepática29 severa.
Dados de segurança pré-clínica
Toxicologia Animal e / ou Farmacologia33
A segurança do cemiplimabe foi avaliada em estudos de toxicidade12 de dose repetida de 1 mês e 6 meses em macacos cynomolgus. O nível de efeito adverso não observado (NOAEL) foi a dose mais elevada administrada nestes estudos (50 mg / kg / semana).
Em modelos animais, a inibição da sinalização PD-L1/PD-1 aumentou a severidade de algumas infecções34 e aumentou as respostas inflamatórias. Camundongos knockout de PD-1 infectados com M. tuberculosis exibiram acentuada diminuição da sobrevida15 em comparação com controles do tipo selvagem, que se correlacionaram com o aumento da proliferação bacteriana e respostas inflamatórias nestes animais. Camundongos e camundongos knockout para PD-L1 e PD-1 que receberam anticorpo21 bloqueador de PD-L1 também mostraram diminuição da sobrevida15 após infecção8 pelo vírus35 da coriomeningite linfocítica.
Carcinogênese, mutagênese, prejuízo da fertilidade
Nenhum estudo foi realizado para testar o potencial do cemiplimabe quanto à carcinogenicidade ou genotoxicidade.
Em um estudo de avaliação de fertilidade de dose repetida de 3 meses com macacos cynomolgus sexualmente maduros na dose mais elevada testada (50 mg / kg / semana), não foram observados efeitos relacionados com o cemiplimabe nos parâmetros de avaliação da fertilidade (ciclo menstrual, análise de sémen ou medidas testiculares) ou em órgãos reprodutivos masculinos ou femininos.
Teratogenicidade
Estudos de reprodução36 animal não foram realizados com o cemiplimabe.
CONTRAINDICAÇÕES
Este medicamento é contraindicado em pacientes com hipersensibilidade ao cemiplimabe ou a qualquer excipiente da formulação.
ADVERTÊNCIAS E PRECAUÇÕES
Reações adversas graves e fatais relacionadas à imunidade37
Libtayo® é um anticorpo21 monoclonal pertencente a uma classe de fármacos que se liga ao receptor de morte programada 1 (PD-1), e bloqueia sua interação com PD-1/PD-L1, removendo assim a inibição da resposta imune com o potencial de quebra da tolerância periférica e indução de reações adversas relacionadas ao sistema imunológico38. As reações adversas importantes relacionadas com o sistema imunológico38 listadas nesta seção podem não incluir todas as possíveis reações
relacionadas ao sistema imunológico38. As reações adversas relacionadas com a imunidade37, que podem ser graves ou fatais, podem ocorrer em qualquer sistema de órgãos ou tecido39. Embora as reações adversas relacionadas com o sistema imunológico38 se manifestem habitualmente durante o tratamento com anticorpos40 bloqueadores de PD-1/PD-L1, as reações adversas relacionadas com o sistema imunológico38 também podem manifestar-se após a descontinuação dos anticorpos40 bloqueadores de PD-1/PD-L1. A identificação e o gerenciamento precoces são essenciais para garantir o uso seguro de anticorpos40 bloqueadores de PD-1/PD-L1. Os sinais41 e sintomas42 das reações adversas relacionadas com a imunidade37 devem ser monitorados. Avaliar as análises clínicas, incluindo testes no fígado43 e testes de função da tireoide44, no início e periodicamente durante o tratamento. Instituir a gestão médica prontamente para incluir consultas especializadas, conforme apropriado. No geral, suspender Libtayo® nos casos de reações adversas relacionadas à imunidade37 Graus 3 e 4 e alguns Grau 2. Descontinuar Libtayo® permanentemente nos casos de reações adversas relacionadas à imunidade37 Grau 4 e alguns Grau 3 (vide Posologia e Modo de Usar). Para reações adversas relacionadas à imunidade37 de Grau 3 ou 4 e certas reações adversas de Grau 2, administrar corticosteroides (1 a 2 mg/kg/dia de prednisona ou equivalente) ou outro tratamento adequado até melhora para Grau 1 ou inferior, seguida da redução do corticosteroide durante um mês (vide Posologia e Modo de Usar). Considerar a administração de outros imunossupressores sistêmicos45 em pacientes cuja reação adversa relacionada ao sistema imunológico38 não é controlada com corticosteroides. Instituir terapia de reposição hormonal para endocrinopatias46 conforme necessário.
Pneumonite7 relacionada à imunidade37
A pneumonite7 relacionada à imunidade37, definida como requerendo o uso de corticosteroides sem etiologia47 alternativa clara, incluindo casos fatais, foi observada em pacientes que receberam Libtayo® (vide item Reações Adversas). Monitorar os pacientes em busca de sinais41 e sintomas42 de pneumonite7. Avaliar pacientes com suspeita de pneumonite7 com imagem radiográfica e controlar com modificações de tratamento e corticosteroides. Administrar corticosteroides na dose inicial de 1 a 2 mg/kg/dia (Grau 2) ou 2 a 4 mg/kg/dia (Grau 3 ou superior ou Grau 2 moderado recorrente) com prednisona ou equivalente, seguido de redução gradual de corticosteroide. Suspender Libtayo® para pneumonite7 moderada (Grau 2). Retomar Libtayo® se a pneumonite7 melhorar e permanecer no grau 0-1 após redução gradual de corticosteroide para menos de 10 mg/dia de prednisona ou equivalente. Interromper permanentemente para pneumonite7 grave (Grau 3), com risco de vida (Grau 4) ou recorrente moderada (Grau 2) (vide item Posologia e modo de usar).
Pneumonite7 relacionada à imunidade37 ocorreu em 18(4,0%) dos 455 pacientes que receberam Libtayo®, incluindo 2 (0,4%) pacientes com grau 4, e 4 (0,9%) pacientes com pneumonite7 grau 3. A pneumonite7 relacionada à imunidade37 levou à descontinuação permanente de Libtayo® em 7 (1,5%) de 455 pacientes. Entre os 18 pacientes com pneumonite7 relacionada ao sistema imunológico38, o tempo médio de início foi de 3,2 meses (variação de 7 dias a 18 meses) e a duração média da pneumonite7 foi de 18 dias (variação de 5 dias a 6,5meses). Catorze dos 18 pacientes (77,8%) receberam altas doses de corticosteroides por uma média de 9 dias (intervalo: 1 dia a 5,9 meses). Resolução de pneumonite7 ocorreu em 12 (66,7%) dos 18 pacientes no momento do corte de dados.
Colite48 relacionada à imunidade37
Diarreia49 ou colite48 relacionada à imunidade37, definida como requerendo o uso de corticosteroides sem etiologia47 alternativa clara, foi observada em pacientes que receberam Libtayo® (vide item Reações Adversas). Monitorar os pacientes em busca de sinais41 e sintomas42 de diarreia49 ou colite48 e controlar com modificações de tratamento, agentes antidiarreicos e corticosteroides. Administrar corticosteroides em uma dose inicial de 1 a 2 mg/kg /dia de prednisona ou equivalente, seguido por uma redução gradual do corticosteroide para diarreia49 ou colite48 de grau 2 ou maior. Suspender Libtayo® para diarreia49 ou colite48 moderada ou severa (Grau 2 ou 3) até a resolução. Retomar Libtayo® se a diarreia49 ou colite48 melhorarem e permanecerem no grau 0 a 1 após redução gradual de corticosteroide para menos de 10 mg/dia de prednisona ou equivalente. Descontinue permanentemente Libtayo® para diarreia49 severa ou com risco de vida (Grau 4) ou para diarreia49 ou colite48 severa recorrente (Grau 3) (vide item Posologia e modo de usar).
Diarreia49 ou colite48 relacionada a imunidade37 ocorreu em 14 (3,1%) dos 455 pacientes que receberam Libtayo® incluindo 6 (1,3%) com diarreia49 ou colite48 relacionada à imunidade37 de Grau 3. A diarreia49 ou colite48 relacionada à imunidade37 levou à descontinuação permanente de Libtayo® em 3 (0,7%) dos 455 pacientes. Entre os 14 pacientes com diarreia49 ou colite48 relacionada ao sistema imunológico38, o tempo médio de início foi de 3,9 meses (variação de 21 dias a 15,5 meses) e a duração média de diarreia49 ou colite48 relacionada ao sistema imunológico38 foi de 2,1 meses (variação de 6 dias a 10,0 meses). Dez pacientes (71,4%) com diarreia49 ou colite48 relacionada ao sistema imunológico38 receberam altas doses de corticosteroides por uma média de 25 dias (variação de 5 dias a 5,2 meses). A resolução de diarreia49 ou colite48 relacionada ao sistema imunológico38 ocorreu em 5 (35,7%) dos 14 pacientes no momento do corte dos dados.
Hepatite10 autoimune6 ou imunomediada
Hepatite10 autoimune6 ou imunomediada, definida como requerendo o uso de corticosteroides sem etiologia47 alternativa clara, incluindo casos fatais, foi observada em pacientes que receberam Libtayo® (vide item Reações Adversas). Monitorar os pacientes quanto a testes hepáticos anormais antes e periodicamente durante o tratamento, e controlar com as modificações do tratamento e corticosteroides. Administrar corticosteroides em uma dose inicial de 1 a 2 mg/kg /dia de prednisona ou equivalente, seguido por uma redução gradual de corticosteroides para Grau 2 (AST ou ALT> 3 e ≤ 5 x LSN ou bilirrubina31 total > 1,5 e ≤ 3 x LSN) ou hepatite10 maior. Suspender Libtayo® para hepatite10 moderada (Grau 2) até a resolução. Retomar Libtayo® se a hepatite10 melhorar e permanecer entre 0 e 1 grau após redução gradual de corticosteroide para menos de 10 mg/dia de prednisona ou equivalente, ou se AST ou ALT retornar à linha basal após o término da redução de corticosteroide. Descontinuar permanentemente para hepatite10 severa (Grau 3 com AST ou ALT > 5 x LSN ou bilirrubina31 total > 3 x LSN) ou com risco de vida (Grau 4) (vide item Posologia e modo de usar).
A hepatite10 autoimune6 ou imunomediada ocorreu em 10 (2,2%) dos 455 pacientes que receberam Libtayo® incluindo 1 (0,2%) paciente com Grau 5 e 7 (1,5%) pacientes com hepatite10 autoimune6 ou imunomediada Grau 3. A hepatite10 autoimune6 ou imunomediada levou à descontinuação permanente de Libtayo® em 6 (1,3%) dos 455 pacientes. Entre os 10 pacientes com hepatite10 autoimune6 ou imunomediada, o tempo médio de início foi de 2,3 meses (variação de 7 dias a 4,2 meses) e a média de duração da hepatite10 foi de 19 dias (variação de 10 dias a 7,6 meses). Nove (90,0%) pacientes com hepatite10 autoimune6 ou imunomediada receberam altas doses de corticosteroides por uma média de 16 dias (variação de 6 dias a 3,1 meses). A resolução da hepatite10 ocorreu em 8 (80,0%) dos 10 pacientes no momento do corte dos dados.
Endocrinopatias46 autoimunes50 ou imunomediadas
Endocrinopatias46 autoimunes50 ou imunomediadas foram observadas em pacientes que receberam Libtayo® (vide item Reações Adversas).
Distúrbios da tireoide44 (hipotireoidismo51/hipertireoidismo52/tireoidite)
Distúrbios da tireoide44 autoimunes50 ou imunomediadas foram observados em pacientes que receberam Libtayo®. Tireoidite pode ocorrer com ou sem alteração nos testes de função tireoidiana. O hipotireoidismo51 pode ocorrer após o hipertireoidismo52. Os distúrbios da tireoide44 podem ocorrer a qualquer momento durante o tratamento. Monitorar os pacientes quanto a alterações na função tireoidiana no início do tratamento, periodicamente durante o tratamento e conforme indicado com base na avaliação clínica. Controlar os pacientes com terapia de reposição hormonal (se indicado) e modificações de tratamento. Inicie o tratamento médico para o controle do hipertireoidismo52. Suspender Libtayo® para distúrbios da tireoide44 severos (Grau 3) ou com risco de vida (Grau 4). Retomar Libtayo® quando os distúrbios da tireoide44 retornarem ao Grau 0 a 1 ou se estiver clinicamente estável (vide item Posologia e modo de usar).
Hipotireoidismo51
Hipotireoidismo51 ocorreu em 40 (8,8%) dos 455 pacientes que receberam Libtayo®. Um (0,2%) dos 455 pacientes interromperam Libtayo® devido a hipotireoidismo51. Entre os 40 pacientes com hipotireoidismo51 autoimune6 ou imunomediado, a média do tempo até o início foi de 4,2 meses (variação: 15 dias a 18,9 meses) com uma duração média de 8,5 meses (variação: 1 dia a 23,3 meses). A resolução do hipotireoidismo51 havia ocorrido em 4 (10,0%) dos 40 pacientes no momento do corte dos dados.
Hipertireoidismo52
Hipertireoidismo52 ocorreu em 11 (2,4%) dos 455 pacientes que receberam Libtayo®, incluindo 2 (0,4%) pacientes com hipertireoidismo52 Grau 2. Nenhum paciente interrompeu Libtayo® devido ao hipertireoidismo52. Entre os 11 pacientes com hipertireoidismo52, o tempo médio de início foi de 1,9 meses (variação: 20 dias a 14,8 meses) e a duração média foi de 1,9 meses (variação: 15 dias a 24,5 meses). A resolução do hipertireoidismo52 ocorreu em 6 (54,5%) dos 11 pacientes no momento do corte dos dados.
A tireoidite ocorreu em 3 (0,7%) de 455 pacientes que receberam Libtayo®, incluindo 1 (0,2%) pacientes com tireoidite de Grau 2. Nenhum paciente interrompeu o tratamento com Libtayo® devido à tireoidite. A resolução da tireoidite não havia ocorrido em nenhum paciente no momento do corte dos dados.
Hipofisite
A hipofisite autoimune6 ou imunomediada foi observada em pacientes que receberam Libtayo®. Monitorar os pacientes quanto a sinais41 e sintomas42 de hipofisite e controlar com modificações do tratamento, corticosteroides na dose inicial de 1 a 2 mg/kg/dia de prednisona ou equivalente, seguidos de redução gradual de corticosteroides e reposição hormonal, conforme indicado clinicamente. Suspender Libtayo® para moderada (Grau 2), severa (Grau 3) ou com risco de vida (Grau 4). Retomar Libtayo® se a hipofisite melhorar e permanecer no grau 0 a 1 após redução gradual de corticosteroide para menos de 10 mg/dia de prednisona ou equivalente ou se estiver clinicamente estável (vide item Posologia e modo de usar).
A hipofisite autoimune6 ou imunomediada ocorreu em 2 (0,4%) dos 455 pacientes que receberam Libtayo®, ambos pacientes com hipofisite Grau 3. Um (0,2%) dos 455 pacientes interrompeu Libtayo® devido à hipofisite. Entre os 2 pacientes com hipofisite, o tempo médio de início foi de 6,0 meses (variação: 4,6meses a 7,4 meses) com uma duração mediana de 28 dias (variação: 9 dias a 1,5 meses). Ambos os pacientes (100%) foram tratados com corticosteroides. A hipofisite não havia sido resolvida em nenhum paciente no momento do corte de dados.
Insuficiência53 Adrenal
Insuficiência53 adrenal tem sido observada em pacientes que recebem Libtayo®. Monitorar os pacientes quanto a sinais41 e sintomas42 de insuficiência53 adrenal durante e após o tratamento e administrar com modificações de tratamento, corticosteroides na dose inicial de 1 a 2 mg/kg /dia de prednisona ou equivalente, seguidos de redução gradual de corticosteroides e reposição hormonal, conforme indicação clínica. Suspender Libtayo® para moderada (Grau 2), severa (Grau 3) ou com risco de vida (Grau 4). Retomar Libtayo® se a insuficiência53 adrenal melhorar e permanecer entre 0 e 1 grau após redução gradual de corticosteroide para menos de 10 mg/dia de prednisona ou equivalente ou se estiver clinicamente estável (vide item Posologia e modo de usar).
Insuficiência53 adrenal ocorreu em 3 (0,7%) dos 455 pacientes que receberam Libtayo®, todos pacientes com insuficiência53 adrenal Grau 3. Um (0,2%) dos 455 pacientes descontinuou Libtayo® devido a insuficiência53 adrenal. Entre os 3 pacientes com insuficiência53 adrenal, o tempo médio de início foi de 11,5 meses (variação: 4,2 meses a 18,3 meses) e a duração média foi de 5,1 meses (variação: 4,9 meses a 6,1 meses). Três dos 5 pacientes (100%) foram tratados com corticosteroides sistêmicos45. A insuficiência53 adrenal não havia sido resolvida em nenhum paciente no momento do corte de dados.
Diabetes Mellitus54 Tipo 1
Diabetes mellitus54 do tipo 1 autoimune6, incluindo cetoacidose diabética55, foi observado em pacientes que receberam Libtayo®. Monitorar os pacientes quanto a hiperglicemia56 e sinais41 e sintomas42 de diabetes57 e controle com anti- hiperglicemiantes orais ou modificações no tratamento da insulina58. Suspender Libtayo® e administrar anti- hiperglicemiantes ou insulina58 em pacientes com hiperglicemia56 severa ou com risco de vida (Grau ≥ 3). Retomar Libtayo® quando o controle metabólico é obtido com reposição de insulina58 ou anti-hiperglicêmicos (vide item Posologia e modo de usar).
Diabetes mellitus54 tipo 1 sem uma etiologia47 alternativa ocorreu em 1 (0,2%) de 455 pacientes, sendo diabetes mellitus54 tipo 1 Grau 4.
Reações adversas cutâneas59 imunomediadas
Reações adversas cutâneas59 imunomediadas, definidas como requerendo o uso de corticosteroides sem etiologia47 clara, incluindo erupção60 cutânea61, eritema multiforme62, penfigoide e síndrome de Stevens-Johnson63 (SSJ) / necrólise epidérmica tóxica64 (NET) (alguns casos com desfecho fatal) tem sido observadas (vide item Reações Adversas). Monitorar os pacientes quanto a sinais41 e sintomas42 de suspeita de reações cutâneas59 graves e excluir outras causas. Administrar pacientes com modificações de tratamento e corticosteroides em uma dose inicial de 1 a 2 mg/kg/dia de prednisona ou equivalente, seguido por uma redução gradual do corticoide para reação adversa cutânea61 Grau 2 com duração maior que 1 semana, severa (Grau 3) ou com risco de vida (Grau 4). Suspender Libtayo® para Grau 2 com duração maior que 1 semana ou reação adversa cutânea61 grave (Grau 3). Retomar se a reação adversa cutânea61 melhorar e permanecer no grau 0 a 1 após redução gradual de corticosteroide para menos de 10 mg/dia de prednisona ou equivalente. Para sintomas42 ou sinais41 de SSJ ou NET, suspender Libtayo® e encaminhar o paciente para atendimento especializado para avaliação e tratamento. Descontinuar permanentemente Libtayo® para reação adversa cutânea61 com risco de vida (Grau 4) ou se SJS ou NET for confirmado (vide item Posologia e modo de usar).
Casos de SSJ/NET/estomatite65, incluindo NET fatal, ocorreram após 1 dose de Libtayo® em pacientes com exposição prévia ao idelalisibe, que participavam de um ensaio clínico avaliando Libtayo® no Linfoma66 Não-Hodgkin (LNH) e que tiverem recente exposição a sulfa contendo antibióticos. Controle os pacientes imediatamente com modificações de tratamento e corticosteroides conforme descritos acima.
As reações adversas cutâneas59 imunitárias ocorreram em 7 (1,5%) dos 455 pacientes que receberam Libtayo® incluindo 4 (0,9%) com Grau 3. As reações adversas cutâneas59 relacionadas com a imunidade37 levaram à descontinuação permanente de Libtayo® em 1(0,2%) dos 455 pacientes. Entre os 7 pacientes com reações adversas da pele67 relacionadas ao sistema imunológico38, o tempo médio de início foi de 2,3 meses (variação de 2 dias a 17,0 meses) e a duração média foi de 2,6 meses (variação de 13 dias a 9,6 meses). Cinco pacientes (71,4%) com reações adversas cutâneas59 imunitárias receberam altas doses de corticosteroides durante uma média de 11 dias (intervalo: 7 dias a 2,6 meses). A resolução ocorreu em 5 (71,4%) dos 7 pacientes no momento do corte dos dados.
Nefrite68 imunomediada
A nefrite68 imunomediada, definida como requerendo o uso de corticosteroides sem etiologia47 alternativa clara, foi observada em pacientes que recebem Libtayo® (vide item Posologia e modo de usar). Monitorar os pacientes quanto a alterações na função renal30. Controlar os pacientes com modificações de tratamento e corticosteroides na dose inicial de 1 a 2 mg/kg/dia de prednisona ou equivalente, seguido de redução gradual de corticosteroide. Suspender Libtayo® para Grau 2. Retomar Libtayo® se a nefrite68 melhorar e permanecer na Grau 0 a 1 após redução gradual de corticosteroide para menos de 10 mg/dia de prednisona ou equivalente. Interromper permanentemente para nefrite68 severa (Grau 3) ou com risco de vida (Grau 4) (vide item Posologia e modo de usar).
A nefrite68 imunomediada ocorreu em 2 (0,4%) dos 455 pacientes que receberam Libtayo®, incluindo 2 (0,2%) pacientes com nefrite68 imunomediada de Grau 3. Nenhum paciente descontinuou Libtayo® devido a nefrite68 imunomediada. Entre os 2 pacientes com nefrite68 imunomediada, o tempo médio de início foi de 1,4 meses (variação: 29 dias a 1,8 meses) e a duração média da nefrite68 foi de 19 dias (variação de 9 dias a 29 dias). Um (50,0%) paciente com nefrite68 imunomediada recebeu altas doses de corticosteroides por 16 dias. A resolução da nefrite68 ocorreu em ambos os pacientes no momento do corte dos dados.
Outras reações adversas relacionadas à imunidade37
Foram observadas reações adversas relacionadas à imunidade37 graves e fatais com o uso de Libtayo®, incluindo encefalomielite paraneoplásica, meningite69 e miosite (vide item Reações Adversas). Essas reações relacionadas à imunidade37 podem envolver qualquer sistema orgânico. A maioria das reações relacionadas ao sistema imunológico38 se manifesta inicialmente durante o tratamento com Libtayo®, entretanto, reações adversas relacionadas ao sistema imunológico38 podem ocorrer após a descontinuação de Libtayo®.
Para suspeitas de reações adversas relacionadas ao sistema imunológico38, avaliar para confirmar uma reação adversa relacionada ao sistema imunológico38 e para excluir outras causas. Gerenciar com modificações de tratamento, terapia de reposição hormonal (se clinicamente indicado) e corticosteroides. Dependendo da gravidade da reação adversa, suspender ou descontinuar permanentemente Libtayo®, administrar corticosteroides na dose inicial de 1 a 2 mg/kg/dia de prednisona ou equivalente e, se apropriado, iniciar a terapia de reposição hormonal. Após a melhoria do Grau 1 ou menos, inicie a redução gradual de corticosteroide. Retomar o tratamento com Libtayo® se outra reação adversa relacionada ao sistema imunológico38 melhorar e permanecer no grau 0 a 1 após redução gradual de corticosteroide para menos de 10 mg/dia de prednisona ou equivalente. Descontinuar permanentemente Libtayo® para reações adversas potencialmente fatais (excluindo endocrinopatias46), ou reação adversa imune recorrente severa (Grau 3), ou reação adversa relacionada à imunidade37 persistente Grau 2 ou 3 com duração de 12 semanas ou mais (excluindo endocrinopatias46), ou incapacidade de reduzir a dose de corticosteroides para 10 mg ou menos de prednisona ou equivalente por dia dentro de 12 semanas (vide item Posologia e modo de usar).
As seguintes reações adversas clinicamente significativas, relacionadas com a imunidade37, ocorreram com uma incidência70 inferior a 1% dos 455 pacientes tratados com Libtayo® em monoterapia. Os eventos foram de grau 3 ou menor a menos que afirmado o contrário. Distúrbios do sistema nervoso71: meningite69a (Grau 4), encefalomielite paraneoplásica (Grau 5), polirradiculoneuropatia desmielinizante72 inflamatória crônica, encefalite73b, miastenia74 grave, neuropatia periférica75c. Distúrbios cardíacos: miocardite76d, pericardite77e. Distúrbios do sistema imunológico38: púrpura78 trombocitopênica imune. Distúrbios musculosqueléticos e dos tecidos conjuntivos: artralgia79, artrite80f, fraqueza muscular, mialgia81, miosite, polimialgia reumática síndrome82 de Sjögren. Distúrbios oculares: ceratite. Distúrbios gastrointestinais: estomatite65.
a inclui meningite69 e meningite asséptica83
b inclui encefalite73 e encefalite73 não infecciosa
c inclui neurite84 e neuropatia periférica75
d inclui miocardite76 autoimune6 e miocardite76
e inclui pericardite77 autoimune6 e pericardite77
f inclui artrite80 e poliartrite
As seguintes reações adversas imunes adicionais foram observadas em pacientes recebendo terapia combinada85 nos estudos clínicos: vasculite86, síndrome82 de Guillain-Barre e inflamação87 do sistema nervoso central88, cada uma com a frequência rara.
Reações Relacionadas à Infusão
Libtayo® pode causar reações graves ou potencialmente fatais relacionadas à infusão (ver item Reações Adversas). Monitorar os pacientes quanto a sinais41 e sintomas42 de reações relacionadas à infusão e controlar com modificações de tratamento e corticosteroides. Interromper ou retardar a taxa de infusão para reações relacionadas à infusão leve ou moderada. Pare a perfusão e descontinue permanentemente Libtayo® para reações graves relacionadas com a perfusão (Grau 3) ou potencialmente fatais (Grau 4) (vide item Posologia e modo de usar).
Reações relacionadas à infusão ocorreram em 38 (8,4%) dos 455 pacientes tratados com Libtayo®, não houve paciente com reação relacionada à infusão de Grau 3 e nenhum paciente descontinuou Libtayo® devido a reação relacionada à infusão. Os sintomas42 mais comuns (>0.5%) da reação relacionada à infusão foram náusea89, pirexia90, erupção60 cutanêa e dor abdominal. Todos os pacientes recuperaram-se das reações relacionadas à infusão.
Gravidez91 e Lactação92
Não existem dados disponíveis sobre a utilização de cemiplimabe em mulheres grávidas. O bloqueio da sinalização PD-1 / PD-L1 foi demonstrado em modelos murinos de gravidez91 para interromper a tolerância ao feto93 e resultar em um aumento na perda fetal. Não foram realizados estudos de reprodução36 animal com o cemiplimabe.
Sabe-se que a IgG4 humana atravessa a barreira placentária e o cemiplimabe é uma IgG4; portanto, o cemiplimabe tem o potencial de ser transmitido da mãe para o feto93 em desenvolvimento. O cemiplimabe não é recomendado durante a gravidez91 e em mulheres com potencial para engravidar que não utilizam métodos contraceptivos eficazes, a menos que o benefício clínico compense o potencial risco. Deve utilizar-se contracepção94 eficaz durante o tratamento com o cemiplimabe e durante pelo menos 4 meses após a última dose de cemiplimabe.
Não se sabe se o cemiplimabe é secretado no leite humano. Sabe-se que os anticorpos40 (incluindo IgG4) são secretados no leite humano. O risco para os recém-nascidos / lactentes95 não pode ser excluído.
Deve ser tomada uma decisão sobre a descontinuação da amamentação96 ou a descontinuação da terapêutica97 com o cemiplimabe, tendo em consideração o benefício da amamentação96 para a criança e o benefício da terapêutica97 para a mulher.
Não há informações sobre a presença de cemiplimabe no leite humano ou seus efeitos sobre a criança amamentada ou sobre a produção de leite. Devido ao potencial de reações adversas graves em crianças amamentadas, aconselhe-se às mulheres a não amamentarem durante o tratamento e por pelo menos 4 meses após a última dose de Libtayo®
Categoria de risco na gravidez91: D. Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica. Informe imediatamente seu médico em caso de suspeita de gravidez91.
Potencial reprodutivo em homens e mulheres: Não há dados clínicos disponíveis sobre os possíveis efeitos do cemiplimabe na fertilidade. Não foram observados efeitos nos parâmetros de avaliação da fertilidade ou nos órgãos reprodutores masculinos e femininos num estudo de avaliação de fertilidade de 3 semanas com doses repetidas, com macacos cynomolgus sexualmente maduros.
Efeitos na habilidade de dirigir e operar máquinas
Não é conhecido se o cemiplimabe tem alguma influência na capacidade de conduzir e utilizar máquinas. Fadiga98 foi relatada após o tratamento com o cemiplimabe.
Informações importantes sobre um dos componentes do medicamento
Atenção diabéticos: este medicamento contém AÇÚCAR99.
INTERAÇÕES MEDICAMENTOSAS
Não foram realizados estudos farmacocinéticos de interação medicamentosa com o cemiplimabe.
CUIDADOS DE ARMAZENAMENTO DO MEDICAMENTO
Cuidados de conservação
Este medicamento deve ser mantido sob refrigeração (entre 2 e 8°C). Proteger da luz. Não congelar. Não agitar.
Após aberto: Uma vez aberto, Libtayo® deve ser diluído e infundido imediatamente.
Depois de preparação de infusão: Depois de preparado, administre a solução diluída imediatamente. Se a solução diluída não for administrada imediatamente, ela pode ser armazenada temporariamente:
- À temperatura ambiente até 25 °C por não mais de 8 horas a partir do momento da preparação. Isto inclui o armazenamento à temperatura ambiente da solução para perfusão no recipiente para administração intravenosa e o tempo para a administração da perfusão.
Ou - Sob refrigeração entre 2 °C e 8 °C por não mais que 24 horas a partir do momento da preparação da infusão. Deixe a solução diluída atingir a temperatura ambiente antes da administração.
Prazo de validade: 30 meses a partir da data de fabricação.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Após preparado manter entre 2°C e 8°C por até 24 horas ou manter até 25°C por não mais que 8 horas.
Características físicas e organolépticas do produto
Este medicamento apresenta-se como uma solução estéril incolor a ligeiramente opalescente, incolor a amarelo pálido com pH de 6,0. A solução pode conter vestígios de partículas translúcidas a brancas.
Libtayo® é fornecido em um frasco de vidro Tipo 1 transparente de 10 mL/20 mm, equipado com uma rolha de clorobutila cinza de 20 mm com revestimento FluroTec © e tampa de vedação de 20 mm com flip-off.
Antes de usar, observe o aspecto do medicamento.
TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS.
POSOLOGIA E MODO DE USAR
A dose recomendada de Libtayo® é de 350 mg administrada por perfusão intravenosa durante 30 minutos, a cada 3 semanas, até progressão da doença ou toxicidade12 inaceitável.
Não são recomendadas reduções de dose. O atraso ou descontinuação da dose pode ser necessário com base na segurança e tolerabilidade individuais. As modificações recomendadas para o manejo das reações adversas são fornecidas na Tabela 4.
Tabela 4: Modificações de Tratamento Recomendadas para Reações Adversas
|
Reação Adversa |
Severidadea |
Modificação de dose |
Intervenção adicional |
|
Pneumonite7 |
Grau 2 |
Suspender Libtayo® |
Dose inicial de 1mg/kg/dia a 2mg/kg/dia de prednisona ou equivalente com redução gradual da dose |
|
Retomar Libtayo® se pneumonite7 melhorar e permanecer em Grau 0 a 1 após redução da dose de corticosteroide (prednisona ou equivalente) para ≤ 10mg/dia |
|||
|
Grau 3 ou 4 |
Descontinuar permanentemente |
Dose inicial de 2mg/kg/dia a 4mg/kg/dia de prednisona ou equivalente com redução gradual da dose |
|
|
Colite48 |
Grau 2 ou 3 |
Suspender Libtayo® |
Dose inicial de 1mg/kg/dia a 2mg/kg/dia de prednisona ou equivalente com redução gradual da dose |
|
Retomar Libtayo® se colite48 ou diarreia49 melhorar e permanecer em Grau 0 a 1 após redução da dose de corticosteroide (prednisona ou equivalente) para ≤10mg/dia |
|||
|
Grau 4 |
Descontinuar permanentemente |
Dose inicial de 1mg/kg/dia a 2mg/kg/dia de prednisona ou equivalente com redução gradual da dose |
|
|
Hepatite10 |
Grau 2 com AST ou ALT > 3 e ≤ 5 × LSN |
Suspender Libtayo® |
Dose inicial de 1mg/kg/dia a 2mg/kg/dia de prednisona ou equivalente com redução gradual da dose |
|
Retomar Libtayo® se hepatite10 melhorar e permanecer em Grau 0 a 1 após redução da dose de corticosteroide (prednisona ou equivalente) ≤ 10mg/dia ou retorno ao nível inicial de TGO ou TGP após a conclusão da redução gradual da dose de corticosteroide |
|||
|
Grau ≥ 3 com AST ou ALT > 5 × LSN |
Descontinuar permanentemente |
Dose inicial de 1mg/kg/dia a 2mg/kg/dia de prednisona ou equivalente com redução gradual da dose |
|
|
Hipotireoidismo51 (vide Advertências e Precauções) |
Grau 3 ou 4 |
Suspender Libtayo® |
Iniciar reposição de hormônio100 tireoidiano conforme indicação clínica |
|
Retomar Libtayo® quando hipotireoidismo51 retornar em Grau 0 a 1 ou quando estiver clinicamente estável |
|||
|
Hipertireoidismo52 (vide Advertências e Precauções) |
Grau 3 ou 4 |
Suspender Libtayo® |
Iniciar tratamento sintomático101 |
|
Retomar Libtayo® quando hipertireoidismo52 retornar em Grau 0 a 1 ou quando estiver clinicamente estável |
|||
|
Tireoidite |
Grau 3 ou 4 |
Suspender Libtayo® |
Iniciar tratamento sintomático101 |
|
Retomar Libtayo® quando a tireoidite retornar para Grau 0 a 1 ou quando estiver clinicamente estável |
|||
|
Hipofisite |
Grau 2 a 4 |
Suspender Libtayo® |
Dose inicial de 1mg/kg/dia a 2mg/kg/dia de prednisona ou equivalente com redução gradual da dose e reposição hormonal quando clinicamente indicado |
|
Retomar Libtayo® se hipofisite melhorar e permanecer em Grau 0 a 1 após redução da dose de corticosteroide (prednisona ou equivalente) para ≤ 10mg/dia ou quando estiver clinicamente estável |
|||
|
Insuficiência53 adrenal (vide Advertências e Precauções) |
Grau 2 a 4 |
Suspender Libtayo® |
Dose inicial de 1mg/kg/dia a 2mg/kg/dia de prednisona ou equivalente com redução gradual da dose |
|
Retomar Libtayo® se insuficiência53 adrenal melhorar e permanecer em Grau 0 a 1 após redução da dose de corticosteroide (prednisona ou equivalente) para ≤ 10mg/dia ou quando estiver clinicamente estável |
|||
|
Diabetes Mellitus54 tipo 1 (vide Advertências e Precauções) |
Grau 3 ou 4 (hiperglicemia56) |
Suspender Libtayo® |
Iniciar tratamento com anti-hiperglicemiante quando clinicamente indicado |
|
Retomar Libtayo® quando diabetes mellitus54 retornar em Grau 0 a 1 ou quando estiver clinicamente estável |
|||
|
Reações adversas de pele67 (vide Advertências e Precauções) |
Grau 2 durando mais de 1 semana |
Suspender Libtayo® |
Dose inicial de 1mg/kg/dia a 2mg/kg/dia de prednisona ou equivalente com redução gradual da dose |
|
Retomar Libtayo® se a reação cutânea61 melhorar e permanecer em Grau 0 a 1 após redução da dose de corticosteroide (prednisona ou equivalente) para ≤ 10mg/dia |
|||
|
Grau 4 ou confirmação de SSJ ou NET |
Descontinuar permanentemente |
Dose inicial de 1mg/kg/dia a 2mg/kg/dia de prednisona ou equivalente com redução gradual da dose |
|
|
Reação cutânea61 imunológica ou outras reações adversas imunológicas em pacientes com tratamento prévio com idelalisibe (vide Advertências e Precauções) |
Grau 2 |
Suspender Libtayo® |
Iniciar tratamento sintomático101 imediatamente, incluindo dose inicial de 1mg/kg/dia a 2mg/kg/dia de prednisona ou equivalente com redução gradual da dose |
|
Retomar Libtayo® se a reação cutânea61 ou outra reação adversa imunológica melhorar e permanecer em Grau 0 a 1 após redução da dose de corticosteroide (prednisona ou equivalente) para ≤ 10mg/dia |
|||
|
Grau 3 ou 4 (excluindo endocrinopatias46) |
Descontinuar permanentemente |
Iniciar tratamento sintomático101 imediatamente, incluindo dose inicial de 1mg/kg/dia a 2mg/kg/dia de prednisona ou equivalente com redução gradual da dose |
|
|
Nefrite68 |
Grau 2 |
Suspender Libtayo® |
Dose inicial de 1mg/kg/dia a 2mg/kg/dia de prednisona ou equivalente com redução gradual da dose |
|
Retomar Libtayo® se nefrite68 melhorar ou permanecer em Grau 0 a 1 após redução da dose de corticosteroide (prednisona ou equivalente) para ≤ 10mg/dia |
|||
|
Grau 3 ou 4 |
Descontinuar permanentemente |
Dose inicial de 1mg/kg/dia a 2mg/kg/dia de prednisona ou equivalente com redução gradual da dose |
|
|
Outras reações adversas imunologicas (incluindo, mas não limitando-se a meningite69, encefalomielite |
Sinais41 ou sintomas42 clínicos moderados ou severos de uma reação adversa imunológica não descrita acima |
Suspender Libtayo® |
Iniciar tratamento sintomático101 |
|
paraneoplásica, artrite80, Síndrome82 de Guillain- Barre, encefalite73, polirradiculoneuropatia desmielinizante72 inflamatória crônica, inflamação87 do sistema nervoso central88, miocardite76 autoimune6, e púrpura78 trombocitopênica, mialgia81, Síndrome82 de Sjogren, vasculite86, miastenia74 grave)b (vide Advertências e Precauções) |
Retomar Libtayo® se outra reação adversa relacionada ao sistema imunológico38 melhorar e permanecer em Grau 0 a 1 após redução da dose de corticosteroide (prednisona ou equivalente) para ≤ 10mg/dia |
||
|
Descontinuar permanentemente |
Dose inicial de 1mg/kg/dia a 2mg/kg/dia de prednisona ou equivalente com redução gradual da dose |
|
|
Reações relacionadas à infusão |
Grau 1 ou 2 |
Interromper ou diminuir o fluxo da infusão |
Iniciar tratamento sintomático101 |
|
Grau 3 ou 4 |
Descontinuar permanentemente |
||
ALT: alanina aminotransferase; AST: aspartato aminotransferase; LSN: limite superior ao normal.
a A toxicidade12 foi classificada de acordo com os Critérios Comuns de Terminologia Comum do Instituto Nacional de Câncer16 para Eventos Adversos. Versão 4.0 (NCI CTCAE v4).
b Observado com Libtayo® ou com outro anticorpo21 monoclonal anti-PD-1/PD-L1
Modo de usar
Preparação
- Inspecione visualmente o medicamento para material particulado e descoloração antes da administração. Libtayo® é uma solução límpida a levemente opalescente, incolor a amarelo pálido que pode conter vestígios de partículas translúcidas a brancas.
- Descarte o frasco-ampola se a solução estiver turva, descolorida ou contiver partículas estranhas que não sejam vestígios de partículas translúcidas a brancas.
- Não agite o frasco.
- Retire 7 mL (350 mg) do (s) frasco (s) de Libtayo® e transfira para uma bolsa de perfusão intravenosa (IV) contendo solução de cloreto de sódio a 0,9% ou solução de dextrose102 a 5%. Misture a solução diluída por inversão suave. Não agite a solução. A concentração final da solução diluída deve estar entre 1 mg/mL e 20 mg/mL.
- Libtayo® é para uso único. Elimine qualquer medicamento não utilizado ou resíduos de acordo com os requisitos locais.
- Nenhum estudo de compatibilidade foi realizado. Não misture com outros medicamentos.
Administração
Libtayo® deve ser administrado por infusão intravenosa durante 30 minutos através de uma linha intravenosa contendo um filtro estéril, em linha ou adicional (tamanho de poro de 0,2 micron a 5 micron). Não coadministre outros medicamentos através da mesma linha de infusão.
Populações especiais
Pacientes pediátricos: A segurança e eficácia em pacientes pediátricos (0 a 18 anos) não foram estabelecidas.
Pacientes idosos: Não é recomendado um ajuste na dose para pacientes13 idosos (≥ 75 anos).
Pacientes com insuficiência renal28: Com base numa análise farmacocinética populacional, não é recomendado ajuste de dose para pacientes13 com redução da função renal30.
Pacientes com insuficiência hepática29: Com base numa análise farmacocinética populacional, não é recomendado um ajuste na dose para pacientes13 com redução leve da função hepática32. O cemiplimabe não foi estudado em pacientes com insuficiência hepática29 moderada a severa.
REAÇÕES ADVERSAS
A seguinte classificação de frequência CIOMS é utilizada, quando aplicável:
Muito comum ≥ 10%; comum ≥ 1% e <10%; incomum ≥ 0,1% e <1%; raro ≥ 0,01% e <0,1%; muito raro <0,01%.
A segurança do cemiplimabe foi avaliada em 455 pacientes com neoplasias103 sólidas avançadas, que receberam cemiplimabe como monoterapia em 3 estudos clínicos. Esses estudos incluíram 219 pacientes com CEC avançado (Estudo 1423 e 1540), 132 pacientes com CBC avançado (Estudo 1620) e 104 pacientes com outros tumores sólidos.
A duração média da exposição ao cemiplimabe foi de 35,1 semanas (intervalo: 10 dias a 144 semanas).
As reações adversas relacionadas à imunidade37 ocorreram em 25,3% dos pacientes tratados com o cemiplimabe nos estudos clínicos, incluindo os graus 5 (0,4%), 4 (0,7%), 3 (7,7%) e 2 (13,6%). As reações adversas relacionadas à imunidade37 levaram à descontinuação permanente do cemiplimabe em 5,3% dos pacientes. As reações adversas mais comuns relacionadas com o sistema imunológico38 foram hipotireoidismo51 (8.8%), pneumonite7 (4,0%), hipertiroidismo (2,4%), colite48 (3,1%) hepatite10 (2,2%) e reações adversas cutâneas59 relacionadas com o sistema imunológico38 (1, 5%) (vide Advertências e Precauções) . Os eventos adversos foram graves em 31,4% dos pacientes e levaram à descontinuação permanente do cemiplimabe em 9,0% dos pacientes.
Foram reportadas reações adversas cutâneas59 graves, incluindo síndrome de Stevens-Johnson63 (SJS) e necrólise epidérmica tóxica64 (TEN), em associação com o tratamento com o cemiplimabe (vide Advertências e Precauções).
As Tabelas 5 e 6 resumem a incidência70 de reações adversas que ocorreram em pacientes que receberam Libtayo®.
Tabela 5: Lista tabulada de reações adversas em pacientes com CEC metastático e localmente avançado tratados com Libtayo® nos estudos clínicos
|
Distúrbios do sistema imunológico38 |
|
|
Comum |
Reações relacionadas à infusão |
|
Incomum |
Síndrome82 de Sjogren, púrpura78 trombocitopênica imune, vasculite86 |
|
Distúrbios endócrinos |
|
|
Comum |
Hipotireoidismo51, hipertireodismo |
|
Incomum |
Insuficiência53 adrenal, Diabetes Mellitus54 Tipo 1, hipofisite |
|
Distúrbios do sistema nervoso71 |
|
|
Incomum |
Encefalomielite paraneoplásica, polirradiculoneuropatia desmielinizante72 inflamatória crônica, meningite69e encefalite73, síndrome82 de Guillain-Barre, inflamação87 do sistema nervoso central88, neuropatia periférica75, miastenia74 grave |
|
Distúrbios cardíacos |
|
|
Incomum |
Miocardite76 autoimune6 |
|
Distúrbios respiratórios, torácicos e mediastinais |
|
|
Comum |
Pneumonite7 |
|
Distúrbios gastrointestinais |
|
|
Muito comum |
Diarreia49a |
|
Incomum |
Estomatite65 |
|
Distúrbios hepatobiliares104 |
|
|
Comum |
Hepatites105 |
|
Distúrbios da pele e tecido subcutâneo106 |
|
|
Muito comum |
Rash107b, prurido108c |
|
Distúrbios musculoesqueléticos e do tecido conjuntivo109 |
|
|
Comum |
Artrite80, artralgia79, dor musculoesqueléticaf |
|
Incomum |
Miosite, fraqueza muscular |
|
Distúrbios renais e urinários |
|
|
Incomum |
Nefrite68 |
|
Distúrbios gerais e condições no local de aplicação |
|
|
Muito comum |
Fadiga98d |
|
Investigações |
|
|
Comum |
Aumento de alanina aminotransferase, aumento de aspartato aminotransferase, aumento da fosfatase alcalina110 sanguínea, aumento da creatinina111 sanguínea |
a Diarreia49 inclui diarreia49 e colite48.
b Rash107 inclui exantema112 maculopapular113, rash107, dermatite114, erupção60 cutânea61 generalizada, dermatite114 bolhosa, erupção60 medicamentosa, eritema115, erupção60 cutânea61 eritematosa116, erupção60 cutânea61 macular, erupção60 cutânea61 pruriginosa e reação cutânea61.
c Prurido108 inclui prurido108 e prurido108 alérgico.
d Fadiga98 inclui fadiga98 e astenia117.
e Meningite69 meningite69 e meningite asséptica83.
f Dor musculoesquelética inclui dor nas costas118, dor musculoesquelética, mialgia81, dor no pescoço119 e dor nas extremidades.
Tabela 6: Reações adversas em pacientes com CBC avançado recebendo Libtayo® (n=132)
|
Distúrbios do sistema imunológico38 |
|
|
Comum |
Reações relacionadas à infusão |
|
Incomum |
Síndrome82 de Sjogren, |
|
Infecções34 e infestações |
|
|
Muito comum |
Infeção do trato respiratório superiora, Infecção8 do trato urinário120 |
|
Distúrbios endócrinos |
|
|
Comum |
Hipotireoidismo51b, hipertireodismo, insuficiência53 adrenal, tireoidite |
|
Incomum |
Hipofisite |
|
Distúrbios do sistema nervoso71 |
|
|
Muito comum |
Cefaleia121, |
|
Comum |
Neuropatia periférica75c |
|
Distúrbios cardíacos |
|
|
Comum |
Miocardite76d, |
|
Incomum |
Pericardite77 autoimune6 |
|
Distúrbios respiratórios, torácicos e mediastinais |
|
|
Muito comum |
Dispneia122e |
|
Comum |
Pneumonite7 |
|
Distúrbios gastrointestinais |
|
|
Muito comum |
Diarreia49, nausea89 constipação123 |
|
Comum |
Colite48f, estomatite65, dor abdominal, vômito124, |
|
Distúrbios hepatobiliares104 |
|
|
Comum |
Hepatite10g |
|
Distúrbios da pele e tecido subcutâneo106 |
|
|
Muito comum |
Rash107h, prurido108 |
|
Distúrbios do metabolismo125 e nutrição126 |
|
|
Muito comum |
Apetite diminuído |
|
Distúrbios musculoesqueléticos e do tecido conjuntivo109 |
|
|
Muito comum |
Dor musculoesqueléticai |
|
Distúrbios renais e urinários |
|
|
Incomum |
Nefrite68j |
|
Distúrbios gerais e condições no local de aplicação |
|
|
Muito comum |
Fadiga98k |
|
Distúrbios do sangue127 e sistema linfático128 |
|
|
Muito comum |
Anemia129 |
|
Distúrbios vasculares130 |
|
|
Comum |
Hipertensão131l |
|
Investigações |
|
|
Comum |
Aumento do hormônio100 estimulante da tireoide44 no sangue127 |
|
Incomum |
Redução do hormônio100 estimulante da tireoide44 no sangue127 |
a . A infecção8 do trato respiratório superior inclui infecção8 do trato respiratório superior, nasofaringite, rinite132, sinusite133, faringite134, infecção8 do trato respiratório e infecção8 viral do trato respiratório superior.
b. O hipotireoidismo51 inclui o hipotireoidismo51 e o hipotireoidismo51 imunomediado.
c. A neuropatia periférica75 inclui parestesia135 e neuropatia136 sensorial periférica
d. A miocardite76 inclui miocardite76 autoimune6, miocardite76 imunomediada.
e. A dispneia122 inclui dispneia122 e dispneia122 de esforço.
f. A colite48 inclui colite48, colite48 autoimune6 e enterocolite.
g. A hepatite10 inclui lesão19 hepatocelular, hepatite10 autoimune6 e hepatite10 imunomediada.
h. A erupção60 cutânea61 inclui erupção60 maculopapular113, erupção60 cutânea61, dermatite114, dermatite114 acneiforme, eritema115, erupção60 cutânea61 pruriginosa, dermatite114 bolhosa, eczema137 disidrótico, penfigoide, erupção60 cutânea61 eritematosa116 e urticária138
i. A dor musculoesquelética inclui artralgia79, dor nas costas118, mialgia81, dor nas extremidades, dor musculoesquelética, dor no pescoço119, rigidez musculoesquelética, dor musculoesquelética no peito139, desconforto musculoesquelético e dor na coluna.
j. A nefrite68 inclui insuficiência renal28 e lesão19 renal30 aguda
k. A fadiga98 inclui fadiga98, astenia117 e mal-estar.
l. A hipertensão131 inclui hipertensão131 e crise hipertensiva.
Tabela 7. Anormalidades laboratoriais de grau 3 ou 4 Piora da linha de base em ≥ 1% dos pacientes com CEC avançado que receberam Libtayo® no Estudo 1423 e no Estudo 1540
|
Anormalidades laboratoriais |
CEC Estudos 1423 e 1540 |
BCC Estudo 1620 |
|
Anormalidades laboratoriais |
Grau 3-4 (%)† |
|
|
Química |
|
|
|
Aumento de aspartato aminotransferase |
3 |
- |
|
Hipoalbuminemia140 |
1 |
- |
|
Hematológica |
||
|
Linfopenia |
7 |
2 |
|
Anemia129 |
2 |
- |
|
Eletrólitos141 |
||
|
Hipofosfatemia |
4 |
- |
|
Hiponatremia142 |
3 |
3 |
|
Hipocalemia143 |
- |
2 |
|
Hipercalcemia |
1 |
- |
|
Coagulação144 |
||
|
INR (índice internacional de normatização) aumentado |
2 |
- |
|
Tempo de tromboplastina145 parcial ativado prolongado |
- |
2 |
Toxicidade12 classificada conforme versão 4.03 do NCI CTCAE
† As porcentagens são baseadas no número de pacientes com pelo menos 1 valor pós-linha de base disponível para esse parâmetro.
Imunogenicidade
Como com todas as proteínas146 terapêuticas, existe um potencial de imunogenicidade com Libtayo®. A detecção da formação de anticorpos40 é altamente dependente da sensibilidade e especificidade do ensaio. Além disso, a incidência70 observada de anticorpos40 positivos (incluindo anticorpos40 neutralizantes) em um ensaio pode ser influenciada por vários fatores, incluindo a metodologia do ensaio, manipulação da amostra, tempo de coleta da amostra, medicações concomitantes e doença subjacente. Por esses motivos, a comparação da incidência70 de anticorpos40 para o cemiplimabe nos estudos descritos com a incidência70 de anticorpos40 em outros estudos ou em outros produtos pode ser enganosa. Anticorpos40 contra o medicamento (ADA) foram testados em 823 pacientes que receberam Libtayo® e a incidência70 de ADAs emergentes do tratamento com cemiplimabe foi de 2,2% usando um imunoensaio de ligação eletroquimioluminescente (ECL); 0,4% foram respostas persistentes da ADA. Nos pacientes que desenvolveram anticorpos40 anti-cemiplimabe, não houve evidência de um perfil farmacocinético alterado de cemiplimabe.
Experiência pós-comercialização
As seguintes reações adversas foram relatadas durante o uso pós-aprovação de Libtayo®. Como essas reações são relatadas voluntariamente em uma população de tamanho incerto, nem sempre é possível estimar com segurança a sua frequência ou estabelecer uma relação causal com a exposição ao medicamento (vide Advertências e Precauções).
Distúrbios do sistema imunológico38: rejeição a transplante de órgão sólido
Distúrbios musculoesqueléticos: miosite
Atenção: este produto é um medicamento novo e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos. Nesse caso, notifique os eventos adversos pelo Sistema VigiMed, disponível no Portal da Anvisa.
SUPERDOSE
Nenhum caso de overdose com cemiplimabe foi reportado.
Em caso de intoxicação ligue para 0800 722 6001, se você precisar de mais orientações.
DIZERES LEGAIS
VENDA SOB PRESCRIÇÃO MÉDICA
USO RESTRITO A HOSPITAIS
MS 1.8326.0303
Farm. Resp: Ricardo Jonsson CRF-SP nº 40.796
Registrado e Importado por:
Sanofi Medley Farmacêutica Ltda.
Rua Conde Domingos Papaiz, 413 – Suzano – SP
CNPJ: 10.588.595/0010-92
Indústria Brasileira
Fabricado por:
Regeneron Pharmaceuticals, Inc.
81 Columbia Turnpike Rensselaer, NY 12144 – EUA
Embalado por:
Catalent Indiana, LLC
1300 South Patterson Drive Bloomington, IN 47403 – EUA e
Sanofi-Aventis Deutschland GmbH
Brüningstrasse 50, 65926 Frankfurt am Main - Alemanha
OU
Embalado por:
Sanofi-Aventis Deutschland GmbH
Brüningstrasse 50, 65926 Frankfurt am Main – Alemanha
SAC 0800 703 0014






