Xeomin (Bula do profissional de saúde)
MERZ FARMACÊUTICA COMERCIAL LTDA
IDENTIFICAÇÃO DO MEDICAMENTO
Xeomin®
toxina1 botulínica A
Injetável 100 U
FORMA FARMACÊUTICA E APRESENTAÇÃO:
Pó liófilo para solução injetável
Cartucho com 1 frasco ampola
VIA INTRAMUSCULAR
USO ADULTO
COMPOSIÇÃO:
Cada frasco ampola de Xeomin contém:
| toxina1 botulínica A (150 kDa), isenta de complexos proteicos | 100 unidades* |
| excipiente q.s.p. | 1 frasco ampola |
Excipientes: sacarose e albumina2 humana.
* Uma unidade corresponde à dose letal média quando o produto reconstituído é injetado intraperitoneamente em ratos sob condições definidas.
Devido à diferença no teste, estas unidades são específicas para o Xeomin® e não são intercambiáveis com outras preparações de toxinas3 botulínicas.
INFORMAÇÕES TÉCNICAS AOS PROFISSIONAIS DE SAÚDE4
INDICAÇÕES
XEOMIN® é destinado ao tratamento sintomático5 do blefarospasmo e da distonia6 cervical com componente rotacional predominante (torcicolo7 espasmódico) em adultos e espasticidade8 dos membros superiores em adultos.
XEOMIN® também está indicado para a melhora temporária da aparência das linhas faciais hipercinéticas.
RESULTADOS DE EFICÁCIA
ESTUDO COM XEOMIN® EM BLEFAROSPASMO
Foi realizado um estudo clínico multicêntrico, randomizado9, duplo cego com XEOMIN® e o produto de referência em 300 pacientes com idade entre 18 e 75 anos de idade, originados de 42 hospitais localizados na Europa e Israel1,23.
Foi concluído que os efeitos do produto XEOMIN® em blefarospasmo avaliados neste estudo multicêntrico demonstraram que os objetivos primários foram plenamente atingidos. Os resultados confirmam eficácia clínica e funcional no tratamento do blefarospasmo.
EFICÁCIA DO XEOMIN® NO TORCICOLO7 ESPASMÓDICO
O estudo da eficácia do XEOMIN® no tratamento do torcicolo7 espasmódico foi o maior estudo multicêntrico, duplo cego e randomizado9 realizado com toxina1 botulínica até o presente momento2,32. Foram recrutados 463 pacientes com idade entre 18 e 75 anos em 51 centros distribuídos pela Europa e Israel.
A avaliação clínica global feita pelos pacientes e médicos que acompanharam o tratamento foi considerada altamente positiva.
O produto XEOMIN®, que representa uma inovadora preparação de toxina1 botulínica A, demonstrou ser eficaz e bem tolerado no tratamento do torcicolo7 espasmódico.
EFICÁCIA DE XEOMIN® EM ESPASTICIDADE8
Espasticidade8 após acidente vascular cerebral10 (AVC): Em um estudo clínico (duplo- cego, controlado por placebo11, multicêntrico, número EudraCT 2005-003951-11) realizado em pacientes com espasticidade8 dos membros superiores após AVC, 148 pacientes foram randomizados para receber XEOMIN® (N=73) ou placebo11 (N=75), de acordo com as recomendações de dose para o tratamento inicial apresentadas na posologia da bula. Os participantes tinham um histórico de AVC (? 6 meses desde o último episódio) e apresentavam espasticidade8 focal no pulso e nos dedos com um escore de ≥ 2 na Escala Ashworth para os flexores do pulso e dos dedos.
Conforme determinação do parâmetro de eficácia primária (taxa de resposta dos flexores do pulso de acordo com a escala Ashworth na semana 4, resposta definida como melhora de pelo menos 1 ponto nos 4 pontos da escala Ashworth), os pacientes tratados com XEOMIN® (taxa de resposta: 68,5% ) tiveram uma probabilidade 3,97 vezes maior de resposta em relação aos pacientes tratados com placebo11 (taxa de resposta: 37,3%, 95% IC: 1,90-8,30; p <0,001, população ITT)4.
Espasticidade8 de diversas etiologias: Em um estudo prospectivo12, multicêntrico, randomizado9, observador-cego, paralelo, a eficácia e a segurança de XEOMIN®, usando duas diluições diferentes (20 U/mL e 50 U/mL), foram avaliadas em pacientes com espasticidade8 dos membros superiores causada por diversas etiologias. Cento e noventa e dois pacientes adultos com espasticidade8 de membros superiores (com ou sem tratamento prévio) causada por AVC, lesão13 cerebral, paralisia14 cerebral ou esclerose múltipla15 participaram do estudo em 32 centros na Europa.
O objetivo primário do estudo foi demonstrar a eficácia do tratamento com XEOMIN® na espasticidade8 de diversas etiologias em termos de análise de responsivos. A resposta foi definida como a redução de pelo menos um ponto na Escala de Avaliação de Incapacidade (EAI) para o alvo terapêutico primário desde o período basal até 4 semanas.
Uma resposta ao tratamento foi observada na semana 4 em 95 pacientes (57,6%; n=165) na avaliação PPS (per protocol set). A melhora foi verificada em 51 pacientes (63,0%) no grupo 20 U/mL e 44 pacientes (52,4%) no grupo 50 U/ml. A diferença na proporção de respostas entre os dois grupos de tratamento foi de 10,6% (95% CI -4,4, 24,9), mostrando a não inferioridade da diluição 20 U/ml em relação à diluição 50 U/mL5.
EFICÁCIA DO XEOMIN® NAS LINHAS FACIAIS HIPERCINÉTICAS
Durante o desenvolvimento clínico de XEOMIN®, grandes estudos clínicos prospectivos, randomizados, duplo-cegos, controlados e multicêntricos foram realizados em adultos para o tratamento de linhas faciais hipercinéticas. Nesses estudos foram incluídos, no total, 1591 pacientes com linhas/ rugas glabelares e periorbitárias laterais.
Segundo as variáveis de eficácia mais utilizadas, os resultados globais mostram que os grupos tratados com XEOMIN® apresentaram taxa de resposta significativamente superior em todos os estudos comparativos com placebo11. 6,7,8,9,10
Além disso, um estudo comparativo em linhas glabelares confirmou a não inferioridade de XEOMIN® em relação ao produto comparativo contendo o complexo de toxina1 botulínica A convencional (900 kDa), já demonstrada em estudos prévios para indicações neurológicas, e comprovou a sua eficácia, com taxa de resposta de até 96,4%.11
Além destes estudos, podemos citar também um estudo nacional, fase III, unicêntrico, que avaliou o uso de XEOMIN® para as rugas de expressão do terço superior da face16, em 101 pacientes, com rugas de expressão de leves a graves, durante máxima contração muscular, nas regiões frontal, periorbital e glabelar. A avaliação de segurança foi realizada pela descrição de todos os eventos adversos relatados pelas pacientes ou pelos investigadores. A avaliação das rugas foi feita por três examinadores independentes, além das pacientes, e as pacientes responderam também a um questionário de Qualidade de Vida em Dermatologia. XEOMIN® mostrou ser um tratamento efetivo e seguro para o tratamento das rugas de expressão do terço superior da face16, com altas taxas de satisfação relatadas pelas pacientes. Houve um impacto positivo na qualidade de vida, medida pela melhora observada nas respostas ao questionário.12
Outro estudo importante a ser citado é o Consenso sobre o uso de toxina1 botulínica. Neste, foram publicadas orientações de consenso sobre as doses para uso da toxina1 em medicina estética. Foi feita a comparação entre as três toxinas3 aprovadas para uso estético nos Estados Unidos, entre elas o XEOMIN®. Foram padronizadas doses de aplicação em diferentes indicações para tratamento de linhas faciais do terço superior e inferior da face16, comparando as doses necessárias para cada uma das três apresentações. Ou seja, além das regiões tradicionais de aplicação no terço superior da face16, foram determinadas as doses para aplicação na região perioral, rugas de comissura17 oral, rugas do mento e do pescoço18, entre outras. Foram citados os principais efeitos colaterais19 e complicações, bem como as boas práticas para minimizar a chance de ocorrerem estas intercorrências.13
Referência bibliográfica
- ROGGENKÄMPER P. et al. Efficacy and safety of a new Botulinum toxin type A free of complexing proteins in the treatment of blepharospasm. Journal of Neural Transmission, v.113, p.303-312, 2006.
- BENECKE R. et al. A new Botulinum toxin type A free of complexing proteins for treatment of cervical dystonia. Neurology, v.64, p.1949, 2005.
- JOST W. et al. Botulinum Neurotoxin Type A Free of Complexing Proteins (XEOMIN®) in Focal Dystonia. Drugs 2007; 67(5): 669-683.
- KANOVSKÝ P, et al. Efficacy and safety of botulinum neurotoxin NT 201 in poststroke upper limb spasticity. Clin Neuropharmacol. 2009 Sep-Oct;32(5):259-65.
- BARNES M, SCHNITZLER A, MEDEIROS L, AGUILAR M, LEH-NERT-BATAR A, MINNASCH P. Efficacy and safety of NT 201 for upper limb spasticity of various etiologies – a randomized parallel-group study. Acta Neurol Scand. 2010;122(4):295–302.
- CARRUTHERS A, CARRUTHERS J, COLEMAN WP 3RD, DONO-FRIO L, FLYNN T, GOLD M, HEINZ M, HARRINGTON L, JONES D, MCDANIEL D, ROHRER T, SCHLÖBE A, SOLISH N, WEISS RA. Multicenter, randomized, phase III study of a single dose of incobotulinumtoxinA, free from complexing proteins, in the treatment of glabellar frown lines. Dermatol Surg. 2013 Apr;39(4):551-8.
- ECCLESTON D, Protocol MRZ 60201–0617 (EudraCT number 2006-005396-17, data on file).
- FLYNN T, Protocol MRZ 60201–0527 (IND number 100288, data on file).
- HANKE CW, NARINS RS, BRANDT F, et al. A randomized, placebo11-controlled, double blind Phase III trial investigating the efficacy and safety of incobotulinumtoxinA in the treatment of glabellar frown lines using a stringent composite endpoint. Dermatol Surg. 2013.
- RZANY B, FLYNN TC, SCHLÖBE A, HEINZ M, HARRINGTON L. Long-term results for incobotulinumtoxinA in the treatment of glabellar frown lines. Dermatol Surg. 2013 Jan;39(1 Pt 1):95-103. doi: 10.1111/dsu.12008.
- SATTLER G1, CALLANDER MJ, GRABLOWITZ D, WALKER T, BEE EK, RZANY B, FLYNN TC, CARRUTHERS A. Noninferiority of incobotulinumtoxinA, free from complexing proteins, compared with another botulinum toxin type A in the treatment of glabellar frown lines. Dermatol Surg. 2010 Dec;36 Suppl 4:2146-54.
- TALARICO S, VENTURA KARIN F, HASSUN KARIME M, MACE-DO FERNANDO S, PARADA MEIRE B, et al. Incobotulinumtoxin is Effective and Safe for Treating Expression Wrinkles in the Upper Third of the Face16: A Phase III, Open-Label Clinical Study. J Clin Exp Dermatol Res 2:134.2011.
- CARRUTHERS J, FOURNIER N, KERSCHER, M, RUIZ-AVILA, J, ALMEIDA, ART. The Convergence of Medicine and Neurotoxins: A Focus on Botulinum Toxin type A and Its Application in Aesthetic Medicine – A Global, Evidence-Based Botulinum Toxin Consensus Education Iniciative. Part II: Incorporating Botulinum Toxin into Aesthetic Clinical Practice. Dermatol Surg 2013; 39(3):510-25.
- WISSEL J, BENSMAIL D, FERREIRA JJ, MOLTENI F, SATKUNAM L, MORALEDA S, et al. Safety and efficacy of incobotulinumtoxinA doses up to 800 U in limb spasticity: the TOWER study. Neurology. 2017;88(14):1321-1328.
- KERSCHER M, Prospective, randomized, double-blind, placebo11 controlled, multicenter study with an open-label extension period to investigate the efficacy and safety of NT 201 in the combined treatment of upper facial lines (horizontal forehead lines, glabellar frown lines, and lateral periorbital lines), protocol MRZ MRZ60201_3076_1 (EudraCT Number 2011-005887-20, data on file).
CARACTERISTICAS FARMACOLÓGICAS
Farmacodinâmica
A toxina1 botulínica A bloqueia a transmissão colinérgica20 na junção neuromuscular21 pela inibição da liberação de acetilcolina22. As terminações nervosas da junção neuromuscular21 não mais respondem aos impulsos nervosos e a liberação de neurotransmissores é impedida (desnervação23 química). A recuperação da transmissão do impulso é restabelecida pela formação de novas terminações nervosas e da placa24 motora terminal.
O mecanismo de ação pelo qual a toxina1 botulínica A exerce seu efeito na terminação nervosa colinérgica20 pode ser descrito por um processo de três passos sequenciais, o qual inclui os seguintes passos:
- Ligação nas terminações nervosas colinérgicas25
- Entrada ou internalização no terminal nervoso e
- Inibição da liberação da acetilcolina22 pelo envenenamento intracelular dentro da terminação nervosa.
A cadeia pesada da toxina1 botulínica A se liga com uma excepcional alta seletividade e afinidade aos receptores apenas encontrados nos terminais colinérgicos. Após a internalização da neurotoxina, a cadeia leve quebra especificamente uma proteína alvo (SNAP 25), que é essencial para a liberação da acetilcolina22.
A recuperação após a aplicação normalmente ocorre dentro de 3-4 meses, quando os terminais nervosos se restabelecem e se reconectam com a placa24 motora.
Farmacocinética
a) Características gerais da substância ativa
Os estudos clássicos de cinética26 e distribuição não podem ser conduzidos com a toxina1 botulínica A, pois a substância ativa é aplicada em pequenas quantidades (picogramas por injeção27) e ela se liga muito rapidamente e irreversivelmente aos terminais nervosos colinérgicos.
A toxina1 botulínica natural é um complexo de alto peso molecular que, além da neurotoxina (150 kDa), contém outras proteínas28 não tóxicas, como hemaglutininas e não hemaglutininas. Em contraste com os preparados convencionais de toxina1 botulínica A com complexo proteico, XEOMIN® contém neurotoxina pura (150 kDa), isento de complexos proteicos.
Assim como muitas outras proteínas28 com este tamanho, a toxina1 botulínica A tem mostrado submeter-se a transporte axonal retrógrado após aplicação intramuscular. Contudo não foi encontrada passagem transsináptica retrocedente da atividade da toxina1 botulínica A no sistema nervoso central29.
O receptor ligado da toxina1 botulínica A é endocitado no terminal nervoso, primeiramente para alcançar o seu alvo (SNAP 25) e será eventualmente degradado intracelularmente. As moléculas de toxina1 botulínica A livres na circulação30, que não foram ligadas aos receptores dos terminais nervosos pré-sinápticos colinérgicos, serão fagocitadas31 ou pinocitadas e degradadas como qualquer outra proteína livre na circulação30.
b) Distribuição da substância ativa em pacientes
Estudos farmacocinéticos em humanos com XEOMIN® não foram realizados pelas razões detalhadas acima.
CONTRAINDICAÇÕES
- Hipersensibilidade a substância ativa toxina1 botulínica A ou a algum dos demais componentes de XEOMIN®.
- Distúrbio generalizado da atividade muscular (por exemplo: miastenia32 grave, síndrome33 Lambert-Eaton).
- Presença de infecção34 ou inflamação35 no local proposto da aplicação.
Este medicamento é contraindicado para menores de 18 anos.
ADVERTÊNCIAS E PRECAUÇÕES
Efeitos indesejáveis podem ocorrer por quando há a aplicação de toxina1 botulínica A em locais incorretos, paralisando temporariamente grupos musculares próximos. Houve relatos de efeitos indesejáveis que podem estar relacionados à difusão da toxina1 para locais distantes do ponto da aplicação (veja item 9). Ao tratar indicações neurológicas alguns destes podem causar risco de morte e há relatos de morte.
Os pacientes tratados com doses terapêuticas podem sentir fraqueza muscular grave. Pacientes com desordens neurológicas subjacentes, incluindo dificuldade de deglutição36, têm um risco aumentado desses efeitos adversos. Produtos contendo toxina1 botulínica devem ser utilizados sob a supervisão de um especialista nestes pacientes e somente deve ser utilizado se o benefício do tratamento for maior que o risco. Para as indicações neurológicas, pacientes com histórico de disfagia37 e aspiração devem ser tratados com extremo cuidado. O tratamento de indicações estéticas com XEOMIN® não é recomendado para pacientes38 com história de disfagia37 e aspiração.
Os pacientes ou seus responsáveis devem ser advertidos a procurar um serviço médico imediato se surgirem distúrbios de deglutição36, fala ou respiração.
Reações de hipersensibilidade foram relatados com o uso de formulações de toxina1 botulínica A. Se reações de hipersensibilidade sérias (reações anafiláticas39) e/ou imediatas ocorrerem, terapia médica apropriada deve ser instituída.
Antes de administrar XEOMIN®, o médico deve familiarizar-se com a anatomia do paciente, bem como ter conhecimento de qualquer alteração na anatomia devido a intervenções cirúrgicas anteriores. É necessário um cuidado especial no tratamento de distonia6 cervical e da espasticidade8 após acidente vascular cerebral10 quando o local da aplicação for próximo de estruturas sensíveis, como a artéria40 carótida, ápices pulmonares e esôfago41.
Existem experimentos limitados em pacientes sem tratamento prévio e que passaram por tratamento de longa duração.
XEOMIN® deve ser usado com cautela:
- se ocorrerem distúrbios da coagulação42 de qualquer tipo, inclusive sangramentos;
- em pacientes que estiverem sendo tratados com anticoagulantes43 ou recebendo outros medicamentos que causem efeito anticoagulante44;
- em pacientes que estiverem sofrendo de esclerose45 lateral amiotrófica ou outras doenças que levem à falha de funções neuromusculares periféricas;
- em casos de músculos46 alvo que apresentem pronunciada fraqueza ou atrofia47 do músculo injetado.
As doses individuais recomendadas não devem ser ultrapassadas e os intervalos de dosagem indicados não devem ser encurtados.
O efeito clínico da toxina1 botulínica A pode ser reforçado ou atenuado por injeções repetidas. As possíveis causas são as diferentes técnicas de reconstituição, os intervalos de tratamento escolhidos, aos músculos46 injetados e uma atividade ligeiramente oscilante da toxina1, condicionada ao método de teste biológico empregado ou a não-resposta secundária.
Doses muito frequentes de toxina1 botulínica podem resultar na formação de anticorpos48, os quais podem conduzir à resistência ao tratamento.
Pacientes que tenham distúrbios de movimento ou sejam sedentários devem ser lembrados de gradualmente retornar as atividades após a aplicação de XEOMIN®.
Deve-se ter cautela para não aplicar XEOMIN® em vasos sanguíneos49.
XEOMIN® contém albumina2, um componente do sangue50 humano. Medidas padrão para evitar infecções51 com o uso de medicamentos preparados a partir de sangue50 ou plasma52 humano incluem cuidadosa seleção de doadores, rastreamento de doações individuais e pool de plasma52 quanto a marcadores específicos de infecção34 e a inclusão de etapas efetivas de fabricação para a inativação/remoção de vírus53. Apesar destas medidas, quando medicamentos fabricados a partir de sangue50 ou plasma52 humanos são administrados, não se pode excluir totalmente a possibilidade da transmissão de agentes infecciosos. Isso também se aplica para vírus53 não conhecidos ou recentemente surgidos e outros patógenos. Não há relatos de transmissões de vírus53 através de preparados de albumina2 que tenham sido produzidos conforme as especificações da Farmacopeia Europeia por processos estabelecidos.
Blefarospasmo
Devido ao efeito anticolinérgico da toxina1 botulínica A, XEOMIN® deve ser usado com cautela em pacientes para os quais há o risco de um glaucoma54 de ângulo estreito.
Para prevenir um ectrópio55, injeções nas regiões da pálpebra inferior devem ser evitadas, e qualquer defeito epitelial deve ser tratado ativamente. Para tanto, poderá ser necessário a utilização de colírios, pomadas, tampões curativos macios ou o fechamento do olho56 com um tapa-olho56 ou similar.
Uma redução no piscar após a aplicação de XEOMIN® no músculo orbicular pode levar a exposição da córnea57, defeitos epiteliais prolongados e ulcerações58 da córnea57, especialmente em pacientes com distúrbios do nervo cranial (nervo facial59). Nos pacientes que já passaram por uma intervenção oftalmológica, a sensibilidade da córnea57 deve ser examinada cuidadosamente.
Nos tecidos macios da pálpebra, surgem facilmente equimoses60. Suave pressão imediata no local da aplicação pode reduzir este risco.
Torcicolo7 espasmódico
Injeções de XEOMIN® para o tratamento do torcicolo7 espasmódico podem provocar disfagia37 leve a grave, com risco de aspiração e dispneia61. Uma intervenção médica poderá ser necessária (por exemplo, sob forma de uma alimentação artificial através de sonda).
A disfagia37 pode durar até duas ou três semanas após a aplicação, mas já foi observado um caso de duração de até cinco meses. A limitação da dose injetada no músculo esternocleidomastoideo62 em menos de 100 unidades reduz a ocorrência de disfagia37. Pacientes com massa muscular reduzida do pescoço18 ou pacientes que necessitam de injeções em ambos os lados do músculo esternocleidomastoideo62 estão sujeitos a um maior risco. A ocorrência de disfagia37 é atribuída ao alastramento do efeito farmacológico de XEOMIN® como efeito do alastramento da neurotoxina na musculatura esofagial (dos tubos alimentares).
Espasticidade8 dos membros superiores em adultos
XEOMIN® como tratamento para a espasticidade8 focal tem sido estudado em associação com regimes de tratamento padrão usual, e não é pretendido como substituto para essas modalidades de tratamento. Não é provável que XEOMIN® seja eficaz na melhora da amplitude de movimento de uma articulação63 afetada por uma contratura fixa.
Foram notificados novos casos de convulsão64 ou crises recorrentes, principalmente em pacientes predispostos a sofrer estes eventos. A relação exata entre esses eventos e a aplicação de neurotoxina botulínica não foi estabelecida.
Linhas faciais hipercinéticas
População especial: Existem dados limitados de estudos fase III com XEOMIN® em pacientes com mais de 65 anos no tratamento de linhas faciais hipercinéticas. Até existirem estudos adicionais nesta faixa etária, XEOMIN® não é recomendado para pacientes38 com idade superior a 65 anos.
Efeitos na habilidade de dirigir e operar máquinas
XEOMIN® tem pouca a moderada influência sobre a capacidade de dirigir ou operar máquinas.
Devido à natureza da doença em tratamento, a capacidade de dirigir e operar máquinas pode estar reduzida. Devido à demora para o início, alguns dos efeitos do tratamento e/ou efeitos adversos de XEOMIN® podem também interferir com a capacidade para dirigir e para operar máquinas. Se ocorrer astenia65, fraqueza muscular, transtornos da visão66, cansaço, tonturas67 ou pálpebras68 caídas, os pacientes devem ser orientados a evitar dirigir ou realizar atividades potencialmente perigosas até que suas capacidades estejam plenamente restabelecidas.
Gravidez69 e Lactação70
Não há dados suficientes disponíveis para a utilização de toxina1 botulínica A em grávidas. Estudos em animais demonstraram toxicidade71 reprodutiva. O risco potencial para o ser humano não é conhecido. Por isso, XEOMIN® não deve ser utilizado em mulheres grávidas, a menos que seja claramente necessário e desde que o potencial benefício justifique o risco.
Categoria C – Não há estudos adequados em mulheres. Em experiências animais ocorreram alguns efeitos colaterais19 no feto72, mas o benefício do produto pode justificar o risco potencial durante a gravidez69.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Lactação70: Não se sabe se a toxina1 botulínica A é excretada no leite materno. Deste modo, a aplicação de XEOMIN® não é recomendada no período de amamentação73.
Populações especiais
Uso pediátrico: A aplicação de XEOMIN® em crianças e adolescentes abaixo de 18 anos não foi testada e por isso atualmente não é recomendada.
Estudos pré-clínicos
Os estudos de toxicidade71 reprodutiva com XEOMIN®, realizados em coelhos, não mostraram efeitos adversos sobre a fertilidade masculina ou feminina, nem efeitos diretos sobre o desenvolvimento embrio-fetal. No entanto, a administração de XEOMIN® em doses exibindo toxicidade71 materna em intervalos semanais para quinzenais aumentou o número de abortos em um estudo de toxicidade71 pré-natal em coelhos. A exposição sistêmica contínua das coelhas gestantes durante a fase sensível da organogênese como um pré-requisito para a indução de efeitos teratogênicos74 não pode necessariamente ser presumida.
Estudos de genotoxicidade, carcinogenicidade e desenvolvimento pré e pós-natal não foram realizados com XEOMIN®.
INTERAÇÕES MEDICAMENTOSAS
A coadministração de XEOMIN® com antibióticos aminoglicosídeos ou outros medicamentos que interfiram com a transmissão neuromuscular, por exemplo, relaxantes musculares do tipo tubocurarina, deverá ser realizada com cuidado pois estes medicamentos podem potencializar o efeito da toxina1.
Principais interações com testes laboratoriais: Nos estudos clínicos com XEOMIN®, não foi observada interferência em testes laboratoriais de sangue50.
CUIDADOS DE ARMAZENAMENTO DO MEDICAMENTO
Cuidados de conservação
O produto deve ser armazenado em temperatura ambiente (15–30°C). Desde que o frasco ampola esteja lacrado, a validade é 36 meses a partir da data de fabricação (vide cartucho).
Solução reconstituída: Foi demonstrada a estabilidade química e física em uso para 24 horas a 2–8°C. Do ponto de vista microbiológico75, o produto deve ser usado imediatamente.
Número de lote e datas de fabricação e validade: vide embalagem. Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Após preparo, manter a 2–8°C por até 24 horas.
Características físicas e organolépticas do produto
XEOMIN® é apresentado como um pó para solução injetável, branco a quase-branco. Quando reconstituído, é uma solução transparente e sem partículas.
Antes de usar, observe o aspecto do medicamento.
TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS.
POSOLOGIA E MODO DE USAR
XEOMIN® reconstituído é destinado à injeção intramuscular76.
As dosagens (unidades) recomendadas para o XEOMIN® não são intercambiáveis com aquelas para outras preparações de toxina1 botulínicas.
XEOMIN® somente pode ser aplicado por médicos com qualificação adequada e conhecimento especializado comprovado no tratamento com neurotoxina botulínica, bem como no manejo dos equipamentos necessários, como por exemplo, EMG (eletromiografia77).
A dose ótima e a quantidade de pontos de aplicação no músculo em questão devem ser determinadas individualmente pelo médico, e deve ser feita uma titulação da dose. Após a reconstituição, XEOMIN® deve ser usado em apenas uma sessão de aplicação e apenas em um paciente.
É possível um aumento ou redução da dose de XEOMIN® ao utilizar um volume de injeção27 maior ou menor. Quanto menor o volume de aplicação, menor é a sensação de pressão durante a aplicação e menor o alastramento de toxina1 botulínica A no músculo injetado. Isto é vantajoso na aplicação em grupos de músculos46 menores, pois os efeitos sobre músculos46 próximos são reduzidos.
XEOMIN® é reconstituído antes do uso com uma solução para injeção27 de cloreto de sódio 9 mg/ml (0,9%) sem conservante e estéril. A reconstituição e diluição devem ser realizadas com boas práticas, particularmente em relação à assepsia78.
É uma boa prática realizar a reconstituição e preparação da seringa79 sobre toalhas de papel plastificadas, para receber eventuais derramamentos. Uma quantidade apropriada de diluente (veja a tabela de diluição) deve ser aspirada pela seringa79. A parte exposta da tampa de borracha do frasco deve ser limpa com álcool (70%) antes de ser perfurada pela agulha. Depois da inserção vertical da agulha através da tampa de borracha, injete o solvente suavemente dentro do frasco a fim de evitar a formação de espuma. Recomenda-se o uso de uma agulha de calibre 22-27G para reconstituição. O frasco deve ser descartado caso não haja vácuo suficiente para puxar o diluente da seringa79 para o frasco. Retirar a seringa79 do frasco e homogeneizar XEOMIN® com o diluente através de movimentos circulares e da inversão do frasco – não agitar vigorosamente. Se necessário, a agulha usada para reconstituição deverá permanecer no frasco e a quantidade necessária de solução deverá ser retirada com uma nova seringa79 estéril adequada para aplicação.
XEOMIN® reconstituído é uma solução clara, incolor e isenta de partículas.
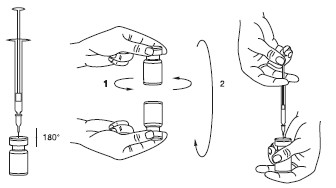
XEOMIN® não deve ser usado se a solução reconstituída (preparada conforme as instruções acima) tiver uma aparência turva ou contiver material floculado ou partículas. As dissoluções recomendadas estão listadas na tabela a seguir:
|
Diluente adicionado (solução de cloreto de sódio 9 mg/ml (0,9 %) injetável) |
Dose resultante em unidades por 0,1 ml |
|
0,5 ml |
20,0 unidades |
|
1,0 ml |
10,0 unidades |
|
2,0 ml |
5,0 unidades |
|
4,0 ml |
2,5 unidades |
|
8,0 ml |
1,25 unidades |
Qualquer solução estocada por mais de 24 horas como também qualquer solução reconstituída e não usada deve ser descartada.
Os frascos não utilizados e a solução reconstituída residual no frasco e/ou seringa79 deverão ser inutilizados através da adição de uma das seguintes soluções: álcool etílico 70%, álcool isopropílico 50%, solução diluída de hidróxido de sódio (NaOH 0,1N) ou solução diluída de hipoclorito de sódio (pelo menos NaOCl 0,1%).
Incompatibilidades: O produto não deve ser misturado com nenhum outro medicamento.
Blefarospasmo
A solução reconstituída de XEOMIN® é injetada com uma agulha adequadamente esterilizada (por exemplo, 27-30 gauge/ 0,30-0,40 mm). Não é necessário que haja orientação eletromiográfica. É recomendado um volume de injeção27 de aproximadamente 0,05 a 0,1 ml.
XEOMIN® é injetado nos músculos46 orbicular medial e lateral da pálpebra superior e no músculo orbicular lateral da pálpebra inferior. Outras injeções, na região da sobrancelha, no músculo orbicular lateral e na face16 superior podem ser necessárias, caso os espasmos80 que se localizem nessa região atrapalhem a visão66.
A dose inicial recomendada é de 1,25 – 2,5 unidades (volume de 0,05 – 0,1ml) em cada ponto de aplicação. Inicialmente, não devem ser aplicadas mais de 25 unidades por olho56. No tratamento do blefarospasmo recomenda-se não ultrapassar uma dose total de 100 unidades a cada 12 semanas. Em geral, o tratamento não deverá ser repetido com intervalo menor de 6 semanas. Em estudos clínicos controlados, XEOMIN® mostrou-se eficaz e bem tolerado quando aplicado em intervalos entre 6 e 20 semanas (média: 12 semanas). Os intervalos de tratamento devem ser determinados com base na necessidade clínica de cada paciente.
Devem ser evitadas injeções na proximidade do levantador da pálpebra superior para reduzir o surgimento de ptose81. Devido à difusão de toxina1 botulínica A no músculo inferior obliquo do olho56, pode-se desenvolver uma diplopia82. Esta reação adversa pode ser reduzida quando se evita injeção27 medial na pálpebra inferior.
Em média, o primeiro efeito da aplicação ocorre dentro de quatro dias. O efeito de um tratamento dura em geral cerca de 3 – 4 meses, porém pode durar bem menos ou bem mais. Caso necessário, o tratamento pode ser repetido.
Nos tratamentos repetidos, a dose pode ser elevada até ao dobro, quando a reação ao tratamento inicial for considerada insuficiente - em geral definida como efeito que não dura mais do que dois meses. Porém, parece que uma aplicação de mais de 5,0 unidades por ponto de aplicação não tem benefício adicional.
Torcicolo7 espasmódico
No tratamento do torcicolo7 espasmódico com XEOMIN®, a dosagem deve ser escolhida individualmente para cada paciente, com base no posicionamento da cabeça83 e pescoço18 do paciente, da localização da possível dor, da hipertrofia84 muscular, do peso corporal do paciente, bem como de sua resposta à aplicação. Para a aplicação nos músculos46 superficiais deve-se utilizar agulhas adequadas esterilizadas (por exemplo, 25-30 gauge/ 0,30-0,50 mm) e para aplicação em músculos46 profundos, pode ser utilizada uma agulha esterilizada, por exemplo, a 22 gauge/ 0,70 mm. É recomendado um volume de injeção27 de 0,1 a 0,5 ml.
Para o tratamento do torcicolo7 espasmódico, XEOMIN® é usualmente injetado nos músculos46 esternocleidomastoideo62, elevador da escápula85, escaleno, splenius capitis e/ou trapézio86. Esta lista não está completa porque qualquer um dos músculos46 responsáveis pelo controle da posição da cabeça83 pode estar envolvido então precisar de tratamento. Caso haja dificuldade no isolamento dos músculos46 individuais, as injeções devem ser realizadas usando apoio eletromiográfico. Na escolha da dosagem adequada, devem ser considerados a massa muscular e grau da hipertrofia84 ou atrofia47.
Na prática, a dose máxima total usualmente não supera 200 unidades. Poderão ser dadas doses de até 300 unidades. Não devem ser aplicadas mais de 50 unidades em um único local de aplicação.
A escolha de vários locais de aplicação87 possibilita um contato mais uniforme de XEOMIN® nas regiões inervadas do músculo distônico e é especialmente favorável em músculos46 maiores. A quantidade ótima de locais de aplicação87 depende do tamanho do músculo que deve ser desnervado quimicamente.
No músculo esternocleidomastoideo62, XEOMIN® não deve ser injetado bilateralmente, pois há um risco aumentado para o surgimento de reações adversas (especialmente disfagia37) quando são aplicadas injeções em ambos os lados deste músculo ou doses com mais de 100 unidades neste músculo.
Em média, o primeiro efeito da aplicação surge dentro de sete dias. O efeito de cada tratamento dura em geral cerca de 3 – 4 meses, porém pode durar bem menos ou bem mais. Em geral, o tratamento não deverá ser repetido com intervalo menor de 6 semanas. Em estudos clínicos controlados, XEOMIN® mostrou-se eficaz e bem tolerado quando aplicado em intervalos entre 6 e 20 semanas (média: 12 semanas). Os intervalos de tratamento devem ser determinados com base na necessidade clínica de cada paciente.
Espasticidade8 dos membros superiores em adultos
XEOMIN® reconstituído é injetado com uma agulha estéril apropriada (por exemplo, 26 gauge / 0,45 mm de diâmetro / 37 mm de comprimento, para os músculos46 superficiais e uma agulha mais longa, por exemplo, 22 gauge / 0,7 mm de diâmetro / 75 mm de comprimento, para a musculatura mais profunda).
A localização dos músculos46 envolvidos com orientação eletromiográfica ou técnicas de estimulação nervosa podem ser úteis. Locais de aplicações múltiplas podem permitir que o XEOMIN® tenha um contato mais uniforme com as áreas inervadas do músculo e são especialmente úteis quando os músculos46 maiores são injetados.
A dosagem exata e o número de locais de aplicação87 devem ser adaptados para cada paciente com base no tamanho, número e localização dos músculos46 envolvidos, na gravidade da espasticidade8, e na presença de fraqueza muscular local.
No tratamento da espasticidade8 dos membros superiores após acidente vascular cerebral10 as seguintes doses iniciais (unidades) foram administradas em ensaio clínico:
|
Padrão Clínico |
Unidades |
|
Punho Flexionado |
|
|
Flexor radial do carpo |
50 |
|
Flexor ulnar do carpo |
40 |
|
Punho cerrado |
|
|
Flexor superficial dos dedos |
40 |
|
Flexor profundo dos dedos |
40 |
|
Cotovelo Flexionado |
|
|
Braquiorradial |
60 |
|
Bíceps |
80 |
|
Braquial |
50 |
|
Antebraço88 Pronado |
|
|
Pronador quadrado |
25 |
|
Pronador redondo |
40 |
|
Polegar na palma |
|
| Flexor longo do polegar | 20 |
| Adutor do polegar | 10 |
| Flexor curto do polegar/oponente do polegar | 10 |
Nos ensaios clínicos89 a dose mínima e máxima total foram, respectivamente, 170 U e 400 U.
Para tratamentos recorrentes a dose deve ser adaptada às necessidades individuais do paciente. Os intervalos de dose recomendadas, por músculo, estão apresentadas na tabela a seguir:
|
Padrão Clínico |
Unidades (intervalo) |
Número de locais de aplicação87 por músculo |
|
Punho Flexionado |
||
|
Flexor radial do carpo |
25-100 |
1-2 |
|
Flexor ulnar do carpo |
20-100 |
1-2 |
|
Punho cerrado |
||
|
Flexor superficial dos dedos |
40-100 |
2 |
|
Flexor profundo dos dedos |
40-100 |
2 |
|
Cotovelo Flexionado |
||
|
Braquiorradial |
25-100 |
1-3 |
|
Bíceps |
75-200 |
1-4 |
|
Braquial |
25-100 |
1-2 |
|
Antebraço88 Pronado |
||
|
Pronador quadrado |
10-50 |
1 |
|
Pronador redondo |
25-75 |
1-2 |
|
Polegar na palma |
||
|
Flexor longo do polegar |
10-50 |
1 |
|
Adutor do polegar |
5-30 |
1 |
|
Flexor curto do polegar/ oponente do polegar |
5-30 |
1 |
A dose máxima recomendada é de até 400 unidades por sessão de tratamento.
A dose ótima e a quantidade de pontos de injeção27 no músculo em questão devem ser determinadas individualmente pelo médico, devendo ser realizada uma titulação da dose.
Os pacientes relataram o início da ação 4 dias após o tratamento. O efeito máximo, referido como uma melhora do tônus muscular90, foi percebido em 4 semanas após a aplicação. Em geral, o efeito do tratamento durou 12 semanas. Novas injeções não devem ocorrer em intervalo de menos de 12 semanas.
Linhas faciais hipercinéticas
Após a reconstituição de XEOMIN®, as seguintes doses e esquemas de aplicação devem ser utilizados:
– Linhas glabelares
Após a reconstituição do XEOMIN®, a dose recomendada é de 4 unidades injetadas em cada um dos 5 locais de aplicação87: duas injeções em cada músculo corrugador e uma aplicação no músculo prócero, o que corresponde à dose padronizada de 20 unidades. A dose pode ser aumentada até 30 unidades, se requerido de acordo com as necessidades do paciente.
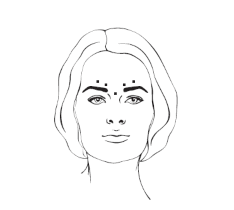
– Rugas periorbitárias laterais
Após a reconstituição de XEOMIN®, a dose recomendada é de 12 unidades injetadas em cada lado (área do olho56 direito/esquerdo), seguindo o esquema de aplicação de três locais de aplicação87 (3 x 4 unidades) ou quatro locais de aplicação87 (4 x 3 unidades), conforme ilustrado abaixo.
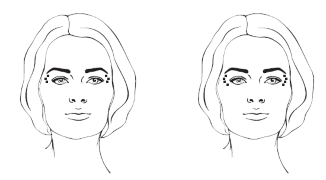
– Rugas frontais
A mímica da região frontal varia muito entre os indivíduos. Os pontos de aplicação não são padronizados e são definidos pelo médico de acordo com a necessidade de cada paciente. A dose total recomendada é de 5 U a 15 U de XEOMIN®. A dose pode ser dividida em 4 a 10 pontos de aplicação.
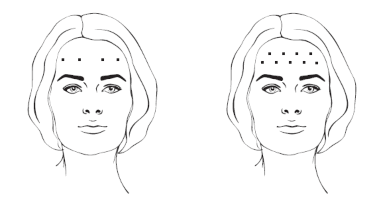
A melhora da gravidade das linhas hipercinéticas geralmente ocorre em 2 a 3 dias, com o efeito máximo observado no dia 30. O efeito foi demonstrado até 4 meses após a administração da aplicação. Em alguns casos a duração do efeito pode ser menor ou maior. Os intervalos do tratamento não devem ser menores que três meses. Na eventualidade de insucesso do tratamento ou de uma diminuição do efeito após injeções repetidas, devem ser utilizados métodos de tratamento alternativos.
O XEOMIN® reconstituído é injetado utilizando-se uma agulha fina estéril (por exemplo, agulha de calibre 30 gauge).
Para reduzir o risco de blefaroptose devem ser evitadas injeções próximas do músculo elevador da pálpebra superior e na porção craniana do músculo orbicular dos olhos91. As injeções no músculo corrugador devem ser administradas na parte mediana e central do mesmo, pelo menos 1 cm acima da cavidade ocular.
Injeções muito próximas ao músculo zigomático maior devem ser evitadas para prevenir ptose81 dos lábios.
O intervalo entre o tratamento não deve ser menor que 3 meses.
Para todas as indicações
Se o tratamento não fizer efeito dentro de um mês após o tratamento inicial, os seguintes procedimentos devem ser realizados:
- verificação clínica do efeito da toxina1 no músculo injetado: por exemplo, uma investigação eletromiográfica;
- análise da razão para a falta de resposta, por exemplo, isolamento ruim dos músculos46 que deveriam sofrer aplicação, dose muito baixa, técnica inadequada de aplicação, contratura fixa, antagonista92 muito fraco e possível desenvolvimento de anticorpos48;
- revisão da toxina1 botulínica A como terapia adequada;
- se nenhuma reação adversa ocorreu durante o tratamento inicial, uma série adicional de tratamento pode ser realizada sob as seguintes condições:
- ajuste da dose considerando a análise da mais recente falha de resposta,
- orientação EMG,
- não exceder o intervalo mínimo recomendado entre o tratamento inicial e sua repetição.
Na ausência de efeito terapêutico, o paciente deverá ser considerado como uma falha terapêutica93 primária. Não foi investigado se no tratamento com XEOMIN® a falha terapêutica93 secundária pela formação de anticorpos48 é menos frequente do que com preparados convencionais com complexo de toxina1 botulínica A. Em caso de falha de terapia, métodos alternativos de tratamento deverão ser considerados.
XEOMIN® não foi estudado na população pediátrica, então não é recomendado em pacientes pediátricos até que mais dados estejam disponíveis.
REAÇÕES ADVERSAS
Usualmente, os efeitos adversos são observados na primeira semana após a aplicação e são passageiros. Eles podem estar relacionados ao princípio ativo, à aplicação ou a ambos.
Como esperado em qualquer procedimento injetável, dor localizada, inflamação35, parestesia94, hipoestesia95, endurecimento, edema96, eritema97, prurido98, infecção34 localizada, hematoma99, sangramento e/ou equimoses60 podem estar associadas com a aplicação.
Dor relacionada a agulha e/ou ansiedade podem resultar em resposta vasovagal, incluindo hipotensão100 sintomática101 transitória, náusea102, tinido e síncope103.
Fraqueza muscular localizada é um efeito farmacológico esperado com a toxina1 botulínica A.
Ao tratar indicações neurológicas, efeitos colaterais19 relativos à difusão da toxina1 para locais distantes do local da aplicação foram notificados muito raramente (fraqueza muscular exagerada, disfagia37 e pneumonite104 aspirativa com desfecho fatal). Efeitos indesejáveis como estes não podem ser completamente descartados com o uso de XEOMIN® nas indicações estéticas.
Disfagia37 foi reportada após injeções em locais diferentes da musculatura cervical.
Raramente foram relatados efeitos adversos relacionados ao sistema cardiovascular105, como arritmias106 e infarto do miocárdio107, alguns deles com resultado fatal. Não está claro se estes casos fatais foram causados pelos preparados convencionais com o complexo de toxina1 botulínica A, ou por doenças cardiovasculares108 pré-existentes.
Foi reportado um caso de neuropatia periférica109 em um paciente masculino após receber quatro séries de injeções de um preparado convencional com o complexo de toxina1 botulínica A (para espasmos80 no pescoço18 e costas110, e dor severa) durante um período de 11 semanas.
Uma paciente do sexo feminino desenvolveu plexopatia braquial dois dias após aplicação da preparação convencional com o complexo de toxina1 botulínica A para o tratamento de distonia6 cervical, com recuperação após 5 meses.
Foram descritos eritema multiforme111, urticária112, rash113 cutâneo114 tipo psoríase115 com o uso de preparados convencionais com o complexo de toxina1 botulínica A, porém, não pôde ser esclarecido o contexto causal.
Após a aplicação de complexo de toxina1 botulínica A convencional houve um aumento do jitter eletrofisiológico na eletromiografia77 de alguns músculos46 distantes, o qual não estava ligado à fraqueza muscular ou outros tipos de distúrbios eletrofisiológicos.
Reações de hipersensibilidade
Reações de hipersensibilidade graves e/ou imediatas, incluindo anafilaxia116, doença do soro117, urticária112, edema96 de tecidos moles e dispneia61 foram raramente relatadas. Algumas destas reações foram relatadas após o uso da toxina1 botulínica de complexo do tipo A sozinho ou em combinação com outros agentes conhecidos por causar reações similares.
Sintomas118 de gripe119 e reações de hipersensibilidade como inchaço120, edema96 (além do local da aplicação), eritema97, prurido98, erupções (locais e generalizadas) e dispneia61 têm sido relatados.
Baseado em estudos clínicos, as informações acerca da frequência das reações adversas para as indicações individuais estão descritas a seguir. As categorias de frequência são definidas como: Muito comum (?1/10); Comum (?1/100 e <1/10); Incomum (?1/1,000 e <1/100); Rara (?1/10,000 e <1/1,000); Muito Rara (<1/10,000) e Desconhecida (não pode ser estimada a partir dos dado disponíveis).
Blefarospasmo
As seguintes reações adversas foram observadas durante o uso de XEOMIN®:
|
Sistema / Órgão |
Reação adversa |
|
|
Doenças do Sistema Nervoso121 |
Incomum |
Cefaleia122, paresia123 facial |
|
Afecções124 oculares |
Muito comum |
Ptose81 palpebral |
|
Comum |
Visão66 borrada, deficiência visual, olhos91 secos |
|
|
Incomum |
Diplopia82, aumento da lacrimação |
|
|
Doenças gastrointestinais |
Comum |
Boca125 seca |
|
Incomum |
Disfagia37 |
|
|
Perturbações gerais e alterações no local de administração |
Comum |
Dor no local da injeção27 |
|
Incomum |
Fadiga126 |
|
|
Afecções124 musculoesqueléticas e dos tecidos conjuntivos |
Incomum |
Fraqueza muscular |
|
Afecções124 dos tecidos cutâneos e subcutâneos |
Incomum |
Rash113 cutâneo114 |
Torcicolo7 espasmódico
As seguintes reações adversas foram observadas durante o uso de XEOMIN®:
|
Sistema / Órgão |
Reação adversa |
|
|
Doenças gastrointestinais |
Muito comum |
Disfagia37 |
|
Comum |
Boca125 seca, náusea102 |
|
|
Perturbações gerais e alterações no local de administração |
Comum |
Dor no local da injeção27, astenia65 |
|
Afecções124 musculoesqueléticas e dos tecidos conjuntivos |
Comum |
Dor no pescoço18, fraqueza muscular, mialgia127, rigidez muscolesquelética, espasmo128 muscular |
|
Doenças do Sistema Nervoso121 |
Comum |
Cefaleia122, pré-síncope103, Tontura129 |
|
Incomum |
Distúrbio da fala |
|
|
Infecções51 e infestações |
Comum |
Infecção34 do trato respiratório superior |
|
Doenças respiratórias torácicas e do mediastino130 |
Incomum |
Disfonia131, dispneia61 |
|
Afecções124 dos tecidos cutâneos e subcutâneos |
Comum Incomum |
Hiperidrose132 Rash113 cutâneo114 |
O tratamento de torcicolo7 espasmódico pode causar disfagias de diferentes graus de gravidade com o perigo de aspiração, de modo que uma intervenção médica possa ser necessária. A disfagia37 pode durar de duas a três semanas após a aplicação, em um caso, porém, foi relatada uma duração de até cinco meses. A disfagia37 parece ser dependente da dose. Em estudos clínicos com complexo de toxina1 botulínica A foi relatado que a disfagia37 ocorre mais raramente quando a dose total durante uma sessão do tratamento estiver abaixo de 200 unidades.
Espasticidade8 dos membros superiores em adultos
As seguintes reações adversas foram observadas durante o uso de XEOMIN®:
|
Sistema / Órgão |
Reação adversa |
|
|
Doenças gastrointestinais |
Comum |
Boca125 seca |
| Incomum | Disfagia37, náusea102 | |
|
Perturbações gerais e alterações no local de administração |
Incomum |
Astenia65 |
|
Afecções124 musculoesqueléticas e dos tecidos conjuntivos |
Incomum |
Fraqueza muscular, dor nas extremidades, mialgia127 |
|
Doenças do Sistema Nervoso121 |
Incomum |
Cefaleia122, hipoestesia95 |
Linhas faciais hipercinéticas
– Linhas glabelares
Os seguintes efeitos adversos foram relatados com XEOMIN® no tratamento das linhas glabelares.
|
Sistema / Órgão |
Reação adversa |
|
|
Perturbações gerais e alterações no local de administração |
Incomum |
Equimose133 no local da injeção27, sintomas118 de gripe119, fragilidade (local), fadiga126, dor no local da injeção27, desconforto (sensação de pálpebra e sobrancelhas134 pesadas) |
|
Afecções124 musculoesqueléticas e dos tecidos conjuntivos |
Comum |
Sinal135 de Mefisto |
|
Incomum |
Assimetria facial (assimetria das sobrancelhas134), espasmos80 musculares (acima das sobrancelhas134) |
|
|
Doenças do Sistema Nervoso121 |
Comum |
Cefaleia122 |
|
Afecções124 oculares |
Incomum |
Edema96 da pálpebra, visão66 borrada, ptose81 da pálpebra |
|
Afecções124 dos tecidos cutâneos e subcutâneos |
Incomum |
Prurido98, ptose81 da sobrancelha |
|
Infecções51 e infestações |
Incomum |
Nasofaringite |
|
Vasculopatias |
Incomum |
Hematoma99 |
– Rugas periorbitárias laterais
Os seguintes efeitos adversos foram relatados com XEOMIN® em um estudo clínico para o tratamento das rugas periorbitárias laterais:
|
Sistema / Órgão |
Reação adversa |
|
|
Perturbações gerais e alterações no local de administração |
Comum |
Hematoma99 no local da injeção27 |
|
Afecções124 oculares |
Comum |
Edema96 da pálpebra, olho56 seco |
As seguintes reações adversas foram relatadas com XEOMIN® baseadas na experiência clínica com linhas glabelares, rugas periorbitais laterais e rugas frontais:
|
Sistema / Órgão |
Reação adversa |
|
|
Perturbações gerais e alterações no local de administração |
Comum |
Hematoma99 no local da injeção27, dor no local da injeção27, eritema97 no local da injeção27, desconforto (sensação de peso na área frontal) |
|
Afecções124 oculares |
Comum |
Ptose81 da pálpebra, olho56 seco |
|
Doenças do Sistema Nervoso121 |
Muito |
Cefaleia122 |
|
|
Comum |
Hipostesia |
|
Afecções124 dos tecidos cutâneos e subcutâneos |
Comum |
Ptose81 da sobrancelha |
|
Afecções124 musculoesqueléticas e dos tecidos conjuntivos |
Comum |
Assimetria facial, sinal135 de mefisto |
|
Doenças gastrointestinais |
Comum |
Náusea102 |
Em casos de eventos adversos, notifique ao Sistema de Notificação de Eventos Adversos a Medicamentos – VIGIMED, ou para a Vigilância Sanitária Estadual ou Municipal.
SUPERDOSE
Sintomas118 de superdose
Doses elevadas de toxina1 botulínica A podem causar intensas paralisias neuromusculares distantes dos locais de aplicação87. Sintomas118 de uma superdose não são aparentes imediatamente após uma aplicação e podem incluir: fraqueza generalizada, ptose81, diplopia82, distúrbios da deglutição36 ou da fala ou paralisia14 da musculatura respiratória, o que pode resultar em pneumonia136 por aspiração.
Condutas
Em caso de superdose o paciente deve ser monitorado quanto aos sintomas118 de excessiva fraqueza muscular ou paralisia14 muscular por vários dias. Se aparecer sinais137 de intoxicação, é necessária a hospitalização e a adoção de medidas de suporte geral para o tratamento sintomático5. Se ocorrer paralisia14 da musculatura respiratória, são necessárias intubação e ventilação138 assistida até a melhora do padrão respiratório.
Em caso de intoxicação ligue para 0800 722 6001, se você precisar de mais orientações.
DIZERES LEGAIS
VENDA SOB PRESCRIÇÃO MÉDICA
MS – 1.8802.0001
Farm. Resp.: Dra. Luciana Silvia Maria Franco da Silva - CRF-SP nº 68932
Fabricado por:
Merz Pharma GmbH & Co. KGaA Dessau-Rosslau – Alemanha
Embalado por:
Merz Pharma GmbH & Co. KGaA Reinheim – Alemanha
Registrado por:
Merz Farmacêutica Comercial Ltda.
Alameda Vicente Pinzon, n° 51, 10° andar, conjunto 1002, Vila Olímpia, São Paulo/SP
CEP 04547-130
CNPJ 11.681.446/0001-45
Importado e Distribuído por:
Merz Farmacêutica Comercial Ltda.
Sob licença de Merz Pharmaceuticals GmbH, Frankfurt – Alemanha
SAC 0800 709 6379