Abba (Bula do profissional de saúde)
SUN FARMACÊUTICA DO BRASIL LTDA
IDENTIFICAÇÃO DO MEDICAMENTO
Abba
acetato de abiraterona
Comprimido 250 mg
Medicamento similar equivalente ao medicamento de referência.
FORMA FARMACÊUTICA E APRESENTAÇÃO:
Comprimido
Embalagem com 120 comprimidos
USO ORAL
USO ADULTO
COMPOSIÇÃO:
Cada comprimido de Abba contém:
| acetato de abiraterona (equivalente a 223 mg de abiraterona) | 250 mg |
| excipiente q.s.p. | 1 comprimido |
Excipientes: lactose1 monoidratada, celulose microcristalina, croscarmelose sódica, hipromelose, laurilsulfato de sódio, estearato de magnésio, butil-hidroxianisol.
INFORMAÇÕES TÉCNICAS AOS PROFISSIONAIS DE SAÚDE2
INDICAÇÕES
O medicamento Abba, em combinação com prednisona ou prednisolona e terapia de privação androgênica (agonista3 de hormônio4 liberador de gonadotrofina ou castração5 cirúrgica), é indicado para:
- o tratamento de pacientes com câncer6 de próstata7 metastático resistente à castração5 (mCRPC) que são assintomáticos ou levemente sintomáticos, após falha à terapia de privação androgênica.
o ftratamento de pacientes com câncer6 de próstata7 avançado metastático resistente à castração5 (mCRPC) e que receberam quimioterapia8 prévia com docetaxel.
O medicamento Abba, em combinação com prednisona e terapia de privação androgênica (agonista3 de hormônio4 liberador de gonadotrofina ou castração5 cirúrgica), é indicado para:
- o tratamento de pacientes com câncer6 de próstata7 metastático de alto risco, com diagnóstico9 recente, não tratados anteriormente com hormônios (mHNPC) ou pacientes que estavam em tratamento hormonal por não mais que três meses e continuam respondendo à terapia hormonal (mHSPC).
RESULTADOS DE EFICÁCIA
A eficácia de acetato de abiraterona foi estabelecida em três estudos clínicos Fase 3 (Estudos 3011, 302, e 301), multicêntricos, randomizados, controlados com placebo10 em pacientes com câncer6 de próstata7 metastático de alto risco não tratados anteriormente com hormônio4 e câncer6 de próstata7 metastático e resistente à castração5.
O Estudo 3011 incluiu pacientes que foram recentemente diagnosticados (no prazo de 3 meses até a randomização) com câncer6 de próstata7 metastático não tratados anteriormente com hormônio4 e que apresentavam fatores de prognóstico11 de alto risco. O prognóstico11 de alto risco foi definido como tendo pelo menos 2 dos 3 seguintes fatores de risco: (1) escore de Gleason ≥ 8; (2) presença de 3 ou mais lesões12 na varredura óssea; (3) presença de metástases13 viscerais mensuráveis (excluindo a doença linfonodal). No braço ativo, acetato de abiraterona foi administrado em uma dose de 1000 mg ao dia em combinação com uma dose baixa de prednisona 5 mg uma vez ao dia em adição à ADT (agonista3 de LHRH ou orquiectomia14), que era o tratamento padrão. Os pacientes no braço controle receberam ADT e placebos tanto para acetato de abiraterona como para prednisona.1
O Estudo 302 incluiu pacientes que não haviam recebido quimioterapia8 prévia e eram assintomáticos ou levemente sintomáticos, enquanto que o Estudo 301 incluiu pacientes que já tinham recebido quimioterapia8 prévia contendo docetaxel. Em ambos os estudos os pacientes estavam em uso de agonistas de LHRH (hormônio4 liberador do hormônio4 luteinizante) ou haviam sido submetidos previamente à orquiectomia14. Nos braços experimentais, acetato de abiraterona foi administrado na dose de 1000 mg ao dia, associado a uma dose baixa de prednisona ou prednisolona de 5 mg duas vezes ao dia. Os pacientes do grupo controle receberam placebo10 e dose baixa de prednisona ou prednisolona de 5 mg duas vezes ao dia.
Devido ao fato de que as alterações na concentração sérica do Antígeno15 Prostático Específico (PSA) nem sempre podem prever um benefício clínico, em todos os estudos os pacientes foram mantidos em tratamento com acetato de abiraterona até atingirem critério para descontinuação, conforme especificado para cada estudo abaixo.
Estudo 3011 [pacientes com câncer6 de próstata7 metastático de alto risco não tratados anteriormente com hormônio4 (mHNPC) recentemente diagnosticado ou câncer6 de próstata7 hormônio4-sensível metastático de alto risco (mHSPC)]
No Estudo 3011 (n=1199) a idade mediana dos pacientes incluídos foi de 67 anos.2 O “performance status ECOG” (Eastern Cooperative Oncology Group) foi de 0 ou 1 para 97% dos pacientes.3 Foram excluídos os pacientes com hipertensão16 não controlada, doença cardíaca significativa ou NYHA Classe II ou maior ou insuficiência cardíaca17.4 Os desfechos de eficácia coprimária foram sobrevida18 global (OS) e sobrevida18 livre de progressão radiográfica (rPFS).5 A mediana do escore basal de dor, medido pelo Formulário Abreviado da Dor (Brief Pain Inventory Short Form (BPISF)) foi 2,0 nos grupos de tratamento e placebo10.6 Além dos desfechos de avaliação coprimária, o benefício também foi avaliado usando tempo para eventos esqueléticos relacionados (ERE), tempo para terapia subsequente para câncer6 de próstata7, tempo para início de quimioterapia8, tempo para progressão de dor e tempo para progressão do PSA.7
No Estudo 3011, o tratamento continuou até a progressão da doença, a retirada da permissão, a ocorrência de toxicidade19 inaceitável ou óbito20.8
A sobrevida18 livre de progressão radiográfica foi definida como o tempo desde a randomização até a ocorrência de progressão radiográfica ou óbito20 por qualquer causa. A progressão radiográfica incluiu progressão por varredura óssea (de acordo com PCWG2 modificado) ou progressão de lesões12 de tecido21 mole por TC ou RNM (de acordo com RECIST 1.1).9
Esta análise final da SG foi realizada com base em um ponto de corte (PC) de 15 de agosto de 2018, após 618 mortes relatadas (mediana de acompanhamento de 51,8 meses). Melhoria significativa na SG foi demostrada no grupo AA-P em comparação ao grupo placebo10, mostrando um efeito consistente e robusto do tratamento em favor do tratamento com AA-P. Além disso, os dados atualizados dos principais desfechos secundários de eficácia (tempo até o início da quimioterapia8, tempo até a terapia subsequente para câncer6 de próstata7, tempo até a progressão da dor, tempo para eventos relacionados ao esqueleto22, tempo para a progressão do antígeno15 prostático específico [PSA]) foram consistentes com os resultados anteriores e continuam a mostrar o efeito favorável do tratamento com AA-P. Através destes desfechos secundários, foram observados benefícios estatisticamente e clinicamente significativos a favor de AA-P mais ADT.
Análise de desfecho primário de eficácia: Sobrevida18 Global
O desfecho co-primário de eficácia de SG é definido como o intervalo de tempo a partir da data de randomização até a data de óbito20 por qualquer causa. Os resultados da análise final da SG são apresentados na Tabela 1 e na Figura 1. A partir do PC de 15 de agosto de 2018, foram notificados 618 óbitos: 275 (46%) no grupo AA-P e 343 (57%) no grupo placebo10. A mediana de tempo de acompanhamento para todos os indivíduos foi de 51,8 meses (PCR3011/Anexo23 TEFOS08). A razão de risco (RR) para SG foi de 0,661 (intervalo de confiança de 95% [IC]: 0,564, 0,775; p <0,0001), representando uma redução de 34% no risco de morte. A mediana de sobrevida18 global foi de 53,3 meses no grupo AA-P e 36,5 meses no grupo placebo10, com uma diferença de 16,8 meses entre as medianas de sobrevida18 global dos dois grupos
Tabela 1. Sobrevida18 Global, Análise Estratificada; População com Intenção de Tratamento (Estudo 212082PCR3011)
|
AA-P |
Placebo10 |
|
|
Indivíduos randomizados |
597 |
602 |
|
Evento |
275 (46,1%) |
343 (57,0%) |
|
Censurados |
322 (53,9%) |
259 (43,0%) |
|
Sobrevida18 global (meses) |
|
|
|
25º percentil (IC 95%) |
26,25 (22,74; 29,93) |
19,75 (17,91; 21,85) |
|
Mediana (IC 95%) |
53,32 (48,23; NE) |
36,53 (33,54; 39,95) |
|
75º percentil (IC 95%) |
NE (NE; NE) |
NE (60,19; NE) |
|
Alcance |
(0,1; 65,2+) |
(1,4+; 64,6+) |
|
Taxa livre de evento por 12 meses (IC 95%) |
0,931 (0,908; 0,949) |
0,892 (0,863; 0,914) |
|
Taxa livre de evento por 24 meses (IC 95%) |
0,771 (0,734; 0,803) |
0,687 (0,646; 0,723) |
|
Taxa livre de evento por 36 meses (IC 95%) |
0,650 (0,608; 0,688) |
0,503 (0,460; 0,544) |
|
Taxa livre de evento por 48 meses (IC 95%) |
0,544 (0,501; 0,585) |
0,399 (0,356; 0,441) |
|
Taxa livre de evento por 60 meses (IC 95%) |
0,458 (0,408; 0,506) |
0,315 (0,265; 0,367) |
|
Valor de pa |
< 0,0001 |
|
|
Razão de Risco (IC 95%)b |
0,661 (0,564; 0,775) |
Nota: + = observação censurada;
NE = Não estimável.
a O valor de p é derivado de um teste de log-rank estratificado pela pontuação ECOG PS (0/1 ou 2) e visceral (ausente ou presente).
b A razão de risco é derivada do modelo estratificado de risco proporcional. Razão de risco < 1 favorece AA-P.
Figura 1: Gráfico de Sobrevida18 Global de Kaplan-Meier; População com Intenção de Tratamento (Estudo 212082PCR3011)
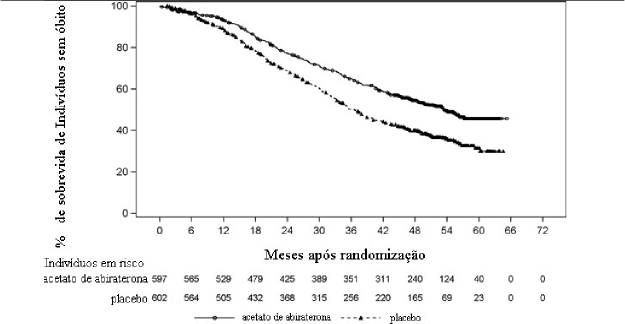
Nota: O acetato de abiraterona indica acetato de abiraterona mais prednisona
Análise de desfecho secundário de eficácia: tempo até o início da quimioterapia8
O tempo até o início da quimioterapia8 foi definido como o intervalo de tempo a partir da data de randomização até a data de início da quimioterapia8 para câncer6 de próstata7. A informação atualizada da análise final é apresentada na Tabela 2 e na Figura 2. O início da quimioterapia8 foi documentado para 25% dos indivíduos do grupo AA-P e 36% dos indivíduos do grupo placebo10. Houve uma redução de 49% no risco de iniciar a quimioterapia8 (RR = 0,508; IC 95%: 0,412, 0,627, p <0,0001). O tempo médio para o início da quimioterapia8 não foi alcançado no grupo AA-P e foi de 57,6 meses no grupo placebo10, demonstrando que o AA-P atrasou a necessidade de início da quimioterapia8. A taxa livre de eventos de 60 meses (ou seja, porcentagem dos indivíduos para os quais a quimioterapia8 não foi necessária em 5 anos após o início do tratamento do estudo) foi de 66% para AA-P versus 48% para o placebo10.
Tabela 2: Tempo até o início da quimioterapia8 - análise estratificada; População com Intenção de Tratamento (Estudo 212082PCR3011)
|
|
AA-P |
Placebo10 |
|
Indivíduos randomizados |
597 |
602 |
|
Evento |
150 (25,1%) |
218 (36,2%) |
|
Censurados |
447 (74,9%) |
384 (63,8%) |
|
Tempo para o evento (meses) |
|
|
|
25 º percentil (IC 95%) |
36,63 (30,16; 44,45) |
18,63 (16,07; 21,22) |
|
Mediana (IC 95%) |
NE (62,62; NE) |
57,59 (38,18; NE) |
|
75º percentil (IC 95%) |
NE (NE; NE) |
NE (NE; NE) |
|
Alcance |
(0,1+; 64,2+) |
(1,4+; 64,6+) |
|
Taxa livre de eventos de 6 meses (IC 95%) |
0,988 (0,975; 0,994) |
0,945 (0,923; 0,961) |
|
Taxa livre de eventos de 12 meses (IC 95%) |
0,951 (0,930; 0,966) |
0,857 (0,825; 0,884) |
|
Taxa livre de eventos de 18 meses (IC 95%) |
0,899 (0,871; 0,922) |
0,766 (0,727; 0,800) |
|
Taxa livre de eventos de 24 meses (IC 95%) |
0,847 (0,812; 0,875) |
0,675 (0,631; 0,715) |
|
Taxa livre de eventos de 30 meses (IC 95%) |
0,791 (0,752; 0,824) |
0,605 (0,558; 0,649) |
|
Taxa livre de eventos de 36 meses (IC 95%) |
0,755 (0,714; 0,791) |
0,563 (0,514; 0,609) |
|
Taxa livre de eventos de 42 meses (IC 95%) |
0,721 (0,678; 0,760) |
0,526 (0,475; 0,574) |
|
Taxa livre de eventos de 48 meses (IC 95%) |
0,693 (0,647; 0,733) |
0,515 (0,464; 0,563) |
|
Taxa livre de eventos de 54 meses (IC 95%) |
0,667 (0,618; 0,711) |
0,501 (0,447; 0,552) |
|
Taxa livre de eventos de 60 meses (IC 95%) |
0,660 (0,610; 0,705) |
0,481 (0,417; 0,542) |
|
Valor de pa |
<0,0001 |
|
| Razão de risco (IC 95%)b | 0,508 (0,412; 0,627) |
Nota: + = observação censurada,
NE = não estimável.
a O valor de p é derivado do teste de log-rank estratificado pela pontuação ECOG PS (0/1 ou 2) e visceral (ausente ou presente).
b A razão de risco é derivada do modelo estratificado de risco proporcional. Razão de risco <1 favorece AA-P.
Figura 2: Gráfico de tempo até o início da quimioterapia8 de Kaplan-Meier; População com Intenção de Tratamento (Estudo 212082PCR3011)
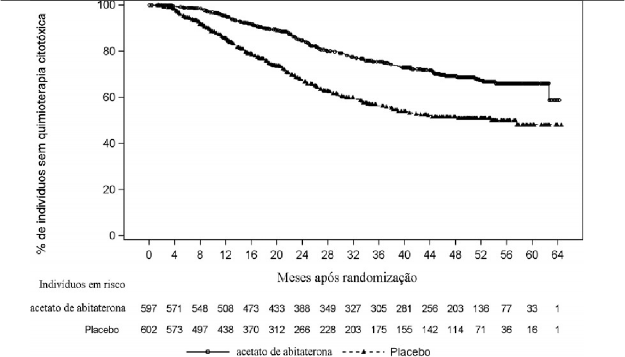
Nota: O acetato de abiraterona indica acetato de abiraterona mais prednisona
Tempo até a terapia subsequente que prolonga a vida para o câncer6 de próstata7
O tempo até a terapia subsequente que prolonga a vida para o câncer6 de próstata7 (ou seja, docetaxel, cabazitaxel, acetato de abiraterona, enzalutamida, sipuleucel-T e rádio24-223) é resumida para a análise final na Tabela 3 e na Figura 3. Havia 29% dos indivíduos no grupo AA-P e 45% dos indivíduos no grupo placebo10 que receberam terapia subsequente que prolonga a vida. A mediana de tempo até a terapia subsequente não foi alcançada no grupo AA-P e foi de 29,6 meses nos grupos placebo10, demonstrando que o AA-P retardou a necessidade de início de terapia subsequente que prolonga a vida (RR = 0,431; IC 95%: 0,356, 0,522, p <0,0001). A taxa livre de eventos em 60 meses foi de 60% para AA-P e 37% para placebo10.
Tabela 3: Tempo até a terapia subsequente que prolonga a vida para o câncer6 de próstata7 – análise estratificada; População com Intenção de Tratamento (Estudo 212082PCR3011)
|
|
AA-P |
Placebo10 |
|
Indivíduos randomizados |
597 |
602 |
|
Evento |
176 (29,5%) |
273 (45,3%) |
|
Censurado |
421 (70,5%) |
329 (54,7%) |
|
Tempo para o evento (meses) |
|
|
|
25º percentil (IC 95%) |
30,62 (26,61; 34,99) |
14,85 (13,21; 16,66) |
|
Mediana (IC 95%) |
NE (60,78; NE) |
29,63 (25,86; 34,99) |
|
75º percentil (IC 95%) Alcance |
NE (NE; NE) (0,1+; 64,2+) |
NE (NE; NE) (1,4+; 63,8+) |
|
Taxa livre de eventos de 6 meses (IC 95%) |
0,988 (0,975; 0,994) |
0,938 (0,915; 0,955) |
|
Taxa livre de eventos de 12 meses (IC 95%) Taxa livre de eventos de 18 meses (IC 95%) |
0,946 (0,924; 0,962) 0,888 (0,858; 0,912) |
0,822 (0,787; 0,852) 0,685 (0,643; 0,724) |
|
Taxa livre de eventos de 24 meses (IC 95%) |
0,819 (0,782; 0,849) |
0,577 (0,531; 0,620) |
|
Taxa livre de eventos de 30 meses (IC 95%) |
0,754 (0,713; 0,790) |
0,494 (0,446; 0,540) |
|
Taxa livre de eventos de 36 meses (IC 95%) |
0,709 (0,665; 0,747) |
0,439 (0,390; 0,486) |
|
Taxa livre de eventos de 42 meses (IC 95%) |
0,671 (0,625; 0,712) |
0,408 (0,360; 0,457) |
|
Taxa livre de eventos de 48 meses (IC 95%) |
0,651 (0,604; 0,693) |
0,388 (0,339; 0,437) |
|
Taxa livre de eventos de 54 meses (IC 95%) |
0,621 (0,572; 0,666) |
0,388 (0,339; 0,437)
|
|
Taxa livre de eventos de 60 meses (IC 95%) |
0,599 (0,546;0,648) | 0,367 (0,305; 0,429) |
|
Valor de pa |
<0,0001 |
|
|
Razão de risco (IC 95%)b |
0,431 (0,356; 0,522) |
Nota: + = observação censurada,
NE = não estimável.
a O valor de p é derivado do teste de log-rank estratificado pela pontuação ECOG PS (0/1 ou 2) e visceral (ausente ou presente).
b A razão de risco é derivada do modelo estratificado de risco proporcional. Razão de risco <1 favorece AA-P.
Terapias que prolongam a vida incluem: docetaxel, cabazitaxel, acetato de abiraterona, enzalutamide, sipuleucel-T e Ra-223.
Figura 3: Gráfico de tempo até a terapia subsequente que prolonga a vida para o câncer6 de próstata7 de Kaplan-Meier; População com Intenção de Tratamento (Estudo 212082PCR3011)
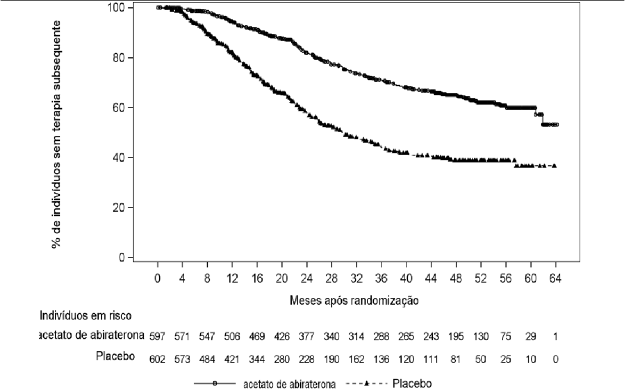
Terapias que prolongam a vida incluem: docetaxel, cabazitaxel, acetato de abiraterona mais prednisona, enzalutamida, sipuleucel-T e rádio24-223.
Nota: O acetato de abiraterona indica acetato de abiraterona mais prednisona
Tempo até a progressão da dor
O tempo até à progressão da dor foi definido como o intervalo de tempo desde a randomização até à primeira data em que um indivíduo apresentou um aumento de .= 30% em relação à linha de base na pior intensidade de dor no BPI-SF (Item 3) observada em 2 avaliações consecutivas com intervalo de ≥ 4 semanas. Dados atualizados do tempo até a progressão da dor na análise final são apresentados na Tabela 4 e na Figura 4. A progressão da dor foi documentada em 41% dos indivíduos do grupo AA-P e 49% dos indivíduos do grupo placebo10. Houve redução de 28% no risco de progressão da dor (RR = 0,721; IC 95%: 0,607, 0,857; p = 0,0002). A mediana de tempo para a progressão da dor foi de 47,4 meses no grupo AA-P e 16,6 meses no grupo placebo10. A taxa livre de eventos em 48 meses foi de 50% para AA-P e 39% para o grupo placebo10.
Tabela 4: Tempo até a Progressão da Dor (BPI3) - Análise Estratificada; População com Intenção de Tratamento (Estudo 212082PCR3011)
|
|
AA-P |
Placebo10 |
|
Indivíduos randomizados |
597 |
602 |
| Evento | 245 (41,0%) | 292 (48,5%) |
|
Censurados |
352 (59,0%) |
310 (51,5%) |
|
Tempo para o evento (meses) |
|
|
|
25°percentil (IC 95%) |
4,67 (2,89; 6,47) |
2,79 (2,73; 3,71) |
|
Mediana (IC 95%) |
47,41 (33,15; NE) |
16,62 (11,07; 23,95) |
|
75º percentil (IC 95%) |
NE (NE; NE) |
NE (NE; NE) |
|
Alcance |
(0,0+; 60,7+) |
(0,0+; 55,8+) |
|
Taxa livre de eventos de 6 meses (IC 95%) |
0,723 (0,685; 0,758) |
0,635 (0,594; 0,673) |
|
Taxa livre de eventos de 12 meses (IC 95%) |
0,630 (0,588; 0,669) |
0,534 (0,490; 0,575) |
|
Taxa livre de eventos de 18 meses (IC 95%) |
0,603 (0,560; 0,643) |
0,496 (0,451; 0,540) |
|
Taxa livre de eventos de 24 meses (IC 95%) |
0,577 (0,533; 0,618) |
0,448 (0,400; 0,495) |
|
Taxa livre de eventos de 30 meses (IC 95%) |
0,556 (0,510; 0,598) |
0,417 (0,367; 0,467) |
|
Taxa livre de eventos de 36 meses (IC 95%) |
0,541 (0,495; 0,585) |
0,410 (0,358; 0,461) |
|
Taxa livre de eventos de 42 meses (IC 95%) |
0,526 (0,478; 0,572) | 0,410 (0,358; 0,461) |
|
Taxa livre de eventos de 48 meses (IC 95%) |
0,499 (0,439; 0,557) |
0,388 (0,324; 0,451) |
|
Taxa livre de eventos de 54 meses (IC 95%) |
0,499 (0,439; 0,557) |
0,388 (0,324; 0,451) |
|
Taxa livre de eventos de 60 meses (IC 95%) |
0,499 (0,439; 0,557) |
NE (NE; NE) |
|
Valor de pa |
0,0002 |
|
|
Razão de risco (IC 95%)b |
0,721 (0,607; 0,857) |
Nota: + = observação censurada,
NE = não estimável.
a O valor de p é derivado do teste de log-rank estratificado pela pontuação ECOG PS (0/1 ou 2) e visceral (ausente ou presente).
b A razão de risco é derivada do modelo estratificado de risco proporcional. Razão de risco <1 favorece AA-P.
Figura 4: Gráfico de tempo até a progressão da dor (BPI3) de Kaplan-Meier; População com Intenção de Tratamento (Estudo 212082PCR3011)
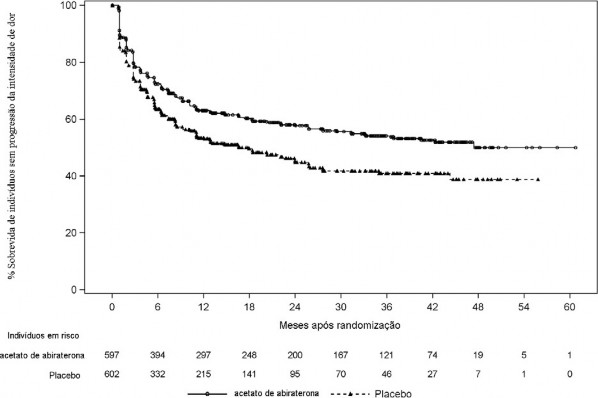
Nota: O acetato de abiraterona indica acetato de abiraterona mais prednisona
Tempo até evento relacionado ao esqueleto22
O tempo até evento relacionado ao esqueleto22 foi definido como o mais precoce dos seguintes: fratura25 clínica ou patológica, compressão da medula espinhal26, radiação paliativa ao osso ou cirurgia óssea. As informações atualizadas na análise final do tempo para evento relacionado ao esqueleto22 estão apresentadas na Tabela 5 e na Figura 5. Os eventos relacionados ao esqueleto22 foram relatados em 22% dos indivíduos no grupo AA-P e em 25% dos indivíduos no grupo placebo10. Houve uma redução de 24% no risco de evento relacionado ao esqueleto22 (RR = 0,759; IC 95%: 0,601, 0,960; p = 0,0208). O 25º percentil do tempo para evento relacionado ao esqueleto22 foi de 43,0 meses para o grupo AA-P e 31,3 meses para o grupo placebo10. A taxa livre de eventos aos 60 meses foi de 71% para AA-P e 64% para o placebo10.
Tabela 5: Tempo até Evento Relacionado ao Esqueleto22 - Análise Estratificada; População com Intenção de Tratamento (Estudo 212082PCR3011)
|
|
AA-P |
Placebo10 |
|
Indivíduos randomizados |
597 |
602 |
|
Evento |
133 (22,3%) |
150 (24,9%) |
|
Censurados |
464 (77,7%) |
452 (75,1%) |
|
Tempo para o evento (meses) |
|
|
|
25°percentil (IC 95%) |
43,04 (34,56; 53,52) |
31,34 (23,29; 41,92) |
|
Mediana (IC 95%) |
NE (NE; NE) |
NE (NE; NE) |
|
75º percentil (IC 95%) |
NE (NE; NE) |
NE (NE; NE) |
|
Alcance |
(0,1; 64,2+) |
(0,8; 64,6+) |
|
Taxa livre de eventos de 6 meses (IC 95%) |
0,965 (0,947; 0,977) |
0,945 (0,924; 0,961) |
|
Taxa livre de eventos de 12 meses (IC 95%) |
0,935 (0,911; 0,952) |
0,877 (0,847; 0,902) |
|
Taxa livre de eventos de 18 meses (IC 95%) |
0,892 (0,863; 0,915) |
0,827 (0,792; 0,856) |
|
Taxa livre de eventos de 24 meses (IC 95%) |
0,841 (0,807; 0,870) |
0,786 (0,748; 0,819) |
|
Taxa livre de eventos de 30 meses (IC 95%) |
0,807 (0,770; 0,839) |
0,753 (0,712; 0,789) |
|
Taxa livre de eventos de 36 meses (IC 95%) Taxa livre de eventos de 42 meses (IC 95%) |
0,783 (0,743; 0,817) 0,753 (0,711; 0,790) |
0,728 (0,685; 0,767) 0,707 (0,662; 0,748) |
|
Taxa livre de eventos de 48 meses (IC 95%) |
0,736 (0,692; 0,774) |
0,674 (0,625; 0,718) |
|
Taxa livre de eventos de 54 meses (IC 95%) |
0,706 (0,658; 0,748) |
0,667 (0,616; 0,713) |
|
Taxa livre de eventos de 60 meses (IC 95%) |
0,706 (0,658; 0,748) |
0,643 (0,584; 0,697) |
|
Valor de pa |
0,0208 |
|
| Razão de risco (IC 95%)b | 0,759 (0,601; 0,960) |
Nota: + = observação censurada,
NE = não estimável.
a O valor de p é derivado do teste de log-rank estratificado pela pontuação ECOG PS (0/1 ou 2) e visceral (ausente ou presente).
b A razão de risco é derivada do modelo estratificado de risco proporcional. Razão de risco <1 favorece AA-P.
Figura 5: Gráfico de tempo até evento relacionado ao esqueleto22 de Kaplan-Meier; População com Intenção de Tratamento (Estudo 212082PCR3011)
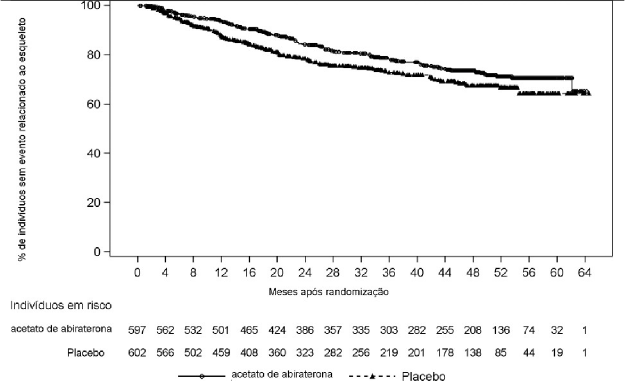
Nota: O acetato de abiraterona indica acetato de abiraterona mais prednisona
Tempo até a progressão do PSA
O tempo até a progressão do PSA foi definido como o intervalo de tempo a partir da data de randomização até a data da progressão do PSA, de acordo com os critérios do Prostate Cancer6 Working Group 2 (PCWG2). No momento desta análise final, a progressão do PSA foi documentada em 46% dos indivíduos no grupo AA-P e em 74% dos indivíduos no grupo placebo10 (Tabela 6 e Figura 6). O tratamento com AA-P diminuiu de forma estatisticamente significativa o risco de progressão do PSA em 69% comparado ao placebo10 (RR = 0,310; IC 95%: 0,266, 0,363; p <0,0001). A mediana de tempo até a progressão do PSA foi de 33,3 meses no grupo AA-P e de 7,4 meses no grupo placebo10, um atraso na progressão do PSA > 25 meses no grupo AA-P em comparação ao grupo placebo10. Como mostrado na Figura 6, esta separação continuou ao longo do tempo avaliado. A taxa livre de eventos aos 60 meses foi de 42% para AA-P e 11% para o placebo10.
Tabela 6: Tempo até a Progressão do PSA - Análise Estratificada; População com Intenção de Tratamento (Estudo 212082PCR3011)
|
|
AA-P |
Placebo10 |
|
Indivíduos randomizados |
597 |
602 |
|
Evento |
273 (45,7%) |
448 (74,4%) |
|
Censurado |
324 (54,3%) |
154 (25,6%) |
|
Tempo para o evento (meses) |
||
|
25º percentil (IC 95%) |
12,71 (10,15; 14,75) |
3,75 (3,71; 4,63) |
|
Mediana (IC 95%) |
33,31 (29,44; 46,09) |
7,43 (7,20; 9,20) |
|
75º percentil (IC 95%) |
NE (NE; NE) |
18,37 (14,82; 20,30) |
|
Alcance |
(0,0+; 64,2+) |
(0,0+; 62,1+) |
|
Taxa livre de eventos de 6 meses (IC 95%) |
0,885 (0,856; 0,909) |
0,616 (0,574; 0,656) |
|
Taxa livre de eventos de 12 meses (IC 95%) |
0,751 (0,712; 0,785) |
0,356 (0,315; 0,397) |
|
Taxa livre de eventos de 18 meses (IC 95%) |
0,665 (0,623; 0,704) |
0,254 (0,217; 0,293) |
|
Taxa livre de eventos de 24 meses (IC 95%) |
0,577 (0,532; 0,618) |
0,184 (0,151; 0,220) |
|
Taxa livre de eventos de 30 meses (IC 95%) |
0,527 (0,481; 0,570) |
0,140 (0,110; 0,174) |
|
Taxa livre de eventos de 36 meses (IC 95%) |
0,489 (0,443; 0,534) |
0,121 (0,092; 0,153) |
|
Taxa livre de eventos de 42 meses (IC 95%) Taxa livre de eventos de 48 meses (IC 95%) |
0,468 (0,422; 0,513) 0,453 (0,406; 0,498) |
0,112 (0,084; 0,144) 0,109 (0,081; 0,141) |
|
Taxa livre de eventos de 54 meses (IC 95%) |
0,430 (0,382; 0,478) |
0,109 (0,081; 0,141) |
|
Taxa livre de eventos de 60 meses (IC 95%) |
0,423 (0,373; 0,472) |
0,109 (0,081; 0,141) |
|
Valor de pa |
<0,0001 |
|
| Razão de risco (IC 95%)b | 0,310 (0,266; 0,363) | |
Nota: + = observação censurada,
NE = não estimável.
a O valor de p é derivado do teste de log-rank estratificado pela pontuação ECOG PS (0/1 ou 2) e visceral (ausente ou presente).
b A razão de risco é derivada do modelo estratificado de risco proporcional. Razão de risco <1 favorece AA-P.
Figura 6: Gráfico de Progressão do PSA de Kaplan-Meier; População com Intenção de Tratamento (Estudo 212082PCR3011)
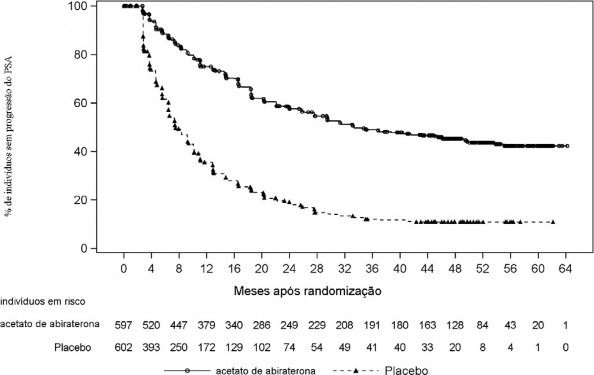
Nota: O acetato de abiraterona indica acetato de abiraterona mais prednisona
Estudo 302 (pacientes assintomáticos ou levemente sintomáticos que não receberam quimioterapia8 prévia)
No Estudo 302, (n = 1.088) a mediana de idade dos pacientes incluídos foi de 71 anos para os pacientes tratados com acetato de abiraterona associado à prednisona ou prednisolona e 70 anos para os pacientes tratados com placebo10 mais prednisona ou prednisolona. O “performance status ECOG” (Eastern Cooperative Oncology Group) era de 0 em 76% dos pacientes e de 1 em 24% dos pacientes em ambos braços. Os pacientes com metástase27 visceral foram excluídos. Os desfechos de eficácia coprimários foram sobrevida18 global e sobrevida18 livre de progressão radiográfica (rPFS). Uma avaliação de dor na linha de base foi de 0-1 (assintomático) em 66% pacientes e 2-3 (levemente sintomático28) em 26% dos pacientes, conforme definido pelo Formulário Abreviado da Dor (Brief Pain Inventory-Short Form) (pior dor ao longo das últimas 24 horas). Além da avaliação dos desfechos coprimários, a eficácia também foi avaliada observando-se o tempo até o uso de opiáceos para o controle da dor oncológica, o tempo para início de quimioterapia8 citotóxica, o tempo para queda no escore de “performance status ECOG” em ≥ 1 ponto e o tempo para progressão do PSA conforme os critérios do “Prostate Cancer6 Working Group-2” (PCWG2).
No Estudo 302, os tratamentos foram descontinuados no momento de progressão clínica inquestionável. Os tratamentos também podiam ser descontinuados no momento de progressão radiográfica confirmada, a critério do investigador.
A sobrevida18 livre de progressão radiográfica (rPFS) foi avaliada empregando-se exames de imagens sequenciais, definidas pelos critérios de PCWG2 (para lesões12 ósseas) e “Response Evaluation Criteria In Solid Tumors” (RECIST) modificado (para lesões12 em partes moles). A análise da rPFS utilizou uma avaliação da progressão radiográfica revisada em laboratório central.
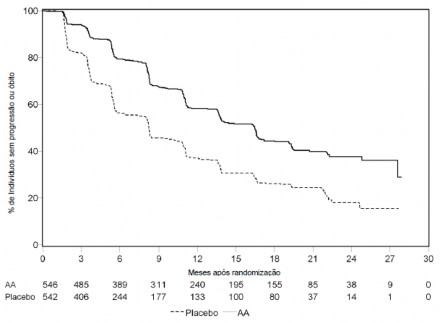
Na análise de rPFS planejada houveram 401 eventos; 150 (28%) em pacientes tratados com acetato de abiraterona e 251 (46%) dos pacientes tratados com placebo10 tiveram evidência radiográfica de progressão ou vieram a óbito20. Uma diferença significativa na rPFS entre os grupos de tratamento foi observada (vide Tabela 7 e Figura 7).
Tabela 7: Estudo 302 - Sobrevida18 Livre de Progressão Radiográfica em pacientes tratados com acetato de abiraterona ou placebo10 em combinação com prednisona ou prednisolona associados a agonistas de LHRH ou orquiectomia14 prévia.
|
|
acetato de abiraterona |
Placebo10 |
|
Sobrevida18 Livre de Progressão Radiográfica (rPFS) |
||
|
Progressão ou óbito20 |
150 (28%) |
251 (46%) |
|
mediana de rPFS em meses |
Não atingido |
8,3 |
| (IC de 95%) | (11,66; NE) | (8,12; 8,54) |
| Valor de p* | < 0,0001 | - |
|
Razão de risco** |
0,425 |
- |
NE = Não Estimado;
* O valor de p é derivado de um teste de log-rank estratificado pelo escore ECOG basal (0 ou 1);
** Razão de risco (HR) <1 favorece acetato de abiraterona.
Figura 7: Curvas de sobrevida18 livre de progressão radiográfica pelo método de Kaplan-Meier em pacientes tratados com acetato de abiraterona ou placebo10 em combinação com prednisona ou prednisolona associado a agonistas de LHRH ou orquiectomia14 prévia.
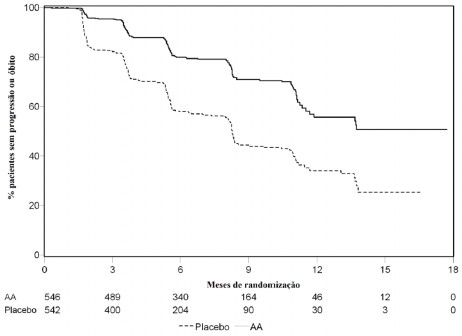
AA = acetato de abiraterona
Entretanto, os dados dos indivíduos continuaram a ser coletados até a data da segunda análise interina de sobrevida18 global (OS). Na Tabela 8 e Figura 8 é apresentada a revisão radiográfica do investigador da rPFS, realizada como uma análise sensitiva de seguimento.
Seiscentos e sete (607) indivíduos tiveram progressão radiográfica ou vieram a óbito20: 271 (50%) no grupo do acetato de abiraterona e 336 (62%) no grupo placebo10. O tratamento com acetato de abiraterona reduziu o risco de progressão radiográfica ou óbito20 em 47% comparado com placebo10 (Razão de Risco = 0,530; IC de 95%: [0,451; 0,623], p < 0,0001). A mediana de rPFS foi de 16,5 meses no grupo acetato de abiraterona e 8,3 meses no grupo placebo10.
Tabela 8: Estudo 302 - Sobrevida18 Livre de Progressão Radiográfica em pacientes tratados com acetato de abiraterona ou placebo10 em combinação com prednisona ou prednisolona associados a análogos de LHRH ou orquiectomia14 prévia (no momento da segunda análise interina de sobrevida18 global – revisão do investigador).
|
|
acetato de abiraterona |
Placebo10 |
|
Sobrevida18 Livre de Progressão Radiográfica (rPFS) |
||
|
Progressão ou óbito20 |
271 (50%) |
336 (62%) |
|
Mediana de rPFS em meses |
16,5 |
8,3 |
|
Valor de p* |
< 0,0001 |
|
|
Razão de risco** |
0,530 |
|
* O valor de p é derivado de um teste de log-rank estratificado pelo escore ECOG basal (0 ou 1);
** Razão de risco <1 favorece acetato de abiraterona.
Figura 8: Curvas de sobrevida18 livre de progressão radiográfica pelo método de Kaplan-Meier em pacientes tratados com acetato de abiraterona ou placebo10 em combinação com prednisona ou prednisolona associado a análogos de LHRH ou orquiectomia14 prévia (no momento da segunda análise interina de sobrevida18 global – revisão do investigador).
AA = acetato de abiraterona
Foi realizada uma análise interina (IA) da sobrevida18 global planejada após a ocorrência de 333 óbitos. O estudo foi aberto com base na magnitude do benefício clínico observado e aos pacientes no grupo placebo10 foram oferecidos tratamento com acetato de abiraterona. A sobrevida18 global foi maior para acetato de abiraterona do que para placebo10, com uma redução de 25% no risco de morte (RR = 0,752, IC 95%: [0,606; 0,934], p = 0,0097), mas os resultados interinos da sobrevida18 global não estavam maduros e não atingiram os limites pré-especificados para significância estatística (vide Tabela 9). A sobrevida18 continuou a ser seguida após esta IA.
A análise final para OS planejada foi realizada após 741 óbitos observados (mediana de acompanhamento de 49 meses). Sessenta e cinco por cento (354 de 546) dos pacientes tratados com acetato de abiraterona, em comparação com 71% (387 de 542) dos pacientes tratados com placebo10, evoluíram para óbito20. Foi demonstrado um benefício estatisticamente significativo da OS a favor do grupo tratado com acetato de abiraterona com uma redução de 19,4% no risco de morte (RR = 0,806; IC 95%: [0,697; 0,931], p = 0,0033) e uma melhora na mediana de OS de 4,4 meses (acetato de abiraterona 34,7 meses, placebo10 30,3 meses) (vide Tabela 9 e Figura 9). Esta melhora foi demonstrada apesar da terapêutica29 subsequente ser comum, independentemente se os pacientes receberam inicialmente acetato de abiraterona ou placebo10. As terapias subsequentes nos grupos de pacientes de acetato de abiraterona e placebo10 incluíram acetato de abiraterona, 69 (13%) e 238 (44%); docetaxel, 311 (57%) e 331 (61%); cabazitaxel, 100 (18%) e 105 (19%); e enzalutamida 87 (16%) e 54 (10%) pacientes respectivamente.
Tabela 9: Estudo 302 - Sobrevida18 Global em pacientes tratados com acetato de abiraterona ou placebo10 em combinação com prednisona ou prednisolona associados a agonistas de LHRH ou orquiectomia14 prévia.
|
|
acetato de abiraterona |
Placebo10 (n= 542) |
|
Análise Interina de Sobrevida18 |
||
|
Óbito20 |
147 (27%) |
186 (34%) |
|
Sobrevida18 global mediana em meses (IC de 95%) |
Não atingido (NE; NE) |
27,2 (25,95; NE) |
|
Valor de p* |
0,0097 |
|
|
Razão de risco** (IC de 95%) |
0,752 (0,606; 0,934) |
|
|
Análise Final de Sobrevida18 |
||
|
Óbito20 |
354 (65%) |
387 (71%) |
|
Sobrevida18 global mediana em meses (IC de 95%) |
34,7 (32,7; 36,8) |
30,3 (28,7; 33,3) |
|
Valor de p* |
0,0033 |
|
|
Razão de risco** (IC de 95%) |
0,806 (0,697; 0,931) |
|
NE = Não Estimado;
* O valor de p é derivado de um teste de log-rank estratificado pelo escore ECOG basal (0 ou 1);
** Razão de risco <1 favorece acetato de abiraterona.
Figura 9: Curvas de sobrevida18 pelo método de Kaplan-Meier em pacientes tratados com acetato de abiraterona ou placebo10 em combinação com prednisona ou prednisolona associados a agonistas de LHRH ou orquiectomia14 prévia, Análise final
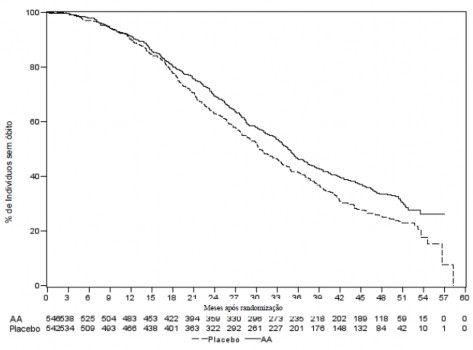
AA = acetato de abiraterona
As análises de subgrupos favorecem consistentemente o tratamento com acetato de abiraterona (vide Figura 10).
Figura 10: Sobrevida18 Global por Subgrupo: Razão de Risco e Intervalo de Confiança de 95%
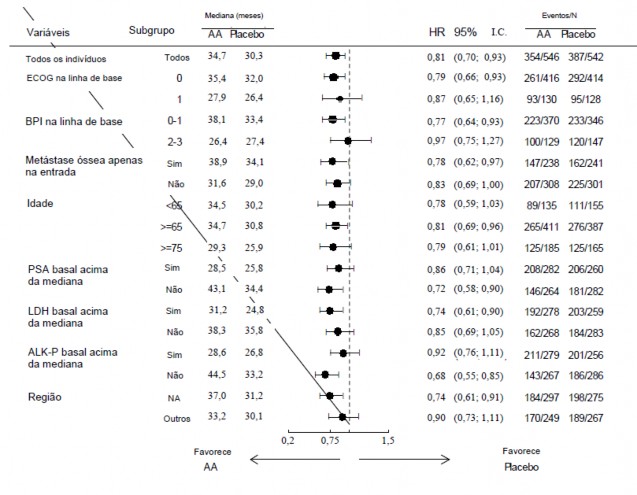
AA = acetato de abiraterona;
ALK-P = fosfatase alcalina30;
BPI = Inventário Breve da Dor;
IC = intervalo de confiança;
ECOG = escore de desempenho do “Eastern Cooperative Oncology Group”;
HR = razão de risco;
LDH = desidrogenase lática31;
NA = América do Norte;
NE = não estimável.
Além das melhoras observadas na sobrevida18 global e rPFS foram observados benefícios do tratamento com acetato de abiraterona quando comparado ao placebo10 em todas as medidas de desfechos secundários prospectivamente definidas, como segue:
Tempo para progressão do PSA, de acordo com os critérios PCWG2: o tempo mediano para a progressão do PSA foi de 11,1 meses para pacientes32 que receberam acetato de abiraterona e 5,6 meses para os pacientes que receberam placebo10 (Razão de risco = 0,488; IC 95%: [0,420; 0,568], p < 0,0001). O tempo para a progressão do PSA foi aproximadamente o dobro no grupo tratado com acetato de abiraterona (Razão de risco = 0,488). A proporção de indivíduos com resposta confirmada de PSA foi maior no grupo de acetato de abiraterona do que no grupo placebo10 (62% versus 24%; p < 0,0001).
Tempo para uso de opiáceos para dor oncológica: o tempo mediano para o uso de opiáceos para a dor causada pelo câncer6 de próstata7 no momento final da análise foi de 33,4 meses para pacientes32 recebendo acetato de abiraterona e foi de 23,4 meses para pacientes32 recebendo placebo10 (Razão de risco = 0,721; IC 95%: [0,614; 0,846], p < 0,0001).
Tempo para início de quimioterapia8 citotóxica: o tempo mediano para o início de quimioterapia8 citotóxica foi de 25,2 meses para os pacientes que receberam acetato de abiraterona e 16,8 meses para os pacientes que receberam placebo10 (Razão de risco = 0,580; IC 95% [0,487; 0,691], p < 0,0001).
Tempo para a piora do escore “performance status (ECOG)” em ≥ 1 ponto: o tempo mediano para piora do escore “performance status (ECOG)” em ≥ 1 ponto foi de 12,3 meses para pacientes32 que receberam acetato de abiraterona e 10,9 meses para os pacientes que receberam placebo10 (Razão de risco = 0,821; IC 95%: [0,714; 0,943], p = 0,0053).
Os seguintes desfechos do estudo demonstraram uma vantagem estatisticamente significativa em favor do tratamento com acetato de abiraterona:
Resposta objetiva: a resposta objetiva foi definida como a proporção de indivíduos com doença mensurável que atingiram uma resposta completa ou parcial, conforme critério RECIST (para ser considerado lesão33 alvo, o linfonodo34 deveria ter um tamanho ≥ 2 cm no período basal). A proporção de indivíduos com doença mensurável na linha de base que tiveram resposta objetiva foi de 36% no grupo de acetato de abiraterona e de 16% no grupo placebo10 (p < 0,0001).
Dor: o tratamento com acetato de abiraterona reduziu significativamente o risco de progressão da intensidade média da dor em 18% comparado com placebo10 (p = 0,0490). O tempo mediano para a progressão foi de 26,7 meses no grupo de acetato de abiraterona e 18,4 meses no grupo placebo10.
Tempo para degradação no FACT-P (escore total): o tratamento com acetato de abiraterona diminuiu o risco da degradação no FACT-P (escore total) em 22% comparado com placebo10 (p = 0,0028). O tempo mediano para a degradação no FACT-P (escore total) foi de 12,7 meses no grupo de acetato de abiraterona e 8,3 meses no grupo placebo10.
Estudo 301 (pacientes que receberam quimioterapia8 prévia)
Onze por cento (11%) dos pacientes incluídos no Estudo 301 tinham “performance status ECOG” (Eastern Cooperative Oncology Group) igual a 2; 70% tinham evidência radiográfica de progressão da doença com ou sem progressão do PSA; 70% haviam recebido um esquema de quimioterapia8 citotóxica anteriormente e 30% haviam recebido dois. Metástase27 hepática35 estava presente em 11% dos pacientes tratados com acetato de abiraterona. Foi recomendado que os pacientes continuassem recebendo os respectivos medicamentos do estudo até que houvesse progressão do PSA (25% de aumento confirmado em relação ao nível basal/nadir do paciente), em conjunto com a progressão radiográfica definida no protocolo e a progressão sintomática36 ou clínica. O desfecho primário de eficácia foi a sobrevida18 global.
Em uma análise planejada conduzida após a ocorrência de 552 óbitos, 42% (333 de 797) dos pacientes tratados com acetato de abiraterona morreram em comparação com 55% (219 de 398) dos pacientes tratados com placebo10. Uma melhora estatisticamente significativa na mediana da sobrevida18 global foi observada em pacientes tratados com acetato de abiraterona (vide Tabela 10 e Figura 11). Uma análise de sobrevida18 atualizada foi conduzida quando 775 óbitos foram observados (97% do número planejado de óbitos para a análise final). Os resultados desta análise de sobrevida18 atualizada foram consistentes com a primeira análise de sobrevida18 (vide Tabela 10).
Tabela 10: Estudo 301 - Sobrevida18 global de pacientes tratados com acetato de abiraterona ou placebo10 em combinação com prednisona ou prednisolona associados a agonistas de LHRH ou orquiectomia14 prévia.
|
|
acetato de abiraterona |
Placebo10 |
|
Análise de Sobrevida18 Primária |
||
|
Óbitos |
333 (42%) |
219 (55%) |
|
Sobrevida18 global mediana em meses (IC de 95%) |
14,8 (14,1; 15,4) |
10,9 (10,2; 12,0) |
|
Valor de p |
<0,0001 |
- |
|
Razão de risco* (IC de 95%) |
0,646 (0,543; 0,768) |
- |
|
Análise de Sobrevida18 Atualizada |
||
|
Óbitos |
501 (63%) |
274 (69%) |
|
Sobrevida18 global mediana, em meses (IC de 95%) |
15,8 (14,8; 17,0) |
11,2 (10,4; 13,1) |
|
Razão de risco* (IC de 95%) |
0,740 (0,638; 0,859) |
- |
* Razão de risco <1 favorece acetato de abiraterona.
Em todos os pontos de avaliação após os primeiros meses de tratamento, uma proporção maior de pacientes tratados com acetato de abiraterona continuava viva em comparação com a proporção de pacientes tratados com placebo10 (vide Figura 11).
Figura 11: Curvas de sobrevida18 pelo método de Kaplan-Meier de pacientes tratados com acetato de abiraterona ou placebo10 em combinação com prednisona ou prednisolona associados a agonistas de LHRH ou orquiectomia14 prévia.
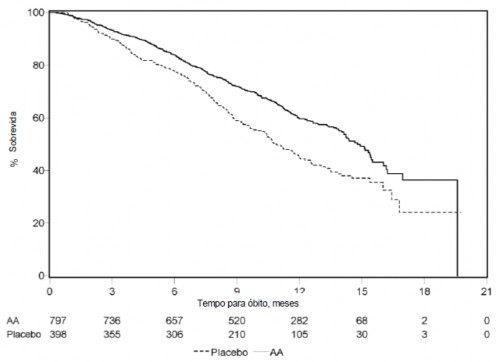
AA = acetato de abiraterona
As análises de sobrevida18 por subgrupo mostraram um benefício consistente de sobrevida18 para o tratamento com acetato de abiraterona (vide Figura 12).
Figura 12: Sobrevida18 global por subgrupo: Razão de risco e intervalo de confiança de 95%.
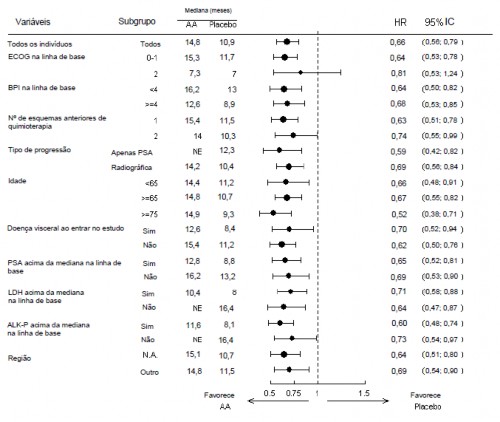
AA = acetato de abiraterona;
ALK-P = fosfatase alcalina30;
BPI = Inventário Breve da Dor;
IC = intervalo de confiança;
ECOG = escore de desempenho do “Eastern Cooperative Oncology Group”;
HR = razão de risco (do inglês Hazard Ratio);
LDH = desidrogenase lática31;
NA = América do Norte;
NE = não avaliável
Além da melhora observada na sobrevida18 global, todos os desfechos secundários do estudo favoreceram acetato de abiraterona e foram estatisticamente significativos depois do ajuste para multiplicidade como segue:
Os pacientes que receberam acetato de abiraterona demonstraram uma taxa de resposta do PSA total significativamente maior (definida como redução ≥ 50% em relação à linha de base) em comparação com os pacientes que receberam o placebo10: 38% versus 10%, p<0,0001.
O tempo mediano para progressão do PSA foi 10,2 meses para os pacientes tratados com acetato de abiraterona e 6,6 meses para os pacientes tratados com placebo10 (Razão de risco = 0,580; IC 95%: [0,462; 0,728], p<0,0001).
A mediana de sobrevida18 livre de progressão radiográfica foi 5,6 meses para os pacientes tratados com acetato de abiraterona e 3,6 meses para os pacientes que receberam placebo10 (Razão de risco = 0,673; IC 95%: [0,585; 0,776], p<0,0001).
Dor
A proporção de pacientes com alívio da dor foi maior e estatisticamente significativo no grupo acetato de abiraterona comparado ao grupo placebo10 (44% versus 27%, p=0,0002). Um paciente com resposta para alívio da dor foi definido como aquele paciente que apresentou redução de pelo menos 30% no escore de intensidade da pior dor durante as últimas 24 horas pelo Inventário Breve da Dor (BPI-SF) em relação à linha de base sem aumento do escore de uso de analgésicos37 observado em duas avaliações consecutivas com 4 semanas de intervalo. Apenas pacientes com escore de dor ≥ 4 na linha de base e pelo menos um escore de dor depois da linha de base foram analisados (n=512) quanto ao alívio da dor.
Uma proporção menor de pacientes tratados com acetato de abiraterona apresentou progressão da dor em comparação aos pacientes tomando placebo10 em 6 (22% versus 28%), 12 (30% versus 38%) e 18 meses (35% versus 46%). Progressão da dor foi definida como um aumento ≥ 30% no escore de intensidade da pior dor nas últimas 24 horas pelo BPI-SF da linha de base, sem diminuição do escore de uso de analgésicos37 observado em duas visitas consecutivas ou um aumento ≥ 30% no escore de uso de analgésicos37 em duas visitas consecutivas. O tempo para progressão da doença no 25º percentil foi 7,4 meses no grupo acetato de abiraterona versus 4,7 meses no grupo placebo10.
Eventos relacionados ao esqueleto22
Uma proporção menor de pacientes no grupo acetato de abiraterona teve eventos relacionados ao esqueleto22 em comparação ao grupo placebo10 em 6 meses (18% versus 28%), 12 meses (30% versus 40%) e 18 meses (35% versus 40%). O tempo para o primeiro evento relacionado ao esqueleto22 no 25º percentil no grupo acetato de abiraterona foi duas vezes maior em relação ao grupo controle no tempo 9,9 meses versus 4,9 meses. Um evento relacionado ao esqueleto22 foi definido como uma fratura25 patológica, compressão da medula espinhal26, radiação paliativa no osso ou cirurgia óssea.
Referências
- H. I. Scher, C. Logothetis, A. Molina, et al. Improved survival outcomes in clinically relevant patient subgroups from COU-AA-301, a phase III study of abiraterone acetate (AA) plus prednisone (P) in patients with metastatic castration-resistant prostate cancer6 (mCRPC) progressing after docetaxel-based chemotherapy. J Clin Oncol 29: 2011 (Suppl 7; Abstr 4).
- J.S. de Bono, C.J. Logothetis, K. Fizazi, et al. Abiraterone Acetate (AA) Plus Low Dose Prednisone (P) Improves Overall Survival (Os) In Patients (Pts) With Metastatic Castration Resistant Prostate Cancer6 (Mcrpc) Who Have Progressed After Docetaxel-Based Chemotherapy (Chemo): Results Of COU-AA-301, A Randomized Double-Blind Placebo10-Controlled Phase III. Study Annals of Oncology 21 (Suppl 8): viii1–viii12, LBA5, 2010.
- Adolfsson J, Steineck G, Hedlund PO. Deferred treatment of locally advanced non-metastatic prostate cancer6: a long-term follow-up. J Urol. 1999;161:505-508.
- Amit O, Mannino F, Stone AM, et al. Blinded independent central review of progression in cancer6. EU J Cancer6. 2011;47:1772-1778.
- Basch E, Jia X, Heller G, et al. Adverse symptom event reporting by patients versus clinicians: Relationship with clinical outcomes. J Natl Cancer6 Inst 2009;101:1624-1632.
- de Bono JS, Logothetis CJ, Molina A, et al. Abiraterone and increased survival in metastatic prostate cancer6. N Engl J Med. 2011;364:1995-2005.
- Fitzpatrick JM. Management of localized prostate cancer6 in senior38 adults: the crucial role of comorbidity. BJU Int. 2008;101 Suppl 2:16-22.
- Flamand V, Zini L, Salleron J, Fantoni J-C, Biserte J, Villers A. Observational survey on variations of prostate cancer6 incidence by stage in the Nord-Pas-de-Calais region between 1998 and 2004. Prog Urol. 2008;18:53-59.
- Gennari JF. Hypokalemia. NJEM. 1998. 339 (7); 451-458.
- Gravis G, Fiazzi, F, Joly F, et al. Androgen-deprivation therapy alone or with docetaxel in non-castrate metastatic prostate cancer6 (GETUG-AFU 15): a randomised, open-label, phase 3 trial. Lancet Oncol 2013;14:149-158.
- Guidelines for Preparing Core Clinical-Safety Information on Drugs. Second edition (Including New Proposals for Investigator's Brochures). Report of CIOMS Working Groups III (Revised) and V (New). CIOMS 1999.
- Thomson CS, Howard GCW, Stroner PL, Goodman CM, Windsor PM, Brewster DH. Patterns of referral, management and survival of patients diagnosed with prostate cancer6 in Scotland during 1988 and 1993: results of a national retrospective population-based audit. BJUI. 2001;87:339-347.
- Jack R, Davies EA, Moller H. Prostate cancer6 incidence, stage at diagnosis, treatment and survival in ethnic groups in South-East England. BJUI.2009;105:1226-1230.
- James ND, Spears MR, Clarke NW et al. Survival with Newly Diagnosed Metastatic Prostate Cancer6 in the "Docetaxel Era": Data from 917 Patients in the Control Arm of the STAMPEDE Trial (MRC PR08, CRUK/06/019). Eur Urol. 2015 Jun;67(6):1028-38.
- James ND, Sydes MR, Clarke NW et al. Addition of docetaxel, zolendronic acid, or both to first-line longterm hormone therapy in prostate cancer6 (STAMPEDE): survival results from an adaptive, multiarm, multistage, platform randomized controlled trial. Lancet. 2016; 387:1163-1177.
- Jonsson E, Sigbjarnarson H, Tomasson J, Benediktsdottir KR. Adenocarcinoma39 of the prostate in Iceland: a population-based study of stage, Gleason grade, treatment and long-term survival in males diagnosed between 1983 and 1987. Scandinavian Journal of Urology and Nephrology. 2006;40:265-271
- 17. Immediate versus deferred treatment for advanced prostatic cancer6: initial results of the Medical Research Council Trial. Medical Research Council (MRC) Prostate Cancer6 Working Party Investigators Group. Br J Urol. 1997;79:234-246.
- Merseburger AS, Alcaraz A, von Klot CA. Androgen deprivation therapy as backbone therapy in the management of prostate cancer6. OncoTargets and Therapy. 2016;9:7263-7274.
- Norgaard M, Jensen AO, Jacobsen JB, Cetin K, Fryzek JP, Sorensen HT. Skeletal related events, bone metastasis and survival of prostate cancer6: a population based cohort study in Denmark. J Urol. 2010;184:162-167.
- Parker C, Gillessen S, Heidenreich A, Horwich A, on behalf of the ESMO Guidelines Committee. Cancer6 of the prostate: ESMO clinical practice guidelines for diagnosis, treatment and follow-up. Annals Oncol. 2015;26(suppl 5): v69-v77.
- Quaglia A, Vercelli M, Puppo A. Prostate cancer6 in Italy before and during the ‘PSA era’: survival trend and prognostic determinants. Eur J Cancer6 Prev. 2003 Apr;12(2):145-52.
- Smith MR. Osteoporosis in men with prostate cancer6: now for the fracture data. J Clin Oncol. 2008;26(27):4371-4372.
- Sweeney CJ, Chen Y-H, Carducci M, et al. Chemohormonal therapy in metastatic hormone-sensitive prostate cancer6. N Engl J Med 2015; 373:737–746.
- Watkins PB, Seligman PJ, Pears JS, Avigan MI, Senior38 JR. Using controlled clinical trials to learn more about acute drug-induced liver injury. Hepatology 2008;48:1680-1689.
- Wilt T, Nair B, MacDonald R, Rutks I. Early vs. deferred androgen suppression in the treatment of advanced prostate cancer6. Cochrane Database System Rev 2002;(1):CD 3506.
CARACTERÍSTICAS FARMACOLÓGICAS
Propriedades Farmacodinâmicas
Mecanismo de ação: In vivo, o Abba (acetato de abiraterona) é convertido em abiraterona, um inibidor da biossíntese de androgênios. Especificamente, abiraterona inibe seletivamente a enzima40 17alfa-hidroxilase/C17,20-liase (CYP17). Esta enzima40 é expressa nos tecidos testicular, suprarrenal e do tumor41 prostático e é necessária para a biossíntese de androgênios nestes tecidos. Ela catalisa a conversão de pregnenolona e progesterona em precursores da testosterona, DHEA e androstenediona42, respectivamente, pela 17 alfa-hidroxilação e clivagem da ligação C17,20. A inibição da CYP17 também resulta em um aumento da produção de mineralocorticoides pelas suprarrenais (vide “Advertências e Precauções – Hipertensão16, hipopotassemia43 e retenção hídrica devido ao excesso de mineralocorticoides”).
O carcinoma44 prostático sensível aos androgênios responde ao tratamento que diminui os níveis de androgênios. Os tratamentos de privação de androgênios, tais como utilização de agonistas de LHRH ou orquiectomia14, diminuem a produção de androgênio nos testículos45, mas não afetam a produção de androgênios pelas suprarrenais ou no tumor41. O tratamento com Abba diminui a testosterona sérica para níveis não detectáveis (utilizando análises comerciais) quando administrado com agonistas de LHRH (ou orquiectomia14).
Efeitos farmacodinâmicos: Abba diminui a testosterona sérica e outros androgênios a níveis menores que aqueles alcançados com o uso de agonistas de LHRH isolados ou pela orquiectomia14. Isto é o resultado da inibição seletiva da enzima40 CYP17 necessária para a biossíntese de androgênios. O antígeno15 prostático específico (PSA) serve como um biomarcador em pacientes com câncer6 de próstata7. Em um estudo clínico Fase 3 em pacientes que falharam à quimioterapia8 anterior com taxanos, 38% dos pacientes tratados com acetato de abiraterona tiveram declínio de pelo menos 50% nos níveis de PSA em relação à linha de base comparado a 10% dos pacientes tratados com placebo10.
A concentração sérica de testosterona é reduzida dentro de 12 horas após a administração da primeira dose do medicamento.
Uso de Espironolactona: Nos estudos clínicos pivotais com acetato de abiraterona não se permitiu que os pacientes recebessem espironolactona uma vez que a mesma se liga ao receptor de androgênio e pode aumentar os níveis de PSA.
Propriedades Farmacocinéticas
Geral: Após a administração do acetato de abiraterona, a farmacocinética da abiraterona foi estudada em indivíduos saudáveis, pacientes com câncer6 de próstata7 avançado metastático e indivíduos sem câncer6 com insuficiência renal46 ou hepática35. In vivo, o acetato de abiraterona é rapidamente convertido em abiraterona, um inibidor da biossíntese de androgênios (vide “Características Farmacológicas – Mecanismo de Ação”).
Absorção: Depois da administração oral de Abba em jejum, o tempo para alcançar a concentração plasmática máxima da abiraterona é de aproximadamente 2 horas.
A administração de Abba com alimento, comparada com a administração em jejum, resulta em aumento de até 17 vezes na exposição sistêmica média da abiraterona, dependendo do conteúdo de gordura47 da refeição. Em função da variação comum do conteúdo e da composição das refeições, o uso de Abba com estas pode resultar em exposições altamente variáveis. Portanto, Abba não deve ser tomado com alimentos. Os comprimidos de Abba devem ser tomados em dose única com o estômago48 vazio. Abba deve ser tomado pelo menos duas horas depois da refeição e alimentos não podem ser ingeridos por pelo menos uma hora após tomar Abba. Os comprimidos devem ser deglutidos inteiros, com água (vide “Posologia e Modo de Usar”).
Distribuição e ligação às proteínas49: No plasma50 humano, a ligação da 14C-abiraterona às proteínas49 plasmáticas é de 99,8%. O volume aparente de distribuição é de aproximadamente 5.630L, sugerindo que a abiraterona é extensivamente distribuída para os tecidos periféricos.
Estudos in vitro demonstraram que o acetato de abiraterona é um inibidor da glicoproteína-P (P-gp). O Abba pode aumentar a exposição a medicamentos administrados concomitantemente, os quais são substratos da P-gp, entretanto, como o Abba é rapidamente convertido em abiraterona, não se espera inibição sistêmica da P-gP.
Metabolismo51: Após a administração oral de 14C-Abba na forma de cápsulas, o Abba é hidrolisado para abiraterona, a qual sofre metabolismo51 incluindo sulfatação, hidroxilação e oxidação, primariamente no fígado52. A maior parte da radioatividade circulante (aproximadamente 92%) é encontrada na forma de metabólitos53 de abiraterona. Entre os 15 metabólitos53 detectáveis, dois metabólitos53 principais, sulfato de abiraterona e sulfato de N-óxido abiraterona, representam aproximadamente 43% da radioatividade total cada um.
Eliminação: A meia-vida média da abiraterona no plasma50 é de aproximadamente 15 horas, com base em dados de sujeitos sadios. Após a administração oral de 14C-acetato de abiraterona, aproximadamente 88% da dose radioativa é recuperada nas fezes e aproximadamente 5% na urina54. Os principais compostos presentes nas fezes são o acetato de abiraterona inalterado e a abiraterona (aproximadamente 55% e 22% da dose administrada, respectivamente).
Populações especiais
Insuficiência hepática55: A farmacocinética da abiraterona foi avaliada em pacientes com insuficiência hepática55 leve ou moderada pré-existente (Classe A e B de Child-Pugh, respectivamente) e em indivíduos sadios controle. A exposição sistêmica à abiraterona depois de uma dose oral de 1000 mg aumentou em aproximadamente 11% e 260% em indivíduos com insuficiência hepática55 leve e moderada pré-existente, respectivamente. A meia-vida média da abiraterona é prolongada para aproximadamente 18 horas em indivíduos com insuficiência hepática55 leve e aproximadamente 19 horas em indivíduos com insuficiência hepática55 moderada. Nenhum ajuste de dose é necessário para pacientes32 com insuficiência hepática55 leve pré-existente. Não existem dados sobre a segurança e a eficácia de doses múltiplas de acetato de abiraterona quando administrados a pacientes com insuficiência hepática55 moderada ou grave (Child Pugh Classe B ou C). Não é possível prever o ajuste da dose. Acetato de abiraterona deve ser utilizado com precaução em pacientes com insuficiência hepática55 moderada e somente se o benefício compensar claramente o possível risco (vide "Posologia e Modo de Usar – Insuficiência56 hepática” e “Advertências e Precauções – Hepatotoxicidade57 e Insuficiência56 hepática”). Acetato de abiraterona não deve ser usado em pacientes com insuficiência hepática55 grave. Para pacientes32 que desenvolvem hepatotoxicidade57 durante o tratamento com acetato de abiraterona, pode ser necessário suspender o tratamento e ajustar a dose (vide “Posologia e Modo de Usar – Insuficiência56 hepática” e “Advertências e Precauções – Hepatotoxicidade57 e Insuficiência56 hepática”).
Pacientes com insuficiência renal46: A farmacocinética da abiraterona foi comparada entre pacientes com doença renal58 terminal que estavam em um cronograma de hemodiálise59 estável e em indivíduos controle correspondentes, com função renal58 normal. A exposição sistêmica à abiraterona depois de uma dose oral única de 1000 mg não aumentou em pacientes com doença renal58 terminal em diálise60.
A administração de acetato de abiraterona em pacientes com insuficiência renal46, incluindo insuficiência renal46 grave, não requer redução da dose (vide “Posologia e Modo de Usar - Insuficiência56 renal”).
Efeitos no intervalo QT: Em um estudo de segurança cardiovascular em pacientes com câncer6 de próstata7 avançado metastático não houve efeitos significativos do acetato de abiraterona sobre o intervalo QT/QTc.
Dados de segurança pré-clínicos
Toxicidade19 reprodutiva: Em estudos de fertilidade em ratos machos e fêmeas, o acetato de abiraterona reduziu a fertilidade, o que foi completamente reversível em 4 a 16 semanas após a interrupção da administração do acetato de abiraterona.
Em um estudo de toxicidade19 do desenvolvimento nos ratos, o acetato de abiraterona afetou a gravidez61, incluindo peso fetal reduzido e sobrevivência62. Efeitos na genitália63 externa foram observados apesar do acetato de abiraterona não ser teratogênico64.
Nestes estudos de fertilidade e toxicidade19 do desenvolvimento realizados em ratos, todos os efeitos foram relacionados à atividade farmacológica da abiraterona.
Abba é contraindicado na gravidez61 (vide “Contraindicações”).
Carcinogênese e mutagenicidade: O acetato de abiraterona não foi carcinogênico em um estudo de 6 meses, em camundongo transgênico (Tg.rasH2). Em um estudo de carcinogenicidade de 24 meses em ratos, o acetato de abiraterona aumentou a incidência65 de neoplasias66 de células intersticiais67 dos testículos45. Este resultado é considerado relacionado à ação farmacológica da abiraterona e a especificidade do rato. O acetato de abiraterona não foi carcinogênico em ratas.
O acetato de abiraterona e a abiraterona foram desprovidos de potencial genotóxico no painel padrão de testes de genotoxicidade, incluindo ensaio de mutação68 reversa bacteriana in vitro (teste de Ames), teste de aberração cromossômica de mamíferos in vitro (usando linfócitos humanos) e ensaio de micronúcleo de rato in vivo.
Toxicologia animal: Em todos os estudos de toxicidade19 em animais, os níveis circulantes de testosterona foram reduzidos de forma significativa. Como resultado, foram observadas reduções no peso de órgãos e alterações morfológicas e/ou histopatológicas nos órgãos reprodutivos e nas glândulas69 suprarrenal, hipófise70 e mamária. Todas as alterações foram completa ou parcialmente reversíveis. As alterações nos órgãos reprodutivos e órgãos sensíveis aos androgênios são consistentes com a farmacologia71 da abiraterona. Todas as alterações hormonais relacionadas ao tratamento foram revertidas ou pareceram estar se resolvendo após um período de recuperação de 4 semanas.
CONTRAINDICAÇÕES
Este medicamento é contraindicado em mulheres grávidas ou que potencialmente possam estar grávidas (vide “Advertências e Precauções – Uso durante a gravidez”).
Este medicamento é contraindicado em pacientes com hipersensibilidade à substância ativa ou qualquer excipiente presente na formulação. Este medicamento é contraindicado em pacientes com insuficiência hepática55 grave.
Categoria X. Este medicamento não deve ser utilizado por mulheres grávidas ou que possam ficar grávidas durante o tratamento.
ADVERTÊNCIAS E PRECAUÇÕES
Hipertensão16, hipopotassemia43 e retenção hídrica devido ao excesso de mineralocorticoides
Abba pode causar hipertensão16, hipopotassemia43 e retenção hídrica (vide “Reações Adversas”) como consequência dos níveis aumentados de mineralocorticoides resultantes da inibição da CYP17 (vide “Características Farmacológicas – Mecanismos de Ação”). A administração concomitante de um corticosteroide suprime o estímulo do hormônio4 adrenocorticotrópico (ACTH), resultando em redução da incidência65 e da gravidade destas reações adversas. É necessário ter cautela ao tratar pacientes cujas condições médicas pré-existentes possam ser comprometidas por aumento da pressão arterial72, hipopotassemia43 ou retenção hídrica, como por exemplo, aqueles com insuficiência cardíaca17, infarto do miocárdio73 recente ou arritmia74 ventricular. Na experiência pós-comercialização, o prolongamento do intervalo QT e Torsades de Pointes foram observados em pacientes que desenvolvem hipocalemia75 ou têm condições cardiovasculares subjacentes durante o tratamento com acetato de abiraterona.
Abba deve ser usado com cautela em pacientes com histórico de doença cardiovascular. A segurança de acetato de abiraterona em pacientes com fração de ejeção do ventrículo esquerdo (FEVE) <50%, ou insuficiência cardíaca17 Classe III ou IV da “New York Heart Association” (NYHA) (no Estudo 301), ou insuficiência cardíaca17 Classe II a IV da NYHA (nos Estudos 3011 e 302) não foi estabelecida (vide “Reações Adversas” e “Resultados de Eficácia”). A hipertensão16 deve ser controlada e a hipopotassemia43 deve ser corrigida antes de iniciar o tratamento com Abba.
A pressão arterial72, o potássio sérico e a retenção hídrica devem ser monitorados pelo menos mensalmente. O prolongamento de QT foi observado em pacientes com hipocalemia75 em associação com o tratamento com acetato de abiraterona.
Densidade óssea
Diminuição da densidade óssea pode ocorrer em homens com câncer6 de próstata7 avançado metastático (câncer6 de próstata7 resistente à castração5). O uso de Abba em combinação com um glicocorticoide pode aumentar esse efeito.
Efeitos músculoesqueléticos
Casos de miopatia76 e rabdomiólise77 foram relatados em pacientes tratados com acetato de abiraterona. A maioria dos casos foi desenvolvida nos primeiros 6 meses de tratamento e recuperada após a retirada de acetato de abiraterona. Recomenda-se precaução em doentes com tratamento concomitante com medicamentos que se sabe serem associados a miopatia76/rabdomiólise77.
Hepatotoxicidade57 e insuficiência hepática55
Aumentos acentuados das enzimas hepáticas78 levando à descontinuação do medicamento ou modificação da dose ocorreram em estudos clínicos controlados (vide “Reações Adversas”). Os níveis séricos de transaminases e bilirrubina79 devem ser avaliados antes de iniciar o tratamento com Abba, a cada duas semanas durante os primeiros três meses de tratamento e, depois disso, mensalmente. Se sintomas80 clínicos ou sinais81 sugestivos de hepatotoxicidade57 forem observados, as transaminases séricas devem ser avaliadas imediatamente. Se a qualquer momento os níveis de ALT (alanina aminotransferase) ou AST (aspartato aminotransferase) aumentarem mais de 5 vezes o limite superior da normalidade ou se os níveis de bilirrubina79 se elevarem acima de 3 vezes o limite superior da normalidade, o tratamento com Abba deve ser interrompido imediatamente e a função hepática35 monitorada com cuidado.
A retomada do tratamento com Abba somente pode ocorrer após o retorno dos testes de função hepática35 aos níveis da linha de base e em nível de dose reduzida (vide “Posologia e Modo de Usar – Insuficiência56 hepática”).
Em pacientes que desenvolvem hepatotoxicidade57 grave (nível de ALT ou AST equivalente a 20 vezes o limite superior da normalidade) a qualquer momento durante o tratamento, Abba deve ser descontinuado e os pacientes não devem ser tratados novamente com Abba.
Pacientes com hepatite82 viral ativa ou sintomática36 foram excluídos dos estudos clínicos; portanto, o uso de Abba nesta população não é recomendado. Não existem dados sobre a segurança e a eficácia de doses múltiplas de Abba quando administrados a pacientes com insuficiência hepática55 moderada ou grave (Child Pugh Classe B ou C).
Não é possível prever o ajuste da dose. Abba deve ser utilizado com precaução em pacientes com insuficiência hepática55 moderada e somente se o benefício compensar claramente o possível risco (vide “Posologia e Modo de Usar – Insuficiência56 hepática” e “Características Farmacológicas – Populações especiais”). Acetato de abiraterona não deve ser utilizado em pacientes com insuficiência hepática55 grave (vide “Posologia e Modo de Usar – Insuficiência56 hepática” e “Propriedades Farmacocinéticas – Populações especiais”). Há raros relatos de pós comercialização de insuficiência hepática55 aguda e hepatite fulminante83, alguns com desfecho fatal (vide “Reações Adversas”).
Retirada dos corticosteroides e cobertura de situações de estresse
Recomenda-se cautela e, se houver necessidade de suspender o tratamento com prednisona ou prednisolona, os pacientes devem ser monitorados quanto a sinais81 de insuficiência56 adrenocortical. Se a administração de Abba continuar após a suspensão dos corticosteroides, os pacientes devem ser acompanhados quanto a sintomas80 de excesso de mineralocorticoides (vide “Advertências e Precauções – Hipertensão16, hipopotassemia43 e retenção hídrica devido ao excesso de mineralocorticoides”).
Em pacientes recebendo prednisona ou prednisolona que estão sujeitos a estresse fora do comum, uma dose aumentada de um corticosteroide pode ser indicada antes, durante ou depois da situação de estresse.
Hipoglicemia84
Casos isolados de hipoglicemia84 foram relatados quando acetato de abiraterona foi administrado a pacientes com diabetes85 pré-existente recebendo pioglitazona ou repaglinida (vide “Interações Medicamentosas – Interação com outros medicamentos – Potencial do acetato de abiraterona para afetar a exposição a outros medicamentos”). A glicose sanguínea86 deve ser monitorada em pacientes com diabetes85.
Uso com quimioterapia8
A segurança e a eficácia do uso concomitante de Abba e quimioterapia8 citotóxica não foi estabelecida (vide “Resultados de Eficácia”).
Uso em combinação com dicloreto ou cloreto de rádio24 223
Em um estudo clínico randomizado87 em pacientes assintomático ou levemente sintomático28 com câncer6 de próstata7 resistente à castração5 metastático predominantemente óssea, no momento da descoberta, a adição de dicloreto ou cloreto de rádio24 223 a acetato de abiraterona mais prednisona/prednisolona mostrou um aumento na mortalidade88 e uma taxa aumentada de fratura25.
O dicloreto ou cloreto de rádio24 223 não é recomendado para uso em combinação com Abba mais prednisona/prednisolona fora dos estudos clínicos.
Potenciais riscos
Há risco potências de anemia89 e disfunção sexual em homens com câncer6 de próstata7 resistente à castração5, incluindo os pacientes em tratamento com acetato de abiraterona.
Gravidez61 e Lactação90
Categoria X – Estudos revelaram anormalidades no feto91 ou evidências de risco para o feto91. Os riscos durante a gravidez61 são superiores aos potenciais benefícios. Não usar em hipótese alguma durante a gravidez61.
Abba é contraindicado em mulheres grávidas ou que potencialmente possam estar grávidas (vide “Contraindicações”).
Não há dados em humanos sobre o uso de Abba na gravidez61 e Abba não é para uso em mulheres em idade fértil. É esperado que o uso de um inibidor da CYP17 pela mãe produza alterações em níveis hormonais que poderiam afetar o desenvolvimento do feto91 (vide “Características Farmacológicas – Mecanismo de ação” e “Dados de segurança pré-clínicos – Toxicidade19 reprodutiva”).
Não se sabe se a abiraterona ou seus metabólitos53 estão presentes no sêmen92. O uso de preservativo é necessário se o paciente tiver relações sexuais com uma mulher grávida. Se o paciente tiver relações sexuais com uma mulher em idade fértil, ele deve utilizar preservativo com outro método contraceptivo efetivo.
Para evitar exposição inadvertida, mulheres grávidas ou que possam estar grávidas não devem manusear Abba 250 mg comprimido sem proteção, por exemplo, sem luvas.
Este medicamento não deve ser utilizado por mulheres grávidas ou que possam ficar grávidas durante o tratamento.
Uso durante a lactação90: Abba não é indicado para uso em mulheres. Não se sabe se a abiraterona ou seus metabólitos53 são excretados no leite humano.
Efeitos na habilidade de dirigir e operar máquinas
Não foram conduzidos estudos sobre os efeitos de Abba sobre a capacidade de dirigir ou operar máquinas. Não é esperado que Abba afete a capacidade de dirigir ou operar máquinas.
INTERAÇÕES MEDICAMENTOSAS
Efeito dos alimentos na abiraterona
A administração de Abba com alimentos aumenta significantemente a absorção da abiraterona. A eficácia e a segurança de Abba administrado com alimento não foram estabelecidas. Abba não deve ser tomado com alimentos (vide “Posologia e Modo de Usar” e “Propriedades Farmacocinéticas – Absorção”).
Interação com outros medicamentos
Potencial de outros medicamentos para afetar a exposição à abiraterona
Em um estudo clínico de interação farmacocinética em indivíduos saudáveis tratados previamente com um indutor forte de CYP3A4 (rifampicina, dose diária de 600 mg, por 6 dias), seguido de uma dose única de 1000 mg de acetato de abiraterona, houve redução de 55% na AUC93∞ plasmática média de abiraterona.
Indutores fortes da CYP3A4 (por exemplo, fenitoína, carbamazepina, rifampicina, rifabutina, rifapentina e fenobarbital) devem ser evitados durante o tratamento com Abba, ou utilizados acompanhados de uma avaliação cuidadosa da eficácia clínica.
Em um estudo clínico separado de interação farmacocinética em indivíduos saudáveis, a coadministração de cetoconazol, um forte inibidor da CYP3A4, não teve efeito clínico significativo na farmacocinética da abiraterona.
Potencial do Abba para afetar a exposição a outros medicamentos
A abiraterona é um inibidor das enzimas hepáticas78 CYP2D6 e CYP2C8 metabolizadoras de medicamentos.
Em um estudo clínico para determinar os efeitos do acetato de abiraterona (associado à prednisona) em uma dose única do substrato de CYP2D6 dextrometorfano, a exposição sistêmica (AUC93) do dextrometorfano aumentou em aproximadamente 200%. A AUC24 para o dextrorfano, o metabólito94 ativo do dextrometorfano, aumentou cerca de 33%.
Recomenda-se cautela quando Abba é administrado com medicamentos ativados ou metabolizados pela CYP2D6, particularmente com medicamentos que têm índice terapêutico estreito. A redução da dose de medicamentos com índice terapêutico estreito metabolizados pela CYP2D6 deve ser considerada.
No mesmo estudo para determinar os efeitos do acetato de abiraterona (associado à prednisona) em uma dose única do substrato de CYP1A2 teofilina, não foi observado aumento na exposição sistêmica à teofilina.
Em um estudo de interação medicamentosa com CYP2C8 em indivíduos saudáveis, a AUC93 de pioglitazona aumentou em 46% e as AUCs para M-III e M-IV, os metabólitos53 ativos da pioglitazona, diminuíram em 10% cada um quando a pioglitazona foi administrada concomitantemente com uma dose única de 1000 mg de acetato de abiraterona. Os pacientes devem ser monitorados para sinais81 de toxicidade19 relacionada aos substratos da CYP2C8 com índice terapêutico estreito, se utilizados concomitantemente com acetato de abiraterona. Exemplos de medicamentos metabolizados pela CYP2C8 incluem pioglitazona e repaglinida (vide “ADVERTÊNCIAS E PRECAUÇÕES – Hipoglicemia”).
Interações com álcool e nicotina
Não há dados disponíveis sobre a interação de Abba e álcool ou nicotina.
Uso com produtos conhecidos por prolongar o intervalo QT
Uma vez que o tratamento de privação de andrógenos95 pode prolongar o intervalo QT, recomenda-se cautela ao administrar Abba com medicamentos conhecidos por prolongar o intervalo QT ou medicamentos capazes de induzir torsades de pointes, como a classe IA (por exemplo, quinidina, disopiramida) ou classe III (por exemplo, amiodarona, sotalol, dofetilida, ibutilida), medicamentos antiarrítmicos, metadona, moxifloxacina, antipsicóticos, etc.
Uso com espironolactona
A espironolactona liga-se ao receptor de andrógenos95 e pode aumentar os níveis de antígeno15 prostático específico (PSA). O uso com Abba não é recomendado.
CUIDADOS DE ARMAZENAMENTO DO MEDICAMENTO
Cuidados de conservação
Este medicamento deve ser conservado em temperatura ambiente (15–30°C). Este medicamento tem validade de 24 meses a partir da data de sua fabricação.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Características físicas e organolépticas do produto
O comprimido de Abba é branco a esbranquiçado, oval, biconvexo, gravados com “993” de um lado e liso do outro lado.
Antes de usar, observe o aspecto do medicamento.
TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS.
POSOLOGIA E MODO DE USAR
POSOLOGIA
A dose recomendada de Abba é 1000 mg (quatro comprimidos de 250 mg) em uma única tomada diária, que não deve ser realizada durante a refeição. Os comprimidos de Abba devem ser tomados em dose única com o estômago48 vazio. Abba deve ser tomado pelo menos duas horas depois da refeição e alimentos não podem ser ingeridos por pelo menos uma hora após tomar Abba. Os comprimidos devem ser deglutidos inteiros, com água (vide “Propriedades Farmacocinéticas – Absorção”). A dose máxima diária de 1000 mg (quatro comprimidos de 250 mg) não deve ser excedida.
A terapia concomitante de privação de andrógenos95 (ADT) deve ser usada em combinação com Abba e prednisona em câncer6 de próstata7 metastático não tratado anteriormente com hormônios (mHNPC) ou pacientes que estavam sob tratamento hormonal por não mais de três meses e continuam respondendo à terapia hormonal (mHSPC).
A terapia concomitante de privação de andrógenos95 (ADT) deve ser usada em combinação com Abba e prednisona ou prednisolona em pacientes com câncer6 de próstata7 metastático resistente à castração5 (mCRPC) que são assintomáticos ou levemente sintomáticos após falha da terapia de privação de andrógenos95 ou em pacientes com câncer6 de próstata7 metastático resistente à castração5 (mCRPC) que receberam docetaxel.
Dose de prednisona ou prednisolona
Para câncer6 de próstata7 metastático não tratado anteriormente com hormônio4 ou câncer6 de próstata7 hormônio4-sensível metastático (mHNPC), Abba é utilizado com 5 mg de prednisona ou prednisolona diariamente.
Para o câncer6 da próstata7 metastático resistente à castração5 (mCRPC), Abba é utilizado com 10 mg de prednisona ou prednisolona diariamente.
Monitoramento recomendado
Os níveis de transaminases séricas e bilirrubina79 devem ser avaliados antes de iniciar o tratamento com Abba, a cada duas semanas durante os 3 primeiros meses de tratamento e após este período, mensalmente. A pressão arterial72, o potássio sérico e a retenção hídrica devem ser monitorados mensalmente (vide “Advertências e Precauções – Hipertensão16, hipopotassemia43 e retenção hídrica devido ao excesso de mineralocorticoides” e “Hepatotoxicidade e Insuficiência56 hepática”).
Recomenda-se que os pacientes sejam mantidos em tratamento até que haja a progressão dos níveis de PSA (Antígeno15 Prostático Específico) associada à progressão radiográfica, sintomática36 ou clínica.
Insuficiência hepática55
Não é necessário ajustar a dose para pacientes32 com insuficiência hepática55 leve pré-existente. Não existem dados sobre a segurança e a eficácia de doses múltiplas de Abba quando administrados a pacientes com insuficiência hepática55 moderada ou grave (Child Pugh Classe B ou C). Não é possível prever o ajuste da dose. Acetato de abiraterona deve ser utilizado com precaução em pacientes com insuficiência hepática55 moderada e somente se o benefício compensar claramente o possível risco (vide “Advertências e Precauções – Hepatotoxicidade57 e insuficiência56 hepática” e “Características Farmacológicas – Populações especiais”). Acetato de abiraterona não deve ser usado em pacientes com insuficiência hepática55 grave (vide “Advertências e Precauções – Hepatotoxicidade57 e Insuficiência56 hepática” e “Propriedade Farmacocinéticas – Populações especiais”).
Para pacientes32 que desenvolvem hepatotoxicidade57 durante o tratamento com Abba [aumentos da alanina aminotransferase (ALT) ou aspartato aminotransferase (AST) 5 vezes acima do limite superior da normalidade ou aumento da bilirrubina79 3 vezes acima do limite superior da normalidade] o tratamento deve ser suspenso imediatamente até a normalização dos testes de função hepática35 (vide “Advertências e Precauções – Hepatotoxicidade57 e Insuficiência56 hepática”). O tratamento pode ser reiniciado com redução da dose para 500 mg (2 comprimidos de 250 mg) uma vez ao dia, após os testes de função hepática35 retornarem aos níveis basais do paciente. Para os pacientes nos quais o tratamento está sendo reintroduzido, as transaminases séricas e a bilirrubina79 devem ser monitoradas no mínimo a cada duas semanas durante 3 meses e depois disso mensalmente. Se ocorrer hepatotoxicidade57 com a dose reduzida de 500 mg/dia, descontinuar o tratamento com Abba. As doses reduzidas não devem ser tomadas com alimentos (vide “Posologia e Modo de Usar – Posologia”).
Se os pacientes desenvolverem hepatotoxicidade57 grave (nível de ALT ou AST equivalente a 20 vezes o limite superior da normalidade) a qualquer momento durante o tratamento, Abba deve ser descontinuado e os pacientes não devem ser tratados novamente com Abba.
Insuficiência renal46
Não é necessário ajustar a dose para pacientes32 com insuficiência renal46 (vide “Propriedades Farmacocinéticas – Populações especiais”).
Este medicamento não deve ser partido, aberto ou mastigado.
REAÇÕES ADVERSAS
As reações adversas são apresentadas nesta seção. Reações adversas são eventos adversos que foram considerados razoavelmente associados ao uso de Abba, com base na avaliação abrangente das informações de eventos adversos disponíveis. Em casos individuais, uma relação causal com o Abba não pode ser estabelecida com confiança. Portanto, pelo fato de que os estudos clínicos são conduzidos em condições amplamente variadas, as taxas de reações adversas observadas nos estudos clínicos de um medicamento não podem ser diretamente comparadas com as taxas nos estudos clínicos de outros medicamentos e podem não refletir as taxas observadas na prática clínica.
Em uma análise das reações adversas dos estudos compostos de Fase 3 com acetato de abiraterona, as reações adversas que foram observadas em ≥ 10% dos pacientes foram: hipertensão16, edema96 periférico, hipopotassemia43, infecção97 do trato urinário98, e aumentos nos níveis de alanina aminotransferase e/ou aumentos nos níveis de aspartato aminotransferase.
Abba pode causar hipertensão16, hipopotassemia43 e retenção hídrica como consequência farmacodinâmica de seu mecanismo de ação. Em estudos Fase 3, os efeitos mineralocorticoides esperados observados mais frequentemente em pacientes tratados com acetato de abiraterona em comparação ao placebo10 foram: hipopotassemia43 (18% versus 8%), hipertensão16 (22% versus 16%) e retenção hídrica (edema96 periférico) (23% versus 17%), respectivamente. Em pacientes tratados com acetato de abiraterona versus pacientes tratados com placebo10: hipopotassemia43 de grau 3 e 4 foi observada em 6% versus 1%, hipertensão16 de grau 3 e 4 foi observada em 7% versus 5%, e retenção hídrica de grau 3 e 4 foi observada em 1% versus 1% dos pacientes, respectivamente. Em geral, foi possível controlar com êxito os efeitos mineralocorticoides com medicamentos. O uso concomitante de corticosteroide reduz a incidência65 e a gravidade destas reações adversas (vide “Advertências e Precauções – Hipertensão16, hipopotassemia43 e retenção hídrica devido ao excesso de mineralocorticoides”).
Em um estudo de Fase 3 de pacientes com câncer6 de próstata7 metastático de alto risco não tratados anteriormente com hormônio4 (mHNPC) com diagnóstico9 recente ou pacientes com câncer6 de próstata7 hormônio4-sensível metastático (mHSPC) (Estudo 3011) que recebiam e permaneceram no ADT (um agonista3 do hormônio4 liberador do hormônio4 luteinizante [LHRH] ou uma orquiectomia14), acetato de abiraterona foi administrado em uma dose de 1000 mg ao dia em combinação com baixa dose de prednisona (5 mg ao dia) e ADT no braço de tratamento ativo; ADT e placebo10 foram administrados aos pacientes do grupo controle. A duração mediana do tratamento com acetato de abiraterona foi de 24 meses.
As reações adversas que ocorreram a uma taxa ≥ 1% (todos os graus) são apresentadas na Tabela 11:
Tabela 11: Reações adversas ≥ 1% dos pacientes no Estudo 3011a
|
|
Acetato de abiraterona 1000 mg ao dia com prednisona e ADT |
|
Placebos e ADT |
||||||
|
Classe de Sistema de Órgãos |
Reação adversa |
Frequência |
Incidência65 |
Frequência |
Incidência65 |
||||
|
Todos graus |
Grau 3% |
Grau 4% |
Todos graus |
Grau 3% |
Grau 4% |
||||
|
Distúrbios do metabolismo51 e da nutrição99 |
Hipopotassemia43 |
Muito comum |
20,4% |
9,5% |
0,8% |
Comum (frequente) |
3,7% |
1,2% |
0,2% |
|
Distúrbios vasculares100 |
Hipertensão16 |
Muito comum |
36,7% |
20,3% |
0% |
Muito comum |
22,1% |
9,8% |
0,2% |
a Todos os pacientes receberam agonista3 LHRH ou foram submetidos a uma orquiectomia14,
b n=pacientes avaliados quanto à segurança.
Em um estudo Fase 3 de pacientes com câncer6 de próstata7 avançado metastático (Estudo 301) que estavam usando agonista3 LHRH ou que haviam sido submetidos previamente à orquiectomia14, no grupo do tratamento ativo, acetato de abiraterona foi administrado na dose de 1000 mg/dia em combinação com dose baixa de prednisona ou prednisolona (10 mg/dia); no grupo controle, foi administrado placebo10 mais dose baixa de prednisona ou prednisolona (10 mg/dia). Os pacientes incluídos eram intolerantes ou haviam falhado a esquemas prévios de quimioterapia8, um dos quais contendo docetaxel.
A duração média do tratamento com acetato de abiraterona foi 8 meses.
As reações adversas que ocorreram em taxa ≥ 1% (todos os graus) estão apresentadas na Tabela 12.
Tabela 12: Reações adversas em ≥ 1% dos pacientes no Estudo 301a.
|
|
Acetato de abiraterona 1000 mg/dia com prednisona ou prednisolona (10 mg) |
|
Placebo10 com prednisona ou prednisolona (10 mg) |
||||||
|
Classe de Sistema de Órgãos |
Reação adversa |
Frequência |
Incidência65 |
Frequência |
Incidência65 |
||||
|
Todos graus |
Grau 3 |
Grau 4 |
Todos graus |
Grau 3 |
Grau 4 |
||||
|
Distúrbios gerais e condições do local de administração |
Edema96 periférico |
Muito comum |
25 |
1 |
< 1 |
Muito comum |
17 |
1 |
0 |
|
Distúrbios do metabolismo51 e da nutrição99 |
Hipopotassemia43 |
Muito comum |
17 |
3 |
< 1 |
Comum (frequente) |
8 |
1 |
0 |
|
Hipertrigliceridemia |
Comum (frequente) |
1 |
< 1 |
0 |
Incomum |
0 |
0 |
0 |
|
|
Infecções101 e infestações |
Infecção97 do trato urinário98 |
Muito comum |
12 |
2 |
0 |
Comum (frequente) |
7 |
1 |
0 |
|
Distúrbios hepatobiliares102 |
Alanina aminotransferase aumentada |
Comum (frequente) |
3 |
1 |
0 |
Comum (frequente) |
1 |
< 1 |
< 1 |
|
Danos, envenenamento e complicações em procedimentos |
Fraturasc |
Comum (frequente) |
6 |
1 |
< 1 |
Comum (frequente) |
2 |
0 |
0 |
|
Distúrbios vasculares100 |
Hipertensão16 |
Comum (frequente) |
9 |
1 |
0 |
Comum (frequente) |
7 |
< 1 |
0 |
|
Distúrbios cardíacos |
Insuficiência56 cardíacad |
Comum (frequente) |
2 |
2 |
< 1 |
Comum (frequente) |
1 |
0 |
< 1 |
|
Angina103 pectoris |
Comum (frequente) |
1 |
< 1 |
0 |
Comum (frequente) |
1 |
0 |
0 |
|
|
Arritmia74 |
Comum (frequente) |
1 |
0 |
0 |
Incomum |
0 |
0 |
0 |
|
|
Fibrilação atrial |
Comum (frequente) |
2 |
1 |
0 |
Comum (frequente) |
1 |
1 |
0 |
|
|
Taquicardia104 |
Comum (frequente) |
3 |
0 |
0 |
Comum (frequente) |
2 |
0 |
0 |
|
a Todos os pacientes estavam recebendo um agonista3 de LHRH ou haviam sido submetidos à orquiectomia14;
b n= pacientes avaliados para segurança;
c “Fraturas” inclui todas as fraturas, com exceção às fraturas patológicas;
d “Insuficiência cardíaca” também inclui insuficiência cardíaca congestiva105, disfunção do ventrículo esquerdo e fração de ejeção diminuída.
Em um segundo estudo clínico Fase 3, multicêntrico, controlado com placebo10 (Estudo 302), em pacientes com câncer6 de próstata7 avançado metastático assintomático ou levemente sintomático28, virgens de quimioterapia8, que faziam uso de agonistas de LHRH ou haviam sido submetidos previamente à orquiectomia14, acetato de abiraterona foi também administrado na dose de 1000 mg ao dia, em associação a uma dose baixa de prednisona ou prednisolona de 10 mg ao dia no braço experimental. Os pacientes do grupo controle receberam placebo10 e dose baixa de prednisona ou prednisolona de 10 mg ao dia. A duração média do tratamento com acetato de abiraterona no Estudo 302 foi de 13,8 meses.
As reações adversas que ocorreram em taxa ≥ 1% (todos os graus) estão apresentadas na Tabela 13.
Tabela 13: Reações adversas em ≥ 1% dos pacientes no Estudo 302a
|
Acetato de abiraterona 1000 mg/dia com prednisona ou prednisolona (10 mg) |
Placebo10 com prednisona ou prednisolona (10 mg) |
||||||||
|
Classe de Sistema de Órgãos |
Reação adversa |
Frequência |
Incidência65 |
Frequência |
Incidência65 |
||||
|
Todos graus % |
Grau 3 % |
Grau 4 % |
Todos graus % |
Grau 3 % |
Grau 4 % |
||||
|
Distúrbios gastrintestinais |
Dispepsia106 |
Muito comum |
11 |
0 |
0 |
Comum (frequente) |
5 |
< 1 |
0 |
|
Distúrbios hepatobiliares102 |
Alanina aminotransferase aumentada |
Muito comum |
12 |
5 |
1 |
Comum (frequente) |
5 |
1 |
< 1 |
|
Aspartato aminotransferase aumentada |
Muito comum |
11 |
3 |
0 |
Comum (frequente) |
5 |
1 |
0 |
|
|
Distúrbios renais e urinários |
Hematúria107 |
Muito comum |
10 |
1 |
0 |
Comum (frequente) |
6 |
1 |
0 |
a Todos os pacientes estavam recebendo um agonista3 de LHRH ou haviam sido submetidos à orquiectomia14;
b n= pacientes avaliados para segurança;
As reações adversas mais comuns obtidas dos dados de estudos Fase 3 que resultaram na descontinuação do fármaco108 foram alanina aminotransferase, aspartato aminotransferase aumentadas, e hipopotassemia43 (cada uma em <1% dos pacientes que receberam acetato de abiraterona).
A reação adversa ao medicamento insuficiência56 da suprarrenal ocorreu nos estudos clínicos Fase 3 a uma taxa de 0,3% em pacientes que receberam acetato de abiraterona e a uma taxa de 0,1% em pacientes que receberam placebo10.
Nos estudos Fase 3, 70% dos pacientes tinham idade ≥ 65 anos e 27% tinham idade ≥ 75 anos em pacientes recebendo acetato de abiraterona. Não foram observadas diferenças relativas à segurança entre estes pacientes mais idosos e pacientes mais jovens.
Efeitos cardiovasculares
Nos três estudos Fase 3 foram excluídos pacientes com hipertensão16 não controlada, doença cardíaca clinicamente significante evidenciada por infarto do miocárdio73, eventos de trombose109 arterial nos últimos 6 meses, angina103 grave ou instável, insuficiência cardíaca17 Classe III ou IV da NYHA (Estudo 301) ou insuficiência cardíaca17 Classe II a IV (Estudos 3011 e 302) ou medição de fração de ejeção <50%. Todos os pacientes incluídos (tanto os pacientes tratados com o ativo como com o placebo10) foram tratados concomitantemente com tratamento de privação androgênica, predominantemente uso de agonistas de LHRH, a qual foi associada com diabetes85, infarto do miocárdio73, acidente vascular cerebral110 e morte cardíaca súbita. Nos estudos Fase 3, a incidência65 de reações adversas cardiovasculares em pacientes que receberam acetato de abiraterona em comparação aos pacientes que receberam placebo10 foi a seguinte: fibrilação atrial (2,6% versus 2,0%); taquicardia104 (1,9% versus 1,0%); angina103 pectoris (1,7% versus 0,8%); insuficiência cardíaca17 (0,7% versus 0,2%) e arritmia74 (0,7% versus 0,5%).
Hepatotoxicidade57
Hepatotoxicidade57 medicamentosa com níveis elevados de ALT, AST e bilirrubina79 total foi relatada em pacientes tratados com acetato de abiraterona. Entre os estudos clínicos de Fase 3, hepatotoxicidade57 graus 3 e 4 (por exemplo, aumentos > 5 vezes o limite superior da normalidade da ALT ou AST ou aumento >1,5 vezes o limite superior da normalidade da bilirrubina79) foram relatados em aproximadamente 6% dos pacientes que receberam acetato de abiraterona, tipicamente durante os 3 primeiros meses após o início do tratamento.
No Estudo 3011, foi observada hepatotoxicidade57 grau 3 ou 4 em 8,4% dos pacientes tratados com acetato de abiraterona. Dez pacientes que receberam acetato de abiraterona foram descontinuados devido à hepatotoxicidade57; dois tinham hepatotoxicidade57 grau 2, seis tinham hepatotoxicidade57 grau 3 e dois tinham hepatotoxicidade57 grau 4. Nenhum paciente faleceu por hepatotoxicidade57 no Estudo 3011. No Estudo clínico 301, os pacientes com níveis basais elevados de ALT ou AST foram mais propensos a apresentar elevações dos testes de função hepática35 do que aqueles cujos valores iniciais eram normais. Quando foram observados aumentos da ALT ou AST maior que 5 vezes o limite superior da normalidade ou aumentos da bilirrubina79 maior que 3 vezes o limite superior da normalidade, acetato de abiraterona foi suspenso ou descontinuado. Em duas ocasiões ocorreram aumentos acentuados dos testes de função hepática35 (vide “Advertências e Precauções – Hepatotoxicidade57 e Insuficiência56 hepática”). Estes dois pacientes com função hepática35 normal na linha de base apresentaram aumentos da ALT ou AST de 15 a 40 vezes o limite superior da normalidade e aumentos da bilirrubina79 de 2 a 6 vezes o limite superior da normalidade. Com a descontinuação de acetato de abiraterona, os testes de função hepática35 normalizaram em ambos os pacientes e um paciente foi tratado novamente com acetato de abiraterona, sem recorrência111 dos aumentos. No Estudo clínico 302, elevações de ALT ou AST grau 3 ou 4 foram observadas em 35 (6,5%) dos pacientes tratados com acetato de abiraterona. As elevações das aminostransferases se resolveram em todos, exceto em 3 pacientes (2 com novas metástases13 hepáticas112 múltiplas e 1 com elevação de AST aproximadamente após 3 semanas da última dose de acetato de abiraterona). No estudo clínico Fase 3, a descontinuação do tratamento devido à elevação de ALT e AST ou da função hepática35 anormal foi relatada em 1,1% dos pacientes tratados com acetato de abiraterona e 0,6% dos pacientes tratados com placebo10. Nenhum óbito20 por hepatotoxicidade57 foi relatado.
Em estudos clínicos, o risco de hepatotoxicidade57 foi amenizado pela exclusão de pacientes com hepatite82 ou anormalidades significativas nos testes de função hepática35. No Estudo 3011, pacientes com ALT basal e AST > 2,5 vezes o limite superior da normalidade, bilirrubina79 > 1,5 vezes o limite superior da normalidade ou aqueles com hepatite82 viral ativa ou sintomática36 ou disfunção hepática35 crônica; ascite113 ou distúrbios hemorrágicos114 secundários para disfunção hepática35 foram excluídos. No Estudo 301, pacientes com ALT e AST basais ≥ 2,5 vezes o limite superior da normalidade, na ausência de metástases13 hepáticas112, e maior que 5 vezes o limite superior da normalidade, na presença de metástases13 hepáticas112, foram excluídos. No Estudo clínico 302, pacientes com metástases13 hepáticas112 não foram elegíveis e pacientes com ALT e AST basais ≥ 2,5 vezes o limite superior da normalidade foram excluídos. As alterações nos testes de função hepática35 que se desenvolveram em pacientes participando de estudos clínicos foram vigorosamente manejados pela interrupção do tratamento e permissão para reiniciá-lo apenas depois do retorno dos testes de função hepática35 ao nível basal do paciente (vide “Posologia e Modo de Usar – Insuficiência56 hepática”). Os pacientes que apresentaram elevações da ALT ou AST maior que 20 vezes o limite superior da normalidade não reiniciaram o tratamento. A segurança do reinício do tratamento em tais pacientes é desconhecida. O mecanismo para hepatotoxicidade57 associado com acetato de abiraterona não é compreendido.
Experiência de pós-comercialização
As reações adversas apresentadas a seguir, foram identificadas durante a experiência pós-comercialização, com base em relatos espontâneos com o uso de acetato de abiraterona.
Classe de Sistema de Órgãos
Distúrbios respiratórios, torácicos e mediastinais:
- Reação rara (≥ 1/10.000 e < 1/1.000): alveolite alérgica.
Distúrbios musculoesqueléticos e do tecido conjuntivo115:
- Reação incomum (≥ 1/1.000 e < 1/100): rabdomiólise77, miopatia76.
Distúrbios hepatobiliares102:
- Reação rara (≥ 1/10.000 e < 1/1.000): hepatite fulminante83, insuficiência hepática55 aguda.
Distúrbios cardíacos:
- Reação muito rara (< 1/10.000): prolongamento do intervalo QT e Torsades de Pointes (observados em pacientes que desenvolveram hipocalemia75 ou tinham condições cardiovasculares subjacentes).
Distúrbios do Sistema Imune116 – Hipersensibilidade:
- Reação muito rara (< 1/10.000): reação anafilática117 (reação alérgica118 grave que inclui, mas não está limitada à dispneia119, disfagia120, edema96 de face121, lábios, língua122 ou glote123, ou uma erupção124 cutânea125 com prurido126 associado).
Atenção: este produto é um medicamento que possui nova indicação e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos. Nesse caso, notifique os eventos adversos pelo Sistema VigiMed, disponível no Portal da Anvisa.
SUPERDOSE
A experiência de superdose em humanos é limitada.
Não há antídoto127 específico. Em caso de superdose, a administração de Abba deve ser interrompida e medidas gerais de suporte devem ser adotadas, incluindo o monitoramento para arritmias128. A função hepática35 também deve ser avaliada.
Em caso de intoxicação ligue para 0800 722 6001, se você precisar de mais orientações.
DIZERES LEGAIS
VENDA SOB PRESCRIÇÃO MÉDICA
MS 1.4682.0078
Farm. Resp.: Ludmilla Vieira Machado de Castro CRF-GO Nº 3649
Fabricado por:
Sun Pharmaceutical Ind. Ltd.
Halol Baroda Highway, Halol - 389 350
Dist. Panchmahal, Gujarat State - Índia.
Importado e registrado por:
SUN FARMACÊUTICA DO BRASIL LTDA
Rodovia GO 080 Km 02 Jardim Pompéia - Goiânia-GO
CEP: 74690-170
CNPJ: 05.035.244/0001-23
SAC 0800 7199702