Abelcet (Bula do profissional de saúde)
TEVA FARMACÊUTICA LTDA.
IDENTIFICAÇÃO DO MEDICAMENTO
Abelcet®
complexo lipídico de anfotericina B
Injetável 5 mg/mL
FORMA FARMACÊUTICA E APRESENTAÇÃO:
Suspensão injetável
Embalagem contendo 1 frasco-ampola de 20 mL de suspensão injetável estéril, para uso único, acompanhado de 1 agulha-filtro de 5 µm
USO INTRAVENOSO
USO ADULTO E PEDIÁTRICO
COMPOSIÇÃO:
Cada mL da suspensão injetável de Abelcet® contém:
| anfotericina B | 5 mg |
| veículo q.s.p. | 1 mL |
Veículo: dimiristil fosfatidilcolina (DMPC), dimiristil fosfatidilglicerol (DMPG), cloreto de sódio, água para injetáveis.
INFORMAÇÕES TÉCNICAS AOS PROFISSIONAIS DE SAÚDE1
INDICAÇÕES
Abelcet® (complexo lipídico de anfotericina B) é indicado para o tratamento de candidíase2 invasiva grave e também como terapia de segunda linha para o tratamento de infecções3 fúngicas4 sistêmicas graves em pacientes que não responderam à anfotericina B convencional ou outros agentes antifúngicos sistêmicos5, naqueles que apresentam comprometimento renal6 ou outras contraindicações à anfotericina B convencional ou em pacientes que desenvolveram nefrotoxicidade7 associada à anfotericina B. O tratamento com Abelcet® é indicado como tratamento de segunda linha para aspergilose invasiva, meningite8 criptocócica e criptococose9 disseminada em pacientes com HIV10, leishmaniose cutânea11 e visceral em pacientes com HIV10, fusariose, coccidiomicose, paracoccidioidomicose, histoplasmose, zigomicose e blastomicose.
RESULTADOS DE EFICÁCIA
Infecções3 Fúngicas4
Duzentos e oitenta e dois pacientes refratários12 ou intolerantes à anfotericina B convencional, ou para os quais esta mostrou-se nefrotóxica, portadores de aspergiloses (n=111), candidíases (n=87), zigomicoses (n=25), criptococoses (n=16), fusarioses (n=11) e outras infecções3 fúngicas4, foram tratados com Abelcet® (complexo lipídico de anfotericina B) em três estudos abertos. Os resultados destes estudos demonstraram a efetividade de Abelcet® no tratamento de infecções3 fúngicas4 invasivas.
Efeitos sobre a função renal6
Pacientes com aspergilose que iniciaram o tratamento com Abelcet® com níveis de creatinina13 sérica acima de 2,5 mg/dL14 apresentaram declínio do nível deste parâmetro durante o tratamento (Figura 1). Em um estudo retrospectivo15 de controle os níveis de creatinina13 sérica de pacientes tratados com Abelcet® apresentaram-se mais baixos quando comparados com os níveis dos pacientes tratados com anfotericina B convencional (Figura 1).
Figura 1: Alterações do nível médio de creatinina13 sérica ao longo do tempo Pacientes com aspergilose e creatinina13 sérica > 2,5 mg/dL14 na condição basal
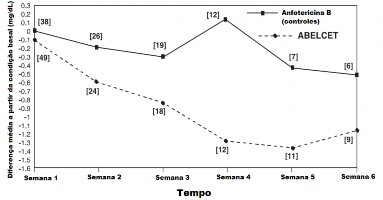
[ ] = Número de pacientes em cada ponto de tempo.
Nota: As curvas não representam a evolução clínica de um paciente, mas sim a evolução clínica de uma coorte16 de pacientes em um estudo aberto.
Figura 2: Alterações do nível médio de creatinina13 sérica ao longo do tempo Pacientes com infecções3 fúngicas4 e creatinina13 sérica > 2,5 mg/dL14 na condição basal
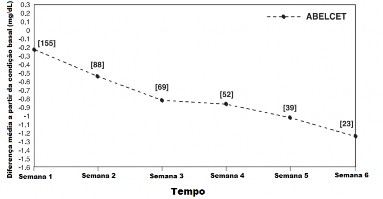
[ ] = Número de pacientes em cada ponto de tempo.
Nota: As curvas não representam a evolução clínica de um paciente, mas sim a evolução clínica de uma coorte16 de pacientes em um estudo aberto.
Em um estudo randomizado17 de Abelcet® para o tratamento de candidíase2 invasiva em pacientes com função renal6 normal ao início do estudo, a incidência18 de nefrotoxicidade7 foi significativamente menor no grupo tratado com Abelcet® na dose de 5 mg/kg/dia do que no grupo tratado com anfotericina B convencional na dose de 0,7 mg/kg/dia.
Apesar de geralmente observar-se menor nefrotoxicidade7 de Abelcet® na dose de 5 mg/kg/dia quando comparado com terapia com anfotericina B convencional na dose de 0,6-1,0 mg/kg/dia, é possível, ainda assim, verificar-se toxicidade19 renal6 dose-limitante com Abelcet®. A toxicidade19 renal6 de doses superiores a 5 mg/kg/dia de Abelcet® não foi formalmente estudada.
CARACTERÍSTICAS FARMACOLÓGICAS
Grupo Farmacoterapêutico: Antimicóticos para Uso Sistêmico20. Código ATC: J02AA01.
Abelcet® (complexo lipídico de anfotericina B) é uma suspensão estéril, apirogênica, para infusão intravenosa.
Abelcet® consiste de anfotericina B complexada com dois fosfolipídios em razão molar de fármaco21-lipídio de 1:1. Os dois fosfolipídios, L-?-dimiristoilfosfatidilcolina (DMPC) e L-?-dimiristoilfosfatidilglicerol (DMPG), estão presentes em razão molar de 7:3. Abelcet® é uma suspensão amarela e opaca, com pH entre 5 e 7.
Nota: A encapsulação lipossomal ou a incorporação em um complexo lipídico pode afetar substancialmente as propriedades funcionais do fármaco21, em comparação às propriedades do fármaco21 não encapsulado ou não complexado a lipídios. Adicionalmente, diferentes produtos lipossomais ou complexos lipídicos diferentes, com um mesmo princípio ativo, podem diferir na composição química e na forma física do componente lipídico. Tais diferenças podem afetar as propriedades funcionais dos medicamentos.
A anfotericina B, um polieno, é um antibiótico antifúngico produzido por uma cepa22 de Streptomyces nodosus. É quimicamente designado como: [1R-(1R*,3S*,5R*,6R*,9R*,11R*,15S*,16R*,17R*,18S*,19E,21E,23E,25E,27E,29E,31E,33R*,35S*, 36R*,37S*)]-33-[(3-Amino-3,6-dideoxi-b-D-manopirasonil)oxi]-1,3,5,6,9,11,17,37-octahidroxi-15,16,18-trimetil-13-oxo-14,39- dioxabiciclo[33.3.1]nonatriaconta-19,21,23,25,27,29,31-heptaeno-36-ácido carboxílico.
Apresenta peso molecular de 924,09 e fórmula molecular C47H73NO17. Sua fórmula estrutural é:
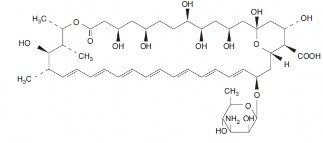
Propriedades Farmacodinâmicas
Mecanismo de Ação:
O princípio ativo de Abelcet®, a anfotericina B, age através ligação aos esteroides da membrana celular23 de fungos suscetíveis, resultando em uma alteração da permeabilidade24 da membrana. As membranas celulares dos mamíferos também contêm esteroides, acreditando-se que os danos às células25 humanas ocorrem por intermédio do mesmo mecanismo de ação.
Atividade in vitro e in vivo: Abelcet® mostrou atividade in vitro contra Aspergillus sp. (n=3) e Candida sp. (n=10), com CIMs geralmente < 1 µg/mL. Dependendo das espécies e cepas26 de Aspergillus e Candida testadas, diferenças significativas in vitro na suscetibilidade à anfotericina B (CIMs variando de 0,1 a > 10 µg/ml) foram relatadas. Entretanto, não foram estabelecidas técnicas padronizadas para testes de suscetibilidade de agentes antifúngicos, e os resultados dos estudos de suscetibilidade necessariamente não se correlacionam com os resultados clínicos.
Abelcet® é ativo em modelos animais contra Aspergillus fumigatus, Candida albicans, C. guillermondi, C. stellatoideae e C. tropicalis, Cryptococcus sp., Coccidioidomyces sp., Histoplasma sp. e Blastomyces sp., nos quais os objetivos foram a eliminação dos microrganismos do(s) órgão(s) alvo(s) e/ou o aumento da sobrevida27 dos animais infectados.
Propriedades Farmacocinéticas
O ensaio usado para dosar a anfotericina B no sangue28 após a administração de Abelcet® não distingue a anfotericina B complexada com fosfolipídios, de Abelcet®, da anfotericina B não complexada.
A farmacocinética da anfotericina B após a administração de Abelcet® é não linear. O volume de distribuição e a depuração do sangue28 aumentam com o aumento da dose de Abelcet®, resultando em aumentos não proporcionais das concentrações sanguíneas de anfotericina B na faixa de doses de 0,6 - 5,0 mg/kg/dia. Os parâmetros farmacocinéticos da anfotericina B no sangue28 total após a administração de Abelcet® e desoxicolato de anfotericina B são:
|
Parâmetros farmacocinéticos da anfotericina B no sangue28 total em pacientes aos quais se administraram doses múltiplas de Abelcet® ou desoxicolato de anfotericina B |
||
|
Parâmetro farmacocinético |
Abelcet® |
anfotericina B |
|
Concentração máxima (?g/ml) |
1,7 ± 0,8 (n=10) 2 |
1,1 ± 0,2 (n=5) |
|
Concentração ao final do intervalo entre as doses (?g/ml) |
0,6 ± 0,3 (n=10) 2 |
0,4 ± 0,2 (n=5) |
|
Área sob a curva concentração sanguínea/tempo (AUC0-24h) (µg*h/mL) |
14 ± 7 (n=14) 2,3 |
17,1 ± 5 (n=5) |
|
Depuração (mL/h*kg) |
436 ± 188,5 (n=14) 2,3 |
38 ± 15 (n=5) |
|
Volume de distribuição aparente (Vdárea) (L/kg) |
131 ± 57,7 (n=8) 3 |
5 ± 2,8 (n=5) |
|
Meia-vida de eliminação terminal (h) |
173,4 ± 78 (n=8) 3 |
91,1 ± 40,9 (n=5) |
|
Quantidade excretada na urina29 nas 24 horas após a última dose (% da dose) 4 |
0,9 ± 0,4 (n=8) 3 |
9,6 ± 2,5 (n=8) |
1 Dados de pacientes com leishmaniose mucocutânea. Velocidade de infusão de 0,25 mg/kg/h.
2 Dados de estudos em pacientes com câncer30 citologicamente comprovado sendo tratados com quimioterapia31 ou pacientes neutropênicos com infecção32 fúngica33 presumida ou comprovada. Velocidade de infusão de 2,5 mg/kg/h.
3 Dados de pacientes com leishmaniose mucocutânea. Velocidade de infusão de 4 mg/kg/h.
4 Percentagem da dose excretada em 24 horas após a última dose.
O grande volume de distribuição e a alta depuração sanguínea da anfotericina B após administração de Abelcet® provavelmente refletem captação pelos tecidos. A longa meia-vida de eliminação final provavelmente reflete uma lenta redistribuição dos tecidos. Embora a anfotericina B seja excretada lentamente, existe uma pequena acumulação no sangue28 após administração de múltiplas doses. A AUC34 da anfotericina B aumentou aproximadamente 34% a partir do dia 1 após a administração de Abelcet®, na dose de 5 mg/kg/dia durante 7 dias. Os efeitos do gênero ou da raça sobre a farmacocinética de Abelcet® não foram estudados.
As concentrações tissulares de anfotericina B (descritas na tabela abaixo) foram obtidas da autópsia35 de um paciente submetido a transplante cardíaco que recebeu três doses de Abelcet® de 5,3 mg/kg/dia:
|
Concentrações Tissulares |
|
|
Órgão |
Concentração Tissular36 de anfotericina B (µg/g) |
|
Baço37 |
290 |
|
Pulmão38 |
222 |
|
Fígado39 |
196 |
|
Nódulos Linfáticos |
7,6 |
|
Rim40 |
6,9 |
|
Coração41 |
5 |
|
Cérebro42 |
1,6 |
Este padrão de distribuição é consistente com o observado em estudos pré-clínicos em cães, nos quais as maiores concentrações de anfotericina B, após administração de Abelcet®, foram observadas no fígado39, baço37 e pulmão38; entretanto, a relação entre as concentrações tissulares de anfotericina B, quando administrada como Abelcet®, e sua atividade biológica é desconhecida.
Populações Especiais
Insuficiência Hepática43: O efeito da insuficiência hepática43 sobre a disponibilidade de Abelcet® não é conhecido, porém observa-se em estudo que mesmo quando há comprometimento hepático por infecção32 fúngica33 invasiva, as enzimas hepáticas44 se mantiveram inalteradas na vigência do tratamento e a concentração hepática45 de Abelcet® permaneceu alta.
Pacientes com insuficiência hepática43 devido à infecção32, doença do enxerto46 contra o hospedeiro, outras doenças hepáticas47 ou administração concomitante de fármacos hepatotóxicos foram tratados com sucesso com Abelcet®.
Insuficiência Renal48: Estudos demonstram a segurança de Abelcet® em pacientes com insuficiência renal48, e mesmo em pacientes com tendência à disfunção renal6. A dose ideal não foi estabelecida, mesmo assim, os estudos relatam que não existe dose limite para a nefrotoxicidade7, mesmo sendo essa dose maior que 5 mg/kg/dia. Conclui-se ainda que os níveis séricos de creatinina13 devem ser monitorados durante o tratamento.
Sendo Abelcet® uma droga potencialmente nefrotóxica, deve ser realizado um monitoramento da função renal6 antes de iniciar o tratamento em pacientes com doença renal6 pré-existente ou que já tiveram insuficiência renal48 e, regularmente, durante a terapia.
Abelcet® pode ser administrado em pacientes durante a diálise49 renal6 ou hemofiltração. Os níveis séricos de potássio e magnésio séricos devem ser monitorados regularmente.
Hemodiálise50 ou diálise peritoneal51 não aumentam visivelmente a taxa de eliminação da anfotericina B.
Pacientes Idosos: A farmacocinética e a farmacodinâmica em pacientes idosos (? 65 anos de idade) não foram estudadas, entretanto infecções3 fúngicas4 sistêmicas têm sido tratadas em pacientes idosos (≥ 65 anos de idade) em doses comparáveis à dose recomendada para o peso corporal.
Pacientes Pediátricos: Estudos em pacientes pediátricos indicam que a eficácia do tratamento foi mantida tanto nas doses mínimas como nas doses máximas. Além disso, a toxicidade19 foi diminuída nas doses menores. Abelcet® foi estudado em neonatos52 e foi constatado que o medicamento é seguro e eficaz no tratamento nesta faixa etária com candidíase2 invasiva na dosagem de 2,5 mg/kg/dia à 5 mg/kg/dia. Os resultados deste estudo indicaram que não há diferença na disposição de Abelcet® em neonatos52 e grupos de outras idades.
CONTRAINDICAÇÕES
Abelcet® (complexo lipídico de anfotericina B) é contraindicado para pacientes53 com hipersensibilidade conhecida à anfotericina B ou a qualquer componente da formulação, a não ser que, na opinião do médico, o benefício do tratamento supere o risco de hipersensibilidade.
Abelcet® é um medicamento classificado na categoria de risco C na gravidez54. Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica.
ADVERTÊNCIAS E PRECAUÇÕES
Foram relatados casos de anafilaxia55 com desoxicolato de anfotericina B e outros produtos que contêm anfotericina B. Casos de anafilaxia55 foram relatados após uso de Abelcet® (complexo lipídico de anfotericina B) com incidência18 inferior a 0,1%. Caso ocorra dificuldade respiratória grave, a infusão deve ser suspensa imediatamente; o paciente não deve receber outras infusões de Abelcet®.
Assim como com qualquer produto que contenha anfotericina B, a administração inicial de Abelcet® deve ser realizada sob observação clínica estriita por profissionais com treinamento adequado.
Reações de hipersensibilidade à infusão
Reações relacionadas à infusão, incluindo pirexia56 e calafrios57, relatadas após a administração de Abelcet® são geralmente leves ou moderadas, e são normalmente relatadas durante os dois primeiros dias de administração (vide item “9. Reações Adversas”). Tais reações geralmente diminuem após alguns dias de tratamento e devem ser consideradas medidas cautelares de prevenção ou tratamento dessas reações para pacientes53 em tratamento com Abelcet®. Tratamento com dose diária de ácido acetilsalicílico, antipiréticos58, anti-histamínicos e antieméticos59 foi relatado como bem sucedido na prevenção ou tratamento destas reações.
A infusão foi raramente associada a casos de hipotensão60, broncoespasmo61, arritmias62, choque63, dor no peito64 e, em certos pacientes, uma diminuição na saturação de oxigênio e cianose65.
Infecções3 fúngicas4 sistêmicas
Abelcet® não deve ser utilizado para tratamento de infecções3 fúngicas4 comuns, superficiais ou infecções3 fúngicas4 somente detectáveis a partir de testes cutâneos ou sorológicos.
Exames laboratoriais
Os níveis de creatinina13 sérica devem ser monitorados a intervalos frequentes durante a terapia com Abelcet® (vide item “8. Reações Adversas”). É também recomendável o monitoramento regular da função hepática45, eletrólitos66 séricos (particularmente magnésio e potássio) e hemograma completo.
Pacientes que iniciaram o tratamento com Abelcet® com altos níveis de creatinina13 sérica (> 2,5 mg/dL14) apresentaram decréscimo estatisticamente significativo (p ? 0,0003) no nível sérico de creatinina13 a partir da condição basal nas semanas 1 à 6 do tratamento com Abelcet®.
Carcinogênese, mutagênese e redução da fertilidade
Não foram realizados estudos de longo prazo, em animais, para avaliar o potencial carcinogênico de Abelcet®.
Para avaliar o potencial mutagênico de Abelcet® foram conduzidos os seguintes estudos in vitro (com e sem ativação metabólica) e in vivo: ensaio de mutação67 reversa bacteriana, ensaio de mutação67 de progressão do linfoma68 em camundongo, ensaio de aberração cromossômica em células25 CHO e ensaio in vivo de micronúcleos em camundongo. Abelcet® não apresentou efeitos mutagênicos em quaisquer dos ensaios. Os estudos demonstraram que Abelcet® não teve qualquer impacto sobre a fertilidade dos ratos machos e fêmeas, em doses até 0,32 vezes a dose humana recomendada (com base no parâmetro área de superfície corporal).
Populações especiais
Estudos sobre a reprodução69 em ratos e coelhos, com doses até 0,64 vezes a dose humana, não revelaram danos aos fetos. Uma vez que os estudos sobre a reprodução69, em animais, não são sempre preditivos da resposta humana e como não foram realizados estudos adequados e bem controlados em mulheres grávidas, Abelcet® somente deve ser utilizado durante a gravidez54 se os benefícios do tratamento superem os riscos à mãe e ao feto70.
Não se sabe se Abelcet® é excretado no leite materno. Como muitos fármacos são excretados no leite humano e tendo em vista o potencial de reações adversas graves relacionadas ao uso de Abelcet® em lactentes71 alimentados ao seio72, deve-se decidir entre a suspensão da amamentação73 ou o uso do fármaco21, levando em conta a necessidade do tratamento.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica. Abelcet® é um medicamento classificado na categoria de risco C na gravidez54.
Populações especiais
Pacientes Idosos: Quarenta e nove pacientes idosos, com idade acima de 65 anos, foram tratados com Abelcet® na dose de 5 mg/kg/dia, em dois estudos abertos e em um estudo de grupo único, prospectivo74 e menor. Nenhum evento adverso grave inesperado foi relatado.
Uso pediátrico: Cento e onze crianças (2 foram recrutadas duas vezes e contadas como pacientes separados), com idades de 16 anos ou menos, onze das quais tinham menos de 1 ano, foram tratadas com Abelcet®, na dose de 5 mg/kg/dia, em dois estudos abertos e em um pequeno estudo prospectivo74 de braço único. Em um estudo monocêntrico, 5 crianças com candidíase2 hepatoesplênica foram tratadas eficazmente com 2,5 mg/kg/dia de Abelcet®. Não foram reportados eventos adversos graves inesperados. Abelcet® foi estudado em neonatos52 e foi constatado que o medicamento é seguro e eficaz no tratamento nesta faixa etária com candidíase2 invasiva na dosagem de 2,5 mg/kg/dia a 5 mg/kg/dia. Os resultados deste estudo indicaram que não há diferença na disposição de Abelcet® em neonatos52 e grupos de outras idades.
Efeitos na habilidade de dirigir e operar máquinas
Os efeitos do Abelcet® sobre a capacidade de dirigir e operar máquinas não foi estudado.
Algumas das reações adversas de Abelcet® (vide item “8. Reações Adversas”) podem alterar a capacidade do paciente de dirigir e operar máquinas. No entanto, a condição clínica da maioria dos pacientes tratados com Abelcet® não permite dirigir e operar máquinas.
INTERAÇÕES MEDICAMENTOSAS
Não foram conduzidos estudos formais de interação de Abelcet® (complexo lipídico de anfotericina B) com outros fármacos. Entretanto, quando administrados concomitantemente, os fármacos descritos abaixo são conhecidos por interagir com a anfotericina B, podendo assim, interagir com Abelcet®:
Interações medicamento-medicamento
Agentes antineoplásicos: O uso simultâneo de agentes antineoplásicos e anfotericina B pode aumentar o potencial para toxicidade19 renal6, broncoespasmo61 e hipotensão60. Deve-se ter muito cuidado quando da administração concomitante de agentes antineoplásicos e Abelcet®.
Corticosteroides e corticotropina (ACTH): O uso concomitante de corticosteroides ou corticotropina com anfotericina B pode potencializar a hipocalemia75, podendo predispor o paciente à disfunção cardíaca; se usados concomitantemente com Abelcet®, os eletrólitos66 séricos e a função cardíaca devem ser estreitamente monitorados.
Ciclosporina A: Dados de interação medicamentosa de medicamentos contendo anfotericina B indicam que pacientes recebendo anfotericina B concomitantemente com altas doses de ciclosporina A apresentaram aumento da creatinina13 sérica, causada por administração simultânea destes dois fármacos. No entanto, Abelcet® mostrou ser menos nefrotóxico do que a anfotericina B convencional.
Glicosídeos digitálicos: O uso concomitante com anfotericina B pode induzir hipocalemia75 e potencializar a toxicidade19 digitálica. Quando administrados concomitantemente com Abelcet®, os níveis séricos de potássio devem ser estreitamente monitorados.
Flucitosina: O uso concomitante de flucitosina com preparações contendo anfotericina B pode aumentar a toxicidade19 da flucitosina por uma possível elevação da sua captação celular e/ou comprometimento da sua excreção renal6. Deve-se ter cautela na administração concomitante da flucitosina com Abelcet®.
Imidazóis (p.ex.: cetoconazol, miconazol, clotrimazol, fluconazol): Antagonismo entre anfotericina B e derivados imidazólicos tais como miconazol e cetoconazol, que inibem a síntese de ergosterol, foi reportado tanto em estudos in vitro quanto em animais in vivo. A importância clínica destes achados não foi determinada.
Outros medicamentos nefrotóxicos: O uso simultâneo de anfotericina B e agentes tais como aminoglicosídeos e pentamidina podem aumentar o potencial de toxicidade19 renal6 droga-induzida. O uso simultâneo de Abelcet® e aminoglicosídeos ou pentamidina requer muito cuidado. Recomenda-se monitoração intensiva da função renal6 em pacientes que requeiram qualquer combinação de medicamentos nefrotóxicos.
Relaxantes musculoesqueléticos: A hipocalemia75 induzida pela anfotericina B pode aumentar o efeito curarizante dos relaxantes músculos76-esqueléticos (tubocurarina, por exemplo). Quando administrados simultaneamente com Abelcet®, os níveis de potássio sérico devem ser monitorados a intervalos frequentes.
Zidovudina: Mielotoxicidade exacerbada e nefrotoxicidade7 foram observadas em cães que receberam administração simultânea de Abelcet® (1,5 ou 5,0 mg/kg/dia) e zidovudina durante 30 dias. Ao se usar zidovudina e Abelcet® simultaneamente, as funções renais e hematológicas devem ser monitoradas a intervalos frequentes.
Interações medicamento-exame laboratorial
Transfusões de leucócitos77: Toxicidade19 pulmonar aguda foi relatada em pacientes recebendo anfotericina B convencional e transfusões de leucócitos77. Não se deve administrar, ao mesmo tempo, transfusões de leucócitos77 e Abelcet®.
CUIDADOS DE ARMAZENAMENTO DO MEDICAMENTO
Cuidados de conservação
Abelcet® (complexo lipídico de anfotericina B) apresenta prazo de validade de 24 meses a partir da data de fabricação, devendo ser conservado sob refrigeração (entre 2°C e 8°C), sem congelar, protegido da luz.
Manter o frasco-ampola dentro do cartucho externo até o momento do uso.
Depois de aberto, a suspensão diluída de Abelcet® em solução glicosada a 5% somente poderá ser utilizada em até 48 horas quando armazenada sob refrigeração (entre 2°C e 8°C) e por um período adicional de 6 horas em temperatura ambiente.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamentos com o prazo de validade vencido. Guarde-o em sua embalagem original.
Características físicas e organolépticas do produto
Abelcet® é uma suspensão opaca, de cor amarela, estéril, apirogênica, para infusão intravenosa.
Antes de usar, observe o aspecto do medicamento.
TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS.
POSOLOGIA E MODO DE USAR
Ao iniciar o tratamento pela primeira vez, uma dose teste de Abelcet® (complexo lipídico de anfotericina B) deve ser administrada imediatamente antes da primeira infusão.
POSOLOGIA
A dose diária recomendada para adultos e crianças (incluindo neonatos52 prematuros) é de 1,0 a 5,0 mg/kg/dia, em uma única infusão a uma taxa de 2,5 mg/kg/h. Para infecções3 fúngicas4 do sistema nervoso central78 (SNC79), o tempo de tratamento é de 2 a 6 semanas dependendo da resposta clínica.
No caso de infecções3 sistêmicas graves a duração do tratamento deve ser de no mínimo 14 dias.
A dosagem de Abelcet® deve ser ajustada de acordo com as necessidades específicas de cada paciente:
Micoses sistêmicas: A terapia usualmente é instituída a uma dose de 1,0 mg/kg/dia, podendo ser aumentada até 5,0 mg/kg/dia conforme a necessidade do paciente.
Leishmaniose visceral: Poderá ser usada a dose de 3 mg/kg/dia por 5 a 10 dias.
Infecção32 fúngica33 sistêmica em pacientes pediátricos: A dose recomendada é de 2,0 a 5,0 mg/kg/dia.
Dosagens especiais
Pacientes idosos: Pacientes idosos devem ser tratados comparando as doses recomendadas e o peso corporal.
Pacientes diabéticos: Abelcet® pode ser administrado em pacientes diabéticos em doses comparáveis às doses recomendadas considerando o peso corporal do paciente.
Pacientes com insuficiência renal48 ou hepática45: infecções3 fúngicas4 sistêmicas em pacientes com insuficiência renal48 ou hepática45 foram tratadas com Abelcet® com dose comparável à dose recomendada considerando o peso corporal do paciente.
Pacientes pediátricos (uso em crianças e adolescentes): infecções3 fúngicas4 sistêmicas foram tratadas com sucesso com Abelcet® em pacientes pediátricos com idade entre 1 mês e 16 anos com doses comparáveis às doses recomendadas para adultos, considerando o peso corporal do paciente.
Não há dados suficientes disponíveis sobre eficácia e segurança em bebês80 com idade inferior a um mês.
Não há dados disponíveis sobre eficácia e segurança do uso de Abelcet® em recém-nascidos prematuros sofrendo de infecções3 fúngicas4 devido a espécies de aspergillus.
MODO DE USAR
O medicamento Abelcet® é estéril, portanto, as técnicas de assepsia81 e antissepsia devem ser rigorosamente observadas durante todo o manuseio do produto, uma vez que a formulação de Abelcet® não contém nenhum agente conservante microbiológico82.
Preparação para Infusão:
- Agitar o frasco suavemente até que não haja evidência de qualquer sedimento amarelo no fundo.
- Retirar a dose adequada de Abelcet® do número necessário de frascos, em uma ou mais seringas estéreis usando uma agulha calibre 18.
- Remover a agulha de cada seringa83 preenchida com Abelcet® substituindo-a pela agulha-filtro de 5 µm fornecida com cada frasco do produto. Pode-se usar uma única agulha-filtro para filtrar o conteúdo de até quatro frascos de 100 mg.
- Introduzir a agulha-filtro da seringa83 em uma bolsa de infusão IV contendo solução glicosada a 5% USP, e esvaziar o conteúdo da(s) seringa83(s) na bolsa.
- A concentração final da infusão deve ser de 1 mg/mL. Em pacientes pediátricos e naqueles com doença cardiovascular ou restrição hídrica o medicamento pode ser diluído em solução glicosada a 5% até uma concentração final máxima para infusão de 2 mg/mL.
- Antes da infusão, homogeneizar a bolsa até que o conteúdo esteja completamente misturado. Caso o tempo de infusão exceda 2 horas, misturar o conteúdo da bolsa de infusão, homogeneizando-a a cada 2 horas.
- Devido à alta viscosidade84 da solução glicosada a 5% e à indicação de uma velocidade máxima de infusão de 2,5 mg/kg/h, é recomendando o uso de uma bomba de infusão para maior controle sobre este parâmetro.
Não usar a mistura após a diluição com solução glicosada a 5% se houver qualquer evidência de substância estranha. Os frascos devem ser usados uma única vez. O material não aproveitado deve ser descartado. Deve-se observar rigorosamente a técnica asséptica durante todo o período de manipulação do Abelcet®.
CUIDADO: NÃO DILUIR COM SOLUÇÕES SALINAS. NÃO MISTURAR COM OUTROS MEDICAMENTOS OU ELETRÓLITOS66, uma vez que a compatibilidade de Abelcet® com esses produtos não foi estabelecida. O acesso intravenoso existente deve ser lavado com solução glicosada a 5% antes da infusão de Abelcet®, ou um acesso separado deve ser usado para a infusão. NÃO USAR UM FILTRO DE LINHA.
A suspensão diluída, pronta para o uso, é estável por até 48 horas de 2°C à 8°C e por um período adicional de 6 horas em temperatura ambiente.
Não há estudos de Abelcet® administrado por vias não recomendadas. Portanto, por segurança e eficácia deste medicamento, a administração deve ser somente por via intravenosa.
ATENÇÃO: NÃO SUBSTITUA A PRESCRIÇÃO DE Abelcet® POR OUTRA FORMULAÇÃO DE ANFOTERICINA B, uma vez que as formulações de anfotericina B disponíveis no mercado apresentam doses e métodos de administração diferentes e, portanto, não são intercambiáveis.
REAÇÕES ADVERSAS
Como todos os medicamentos, Abelcet® (complexo lipídico de anfotericina B) pode causar efeitos indesejáveis, embora nem todos os apresentem.
As reações adversas mais comumente relatadas em estudos clínicos controlados e abertos foram calafrios57 (16%),aumento de creatinina13 sérica (13%), pirexia56 (10%), hipocalemia75 (9%), náusea85 (7%) e vômito86 (6%).
As reações adversas estão classificadas pela frequência segundo as seguintes convenções: muito comum (≥ 1/10); comum (≥ 1/100, < 1/10); incomum (≥ 1/1.000, < 1/100); rara (≥ 1/10.000, < 1/1.000); muito rara (≥ 1/10.000); desconhecida (frequência não pôde ser estimada com base dos dados disponíveis). As reações adversas listadas a seguir foram relacionadas ao tratamento com Abelcet® durante estudos clínicos e/ou período pós-comercialização:
Distúrbios do Sangue28 e Sistema Linfático87
- Comum: Trombocitopenia88
Distúrbios do Sistema Imunológico89
- Incomum: Resposta anafilática
Distúrbios do Metabolismo90 e Nutricionais
- Comum: Hiperbilirrubinemia, distúrbio eletrolítico (incluindo hipocalemia75, hipercalemia91 e hipomagnesemia)
Distúrbios do Sistema Nervoso92
- Comum: Cefaleia93, tremor
- Incomum: Convulsão94, neuropatia95
Distúrbios Cardíacos
- Comum: Taquicardia96, arritmias62 cardíacas
- Incomum: Parada cardiorrespiratória
Distúrbios Vasculares97
- Comum: Hipertensão98, hipotensão60
- Incomum: Choque63
Distúrbios Respiratórios, Torácicos e do Mediastino99
- Comum: Dispneia100, asma101
- Incomum: Insuficiência respiratória102
- Desconhecido: Broncoespasmo61
Distúrbios Gastrintestinais
- Comum: Náusea85, vômito86, dor abdominal
Distúrbios Hepatobiliares103
- Comum: Alteração de testes de função hepática45
Distúrbios da Pele e Tecido Subcutâneo104
- Comum: Rash105 cutâneo106
- Incomum: Prurido107
- Desconhecido: Dermatite108 esfoliativa
Distúrbios Musculoesqueléticos e do Tecido Conectivo109
- Incomum: Mialgia110
Distúrbios Renais e Urinários
- Comum: Deficiência renal6 (incluindo insuficiência renal48)
- Desconhecido: Hipostenúria, acidose111 tubular renal6, diabetes insipidus112 nefrogênico
Distúrbios Gerais e do Local de Administração
- Muito comum: Calafrios57, pirexia56
- Incomum: Reação no local de administração
Investigações
- Muito comum: Aumento de creatinina13 sérica
- Comum: Aumento sanguíneo da fosfatase alcalina113, uremia114
Reações de hipersensibilidade à infusão foram associadas a dor abdominal, náusea85, vômito86, mialgia110, prurido107, rash105 maculopapular115, pirexia56, hipotensão60, choque63, broncoespasmo61, insuficiência respiratória102, dor no peito64 e em certos pacientes uma diminuição na saturação de oxigênio e cianose65 (vide item “5. Advertências e Precauções”).
Testes de função hepática45 anormais foram relatados após o uso de Abelcet® e outros medicamentos contendo anfotericina B associado a outros fatores, tais como infecção32, hiperalimentação, administração concomitante com fármacos hepatotóxicos e doença do enxerto46 contra o hospedeiro.
População pediátrica
As reações adversas observadas em pacientes pediátricos e adolescentes são semelhantes às observadas em pacientes adultos.
Outras populações especiais
Em um estudo randomizado17 controlado incluindo pacientes com idade superior a 65 anos, o perfil de reações adversas foi semelhante ao observado em adultos com idade inferior a 65 anos. Exceções importantes foram hipercreatinemia e dispneia100, que foram observadas com maior frequência em pacientes com idade superior a 65 anos tanto com uso de Abelcet® quanto com o uso de anfotericina B.
Em casos de eventos adversos, notifique pelo Sistema VigiMed, disponível no Portal da Anvisa.
SUPERDOSE
Doses de Abelcet® (complexo lipídico de anfotericina B) de até 10 mg/kg/dia foram administradas durante os estudos clínicos sem toxicidade19 dose-dependente aparente.
As reações adversas de superdose relatadas com Abelcet® foram consistentes com aquelas relatadas durante os estudos clínicos com as doses recomendadas (vide item “8. Reações Adversas”). Adicionalmente, convulsão94 e bradicardia116 foram apresentadas por um paciente pediátrico que recebeu dose de 25 mg/kg.
Em caso de superdose, o estado do paciente (em particular as funções cardiopulmonar, renal6 e hepática45, assim como a contagem de eletrólitos66 séricos) deve ser monitorado e medidas de suporte devem ser iniciadas de acordo. Não existe antídoto117 específico para anfotericina B.
Caso se suspeite de superdosagem, descontinuar o tratamento, monitorar o estado clínico do paciente e instituir as medidas de apoio necessárias. Abelcet® não é eliminado com a hemodiálise50.
Em caso de intoxicação ligue para 0800 722 6001, se você precisar de mais orientações.
DIZERES LEGAIS
VENDA SOB PRESCRIÇÃO MÉDICA
USO RESTRITO A HOSPITAIS
MS n°: 1.5573.0034
Farm. Resp.: Carolina Mantovani Gomes Forti - CRF-SP n°: 34.304
Fabricado por:
Exelead, Inc. Indianapolis - EUA
Importado por:
Teva Farmacêutica Ltda.
Av. Guido Caloi, 1935 - Prédio B - 1° Andar São Paulo - SP
CNPJ nº 05.333.542/0001-08
SAC 0800-777-8382