Artag (Bula do profissional de saúde)
LIBBS FARMACÊUTICA LTDA
IDENTIFICAÇÃO DO MEDICAMENTO
Artag®
ticagrelor
Comprimidos 90 mg
Medicamento similar equivalente ao medicamento de referência
FORMA FARMACÊUTICA E APRESENTAÇÃO:
Comprimidos revestidos
Embalagens com 20 ou 60 comprimidos
USO ORAL
USO ADULTO
COMPOSIÇÃO:
Cada comprimido de Artag contém:
| ticagrelor | 90 mg |
| excipiente q.s.p. | 1 comprimido |
Excipientes: copolímero de álcool polivinílico e macrogol, fosfato de cálcio dibásico di-hidratado, manitol, dióxido de silício, croscarmelose sódica, estearato de magnésio, hipromelose, macrogol, dióxido de titânio, amarelo de quinolina laca de alumínio e azul brilhante 133 laca de alumínio.
INFORMAÇÕES TÉCNICAS AOS PROFISSIONAIS DE SAÚDE1
INDICAÇÕES
Artag, coadministrado com ácido acetil salicílico (AAS), é indicado para a prevenção de eventos trombóticos2 (morte cardiovascular [CV], infarto do miocárdio3 [IM] e acidente vascular cerebral4 [AVC]) em pacientes adultos com Síndrome5 Coronariana Aguda (SCA) (angina6 instável, infarto7 agudo8 do miocárdio9 sem elevação do segmento ST [IAMSST] ou infarto7 agudo8 do miocárdio9 com elevação do segmento ST [IAMCST]), incluindo pacientes tratados clinicamente, e aqueles que são tratados com intervenção coronária percutânea (ICP) ou cirurgia de revascularização do miocárdio9 (RM).
Artag, coadministrado com ácido acetil salicílico (AAS), é indicado para a prevenção de Acidente Vascular Cerebral4 (AVC) em pacientes com Acidente Vascular Cerebral4 Isquêmico10 Agudo8 ou Ataque Isquêmico10 Transitório (AIT).
RESULTADOS DE EFICÁCIA
A evidência clínica para a eficácia do ticagrelor é procedente de três estudos clínicos fase 3:
- Estudo PLATO (PLATelet Inhibition and Patient Outcomes), um estudo comparativo de ticagrelor e clopidogrel, ambos administrados em combinação com ácido acetilsalicílico e outras terapias padrão.
- Estudo PEGASUS TIMI-54 (PrEvention with TicaGrelor of SecondAry Thrombotic Events in High- RiSk AcUte Coronary Syndrome Patients), um estudo comparativo de ticagrelor em combinação com ácido acetilsalicílico e ácido acetilsalicílico sozinho.
- Estudo THALES (Acute STroke or Transient IscHaemic Attack Treated with TicAgreLor and ASA for PrEvention of Stroke and Death), uma comparação entre o tratamento de ticagrelor combinado com AAS e a terapia com AAS sozinho.
Estudo PLATO (Síndrome5 Coronariana Aguda)
O estudo PLATO foi um estudo randomizado11, duplo-cego, de grupos paralelos, fase III, com 18.624 pacientes, que avaliou eficácia e segurança do ticagrelor comparado com clopidogrel para prevenção de eventos trombóticos2 (morte CV, IM e AVC) em pacientes com SCA (angina6 instável, IM sem elevação do segmento ST [IAMSST] ou IM com elevação do segmento ST [IAMCST]).
O estudo foi composto de pacientes que se apresentaram no prazo de 24 horas do início do episódio mais recente da dor no peito12 ou sintomas13 relacionados. Os pacientes foram randomizados para receber clopidogrel (75 mg uma vez ao dia, com uma dose de ataque inicial de 300 mg), ou uma dose de ataque de 180 mg de ticagrelor seguido por uma dose de manutenção de 90 mg de ticagrelor duas vezes ao dia. Os pacientes poderiam ser controlados clinicamente, tratados com intervenção coronária percutânea (ICP) ou cirurgia de revascularização do miocárdio9 (RM).
Figura 1: Curva Kaplan-Meier e análise do desfecho primário clínico composto de Morte CV, IM e AVC no estudo PLATO (análise de todo o conjunto)
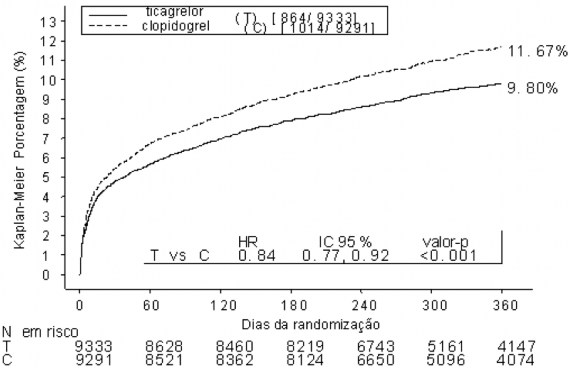
O ticagrelor reduziu a ocorrência do desfecho composto primário comparado ao clopidogrel em ambas as populações AI/ IAMCST e IAMSST.
Tabela 1: Análise dos desfechos primários e secundários de eficácia no estudo PLATO (Análise de todo o conjunto)
|
Desfecho primário |
Pacientes com eventos |
||||
|
ticagrelor 90 mg duas vezes ao dia |
clopidogrel 75 mg uma vez ao dia (%) |
Redução do Risco Relativo(a)(%) |
Hazard Ratio (HR) (IC 95%) |
valor-p |
|
|
Composto de morte CV/IM (excluindo IM silencioso) /AVC |
9,3 |
10,9 |
16 |
0,84 |
p=0,0003 |
|
Morte CV |
3,8 |
4,8 |
21 |
0,79 |
p=0,0013 |
|
IM (excluindo IM silencioso)(a) |
5,4 |
6,4 |
16 |
0,84 |
p=0,0045 |
|
AVC |
1,3 |
1,1 |
-17 |
1,17 |
p=0,2249 |
|
Desfechos secundários |
|||||
|
Composto de morte CV/IM (excluindo IM silencioso) /AVC – intenção de tratar invasivamente(a) |
8,5 |
10,0 |
16 |
0,84 |
p=0,0025 |
|
Composto de mortalidade14 por todas as causas /IM (excluindo IM silencioso) /AVC |
9,7 |
11,5 |
16 |
0,84 |
p=0,0001 |
|
Composto de morte CV/IM total/AVC/IRS(b)/IR(c)/AIT(d)/outros EAT(e) |
13,8 |
15,7 |
12 |
0,88 |
p=0,0006 |
|
Mortalidade14 por todas as causas |
4,3 |
5,4 |
22 |
0,78 |
p=0,0003** |
(a) RRR= (1-HR) x 100%. Valores com uma redução do risco relativo negativo indicam um aumento do risco relativo
(b) IRS = isquemia15 recorrente severa
(c) IR = isquemia15 recorrente
(d) AIT= acidente isquêmico10 transitório
(e) EAT= evento arterial trombótico16
** valor-p nominal
O ticagrelor é superior ao clopidogrel na prevenção de eventos trombóticos2 (Redução do Risco Relativo [RRR] 16%; Redução de Risco Absoluto [RRA] 1,9%; NNT=54) no desfecho composto de eficácia (morte CV, IM e AVC) em 12 meses. A diferença nos tratamentos foi determinada pela morte CV e IM sem diferença nos acidentes vasculares17 cerebrais. O ticagrelor demonstrou uma RRR estatisticamente significativa de 16% (RRA 1,1%) para IM e uma redução do risco relativo de 21% (RRA 1,1%) para morte CV. Tratar 91 pacientes com ticagrelor ao invés de clopidogrel prevenirá 1 morte CV.
O ticagrelor demonstrou superioridade em relação ao clopidogrel na prevenção do desfecho composto (morte CV, IM ou AVC). Os resultados foram precoces (RRA de 0,6% e RRR de 12% em 30 dias), com efeitos observados no tratamento mantidos durante o período de 12 meses, resultando em uma RRA de 1,9% ao ano com RRR de 16%. Isto sugere que o tratamento é apropriado por pelo menos 12 meses (ver item “Posologia e Modo de Usar”).
No estudo PLATO um grande número de comparações de subgrupos foram conduzidas do desfecho de eficácia primário para avaliar a robustez e consistência do benefício global. O efeito do tratamento com ticagrelor em comparação ao clopidogrel parece consistente entre os múltiplos subgrupos de pacientes pelas características demográficas, incluindo peso, sexo, antecedentes clínicos, terapia concomitante e pelo diagnóstico18 final do evento (IAMSST, IAMCST e AI).
Uma fraca, mas significativa interação do tratamento foi observada por região em que o Hazard Ratio (HR) para o desfecho primário favorece o ticagrelor no resto do mundo, mas favorece o clopidogrel na América do Norte, que representou aproximadamente 10% do total da população estudada (valor-p da interação = 0,045).
Essa aparente interação de tratamento por região observada no PLATO pode plausivelmente ser atribuída ao acaso, pelo menos em parte. Análises adicionais sugerem que a eficácia de ticagrelor em relação ao clopidogrel está associada à dose de ácido acetilsalicílico durante a terapia de manutenção. Os dados mostram uma maior eficácia de ticagrelor em relação ao clopidogrel, quando utilizados em associação com uma dose baixa de ácido acetilsalicílico (75-150 mg). A eficácia relativa de ticagrelor versus clopidogrel, quando utilizado com altas doses de ácido acetilsalicílico (> 300 mg) é menos evidente. Baseado nessas observações da relação entre a dose de manutenção do ácido acetilsalicílico e a eficácia relativa de ticagrelor em comparação ao clopidogrel, é recomendado que o ticagrelor seja utilizado com uma dose baixa de ácido acetilsalicílico de 75-150 mg (ver itens “Posologia e Modo de Usar” e “Advertências e Precauções”).
Os benefícios associados com ticagrelor também foram independentes do uso de outras terapias cardiovasculares indicadas na fase aguda e de longo-prazo, incluindo heparina, heparina de baixo peso molecular (HBPM), inibidores GpIIb/IIIa por via intravenosa, medicamentos hipolipemiantes, betabloqueadores, inibidores da enzima19 conversora da angiotensina (ECA), antagonistas dos receptores da angiotensina II e inibidores da bomba de prótons (ver item “Interações Medicamentosas”).
O ticagrelor demonstrou uma RRR estatisticamente significativa no desfecho composto de morte CV, IM e AVC em pacientes com SCA com intenção de tratamento invasivo (RRR 16%; RRA 1,7%; p = 0,0025). Em uma análise exploratória, ticagrelor demonstrou uma RRR do desfecho composto primário em pacientes com SCA com intenção de tratamento clínico (RRR 15%; RRA 2,3%; p nominal = 0,0444). Consistente com o desfecho primário do estudo, o efeito nesses dois grupos foi determinado pela morte CV e IM, sem efeito em AVC. Em pacientes recebendo stents houve numericamente menos trombose20 definitiva de stent entre pacientes tratados com ticagrelor comparado com o clopidogrel (73 versus 107; RRR 32%; RRA 0,6%; p nominal = 0,0123).
O ticagrelor demonstrou uma RRR estatisticamente significativa de 16% (RRA 2,1%) para o composto de mortalidade14 por todas as causas, IM e AVC comparado com o clopidogrel.
O desfecho secundário final (mortalidade14 por todas as causas) foi avaliado. O ticagrelor demonstrou uma RRR de 22% de mortalidade14 por todas as causas comparado com o clopidogrel com um nível de significância de p = 0,0003 e uma RRA de 1,4%.
Subestudo de Holter21
Para estudar a ocorrência de pausas ventriculares e outros episódios arrítmicos durante o estudo PLATO, investigadores realizaram monitoramento de Holter21 em um subconjunto de cerca de 3.000 pacientes, dos quais aproximadamente 2.000 tinham gravações tanto na fase aguda da SCA quanto um mês depois. A principal variável de interesse foi a ocorrência de pausas ventriculares ≥ 3 segundos. Mais pacientes tiveram pausas ventriculares com ticagrelor (6,0%) do que com o clopidogrel (3,5%) na fase aguda; e 2,2% e 1,6%, respectivamente, um mês depois. Mais pacientes tiveram pausas ventriculares com ticagrelor que com clopidogrel, entretanto, não houve consequências clínicas adversas associadas a esta diferença (incluindo inserções de marcapasso22) nesta população de pacientes.
Subestudo Genético
No estudo PLATO, amostras genéticas de 10.285 pacientes foram analisadas para determinação do genótipo23 do CYP2C19 e loco ABCB1. Foram analisadas associações de grupos de genótipo23 em relação aos resultados de eficácia e segurança do estudo PLATO.
A superioridade de ticagrelor em relação ao clopidogrel na redução dos principais eventos CV não foi significativamente afetada em pacientes genótipo23 CYP2C19 ou ABCB1.
Assim como no estudo PLATO global, o sangramento maior total não diferiu entre ticagrelor e clopidogrel independentemente do genótipo23 CYP2C19 ou ABCB1. O sangramento não relacionado a procedimento cirúrgico de RM aorta24-coronariana no PLATO aumentou com ticagrelor em relação ao clopidogrel em paciente com um ou mais alelo25 da CYP2C19 de perda de função, mas, foi similar ao clopidogrel em pacientes sem o alelo25 de perda de função.
Desfechos de eficácia e segurança combinados
Desfechos de eficácia e segurança combinados (morte CV, IM, AVC, ou sangramento “maior total” segundo a definição do PLATO) sustentam o benefício clínico do ticagrelor comparado com o clopidogrel (RRR 8%; RRA 1,4%; HR 0,92; p = 0,0257) por mais de 12 meses após os eventos de SCA.
Estudo PEGASUS (História de Infarto do Miocárdio3)
O estudo PEGASUS TIMI-54 foi um estudo com 21.162 pacientes, evento-dirigido, randomizado26, duplo cego, controlado por placebo27, de grupos paralelos, multicêntrico e internacional para avaliar a prevenção de eventos trombóticos2 com ticagrelor administrado em 2 doses (90 mg duas vezes ao dia ou 60 mg duas vezes ao dia), combinados com uma dose baixa de ácido acetilsalicílico (AAS) (75-150 mg) em comparação com a terapia de AAS sozinha em pacientes com história de infarto do miocárdio3 e os fatores de risco adicionais para aterotrombose.
Eram elegíveis a pacientes com 50 anos ou mais, com história de infarto do miocárdio3 (1 a 3 anos antes da randomização), e tinham pelo menos um dos seguintes fatores de risco para aterotrombose: idade ≥ 65 anos, diabetes mellitus28 que necessitam de medicação, um segundo IM prévio, evidência de Doença Arterial Coronariana (DAC) multiarterial, ou disfunção renal29 crônica não terminal.
Figura 2: Curva Kaplan-Meier e análise do desfecho primário clínico composto de Morte CV, IM e AVC no estudo PEGASUS (Análise de todo o conjunto)

Tabela 2: Análise dos desfechos primários e secundários no estudo PEGASUS (Análise de todo o conjunto)
|
|
ticagrelor 60 mg duas vezes ao dia + AAS |
AAS sozinho |
valor-p |
|||
|
Características |
Pacientes com eventos |
KM % |
HR (95% IC) |
Pacientes com eventos |
KM % |
|
|
Desfechos primários |
||||||
|
Composto de morte CV/IM (excluindo IM silencioso) /AVC |
487 (6,9%) |
7,8% |
0,84 |
578 (8,2%) |
9,0% |
0,0043 (s) |
|
Morte CV |
174 (2,5%) |
2,9% |
0,83 |
210 (3,0%) |
3,4% |
0,0676 |
|
IM |
285 (4,0%) |
4,5% |
0,84 |
338 (4,8%) |
5,2% |
0,0314 |
|
AVC |
91 (1,3%) |
1,5% |
0,75 |
122 (1,7%) |
1,9% |
0,0337 |
|
Desfechos secundários |
||||||
|
Morte CV |
174 (2,5%) |
2,9% |
0,83 |
210 (3,0%) |
3,4% |
- |
|
Mortalidade14 por todas as causas |
289 (4,1%) |
4,7% |
0,89 |
326 (4,6%) |
5,2% |
- |
Hazard ratio e valores-p são calculados separadamente para ticagrelor vs. AAS sozinho a partir de modelo de riscos proporcionais de Cox com o grupo de tratamento como a única variável explicativa.
Kaplan-Meier percentagem calculada em 36 meses.
Nota: o número de primeiros eventos para os componentes morte CV, IM e AVC são o número real de primeiros eventos para cada componente e não adicionam ao número de eventos no desfecho composto.
(s) indica a significância estatística.
IC = intervalo de confiança; CV = Cardiovascular; HR = Hazard ratio; KM = Kaplan-Meier; IM = Infarto do miocárdio3; N = Número de pacientes.
Ambos os regimes de dosagem de 60 mg duas vezes ao dia e 90 mg duas vezes ao dia de ticagrelor, em combinação com AAS, foram superiores ao AAS sozinho na prevenção de eventos trombóticos2 (desfecho composto: morte CV, IM e AVC), com um efeito de tratamento consistente ao longo de todo o período do estudo, obtendo-se 16% de RRR e 1,27% de RRA para ticagrelor 60 mg e 15% de RRR e 1,19% de RAR para ticagrelor 90 mg.
Embora o perfil de eficácia de ticagrelor 90 mg e 60 mg tenham sido semelhantes, há evidências de que a dose mais baixa tem um melhor perfil de tolerabilidade e segurança em relação ao risco de hemorragia30 e dispneia31. Portanto, ticagrelor 60 mg duas vezes ao dia coadministrado com AAS é recomendado para a prevenção de eventos trombóticos2 (morte CV, IM e AVC) em pacientes com história de infarto do miocárdio3 (IM ocorreu pelo menos um ano atrás) e um alto risco de desenvolver um evento trombótico16.
Em relação ao AAS sozinho, ticagrelor 60 mg duas vezes ao dia reduziu significativamente o desfecho primário composto de morte CV, IM e AVC. Cada um dos componentes contribuiu para a redução do desfecho composto primário (morte CV 17% RRR, IM 16% RRR, e AVC 25% RRR).
O tratamento de 79 pacientes por até 36 meses, com ticagrelor 60 mg duas vezes ao dia em combinação com AAS, em vez da terapia AAS sozinha, irá prevenir um evento do desfecho primário composto.
O benefício de ticagrelor observado no desfecho primário composto também se refletiu nos dois desfechos secundários, com uma diminuição numérica na morte CV e mortalidade14 por todas as causas para ticagrelor 60 mg duas vezes ao dia combinado com AAS em comparação com a terapia de AAS sozinha, mas este fez não alcançou significância estatística (ver Tabela 2).
O RRR para o desfecho composto de 1 a 360 dias (17% RRR) e de 361 dias e em diante (16% RRR) foi semelhante. Este efeito foi consistente ao longo do estudo, com duração até 48 meses (mediana de 33 meses). A consistência da RRR ao longo do tempo sugere que é adequado continuar o tratamento com ticagrelor, desde que o paciente permaneça com alto risco de desenvolvimento de eventos trombóticos2 (ver item “Posologia e Modo de Usar”). Os dados de eficácia e segurança de ticagrelor após 3 anos de tratamento prolongado são limitados.
Não há evidência de benefício (nenhuma redução no desfecho clínico primário composto de morte CV, IM e AVC) mas um aumento do risco de sangramento quando o ticagrelor 60 mg foi administrado duas vezes ao dia em pacientes clinicamente estáveis, ou seja, há mais de 2 anos do infarto do miocárdio3 ou mais de um ano após o término do tratamento prévio com inibidor do receptor de ADP.
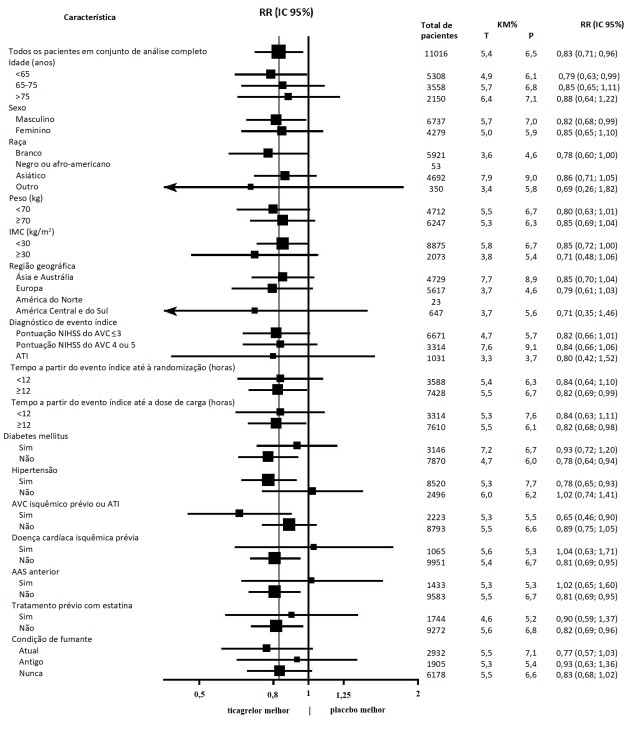
O efeito do tratamento de ticagrelor 60 mg duas vezes por dia versus AAS foi consistente em subgrupos principais, veja a Figura 3.
Figura 3: Hazard ratios e taxa do desfecho primário clínico composto de morte CV, IM e AVC por subgrupo de pacientes no PEGASUS (análise de todo o conjunto)
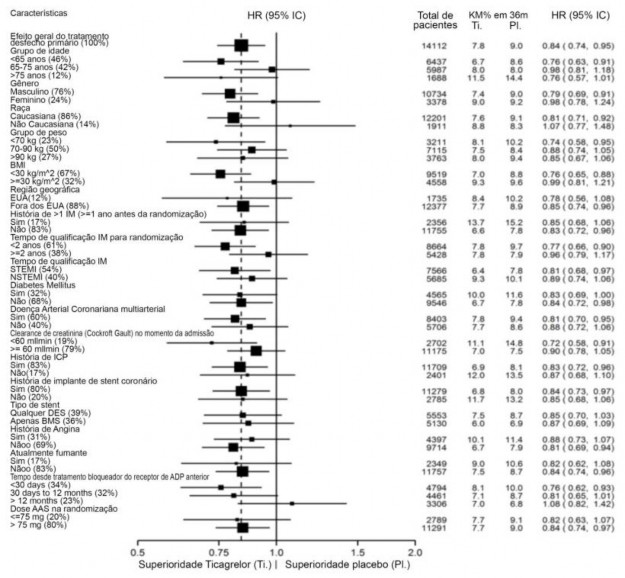
O efeito do tratamento de ticagrelor 60 mg duas vezes ao dia versus a terapia de AAS sozinho foi consistente em vários subgrupos de pacientes, com base em características demográficas, incluindo peso, gênero, história médica e região.
Os benefícios associados com ticagrelor também são independentes do uso de outras terapias cardiovasculares incluindo agentes hipolipemiantes, betabloqueadores, inibidores da enzima19 conversora da angiotensina (ECA), antagonistas do receptor da angiotensina II, bloqueadores dos canais de cálcio, nitratos e inibidores da bomba de prótons (ver item “Interações Medicamentosas”).
Estudo THALES (AVC isquêmico10 agudo8 ou ataque isquêmico10 transitório)
O estudo THALES foi um estudo multicêntrico internacional de fase 3 de 11.016 pacientes, orientado por evento, randomizado26, duplo-cego, controlado por placebo27, de grupo paralelo, para testar a hipótese de que ticagrelor 90 mg em combinação com AAS é superior ao AAS sozinho na prevenção de acidente vascular cerebral4 e morte em pacientes com acidente vascular cerebral4 isquêmico10 agudo8 ou ataque isquêmico10 transitório (AIT).
Os pacientes eram elegíveis para participar se tivessem 40 anos ou mais, com AVC isquêmico10 agudo8 não cardioembólico (pontuação NIHSS ≤ 5) ou AIT de alto risco (definido como pontuação ABCD ≥ 6 ou estenose32 aterosclerótica ipsilateral ≥ 50% na carótida interna ou uma artéria33 intracraniana). Os pacientes que receberam trombólise34 ou trombectomia nas 24 horas anteriores à randomização não eram elegíveis.
O estudo foi composto por pacientes que foram randomizados dentro de 24 horas do início de um acidente vascular cerebral4 isquêmico10 agudo8 ou AIT. Os pacientes receberam ticagrelor (90 mg duas vezes ao dia, com uma dose de ataque inicial de 180 mg) e AAS ou AAS sozinho por 30 dias. A dose recomendada de AAS foi de 75-100 mg uma vez ao dia e uma dose de ataque inicial de 300-325 mg. A duração média do tratamento foi de 31 dias.
Figura 4: Gráfico de Kaplan-Meier do desfecho clínico primário composto de AVC e morte no THALES (conjunto de análise completo)
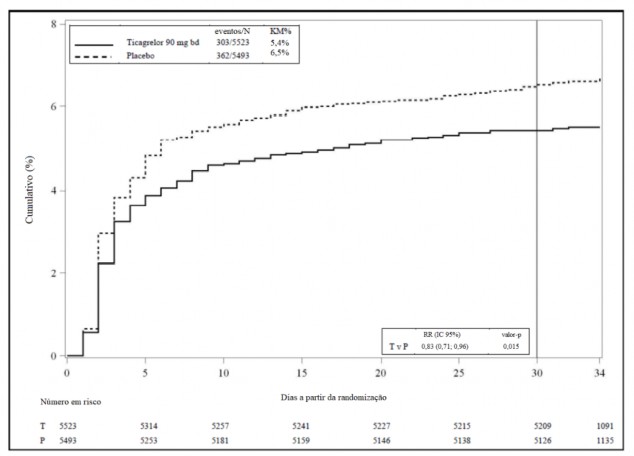
Tabela 3: Análise de desfechos de eficácia primários e secundários no THALES (conjunto de análise completo)
|
|
ticagrelor 90 mg duas vezes ao dia com AAS |
AAS sozinho |
valor-p |
|||
|
Característica |
Pacientes com eventos |
KM % |
Hazard Ratio (HR) (IC 95%) |
Pacientes com eventos |
KM % |
|
|
Desfecho primário |
||||||
|
Composto de AVC/Morte |
303 (5,5%) |
5,4% |
0,83 (0,71; 0,96) |
362 (6,6%) |
6,5% |
0,015 (s) |
|
AVC |
284 (5,1%) |
5,1% |
0,81 (0,69; 0,95) |
347 (6,3%) |
6,3% |
0,008 |
|
Morte |
36 (0,7%) |
0,6% |
1,33 (0,81; 2,19) |
27 (0,5%) |
0,5% |
0,0264 |
|
Desfecho secundário |
||||||
|
AVC isquêmico10 |
276 (5,0%) |
5,0% |
0,79 (0,68; 0,93) |
345 (6,3%) |
6,2% |
0,004 (s) |
As razões de risco e os valores p são calculados para ticagrelor 90 mg duas vezes ao dia + AAS vs. AAS sozinho a partir do modelo de riscos proporcionais de Cox com o grupo de tratamento como a única variável explicativa.
Porcentagem Kaplan-Meier calculada em 30 dias.
Nota: o número de primeiros eventos para os componentes acidente vascular cerebral4 e morte é o número real dos primeiros eventos para cada componente e não somam o número de eventos no desfecho composto.
(s) Indica significância estatística.
IC = intervalo de confiança; HR = Razão de risco; KM = Kaplan-Meier; N = Número de pacientes
O ticagrelor 90 mg duas vezes ao dia, em combinação com AAS, foi superior ao AAS sozinho na prevenção do desfecho composto de AVC e morte, que correspondeu a uma redução do risco relativo (RRR) de 17% e uma redução do risco absoluto (RRA) de 1,1 % (Tabela 3). O efeito foi impulsionado por uma redução no componente de AVC do desfecho primário (19% RRR, 1,1% RRA).
Houve uma redução estatisticamente significativa na taxa de AVC isquêmico10 para ticagrelor em combinação com AAS em comparação com AAS sozinho (21% RRR, 1,2% RRA).
Em uma análise exploratória predefinida, houve menos eventos de AVC incapacitantes subsequentes (definidos por pacientes com um AVC subsequente e com uma pontuação mRS > 2) em pacientes tratados com ticagrelor 90 mg com AAS em comparação com AAS sozinho (150 (2,7%) vs. 188 (3,5%), respectivamente).
Uma análise exploratória predefinida foi realizada em pacientes com estenose32 aterosclerótica ipsilateral > 30%, nos quais havia numericamente menos eventos de desfecho primário (composto de acidente vascular cerebral4 e morte) para pacientes35 tratados com ticagrelor 90 mg com AAS em comparação com AAS sozinho (92 (8,1%) vs 132 (10,9%), respectivamente).
O efeito do tratamento de ticagrelor em combinação com AAS vs. AAS sozinho foi consistente entre os subgrupos predefinidos, ver Figura 5.
Figura 5: Razões de risco e taxas do desfecho clínico composto primário de AVC e morte por subgrupo de pacientes no THALES (conjunto de análise completo)
População pediátrica
Em um estudo de fase 3 randomizado26, duplo-cego, controlado por placebo27, o objetivo primário de redução da taxa de crises vaso-oculsivas em pacientes pediátricos com 2 a menos de 18 anos de idade e com doença falciforme, não foi atendida.
Referências Bibliográficas
- Bonaca MP, Bhatt DL, Cohen M, Steg PG, Storey RF, Jensen EC, et al. Long-term use of ticagrelor in patients with prior myocardial infarction. N Engl J Med 2015;372:1791-800.
- Cannon CP, Harrington RA, James S, Ardissino D, Becker RC, Emanuelsson H, et al. Comparison of ticagrelor with clopidogrel in patients with a planned invasive strategy for acute coronary syndromes (PLATO): a randomised double-blind study. Lancet 2010;375(9711):283-93.
- James SK, Roe MT, Cannon CP, Cornel JH, Horrow J, Husted S, et al. Ticagrelor versus clopidogrel in patients with acute coronary syndromes intended for non-invasive management: a substudy from the prospective randomized PLATelet inhibition and patient Outcomes (PLATO) trial. BMJ 2011;342:d3527. Mahaffey KW, Wojdyla DM, Carroll K, Becker RC, Storey FR, Angiolillo DJ, et al. Ticagrelor compared to clopidogrel by geographic region in the PLATelet inhibition and patient Outcomes (PLATO) Trial. Circulation 2011;124(5):544-54.
- Scirica BM, Cannon CP, Emanuelsson H, Michelson EL, Harrington RA, Husted S, et al. The incidence of bradyarrhythmias and clinical bradyarrhythmic events in patients with acute coronary syndromes treated with ticagrelor or clopidogrel in the PLATO (PLATelet inhibition and patient Outcomes) trial: results of the continuous electrocardiographic assessment substudy. J Am Coll Cardiol 2011;57(19):1908-16.
- Wallentin L, Becker RC, Budaj A, Cannon CP, Emanuelsson H, Held C, et al. Ticagrelor versus clopidogrel in patients with acute coronary syndromes. N Engl J Med 2009;361:1045-57.
- Wallentin L, James S, Storey RF, Armstrong M, Barratt BJ, Horrow J, et al. Effect of CYP2C19 and ABCB1 single nucleotide polymorphisms on outcomes of treatment with ticagrelor versus clopidogrel for acute coronary syndromes: a genetic substudy of the PLATO trial. Lancet 2010;376(9749):1320-8.
CARACTERÍSTICAS FARMACOLÓGICAS
Propriedades Farmacodinâmicas
- Mecanismo de ação
Artag contém ticagrelor um membro da classe química ciclopentiltriazolopirimidinas (CPTP), que é antagonista36 seletivo oral, de ação direta e de ligação reversível ao receptor P2Y12 que previne a ativação e agregação plaquetária mediada por adenosina difosfato (ADP) P2Y12 dependente. O ticagrelor não previne a ligação do ADP, mas quando ligado ao receptor P2Y12 previne a transdução de sinal37 ADP induzida. Como as plaquetas38 participam na iniciação e/ou evolução de complicações trombóticas39 da doença arterosclerótica, a inibição da função plaquetária tem demonstrado redução do risco de eventos cardiovasculares como morte, IM ou AVC.
O ticagrelor possui um mecanismo de ação adicional, aumentando os níveis de adenosina endógena pela inibição do transportador equilibrativo 1 de nucleosídeo (ENT-1). A adenosina é formada localmente nos pontos de hipóxia40 e dano tecidual, através da degradação da adenosina tri- e di-fosfato (ATP41 e ADP) liberada. Como a degradação da adenosina é essencialmente restrita ao espaço intracelular, a inibição do ENT-1 pelo ticagrelor prolonga a meia-vida da adenosina e, portanto, aumenta a sua concentração extracelular local promovendo aumento localizado das respostas à adenosina. O ticagrelor não possui efeito significativo direto nos receptores de adenosina (A1, A2A, A2B, A3) e não é metabolizado à adenosina. Tem sido documentado que a adenosina possui um número de efeitos que incluem: vasodilatação, cardioproteção, inibição da agregação plaquetária, modulação da inflamação42 e indução de dispneia31, o que pode contribuir para o perfil clínico do ticagrelor.
Efeitos farmacodinâmicos:
- Início da Ação
A inibição da agregação plaquetária (IAP) por ticagrelor e clopidogrel foi comparada em um estudo de 6 semanas examinando43 ambos os efeitos agudos e crônicos de inibição das plaquetas38 em resposta a 20 µM ADP como a agregação agonista44 de plaquetas38 em pacientes com Doença Arterial Coronariana (DAC) estável em terapia com o AAS. O início foi avaliado após uma dose de ataque de 180 mg de ticagrelor ou 600 mg de clopidogrel.
O ticagrelor demonstra um rápido início de efeito farmacológico, como demonstrado pela média de IAP para ticagrelor em 0,5 horas após dose de ataque de 180 mg em torno de 41%, com o efeito IAP máximo de 87,9% a 89,6% por 2-4 horas pós-dose. 90% dos pacientes tiveram um alcance final de IAP >70% por 2 horas pós-dose. O alto efeito da IAP do ticagrelor entre 87% -89% foi mantido entre 2-8 horas.
Figura 6: Extensão média final de Inibição (± EP*) da Agregação Plaquetária (IAP) após doses orais únicas de 180 mg de ticagrelor ou 600 mg de clopidogrel em pacientes com Doença Arterial Coronariana (DAC) estável.
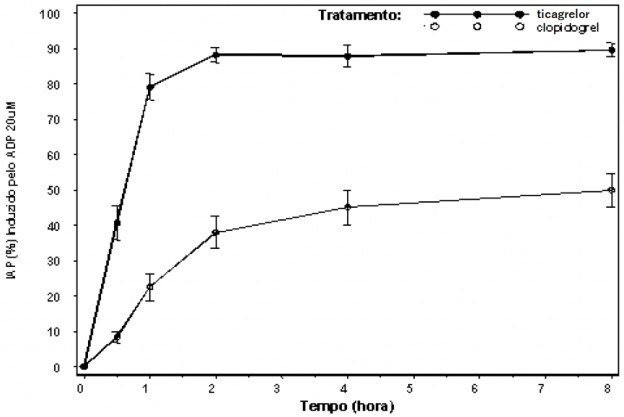
*EP: erro padrão
- Reversão de Efeito
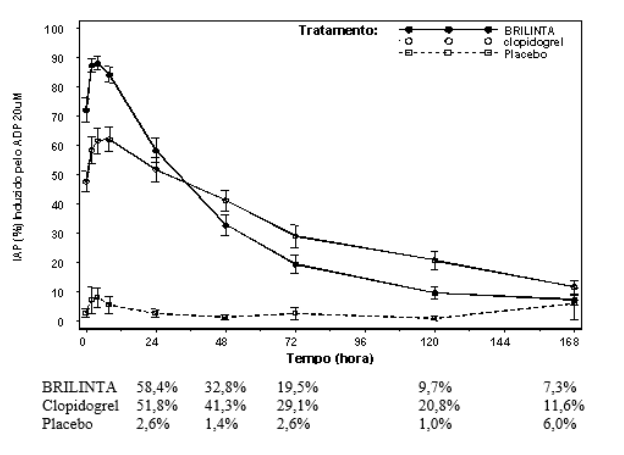
A reversão foi examinada após 6 semanas com ticagrelor 90 mg duas vezes ao dia ou 75 mg de clopidogrel uma vez ao dia, novamente em resposta a 20 µM ADP. Após o declínio das concentrações de ticagrelor a um nível inferior ao requerido para saturação do receptor, a IAP diminui gradualmente com o declínio das concentrações plasmáticas. Uma vez que ticagrelor se liga reversivelmente, a recuperação da função plaquetária não depende da reposição de plaquetas38. O ticagrelor tem uma taxa de reversão mais rápida da IAP em comparação com o clopidogrel, conforme determinado pela inclinação de reversão de 4-72 horas após a última dose.
A extensão média final da IAP medida após a última dose de ticagrelor é aproximadamente 20-30% maior para ticagrelor comparado com o clopidogrel. Entretanto, por 24 horas pós-dose, a % da IAP é similar entre ticagrelor e clopidogrel, e é menor para ticagrelor a partir de 72 horas em até 7 dias comparado com o clopidogrel. A % média da IAP para ticagrelor em 72 horas (Dia 3) após última dose foi comparável ao clopidogrel no Dia 5, e a % da IAP para ticagrelor no Dia 5 foi similar ao clopidogrel no Dia 7, que não é estatisticamente diferente do placebo27.
Figura 7: Extensão média final de Inibição (± EP) da Agregação Plaquetária (IAP) após a última dose de manutenção de 90 mg de ticagrelor ou 75 mg de clopidogrel ou placebo27.
Respondedores ao ticagrelor
A IAP induzida por ticagrelor tem menor variabilidade nos picos de concentrações plasmáticas de ticagrelor observados com a dose de 90 mg duas vezes ao dia em comparação ao clopidogrel 75 mg uma vez ao dia. Pacientes com DAC estável, predeterminados a terem menor resposta IAP ao clopidogrel (não- respondedores), e que receberam uma dose concomitante de ácido acetilsalicílico, exibiram maior média de resposta IAP após administração de ticagrelor comparado ao clopidogrel. Em não-respondedores ao clopidogrel, a resposta observada de IAP ao ticagrelor foi maior e mais consistente. O tratamento de ticagrelor resultou em IAP consistentemente mais elevada em comparação com o clopidogrel, e isso foi aparente após a dose para ambos os respondedores e não-respondedores.
Dados de troca
A troca de clopidogrel 75 mg uma vez ao dia para ticagrelor 90 mg duas vezes ao dia resulta em um aumento absoluto da IAP de 26,4% e a troca de ticagrelor para clopidogrel resulta em uma diminuição absoluta da IAP de 24,5%. Os pacientes podem ser transferidos de clopidogrel para ticagrelor sem a interrupção do efeito antiplaquetário (ver item “Posologia e Modo de Usar”).
Mecanismo da Adenosina (ENT-1)
O ticagrelor aumenta a concentração plasmática de adenosina em pacientes SCA e tem demonstrado que amplia inúmeras respostas fisiológicas45 à adenosina. A adenosina é um vasodilatador; ticagrelor demonstrou que amplia o aumento do fluxo sanguíneo coronário induzido por adenosina em voluntários saudáveis e em pacientes SCA. Adenosina é um inibidor plaquetário endógeno; ticagrelor demonstrou que aumenta a inibição da agregação plaquetária mediada por adenosina em adição à inibição plaquetária decorrente do seu antagonismo ao P2Y12. A adenosina está associada ao efeito cardioprotetor de pré-condicionamento;
em um modelo em ratos com lesão46 de reperfusão, ticagrelor demonstrou redução do tamanho do infarto7 através do mecanismo mediado por adenosina. A adenosina também induz dispneia31; ticagrelor demonstrou ampliação da dispneia31 adenosina-induzida em voluntários saudáveis. Desta maneira, a dispneia31 observada em alguns pacientes que utilizam ticagrelor (ver item “Reações Adversas”) pode ser parcialmente mediada por adenosina.
Propriedades Farmacocinéticas
Geral
O ticagrelor demonstra farmacocinética linear, e a exposição ao ticagrelor e ao metabólito47 ativo (AR- C124910XX) são aproximadamente proporcionais à dose.
Absorção
A absorção de ticagrelor é rápida, com uma Tmáx mediana de aproximadamente 1,5 horas. A formação do principal metabólito47 circulante AR-C124910XX (também ativo) de ticagrelor é rápida, com uma Tmáx mediana de aproximadamente 2,5 horas. A Cmáx e a AUC48 de ticagrelor e do metabólito47 ativo aumentaram de uma maneira aproximadamente proporcional à dose por toda faixa de doses estudadas (30-1260 mg).
A biodisponibilidade média absoluta de ticagrelor foi estimada em 36% (faixa de 25,4% a 64,0%). A ingestão de uma refeição rica em gordura49 não teve efeito sobre a Cmáx do ticagrelor ou a AUC48 do metabólito47 ativo, mas resultou em um aumento de 21% na AUC48 de ticagrelor e uma diminuição de 22% na Cmáx do metabólito47 ativo. Estas pequenas alterações são consideradas de mínima relevância clínica, portanto, ticagrelor pode ser administrado com ou sem alimentos.
O ticagrelor na forma de comprimidos triturados misturados em água, administrado por via oral ou administrado através de tubo nasogástrico ao estômago50 é bioequivalente aos comprimidos inteiros com AUC48 e Cmáx dentro de 80-125% e Tmáx mediana de 1h (intervalo de 1h a 4h) para ticagrelor.
Distribuição
O volume de distribuição de ticagrelor no estado de equilíbrio é 87,5 L. O ticagrelor e o metabólito47 ativo são extensivamente ligados às proteínas51 plasmáticas humanas (> 99,0%).
Metabolismo52
A CYP3A é a principal enzima19 responsável pelo metabolismo52 de ticagrelor e a formação do metabólito47 ativo e suas interações com outros substratos da CYP3A variam da ativação até a inibição. O ticagrelor e o metabólito47 ativo são fracos inibidores da glicoproteína-P.
O principal metabólito47 de ticagrelor é o AR-C124910XX, que também é ativo como avaliado in vitro pela ligação ao receptor de ADP P2Y12 das plaquetas38. A exposição sistêmica ao metabólito47 ativo é aproximadamente 30-40% do obtido por ticagrelor.
Excreção
A principal via de eliminação de ticagrelor é por metabolização hepática53. Quando ticagrelor marcado radioativamente é administrado, a recuperação média da radioatividade é de aproximadamente 84% (57,8% nas fezes, 26,5% na urina54). Recuperações de ticagrelor e do metabólito47 ativo na urina54 foram menor que 1% da dose. A primeira via de eliminação do metabólito47 ativo é principalmente através da secreção biliar. A t1/2 média foi aproximadamente 6,9 horas (faixa 4,5-12,8 horas) para ticagrelor e 8,6 horas (faixa 6,5-12,8 horas) para o metabólito47 ativo.
Populações especiais
Idosos: exposições maiores ao ticagrelor (aproximadamente 60% para Cmáx e para AUC48) e ao metabólito47 ativo (aproximadamente 50% para Cmáx e para AUC48) foram observadas em indivíduos idosos (≥ 65 anos) em comparação com indivíduos mais jovens. Estas diferenças não são consideradas clinicamente significativas (ver item “Posologia e Modo de Usar”).
Pediátrico: ticagrelor não é indicado na população pediátrica (ver item “Posologia e Modo de Usar”). Sexo: exposições maiores ao ticagrelor (aproximadamente 52% e 37% para Cmáx e AUC48, respectivamente) e ao metabólito47 ativo (aproximadamente 50% para Cmáx e para AUC48) foram observadas em mulheres em relação aos homens. Estas diferenças não são consideradas clinicamente significativas.
Insuficiência renal55: a exposição ao ticagrelor foi aproximadamente 20% menor e a exposição ao metabólito47 ativo foi aproximadamente 17% maior em pacientes com insuficiência renal55 grave comparado a indivíduos com função renal29 normal. O efeito de IAP de ticagrelor foi similar entre os dois grupos, entretanto, houve maior variabilidade observada na resposta individual em pacientes com insuficiência renal55 grave.
Em pacientes com doença renal29 terminal em hemodiálise56, a AUC48 e a Cmáx de ticagrelor 90 mg administradas em um dia sem diálise57 foram 38% e 51% superiores, respectivamente, em comparação com indivíduos com função renal29 normal. Um aumento similar na exposição foi observado quando o ticagrelor foi administrado imediatamente antes da diálise57, demostrando que ticagrelor não é dialisável. A exposição do metabolito47 ativo aumentou em menor grau. O efeito da IAP do ticagrelor foi independente da diálise57 em pacientes com doença renal29 terminal e semelhante a indivíduos com função renal29 normal.
Não é necessário ajuste de dose em pacientes com insuficiência renal55.
Insuficiência hepática58: a Cmáx e a AUC48 para ticagrelor foram 12% e 23% maiores em pacientes com insuficiência hepática58 leve em comparação com indivíduos saudáveis, respectivamente, entretanto, o efeito de IAP de ticagrelor foi similar entre os dois grupos. Não é necessário ajuste de dose em pacientes com insuficiência hepática58 leve. O ticagrelor não foi estudado em pacientes com insuficiência hepática58 grave e não há informações sobre a farmacocinética em pacientes com insuficiência hepática58 moderada (ver itens “Posologia e Modo de Usar”, “Contraindicações” e “Advertências e Precauções”).
Etnia: pacientes de origem asiática têm uma biodisponibilidade média 39% mais alta em comparação com pacientes caucasianos. Pacientes autoidentificados como negros tiveram uma biodisponibilidade 18% menor de ticagrelor comparados a pacientes caucasianos. Em estudos de farmacologia59 clínica, a exposição (Cmáx e AUC48) de ticagrelor em indivíduos japoneses foi aproximadamente 40% (20% após o ajuste para o peso corporal) maior comparada com a de caucasianos. A exposição em pacientes autoidentificados como hispânicos ou latinos foi semelhante aos caucasianos.
Dados de segurança pré-clínica
Dados pré-clínicos para o ticagrelor e o principal metabólito47 não demonstraram risco inaceitável para efeitos adversos para humanos baseado em estudos convencionais de farmacologia59 de segurança, toxicidade60 de dose única e repetida e potencial genotóxico.
Reações adversas não observadas em estudos clínicos, mas observadas em animais com níveis de exposição similar ou superior aos níveis de exposição clínica e com possível relevância para o uso clínico foram: toxicidade60 GI (gastrointestinais) e irritação gastrointestinal.
Não foram observados tumores relacionados ao composto em um estudo de 2 anos com camundongos em doses orais até 250 mg/kg/dia (> 18 vezes a exposição terapêutica61 humana máxima). Não houve aumento nos tumores em ratos machos em doses orais até 120 mg/kg/dia (> 15 vezes a exposição terapêutica61 humana máxima). Houve um aumento de adenocarcinomas uterinos e adenomas hepatocelulares mais adenocarcinomas e uma redução nos adenomas hipofisários e fibroadenomas mamários em ratas expostas somente a altas doses (> 25 vezes a exposição terapêutica61 humana máxima). Não foi observada alteração na incidência62 de tumores em doses de 60 mg/kg/dia (diferença de 8 vezes para a exposição terapêutica61 humana máxima). Os tumores uterinos observados apenas em ratos foram achados ser o resultado de um efeito endócrino63 não-genotóxico do desequilíbrio hormonal presente em ratos que receberam altas doses de ticagrelor. Os tumores benignos do fígado64 são considerados secundários a resposta pelo fígado64 para a carga metabólica localizada no fígado64 a partir de doses elevadas de ticagrelor.
O ticagrelor foi testado em uma faixa de testes in vitro e in vivo e não foi mostrado ser genotóxico.
O ticagrelor não demonstrou ter efeito na fertilidade de ratas fêmeas em doses orais até 200 mg/kg por dia (aproximadamente 20 vezes a exposição terapêutica61 humana máxima) e não teve efeito sobre a fertilidade de ratos machos em doses até 180 mg/kg/dia (15,7 vezes a exposição terapêutica61 humana máxima).
Em estudos de toxicologia reprodutiva, ratas grávidas receberam ticagrelor durante a organogênese em doses de 20 a 300 mg/kg/dia. 20 mg/kg/dia é aproximadamente o mesmo que a dose máxima recomendada para humanos (DMRH) de 90 mg duas vezes por dia para um ser humano de 60 kg numa base mg/m2. As reações adversas em prole ocorreram em doses de 300 mg/kg/dia (16,5 vezes a DMRH em mg/m2) e incluíram lobo de fígado64 e costelas65 supranumerárias, ossificação incompleta de esterno66, articulação67 deslocada da pelve68 e esterno66 disformes/desalinhadas. Na dose média de 100 mg/kg/dia (5,5 vezes a DMRH em mg/m2), foram observados atrasos no desenvolvimento do fígado64 e esqueleto69. Quando coelhas grávidas receberam ticagrelor durante a organogênese em doses de 21 a 63 mg/kg/dia, fetos expostos à maior dose materna de 63 mg/kg/dia (6,8 vezes o DMRH com base em mg/m2) tiveram o desenvolvimento da vesícula biliar70 retardado e ossificação incompleta do osso hioide71, púbis72 e esterno66.
Em um estudo pré-natal/pós-natal, ratas grávidas receberam ticagrelor em doses de 10 a 180 mg/kg/dia durante o final da gestação e lactação73. Foram observadas morte dos filhotes e efeitos no crescimento dos mesmos a doses de 180 mg/kg/dia (aproximadamente 10 vezes a DMRH com base em mg/m2). Efeitos relativamente menores, como atrasos no desdobramento da orelha74 e abertura ocular, ocorreram em doses de 10 e 60 mg/kg (aproximadamente metade e 3,2 vezes a DMRH em mg/m2 base).
CONTRAINDICAÇÕES
Artag é contraindicado a pacientes com hipersensibilidade ao ticagrelor ou a qualquer componente da fórmula.
Este medicamento é contraindicado a pacientes com sangramento patológico ativo, com antecedente de hemorragia30 intracraniana e/ou com insuficiência hepática58 grave (ver itens “Reações Adversas”, “ Posologia e Modo de Usar”, “Advertências e Precações” e “Propriedades Farmacocinéticas”).
A administração concomitante de ticagrelor com inibidores potentes do CYP3A4 (por exemplo, cetoconazol, claritromicina, nefazodona, ritonavir e atazanavir), pode levar a um aumento substancial da exposição ao ticagrelor (ver item “Interações Medicamentosas”).
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
ADVERTÊNCIAS E PRECAUÇÕES
Risco de sangramento
Assim como com outros agentes antiplaquetários, o uso de Artag em pacientes com conhecido risco aumentado de sangramento deve ser balanceado em relação ao benefício em termos de prevenção de eventos trombóticos2. Se clinicamente indicado, Artag deve ser utilizado com cuidado nos seguintes grupos de pacientes:
- Pacientes com propensão a sangrar (por exemplo, devido a um trauma recente, cirurgia recente, sangramento gastrointestinal ativo ou recente, ou insuficiência hepática58 moderada) ou que se encontram sob risco aumentado de trauma. O uso de Artag é contraindicado em pacientes com sangramento patológico ativo e em pacientes com antecedente de hemorragia30 intracraniana e insuficiência hepática58 grave (ver item “Contraindicações”).
- Pacientes com administração concomitante de medicamentos que podem aumentar o risco de sangramento (por exemplo, anti-inflamatórios não-esteroidais (AINEs), anticoagulantes75 orais e/ou fibrinolíticos dentro de 24 horas da dose de Artag).
A transfusão76 de plaquetas38 não reverteu o efeito antiagregante plaquetário de ticagrelor em voluntários saudáveis e é improvável que apresente benefício clínico em pacientes com sangramento. O ticagrelor circulante pode inibir as plaquetas38 transfundidas. Uma vez que a coadministração de ticagrelor com desmopressina não diminuiu o tempo de sangramento padrão, é improvável que a desmopressina seja efetiva no manuseio clínico do sangramento.
Terapia antifibrinolítica (ácido aminocapróico ou ácido tranexâmico) e/ou terapia com fator VIIa recombinante pode aumentar a hemostasia77. Artag pode ser retomado após a causa de sangramento ter sido identificada e controlada.
Cirurgia
Se um paciente necessita de cirurgia, os médicos devem considerar o perfil clínico de cada paciente, bem como os benefícios e riscos da terapia antiplaquetária continuada determinando quando a interrupção do tratamento de Artag deve ocorrer.
Nos pacientes do estudo PLATO que se submeteram a RM, ticagrelor apresentou uma taxa similar de sangramentos maior em comparação ao clopidogrel em todos os dias da terapia com exceção do Dia 1 onde ticagrelor teve a maior taxa de sangramento.
Se um paciente for submetido a cirurgia eletiva78 e efeito antiplaquetário não é desejado, Artag deve ser interrompido 5 dias antes da cirurgia. (ver item “Propriedades Farmacodinâmicas”).
Pacientes com AVC isquêmico10 prévio
Pacientes com SCA e com AVC isquêmico10 anterior podem ser tratados com Artag por até 12 meses (estudo PLATO).
No estudo PEGASUS, pacientes com história de infarto do miocárdio3 com AVC isquêmico10 prévio não foram incluídos.
Portanto, na ausência de dados, não é recomendado o tratamento desses pacientes após um ano.
Pacientes com insuficiência hepática58 moderada
Existe uma experiência limitada com ticagrelor em pacientes com insuficiência hepática58 moderada, portanto, é aconselhada cautela nesses pacientes. Artag é contraindicado em pacientes com insuficiência hepática58 grave (ver itens “Posologia e Modo de Usar”, “Contraindicações” e “Características Farmacológicas - Propriedades Farmacocinéticas”).
Bradiarritmia
A monitorização por Holter21 ECG demonstrou, na maioria das vezes, uma frequência aumentada de pausas ventriculares assintomáticas durante o tratamento com ticagrelor em comparação com o clopidogrel. Nos estudos de fase 3 para avaliação da segurança e eficácia de ticagrelor, os eventos bradiarrítmicos foram relatados em uma frequência similar para o ticagrelor e comparadores (placebo27, clopidogrel e ácido acetilsalicílico). Pacientes com um risco aumentado de eventos bradicárdicos (por exemplo, pacientes sem marcapasso22 que tinham síndrome5 do nó sinoatrial79, bloqueio atrioventricular de 2º ou 3º grau ou síncope80 relacionada à bradicardia81) foram excluídos dos estudos pivotais de ticagrelor. Portanto, devido à experiência clínica limitada nestes pacientes, recomenda-se precaução (ver também item “Propriedades Farmacodinâmicas”).
Eventos bradiarrítmicos e bloqueios atrioventriculares foram relatados no cenário pós-comercialização em pacientes tomando ticagrelor (ver item “Reações Adversas”), principalmente em pacientes com Síndrome5 Coronariana Aguda (SCA), para os quais a isquemia15 cardíaca e fármacos concomitantes que reduzem a frequência cardíaca ou afetam a condução cardíaca são potenciais fatores de confusão. A condição clínica do paciente e a medicação concomitante devem ser avaliadas como causas potenciais antes de ajustar o tratamento.
Apneia82 Central do Sono
Apneia82 central do sono, incluindo respiração de Cheyne-Stokes, foi relatada no cenário pós- comercialização em pacientes tomando ticagrelor. Se houver suspeita de apneia82 central do sono, uma avaliação clínica adicional deve ser considerada.
Púrpura83 Trombocitopênica Trombótica84 (PTT)
A púrpura83 trombocitopênica trombótica84 foi reportada muito raramente com o uso de ticagrelor. PTT é uma condição séria e requer tratamento imediato.
Interferência com testes laboratoriais
Testes de função plaquetária para diagnosticar trombocitopenia85 induzida pela heparina (TIH) Resultados falso-negativos no teste da função plaquetária para trombocitopenia85 induzida por heparina (TIH) foram relatados em pacientes que receberam ticagrelor. Isso está relacionado à inibição do receptor P2Y12 nas plaquetas38 de doador saudável no teste com soro86/plasma87 do paciente com ticagrelor. A informação sobre o tratamento concomitante com ticagrelor é necessária para interpretação dos testes de função plaquetária da TIH.
Antes de considerar a descontinuação do ticagrelor, o risco/benefício de continuar o tratamento deve ser avaliado, considerando tanto o estado protrombótico da TIH quanto o risco aumentado de hemorragia30 com tratamento concomitante com anticoagulante88 e ticagrelor.
Dispneia31
Dispneia31, geralmente de leve a moderada intensidade e frequentemente de resolução espontânea sem a necessidade de descontinuação do tratamento, foi relatada em pacientes tratados com ticagrelor (ver item “Reações Adversas”).
Pacientes com asma89 ou doença pulmonar obstrutiva crônica (DPOC) podem ter um risco absoluto aumentado de ocorrência de dispneia31 durante o uso com ticagrelor e, portanto, o ticagrelor deve ser utilizado com precaução em pacientes com histórico de asma89 e/ou DPOC.
O mecanismo associado a este achado ainda não foi elucidado. Se o paciente relatar nova, prolongada ou piora da dispneia31 deve-se fazer uma investigação completa e se não tolerado, o tratamento com Artag deve ser descontinuado.
Aumento de ácido úrico
A hiperuricemia pode ocorrer durante o tratamento com ticagrelor (ver item “Reações Adversas”). Aconselha-se precaução em doentes com história de hiperuricemia ou artrite90 gotosa. Como medida de precaução, o uso de ticagrelor em pacientes com nefropatia91 por ácido úrico não é recomendado.
Outros
Baseado na relação observada no estudo PLATO entre a dose de manutenção de ácido acetilsalicílico e a eficácia relativa do ticagrelor em comparação ao clopidogrel, a coadministração de ticagrelor com altas doses de ácido acetilsalicílico (>300 mg) não é recomendada (ver item “Propriedades Farmacodinâmicas”). A coadministração de Artag com potentes inibidores da CYP3A4 (por exemplo, cetoconazol, claritromicina, nefazodona, ritonavir e atazanavir) deve ser evitada visto que a coadministração pode levar a um aumento substancial de exposição ao Artag (ver item “Interações Medicamentosas”).
Descontinuações
Os pacientes que requerem a descontinuação de Artag estão em risco aumentado para eventos cardíacos ou AVC. A descontinuação prematura do tratamento deve ser evitada. Se Artag tiver que ser temporariamente interrompido devido a evento(s) adverso(s), o tratamento deve ser reiniciado assim que os benefícios superarem os riscos do evento adverso ou quando o evento adverso for resolvido (ver item “Posologia e Modo de Usar”).
Efeitos na habilidade de dirigir e operar máquinas
Não foram realizados estudos sobre os efeitos de ticagrelor sobre a capacidade de dirigir veículos e utilizar máquinas. É esperado que Artag não tenha influência ou é insignificante, sobre a capacidade de dirigir veículos e utilizar máquinas. Durante o tratamento Artag, tontura92 e confusão foram relatadas. Portanto, pacientes que apresentarem estes sintomas13 devem ser cautelosos enquanto estiverem dirigindo ou utilizando máquinas.
Informações importantes sobre um dos componentes do medicamento
Atenção: este medicamento contém MANITOL (114 mg/comprimido), portanto, deve ser usado com cautela e a critério médico em pacientes portadores de diabetes93.
Artag contém manitol, que pode ter um leve efeito laxativo94.
Fertilidade, Gravidez95 e Lactação73
O ticagrelor não teve efeito na fertilidade masculina ou feminina em animais (ver item “Dados de Segurança Pré-Clínica”).
Categoria C – Não há estudos adequados em mulheres. Em experiências animais ocorreram alguns efeitos colaterais96 no feto97, mas o benefício do produto pode justificar o risco potencial durante a gravidez95.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Não foi conduzido estudo clínico em mulheres grávidas ou lactantes98.
Dados clínicos limitados sobre a exposição de ticagrelor durante a gravidez95 estão disponíveis.
Estudos em animais demonstraram toxicidade60 reprodutiva a níveis plasmáticos superiores aos da dose clínica pretendida (ver item “Características Farmacológicas – Dados de Segurança Pré-clínica”).
Estudos em animais não indicam efeitos prejudiciais diretos com relação a gravidez95, desenvolvimento embrionário/fetal, parto ou desenvolvimento pós-natal nos níveis plasmáticos equivalente à dose clínica
pretendida. Como estudos de reprodução99 animal nem sempre são preditivos de uma resposta humana, o ticagrelor deve ser usado durante a gravidez95 somente se o benefício potencial para a mãe justificar qualquer risco potencial para o feto97.
Não se sabe se este medicamento é excretado no leite humano. Estudos em ratos demonstraram que o ticagrelor e metabólitos100 ativos são excretados no leite. O uso de Artag durante a amamentação101 não é recomendado.
INTERAÇÕES MEDICAMENTOSAS
Efeitos de outros medicamentos em Artag
Medicamentos metabolizados pela CYP3A4
Cetoconazol (potentes inibidores da CYP3A4): a coadministração de cetoconazol com ticagrelor aumentou a Cmáx e AUC48 de ticagrelor igual a 2,4 vezes e 7,3 vezes, respectivamente. A Cmáx e AUC48 do metabólito47 ativo foram reduzidas em 89% e 56%, respectivamente. Outros potentes inibidores da CYP3A4 (claritromicina, nefazodona, ritonavir e atazanavir), devem ter efeitos similares e não devem ser administrados concomitantemente com Artag (ver item “Advertências e Precauções”).
Diltiazem (inibidores moderados da CYP3A4): a coadministração de ticagrelor e diltiazem aumentou a Cmax de ticagrelor em 69% e a AUC48 em 174% e diminuiu a Cmáx do metabólito47 ativo em 38% e a AUC48 não foi alterada. Não houve efeito de ticagrelor nos níveis plasmáticos do diltiazem. Outros moderados inibidores da CYP3A4 (por exemplo, amprenavir, aprepitanto, eritromicina, fluconazol e verapamil) podem ser coadministrados com Artag.
Rifampicina e outros indutores da CYP3A4: a coadministração de rifampicina com ticagrelor diminuiu a Cmax e AUC48 de ticagrelor em 73% e 86%, respectivamente. A Cmáx do metabólito47 ativo foi inalterada e a AUC48 diminuiu em 46%, respectivamente. Também é esperado que outros indutores da CYP3A4 (por exemplo, fenitoína, carbamazepina e fenobarbital) diminuam a exposição ao ticagrelor. A coadministração de ticagrelor com indutores potentes do CYP3A4 pode diminuir a exposição e a eficácia de ticagrelor, portanto, o seu uso concomitante com ticagrelor não é recomendado.
Ciclosporina (GpP – glicoproteína P e inibidor CYP3A): a coadministração de ciclosporina (600 mg) com ticagrelor aumentou a Cmáx e AUC48 de ticagrelor em 2,3 vezes e 2,8 vezes, respectivamente. A AUC48 do metabólito47 ativo aumentou 32% e a Cmáx diminuiu 15% na presença da ciclosporina. Não houve efeito de ticagrelor nos níveis plasmáticos da ciclosporina.
Não há dados disponíveis sobre a utilização concomitante de ticagrelor com outras substâncias ativas que também sejam inibidores potentes da GpP e inibidores moderados do CYP3A4 (por exemplo, verapamil, quinidina) que também possam aumentar a exposição ao ticagrelor. Se a associação não puder ser evitada, seu uso concomitante deve ser feito com cautela.
Outros: Estudos de interação de farmacologia59 clínica demonstraram que a coadministração de ticagrelor com heparina, enoxaparina e AAS não têm qualquer efeito sobre os níveis plasmáticos de ticagrelor ou do metabólito47 ativo. A coadministração de ticagrelor e heparina não teve efeito sobre a heparina baseado nos testes de Tempo de Tromboplastina102 Parcial ativada (TTPa) e Tempo de Coagulação103 Ativado (TCA). A coadministração de ticagrelor e enoxaparina não teve efeito sobre a enoxaparina com base no teste de fator Xa.
Uma exposição menor e tardia aos inibidores P2Y12 por via oral, incluindo o ticagrelor e o seu metabolito47 ativo, foi reportada em pacientes tratados com morfina (aproximadamente 35% de redução no ticagrelor). Essa interação pode estar relacionada à redução da motilidade gastrintestinal, portanto, se aplica a outros opioides. A relevância clínica é desconhecida.
Devido a potenciais interações farmacodinâmicas, deve-se ter precaução na administração concomitante de ticagrelor com medicamentos conhecidos por alterarem a hemostase.
Devido a relatos de anormalidades hemorrágicas104 cutâneas105 com ISRSs -inibidor seletivo da recaptação de serotonina (por exemplo, paroxetina, sertralina e citalopram), recomenda-se cautela ao administrar ISRSs com ticagrelor, pois isso pode aumentar o risco de sangramento.
Efeitos de Artag em outros medicamentos
- Medicamentos metabolizados pela CYP3A4
Sinvastatina: a coadministração de ticagrelor com sinvastatina aumentou a Cmáx da sinvastatina em 81% e a AUC48 em 56% e aumentou a Cmáx em 64% e a AUC48 em 52% da sinvastatina ácida, com alguns aumentos individuais iguais a 2 a 3 vezes. Consideração de significância clínica deve ser dada referente a magnitude e variação de alterações na exposição a sinvastatina em pacientes que requerem mais de 40 mg de sinvastatina. Não houve efeito da sinvastatina nos níveis plasmáticos de ticagrelor. Artag pode ter efeito similar sobre a lovastatina, mas não é esperado ter um efeito clinicamente significativo sobre outras estatinas.
A utilização concomitante de ticagrelor com doses de sinvastatina ou lovastatina superiores a 40 mg não é recomendada.
O ticagrelor é um inibidor leve do CYP3A4. A coadministração de ticagrelor e substratos do CYP3A4 com índices terapêuticos estreitos (isto é, cisaprida ou alcaloides do Ergot) não é recomendada, uma vez que o ticagrelor pode aumentar a exposição a estes medicamentos.
Atorvastatina: a coadministração de atorvastatina e ticagrelor aumentou a Cmáx da atorvastatina ácida em 23% e a AUC48 em 36%. Aumentos similares na AUC48 e Cmáx foram observados para todos os metabólitos100 da atorvastatina ácida. Estes aumentos não são considerados clinicamente significativos.
Medicamentos metabolizados pela CYP2C9 – tolbutamida
A coadministração de ticagrelor com a tolbutamida não resultou em alteração dos níveis plasmáticos de cada fármaco106, o que sugere que ticagrelor não é um inibidor da CYP2C9 e é improvável que altere o metabolismo52 de fármacos mediados pela CYP2C9 como a varfarina e a tolbutamida.
Anticoncepcionais orais: a coadministração de ticagrelor e levonorgestrel e etinilestradiol aumentou a exposição do etinilestradiol em aproximadamente 20%, mas não alterou a farmacocinética do levonorgestrel. Não é esperado efeito clinicamente relevante sobre a eficácia do contraceptivo oral quando levonorgestrel e etinilestradiol são coadministrados com ticagrelor.
Medicamentos conhecidos por induzir bradicardia81: devido a observações de pausas ventriculares e bradicardia81 predominantemente assintomáticas, deve ter-se cuidado ao administrar o ticagrelor concomitantemente com medicamentos conhecidos por induzir bradicardia81 (ver item “ Advertências e Precauções”). No entanto, não foi observada evidência de reações adversas clinicamente significativas no estudo PLATO após administração concomitante com um ou mais medicamentos conhecidos por induzir bradicardia81 (por exemplo, 96% de bloqueadores beta, 33% bloqueadores dos canais de cálcio diltiazem e verapamil e 4% digoxina).
Digoxina (substrato da GpP – glicoproteína P): a administração concomitante de ticagrelor aumentou a Cmáx da digoxina em 75% e a AUC48 em 28%. Portanto, monitoramento laboratorial e/ou clínico adequado é recomendado quando da administração de medicamentos dependentes da GpP– glicoproteína P de índice terapêutico estreito como a digoxina concomitantemente com ticagrelor.
Outras terapias concomitantes: em estudos clínicos, ticagrelor foi geralmente administrado com AAS, heparina, heparina de baixo peso molecular, inibidores da GpIIb/IIIa por via intravenosa, inibidores da bomba de prótons, estatinas, betabloqueadores, inibidores da enzima19 conversora da angiotensina e bloqueadores dos receptores da angiotensina, conforme a necessidade para condições concomitantes. Esses estudos não apresentaram qualquer evidência de interações adversas clinicamente significativas.
CUIDADOS DE ARMAZENAMENTO DO MEDICAMENTO
Cuidados de conservação
Artag deve ser mantido em temperatura ambiente (15–30°C).
Esse medicamento tem validade de 24 meses a partir da data de fabricação.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Características físicas e organolépticas do produto
Os comprimidos de Artag são apresentados da seguinte maneira: comprimido revestido verde claro, circular, biconvexo e liso.
Antes de usar, observe o aspecto do medicamento.
TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS.
POSOLOGIA E MODO DE USAR
Modo de usar
Artag deve ser administrado por via oral e pode ser ingerido com ou sem alimentos. Para os pacientes que não conseguem engolir o comprimido inteiro, Artag (90 mg e 2x90 mg) pode ser triturado a um pó fino e misturado em meio copo de água e ingerido imediatamente. O copo deve ser lavado com mais meio copo de água e o conteúdo deve ser ingerido. A mistura também pode ser administrada através de uma sonda nasogástrica107 (CH8 ou maior). É importante lavar a sonda nasogástrica107 com água após a administração da mistura.
Os comprimidos de Artag não devem ser partidos, abertos ou mastigados.
Posologia
Em pacientes com Síndromes Coronarianas Agudas, o tratamento de ticagrelor deve ser iniciado com uma dose única de 180 mg (dois comprimidos de 90 mg) e então continuado com a dose de 90 mg duas vezes ao dia. O tratamento é recomendado por pelo menos 12 meses, a menos que a interrupção do ticagrelor seja clinicamente indicada (item "Propriedades Farmacodinâmicas").
Em pacientes com Acidente Vascular Cerebral4 (AVC) Isquêmico10 Agudo8 ou Ataque Isquêmico10 Transitório (AIT), iniciar Artag com uma dose única de 180 mg (dois comprimidos de 90 mg) e então continuar com a dose de 90 mg duas vezes ao dia por 30 dias (ver item “Propriedades Farmacodinâmicas”).
Os pacientes que estiverem utilizando Artag devem também tomar uma dose baixa de manutenção diária de 75-150 mg de ácido acetilsalicílico (AAS). Uma dose inicial de ataque de ácido acetilsalicílico é recomendada em pacientes com SCA, AVC lsquêmico Agudo8 ou AIT (ver item “Propriedades Farmacodinâmicas”).
Esquecimento de dose
Lapsos durante a terapia devem ser evitados. Se o paciente esquecer-se de tomar uma dose de Artag deve tomar suapróxima doseno horário programado.
Interrupção prematura
A interrupção prematura com qualquer terapia antiplaquetária, incluindo Artag, pode resultar em um aumento do risco de morte cardiovascular (CV), infarto do miocárdio3 (IM) ou AVC devido à doença subjacente do paciente (ver item “Advertências e Precauções”).
Os médicos que desejam alterar a terapia para Artag devem administrar a primeira dose de Artag 24 horas após a última dose do outro medicamento antiplaquetário.
Populações Especiais
Pacientes pediátricos: a segurança e a eficácia em crianças abaixo de 18 anos de idade não foram estabelecidas.
Idosos: não é necessário ajuste de dose.
Pacientes com insuficiência renal55: não é necessário ajuste de dose para pacientes35 com insuficiência renal55 (ver item “Propriedades farmacocinéticas”).
Pacientes com insuficiência hepática58: não é necessário ajuste de dose para pacientes35 com insuficiência hepática58 leve. O ticagrelor não foi estudado em pacientes com insuficiência hepática58 grave e o uso nesses pacientes é, portanto, contraindicado. Apenas informações limitadas estão disponíveis em pacientes com insuficiência hepática58 moderada. O ajuste de dose não é recomendado, mas o ticagrelor deve ser usado com cautela (ver itens “Contraindicações”, “Advertências e Precauções” e “Propriedades Farmacocinéticas”).
REAÇÕES ADVERSAS
Sumário do perfil de segurança
O perfil de segurança de ticagrelor foi avaliado em um grande programa de desenvolvimento, em que mais de 58.000 pacientes e voluntários saudáveis receberam ticagrelor. Os dados sobre reações adversas ao medicamento identificadas em estudos clínicos ou em experiência pós-comercialização com ticagrelor são apresentados abaixo, incluindo informações de estudos clínicos específicos para as indicações aprovadas (PLATO, PEGASUS e THALES).
A segurança de ticagrelor em pacientes com síndrome5 coronariana aguda (AI, IAMSST e IAMCST) foi avaliada no estudo PLATO, que comparou os pacientes tratados com ticagrelor (90 mg duas vezes ao dia) com pacientes tratados com clopidogrel (75 mg uma vez ao dia) ambos administrados em associação com AAS e outras terapias padrão.
A duração mediana do tratamento para ticagrelor foi de 277 dias. No PLATO, os pacientes tratados com ticagrelor tiveram maior incidência62 de descontinuação devido a eventos adversos do que com o clopidogrel (7,4% vs 5,4%).
A segurança de ticagrelor em pacientes com história de infarto do miocárdio3 (IM ocorreu pelo menos um ano atrás) e alto risco de desenvolver um evento trombótico16 foi avaliada no estudo PEGASUS, que comparou pacientes tratados com 60 mg de ticagrelor duas vezes ao dia ou 90 mg duas vezes ao dia combinado com AAS com a terapia de AAS sozinho e outras terapias padrões. A duração mediana do tratamento para ticagrelor 60 mg duas vezes ao dia foi de 29,4 meses. No PEGASUS, os pacientes tratados com ticagrelor tiveram uma maior incidência62 de descontinuação devido a eventos adversos em comparação com a terapia de AAS sozinho (16,1% para ticagrelor 60 mg com AAS vs. 8,5% para a terapia AAS sozinho).
No estudo THALES, os pacientes tratados com ticagrelor em combinação com ácido acetilsalicílico (AAS) tiveram uma maior incidência62 de descontinuação do medicamento do estudo devido a eventos adversos em comparação com o tratamento com AAS sozinho (9,7% para ticagrelor 90 mg duas vezes ao dia em combinação com AAS vs. 7,6% para o tratamento com AAS sozinho).
As reações adversas ao medicamento mais comumente relatadas em pacientes tratados com ticagrelor foram sangramento e dispneia31 (ver item “Advertências e Precauções”).
Lista tabelada de reações adversas ao medicamento
Dentro de cada categoria de CSO e frequência, as reações adversas são apresentadas por ordem decrescente de gravidade.
As categorias de frequência são definidas de acordo com os seguintes parâmetros: muito comum (≥ 1/10), comum (≥ 1/100 a < 1/10), incomum (≥ 1/1.000 a < 1/100), rara (≥ 1/10.000 a < 1/1.000), muito rara (< 1/10.000), não conhecido (não pode ser estimada a partir dos dados disponíveis).
Tabela 4: Reações adversas a medicamentos observadas nos estudos clínicos
|
Classificação por Sistema de órgãos |
Muito comum |
Comum |
Incomum |
|
Neoplasias108 benignas, malignas e não especificadas (incluindo cistos e pólipos109) |
--- |
--- |
Hemorragias110 tumorais(b) |
|
Distúrbios do sangue111 e do sistema linfático112 |
Distúrbio hemorrágico113(c) |
--- |
--- |
|
Distúrbios do sistema imune114 |
|
|
Hipersensibilidade incluindo angioedema115 |
|
Distúrbios do metabolismo52 e nutrição116 |
Hiperuricemia(a) |
Gota117 |
--- |
|
Distúrbios psiquiátricos |
--- |
--- |
Confusão |
|
Distúrbios do Sistema Nervoso118 |
--- |
Tontura92, síncope80, dor de cabeça119 |
Hemorragia30 intracraniana(l) |
|
Distúrbios da visão120 |
--- |
--- |
Hemorragia30 ocular(d) |
|
Distúrbios do labirinto121 e audição |
--- |
Vertigem122 |
Hemorragia30 auricular |
|
Distúrbios vasculares17 |
--- |
Hipotensão123 |
--- |
|
Distúrbios respiratórios, torácico e do mediastino124 |
Dispneia31 |
Hemorragia30 do sistema respiratório125(e) |
--- |
|
Distúrbios gastrointestinais |
--- |
Hemorragia30 gastrointestinal(f), diarreia126, náusea127, dispepsia128, constipação129 |
Hemorragia30 retroperitoneal130 |
|
Distúrbios da pele e tecido subcutâneo131 |
--- |
Sangramento dérmico ou subcutâneo132(g), prurido133, rash134 |
--- |
|
Tecido conjuntivo135 do esqueleto69 muscular e osso |
--- |
--- |
Hemorragia30 muscular(h) |
|
Distúrbios renais e urinários |
--- |
Sangramento do trato urinário136(i) |
--- |
|
Distúrbios do Sistema reprodutivo e da mama137 |
--- |
--- |
Hemorragia30 do sistema reprodutivo(j) |
|
Investigações |
--- |
Creatinina138 sanguínea aumentada(a) |
--- |
|
Lesão46, intoxicação e complicações de procedimento |
--- |
Hemorragia30 pós-procedimento, hemorragia30 traumática(k) |
--- |
(a) frequências derivadas das observações laboratoriais (aumento do ácido úrico para > LSN abaixo da linha de base ou no intervalo de referência e aumento de creatinina138 > 50% do valor basal) e não da frequência de relatos brutos de eventos adversos.
(b) por exemplo: sangramento de câncer139 de bexiga140, câncer139 gástrico, câncer139 de cólon141.
(c) por exemplo: o aumento da tendência de contusão142, hematoma143 espontâneo, diátese hemorrágica144.
(d) por exemplo: hemorragia30 da conjuntiva145, da retina146, intraocular.
(e) por exemplo: epistaxe147, hemoptise148.
(f) por exemplo: sangramento gengival, hemorragia30 retal, hemorragia30 da úlcera gástrica149.
(g) por exemplo: equimose150, hemorragia30 da pele151, petéquias152.
(h) por exemplo: hemartrose, hemorragia30 muscular.
(i) por exemplo: hematúria153, cistite154 hemorrágica144.
(j) por exemplo: hemorragia vaginal155, hematospermia, hemorragia30 pós-menopausa156.
(k) por exemplo: contusão142, hematoma143 traumático, hemorragia30 traumática.
(l) isto é: hemorragia30 intracraniana traumática, relacionada a procedimentos ou espontânea.
Experiência pós-comercialização
As seguintes reações adversas foram identificadas no uso pós-comercialização de ticagrelor. Uma vez que estas reações são reportadas voluntariamente por uma população de tamanho desconhecido, não é sempre possível estimar com exatidão suas frequências.
Distúrbios do sistema nervoso118: apneia82 central do sono, incluindo respiração de Cheyne-Stokes (ver item “Advertências e Precauções”);
Distúrbios no sangue111: púrpura83 trombocitopênica trombótica84 (ver item “Advertências e Precauções”); Distúrbios cardíacos: bradiarritmia, bloqueios atrioventriculares (ver item “Advertências e Precauções”).
Descrição das reações adversas ao medicamento selecionadas
Sangramentos achados no estudo PLATO
Resultados gerais de eventos hemorrágicos157 no estudo PLATO são mostrados na Tabela 5.
Tabela 5. Análise de eventos de sangramento totais, estimativa Kaplan Meier das taxas de sangramento por tratamento aos 12 meses (PLATO)
|
Desfechos de segurança |
ticagrelor 90 mg duas vezes ao dia |
clopidogrel 75 mg uma vez ao dia |
p-valor |
|
|
KM% |
Hazard Ratio (95% IC) |
KM% |
||
|
Categorias de sangramento definição PLATO |
||||
|
Desfecho primário de segurança |
11,6 |
1,04 |
11,2 |
0,4336 |
|
Desfecho secundário |
5,8 |
1,03 |
5,8 |
0,6988 |
|
PLATO Maior Total or Menor |
16,1 |
1,11 |
14,6 |
0,0084 |
|
PLATO Não RM Maior |
4,5 |
1,19 |
3,8 |
0,0264 |
|
PLATO Não Procedimento Maior |
3,1 |
1,31 |
2,3 |
0,0058 |
|
PLATO Não Procedimento Maior ou Menor |
5,9 |
1,39 |
4,3 |
<0,0001 |
|
Categorias de sangramento definição TIMI |
||||
|
TIMI Maior |
7,9 |
1,03 |
7,7 |
0,5669 |
|
TIMI Maior ou Menor |
11,4 |
1,05 |
10,9 |
0,3272 |
Definições de categoria de sangramento:
PLATO Maior Fatal/Ameaça à Vida: sangramento fatal, OU qualquer sangramento intracraniano, OU intrapericárdico com tamponamento cardíaco ou choque hipovolêmico158 ou hipotensão123 grave, necessitando vasopressores/inotrópicos ou cirurgia OU diminuição na hemoglobina159 clinicamente aparente com > 50 g/L ou ≥ 4 unidades de glóbulos vermelhos transfundidos.
PLATO Maior outros: significativamente debilitante, OU diminuição na hemoglobina159 clinicamente aparente com 30-50 g/L, OU 2-3 unidades de glóbulos vermelhos transfundidos.
PLATO Menor: requerem intervenção médica para parar ou tratar o sangramento.
TIMI Maior: hemorragia30 fatal, OU qualquer hemorragia30 intracraniana, OU sinais160 clinicamente evidentes de hemorragia30 associada com uma queda na hemoglobina159 (Hb) de ≥ 50 g/L, ou quando Hb não está disponível, uma queda no hematócrito161 (Hct) de ≥ 15%.
TIMI Menor: diminuição na hemoglobina159 clinicamente aparente com 30-50 g/L
No estudo PLATO, tempo para o primeiro sangramento definido em PLATO como “Maior Total”, ticagrelor não diferiu significativamente do clopidogrel. Houve pouco sangramento fatal no estudo, 20 (0,2%) para ticagrelor 90 mg duas vezes ao dia e 23 (0,3%) para o clopidogrel 75 mg uma vez ao dia.
Quando o sangramento menor foi incluído, eventos de sangramento Maior e Menor definidos pelo PLATO combinados foram significativamente maiores para ticagrelor do para o clopidogrel. As taxas globais de eventos de sangramento definido pelo TIMI não diferiram significativamente entre ticagrelor e clopidogrel.
- Sangramento relacionado a cirurgia de RM: no estudo PLATO, 42 % dos 1584 pacientes (12% de coorte162) que foram submetidos à cirurgia de revascularização miocárdica (RM) tiveram um sangramento definido em PLATO como Maior Fatal/Ameaça à Vida com nenhuma diferença entre os grupos de tratamento. Sangramento fatal relacionado à RM ocorreu em 6 pacientes em cada grupo de tratamento (ver item “Advertências e Precauções”).
- Sangramento não relacionado à RM e sangramentos não relacionados à procedimentos: ticagrelor e clopidogrel não diferiram em sangramento Maior fatal/Ameaça a vida definido pelo PLATO não-RM, mas Maior total definido pelo PLATO, TIMI Maior e sangramento TIMI Maior + Menor, foram mais comuns com ticagrelor. Da mesma forma, ao remover todo o sangramento relacionado ao procedimento, ocorreu mais sangramento com ticagrelor do que com o clopidogrel (Tabela 5). A descontinuação do tratamento devido a sangramento não-processual foi mais comum para ticagrelor (2,9%) do que para o clopidogrel (1,2%; p < 0,001).
Idade, sexo, peso, etnia, região geográfica, condições concomitantes, terapias concomitantes, e antecedentes clínicos, incluindo um AVC prévio ou ataque isquêmico10 transitório, todos não preveem sangramento definido em PLATO como Maior tanto global como não relacionados à procedimentos.
Assim, nenhum grupo particular foi identificado sob risco para qualquer subconjunto de sangramento. Hemorragia30 intracraniana: Houve mais hemorragias110 intracranianas não relacionados à procedimentos com ticagrelor (n=27 sangramento em 26 pacientes, 0,3%) do que com clopidogrel (n=14 sangramentos, 0,2%), dos quais 11 sangramentos com ticagrelor e 1 com o clopidogrel foram fatais. Não houve diferença em sangramentos fatais globais. A porcentagem de hemorragia30 intracraniana foi baixa em ambos os grupos de tratamento dadas as comorbidades163 e fatores de risco cardiovasculares significativos da população em estudo.
Sangramentos achados no estudo PEGASUS
Resultados gerais de eventos hemorrágicos157 no estudo PEGASUS são mostrados na Tabela 6.
Tabela 6: Análise de eventos de sangramento totais, estimativa Kaplan Meier das taxas de sangramento por tratamento aos 36 meses (PEGASUS)
|
|
ticagrelor 60 mg duas vezes ao dia com AAS |
AAS sozinho |
p-valor |
|
|
Desfecho de Segurança |
KM% |
Hazard Ratio (95% IC) |
KM% |
|
|
Categorias de sangramento definição TIMI |
||||
|
TIMI Maior |
2,3 |
2,32 |
1,1 |
<0,0001 |
|
Fatal |
0,3 |
1,00 |
0,3 |
1,0000 |
|
HIC |
0,6 |
1,33 |
0,5 |
0,3130 |
|
Outros TIMI Maior |
1,6 |
3,61 |
0,5 |
<0,0001 |
|
TIMI Maior or Menor |
3,4 |
2,54 |
1,4 |
<0,0001 |
|
TIMI Maior ou Menor ou Requer atenção médica |
16,6 |
2,64 |
7,0 |
<0,0001 |
|
Categorias de sangramento definição PLATO |
||||
|
PLATO Maior |
3,5 |
2,57 |
1,4 |
<0,0001 |
|
Fatal/Ameaça à Vida |
2,4 |
2,38 |
1,1 |
<0,0001 |
|
Outros PLATO Maior |
1,1 |
3,37 |
0,3 |
<0,0001 |
|
PLATO Maior or Menor |
15,2 |
2,71 |
6,2 |
<0,0001 |
Definições de categoria de sangramento:
TIMI Maior: hemorragia30 fatal, OU qualquer hemorragia30 intracraniana, OU sinais160 clinicamente evidentes de hemorragia30 associada com uma queda na hemoglobina159 (Hb) de ≥ 50 g/L, ou quando Hb não está disponível, uma queda no hematócrito161 (Hct) de ≥ 15%.
Fatal: Um evento de sangramento que conduziu diretamente à morte no prazo de 7 dias.
HIC: Hemorragia30 intracraniana.
Outros TIMI Maior: sangramento TIMI Maior não-fatal, não HIC.
TIMI Menor: diminuição na hemoglobina159 clinicamente aparente com 30-50 g/L.
TIMI que requerem atenção médica: Exigem intervenção OU conduzem à hospitalização, OU solicitam avaliação.
PLATO Maior Fatal/Ameaça à Vida: sangramento fatal, OU qualquer sangramento intracraniano, OU intrapericárdico com tamponamento cardíaco ou choque hipovolêmico158 ou hipotensão123 grave, necessitando vasopressores/inotrópicos ou cirurgia OU diminuição na hemoglobina159 clinicamente aparente com > 50 g/L ou ≥ 4 unidades de glóbulos vermelhos transfundidos.
PLATO Maior outros: significativamente debilitante, OU diminuição na hemoglobina159 clinicamente aparente com 30-50 g/L, OU 2-3 unidades de glóbulos vermelhos transfundidos.
PLATO Menor: requerem intervenção médica para parar ou tratar o sangramento.
No PEGASUS, sangramento TIMI Maior para ticagrelor 60 mg duas vezes ao dia, foi maior do que para a AAS sozinho. Não foi observado aumento no risco de hemorragia30 fatal e apenas um pequeno aumento foi observado em hemorragias110 intracranianas, em comparação com a terapia do AAS sozinho. Houve poucos eventos de hemorragia30 fatal no estudo, 11 (0,3%) para ticagrelor 60 mg duas vezes ao dia e 12 (0,3%) para a terapia de AAS sozinho. O aumento do risco observado de sangramento TIMI Maior com ticagrelor 60 mg foi devido principalmente a uma maior frequência de sangramento Outros TIMI Maior impulsionado por eventos na CSO gastrointestinal.
Aumento dos padrões de sangramento semelhante à TIMI maior foram vistos para categorias de sangramentos TIMI maior ou menor e PLATO-definido Maior e PLATO-definido maior ou menor (ver Tabela 6). A descontinuação do tratamento devido a sangramento era mais comum com ticagrelor 60 mg duas vezes ao dia em comparação com a terapia AAS sozinho (6,2% e 1,5%, respectivamente). A maioria desses sangramentos foram de menor gravidade (classificado como TIMI que requerem atenção médica), por exemplo, epistaxe147, contusões e hematomas164.
O perfil de sangramento de ticagrelor 60 mg duas vezes ao dia foi consistente em vários subgrupos pré- definidos (por exemplo, por idade, gênero, peso, raça, região geográfica, condições concomitantes, terapia concomitante, e história médica) para eventos de sangramento TIMI maior, TIMI maior ou menor e PLATO maior.
Hemorragia30 intracraniana: HICs espontâneas foram relatadas em taxas semelhantes para ticagrelor 60 mg duas vezes ao dia e terapia AAS sozinho (n=13, 0,2% em ambos os grupos de tratamento). HICs traumática e procedimental apresentaram um menor aumento com ticagrelor 60 mg, (n=15, 0,2%) comparado com a terapia do AAS sozinho (n=10, 0,1%). Houve 6 HICs fatais com ticagrelor 60 mg e 5 HICs fatais com a terapia AAS sozinho. A incidência62 de hemorragia30 intracraniana foi baixa em ambos os grupos de tratamento dadas as comorbidades163 e fatores de risco cardiovasculares significativos da população em estudo.
Sangramentos achados no estudo THALES
O resultado geral dos eventos hemorrágicos157 no estudo THALES é mostrado na Tabela 7.
Tabela 7. Análise de eventos de sangramento, estimativa de Kaplan-Meier das taxas de sangramento por tratamento em 30 dias (THALES)a
|
|
ticagrelor 90 mg duas vezes ao dia com AAS |
AAS sozinho |
p-valor |
|||
|
Desfecho de segurança |
Pacientes com eventos |
KM% |
Razão de risco (IC 95%) |
Pacientes com eventos |
KM% |
|
|
Categorias de Sangramento GUSTO |
||||||
|
Severa |
28 (0,5%) |
0,5% |
3,99 |
7 (0,1%) |
0,1% |
0,001 |
|
Severa ou Moderada |
36 (0,7%) |
0,6% |
3,27 |
11 (0,2%) |
0,2% |
<0,001 |
Categoria de sangramento:
GUSTO Grave: Qualquer um dos seguintes: sangramento fatal, sangramento intracraniano (excluindo transformações hemorrágicas104 assintomáticas de infartos cerebrais isquêmicos e excluindo micro-hemorragias110 < 10 mm evidentes apenas na imagem de ressonância magnética165 gradiente-eco), sangramento que causou comprometimento hemodinâmico que requer intervenção (por exemplo, pressão sanguínea sistólica < 90 mm Hg que requer reposição de sangue111 ou fluidos, ou vasopressor/suporte inotrópico ou intervenção cirúrgica).
GUSTO Moderado: Sangramento requerendo transfusão76 de sangue111 total ou concentrado de hemácias166 sem comprometimento hemodinâmico (conforme definido acima).
a Conjunto de análise completo - análise por intenção de tratar: incluiu todos os pacientes randomizados, independentemente de sua adesão ao protocolo e participação contínua no estudo.
No THALES, a taxa de hemorragia30 grave de GUSTO para ticagrelor 90 mg duas vezes ao dia em combinação com AAS foi superior do que para AAS sozinho. Um padrão de sangramento semelhante foi observado para a categoria de sangramento GUSTO Grave ou Moderada (ver Tabela 7). Devido ao baixo número de eventos hemorrágicos157 graves de GUSTO, nenhuma conclusão pode ser tirada quanto ao risco de sangramento entre os subgrupos. A descontinuação do tratamento devido a hemorragia30 foi mais comum com ticagrelor 90 mg com AAS em comparação com a terapêutica61 com AAS isoladamente (2,9% e 0,6%, respetivamente).
Sangramento intracraniano e sangramento fatal: no total, houve 21 hemorragias110 intracranianas (HICs) (19 espontâneas, 1 traumática, 1 processual) para ticagrelor 90 mg com AAS e 6 HICs (3 espontâneas, 2 traumáticas, 1 processual) para AAS sozinho. Ocorreram hemorragias110 fatais em 11 pacientes (10 HICs fatais, 1 hemorragia30 gastrointestinal fatal) com ticagrelor 90 mg com AAS e em 2 pacientes (2 HICs fatais) apenas com AAS.
Dispneia31
No estudo PLATO, Eventos Adversos de dispneia31 foram relatados em 13,8% dos pacientes tomando ticagrelor 90 mg duas vezes ao dia e em 7,8% dos pacientes tomando clopidogrel 75 mg uma vez ao dia. A maior parte dos eventos adversos de dispneia31 reportados foi de intensidade leve a moderada, e, normalmente resolvida sem a necessidade de interrupção do tratamento. Dispneia31 foi geralmente relatada na fase inicial do tratamento e 87% dos pacientes que referiram dispneia31, relataram ter apresentado um único episódio. Eventos adversos sérios de dispneia31 foram relatados em 0,7% dos pacientes tomando ticagrelor e em 0,4%, dos pacientes tomando clopidogrel. Os pacientes que relataram dispneia31 tendiam ser mais velhos e mais frequentemente apresentavam dispneia31, ICC, DPOC ou asma89 no basal. Dados do estudo PLATO não sugerem que a maior frequência com ticagrelor é devido ao aparecimento ou agravamento de doença cardíaca ou pulmonar. Não havia nenhuma indicação de um efeito adverso de ticagrelor sobre a função pulmonar (ver item “Advertências e Precauções”).
No PEGASUS dispneia31 foi relatada em 14,2% dos pacientes que tomaram ticagrelor 60 mg duas vezes ao dia e em 5,5% dos doentes que tomaram AAS sozinho. Assim como no PLATO, a maior parte de dispneia31 reportada foi de intensidade leve a moderada (ver item “Advertências e Precauções”).
No estudo THALES, a dispneia31 levou à descontinuação do medicamento em estudo em 1,0% e 0,2% dos pacientes que tomaram ticagrelor 90 mg em combinação com AAS vs. AAS isoladamente, respectivamente.
Em casos de eventos adversos, notifique pelo Sistema VigiMed, disponível no Portal da Anvisa.
Atenção: este produto é um medicamento que possui nova indicação terapêutica61 no país e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos. Nesse caso, notifique os eventos adversos pelo Sistema VigiMed, disponível no Portal da Anvisa.
SUPERDOSE
Atualmente não há antídoto167 disponível para reverter os efeitos do ticagrelor e ele não é dialisável (ver item “Propriedades Farmacocinéticas”). O tratamento da superdose deve seguir a prática médica local padrão. O efeito esperado da dose excessiva de ticagrelor é a duração prolongada do risco de sangramento associado com a inibição plaquetária. Se ocorrer sangramento, devem ser tomadas medidas de suporte apropriadas.
O ticagrelor é bem tolerado em doses únicas de até 900 mg. A toxicidade60 gastrointestinal foi dose-limitante em um único estudo de aumento de dose. Outros efeitos adversos significativos que podem ocorrer com a superdosagem incluem dispneia31 e pausas ventriculares.
Em caso de superdosagem, deve-se observar os efeitos adversos potenciais e considerar o monitoramento ECG.
Em caso de intoxicação ligue para 0800 722 6001, se você precisar de mais orientações.
DIZERES LEGAIS
VENDA SOB PRESCRIÇÃO MÉDICA
MS nº: 1.0033.0221
Farm. Resp.: Cintia Delphino de Andrade – CRF-SP nº 25.125
Registrado por:
Libbs Farmacêutica Ltda.
Av. Marques de São Vicente, 2.219, 2º andar – São Paulo – SP
CNPJ: 61.230.314/0001-75
Fabricado por:
Libbs Farmacêutica Ltda.
Rua Alberto Correia Francfort, 88 – Embu das Artes – SP
Indústria Brasileira
SAC 0800 0135044