

Relenza (Bula do profissional de saúde)
GLAXOSMITHKLINE BRASIL LTDA
IDENTIFICAÇÃO DO MEDICAMENTO
Relenza
zanamivir
Pó para inalação oral
FORMA FARMACÊUTICA E APRESENTAÇÃO:
Pó para inalação oral, acondicionado em Rotadisk. O Rotadisk é um disco em folha dupla de alumínio, com quatro bolhas. Cada uma armazena uma mistura de pó micronizado que contém 5 mg de zanamivir.
A embalagem contém 20 doses apresentadas em cinco Rotadisk com quatro doses cada, acompanhados de um Diskhaler.
USO ORAL
USO ADULTO E PEDIÁTRICO A PARTIR DE 5 ANOS
COMPOSIÇÃO:
Cada dose de Relenza contém:
| zanamivir | 5 mg |
| excipiente q.s.p. | 1 dose |
Excipientes: lactose mono-hidratada (contém proteína do leite).
INFORMAÇÕES TÉCNICAS AOS PROFISSIONAIS DE SAÚDE
INDICAÇÕES
Relenza é indicado para o tratamento e para a profilaxia da gripe causada pelo vírus influenza tipos A e B, em adultos e crianças a partir de 5 anos.
RESULTADOS DE EFICÁCIA
O zanamivir foi 67% eficaz na prevenção de influenza e 84% eficaz na prevenção de quadros clínicos febris. Os dados foram confirmados por testes laboratoriais. Todas as ocorrências de infecção por influenza, com ou sem sintomas, foram prevenidas com eficácia de 31%1.
Em comparação com placebo, zanamivir reduziu de forma significativa o tempo para o alívio dos sintomas (média de 7,5 e 5 dias, respectivamente), com redução de 33% na duração do quadro clínico. A proporção de pacientes sem febre, após 24 horas, foi 46% maior em relação a placebo2.
O tempo médio de resolução de sintomas em pacientes infectados com o vírus da influenza foi diminuído em 1 a 1,5 dias com o uso de zanamivir, quando comparado ao placebo3.
- MONTO, AS, et al. Zanamivir in the prevention of influenza among healthy adults: a randomized controlled trial. JAMA. 282(1):31-5, 1999.
- MAKELA, MJ, et al. Clinical efficacy and safety of the orally inhaled neuraminidase inhibitor zanamivir in the treatment of influenza: a randomized, double-blind, placebo-controlled European study. J Infect. 40(1):42-8, 2000.
- LOWEN AC, Palese P. Influenza virus transmission: basic science and implications for the use of antiviral drugs during a pandemic. Infect Disord Drug Targets. 2007 Dec;7(4):318-28.
CARACTERÍSTICAS FARMACOLÓGICAS
Propriedades farmacodinâmicas
Mecanismo de ação: O zanamivir é um inibidor potente e altamente seletivo da neuraminidase, uma enzima de superfície do vírus influenza. A neuraminidase viral auxilia na liberação de partículas virais recém-formadas das células infectadas. Ela pode facilitar o acesso do vírus pelo muco a superfícies de células epiteliais, permitindo a infecção viral de outras células. A inibição dessa enzima é refletida na atividade in vitro e in vivo contra a replicação do vírus influenza tipos A e B, englobando todos os subtipos conhecidos de neuraminidase do vírus influenza A.
A atividade do zanamivir é extracelular. Ele reduz a propagação do vírus influenza tipos A e B, inibindo a liberação de vírions infecciosos de influenza a partir das células infectadas do epitélio do trato respiratório. A replicação do vírus influenza está limitada ao tecido epitelial superficial do trato respiratório. A eficácia da administração tópica do zanamivir nesse local foi confirmada em estudos clínicos. Dados de ensaios clínicos demonstraram que o tratamento de infecções agudas pelo vírus influenza com zanamivir inalatório, em comparação ao placebo. Surgimento de vírus com suscetibilidade reduzida ao zanamivir em estudos clínicos de zanamivir são raros.
Em uma análise combinada de pacientes com o vírus influenza tipo B (n=163), entre eles 79 tratados com o zanamivir, um benefício diário do tratamento duas vezes maior foi observado (IC de 95%: 0,50 a 3,50).
Devido ao número limitado de pacientes tratados que tinham asma grave ou outra doença crônica das vias respiratórias, bem como doenças crônicas instáveis ou imunodepressão, não foi possível demonstrar a eficácia e a segurança de Relenza nestes grupos.
Houve relatos muito raros de pacientes tratados com Relenza que desenvolveram broncoespasmo e/ou redução da função respiratória, que pode ser aguda e grave. Alguns desses pacientes não tinham nenhuma história prévia de doença das vias respiratórias. Qualquer pessoa que desenvolva tais reações deve interromper o uso de Relenza e buscar avaliação médica.
A eficácia e a segurança deste medicamento em pacientes com doença que requeira hospitalização imediata não foram demonstradas.
Uma análise integrada de dados sobre indivíduos com alto risco (entre eles pessoas com idade igual ou maior que 65 anos e/ou com uma ou mais, simultaneamente, das seguintes condições: doença cardiovascular, respiratória, metabólica, endócrina ou comprometimento imunológico) demonstrou redução estatisticamente significativa do tempo para alívio dos sintomas clinicamente significantes de gripe e também da incidência de complicações que requerem o uso de antibióticos.
O zanamivir teve perfil de segurança aceitável em adultos, crianças e também em idosos que tinham condições médicas crônicas subjacentes (população de alto risco). O perfil de segurança, conforme avaliado com base nos eventos adversos relatados foi semelhante ao do placebo e não foi diferente entre estas populações.
Propriedades farmacocinéticas
Absorção: Estudos farmacocinéticos em humanos demonstraram que a biodisponibilidade oral absoluta do medicamento é baixa (média de 2%). Estudos semelhantes de zanamivir administrado por uma inalação oral indicam que aproximadamente 4% a 17% da dose é absorvida sistemicamente, atingindo concentrações séricas com picos geralmente dentro de uma a duas horas. A pequena absorção do medicamento resulta em baixas concentrações sistêmicas. Portanto, não há exposição sistêmica significativa ao zanamivir após inalação oral. Não se observou evidência de modificações na cinética depois de repetidas doses com inalação oral.
Distribuição: A ligação de zanamivir às proteínas do plasma é muito baixa (<10%). O volume de distribuição do zanamivir é de aproximadamente 16 L, se aproximando do volume de água extracelular.
Após a inalação oral, o zanamivir é amplamente depositado em altas concentrações em todo o trato respiratório, sendo fornecido, assim, ao local da infecção do vírus influenza. Os dois principais locais de deposição são a orofaringe e os pulmões (média de 77,6% e 13,2%, respectivamente). Seguindo a administração duas vezes ao dia de zanamivir 10 mg por inalação oral, as concentrações medianas do medicamento medidas na camada epitelial das vias aéreas, (o principal local de replicação do vírus) variou de 326 ng/mL a 891 ng/mL. Estas concentrações mínimas são múltiplas vezes superiores aos valores in vitro de IC50 (<1 a 4 ng / mL) e IC90 (1,7 a 7,8 ng / mL) para a neuraminidase do vírus influenza para vários subtipos de influenza. As elevadas concentrações do zanamivir no trato respiratório resultam no início rápido de inibição da neuraminidase viral.
Metabolismo: Foi demonstrado que o zanamivir é excretado por via renal como droga inalterada e não é metabolizado.
Eliminação: Na circulação sistêmica, o zanamivir é eliminado totalmente na urina como droga inalterada. Em adultos com a função renal normal, a meia-vida de eliminação é de cerca de 2-3 horas. Em pacientes com insuficiência renal grave, a meia-vida sérica de zanamivir aumenta para 12-20 horas (clearance de creatinina <30 mL/min). O zanamivir não foi estudado em pacientes em estágio terminal de doença renal.
Populações especiais de pacientes
Idosos: Com a dose terapêutica diária de 20 mg, a biodisponibilidade é baixa (de 10% a 20%). Como resultado, não ocorre exposição sistêmica significativa dos pacientes ao zanamivir. Qualquer alteração da farmacocinética que possa haver devido à idade, provavelmente, não terá consequências clínicas. Assim, não se recomenda nenhuma modificação de dose para idosos.
Pacientes pediátricos: Em um estudo aberto de dose única, a farmacocinética do zanamivir foi avaliada em 24 pacientes pediátricos com idade de 3 meses a 12 anos, que usaram formulações de inalação nebulizada (10 mg) e de pó seco (10 mg). A exposição sistêmica nas crianças foi semelhante à de 10 mg de pó inalado em adultos.
Pacientes com insuficiência renal: Com a dose terapêutica diária de 20 mg, a biodisponibilidade é baixa (de 4% a 17%). Como resultado, não ocorre exposição sistêmica significativa dos pacientes ao zanamivir. Considerando a ampla margem de segurança deste medicamento, o possível aumento da exposição em pacientes com insuficiência renal grave não é considerado problemático e nenhum ajuste de dose é necessário.
Pacientes com insuficiência hepática: O zanamivir não é metabolizado. Portanto, não é necessário ajuste de dose em pacientes com insuficiência hepática.
CONTRAINDICAÇÕES
Relenza é contraindicado a pacientes com hipersensibilidade conhecida a qualquer componente da fórmula. Contraindicado em pacientes com alergia severa à proteína do leite.
ADVERTÊNCIAS E PRECAUÇÕES
A gripe pode estar associada a uma variedade de sinais e sintomas neurológicos e comportamentais. Houve relatos pós-comercialização (a maioria em pacientes pediátricos do Japão) de convulsões, delírio, alucinações e alterações do comportamento em pacientes com gripe que estavam recebendo inibidores da neuraminidase, incluindo o zanamivir. Estes eventos foram observados, principalmente, no início da doença e, frequentemente, paravam de forma abrupta. A contribuição do zanamivir para a ocorrência destes eventos não foi estabelecida. Se sintomas neuropsiquiátricos ocorrerem, os riscos e os benefícios da continuação do tratamento devem ser avaliados para cada paciente.
A infecção pelo vírus influenza pode estar associada ao aumento da hiper-responsividade das vias aéreas. Existem relatos muito raros de pacientes com gripe que, após serem tratados com zanamivir, apresentaram broncoespasmo e/ou diminuição da função respiratória, alguns dos quais sem história prévia de doença respiratória. Qualquer paciente nessa situação deve suspender a inalação de zanamivir e procurar avaliação médica. Pacientes com doenças respiratórias pré-existentes devem ter um broncodilatador de ação rápida disponível durante o uso de zanamivir (ver item 8. POSOLOGIA E MODO DE USAR).
Relenza pó para inalação não deve ser preparado em uma solução extemporânea para administração por nebulização ou ventilação mecânica. Há relatos de pacientes hospitalizados com gripe que receberam Relenza por nebulização ou ventilação mecânica, incluindo um caso fatal onde foi relatado que a lactose, presente nesta formulação, compromete o funcionamento do equipamento.
Relenza pó para inalação deve ser administrado utilizando apenas o dispositivo previsto (ver item 8. POSOLOGIA E MODO DE USAR).
Populações especiais
Não é necessária nenhuma modificação posológica para administração em crianças (com idade maior ou igual a 5 anos), idosos, pacientes com insuficiência renal ou hepática.
Pacientes pediátricos: Em um estudo aberto de dose única, a farmacocinética do zanamivir foi avaliada em 24 crianças com idade entre 3 meses e 12 anos que utilizavam formulações para inalação em nebulização (10 mg) e em pó seco (10 mg). A exposição sistêmica em crianças foi semelhante à de 10 mg do pó inalado em adultos.
Pacientes idosos: Com a dose terapêutica diária de 20 mg, a biodisponibilidade é baixa (de 10% a 20%); como resultado, não houve nenhuma exposição sistêmica significativa dos pacientes ao zanamivir. Qualquer alteração farmacocinética que possa ocorrer com a idade é improvável de ter consequências clínicas. Assim, nenhuma modificação de dose é recomendada para esses pacientes.
Efeitos sobre a capacidade de dirigir veículos e operar máquinas
Nenhum efeito prejudicial sobre essas atividades é conhecido.
Gravidez e Lactação
Fertilidade: Estudos em animais não indicam efeitos clinicamente significativos de zanamivir na fertilidade feminina (ver Informação Não-Clínica).
Gravidez: A segurança do uso de Relenza durante a gravidez não foi estabelecida.
Não há dados suficientes sobre o uso de zanamivir em mulheres grávidas para informar o risco associado. Os dados de vários estudos não encontraram um risco aumentado de resultados adversos da gravidez após a exposição in utero ao zanamivir inalado, mas devido aos tamanhos de amostra limitados, não podem ser tiradas conclusões definitivas sobre a segurança do zanamivir na gravidez.
Estudos reprodutivos realizados em ratos e coelhos indicaram que ocorre transferência placentária de zanamivir e não há evidência de teratogenicidade. Resultados de estudos em ratos peri ou pós-natal não demonstraram distúrbio clinicamente significativo do desenvolvimento da prole. Contudo, não há informações sobre a transferência placentária em humanos.
Como os estudos são limitados, o uso de zanamivir na gravidez somente deve ser considerado se o possível benefício para a mãe compensa qualquer possível risco para o feto.
Lactação: Em ratos, foi demonstrado que o zanamivir é secretado em doses baixas no leite. Contudo, não há informações sobre a secreção no leite materno humano.
Uma vez que a experiência é limitada, o uso de Relenza em mulheres que estejam amamentando deve ser considerado apenas quando o possível benefício para a mãe compensar qualquer possível risco para a criança.
Categoria C – Não há estudos adequados em mulheres. Em experiências animais ocorreram alguns efeitos colaterais no feto, mas o benefício do produto pode justificar o risco potencial durante a gravidez.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Informações importantes sobre um dos componentes do medicamento
Este medicamento contém LACTOSE.
INTERAÇÕES MEDICAMENTOSAS
In vitro, o zanamivir não é um substrato das enzimas do citocromo P450 (CYP), da P-glicoproteína (Pgp) ou dos transportadores renais nem afeta os transportadores humanos (ânions orgânicos, cátions ou transportadores de urato) ou enzimas do citocromo P450 (CYP) (CYP1A1 / 2, 2A6, 2C9, 2C19, 2D6, 2E1 e 3A4). In vivo, o zanamivir é excretado como medicamento inalterado na urina e não há evidências de que o zanamivir seja metabolizado ou modificado no fígado.
Interações medicamentosas clinicamente significativas são improváveis.
CUIDADOS DE ARMAZENAMENTO DO MEDICAMENTO
Cuidados de armazenamento
Mantenha o produto na embalagem original e em temperatura ambiente (15–30°C). O prazo de validade de Relenza é de 60 meses a partir da data de fabricação, impressa na embalagem externa do produto.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Características físicas e organolépticas do produto
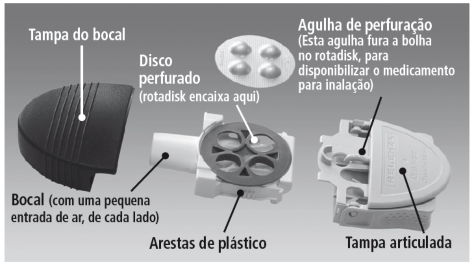
Relenza é uma mistura em pó seco de cor esbranquiçada. Não contém corantes artificiais. O pó está no interior das quatro “bolhas” do disco prateado denominado Rotadisk. Em cada “bolha” há uma dose de 5 mg de Relenza. O medicamento contido nas “bolhas” do Rotadisk é aspirado pela boca por meio de um dispositivo plástico chamado Diskhaler.
Antes de usar, observe o aspecto do medicamento.
TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS.
POSOLOGIA E MODO DE USAR
Modo de Uso
O zanamivir deve ser administrado somente por inalação oral e com o uso do dispositivo Diskhaler que acompanha o produto (ver Instruções de Uso).
Instruções de uso: O medicamento em pó é inalado pela boca até os pulmões. O dispositivo Diskhaler é carregado com um disco de lâmina (Rotadisk), que contém o medicamento em suas bolhas individuais. A bolha é aberta quando suas duas superfícies são perfuradas.
Um Rotadisk de zanamivir pode ser mantido no Diskhaler durante todo o tempo, mas só se deve perfurar uma bolha imediatamente antes do uso. A não-observação dessa instrução afetará o funcionamento do Diskhaler.
O Diskhaler é um dispositivo usado em conjunto com o Rotadisk para a inalação do medicamento.
O Diskhaler possui três partes.
Não o utilize até que tenha terminado de ler estas instruções de uso.
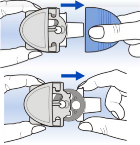
O Rotadisk encaixa-se no Diskhaler.
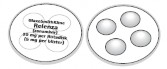
O Rotadisk é encaixado ao disco perfurado do Diskhaler. Cada uma das quatro bolhas do Rotadisk contém uma dose (5 mg) de Relenza. IMPORTANTE:
Não perfure nenhuma bolha do Rotadisk antes de encaixá-lo ao disco perfurado do Diskhaler.
Você pode manter o Rotadisk no Diskhaler entre as tomadas de dose, mas não perfure nenhuma das bolhas até que chegue o momento de inalar a dose.
Mantenha o Diskhaler limpo. Após o uso, limpe/seque o bocal com um pano limpo e deixe o aparelho tampado até a próxima vez que for utilizá-lo.
POSOLOGIA
O tratamento deve começar o mais precocemente possível: dentro de 48 horas após o início dos sintomas para os adultos e dentro de 36 horas após o início dos sintomas para as crianças.
Durante o tratamento com zanamivir, pacientes que fazem uso de outros medicamentos inalatórios (por exemplo, broncodilatadores de ação rápida) devem ser aconselhados a administrar esses medicamentos antes de zanamivir, quando houver coincidência de horários.
Adultos
Tratamento da gripe:
A dosagem recomendada de zanamivir para o tratamento da gripe consiste em duas administrações, duas vezes ao dia (duas doses de 5 mg a cada vez), por cinco dias, sendo administrada dose diária total de 20 mg.
Para que se obtenha o máximo benefício, o tratamento deve ser iniciado o mais rápido possível (de preferência dentro de dois dias) após o início dos sintomas.
O zanamivir deve ser administrado nos mesmos horários de manhã e à noite (por exemplo, às 8 horas da manhã e às 8 horas da noite). Mesmo que não seja possível adotar o esquema manhã-noite, o medicamento deve ser inalado com intervalo de 12 horas entre as doses e duas vezes por dia. Se isso não for possível (por exemplo, se o paciente receber a primeira dose durante a tarde), a segunda dose deve ser tomada no mesmo dia, com um intervalo mínimo de 2 horas.
Profilaxia da gripe:
A dosagem recomendada do zanamivir para a profilaxia (prevenção) da gripe consiste em duas inalações (de 5 mg cada uma) uma vez ao dia, durante 10 dias, sendo administrada dose diária total de 10 mg.
A terapia pode ser prolongada por até um mês caso o período de risco de exposição se estender além de 10 dias. O curso completo de terapia profilática prescrito deve ser concluído.
Idosos, crianças e outros grupos de risco
Não é necessária nenhuma modificação posológica para administração em crianças (a partir de 5 anos), idosos, pacientes com insuficiência renal ou hepática.
REAÇÕES ADVERSAS
Em estudos clínicos, que incluem os realizados com pacientes de alto risco (idosos e indivíduos com determinadas doenças crônicas), os eventos adversos relatados foram semelhantes nos grupos de zanamivir pó para inalação oral e placebo.
Os seguintes eventos foram identificados durante o uso do zanamivir pó para inalação oral no período pós-comercialização.
Reações muito raras (≤ 1/10.000): reações alérgicas, incluindo anafiláticas e anafilactóides, edema facial e orofaríngeo; broncoespasmo; dispneia; rash cutâneo; urticária; reações graves de pele incluindo eritema multiforme, síndrome de Steve-Johnson, necrólise epidérmica tóxica. Reações do tipo vasovagal têm sido relatadas em pacientes com sintomas de gripe, como febre e desidratação, logo após a inalação de Relenza.
Atenção: este produto é um medicamento novo e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos. Nesse caso, notifique os eventos adversos pelo Sistema VigMed, disponível no Portal da Anvisa.
SUPERDOSE
Sintomas e Sinais
Relatórios de overdoses com zanamivir inalado foram recebidos durante a experiência pós-comercialização. Os sinais ou sintomas clínicos relatados foram semelhantes aos observados com doses terapêuticas de zanamivir inalado e a doença subjacente.
Doses de uma solução investigacional aquosa (livre de lactose) de zanamivir de até 64 mg/dia (aproximadamente três vezes a dose máxima diária recomendada) foram administradas por inalação oral, com nebulizador, sem efeitos adversos. Além disso, a exposição sistêmica após uso intravenoso de até 1.200 mg/dia durante cinco dias não demonstrou efeitos adversos.
Tratamento
Como o zanamivir tem um baixo peso molecular, baixa ligação à proteína e pequeno volume de distribuição, espera-se que seja removido por hemodiálise. O gerenciamento adicional deve ser indicado clinicamente ou recomendado pelo centro nacional de intoxicação, quando disponível.
Em caso de intoxicação ligue 0800 722 6001, se você precisar de mais orientações.
DIZERES LEGAIS
VENDA SOB PRESCRIÇÃO MÉDICA
Reg. MS: 1.0107.0263
Farm. Resp.: Ednilson da Silva Oliveira CRF-RJ N° 18875
Fabricado por:
Glaxo Wellcome Production
23, rue Lavoisier, Zone Industrielle n° 2, 27000 Evreux – França OU
GlaxoSmithKline Australia Pty Ltd
1061 Mountain Highway - Boronia - Vic 3155 - Austrália
Registrado e Importado por:
GlaxoSmithKline Brasil Ltda.
Estrada dos Bandeirantes, 8464 – Rio de Janeiro – RJ
CNPJ: 33.247.743/0001-10
SAC 0800 701 22 33






