

Kefazol
ANTIBIÓTICOS DO BRASIL LTDA
IDENTIFICAÇÃO DO MEDICAMENTO
Kefazol®
cefazolina sódica
Injetável 1 g
FORMA FARMACÊUTICA E APRESENTAÇÃO:
Pó para solução injetável 1 g
Embalagem com 50 frascos-ampola. Sistema Fechado: embalagem com 50 frascos-ampola + 50 bolsas de diluente com 100 mL de Cloreto de Sódio 0,9%.
VIA INTRAMUSCULAR OU INTRAVENOSA
USO ADULTO E PEDIÁTRICO
COMPOSIÇÃO:
Cada frasco-ampola de Kefazol® contém:
| cefazolina sódica (equivalente a 1 g de cefazolina) | 1,048 g |
A cefazolina sódica contém 48,3 mg de SÓDIO por grama1.
INFORMAÇÕES AO PACIENTE
PARA QUE ESTE MEDICAMENTO É INDICADO?
Kefazol® é indicado para o tratamento de infecção2 respiratória, infecção2 urinária, infecção2 da pele3 e estruturas da pele3, infecção2 no trato biliar4, infecção2 nos ossos, infecção2 nas juntas, infecções5 genitais, infecção2 no sangue6, endocardite7 bacteriana (infecção2 nas válvulas do coração8) e para prevenção de infecção2 durante cirurgia.
COMO ESTE MEDICAMENTO FUNCIONA?
Kefazol® é um antibacteriano da classe das cefalosporinas. Em doses adequadas, promove a morte de bactérias. O tempo para cura da infecção2 pode variar de dias a meses, dependendo do local e do tipo de bactéria9 causadora da infecção2 e das condições do paciente.
QUANDO NÃO DEVO USAR ESTE MEDICAMENTO?
Kefazol® não deve ser usado por pacientes com histórico de reação alérgica10 a penicilinas, derivados da penicilina, penicilamina e a outras cefalosporinas.
O QUE DEVO SABER ANTES DE USAR ESTE MEDICAMENTO?
Antes que o tratamento com Kefazol® seja iniciado, informe ao seu médico se você já apresentou reações anteriores de alergia11 a algum medicamento, especialmente à cefazolina, a outras cefalosporinas, às penicilinas ou à penicilamina. Pacientes alérgicos a penicilinas podem ser alérgicos também à cefazolina.
Se uma reação alérgica10 ocorrer, interrompa o tratamento com o medicamento.
O tratamento com cefazolina pode levar ao crescimento da bactéria9 Clostridium difficile, uma das causas primárias de colite12 associada ao uso de antibiótico (caracterizada por dor na barriga e no estômago13; cólica; diarreia14 aquosa, podendo conter sangue6; febre15). É importante considerar este diagnóstico16 caso você apresente diarreia14 durante ou até dois meses após o uso de antibiótico. Informe ao seu médico se você já apresentou doença gastrintestinal, particularmente colite12.
Pacientes com diminuição da função renal17 podem precisar de doses menores que pacientes com a função renal17 normal. A administração de altas doses, especialmente nestes pacientes, pode provocar convulsões.
Gravidez18 e Lactação19
Uso na Gravidez18: categoria de risco B.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Trabalho de Parto: quando a cefazolina foi administrada antes da cirurgia cesariana, os níveis do medicamento no sangue do cordão umbilical20 foram aproximadamente um quarto a um terço dos níveis do medicamento na mãe. A droga parece não ter nenhum efeito adverso no feto21.
Uso na amamentação22: a cefazolina está presente em níveis muito baixos no leite materno. Entretanto, não foram documentados problemas.
Populações especiais
Uso em pacientes com diminuição da função renal17: pacientes com diminuição da função renal17 podem necessitar de doses menores.
Uso em crianças: a segurança e a eficácia em prematuros ainda não foram estabelecidas.
Interações Medicamentosas
Aminoglicosídeos (ex.: amicacina, gentamicina, tobramicina): há maior chance de ocorrerem reações tóxicas para os rins23 com a administração conjunta de cefazolina e aminoglicosídeos. Não se recomenda a mistura de antibacterianos betalactêmicos (penicilinas e cefalosporinas) com aminoglicosídeos, pois pode ocorrer inativação de ambas as substâncias.
Varfarina: a varfarina pode ter sua ação aumentada pela cefazolina. Pode ser necessário diminuir a dose de varfarina.
Heparina: há maior risco de sangramento quando a cefazolina é utilizada com heparina.
Probenecida: a probenecida aumenta as concentrações de cefazolina no sangue6, e pode aumentar os riscos de reações tóxicas.
Interações com testes laboratoriais: a cefazolina pode alterar o resultado de exames que detectam glicose24 na urina25 através da solução de Benedict ou Fehling. Pacientes que receberam cefazolina ou recém-nascidos cujas mães receberam tratamento com esta droga antes do parto podem apresentar resultado alterado no teste de antiglobulina (Coombs).
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento. Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde26.
ONDE, COMO E POR QUANTO TEMPO POSSO GUARDAR ESTE MEDICAMENTO?
Cuidados de conservação
Kefazol® deve ser mantido em sua embalagem original, em temperatura ambiente (15°C e 30°C) e protegido da luz.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Após preparo, manter em temperatura ambiente (15°C a 30°C), protegido da luz por até 12 horas ou sob refrigeração (2°C a 8°C), protegido da luz por até 24 horas (ver item “6. Como devo usar este medicamento?”).
Características físicas e organolépticas do produto
- Aspecto do pó: pó cristalino27 branco a quase branco.
- Aspecto da solução após reconstituição: solução incolor a amarela (ver item “6. Como devo usar este medicamento?”).
- Aspecto da solução após diluição: solução incolor a amarela (ver item “6. Como devo usar este medicamento?”).
Como ocorre com outras cefalosporinas, a cor da solução reconstituída e/ou diluída de Kefazol® pode escurecer durante a armazenagem, porém a potência do produto permanece inalterada.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS.
COMO DEVO USAR ESTE MEDICAMENTO?
Kefazol® é de uso injetável, portanto deve ser administrado somente em serviços profissionais autorizados.
POSOLOGIA
ATENÇÃO: as doses são dadas em termos de cefazolina.
Adultos e Adolescentes
- Infecção2 Urinária Aguda (não complicada): 1 g a cada 12 horas por infusão intravenosa.
- Pneumonia28 Pneumocócica: 500 mg a cada 12 horas por infusão intravenosa.
- Prevenção de endocardite7 (infecção2 nas válvulas do coração8): 1 g, 30 minutos antes do início do procedimento, por infusão intravenosa.
- Prevenção de infecção2 em cirurgia (infusão intravenosa)
- Antes da cirurgia: 1 g, 30 a 60 minutos antes do início da cirurgia.
- Durante a cirurgia (procedimentos com duração de 2 horas ou mais): 500 mg a 1 g.
- Depois da cirurgia: 500 mg a 1 g a cada 6 a 8 horas, até 24 horas após a cirurgia.
Em cirurgias onde uma infecção2 pode ser particularmente devastadora a administração da cefazolina deve ser continuada por 3 a 5 dias após o término da cirurgia. - Outras Infecções5
- Infecções5 leves: 250 a 500 mg a cada 8 horas, por infusão intravenosa.
- Infecções5 moderadas a graves: 500 mg a 1 g, a cada 6 a 8 horas, por infusão intravenosa.
- Limite de dose para adultos: 6 g por dia, embora em raras ocasiões doses de até 12 g por dia foram utilizadas.
Crianças
- Prevenção de endocardite7 (infecção2 nas válvulas do coração8): 25 mg por quilograma de peso corporal, 30 minutos antes do início do procedimento, por infusão intravenosa.
- Outras infecções5:
- Crianças a partir de 1 mês de idade (infusão intravenosa)
- Infecção2 leve a moderada: 6,25 a 12,5 mg por quilograma de peso corporal a cada 6 horas ou 8,3 a 16,7 mg por quilograma de peso corporal a cada 8 horas.
- Infecção2 grave: 25 mg por quilograma de peso corporal a cada 6 horas ou 33,3 mg por quilograma de peso corporal a cada 8 horas.
- Crianças com menos de 1 mês de idade (infusão intravenosa): 20 mg por quilograma de peso corporal, a cada 8 ou 12 horas.
Idosos: Pacientes idosos têm maior probabilidade de ter a função renal17 diminuída, por isso pode ser necessário o ajuste de dose de acordo com o clearance de creatinina29. (ver Adultos com diminuição da função renal17).
- Limite de dose para idosos acima de 75 anos de idade: 500 mg a cada 8 horas (mesmo com clearance de creatinina29 normal).
Pacientes com diminuição da função renal17
- Adultos com diminuição da função renal17: Após uma dose inicial apropriada à gravidade do caso, as doses devem ser ajustadas de acordo com o sistema abaixo que considera o clearance de creatinina29 (ver Tabela 1).
Tabela 1: Ajuste de Dose para Adultos com Diminuição da Função Renal17
|
Clearance de creatinina29 |
Dose |
|
≥ 55 |
Dose usual |
|
35-54 |
Dose usual a cada 8 ou 12 horas |
|
11-34 |
Metade da dose usual a cada 12 horas |
|
≥ 10 |
Metade da dose usual a cada 18 ou 24 horas |
- Crianças com diminuição da função renal17: após uma dose inicial apropriada à gravidade do caso, as doses devem ser ajustadas de acordo com o esquema abaixo que considera o clearance da creatinina29 (ver Tabela 2).
Tabela 2: Ajuste de Dose para Crianças com Diminuição da Função Renal17
|
Clearance de creatinina29 |
Dose |
|
≥ 70 |
Dose usual para crianças |
|
40-70 |
7,5 a 30 mg por quilograma de peso corporal a cada 12 horas |
|
20-40 |
3,1 a 12,5 mg por quilograma de peso corporal a cada 12 horas |
|
5-20 |
2,5 a 10 mg por quilograma de peso corporal a cada 24 horas |
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento. Não interrompa o tratamento sem o conhecimento do seu médico.
Duração do tratamento
A duração do tratamento será determinada pelo médico. Como na terapia com antibióticos em geral, o tratamento com Kefazol® deve ser prolongado por um mínimo de 48 a 72 horas após abaixar a temperatura do paciente, ou após a constatação da eliminação das bactérias causadoras da infecção2.
MODO DE USAR
Via intramuscular
Reconstituição
- Diluente: lidocaína 0,5% ou água para injetáveis.
- Volume: 2,5 mL. Após reconstituição, o produto tem volume final de aproximadamente 3,2 mL e concentração de aproximadamente 312,5 mg/mL.
- Aspecto da solução reconstituída: solução incolor a amarela.
- Estabilidade após reconstituição: Temperatura ambiente (15°C a 30°C): 12 horas, protegido da luz. Refrigeração (2°C a 8°C): 24 horas, protegido da luz.
ATENÇÃO: como ocorre com outras cefalosporinas, a cor da solução reconstituída de Kefazol® pode escurecer durante a armazenagem, porém a potência do produto permanece inalterada.
Administração: injetar em grande massa muscular. Em adultos, nas nádegas30 (quadrante superior externo); em crianças, na face31 lateral da coxa32.
ATENÇÃO: o produto reconstituído com lidocaína 0,5% não pode ser administrado por via intravenosa.
Via intravenosa direta
Reconstituição
- Diluente: água para injetáveis.
- Volume: 10 mL. Após reconstituição, o produto tem volume final de aproximadamente 10,6 mL e concentração de aproximadamente 94 mg/mL.
- Aspecto da solução reconstituída: solução incolor a amarela.
- Estabilidade após reconstituição: Temperatura ambiente (15°C a 30°C): 12 horas, protegido da luz. Refrigeração (2°C a 8°C): 24 horas, protegido da luz.
ATENÇÃO: como ocorre com outras cefalosporinas, a cor da solução reconstituída de Kefazol® pode escurecer durante a armazenagem, porém a potência do produto permanece inalterada.
Administração: injetar direto na veia durante 3 a 5 minutos.
Infusão intravenosa
Reconstituição
- Diluente: água para injetáveis.
- Volume: 10 mL. Após reconstituição, o produto tem volume final de aproximadamente 10,6 mL e concentração de aproximadamente 94 mg/mL.
- Aspecto da solução reconstituída: solução incolor a amarela.
- Estabilidade após reconstituição: Temperatura ambiente (15°C a 30°C): 12 horas, protegido da luz. Refrigeração (2°C a 8°C): 24 horas, protegido da luz.
ATENÇÃO: como ocorre com outras cefalosporinas, a cor da solução reconstituída de Kefazol® pode escurecer durante a armazenagem, porém a potência do produto permanece inalterada.
Diluição
- Diluente: cloreto de sódio 0,9% ou glicose24 5%.
- Volume: 50 mL a 100 mL. Após diluição com 100 mL, o produto tem concentração de aproximadamente 9 mg/mL.
- Aspecto da solução diluída: solução incolor a amarela.
- Estabilidade após diluição: Temperatura ambiente (15° a 30°C): 12 horas, protegido da luz. Refrigeração (2° a 8°C): 24 horas, protegido da luz.
ATENÇÃO: como ocorre com outras cefalosporinas, a cor da solução diluída de Kefazol® pode escurecer durante a armazenagem, porém a potência do produto permanece inalterada.
Tempo de infusão: 30 a 60 minutos.
Outras soluções compatíveis:
- Glicose24 10%
- Injeção33 de Ringer Lactato34
- Injeção33 de Ringer
Incompatibilidades: não se recomenda a mistura de cefazolina com outras medicações. A mistura de antibacterianos betalactâmicos (penicilina e cefalosporinas) e aminoglicosídeos pode resultar em inativação de ambas substâncias. Se clinicamente necessário elas devem ser administradas separadamente (não misturá-las no mesmo frasco ou numa mesma bolsa intravenosa).
Infusão intravenosa
O frasco-ampola de Kefazol® 1 g para infusão intravenosa deve ser acoplado à bolsa conforme ilustrações abaixo. Devem ser observados cuidados usuais para evitar contaminação na montagem do sistema fechado ilustrado a seguir. Recomenda-se a utilização de equipos com filtro.
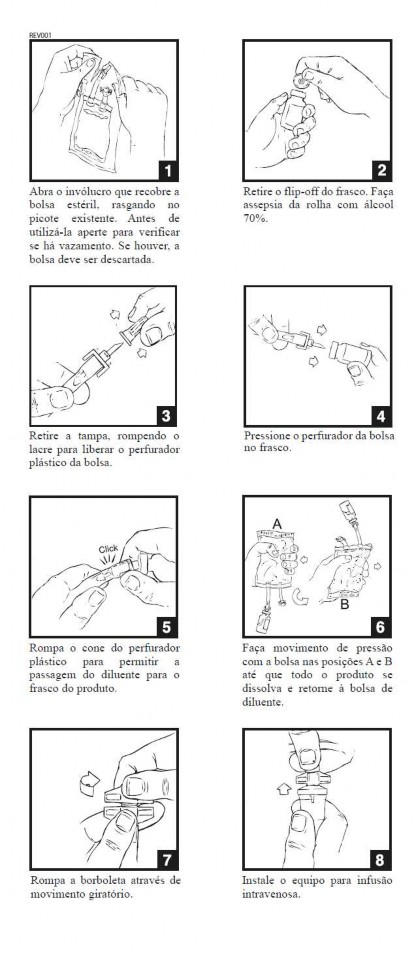
ATENÇÃO: o frasco deve ser mantido acoplado à bolsa. Isso garante o fechamento do circuito de infusão e o próprio frasco é o indicador do produto que está sendo administrado.
Reconstituição e Diluição (realizadas simultaneamente):
- Diluente: cloreto de sódio 0,9%.
- Volume: 100 mL. Após reconstituição/diluição, o produto tem concentração de aproximadamente 10 mg/mL.
- Aparência da solução diluída: solução incolor a amarela.
- Estabilidade após a diluição: Temperatura ambiente (15°C a 30°C): 12 horas, protegido da luz. Sob refrigeração (2°C a 8°C): 24 horas, protegido da luz.
ATENÇÃO: como ocorre com outras cefalosporinas, a cor da solução diluída de Kefazol® pode escurecer durante a armazenagem, porém a potência do produto permanece inalterada.
Tempo de Infusão: 30 a 60 minutos.
Incompatibilidades: não se recomenda a mistura de cefazolina com outras medicações. A mistura de antibacterianos betalactâmicos (penicilina e cefalosporinas) e aminoglicosídeos pode resultar em inativação de ambas substâncias. Se clinicamente necessário elas devem ser administradas separadamente (não misturá-las no mesmo frasco ou numa mesma bolsa intravenosa).
O QUE DEVO FAZER QUANDO EU ME ESQUECER DE USAR ESTE MEDICAMENTO?
Se você se esquecer de usar este medicamento, entre em contato com seu médico. Deixar de administrar uma ou mais doses ou não completar o tratamento pode comprometer o resultado.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
QUAIS OS MALES QUE ESTE MEDICAMENTO PODE ME CAUSAR?
As seguintes reações adversas foram reportadas:
Alérgicas: anafilaxia35 (urticária36, coceira, diminuição grave da respiração e pressão), eosinofilia37 (aumento de eosinófilos38 no sangue6), prurido39 (coceira), febre15 medicamentosa, erupções na pele3 e Síndrome de Stevens-Johnson40 (reação alérgica10 grave na pele3 com bolhas e vermelhidão). Há maior probabilidade de essas reações ocorrerem em pacientes com história de alergia11, particularmente à penicilina.
Reações locais: raros casos de flebite41 (inflamação42 da veia) no local da injeção33 f oram relatados.
Gastrintestinais: diarreia14, estomatite43 por Candida (monilíase ou “sapinho”), vômitos44 e náuseas45, dor de estômago13, anorexia46 (falta de apetite) e colite12 pseudomembranosa (caracterizada por dor na barriga e no estômago13; cólica; diarreia14 aquosa, podendo conter sangue6; febre15), durante ou após o tratamento com antibióticos.
Sangue6: neutropenia47 (diminuição de neutrófilos48 no sangue6), leucopenia49 (diminuição de glóbulos brancos no sangue6), trombocitopenia50 (diminuição de plaquetas51 no sangue6) e trombocitemia (aumento de plaquetas51 no sangue6).
Fígado52: aumento passageiro de enzimas do fígado52 (aspartato aminotransferase – AST, alanina transaminase – ALT e fosfatase alcalina53), sem evidências clínicas de prejuízo para o fígado52.
Rim54: uremia55 (elevação de ureia56 no sangue6), sem evidências clínicas de prejuízo dos rins23.
Outras Reações: prurido39 (coceira) genital e anal.
Informe ao seu médico, cirurgião-dentista ou farmacêutico o aparecimento de reações indesejáveis pelo uso do medicamento. Informe também à empresa através do seu serviço de atendimento.
O QUE FAZER SE ALGUÉM USAR UMA QUANTIDADE MAIOR DO QUE A INDICADA DESTE MEDICAMENTO?
Sinais57 e sintomas58
Após uma superdose de cefazolina, o paciente pode apresentar dor, inflamação42 e flebite41 (inflamação42 da veia) no local da injeção33. A administração de grandes doses inadequadas de cefalosporinas por via injetável pode causar tontura59, parestesia60 (formigamento) e cefaleia61 (dor de cabeça62). O uso de doses excessivas pode levar à ocorrência de reações adversas mais intensas. Podem ocorrer convulsões, principalmente em pacientes que tem a função renal17 diminuída.
Tratamento
Procurar um Hospital ou Centro de Controle de Intoxicações para tratamento dos sintomas58. Se ocorrerem convulsões, a droga deve ser suspensa imediatamente e, quando indicado, um tratamento com medicamento anticonvulsivante deve ser administrado. Os sinais vitais63, a função respiratória e os eletrólitos64 no sangue6 devem ser monitorados.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001 se você precisar de mais orientações.
DIZERES LEGAIS
USO RESTRITO A HOSPITAIS
VENDA SOB PRESCRIÇÃO MÉDICA
Registro MS n° 1.5562.0003
Farm. Resp.: Sidnei Bianchini Junior - CRF-SP nº 63.058
Fabricado por:
Antibióticos do Brasil Ltda.
Sumaré – SP ou
Fabricado por: Antibióticos do Brasil Ltda. Cosmópolis – SP
Registrado por:
Antibióticos do Brasil Ltda
Rod. Professor Zeferino Vaz, SP-332, Km 135 – Cosmópolis – SP
CNPJ 05.439.635/0001-03
Indústria Brasileira
SAC 0800 7015456



