ONGLYZA
Bristol-Myers Squibb Filial Itapevi
ONGLYZA
Saxagliptina
Apresentações da Onglyza
ONGLYZA está disponível em embalagens contendo:2,5 mg de saxagliptina: 28 comprimidos revestidos
5 mg de saxagliptina: 14 e 28 comprimidos revestidos
USO ORAL
Composição da Onglyza
Cada comprimido revestido de ONGLYZA 2,5 mg contém 2,79 mg de cloridrato de saxagliptina (anidra) equivalente a 2,5 mg de saxagliptina.
Excipientes q.s.p. .................................................................................................1 comprimido
Excipientes: lactose1 monoidratada, celulose microcristalina, croscarmelose sódica, estearato de magnésio, álcool polivinílico, polietilenoglicol, dióxido de titânio, talco e óxidos de ferro.
Cada comprimido revestido de ONGLYZA de 5 mg contém 5,58 mg de cloridrato de saxagliptina (anidra) equivalente a 5 mg de saxagliptina.
Excipientes q.s.p. .................................................................................................1 comprimido
Excipientes: lactose1 monoidratada, celulose microcristalina, croscarmelose sódica, estearato de magnésio, álcool polivinílico, polietilenoglicol, dióxido de titânio, talco e óxidos de ferro.
Informações ao Paciente da Onglyza
1- Como este medicamento funciona?ONGLYZA é um medicamento de uso sob prescrição médica que pertence a uma classe de agentes inibidores de uma enzima2 de controle da liberação de glicose3 para o sangue4 durante a digestão5: a dipeptidil peptidase 4 (DPP-4). ONGLYZA melhora o controle de açúcar6 no sangue4 de pacientes adultos com diabetes tipo 27 quando utilizado em associação com dieta e exercício. ONGLYZA pode ser utilizado sozinho ou combinado com outros medicamentos que também controlem o açúcar6 no sangue4.
ONGLYZA:
• Reduz as concentrações de açúcar6 no sangue4 quando as mesmas estão altas, especialmente após as refeições. ONGLYZA também reduz as concentrações de açúcar6 no sangue4 entre as refeições;
• Promove o aumento de secreção de insulina8 pelo organismo após as refeições;
• Modera a produção de açúcar6 pelo fígado9 após as refeições. É improvável que ONGLYZA diminua a concentração de açúcar6 a um nível perigoso, ao ponto de causar hipoglicemia10, uma vez que não tem ação quando o nível de açúcar6 no sangue4 está baixo.
2- Por que este medicamento foi indicado?
Monoterapia e Terapia combinada11:
ONGLYZA é indicado para melhorar o controle de açúcar6 no sangue4 de pacientes adultos com diabetes tipo 27 quando utilizado em associação com dieta e exercício.
ONGLYZA não deve ser utilizado para o tratamento de pacientes com diabetes tipo 112 ou para o tratamento da cetoacidose diabética13 (condição mais grave, em que há nível elevado e perigoso de certos ácidos, conhecidos como cetonas, no sangue4 ou urina14).
3- Quando não devo usar este medicamento?
ONGLYZA não deve ser utilizado para tratamento de:
• Pessoas com diabetes tipo 112;
• Pessoas com histórico ou risco de cetoacidose diabética13 (condição mais grave, em que há nível elevado e perigoso de certos ácidos, conhecidos como cetonas, no sangue4 ou urina14);
• Pessoas que tiveram reação alérgica15 (hipersensibilidade) grave a ONGLYZA ou outro medicamento semelhante, usado para controlar os níveis de açúcar6 no sangue4.
Contraindicações da Onglyza
ONGLYZA é contraindicado para pacientes16 com reações alérgicas a qualquer um dos seus componentes.
ONGLYZA não deve ser usado por pessoas que tiveram reação alérgica15 (hipersensibilidade) grave a ONGLYZA ou outro medicamento semelhante, usado para controlar os níveis de açúcar6 no sangue4. Os sintomas17 de reação alérgica15 grave podem incluir:
• Erupções cutâneas18 (irritação na pele19);
• Aumento de manchas vermelhas na pele19 (urticária20);
• Inchaço21 na face22, lábios, língua23, e garganta24, podendo causar dificuldade em respirar ou engolir.
Precauções e Advertências da Onglyza
Em períodos de estresse corporal, como febre25, trauma, infecção26 ou cirurgia entre em contato com seu médico para que o mesmo o oriente sobre a conduta medicamentosa adequada.Havendo quaisquer dos sintomas17 de reação alérgica15 grave descritos anteriormente (vide “Contraindicações”), você deve suspender o tratamento com ONGLYZA e contatar seu médico imediatamente.
Uso em pacientes com deficiência nos rins27
Para pacientes16 com deficiência moderada ou grave nos rins27 ou com deficiência nos rins27 em estágio terminal e que realizam hemodiálise28 é necessário adequar a dose única diária deste medicamento, para isso é recomendado que seja realizado um exame para avaliar a função dos rins27 antes e durante o tratamento com ONGLYZA.
Gravidez29 e Lactação30
Informe ao seu médico se você está grávida, ou pretende engravidar. Não se sabe se o uso de ONGLYZA afeta o desenvolvimento do bebê. Se você está grávida converse com o seu médico sobre a melhor maneira de controlar o açúcar6 no sangue4 enquanto estiver grávida.
Se você estiver amamentando ou planeja amamentar, informe ao seu médico, pois ONGLYZA pode passar para o bebê através do leite. Converse com o seu médico sobre a melhor maneira de alimentar seu bebê, caso esteja fazendo uso de ONGLYZA.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica.
Informe imediatamente seu médico em caso de suspeita de gravidez29.
Informe o seu médico caso esteja amamentando.
Uso Pediátrico
A segurança e a eficácia de ONGLYZA em pacientes pediátricos não foram estabelecidas.
Uso em idosos
Pacientes idosos normalmente apresentam diminuição na função dos rins27, portanto deve-se ter cuidado na seleção da dose em pacientes idosos baseados na função dos rins27.
Efeitos na capacidade de dirigir e operar máquinas
Não foi realizado nenhum estudo para verificar a capacidade de dirigir e de operar máquinas.
Entretanto, deve-se levar em conta que pode ocorrer tontura31 com o uso de ONGLYZA.
Interações Medicamentosas
Informe ao seu médico se estiver fazendo uso de algum outro medicamento, incluindo medicamentos isentos de prescrição, vitaminas, fitoterápicos, suplementos; mantenha uma lista para mostrar ao seu médico ou a outro profissional de saúde32.
ONGLYZA pode afetar a forma como outros medicamentos agem, e outros medicamentos podem afetar a ação de ONGLYZA. Contate o médico se você for iniciar ou parar alguns certos tipos de medicamentos, como antibióticos, ou medicamentos que tratam fungos ou HIV33/AIDS, pois a sua dose de ONGLYZA talvez precise ser alterada.
Achados Laboratoriais
Ocorreu uma diminuição na contagem de linfócitos (células34 brancas, diretamente ligadas com o sistema de defesa do corpo humano35). A diminuição da quantidade de linfócitos não foi associada com outros problemas importantes. A relevância clínica dessa diminuição na contagem de dessas células34 brancas em relação ao placebo36 é desconhecida.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use medicamento sem o conhecimento de seu médico. Pode ser perigoso para sua saúde32.
4- Como devo usar este medicamento?
O comprimido revestido de ONGLYZA 5 mg é rosa, biconvexo e arredondado.
O comprimido revestido de ONGLYZA 2,5 mg é amarelo a amarelo claro, biconvexo e arredondado.
Este medicamento não deve ser partido ou mastigado. Você deve ingerir os comprimidos sem mastigar com auxílio de um pouco de líquido. Os comprimidos podem ser ingeridos com ou sem alimentação.
Depois de aberto, ONGLYZA deve ser mantido em sua embalagem original, conservado em temperatura ambiente.
Posologia da Onglyza
Monoterapia e terapia combinada11
A dose recomendada de ONGLYZA é de 2,5 mg e 5 mg em dose única diária como monoterapia ou em terapia combinada11 com outros medicamentos que também diminuam o açúcar6 no sangue4. ONGLYZA pode ser tomado com ou sem alimentos.
Deficiência nos rins27
Para pacientes16 com deficiência leve nos rins27 não é necessário ajuste posológico para ONGLYZA.
Para pacientes16 com deficiência moderada ou grave nos rins27 ou com deficiência em estágio terminal nos rins27 e que realizam hemodiálise28 a dose de ONGLYZA é de 2,5 mg em dose única diária. ONGLYZA deve ser administrado logo após a hemodiálise28.
ONGLYZA não foi estudado em pacientes submetidos à diálise peritoneal37.
Deficiência no fígado9
Não é necessário ajuste de dose de ONGLYZA para pacientes16 com deficiência no fígado9 seja essa deficiência leve, moderada ou grave.
Pacientes pediátricos
Não foram conduzidos estudos de eficácia e segurança com ONGLYZA em pacientes pediátricos.
Pacientes idosos
Não é necessário ajuste de dose para ONGLYZA baseados na idade. Pacientes idosos, normalmente, apresentam diminuição na função dos rins27, portanto deve-se ter cuidado na seleção da dose em pacientes idosos baseados na função dos rins27.
Fortes inibidores da enzima2 CYP3A4/5
A dose recomendada de ONGLYZA é de 2,5 mg em dose única diária quando co-administrada com fortes inibidores do citocromo P450 3A4/5 (CYP3A4/5) (por exemplo, cetoconazol, atazanavir, claritromicina, indinavir, itraconazol, nefazodona, nelfinavir, ritonavir, saquinavir e telitromicina).
Conduta necessária caso haja esquecimento de administração de uma dose
Caso você esqueça de tomar os comprimidos de saxagliptina, tome assim que se lembrar. Se você lembrar de tomar a dose esquecida apenas perto do horário da proxima dose, tome apenas a dose seguinte, no horário habitual. Nunca devem ser administradas duas doses ao mesmo tempo, a não ser se o seu médico orientar você a fazer isso. Converse com o médico caso você tenha alguma dúvida a respeito da dose esquecida.
Você deve seguir a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento.
Você não deve interromper o tratamento sem o conhecimento de seu médico.
Não use o medicamento com o prazo de validade vencido. Antes de usar observe o aspecto do medicamento.
5- Quais os males este medicamento pode causar?
Os efeitos adversos mais comuns com o uso de ONGLYZA incluem:
- Infecção26 do trato respiratório superior
- Infecção26 do trato urinário38
- Dor de cabeça39
Diminuição de açúcar6 no sangue4 (hipoglicemia10) pode agravar-se em pessoas que estejam fazendo outro tratamento para diabetes40, tais como uso de sulfoniluréias41. Informe seu médico se estiver tomando outros medicamentos para diabetes40. Se você tiver sintomas17 de baixo açúcar6 no sangue4, você deve verificar o seu nível de açúcar6 no sangue4 e se estiver baixo procurar tratamento entrando em contato com o seu médico. Os sintomas17 de hipoglicemia10 incluem: agitação, sudorese42, batimento cardíaco rápido, mudança na visão43, fome, dor de cabeça39, mudança no humor.
Inchaço21 ou retenção de líquidos nas mãos44, pés ou tornozelos (edema45 periférico) pode agravar- se em pessoas que também estiverem fazendo uso de tiazolidinediona para tratar a diabetes40.
Se você não souber se faz uso deste tipo de medicação, pergunte ao seu médico.
As reações alérgicas (de hipersensibilidade), tais como erupções cutâneas18, urticária20 e inchaço21 da face22, lábios e garganta24 podem ocorrer. Se tiver estes sintomas17, pare de tomar ONGLYZA e contate seu médico imediatamente.
Informe ao seu médico sobre a ocorrência de qualquer efeito indesejado persistente. Para maiores informações entre em contato com o médico.
Informe ao seu médico ou cirurgião-dentista o aparecimento de reações indesejáveis.
Atenção: este é um medicamento novo e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis para comercialização, efeitos indesejáveis e não conhecidos podem ocorrer. Neste caso, informe ao seu médico.
6- O que fazer se alguém usar uma grande quantidade deste medicamento de uma só vez?
Se você acredita que ingeriu uma quantidade muito grande de ONGLYZA entre em contato com seu médico ou Centro de Toxicologia mais próximo.
7- Onde e como devo guardar este medicamento?
ONGLYZA deve ser mantido em sua embalagem original, conservado em temperatura ambiente (15º - 30ºC).
Todo medicamento deve ser mantido em sua embalagem original até o momento do uso.
Todo medicamento deve ser mantido fora do alcance das crianças.
Informações Técnicas Aos Profissionais de Saúde32 da Onglyza
Características Farmacológicas da Onglyza
ONGLYZA (saxagliptina) é um inibidor ativo por via oral da enzima2 dipeptidil peptidase 4 (DPP-4). A saxagliptina monoidratada é descrita quimicamente como: (1S,3S,5S)-2-[(2S)-2-amino-2-(3-hidroxitriciclo [3.3.1.13,7] dec-1-il) acetil1]-2-azabiciclo [3.1.0] hexano-3-carbonitrila monohidratada ou (1S,3S,5S)-2-[(2S)-2-amino-2-(3-hidroxi-1-adamantan-1-il)acetil]-2-azabiciclo [3.1.0] hexano-3-carbonitrila hidratada. A fórmula empírica é C18H25N3O2•H2O e o peso molecular é 333,43. A fórmula estrutural é: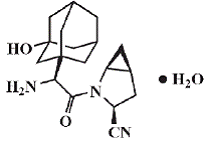
A saxagliptina monoidratada é um pó cristalino46 branco a amarelo claro ou marrom claro, não higroscópico. É pouco solúvel em água à temperatura de 24ºC ± 3ºC, altamente solúvel em acetato de etila e solúvel em metanol, etanol, álcool isopropílico, acetonitrila, acetona e polietilenoglicol 400 (PEG 400).
- MECANISMO DE AÇÃO:
Concentrações aumentadas dos hormônios incretina como os peptídeos-1 semelhantes ao glucagon47 (GLP-1) e os e o polipeptídeos insulinotrópicos dependentes de glicose3 (GIP) são liberados pelo intestino na corrente sanguínea em resposta a uma refeição. Esses hormônios causam a liberação de insulina8 das células pancreáticas beta48 de modo glicose3-dependente, mas são inativados pelas enzimas DPP-4 dentro de minutos. Além disso, o GLP-1 também diminui a secreção de glucagon47 pelas células34 pancreáticas alfa reduzindo a produção hepática49 de glicose3. Em pacientes com diabetes tipo 27, as concentrações de GLP-1 são reduzidas, mas a resposta da insulina8 ao GLP-1 é preservada. A saxagliptina é um competitivo inibidor da DPP4 que diminui a inativação dos hormônios incretina, aumentando suas concentrações na circulação50 sanguínea e reduzindo as concentrações de glicose3 em jejum e pós-prandial de modo glicose3-dependente em pacientes com diabetes mellitus51 tipo II.
Farmacodinâmica da Onglyza
Geral
Nos pacientes com diabetes40 do tipo 2, a administração de ONGLYZA levou a inibição da atividade da enzima2 DPP4 durante um período de 24 horas. Após uma carga oral de glicose3 ou uma refeição, esta inibição da DDP4 resultou em um aumento de 2 a 3 vezes os níveis de circulação50 dos ativos GLP1 e GIP, diminuiu as concentrações de glucagon47 e aumentou a secreção de insulina8 glicose3-dependente das células pancreáticas beta48. O aumento da insulina8 e a diminuição do glucagon47 foram associados a uma menor concentração de glicose3 em jejum e reduziram a excursão da glicose3 na sequência de uma carga oral de glicose3 ou uma refeição.
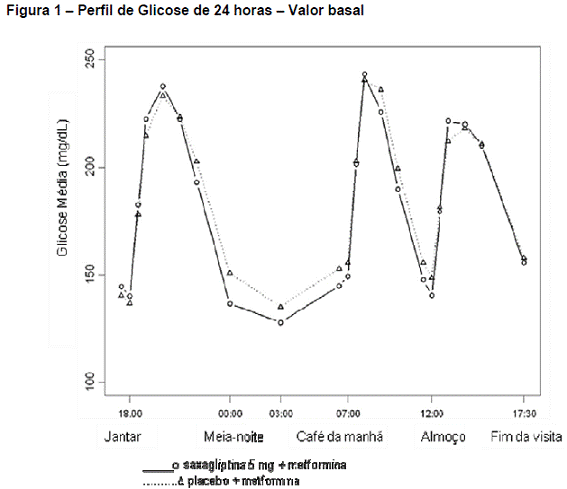
O tratamento com saxagliptina 5 mg e metformina52 de liberação prolongada administrados uma vez ao dia com a refeição da noite por 4 semanas promoveu reduções significativas na concentração média de glicose3 durante o intervalo de 24 horas (definido como área sob a curva de glicose3 ao longo de 24 horas dividido por 24 horas), quando comparado com o placebo36 + metformina52 de liberação prolongada (redução média corrigida por placebo36 de -16,8 mg/dL53, p = 0,0001), com melhorias consistentes nos valores de glicemia54 medidos ao longo do intervalo posológico de 24 horas (Figuras 1 e 2). Reduções significativas na glicose3 pós-prandial de 2 horas e média de glicemia de jejum55 de 2 dias foram observadas (redução média corrigida por placebo36 de -35,4 mg/dL53, p = 0,0010 e – 15,3 mg/dL53, p = 0,0002, respectivamente).

Eletrofisiologia cardíaca
Em um ensaio randomizado56, duplo=cego, placebo36 controlado, cruzado de 4 braços, com comparador de ativo usando movifloxacino em 40 indivíduos saudáveis ONGLYZA não foi associado com prolongamento clinicamente significativo do intervalo QTc ou frequência cardíaca em doses de até 40 mg (8 vezes a máxima dose recomendada para humanos – MDRH).
Farmacocinética da Onglyza
A farmacocinética da saxagliptina e de seu metabólito57 ativo, 5-hidroxi saxagliptina, foram similares em indivíduos saudáveis e em pacientes com diabetes mellitus51 tipo 2. Os valores de Cmax e AUC58 da saxagliptina e de seu metabólito57 ativo aumentaram proporcionalmente no intervalo de dose de 2,5 mg a 400 mg. Após uma dose oral única de 5 mg de saxagliptina em indivíduos saudáveis, os valores de AUC58 plasmático médio para a saxagliptina e o seu metabólito57 ativo foram 78 ng.h/mL e 214 ng.h/mL, respectivamente. Os valores plasmáticos correspondentes de Cmax foram 24 ng/mL e 47 ng/mL, respectivamente. A variação média (CV%) para a AUC58 e Cmax para ambos, saxagliptina e seu metabólito57 ativo, foi inferior a 25%.Nenhum acúmulo apreciável foi observado da saxagliptina e de seu metabólito57 ativo com repetidas doses únicas diárias em qualquer nível de dose. Nenhuma dependência de dose e de tempo foi observada na depuração da saxagliptina e de seu metabólito57 ativo durante 14 dias administrando doses diárias de saxagliptina que variaram entre 2,5 mg e 400 mg.
Absorção
O tempo médio para a concentração máxima (Tmax) após a administração de uma dose de 5 mg uma vez ao dia foi de 2 horas para saxagliptina e 4 horas para o seu metabolito57 ativo. A administração com uma refeição rica em gorduras resultou em um aumento de Tmax da saxagliptina por aproximadamente 20 minutos em relação ao jejum. Houve um aumento de 27% na AUC58 da saxagliptina quando administrada com uma refeição, em comparação com condições de jejum. ONGLYZA pode ser administrado com ou sem alimentos.
Distribuição
A ligação às protéinas plasmáticas in vitro da saxagliptina e do seu metabólito57 ativo no soro59 humano está abaixo dos níveis mensuráveis. Por isso, não é esperado que se altere a disposição da saxagliptina com mudanças nos níveis de proteínas60 sanguíneas em vários estados da doença (por exemplo, insuficiência renal61 ou hepática49).
Metabolismo62
O metabolismo62 da saxagliptina é mediado, principalmente, pelo citocromo P450 3A4/5 (CYP3A4/5). O metabólito57 ativo da saxagliptina também é inibidor da DPP4, que tem a metade da potênciada saxagliptina. Portanto, fortes inibidores e indutores da CYP3A4/5 alterarão a farmacocinética da saxagliptina e de seu metabólito57 ativo.
Excreção
A saxagliptina é eliminada por ambas as vias: renal63 e hepática49. Após uma dose única de 50 mg de 14C-saxagliptina, 24%, 36% e 75% da dose de saxagliptina foi excretada na urina14, e seu metabólito57 ativo, e radioatividade total, respectivamente. A média da depuração renal63 da saxagliptina (~230 mL/min) foi maior do que a taxa média estimada de filtração glomerular (~120 mL/min), sugerindo alguma excreção renal63 ativa. Um total de 22% da radioatividade administrada foi recuperada nas fezes que representam a fração da dose da saxagliptina excretada na bile64 e/ou do fármaco65 não absorvido no trato gastrointestinal. Após uma dose oral única de ONGLYZA 5 mg a indivíduos saudáveis, a meia-vida plasmática média terminal (t1/2) para saxagliptina e seu metabólito57 ativo foi de 2,5 e 3,1 horas, respectivamente.
Populações especiais
Insuficiência Renal61
Em um estudo de dose única, de caráter aberto foi conduzido para avaliar a farmacocinética da saxagliptina (10 mg/dose) em indivíduos portadores de vários níveis de insuficiência renal61 crônica (N=8 por grupo) comparados com indivíduos com função renal63 normal. O estudo incluiu pacientes com insuficiência renal61 classificada conforme o clearance de creatinina66: leve (>50 a ≤80 mL/min), moderado (30 a ≤50 mL/min), e grave (<30 mL/min), assim como pacientes com insuficiência renal61 terminal em hemodiálise28. O clearance de creatinina66 foi estimado da creatinina66 sérica baseada na fórmula Cockcroft-Gault:
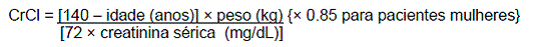
O nível de comprometimento renal63 não afetou os valores de Cmax de saxagliptina ou de seu metabólito57 ativo. Em indivíduos com insuficiência renal61 leve o valor de AUC58 de saxagliptina e de seu metabólito57 ativo ficou entre 20% e 70% maior, respectivamente, do que os valores de AUC58 em indivíduos com função renal63 normal. Como o aumento dessa magnitude não demonstrou relevância clínica não é necessário realizar ajuste de dose em pacientes com insuficiência renal61 leve. Em indivíduos com insuficiência renal61 moderada ou grave, os valores de AUC58 de saxagliptina e de seu metabólito57 ativo foram entre 2,1- e 4,5-vezes maior, respectivamente, que os valores AUC58 em pacientes com função renal63 normal. A dose recomendada é de 2,5 mg em pacientes com insuficiência renal61 moderada ou grave, assim como em indivíduos com insuficiência renal61 terminal que requeiram hemodiálise28. A saxagliptina é removida pela hemodiálise28.
Insuficiência hepática67
Em indivíduos com insuficiência hepática67 (classificados por Child-Pugh em classes A, B e C), os valores médios de Cmax e AUC58 de saxagliptina foram de até 8% a 77% maiores, respectivamente, quando comparados a controles sadios após administração única de 10 mg de saxagliptina. Os valores de Cmax e AUC58 correspondentes de seu metabólito57 ativo foram de 59% a 33% menores, respectivamente, quando comparados ao grupo controle de voluntários sadios. Essas diferenças não foram consideradas clinicamente significativas. Não é necessário realizar ajuste de dose em pacientes com insuficiência hepática67.
Índice de massa corporal68
Nenhum ajuste de dose é recomendado baseado no índice de massa corporal68 (IMC69). IMC69 não foi identificado como variável significativa no clearance aparente da saxagliptina ou do seu metabólito57 ativo em uma análise farmacocinética populacional.
Idosos
Não há recomendação de ajuste de dose baseado apenas na idade. Indivíduos idosos (65 – 80 anos) obtiveram valores geométricos 23% e 59% maiores de Cmax e AUC58 médias, respectivamente, para saxagliptina do que em indivíduos jovens (18-40 anos). As diferenças observadas na farmacocinética do metabólito57 ativo da saxagliptina entre indivíduos idosos e jovens normalmente refletiu as diferenças ocorridas na farmacocinética da saxagliptina. A diferença entre a farmacocinética da saxagliptina e de seu metabólito57 ativo em indivíduos jovens e idosos provavelmente acontece graças a fatores múltiplos incluindo declínio na função renal63 e na capacidade metabólica conforme aumenta a idade. A idade não foi identificada como uma variante significativa no clearance aparente da saxagliptina ou do seu metabólito57 ativo em uma análise farmacocinética populacional.
Pediatria
Estudos caracterizando a farmacocinética de saxagliptina em pacientes pediátricos não foram realizados.
Sexo
Não há recomendação de ajuste de dose baseado no sexo do paciente. Não foi observada diferença significativa na farmacocinética da saxagliptina entre homens e mulheres.
Comparadas aos homens, as mulheres obtiveram valores de exposição 25% maiores ao metabólito57 ativo da saxagliptina do que os homens, mas é improvável que essa diferença possua relevância clínica. O sexo do paciente não foi identificado como uma variante significativa no clearance da saxagliptina ou do seu metabólito57 ativo em uma análise farmacocinética populacional.
Raça e etnicidade
Não há recomendação de ajuste de dose baseado na raça do paciente. Em uma análise de modelo experimental comparou-se a farmacocinética da saxagliptina e de seu metabólito57 ativo em 309 indivíduos brancos e 105 indivíduos de outra raça que não a branca (consistindo em um grupo de 6 raças). Não foi observada diferença significativa na farmacocinética da saxagliptina entre as duas populações.
Carcinogênese, Mutagênese e Problemas de Fertilidade da Onglyza
A saxagliptina não induziu tumores em camundongos (50, 250 e 600 mg/kg) ou ratos (25, 75, 150 e 300 mg/kg) nas doses mais altas avaliadas. As doses mais altas avaliadas em camundongos foram equivalentes a aproximadamente 870 (machos) e 1165 (fêmeas) vezes a exposição em humanos na dose humana recomendada de 5 mg/dia. Em ratos, as exposições foram aproximadamente 355 (machos) e 2217 (fêmeas) vezes a dose máxima recomendada para humanos.
A saxagliptina não demonstrou-se clastogênica ou mutagênica com ou sem ativação metabólica em um ensaio bacterial Ames in vitro, um ensaio citogenético in vitro em linfócitos humanos primários, um ensaio oral in vivo em micronúcleos em ratos, um estudo in vivo oral de reparo de DNA em ratos, e um estudo oral in vivo/in vitro citogenético em linfócitos de sangue4 periférico de ratos. A saxagliptina não foi mutagênica ou clastogênica baseado nestes estudos combinados. O principal metabólito57 não foi mutagênico em um ensaio in vitro de bacterial de Ames.
Em estudos de fertilidade em ratos, os machos foram tratados com doses orais de alimentação forçada por 2 semanas antes do acasalamento, durante o acasalamento e até o término agendado (aproximadamente o total de quatro semanas) e as fêmeas foram tratadas com doses orais de alimentação forçada para 2 semanas antes do acasalamento pelo 7º dia da gestação. Nenhum efeito adverso na fertilidade foi observado à exposição de aproximadamente 603 (machos) e 776 (fêmeas) vezes a dose recomendada para humanos. A uma dose de toxicidade70 materna mais alta, obervou-se reabsorção fetal aumentada (aproximadamente 2069 e 6138 vezes a dose máxima recomendada para humanos). Efeitos adicionais no ciclo relacionados à fertilidade, ovulação71, e implantação foram observados em aproximadamente 6138 vezes a dose máxima recomendada para humanos.
Toxicologia Animal da Onglyza
A saxagliptina produziu alterações na pele19 (escara72 e ou ulceração73) nas extremidades (unha, dedos, escroto74 e/ou nariz75). As lesões76 cutâneas18 foram reversíveis com doses ≥ 20 vezes a dose máxima recomendada para humanos, mas em alguns casos eram irreversíveis e necrosantes77 com exposições a altas doses. Alterações cutâneas18 adversas não foram observadas em exposições semelhantes (1 a 3 vezes) à dose máxima recomendada para humanos (5 mg).Correlações clínicas a lesões76 de pele19 em macacos não foram observadas em estudos clínicos com a saxagliptina em humanos.
Resultados de Eficácia da Onglyza
ONGLYZA foi estudado como monoterapia e em combinação com metformina52, glibenclamida e as tiazolidinedionas: pioglitazona e rosiglitazona.
Um total de 4148 pacientes com diabetes40 do tipo 2 foram randomizados, em seis estudos duplo-cego conduzidos para avaliar a segurança e a eficácia glicêmica de ONGLYZA. Um total de 3021 indivíduos desses estudos foi tratado com ONGLYZA. Nestes estudos, a média de idade dos pacientes foi de 54 anos, e 71% dos pacientes eram brancos, 16% eram asiáticos, 4% eram negros, e 9% eram de outros grupos raciais. Um adicional de 423 pacientes, incluindo 315 que receberam ONGLYZA, participaram de um estudo placebo36 controlado, variando a dose de 6 a 12 semanas de duração.
Nestes seis estudos duplo-cego, ONGLYZA foi avaliado em doses de 2,5 mg e 5 mg uma vez por dia. Em três desses estudos também foi avaliada a dose única de 10 mg ao dia. A dose diária de 10 mg de saxagliptina não forneceu maior eficácia do que a dose diária de 5 mg. O tratamento com ONGLYZA produziu em todas as doses clinicamente relevantes melhorias estatisticamente significativas na hemoglobina78 A1c79 (A1C79), na glicemia de jejum55 do plasma80 (FPG), e na glicemia pós-prandial81 (PPG), 2 horas PPG que seguem o teste de tolerância glicemia54 oral (OGTT), comparadas ao grupo controle.
Reduções em A1C79 foram observadas através dos subgrupos que incluíram o gênero, a idade, a raça e o índice de massa corporal68 (IMC69) inicial.
ONGLYZA não está associado a grandes alterações no peso ou índice de lipídeos no plasma80 no jejum quando comparados ao placebo36.
ONGLYZA foi avaliado em dois estudos adicionais em pacientes com diabetes40: um estudo ativo-controlado comparando terapia com ONGLYZA adjuvante à glipizida82 em 858 pacientes inadequadamente controlados com metformina52 isolada, e um estudo placebo36-controlado comparando ONGLYZA a placebo36 em 170 pacientes com diabetes tipo 27 e insuficiência renal61 moderada ou grave, ou doença renal63 em estágio terminal (ESRD).
Monoterapia
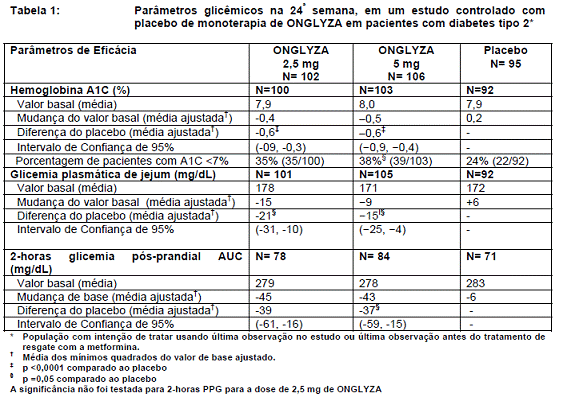
Um total de 766 pacientes virgens de tratamento do diabetes tipo 27 inadequadamente controlados com dieta e exercícios (A1C79 ≥7% a ≤10%) participaram de dois estudos duplocego, controlados com placebo36 de 24 semanas de duração para avaliar a eficácia e a segurança da monoterapia com ONGLYZA.
No primeiro estudo, depois de um estudo único-cego de 2 semanas, de dieta, exercício e um período inicial com placebo36, os 401 pacientes foram randomizados para os grupos de ONGLYZA 2,5 mg, 5 mg ou 10 mg ou placebo36. Os pacientes que não conseguiram cumprir metas glicêmicas específicas durante o estudo foram tratados com a terapia de resgate com metformina52, adicionada ao grupo placebo36 ou ao grupo ONGLYZA. A eficácia foi avaliada na última medição antes da terapia de resgate para os pacientes que precisaram desta. A titulação de dose de ONGLYZA não foi permitida neste estudo.
O tratamento com ONGLYZA 2,5 mg e 5 mg por dia, proporcionou melhorias significativas na A1C79, FPG, e PPG em comparação com o placebo36 (Tabela 1). A proporção de pacientes que descontinuaram o tratamento por falta de controle glicêmico ou que receberam terapia de resgate para obter a glicemia54 pré-especificada foi 16% no grupo ONGLYZA 2,5 mg, 20% no grupo ONGLYZA, 5 mg e 26% no grupo placebo36.
Um segundo estudo de 24 semanas de monoterapia foi realizado para avaliar uma escala de regimes posológicos de ONGLYZA. Os pacientes virgens de tratamento com diabetes40 inadequadamente controlada (≥ 7% ≤10% de A1C79) submeteram-se a um estudo único-cego de 2 semanas, de dieta e exercícios em um período inicial com placebo36. Um total de 365 pacientes foram randomizados para receber as dosagens de 2,5 mg todas as manhãs, 5 mg todas as manhãs, 2,5 mg todas as manhãs com possibilidade de titulação de dose para 5 mg todas as manhãs, 5 mg todas as noites ou placebo36. Pacientes que não obtiveram a glicemia54 desejada foram tratados com terapia de metformina52 de resgate adicionados ao placebo36 ou ONGLYZA, o número de pacientes randomizados por grupo de tratamento variou de 71 a 74.
O tratamento com ONGLYZA 5 mg a cada manhã ou 5 mg a cada noite forneceu melhorias significativas em A1C79 contra o placebo36 (redução média placebo36-corrigida de - 0.4% e -0.3%, respectivamente). O tratamento com ONGLYZA 2,5 mg a cada manhã também forneceu melhorias significativas em A1C79 contra o placebo36 (redução média placebo36-corrigida de - 0.4%).
Terapia em combinação
Terapia combinada11 em adição a metformina52
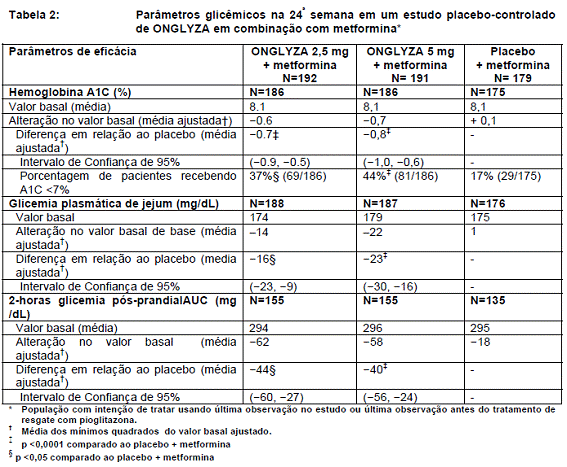
Um total de 743 pacientes com diabetes tipo 27 participaram de estudo randomizado83, duplocego, placebo36-controlado, de duração de 24 semanas, para avaliar a eficácia e segurança de ONGLYZA em combinação com metformina52 em pacientes com controle glicêmico inadequado (A1C79 ≥7% e ≤10%) com metformina52 sozinha. Foi exigido que os pacientes estivessem utilizando uma dose estável de metformina52 (1500 mg para 2550 mg diariamente) durante, pelo menos, 8 semanas, para então serem adicionados a este estudo.
Pacientes que obedeceram aos critérios de elegibilidade foram incluídos em um período únicocego, de duas-semanas, com dieta e exercício, e início com placebo36 durante o qual os pacientes receberam metformina52 na dose de pré-estudo deles, até 2500 mg diariamente. Após o período inicial, os pacientes elegíveis foram randomizados a 2,5 mg, 5 mg, ou 10 mg de ONGLYZA ou placebo36, em adição à dose atual de metformina52 aberta. Pacientes que não obtiveram a glicemia54 desejada durante o estudo foram tratados com pioglitazona como terapia de resgate, adicionadasàs medições do estudo. Titulações de dose de ONGLYZA e de metformina52 não foram permitidas neste estudo.
Em combinação com a metformina52, ONGLYZA 2,5 mg e 5 mg promoveu melhoras significativas em A1C79, FPG, e PPG comparados com o grupo placebo36 mais metformina52 (Tabela 2). Alterações médias desde o início para A1C79 ao longo do tempo e na avaliação são mostrados na Figura 1. A proporção de pacientes que interromperam o tratamento por falta de controle glicêmico, ou que foram resgatadas para atender os critérios glicêmicos pré-especificados foi de 15% para a dose de ONGLYZA 2,5 mg adicionada à metformina52, 13% para o grupo de ONGLYZA 5 mg adicionada à metformina52, e 27% no grupo placebo36 adicionada à metformina52.

Um total de 565 pacientes com diabetes tipo 27 participaram deste estudo randomizado83, duplocego, placebo36-controlado de duração de 24 semanas, para avaliar a eficácia e segurança de ONGLYZA em combinação com uma tiazolidinediona (TZD) em pacientes com controle glicêmico inadequado (A1C79 ≥7% a ≤10.5%) com TZD sozinha. Foi exigido que os pacientes estivessem fazendo uso de uma dose estável de pioglitazona (30 mg-45 mg uma vez ao dia) ou rosiglitazona (4 mg uma vez ao dia ou 8 mg ou uma vez ao dia ou em duas doses divididas de 4 mg) durante pelo menos 12 semanas para, então serem incluídos neste estudo.
Pacientes que obedeceram aos critérios de elegibilidade foram incluídos em um período únicocego, de duas-semanas, com dieta e exercício e início com placebo36, durante o qual os pacientes receberam TZD na dose de pré-estudo deles. Após o período inicial, os pacientes elegíveis foram randomizados a 2,5 mg, 5 mg de ONGLYZA ou placebo36, em adição à dose atual de TZD. Pacientes que não obtiveram a glicemia54 desejada durante o estudo foram tratados com metformina52 como terapia de resgate, adicionados ao placebo36 ou ONGLYZA mais TZD. Titulações de dose de ONGLYZA e de TZD não foram permitidas neste estudo. Uma mudança no regime terapêutico de TZD de rosiglitazona para pioglitazona com doses terapêuticas equivalentes e especificadas foram permitidas à discrição do investigador caso o mesmo acreditasse ser clinicamente apropriado.
Em combinação com TZD, ONGLYZA 2,5 mg e 5 mg promoveu melhorias significativas em A1C79, FPG, e PPG comparados com o grupo placebo36 mais TZD (Tabela 3). A proporção de pacientes que descontinuaram por falta de controle glicêmico ou que receberam tratamento de resgate para atingir os critérios de glicemia54 pré-especificados foi de 10% para o grupo de ONGLYZA 2,5 mg mais TZD, 6% para o grupo de ONGLYZA 5 mg mais TZD e de 10% para o grupo placebo36 mais TZD.

Terapia combinada11 em adição a glibenclamida
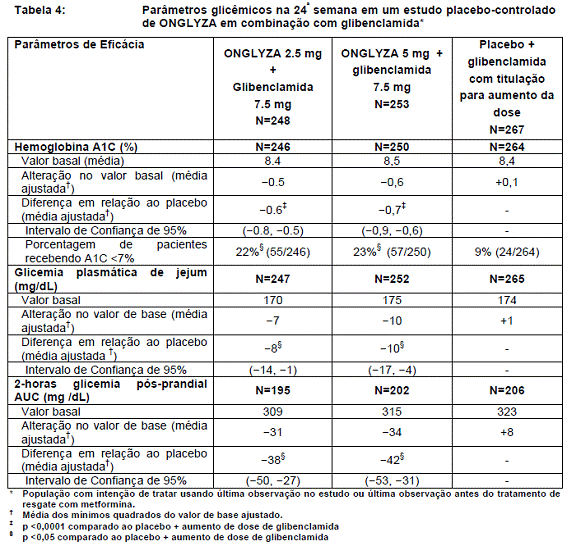
Um total de 768 pacientes com diabetes tipo 27 participaram deste estudo randomizado83, duplocego, placebo36-controlado de duração de 24 semanas, para avaliar a eficácia e segurança de ONGLYZA em combinação com uma sulfoniluréia (SU) em pacientes com controle glicêmico inadequado (A1C79 ≥7,5% a ≤10%) com a dose submáxima de SU sozinha. Foi exigido que os pacientes estivessem fazendo uso de uma dose de SU por dois meses ou mais para, então serem incluídos neste estudo. Neste estudo, uma combinação em dose fixa de ONGLYZA e uma dose intermediária de SU foi comparada à titulação com uma maior dose de SU.
Pacientes que obedeceram aos critérios de elegibilidade foram incluídos em um período únicocego, de quatro-semanas, de dieta e exercício, e início com placebo36 durante o qual os pacientes receberam glibenclamida 7,5 mg uma vez ao dia. Após o período inicial, os pacientes elegíveis com A1C79 ≥7% a ≤10% foram randomizados a 2,5 mg ou 5 mg de ONGLYZA mais 7,5 mg de glibenclamida ou placebo36 mais 10 mg de dose total diária de glibenclamida. Pacientes que receberam placebo36 foram elegíveispara receberem glibenclamida em titulação de aumento de dose até uma dose diária total de 15 mg. Titulações de aumento de glibenclamida não foram permitidas para pacientes16 que receberam ONGLYZA 2,5 mg ou 5 mg. A diminuição de dose de glibenclamida foi permitida em qualquer grupo de tratamento durante o período de 24 semanas do estudo caso houvesse hipoglicemia10, conforme julgado pelo investigador. Aproximadamente 92% dos pacientes do grupo placebo36 mais glibenclamida tiveram a dose titulada para uma dose total diária de 15 mg durante as primeiras 4 semanas do período de estudo. Pacientes que não obtiveram as metas de glicemia54 específicas foram tratados com metformina52 de resgate, e adicionados à medicação do estudo já em andamento. A titulação de dose de ONGLYZA não foi permitida durante o estudo.
Em combinação com a glibenclamida, ONGLYZA 2,5 mg e 5 mg promoveram melhorias significativas em A1C79, FPG, e PPG comparados com o grupo placebo36 mais glibenclamida titulada (Tabela 4). A proporção de pacientes que descontinuaram por falta de controle glicêmico ou que receberam tratamento de resgate para atingir os critérios de glicemia54 pré-especificados foi de 18% no grupo de ONGLYZA 2,5 mg mais glibenclamida , 17% no grupo de ONGLYZA 5 mg mais glibenclamida e 30% no grupo placebo36 mais glibenclamida.
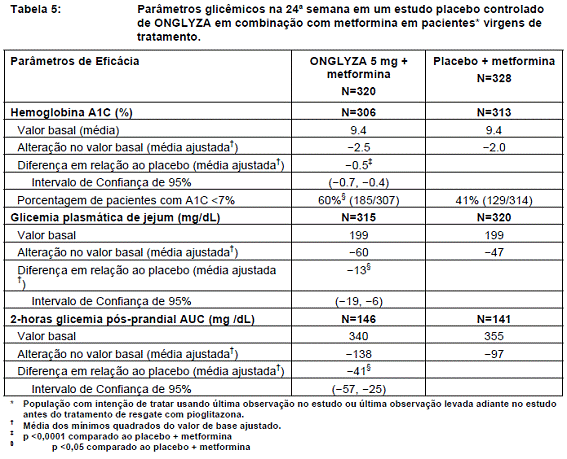
Combinação com a metformina52 em pacientes virgens de tratamento
Um total de 1306 pacientes virgens de tratamento com diabetes tipo 27 participaram deste estudo randomizado83, duplo-cego, ativo-controlado de duração de 24 semanas, para avaliar a eficácia e segurança de ONGLYZA em combinação com metformina52 para o tratamento inicial de pacientes com controle glicêmico inadequado (A1C79 ≥8% a ≤12%) com dieta e exercício apenas. Foi exigido que os pacientes fossem virgens de tratamento prévio para, então serem incluídos neste estudo.
Pacientes que obedeceram aos critérios de elegibilidade foram incluídos em um período únicocego, de uma semana, com dieta e exercício e início com placebo36. Os pacientes foram randomizados um dos quatro braços de tratamento: ONGLYZA 5 mg + metformina52 500 mg, saxagliptina 10 mg + metformina52 500 mg, saxagliptina 10 mg + placebo36 ou metformina52 500 mg + placebo36. ONGLYZA foi administrado uma vez ao dia. Nos 3 grupos de tratamento usando metformina52, a metformina52 foi titulada em aumentos de dose, incrementos de 500 mg por dia até alcançar uma dose máxima tolerável de 2000 mg por dia, baseado no FPG. Pacientes que não obtiveram as metas de glicemia54 específicas foram tratados com pioglitazona de resgate como terapia adicional.
A coadministração de ONGLYZA 5 mg em combinação com a metformina52 promoveu melhorias significativas em A1C79, FPG, e PPG comparados com o grupo de placebo36 mais metformina52 (Tabela 5).
Terapia combinada11 em adição a metformina52 versus terapia combinada11 em adição de glipizida82 a metformina52
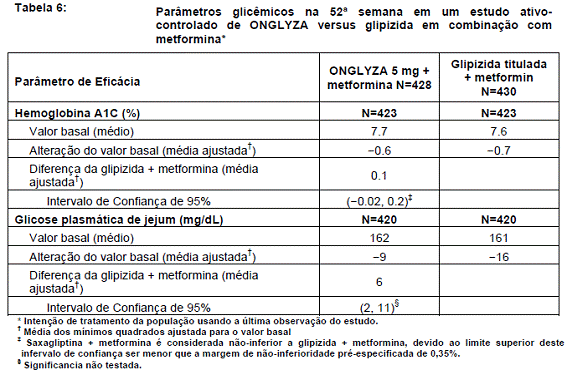
Neste estudo ativo-controlado de 52 semanas, um total de 858 pacientes com diabetes tipo 27 e controle glicêmico inadequado (A1C>6,5% e ≤10%) com metformina52 isolada foram ramdomizados em terapia duplo-cega combinada com ONGLYZA ou glipizida82. Pacientes foram requeridos a estar sob uso de dose estável de metformina52 (pelo menos 1500 mg ao dia) por pelo menos 8 semanas anteriores à inscrição.
Os pacientes que cumpriam o critério de elegibilidade foram submetidos a um período introdutório de 2 semanas, simples-cego, com placebo36, dieta e exercício, durante o qual os pacientes receberam metformina52 (1500-3000 mg com base em suas doses pré-estudo). Após o período introdutório, os pacientes eleitos foram randomizados para 5 mg de ONGLYZA ou 5 mg de glipizida82 em adição à suas atuais doses abertas de metformina52. Pacientes no grupo de glipizida82 com metformina52 receberam titulação cega da dose de glipizida82 durante as primeiras 18 semanas do estudo até uma dose máxima de glipizida82 de 20 mg/dia. A titulação objetivou a meta de FPG < 110mg/mL ou a maior dose tolerada de glipizida82. Cinquenta por cento (50%) dos pacientes tratados com glipizida82 foram titulados até a dose de 20 mg/dia; 21% dos pacientes tratados com glipizida82 tiveram uma dose final de glipizida82 de 5 mg ou menos. A dose média diária final de glipizida82 foi 15 mg.
Após 52 semanas de tratamento, ONGLYZA e glipizida82 resultaram em reduções médias semelhantes do valor basal de A1C79 quando adicionada à terapia com metformina52 (Tabela 6). Esta conclusão pode se limitar a pacientes com valores basais de A1C79 comparáveis aos do estudo (91% dos pacientes tinham valores basais de A1C79 < 9%).
De um peso corporal inicial médio de 89 kg, houve uma redução média estatisticamente significativa de 1,1 kg em pacientes tratados com ONGLYZA comparado a um ganho de peso médio de 1,1 kg em pacientes tratados com glipizida82 (p <0,0001).
Insuficiência Renal61
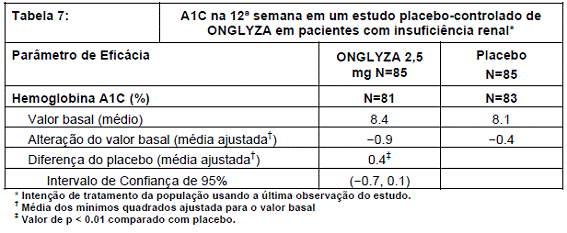
Um total de 170 pacientes participaram de um estudo de 12 semanas, randomizado56, duplocego, controlado por placebo36 conduzido para avaliar a eficácia e segurança de ONGLYZA 2,5 mg uma vez ao dia em comparação com placebo36 em pacientes com diabetes tipo 27 e insuficiência renal61 moderada (n=90) ou grave (n=41), ou doença renal63 em estágio terminal (n=39). Neste estudo, 98% dos pacientes estavam em uso de medicamentos antidiabéticos de fundo (75% faziam uso de insulina8 e 31% faziam uso de medicamentos antidiabéticos orais84, a maioria sulfoniluréias41).
Após 12 semanas de tratamento, ONGLYZA 2,5 mg aumentou significativamente a A1C79 comparado ao placebo36 (Tabela 7). No subgrupo de pacientes com doença renal63 em estágio terminal (ESRD), ONGLYZA e placebo36 resultaram em reduções comparáveis em A1C79 dos valores basais na semana 12. Este resultado é inconclusivo, pois o estudo não foi devidamente desenhado para demonstrar a eficácia em subgrupos específicos de insuficiência renal61.
Após 12 semanas de tratamento, a alteração média na glicose3 plasmática de jejum (FPG) foi de -12 mg/dL53 com ONGLYZA 2,5 mg e -13 mg/dL53 com placebo36. Comparado com placebo36, a alteração média na FPG com ONGLYZA foi de -12 mg/dL53 no subgrupo de pacientes com insuficiência renal61 moderada, -4 mg/dL53 no subgrupo de pacientes com insuficiência renal61 grave, e +44 mg/dL53 no subgrupo de pacientes com doença renal63 em estágio terminal. Estes resultados são inconclusivos, pois o estudo não foi devidamente desenhado para demonstrar a eficácia dentro de subgrupos específicos de insuficiência renal61.
Extenção de estudo de longo prazo controlado
Os pacientes que completaram o período inicial de 12 semanas do estudo, eram elegíveis a participar de uma extenção de longo prazo do estudo controlado, por 40 semanas. Pacientes que receberam saxagliptina no período inicial de 12 semanas de estudo mantiveram a mesma dose de saxagliptina na extensão de longo prazo. A maioria dos indivíduos (76%) em ambos os grupos de tratamento recebendo insulina8 ou outros medicamentos anti-hiperglicêmicos não teve nenhuma mudança na dose ou no tipo de medicação durante o período de tratamento de 52 semanas. Para os indivíduos que tiveram uma mudança significativa no tipo e dose de insulina8 (mais de ± 20%) ou antidiabéticos de uso oral (OAD), os dados de eficácia foram posteriormente excluídos da análise.
O tratamento com saxagliptina 2,5 mg proporcionou uma melhoria sustentada em A1C79 versus placebo36 (redução média do valor basal na 52ª semana, de -1,4% para o grupo de saxagliptina e -0,5% para o grupo do placebo36).
O perfil de segurança da saxagliptina no período de tratamento a longo prazo foi consistente com o previamente observado na experiência clínica e o observado no período de tratamento de curta duração (12 semanas) deste estudo.
Indicações da Onglyza
Monoterapia e terapia combinada11:ONGLYZA é indicado como adjuvante à dieta e à prática de exercícios para melhorar o controle glicêmico em pacientes adultos com diabetes mellitus51 tipo 2.
ONGLYZA não deve ser utilizado para o tratamento de pacientes com diabetes tipo 112 ou para o tratamento da cetoacidose diabética13, pois pode não ser eficaz nesses casos.
Contraindicações da Onglyza
ONGLYZA é contraindicado para pacientes16 com reações alérgicas a qualquer um dos seus componentes; e a pacientes com histórico de hipersensibilidade grave, tais como anafilaxia85 ou angioedema86, a qualquer inibidor de enzima2 DPP4. (vide “Advertências e Precauções” e “Reações Adversas”.
Modo de Usar e Cuidados de Conservação Depois de Aberto da Onglyza
Os comprimidos devem ser ingeridos sem mastigar com um pouco de liquido. Os comprimidos podem ser ingeridos com ou sem alimentação.Depois de aberto, ONGLYZA deve ser mantido em sua embalagem original, conservado em temperatura ambiente (15º - 30ºC).
Posologia da Onglyza
Monoterapia e terapia combinada11
A dose recomendada de ONGLYZA é de 2,5mg ou 5 mg em dose única diária como monoterapia ou em terapia combinada11. ONGLYZA pode ser tomado com ou sem alimentos.
Insuficiência renal61
Para pacientes16 com insuficiência renal61 leve (clearance de creatinina66 >50 mL/min), não é necessário ajuste posológico para ONGLYZA.
Para pacientes16 com insuficiência renal61 moderada ou grave ou com insuficiência renal61 terminal que requeiram hemodiálise28 (clearance de creatinina66 ≤50 mL/min), a posologia de ONGLYZA é de 2,5 mg em dose única diária. ONGLYZA deve ser administrado logo após a hemodiálise28.
ONGLYZA não foi estudado em paciente submetidos a diálise peritoneal37.
Como a dose é limitada a 2,5 mg baseada na função renal63, é recomendado que seja realizado avaliação de função renal63 prévia ao início do tratamento com ONGLYZA , e depois periodicamente. O clearance de creatinina66 pode ser estimado a partir da creatinina66 sérica utilizando-se a fórmula de Cockcroft-Gault ou a fórmula de modificação da dieta na doença renal63. (Vide “Advertências e Precauções” – Uso em pacientes com insuficiência renal61).
Fortes inibidores da enzima2 CYP3A4/5
A dose recomendada de ONGLYZA é de 2,5 mg em dose única diária quando co-administrada com fortes inibidores do citocromo P450 3A4/5 (CYP3A4/5) (por exemplo, cetoconazol, atazanavir, claritromicina, indinavir, itraconazol, nefazodona, nelfinavir, ritonavir, saquinavir e telitromicina).
Insuficiência hepática67
Não é necessário ajuste posológico de ONGLYZA para pacientes16 com insuficiência hepática67 leve, moderada ou grave.
Pacientes pediátricos
A segurança e eficácia de ONGLYZA em pacientes pediátricos não foram estabelecidas.
Pacientes geriátricos
Não é necessário ajuste posológico para ONGLYZA de acordo com a idade. Pacientes idosos, normalmente, apresentam decréscimo na função renal63, portanto deve-se ter precaução na seleção da dose em pacientes idosos baseados na função renal63 (Vide “Uso geriátrico”).
Conduta necessária caso haja esquecimento de administração
Caso o paciente esqueça de tomar uma dose, ele deverá tomá-la assim que possível, no entanto, se estiver próximo do horário da dose seguinte o paciente deverá esperar por este horário, respeitando sempre o intervalo determinado pela posologia. Nunca devem ser administradas duas doses ao mesmo tempo.
Advertências e Precauções da Onglyza
Uso com medicamentos que podem causar hipoglicemia10Secretatogos de insulina8, como as sulfoniluréias41, causam hipoglicemia10. Por isso, pode ser necessária a administração de uma dose menor de secretagogo de insulina8 afim de reduzir o risco de hipoglicemia10 ao utilizá-lo em combinação com ONGLYZA.
Reações de hipersensibilidade
Durante a experiência pós-comercialização, as seguintes reações adversas foram relatadas com o uso de saxagliptina: reações de hipersensibilidade graves, incluindo anafilaxia85 e angioedema86. Como estas reações são relatadas voluntariamente por uma população de tamanho incerto, não é possível estimar a sua freqüência com confiança. Se houver suspeita de reação de hipersensibilidade grave à saxagliptina, deve-se descontinuar ONGLYZA, avaliar outras possíveis causas para o evento, e instituir tratamento alternativo para o diabetes40 (vide “Contraindicações” e “Reações Adversas – Experiência pós comercialização”).
Gravidez29 e Lactação30
Não existem estudos adequados e bem controlados conduzidos em mulheres grávidas. Como os estudos realizados em animais nem sempre são preditivos para as repostas em humanos, ONGLYZA deve ser usado durante a gravidez29 apenas se claramente necessário, assim como com outros antidiabéticos.
A saxagliptina não demonstrou-se teratogênica87 em nenhuma dose testada quando administrada em ratas e coelhas grávidas durante o período da organogênese. Ossificação incompleta da pelvis, uma forma de atraso no desenvolvimento, ocorreu nas ratas a uma dose de 240 mg/kg, ou aproximadamente 1503 e 66 vezes a exposição humana à saxagliptina e à seu metabólito57 principal, respectivamente, na dose máxima recomendada de 5 mg.Toxicidade70 materna e redução no peso fetal foram observados em doses 7986 e 328 vezes a exposição humana à saxagliptina e à seu metabólito57 principal, respectivamente. Variações menores no esqueleto88 de coelhas ocorreram na dose tóxica materna de 200 mg/kg, ou aproximadamente 1432 e 992 vezes a exposição humana máxima recomendada à saxagliptina e à seu metabólito57 ativo, respectivamente.
A coadministração de saxagliptina e metformina52 a ratas e coelhas durante o período de organogênese, não foi embrioletal nem teratogênica87 em ambas as espécies quando testadas a doses gerando exposição sistêmica (AUC58) de até 100 e 10 vezes a dose máxima diária recomendada a humanos (5 mg de saxagliptina e 2000 mg de metformina52), respectivamente, em ratos; e 249 e 1,1 vez a dose máxima diária recomendada a humanos em coelhos. Em ratos, o desenvolvimento de toxicidade70 menor se limitou à incidência89 aumentada de costelas90 onduladas; a toxicidade70 associada à mãe se limitou à redução de peso de 11% a 17% ao longo do estudo e reduções ligadas ao consumo de alimento materno. Em coelhos, a coadministração foi pouco tolerada em um subgrupo de mães (12 a 30), resultando em morte, moribundez, ou aborto. Contudo, dentre as mães sobreviventes com ninhadas analisadas, a toxicidade70 materna estava limitada a reduções marginais do peso corporal ao longo dos dias 21 a 29 do período gestacional; e o desenvolvimento de toxicidade70 associada nestas ninhadas se limitou à redução de 7% do peso corpóreo fetal, e à baixa incidência89 de atraso na ossificação do hióide fetal.
A administração de saxagliptina a ratas fêmeas desde o 6º dia de gestação até o 20º dia de amamentação91 resultou em decréscimo de peso em filhotes machos e fêmeas apenas em doses tóxicas maternas (exposição ≥ 1629 e 53 vezes a exposição humana à saxagliptina e a seu metabólito57 ativo, respectivamente). Nenhuma toxicidade70 funcional ou comportamental foi observada na ninhada de ratos que tiveram saxagliptina administrada a qualquer dose.
A saxagliptina atravessa a barreira placentária de ratas prenhas.
A saxagliptina é secretada no leite de ratas lactantes92 a uma proporção de aproximadamente 1:1 a razão da concentração da droga no plasma80. Não se sabe se a saxagliptina é secretada no leite humano. Como muitos fármacos são secretados no leite humano recomenda-se precaução quando ONGLYZA for administrado em mulheres que estejam amamentando.
Categoria de risco: B – Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica.
Uso Pediátrico
A segurança e a eficácia de ONGLYZA em pacientes pediátricos não foram estabelecidas.
Uso Geriátrico
Nos 6 estudos duplo-cegos controlados de segurança e eficácia clínica de ONGLYZA , 634 (15,3%), dos 4148 pacientes randomizados tinham idade ≥ a 65 anos, e 59 (1.4%) pacientes tinham idade ≥ 75 anos. Nenhuma diferença em segurança e eficácia foi observada os indivíduos com idade maior ou igual a 65 anos ou entre pacientes mais jovens. Como esta experiência clínica não identificou diferenças entre as respostas de pacientes jovens e idosos, uma maior sensibilidade em alguns pacientes idosos não pode ser descartada. Parte da eliminação da saxagliptina e do seu metabólito57 ativo é renal63. Pacientes idosos, normalmente, apresentam decréscimo na função renal63, portanto deve-se ter precaução na seleção da dose em pacientes idosos baseados na função renal63 destes pacientes (Vide “Posologia” e “Farmacocinética – Populações especiais”)
Efeitos na capacidade de dirigir e operar máquinas
Não foi realizado nenhum estudo para verificar a capacidade de dirigir e de operar máquinas.
Entretanto, deve-se levar em conta que tontura31 pode ocorrer com o uso de ONGLYZA.
Alterações clinicamente significativas nos sinais vitais93 não foram observadas em pacientes tratados com ONGLYZA.
Riscos Macrovasculares
Até o momento não há estudos clínicos que estabeleçam evidências conclusivas de redução dos riscos macrovasculares com ONGLYZA ou qualquer outra droga antidiabética.
Interações Medicamentosas
Avaliação in vitro de interações medicamentosas
O metabolismo62 da saxagliptina é principalmente mediado pela CYP3A4/5.
Em estudos in vitro, nem a saxagliptina nem seu metabólito57 ativo inibiram as isoenzimas CYP1A2, 2A6, 2B6, 2C9, 2C19, 2D6, 2E1, ou 3A4, nem induziram as enzimas CYP1A2, 2B6, 2C9, ou 3A4. Sendo assim, não se espera que a saxagliptina altere o clearance metabólico de fármacos co-administrados que sejam metabolizados por essas enzimas. A saxagliptina é substrato da P-glicoproteína (Pgp), mas não é um inibidor, nem um indutor significativo da Pglicoproteína (Pgp).
Avaliação in vivo de interações medicamentosas

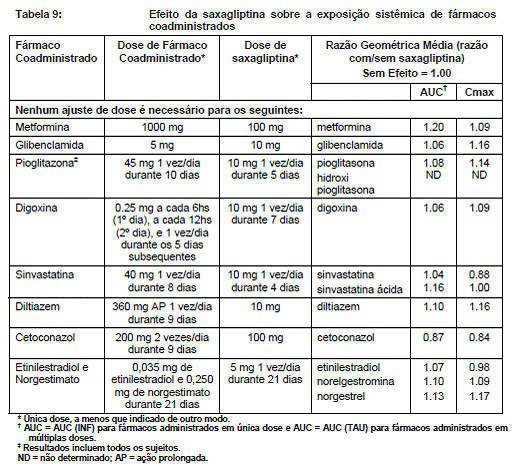
Potentes inibidores das enzimas CYP3A4/5
Cetoconazol aumentou significativamente a exposição de saxagliptina. Aumentos significativos e significantes nas concentrações plasmáticas de saxagliptina também ocorreram com outros potentes inibidores da CYP3A4/5 (por exemplo, atazanavir, claritromicina, indinavir, itraconazol, nefazodona, nelfinavir, ritonavir, saquinavir e telitromicina). A dose de ONGLYZA deve ser limitada a 2,5 mg, quando coadministrado com um potente inibidor da CYP3A4/5.
Reações Adversas da Onglyza
Experiência com Estudos Clínicos
Como os ensaios clínicos94 são conduzidos sob condições muito diversas, as taxas de reações adversas observadas nos ensaios clínicos94 de um fármaco65 não podem ser comparadas diretamente com as taxas em ensaios clínicos94 de um outro fármaco65, pois nem sempre refletem as taxas observadas na prática.
Monoterapia e terapia em combinação
Em dois estudos de monoterapia placebo36-controlados de 24 semanas de duração, os pacientes foram tratados diariamente com ONGLYZA 2,5 mg, ONGLYZA 5 mg e placebo36. Três estudos placebo36-controlados, de terapia combinada11 de 24 semanas também foram realizados, um com metformina52, um com tiazolidinediona (pioglitazona ou rosiglitazona), e um com glibenclamida. Nestes três estudos, os pacientes foram randomizados para receber ONGLYZA 2,5 mg ou 5 mg diariamente ou placebo36 em adição à terapia. Um braço de tratamento com saxagliptina 10 mg foi incluído em um dos ensaios em monoterapia, e em combinação com metformina52.
Em uma análise pré-especificada dos dados da 24ª semana (indepententemente de resgate glicêmico) dois estudos de monoterapia e dos estudos de terapia combinada11 com metformina52, TZD e glibenclamida, a incidência89 total de eventos adversos nos pacientes tratados com o ONGLYZA 2,5 e 5 mg foi semelhante ao placebo36 (72,0% e 72,2% contra 70,6%). A descontinuação da terapia devido a eventos adversos ocorreu 2,2%, 3,3% e 1,8%, dos pacientes recebendo ONGLYZA 2,5 mg, 5 mge placebo36, respectivamente. Os eventos adversos mais comuns (relatados por pelo menos 2 pacientes tratados com ONGLYZA 2,5 mg ou pelo menos 2 pacientes tratados com ONGLYZA 5 mg) associados à interrupção da terapêutica95 incluíram linfopenia (0,1% e 0,5% versus 0%, respectivamente), erupção96 cutânea97 (0,2% e 0,3% versus 0,3%), aumento da creatinina66 sanguínea (0,3% e 0% versus 0%) e aumento da creatinina66 fosfoquinase (0,1% e 0,2% versus 0%). As reações adversas nesta análise conjunta relatados (independentemente da avaliação do investigador da causalidade) em ≥ 5% dos pacientes tratados com ONGLYZA 5 mg, e mais frequentemente do que nos pacientes tratados com placebo36 são apresentados na Tabela 10.

A tabela mostra dados de 24 semanas independentemente do resgate glicêmico. Nos pacientes tratados com ONGLYZA 2,5 mg, cefaléia98 (6,5%) foi a única reação adversa relatada com uma taxa ≥ 5% e mais frequentemente do que nos pacientes tratados com placebo36.
Nesta análise associada, as reações adversas que foram notificadas em ≥ 2% dos pacientes tratados com ONGLYZA 2,5 mg ou 5 mg e ≥ 1% mais freqüentemente comparado com o placebo36 incluem as seguintes: sinusite99 (2,9% e 2,6% contra 1,6%, respectivamente), dor abdominal (2,4% e 1,7% contra 0,5%), gastroenterite100 (1,9% e 2,3% contra 0,9%) e vômitos101 (2,2% e 2,3% contra 1,3%).
No estudo de adição de TZD, a incidência89 de edema45 periférico foi maior para ONGLYZA 5 mg versus placebo36 (8,1% e 4,3%, respectivamente). A incidência89 de edema45 periférico para ONGLYZA 2,5 mg foi de 3,1%. Nenhuma das reações adversas relatadas de edema45 periférico resultou em descontinuação da droga no estudo. Taxas de edema45 periférico para ONGLYZA 2,5 mg e ONGLYZA 5 mg versus placebo36 foram de 3,6% e 2% versus 3%, administrado em monoterapia, 2,1% e 2,1% versus 2,2%, dado como terapia adjuvante à metformina52 e 2,4% e 1,2% versus 2,2%, dado como terapia adjuvante para glibenclamida.
A taxa de incidência89 de fraturas foi de 1,0 e 0,6 por 100 pacientes-ano, respectivamente, para ONGLYZA (análise combinada de 2,5 mg, 5 mg e 10 mg) e placebo36. A taxa de incidência89 de eventos de fratura102 em pacientes que receberam ONGLYZA não aumentou ao longo do tempo.
Causalidade não foi estabelecida e estudos não-clínicos não demonstraram efeitos adversos da saxagliptina no osso.
Um evento de trombocitopenia103, consistente com um diagnóstico104 de púrpura105 trombocitopênica idiopática106, foi observado no programa clínico. A relação deste evento para ONGLYZA não é conhecido.
Uso em insuficiência renal61
ONGLYZA 2,5 mg foi comparado a placebo36 em um estudo de 12 semanas feito em pacientes com diabetes tipo 27 e insuficiência renal61 moderada ou grave, ou doença renal63 em estágio terminal (ESRD). A incidência89 de eventos adversos, incluindo eventos adversos graves, e descontinuações devidas a eventos adversos, foi similar entre ONGLYZA e placebo36.
Reações adversas associadas com ONGLYZA coadministrada com metformina52 em pacientes virgens de tratamento para Diabetes Tipo 27
A Tabela 7 mostra as reações adversas notificadas (independentemente da avaliação do investigador da causalidade) em ≥ 5% dos pacientes que participam em um estudo adicional de 24 semanas, ativo-controlado de ONGLYZA coadministrada com metformina52 no tratamento de pacientes virgens de tratamento.

Hipoglicemia10
As reações adversas de hipoglicemia10 foram baseadas em todos os relatos de hipoglicemia10, uma medição de glicose3 concorrente não era necessária. No estudo com adição de glibenclamida, a incidência89 global de hipoglicemia10 relatada foi maior para ONGLYZA 2,5 mg e ONGLYZA 5 mg (13,3% e 14,6%) versus placebo36 (10,1%). A incidência89 de hipoglicemia10 confirmada neste estudo, definida como sintomas17 de hipoglicemia10 acompanhada por um valor de glicose3 no dedo ≤ 50 mg/dL53, foi de 2,4% e 0,8% para ONGLYZA 2,5 mg e ONGLYZA 5 mg e 0,7% para o placebo36. A incidência89 de hipoglicemia10 relatada para ONGLYZA 2,5 mg e ONGLYZA 5 mg versus placebo36 administrada como monoterapia foi de 4,0% e 5,6% versus 4,1%, respectivamente, 7,8% e 5,8% contra 5% dado como terapia adjuvante à metformina52 e 4,1% e 2,7% versus 3,8%, dado como terapia adjuvante para TZD. A incidência89 de hipoglicemia10 relatada foi de 3,4% em pacientes sem tratamento prévio dado ONGLYZA 5 mg e metformina52 e 4,0% em pacientes que receberam apenas metformina52.
No estudo ativamente controlado, comparando terapia adjuvante com ONGLYZA 5 mg a glipizida82 em pacientes inadequadamente controlados com metformina52 isolada, a incidência89 de hipoglicemia10 relatada foi 3% (19 eventos em 13 pacientes) com ONGLYZA versus 36,3% (750 eventos em 156 pacientes) com glipizida82. Hipoglicemia10 sintomática107 confirmada (acompanhada por glicose sanguínea108 em ponta do dedo <50 mg/dL53) não foi relatada em nenhum dos pacientes tratados com ONGLYZA e foi relatada em 35 pacientes tratados com glipizida82 (8,1%) (p<0,0001).
Durante as 12 semanas de tratamento nos pacientes com insuficiência renal61 moderada ou grave ou ESDR, a incidência89 total de hipoglicemia10 reportada foi 20% entre os pacientes tratados com ONGLYZA 2,5 mg e 22% entre os pacientes tratados com placebo36. Quatro pacientes tratados com ONGLYZA (4,7%) e três pacientes tratados com placebo36 (3,5%) relataram ao menos um episódio de hipoglicemia10 sintomática107 confirmada (acompanhada por glicose sanguínea108 em ponta do dedo <50 mg/dL53).
Reações de hipersensibilidade
Eventos relacionados à hipersensibilidade, tais como urticária20 e edema45 facial, na análise conjunta dos 5 estudos até à semana 24, foram relatados em 1,5%, 1,5% e 0,4% dos pacientes que receberam ONGLYZA 2,5 mg, ONGLYZA 5 mg e placebo36, respectivamente.
Nenhum desses eventos em pacientes que receberam ONGLYZA necessitou de internação ou foi relatado como risco de vida por parte dos investigadores. Um paciente tratado com saxagliptina nesta análise conjunta interrompeu o tratamento devido à urticária20 generalizada e edema45 facial.
Infecções109
Na base de dados para saxagliptina do estudo clínico não-cego, controlado, até o momento houve 6 relatos (0,12%) de tuberculose110 entre os 4959 pacientes tratados com saxagliptina (1,1 por 1000 pacientes-anos) comparados a nenhum relato de tuberculose110 entre os 2868 tratados com o comparador. Dois destes seis casos foram confirmados com testes laboratoriais. Os demais casos tiveram informação limitada ou diagnóstico104 presumido de tuberculose110. Nenhum dos seis casos ocorreu nos Estados Unidos ou Europa Ocidental. Um caso ocorreu no Canadá em um paciente originário da Indonésia que recentemente havia visitado a Indonésia. A duração do tratamento com saxagliptina até o relato de tuberculose110 variou de 144 a 929 dias.
A contagem de linfócitos pós-tratamento foi consistente dentro da faixa de referência para quatro casos. Um paciente apresentou linfopenia antes do início do tratamento com saxagliptina, a qual permaneceu estável durante o tratamento com saxagliptina.
O paciente final teve uma contagem de linfócitos abaixo do normal isolada, aproximadamente quatro meses antes do relato de tuberculose110. Não houve relatos espontâneos de tuberculose110 associada ao uso de saxagliptina. A causalidade não foi estabelecida e até o momento existem muito poucos casos para se determinar se a tuberculose110 está relacionada ao uso de saxagliptina.
Até o momento, houve um caso de potencial infecção26 oportunista na base de dados do estudo não-cego e controlado, em um paciente tratado com saxagliptina que desenvolveu suspeita de septicemia111 fatal por Salmonella de origem alimentar, após aproximadamente 600 dias de terapia com saxagliptina. Não houve relatos espontâneos de infecções109 oportunistas associadas ao uso de saxagliptina.
Experiência pós-comercialização
Durante a experiência pós-comercialização, as seguintes reações adversas foram relatadas com o uso de saxagliptina: reações de hipersensibilidade graves, incluindo anafilaxia85 e angioedema86. Como estas reações são relatadas voluntariamente por uma população de tamanho incerto, não é possível estimar a sua frequência com confiança.
Achados Laboratoriais
Contagem absoluta de linfócitos
Houve uma diminuição dose-relacionada média na contagem absoluta de linfócitos observada com ONGLYZA. De uma média basal de linfócitos absoluta de aproximadamente 2200 células34/μL, diminuições da média de aproximadamente 100 e 120 células34/μL com ONGLYZA 5 mg e 10 mg, respectivamente, em relação ao placebo36 foram observados em 24 semanas em uma análise conjunta dos cinco estudos clínicos placebo36 controlados. Efeitos similares foram observados quando ONGLYZA 5 mg foi administrado em combinação inicial com metformina52 em comparação com metformina52. Não houve diferença observada para ONGLYZA 2,5 mg em relação ao placebo36. A proporção de pacientes que relataram ter uma contagem de linfócitos ≤ 750 células34/μL foi de 0,5%, 1,5%, 1,4% e 0,4% para saxagliptina 2,5 mg, 5 mg, 10 mg, e placebo36, respectivamente. Na maioria dos pacientes, não foi observada recorrência112 devido em a exposição repetida ao ONGLYZA embora alguns pacientes tiveram quedas recorrentes o que levou à interrupção do tratamento com ONGLYZA. A diminuição da contagem de linfócitos não foi associada com reações adversas clinicamente relevantes.
A importância clínica desta diminuição na contagem de linfócitos em relação ao placebo36 não é conhecida. Quando clinicamente indicada, como em controles de infecção26 incomum ou prolongada, a contagem de linfócitos deve ser feita. O efeito de ONGLYZA na contagem de linfócitos em pacientes com alterações de linfócitos (por exemplo, o vírus113 da imunodeficiência114 humana) é desconhecido.
Plaquetas115
ONGLYZA não demonstrou um efeito clinicamente significativo ou consistente na contagem de plaquetas115 nos seis ensaios clínicos94 duplo-cegos, controlados de segurança e eficácia.
Superdose da Onglyza
Em um estudo clínico-controlado, ONGLYZA administrado por via oral uma vez ao dia não teve nenhuma reação adversa clínica relacionada à dose ou efeito clinicamente significativo no intervalo QTc ou freqüência cardíaca em doses de até 400 mg por 2 semanas (80 vezes a dose humana recomendada).Caso ocorra um evento de superdosagem, tratamento de suporte apropriado deve ser iniciado conforme o estado clínico do paciente. A saxagliptina e seu metabólito57 ativo são removidos através de hemodiálise28 (23% da dose a cada quatro horas).
Armazenagem da Onglyza
ONGLYZA deve ser mantido em sua embalagem original, conservado em temperatura ambiente (15º - 30ºC).
nº do lote, data de fabricação e data de validade: vide cartucho.
VENDA SOB PRESCRIÇÃO MÉDICA
Reg. MS – 1.0180. 0396
Responsável Técnico:
Dra. Elizabeth M. Oliveira
CRF-SP nº 12.529
Fabricado por:
Bristol-Myers Squibb Company
4601 Highway 62 East
Mount Vernon (Indiana) – Estados Unidos
Embalado por:
Bristol-Myers Squibb S.r.L
Loc. Fontana del Ceraso
Anagni (Frosinone) - Itália
Importado por:
Bristol-Myers Squibb Farmacêutica S.A.
Rua Carlos Gomes, 924 - Santo Amaro - São Paulo - SP
CNPJ 56.998.982/0001-07
ONGLYZA® é uma marca do grupo Bristol-Myers Squibb Company.
ONGLYZA - Laboratório
Bristol-Myers Squibb Filial Itapevi
Av. Portugal, 1100. Complemento: Unidade 4 - Módulo 2. Bairro: Itaqui
Itapevi/SP
- CEP: 06696-060
Tel: 0800 7276160
BMS Matriz
Rua Verbo Divino, 1.711 - 2º ao 5º andar
Bairro: Chácara Santo Antônio
Cidade: São Paulo
CEP: 04719-002
Ver outros medicamentos do laboratório "Bristol-Myers Squibb Filial Itapevi"