Jurnista TM
JANSSEN- CILAG FARMACÊUTICA LTDA.
Jurnista™
Informações ao Paciente
cloridrato de hidromorfona
IDENTIFICAÇÃO DO MEDICAMENTO
FORMAS FARMACÊUTICAS E APRESENTAÇÕES
Comprimidos revestidos de liberação prolongada de 8, 16 ou 32 mg em embalagens com 30 comprimidos.
USO ADULTO
USO ORAL
Informações Gerais
Marca Comercial: Jurnista™
Princípio Ativo: cloridrato de hidromorfona
Classe Terapêutica1: Analgésicos2
Composição
Jurnista™ 8 mg
Cada comprimido revestido de liberação prolongada contém 8 mg de cloridrato de hidromorfona.
Excipientes: acetato de celulose, butilidroxitolueno, cloreto de sódio, estearato de magnésio, hipromelose, macrogol 3350, Opadry® II vermelho (dióxido de titânio, hipromelose, lactose3 monoidratada, óxido férrico vermelho, triacetina), Opadry® incolor (hipromelose e macrogol), óxido ferroso preto/lactose3, polioxietileno, povidona.
Jurnista™ 16 mg
Cada comprimido revestido de liberação prolongada contém 16mg de cloridrato de hidromorfona.
Excipientes: acetato de celulose, butilidroxitolueno, cloreto de sódio, estearato de magnésio, hipromelose, macrogol 3350, Opadry® II amarelo (dióxido de titânio, hipromelose, lactose3 monoidratada, óxido férrico amarelo, triacetina), Opadry® incolor (hipromelose e macrogol), óxido ferroso preto/lactose3, polioxietileno, povidona.
Jurnista™ 32 mg
Cada comprimido revestido de liberação prolongada contém 32 mg de cloridrato de hidromorfona.
Excipientes: acetato de celulose, butilidroxitolueno, cloreto de sódio, estearato de magnésio, hipromelose, macrogol 3350, Opadry® II branco (dióxido de titânio, hipromelose, lactose3 monoidratada, triacetina), Opadry® incolor (hipromelose e macrogol), óxido ferroso preto/lactose3, óxido férrico amarelo, polioxietileno, povidona.
Como este medicamento funciona?
O cloridrato de hidromorfona, princípio ativo de Jurnista™, é um analgésico4 potente, pertencente ao grupo dos opióides.
Por que este medicamento foi indicado?
Jurnista™ é indicado para o tratamento da dor moderada à intensa.
Quando não devo usar este medicamento?
Contra-indicações
Jurnista™ não deve ser utilizado nos seguintes casos:
- se você tiver hipersensibilidade (alergia5) conhecida à hidromorfona ou a qualquer um dos componentes da fórmula;
- se você passou por cirurgia e/ou possui doença subjacente que possa resultar em estreitamento ou obstrução do canal alimentar ou pessoas portadoras de “alças cegas” no intestino;
- no tratamento da dor aguda ou após uma cirurgia;
- se você tiver asma6;
- em crianças;
- durante a gravidez7, trabalho de parto e parto.
Advertências
Os analgésicos2 opióides, como por exemplo a hidromorfona, podem causar queda da pressão arterial8 grave (pressão baixa) em um indivíduo cuja capacidade de manter a pressão arterial8 esteja comprometida por diminuição do volume do sangue9 ou uso combinado de medicamentos, tais como, as fenotiazinas ou os anestésicos gerais.
Jurnista™ não deve ser usado em situações de risco, como por exemplo, se você tiver ou durante o tratamento apresentar suspeita de íleo paralítico10 (interrupção temporária dos movimentos do sistema digestório11). Neste caso, o tratamento com Jurnista™ deve ser interrompido.
Disfunção respiratória (Problemas na respiração)
Em idosos, em pacientes debilitados e naqueles sofrendo de condições acompanhadas de alteração dos gases no sangue9 (hipóxia12 ou hipercapnia13), a diminuição dos movimentos da respiração pode ocorrer mais frequentemente com dose excessiva de medicamentos opióides, tais como a hidromorfona, e mesmo quando em doses moderadas podem deprimir a respiração de forma perigosa.
Informe ao seu médico se você tem problemas no pulmão14 (tais como: doença pulmonar crônica obstrutiva) ou dificuldade de respirar, pois nestes casos, Jurnista™, como todos os outros opióides, deve ser usado com extrema cautela. A dor intensa inibe os efeitos da dificuldade de respiração causados pelos opióides. No entanto, se a dor passar de repente, esses efeitos podem voltar rapidamente.
Se você irá passar por uma cirurgia ou será submetido a outras formas de bloqueio da dor, informe ao médico que você está tomando Jurnista™, pois o seu uso deve ser interrompido 24 horas antes do procedimento. O uso concomitante da hidromorfona com outros analgésicos2 opióides pode aumentar o risco de insuficiência respiratória15 (dificuldade para respirar). Portanto, é importante informar ao médico se você está fazendo uso de outros medicamentos para a dor, pois pode ser necessário diminuir a dose da hidromorfona quando outros analgésicos2 forem administrados concomitantemente.
Traumatismo16 craniano e pressão intracraniana aumentada (Problemas relacionados à traumas no crânio17 e aumento da pressão na cabeça18)
Os analgésicos2 (medicamento para dor) opióides produzem efeitos que podem mascarar os sinais19 neurológicos de aumentos adicionais da pressão na cabeça18 em pacientes com trauma nesta região. Neste caso, Jurnista™ só deve ser utilizado quando for considerado essencial e, então, deve-se usar com extrema cautela.
Trato gastrintestinal e outros músculos20 lisos (Problemas no aparelho digestório21)
Informe ao seu médico se você tiver qualquer problema no aparelho digestório21, pois a hidromorfona como outros opióides, pode diminuir os movimentos do trato gastrintestinal e ocasionar constipação22 que é um efeito colateral23 que ocorre com frequência durante o tratamento com medicamentos para a dor do tipo opióide, como por exemplo, a hidromorfona. O médico irá orientá-lo sobre as medidas para evitar a constipação22 e, se necessário, poderá indicar o uso de laxativos24, de forma preventiva. Informe ao médico se você sofre de constipação22 crônica.
O uso de medicamentos opióide, como por exemplo, a hidromorfona, pode disfarçar o diagnóstico25 ou o estado clínico de condições na região do abdômen.
Os comprimidos de Jurnista™ não se deformam e não sofrem alteração significante do formato no trato gastrintestinal. Tem havido relatos muito raros de sintomas26 de obstrução em pacientes com história de estenoses27 (estreitamentos em órgãos) em associação com a ingestão de medicamentos em formulações de liberação controlada que não se deformam (vide Contra-indicações).
Você poderá notar a presença de algo parecido com um comprimido em suas fezes. Não há motivo para preocupação, pois isso é apenas o revestimento do comprimido de Jurnista™ que não se dissolve e é eliminado nas fezes.
As condições clínicas ou os medicamentos que causam uma inesperada e significante redução do tempo do trânsito gastrintestinal podem resultar em uma diminuição da absorção da hidromorfona com Jurnista™ e podem potencialmente levar a sintomas26 de abstinência em pacientes com dependência física a opióides.
Dependência farmacológica
A dependência física é um estado de adaptação que se manifesta por uma síndrome28 de abstinência (conjunto de sinais19 e sintomas26 provocado pela falta ou suspensão de uso de determinadas substâncias), específica para opióides, que pode ser produzida pela interrupção abrupta, diminuição rápida da dose, diminuição do nível de medicamento no sangue9 e/ou uso de um medicamento inibidor.
Na abstinência de opióides ou síndrome28 de abstinência, podem ocorrer alguns ou todos os seguintes sintomas26: inquietação, lacrimejamento, corrimento nasal, bocejos, perspiração, calafrios29, ereção30 dos pêlos, dor muscular, pupilas dilatadas, irritabilidade, ansiedade, dor nas costas31, dor em articulações32, fraqueza, cólicas33 abdominais, insônia, náusea34, falta de apetite, vômito35, diarréia36 ou aumento da pressão arterial8 (pressão alta), aumento dos movimentos respiratórios ou dos batimentos do coração37.
Em geral, Jurnista™ não deve ser descontinuado de forma abrupta.
Jurnista™ deve ser usado com cautela em pacientes com alcoolismo e outras dependências farmacológicas devido à frequência aumentada de tolerância ao opióide e dependência psicológica observada nessas populações de pacientes. Com o uso abusivo por injeção38, os excipientes do comprimido podem causar complicações com risco de vida.
Você não deve fazer uso de bebidas alcoólicas durante o tratamento com Jurnista™ uma vez que o álcool aumenta o efeito sedativo da hidromorfona.
Jurnista™ contém lactose3. Se você tem problemas hereditários raros de intolerância à galactose39, deficiência de Lapp ou má-absorção de glicose40-galactose39 não devem fazer uso desse medicamento.
Atenção diabéticos: Este medicamento contém açúcar41, portanto, deve ser usado com cautela em portadores de diabetes42.
Atenção: Não use álcool durante o tratamento com Jurnista™.
Alergia5 ao sulfito
Jurnista™ pode conter metabisulfito de sódio, um sulfito que pode causar reações do tipo alérgica, incluindo sintomas26 anafiláticos e com risco de vida ou crises de asma6 menos graves em certas pessoas sensíveis. A prevalência43 geral de sensibilidade ao sulfito na população em geral é desconhecida e, provavelmente, baixa. A sensibilidade ao sulfito é observada com maior frequência em pessoas asmáticas que em não asmáticas.
Efeito sobre a capacidade de dirigir veículos e utilizar máquinas
Jurnista™ pode ter uma grande influência sobre a capacidade de dirigir e utilizar máquinas. Isso é mais provável ao início do tratamento, após um aumento da dose ou na troca de medicamento.
Durante o tratamento, você não deve dirigir veículos ou operar máquinas, pois sua habilidade e atenção podem estar prejudicadas
Pacientes idosos
Os idosos estão mais propensos aos efeitos adversos no Sistema Nervoso Central44 (confusão), transtornos gastrintestinais e diminuição da função dos rins45.Portanto, para pacientes46 idosos, recomenda-se cautela extra e a dose inicial deve ser diminuída. O uso combinado da hidromorfona com outros medicamentos, especialmente antidepressivos tricíclicos, aumenta o risco de confusão e de constipação22. Doenças da próstata47 e do trato urinário48 são observadas, em geral, nos idosos. Isso contribui para o risco aumentado de retenção da urina49. As considerações acima enfatizam a importância de se ter cautela ao contrário de implicar na restrição de opióides no idoso.
Uso em crianças e adolescentes
Jurnista™ não é recomendado para crianças e adolescentes com idade inferior a 18 anos, pois os dados de eficácia e segurança nessa população não são suficientes.
Uso em pacientes com doença do rim50 e do fígado51
Pacientes com doença moderada do rim50 ou do fígado51 devem iniciar o tratamento com uma dose reduzida e devem ser acompanhados de perto durante o tratamento. Em pacientes com doença grave do rim50, o médico poderá considerar um intervalo maior entre as doses de Jurnista™.
Pacientes sob risco especial
Jurnista™, da mesma forma que todos os analgésicos2 opióides, deve ser administrado com cautela e em dose reduzida em pacientes com doença do rim50 ou fígado51 moderada a grave, insuficiência52 adrenocortical, mixedema53, hipotireoidismo54, aumento da próstata47, estenose55 do ureter56, depressão do sistema nervoso central44, deformidade da coluna (cifoescoliose), psicose57 tóxica, alcoolismo agudo58, delirium tremens59 ou transtornos convulsivos.
Gravidez7 e Amamentação60
Jurnista™ não deve ser utilizado durante a gravidez7 e trabalho de parto devido ao prejuízo para a contração do útero61 e ao risco de causar diminuição da respiração no recém-nascido. Sintomas26 de abstinência podem ser observados em bebês62 de mães submetidas a tratamento crônico63.
Jurnista™ não deve ser utilizado durante a amamentação60.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica.
Interações Medicamentosas
Informe ao seu médico se você está fazendo uso de outros medicamentos ou recentemente tenha tomado outros medicamentos.
O uso combinado de Jurnista™ com medicamentos inibidores da monoamino oxidase (IMAOs) pode causar excitação ou depressão do Sistema Nervoso Central44 e hipotensão64 (pressão baixa) ou hipertensão65 (pressão alta), portanto, Jurnista™ não deve ser usado em combinação com esses medicamentos ou dentro de 14 dias após a interrupção de tal tratamento.
O uso combinado de hidromorfona com medicamentos agonistas/antagonistas da morfina (por exemplo: buprenorfina, nalbufina, pentazocina) pode levar a uma diminuição do efeito analgésico4, levando ao risco de sintomas26 de abstinência. Portanto, essa combinação não é recomendada.
O uso combinado de medicamentos que deprimem o sistema nervoso central44, tais como hipnóticos, sedativos, anestésicos gerais, antipsicóticos pode causar efeitos adicionais de depressão e diminuição dos movimentos respiratórios. Adicionalmente, queda da pressão arterial8 (pressâo baixa) e sedação66 profunda ou coma67 podem ocorrer. Quando essa combinação for indicada, o médico definirá a dose a ser usada.
Jurnista™, como outros medicamentos opióides, pode aumentar a ação de bloqueio neuromuscular de relaxantes musculares e causar um grau aumentado de depressão respiratória (dificuldade de respirar).
Você não deve fazer uso de bebidas alcoólicas durante o tratamento com Jurnista™, pois o álcool aumenta o efeito sedativo da hidromorfona.
Jurnista™ não é recomendado para crianças e adolescentes com idade inferior a 18 anos.
Informe ao médico o aparecimento de reações indesejáveis.
Informe ao seu médico se você está fazendo uso de algum outro medicamento.
Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde68.
Como devo usar este medicamento?
Aspecto Físico
Os comprimidos de Jurnista™ têm três concentrações diferentes do princípio ativo, que podem ser identificadas pela cor: 8mg = comprimidos vermelhos, 16mg = comprimidos amarelos, 32mg = comprimidos brancos.
Jurnista™ não deve ser administrado mais que uma vez a cada 24 horas.
Se o paciente não tomou regularmente a dose de Jurnista™, o paciente deve ser instruído para tomar imediatamente a próxima dose e começar um novo regime de 24 horas.
Como usar
Os comprimidos de Jurnista™ devem ser tomados uma vez ao dia com um copo de água e não devem ser mastigados, partidos ou triturados. Procure tomar os comprimidos aproximadamente na mesma hora do dia.
Dosagem
Como para outros analgésicos2 opióides, a administração segura e eficaz de Jurnista™ a pacientes com dor depende de uma avaliação completa do paciente que será feita pelo médico. A natureza da dor, assim como o estado clínico concomitante do paciente, irão influenciar a seleção da dose. O tratamento será iniciado com uma dose pequena e o médico ajustará a dose até obter um alívio adequado da dor.
Como para qualquer opióide potente, a prevenção apropriada para reações adversas conhecidas (por exemplo: constipação22) deve ser considerada.
Pacientes que não estão recebendo opióides
A dose inicial de Jurnista™ em pacientes que não estão recebendo opióides regularmente não deve exceder 8 mg a cada 24 horas. A dose deve ser titulada para cima, se necessário, com aumentos de 8 mg dependendo da resposta e da necessidade de analgésico4 suplementar. A dose não deve ser titulada com frequência maior que cada 2 dias.
Pacientes que estão recebendo opióides regularmente
Em pacientes que já estão recebendo analgésicos2 opióides, a dose inicial de Jurnista™ deve ser baseada na dose diária do opióide em uso, usando o cálculo69 para obter analgesia equivalente.
Devido às diferenças individuais do paciente e de cada formulação, a conversão para a dose inicial recomendada de Jurnista™, seguida pelo monitoramento cuidadoso do paciente, e os ajustes da dose devem ser realizados pelo médico.
As doses devem ser arredondadas para baixo, para a dose mais próxima de Jurnista™ disponível em aumentos de 8 mg (comprimidos de 8, 16, 32 mg), conforme clinicamente indicado.
Ao iniciar a terapia com Jurnista™, suspender o uso todas as outras medicações analgésicas opióides em 24 horas (forma contínua).
Jurnista™ também pode ser utilizado com segurança com doses usuais de analgésicos2 não-opióides e adjuvantes de analgésicos2.
Individualização da dose e terapia de manutenção
Após o início da terapia com Jurnista™, ajustes da dose podem ser necessários para obter o melhor equilíbrio do paciente entre o alívio da dor e as reações adversas relacionadas ao opióide.
Se a dor aumentar ou se o alívio da dor não for adequado, um aumento gradual da dose pode ser necessário. A fim de permitir que ocorra a estabilização dos efeitos da mudança da dose, o aumento deve ser realizado não mais frequentemente que a cada dois dias e sob orientação do médico.
Uso em idosos
O cenário médico do idoso é, em geral, complexo. Portanto, o tratamento com Jurnista™ deve ser iniciado com cautela e com uma dose inicial reduzida.
Doença do rim50 e do fígado51
Em pacientes com doença moderada do rim50 ou do fígado51, o tratamento deve ser iniciado com uma dose reduzida e eles devem ser acompanhados de perto durante o ajuste da dose. Em pacientes com doença grave do rim50, o médico pode aumentar o intervalo entre as administrações e esses pacientes devem ser acompanhados, também, durante a terapia de manutenção para o desenvolvimento de reações adversas relacionadas aos opióides.
Interrupção do tratamento
Em pacientes que são fisicamente dependentes de opióides e que recebem a hidromorfona diariamente, a descontinuação abrupta do tratamento com Jurnista™ resultará em sintomas26 de síndrome28 de abstinência. Portanto, se a interrupção do tratamento for indicada, a dose de Jurnista™ deve ser reduzida pela metade a cada dois dias, até atingir a menor dose possível, período no qual a terapia pode ser interrompida com segurança. Se aparecerem sintomas26 de abstinência, a redução da dose deve ser interrompida. A dose deve ser ligeiramente aumentada até o desaparecimento dos sinais19 e sintomas26 de abstinência de opióides. Então, a redução da dose deve ser iniciada novamente, mas com intervalos mais longos entre cada redução da dose de Jurnista™ ou antes de converter para uma dose equianalgésica de outro opióide para continuar a redução da dose.
Dose omitida
Assim que o paciente perceber que esqueceu de tomar o medicamento, deverá tomar a próxima dose e iniciar um novo ritmo de tomada com duração de 24 horas a partir do novo horário em diante.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento.
Não interrompa o tratamento sem o conhecimento de seu médico.
Não use o medicamento com o prazo de validade vencido. Antes de usar, observe o aspecto do medicamento.
Esse medicamento não pode ser partido ou mastigado.
Quais males que este medicamento pode causar?
Eventos adversos
As reações adversas a seguir foram identificadas com base nos dados de segurança de 12 estudos, envolvendo um total de 1684 pacientes tratados com Jurnista™. As reações adversas mais comuns relacionadas à Jurnista™ foram eventos gastrintestinais (constipação22, náusea34 e vômito35) e eventos do sistema nervoso70 (sonolência, dor de cabeça18 e tontura71) relacionados a opióides.
A diminuição dos movimentos respiratórios pode ser mais provável em certos subgrupos de pacientes (vide Advertências).
Infecções72 e infestações: gastroenterite73 (0,95%), diverticulite74 (0,30%).
Transtorno endócrino75: hipogonadismo (0,06%).
Transtornos do metabolismo76 e nutricional: anorexia77 (6,0%), desidratação78 (1,96%), retenção de líquidos (0,36%), apetite aumentado (0,36%), aumento de ácido úrico no sangue9 (0,12%).
Transtornos psiquiátricos: insônia (8,19%), ansiedade (4,69%), depressão (4,22%), estado de confusão (3,33%), nervosismo (2,08%), sonhos anormais (1,72%), inquietação (1,72%), alucinação79 (1,13%), humor alterado (1,13%), libido80 reduzida (0,95%), ataque de pânico (0,42%), euforia (0,18%), apatia81 (0,18%), paranóia (0,18%), agressão (0,12%), choro (0,12%), desconforto (0,06%).
Transtornos do sistema nervoso70: sonolência (18,11%), dor de cabeça18 (16,03%), tontura71 (12,71%), diminuição da sensibilidade (2,20%), dormência82 ou formigamento (2,08%), tremor (2,02%), sedação66 (1,60%), memória prejudicada (1,54%), distúrbio da atenção (1,13%), alteração do paladar83 (1,01%), distúrbio da fala (0,71%), síncope84 (0,71%), distúrbio do equilíbrio (0,48%), coordenação anormal (0,48%), depressão do nível de consciência (0,48%), aumento da sensibilidade (0,30%), discinesia (0,24%), contração muscular (0,24%), encefalopatia85 (0,18%), distúrbio cognitivo86 (0,12%), hiperatividade psicomotora87 (0,12%), ataques/convulsões (0,12%), exacerbação dos reflexos (0,06%).
Transtorno da visão88: visão88 borrada (2,14%), visão88 dupla (0,36%), olho89 seco (0,24%), pupilas contraídas (0,06%).
Transtorno do ouvido e do labirinto90: vertigem91 (1,19%), tinido (0,83%).
Transtornos cardíacos: aumento dos batimentos do coração37 (1,13%), palpitações92 (0,83%), extrasístoles (0,18%), diminuição dos batimentos cardíacos (0,06%).
Transtornos vasculares93: rubor (2,14%), pressão alta (2,08%) ou pressão baixa (0,59%).
Transtornos respiratório, torácico e do mediastino94: dispnéia95 (3,56%), corrimento nasal (0,53%), diminuição do oxigênio no sangue9 ou tecidos (0,36%), angústia respiratória (0,36%), broncoespasmo96 (0,24%), hiperventilação (0,12%), espirros (0,12%), diminuição dos movimentos respiratórios (0,06%).
Transtornos gastrintestinais: constipação22 (33,02%), náusea34 (30,88%), vômito35 (15,56%), diarréia36 (8,49%), dor abdominal (7,01%), boca97 seca (5,52%), dispepsia98 (3,08%), dificuldade para engolir (1,07%), flatulência (1,01%), fezes sanguinolentas (0,83%), distensão abdominal (0,53%), hemorróidas99 (0,48%), fezes anormais (0,36%), obstrução intestinal (0,30%), divertículo100 (0,18%), eructação101 (0,18%), alteração dos movimentos gastrintestinais (0,18%), perfuração de intestino grosso102 (0,12%), fissura103 anal (0,06%), formação de bolo de alimento no canal alimentar (0,06%), inflamação104 do duodeno105 (0,06%), íleo106 (0,06%), esvaziamento gástrico alterado (0,06%), defecação dolorosa (0,06%).
Transtorno da pele107 e de tecido subcutâneo108: coceira (9,14%), suor excessivo (7,19%), rash109 ou vermelhidão (3,86%), eritema110 (0,53%).
Transtornos musculoesquelético e de tecido conjuntivo111: espasmos112 musculares (4,51%), dor nas costas31 (4,39%), dor nas articulações32 (4,16%), dor em extremidade (3,27%), dor muscular (0,89%).
Transtorno renal113 e urinário: dificuldade para urinar (1,37%), retenção urinária114 (1,01%), aumento da frequência de micção115 (0,89%), hesitação urinária (0,89%), distúrbio da micção115 (0,48%).
Transtornos do sistema reprodutor e das mamas116: disfunção erétil (0,71%), disfunção sexual (0,24%).
Transtornos gerais e condições do local de aplicação: astenia117 (11,70%), inchaço118 (7,78%), febre119 (3,33%), dor (2,91%), desconforto torácico (2,73%), calafrios29 (1,48%), síndrome28 de abstinência (1,13%), mal-estar (0,77%), sensação anormal (0,48%), inquietude (0,42%), dificuldade para caminhar (0,24%), ressaca (0,12%), sentir-se bêbado (0,06%), sentir calor e frio (0,06%), diminuição da temperatura (0,06%).
Exames: redução do peso (1,48%) e diminuição da saturação de oxigênio (0,65%), diminuição do potássio sanguíneo (0,36%), aumento das enzimas hepáticas120 (0,36%), aumento da amilase sanguínea (0,12%) e diminuição da testosterona sanguínea (0,06%).
Trauma, envenenamento e complicações de procedimento: queda (2,73%), contusão121 (1,72%), superdose (0,42%).
Atenção: esse é um medicamento novo e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis para comercialização, efeitos indesejáveis não conhecidos podem ocorrer. Neste caso, informe seu médico.
O que fazer se alguém usar uma grande quantidade desde medicamento de uma sí vez?
Se você ingeriu acidentalmente uma dose excessiva de Jurnista™, procure o médico imediatamente.
Sintomas26
Os possíveis sintomas26 de uma dose excessiva são: diminuição dos movimentos respiratórios, sonolência que progride para estupor e coma67, flacidez dos músculos20, pele107 fria, pupilas contraídas e, as vezes, aumento dos batimentos cardíacos e queda da pressão arterial8 (pressão baixa).
Tratamento
No tratamento da dose excessiva, a atenção primária deve ser para o restabelecimento de troca respiratória adequada, mantendo as vias aéreas desobstruídas e instituindo ventilação122 assistida ou controlada. Se a ingestão oral foi recente, o conteúdo gátrico deve ser esvaziado através de lavagem gástrica123, como indicado.
Medidas de suporte (incluindo oxigênio e vasoconstritores), devem ser usadas para controlar o choque124 e o edema pulmonar125 que potencialmente acompanham a dose excessiva. Parada cardíaca e arritmias126 podem exigir massagem cardíaca ou desfibrilação.
Onde e como devo guardar este medicamento?
Jurnista™ deve ser guardado em temperatura ambiente (15°C-30°C).
TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS.
Informações Técnicas aos Profissionais de Saúde68
cloridrato de hidromorfona
IDENTIFICAÇÃO DO MEDICAMENTO
FORMAS FARMACÊUTICAS E APRESENTAÇÕES
Comprimidos revestidos de liberação prolongada de 8, 16 ou 32 mg em embalagens com 30 comprimidos.
USO ADULTO
USO ORAL
Informações Gerais
Marca Comercial: Jurnista™
Princípio Ativo: cloridrato de hidromorfona
Classe Terapêutica1: Analgésicos2
Composição
Jurnista™ 8 mg
Cada comprimido revestido de liberação prolongada contém 8 mg de cloridrato de hidromorfona.
Excipientes: acetato de celulose, butilidroxitolueno, cloreto de sódio, estearato de magnésio, hipromelose, macrogol 3350, Opadry® II vermelho (dióxido de titânio, hipromelose, lactose3 monoidratada, óxido férrico vermelho, triacetina), Opadry® incolor (hipromelose e macrogol), óxido ferroso preto/lactose3, polioxietileno, povidona.
Jurnista™ 16 mg
Cada comprimido revestido de liberação prolongada contém 16mg de cloridrato de hidromorfona.
Excipientes: acetato de celulose, butilidroxitolueno, cloreto de sódio, estearato de magnésio, hipromelose, macrogol 3350, Opadry® II amarelo (dióxido de titânio, hipromelose, lactose3 monoidratada, óxido férrico amarelo, triacetina), Opadry® incolor (hipromelose e macrogol), óxido ferroso preto/lactose3, polioxietileno, povidona.
Jurnista™ 32 mg
Cada comprimido revestido de liberação prolongada contém 32 mg de cloridrato de hidromorfona.
Excipientes: acetato de celulose, butilidroxitolueno, cloreto de sódio, estearato de magnésio, hipromelose, macrogol 3350, Opadry® II branco (dióxido de titânio, hipromelose, lactose3 monoidratada, triacetina), Opadry® incolor (hipromelose e macrogol), óxido ferroso preto/lactose3, óxido férrico amarelo, polioxietileno, povidona.
Caracterêsticas Farmacolígicas
Propriedades Farmacodinâmicas
A hidromorfona é um derivado semi-sintético da morfina. Como todos os analgésicos2 opióides, a hidromorfona exerce os seus principais efeitos farmacológicos sobre o SNC127 e o músculo liso128, incluindo o trato gastrintestinal. Esses efeitos são expressos e modulados pela ligação a receptores de opióide específicos. A hidromorfona é, principalmente, um agonista129 de receptores u, mostrando uma afinidade fraca para receptores k. A analgesia ocorre como uma consequência da ligação da hidromorfona aos receptores u do SNC127. Embora as estimativas sejam variáveis (de 2 a 10 vezes), a hidromorfona parece ser aproximadamente 5 vezes tão potente (por peso) quanto a morfina. A depressão respiratória ocorre principalmente por ação direta sobre os centros de controle da respiração no cérebro130. Os opióides podem causar náusea34 e vômito35 devido ao estímulo direto dos quimiorreceptores para a emese131 na área posterior da medula132.
Propriedades Farmacocinéticas
Após a administração de dose oral única de Jurnista™ sob a forma de comprimidos de liberação prolongada (OROS® Push-Pull™, tecnologia desenvolvida pela Alza Corporation), as concentrações plasmáticas aumentam gradualmente por 6 a 8 horas e, depois disso, as concentrações são mantidas por aproximadamente 18 a 24 horas após a administração; os valores médios de Tmáx foram aproximadamente 13 a 16 horas. Isso demonstra que, como pretendido, a hidromorfona é liberada de forma controlada, compatível com a administração uma vez ao dia. A biodisponibilidade absoluta média da hidromorfona após uma dose única de 8, 16 ou 32 mg de Jurnista™ variou de 22% a 26%. A administração concomitante de Jurnista™ com uma refeição muito gordurosa não interfere na absorção da hidromorfona.
As concentrações plasmáticas do estado de equilíbrio são aproximadamente o dobro daquelas observadas após a primeira dose e o estado de equilíbrio é alcançado até a quarta dose de Jurnista™. Não foi observada alteração dependente do tempo na farmacocinética com a administração de doses múltiplas. No estado de equilíbrio, Jurnista™, administrado uma vez ao dia, manteve as concentrações plasmáticas de hidromorfona dentro da mesma faixa de concentração do comprimido de liberação imediata administrado quatro vezes ao dia, na mesma dose total diária e diminui as flutuações periódicas nos níveis plasmáticos observadas com o comprimido de liberação imediata. O grau de flutuação na concentração plasmática do estado de equilíbrio durante o período de 24 horas (calculado como (Cmáx(ss) – Cmín(ss)/Cavg(ss) x 100%) foi menor com Jurnista™ (83%) em comparação às flutuações gerais do comprimido de liberação imediata (147%). (Figura 1). No estado de equilíbrio, a AUC133 da hidromorfona para Jurnista™ é equivalente àquela observada para o comprimido de liberação imediata.
Figura 1: Perfil de Concentração Plasmática no estado de equilíbrio (n=18 indivíduos saudáveis com bloqueio por naltrexona).
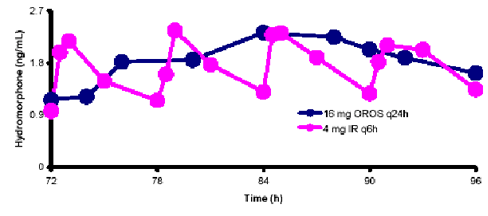
A ligação à proteína plasmática é baixa (<30%). A glicuronidação é a principal via de biotransformação e o principal metabólito134 é a hidromorfona 3-glicuronídeo inativo, que segue um curso de tempo similar ao da hidromorfona no plasma135. Ao contrário da morfina, não é produzido nenhum metabólito134 ativo 6-glicuronídeo. Farmacocinética linear foi demonstrada para o comprimido de liberação prolongada na faixa de dose de 4 a 64 mg, com aumentos proporcionais à dose nas concentrações plasmáticas (Cmáx) e exposição geral (AUC133).
O efeito da idade sobre a farmacocinética de dose única da hidromorfona de liberação imediata resultou em uma redução de 14% na Cmáx e um aumento modesto (11%) na AUC133 no idoso em comparação ao jovem. Nenhuma diferença foi observada na Tmáx. Uma maior sensibilidade em indivíduos mais velhos não pode ser excluída. Em geral, a seleção da dose para um paciente idoso deve ser cautelosa, iniciando com o limite inferior do intervalo posológico, refletindo a maior frequência de diminuição das funções hepática136, renal113 e cardíaca e de doença concomitante ou outro tratamento medicamentoso nessa população.
As concentrações plasmáticas de hidromorfona e os parâmetros farmacocinéticos após a administração de Jurnista™ são comparáveis em homens e mulheres.
Em estudos que usaram a administração oral única de comprimidos convencionais (liberação imediata), a insuficiência hepática137 reduziu o metabolismo76 de primeira passagem da hidromorfona, de forma que são observados níveis plasmáticos de hidromorfona quatro vezes maiores em pacientes com insuficiência hepática137 moderada. A insuficiência renal138 afetou a farmacocinética da hidromorfona e de seu metabólito134 hidromorfona 3-glicuronídeo após a administração de um comprimido de liberação imediata. Os efeitos da insuficiência renal138 sobre a farmacocinética da hidromorfona são refletidos por aumentos de duas e quatro vezes na biodisponibilidade da hidromorfona na insuficiência52 moderada e grave, respectivamente. Houve, também, alterações substanciais na cinética139 de eliminação da hidromorfona 3-glicuronídeo para o grupo com insuficiência52 grave, embora a hemodiálise140 tenha sido eficaz na redução dos níveis plasmáticos tanto da hidromorfona como de seus metabólitos141. Vide o item Posologia para as recomendações de dose.
Em um estudo que avaliou a absorção da hidromorfona de Jurnista™, quando administrado com 240 mL de álcool 4%, 20% e 40%, a Cmáx aumentou em média 17, 31 e 28%, respectivamente em jejum, e foi menos afetada no condição pós-prandial com aumento de 14, 14 e 10%, respectivamente. A mediana da Tmáx (jejum e pós-prandial) com 4, 20 e 40% de álcool foi 12 a 16 horas e com 0% de álcool foi 16 horas. Nenhum efeito foi observado nos valores de AUC133, tanto em jejum como na condição pós-prandial. O uso concomitante de bebidas alcoólicas deve ser evitado (vide Advertências). Devido à tecnologia OROS® no Jurnista™, as propriedades de liberação prolongada do Jurnista™ são mantidas na presença de álcool. Para as interações farmacodinâmicas, veja o item Advertências.
Dados de segurança pré-clinica
Os dados de estudos pré-clínicos não revelaram riscos da administração oral de hidromorfona para os seres humanos com base em estudos convencionais de segurança de farmacologia142, toxicidade143 de doses múltiplas, genotoxicidade e fertilidade. Os principais efeitos estão relacionados às atividades farmacológicas dos opióides sobre o SNC127 e o trato gastrintestinal, incluindo aumentos relacionados à dose na sedação66, hiperatividade, morte súbita, perda de peso e redução no consumo de ração. No rato, uma redução leve, mas estatisticamente significante nas implantações foi observada com 6,25 mg/kg/dia, um nível de dose que produziu toxicidade143 materna durante o período de acasalamento. A exposição plasmática (AUC133) à hidromorfona nesse nível de dose foi 135 ng•h/mL, fornecendo um fator de segurança de cerca de 1,5 sobre a exposição em seres humanos (AUC133), com base na mediana da dose diária. A viabilidade neonatal e a sobrevivência144 foram reduzidas em ratos antes do desmame com a dose oral materna diária de 6,25 mg/kg. O último parece ser um efeito de classe de um analgésico4 opióide.
Resultados de Eficácia
Os resultados de 4 estudos de fase 3 sobre eficácia e segurança sustentam a eficácia de Jurnista™ para o tratamento da dor moderada a severa. Em um estudo envolvendo 200 pacientes com câncer145, Jurnista™ administrado uma vez ao dia mostrou ser um analgésico4 equivalente a morfina SR administrada duas vezes ao dia. A morfina é o tratamento padrão em muitos países. Em um segundo estudo de 6 semanas envolvendo 138 pacientes com osteoartrite146, Jurnista™ demonstrou ser comparável (escalas de intensidade e alívio da dor) ao cloridrato de oxicodona administrado 2 vezes ao dia. Este estudo é particularmente relevante considerando-se que refletiu a prática clínica, em que os pacientes com osteoartrite146 estudados eram não-virgens de opióides, e foram tratados com Jurnista™ 8 mg ou cloridrato de oxicodona 10 mg administrado duas vezes ao dia. Os pacientes foram escalonados até a dose mais eficaz utilizando um algoritmo recomendado e flexível de escalonamento da dose.
Estudos de suporte sobre eficácia e segurança
Quatro estudos de suporte forneceram evidências sobre eficácia e segurança de Jurnista™. Nestes estudos, a conversão de outros medicamentos opióides para Jurnista™ baseada na disposição do paciente durante a fase de titulação sugere que o algoritmo de conversão predominante utilizado (5:1) foi razoável para a maioria dos pacientes. Nestes estudos, 72 a 78% dos pacientes tratados completaram a fase de titulação.
Estudos de segurança de longo prazo
Três estudos de segurança de longo prazo foram conduzidos com Jurnista™. Destes, um estudo de extensão de longo prazo com 388 pacientes mostrou alívio moderado da dor por até 21 meses em pacientes com dor oncológica ou dor crônica não-maligna.
Em resumo, Jurnista™ 16mg é um analgésico4 efetivo, sendo esta observação feita em um estudo controlado por placebo147 envolvendo pacientes com osteoartrite146. Jurnista™ em doses 16mg também apresentou analgesia comparável a hidromorfona IR administrada a cada 4 horas, cloridrato de oxicodona duas vezes ao dia e morfina administrada duas vezes ao dia em pacientes com dor crônica. O fator de conversão 5:1 para morfina:hidromorfona proveu um alívio adequado da dor para pacientes46 que faziam uso de de outros opióides. Jurnista™ manteve o alívio moderado da dor por até 21 meses em um estudo de extensão a longo prazo.
Indicações
Jurnista™ é indicado para o tratamento da dor moderada a intensa em pacientes que necessitam de analgesia contínua.
Contra Indicações
Jurnista™ é contra-indicado:
- em pacientes com hipersensibilidade conhecida à hidromorfona ou a qualquer um dos componentes da fórmula,
- em pacientes submetidos a procedimento cirúrgico e/ou com doença subjacente que poderia resultar em estenose55 do trato gastrintestinal ou portadores de “alças cegas” do trato gastrintestinal ou obstrução gastrintestinal,
- no tratamento da dor aguda ou pós-operatória,
- em pacientes com estado asmático,
- em crianças,
- durante a gestação, trabalho de parto e parto.
Modo de usar e cuidados de conservação depois de aberto
Os pacientes devem ser instruídos para deglutir148 o comprimido de Jurnista™ inteiro, com um copo de água, aproximadamente na mesma hora do dia e nunca mastigar, dividir ou esmagar os comprimidos.
Jurnista™ não deve ser administrado mais que uma vez a cada 24 horas.
Se o paciente não tomou regularmente a dose de Jurnista™, o paciente deve ser instruído para tomar imediatamente a próxima dose e começar um novo regime de 24 horas.
Posologia
Administração oral
Como para outros analgésicos2 opióides, a administração segura e eficaz de Jurnista™ a pacientes com dor depende de uma avaliação completa do paciente. A natureza da dor, assim como o estado clínico concomitante do paciente, irão influenciar a seleção da dose. Devido à resposta individual variada aos opióides, recomenda-se que todos os pacientes iniciem o tratamento com a menor dose de opióide e que a dose seja titulada para um nível adequado de analgesia, em equilíbrio com uma frequência aceitável de reações adversas.
Como para qualquer opióide potente, a profilaxia apropriada para reações adversas conhecidas (por exemplo, constipação22) deve ser considerada.
Pacientes que não estão recebendo opióides regularmente
A dose inicial de Jurnista™ em pacientes que não estão recebendo opióides regularmente não deve exceder 8 mg a cada 24 horas. A dose deve ser titulada para cima, se necessário, com aumentos de 8 mg dependendo da resposta e da necessidade de analgésico4 suplementar. A dose não deve ser titulada com frequência maior que cada 2 dias
Uma vez que pode ser mais demorado realizar a titulação da dose do paciente para obter analgesia adequada com um comprimido de opióide de liberação prolongada, é recomendável iniciar o tratamento com preparações convencionais de liberação imediata (por exemplo, hidromorfona de liberação imediata ou morfina de liberação imediata) e depois fazer a conversão para a dose diária total de Jurnista™. Usar a tabela de conversão fornecida abaixo para calcular as doses de conversão (Tabela 1).
Pacientes que estão recebendo opióides regularmente
Em pacientes que já estão recebendo analgésicos2 opióides, a dose inicial de Jurnista™ deve ser baseada na dose diária do opióide em uso, usando razões-padrão de equianalgesia. Para opióides exceto a morfina, estimar primeiro a dose diária total equivalente de morfina e depois usar a Tabela 1 para determinar a dose diária total equivalente de Jurnista™.
Tabela 1: Fatores de multiplicação para a conversão da dose diária dos opióides em uso para a dose diária de Jurnista™ (mg/dia opióide em uso x Fator = mg/dia de Jurnista™)
| Opióide em uso | Opióide oral em uso
(Fator) | Opióide parenteral em uso (Fator) |
| morfina
hidromorfona | 0,2
1 | 0,6
4 |
As doses devem ser arredondadas para baixo, para a dose mais próxima de Jurnista™ disponível em incrementos de 8 mg (comprimidos de 8, 16, 32 mg), conforme clinicamente indicado.
Ao iniciar a terapia com Jurnista™, suspender o uso de todas as outras medicações analgésicas opióides em 24 horas, de forma contínua.
Jurnista™ também pode ser utilizado com segurança com doses usuais de analgésicos2 não-opióides e adjuvantes de analgésicos2.
Individualização da dose e terapia de manutenção
Após o início da terapia com Jurnista™, ajustes da dose podem ser necessários para obter o melhor equilíbrio do paciente entre o alívio da dor e as reações adversas relacionadas ao opióide.
Se a dor aumentar ou se a analgesia for inadequada, um aumento gradual da dose pode ser necessário. A fim de permitir que ocorra a estabilização dos efeitos da mudança da dose, o aumento deve ser realizado não mais frequentemente que a cada dois dias. Como orientação, aumentos de 25-100% da dose diária total atual de Jurnista™ devem ser considerados para cada etapa de titulação.
Uma vez que o paciente esteja estabilizado na terapia com Jurnista™ uma vez ao dia, a dose pode ser mantida durante o tempo que o alívio da dor for necessário. A necessidade continuada para terapia opióide ao longo do dia ou ajustes da terapia devem ser reavaliados periodicamente, conforme apropriado.
Uso em crianças e adolescentes
Jurnista™ não é recomendado para crianças e adolescentes com idade inferior a 18 anos, pois os dados de eficácia e segurança nessa população não são suficientes.
Uso em idosos
O conjunto médico do idoso é, em geral, complexo. Portanto, o tratamento com Jurnista™ deve ser iniciado com cautela e com uma dose inicial reduzida.
Insuficiência renal138 e hepática136
Após a administração de dose única de comprimidos de hidromorfona de liberação imediata, os seguintes resultados foram observados em estudos clínicos iniciais:
• Em pacientes com insuficiência hepática137 moderada (escore de 7-9 na escala de Child-Pugh), a exposição (AUC133 plasmática) e as concentrações de pico plasmático de hidromorfona foram aproximadamente 4 vezes maiores em comparação com controles saudáveis e a meia-vida de eliminação não se alterou.
• Em pacientes com insuficiência renal138 moderada (depuração de creatinina149 de 40-60 mL/min), a exposição (AUC133 plasmática) à hidromorfona foi aproximadamente 2 vezes maior que naqueles com função renal113 normal e a meia-vida de eliminação não se alterou.
• Em pacientes com insuficiência renal138 grave (depuração de creatinina149 < 30 mL/min), a exposição (AUC133 plasmática) à hidromorfona foi aproximadamente 4 vezes maior que naqueles com função renal113 normal e meia-vida de eliminação 3 vezes mais longa.
Portanto, em pacientes com insuficiência renal138 ou hepática136 moderada, a terapia deve ser iniciada com uma dose reduzida e eles devem ser monitorados de perto durante a titulação da dose. Em pacientes com insuficiência renal138 grave, um aumento do intervalo entre as administrações também deve ser considerado e esses pacientes devem ser monitorados, também, durante a terapia de manutenção para o desenvolvimento de reações adversas relacionadas aos opióides.
Interrupção do tratamento
Em pacientes que são fisicamente dependentes de opióides e que recebem a hidromorfona diariamente, a descontinuação abrupta do tratamento com Jurnista™ resultará em sintomas26 de síndrome28 de abstinência. Portanto, se a interrupção do tratamento for indicada, a dose de Jurnista™ deve ser reduzida em 50% a cada dois dias, até atingir a menor dose possível, período no qual a terapia pode ser interrompida com segurança. Se aparecerem sintomas26 de abstinência, a redução da dose deve ser interrompida. A dose deve ser ligeiramente aumentada até o desaparecimento dos sinais19 e sintomas26 de abstinência de opióides. Então, a redução da dose deve ser iniciada novamente, mas com intervalos mais longos entre cada redução da dose de Jurnista™ ou antes de converter para uma dose equianalgésica de outro opióide para continuar a redução da dose.
Dose omitida
Assim que o paciente perceber que esqueceu de tomar o medicamento, deverá tomar a próxima dose e iniciar um novo ritmo de tomada com duração de 24 horas a partir do novo horário em diante.
Advertências
Os analgésicos2 opióides, incluindo a hidromorfona, podem causar hipotensão64 grave em um indivíduo cuja capacidade de manter a pressão arterial8 esteja comprometida por depleção150 do volume sanguíneo ou administração concomitante de fármacos tais como as fenotiazinas ou os anestésicos gerais.
Jurnista™ não deve se usado em situações de risco para íleo paralítico10. Se durante o tratamento houver suspeita de íleo paralítico10, o tratamento com Jurnista™ deve ser interrompido.
Disfunção respiratória
A depressão respiratória é o prejuízo mais importante das preparações de opióides e ocorre mais frequentemente com dose excessiva, em idosos, em pacientes debilitados e naqueles sofrendo de condições acompanhadas de hipóxia12 ou hipercapnia13, quando mesmo doses moderadas podem deprimir a respiração de forma perigosa. Jurnista™, como todos os outros opióides, deve ser usado com extrema cautela em pacientes com reserva respiratória substancialmente reduzida ou depressão respiratória preexistente e em pacientes com doença pulmonar obstrutiva crônica. A dor intensa antagoniza os efeitos depressores respiratórios dos opióides. No entanto, se a dor passar de repente, esses efeitos podem se manifestar rapidamente. Os pacientes que serão submetidos a procedimentos de anestesia151 regional ou outras interrupções das vias de transmissão da dor não devem receber Jurnista™ dentro de 24 horas do procedimento. A administração concomitante da hidromorfona com outros analgésicos2 opióides está associada com um risco aumentado de insuficiência respiratória15. Portanto, é importante reduzir a dose da hidromorfona quando outros analgésicos2 forem administrados concomitantemente.
Traumatismo16 craniano e pressão intracraniana aumentada
Os efeitos depressores da respiração dos opióides, com retenção de dióxido de carbono e elevação secundária da pressão do líquido cerebroespinhal podem ser exacerbados de forma acentuada na presença de traumatismo16 craniano ou pressão intracraniana elevada. Os opióides produzem efeitos que podem mascarar os sinais19 neurológicos de aumentos adicionais da pressão intracraniana em pacientes com traumatismo16 craniano. Jurnista™ só deve ser administrado nessas circunstâncias quando for considerado essencial e, então, com extrema cautela.
Trato gastrintestinal e outros músculos20 lisos
Como outros opióides, a hidromorfona causa uma redução na motilidade do trato gastrintestinal associada com um aumento no tônus do músculo liso128. Consequentemente, a constipação22 é um efeito colateral23 frequente relatado durante o tratamento com opióides. Os pacientes devem ser orientados sobre as medidas para evitar a constipação22 e o uso profilático de laxativos24 deve ser considerado. Cautela extra deve ser exercida em pacientes com constipação22 crônica.
A administração de opióides pode mascarar o diagnóstico25 ou o curso clínico de condições abdominais. Portanto, é importante certificar-se de que o paciente não está sofrendo de oclusão intestinal, especialmente do íleo106, antes de iniciar o tratamento. A hidromorfona também pode causar um aumento na pressão do trato biliar152 como resultado do espasmo153 do esfincter de Oddi154. Portanto, cautela deve ser exercida na administração de Jurnista™ a pacientes com doenças inflamatórias ou obstrutivas do intestino, pancreatite155 aguda secundária à doença do trato biliar152 e em pacientes que serão submetidos à cirurgia do trato biliar152.
Os comprimidos de Jurnista™ não se deformam e não sofrem alteração significante do formato no trato gastrintestinal. Tem havido relatos muito raros de sintomas26 de obstrução em pacientes com história de estenoses27 em associação com a ingestão de medicamentos em formulações de liberação controlada que não se deformam (vide Contra-indicações).
Os pacientes devem ser orientados para não se alarmarem caso notem algo parecido com um comprimido de Jurnista™ em suas fezes, pois isso é apenas o revestimento do comprimido que não se dissolve.
As condições clínicas ou os medicamentos que causam uma inesperada e significante redução do tempo do trânsito gastrintestinal podem resultar em uma diminuição da absorção da hidromorfona com Jurnista™ e podem potencialmente levar a sintomas26 de abstinência em pacientes com dependência física a opióides.
Dependência farmacológica
A dependência física é um estado de adaptação que se manifesta por uma síndrome28 de abstinência específica de opióides que pode ser produzida pela interrupção abrupta, redução rápida da dose, nível sanguíneo decrescente do fármaco156 e/ou administração de um antagonista157.
A abstinência de opióides ou síndrome28 de abstinência é caracterizada por alguns ou todos os seguintes sintomas26: inquietação, lacrimejamento, rinorréia158, bocejos, perspiração, calafrios29, piloereção159, mialgia160, midríase161, irritabilidade, ansiedade, lombalgia162, dor em articulações32, fraqueza, cólicas33 abdominais, insônia, náusea34, anorexia77, vômito35, diarréia36 ou aumento da pressão arterial8, frequência respiratória ou frequência cardíaca.
Em geral os opióides não devem ser descontinuados de forma abrupta.
Jurnista™ deve ser usado com cautela em pacientes com alcoolismo e outras dependências farmacológicas devido à frequência aumentada de tolerância ao opióide e dependência psicológica observada nessas populações de pacientes. Com o abuso por vias parenterais, os excipientes do comprimido podem causar complicações letais.
Jurnista™ contém lactose3. Pacientes com problemas hereditários raros de intolerância à galactose39, deficiência de Lapp ou má-absorção de glicose40-galactose39 não devem fazer uso desse medicamento.
Atenção diabéticos: Este medicamento contém açúcar41, portanto, deve ser usado com cautela em portadores de diabetes42
Atenção: Jurnista™ não deve ser utilizado concomitantemente com álcool, pois a ingestão de álcool promove a liberação de uma dose maior da droga no sangue9, levando ao aumento do efeito sedativo da hidromorfona.
Alergia5 ao sulfito
Jurnista™ pode conter metabisulfito de sódio, um sulfito que pode causar reações do tipo alérgica, incluindo sintomas26 anafiláticos e com risco de vida ou episódios asmáticos menos graves em certas pessoas sensíveis. A prevalência43 geral de sensibilidade ao sulfito na população em geral é desconhecida e, provavelmente, baixa. A sensibilidade ao sulfito é observada com maior frequência em pessoas asmáticas que em não asmáticas.
Efeitos sobre a capacidade de dirigir veículos e utilizar máquinas
Jurnista™ pode ter uma grande influência sobre a capacidade de dirigir e utilizar máquinas. Isso é mais provável ao início do tratamento, após um aumento da dose ou na troca de medicamento.
Durante o tratamento, o paciente não deve dirigir veículos ou operar máquinas, pois sua habilidade e atenção podem estar prejudicadas.
Gravidez7 (Categoria C) e Lactação163
Gravidez7
Não há dados clínicos disponíveis sobre a exposição ao Jurnista™ durante a gravidez7. Embora os estudos em ratos e coelhos não tenham revelado efeitos teratogênicos164, toxicidade143 reprodutiva foi observada (vide Dados de Segurança Pré-Clínica). A hidromorfona cruza a barreira placentária em animais de experimentação. O potencial risco de teratogenicidade para os seres humanos a partir do uso de hidromorfona e outros opióides durante a gestação é desconhecido.
Jurnista™ não deve ser utilizado durante a gravidez7 e o trabalho de parto devido ao prejuízo para a contração uterina e ao risco de causar depressão respiratória no neonato165. Sintomas26 de abstinência podem ser observados em neonatos166 de mães submetidas a tratamento crônico63.
Lactação163
Em estudos clínicos, concentrações baixas de hidromorfona e outros opióides analgésicos2 foram detectadas no leite humano. Os estudos pré-clínicos mostraram que a hidromorfona pode ser detectada no leite de ratas.
Jurnista™ não deve ser utilizado durante a amamentação60.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica.
Uso em idosos, crianças e outros grupos de pessoas
Pacientes idosos
Os idosos estão mais propensos aos efeitos adversos no SNC127 (confusão) e transtornos gastrintestinais e redução fisiológica167 da função renal113. Portanto, recomenda-se cautela extra e a dose inicial deve ser reduzida. O uso concomitante de outros medicamentos, especialmente antidepressivos tricíclicos, aumenta o risco de confusão e de constipação22. Doenças da próstata47 e do trato urinário48 são observadas, em geral, no idoso. Isso contribui para o risco aumentado de retenção urinária114. As considerações acima enfatizam a importância de se ter cautela ao contrário de implicar na restrição de opióides no idoso.
Uso em crianças e adolescentes
Jurnista™ não é recomendado para crianças e adolescentes com idade inferior a 18 anos, pois os dados de eficácia e segurança nessa população não são suficientes.
Uso em pacientes com insuficiência renal138 e hepática136
Pacientes com insuficiência renal138 ou hepática136 moderada devem iniciar o tratamento com uma dose reduzida e acompanhados de perto durante o tratamento. Em pacientes com insuficiência renal138 grave, deve-se considerar um intervalo maior entre as doses de Jurnista™ também deve ser considerado e esses pacientes devem ser monitorados durante o tratamento de manutenção para o desenvolvimento de reações adversas relacionadas aos opióides (vide Reações Adversas).
Pacientes sob risco especial
Jurnista™, da mesma forma que todos os analgésicos2 opióides, deve ser administrado com cautela e em dose reduzida em pacientes com insuficiência renal138 ou hepática136 moderada a grave, insuficiência52 adrenocortical, mixedema53, hipotireoidismo54, hipertrofia168 prostática ou estenose55 do ureter56. Cautela também deve ser exercida na administração de Jurnista™ a pacientes com depressão do SNC127, cifoescolioses, psicose57 tóxica, alcoolismo agudo58, delirium tremens59 ou transtornos convulsivos.
Interações Medicamentosas
Os inibidores da monoamino oxidase (IMAOs) podem causar excitação ou depressão do SNC127 e hipotensão64 ou hipertensão65 se administrados concomitantemente com opióides. Jurnista™ não se destina a pacientes fazendo uso de IMAOs ou dentro de 14 dias após a interrupção de tal tratamento.
O uso concomitante de hidromorfona e agonistas/antagonistas da morfina (buprenorfina, nalbufina, pentazocina) pode levar a uma redução do efeito analgésico4 pelo bloqueio competitivo de receptores, levando ao risco de sintomas26 de abstinência. Portanto, essa combinação não é recomendada.
O uso concomitante de depressores do sistema nervoso central44, tais como hipnóticos, sedativos, anestésicos gerais, antipsicóticos e álcool pode causar efeitos depressores aditivos e depressão respiratória. Adicionalmente, hipotensão64 e sedação66 profunda ou coma67 podem ocorrer. Quando essa combinação for indicada, a dose de um ou dos dois agentes deve ser reduzida.
Jurnista™, como outros opióides, pode aumentar a ação de bloqueio neuromuscular de relaxantes musculares e causar um grau aumentado de depressão respiratória.
Atenção: Jurnista™ não deve ser utilizado concomitantemente com álcool, pois a ingestão de álcool promove a liberação de uma dose maior da droga no sangue9, levando ao aumento do efeito sedativo da hidromorfona.
Reações Adversas a Medicamentos
Dados de estudos clínicos
A segurança de Jurnista™ foi avaliada agrupando os dados de segurança de 12 estudos: 4 estudos controlados de eficácia e segurança e 8 estudos abertos, não controlados de eficácia e segurança. Os estudos controlados e não controlados incluem 1684 pacientes que receberam Jurnista™.
Os 4 estudos controlados foram conduzidos em pacientes com dor oncológica, pacientes com dor por osteoartrite146 e pacientes com dor oncológica ou não maligna. Três dos 4 estudos controlados avaliaram Jurnista™ em relação a um controle ativo: sulfato de morfina de liberação contínua, oxicodona de liberação controlada e hidromorfona de liberação imediata. Um estudo foi controlado com placebo147.
Os três estudos com controle ativo incluíram uma fase de titulação na qual os pacientes tiveram a sua dose de Jurnista™ ajustada para obter o equilíbrio ótimo entre benefícios e efeitos colaterais169. No estudo controlado com placebo147, os pacientes receberam uma dose fixa de Jurnista™ e ajustes da dose não eram permitidos.
Dos oito estudos não controlados, dois estudos tinham desenho idêntico, um em pacientes com dor oncológica e um em pacientes com dor não oncológica. Um estudo foi em pacientes com lombalgia162. O perfil farmacocinético no estado de equilíbrio e as medidas farmacodinâmicas de Jurnista™ foram caracterizadas em pacientes com dor crônica. Um estudo piloto em pacientes com dor aguda também foi conduzido. Três estudos avaliaram a segurança de Jurnista™ a longo prazo em pacientes que continuaram o tratamento a partir de estudos anteriores de curto prazo.
Eventos adversos
As reações adversas a seguir foram identificadas antes da comercialização com base nos dados de segurança de 12 estudos. A frequência de reações adversas foi calculada com base no total de casos relatados nesse total de 1684 pacientes tratados com Jurnista™. As reações adversas mais comuns relacionadas a Jurnista™ foram eventos gastrintestinais (constipação22, náusea34 e vômito35) e eventos do sistema nervoso70 (sonolência, cefaléia170 e vertigem91) relacionados a opióides.
A depressão respiratória pode ser mais provável em certos subgrupos de pacientes (vide Advertências).
Infecções72 e infestações: gastroenterite73 (0,95%), diverticulite74 (0,30%).
Transtorno endócrino75: hipogonadismo (0,06%).
Transtornos do metabolismo76 e nutricional: anorexia77 (6,0%), desidratação78 (1,96%), retenção de líquidos (0,36%), apetite aumentado (0,36%), hiperuricemia (0,12%).
Transtornos psiquiátricos: insônia (8,19%), ansiedade (4,69%), depressão (4,22%), estado de confusão (3,33%), nervosismo (2,08%), sonhos anormais (1,72%), inquietação (1,72%), alucinação79 (1,13%), humor alterado (1,13%), libido80 reduzida (0,95%), ataque de pânico (0,42%), euforia (0,18%), apatia81 (0,18%), paranóia (0,18%), agressão (0,12%), choro (0,12%), disforia171 (0,06%).
Transtornos do sistema nervoso70: sonolência (18,11%), cefaléia170 (16,03%), vertigem91 (12,71%), hipoestesia172 (2,20%), parestesia173 (2,08%), tremor (2,02%), sedação66 (1,60%), memória prejudicada (1,54%), distúrbio da atenção (1,13%), disgeusia174 (1,01%), disartria175 (0,71%), síncope84 (0,71%), distúrbio do equilíbrio (0,48%), coordenação anormal (0,48%), depressão do nível de consciência (0,48%), hiperestesia (0,30%), discinesia (0,24%), mioclonia176 (0,24%), encefalopatia85 (0,18%), distúrbio cognitivo86 (0,12%), hiperatividade psicomotora87 (0,12%), ataque/convulsões (0,12%), hiperreflexia177 (0,06%).
Transtorno da visão88: visão88 borrada (2,14%), diplopia178 (0,36%), olho89 seco (0,24%), miose179 (0,06%).
Transtorno do ouvido e do labirinto90: vertigem91 (1,19%), tinido (0,83%).
Transtornos cardíacos: taquicardia180 (1,13%), palpitações92 (0,83%), extrasístoles (0,18%), bradicardia181 (0,06%).
Transtornos vasculares93: rubor (2,14%), hipertensão65 (2,08%), hipotensão64 (0,59%).
Transtornos respiratório, torácico e do mediastino94: dispnéia95 (3,56%), rinorréia158 (0,53%), hipóxia12 (0,36%), dificuldade respiratória (0,36%), broncoespasmo96 (0,24%), hiperventilação (0,12%), espirros (0,12%), depressão respiratória (0,06%).
Transtornos gastrintestinais: constipação22 (33,02%), náusea34 (30,88%), vômito35 (15,56%), diarréia36 (8,49%), dor abdominal (7,01%), boca97 seca (5,52%), dispepsia98 (3,08%), disfagia182 (1,07%), flatulência (1,01%), hematoquezia183 (0,83%), distensão abdominal (0,53%), hemorróidas99 (0,48%), fezes anormais (0,36%), obstrução intestinal (0,30%), divertículo100 (0,18%), eructação101 (0,18%), distúrbio da motilidade gastrintestinal (0,18%), perfuração de intestino grosso102 (0,12%), fissura103 anal (0,06%), bezoar (0,06%), duodenite (0,06%), íleo106 (0,06%), esvaziamento gástrico prejudicado (0,06%), defecação dolorosa (0,06%).
Transtorno da pele107 e de tecido subcutâneo108: prurido184 (9,14%), hiperidrose185 (7,19%), rash109 (3,86%), eritema110 (0,53%).
Transtornos musculoesquelético e de tecido conjuntivo111: espasmos112 musculares (4,51%), lombalgia162 (4,39%), artralgia186 (4,16%), dor em extremidade (3,27%), mialgia160 (0,89%).
Transtorno renal113 e urinário: disúria187 (1,37%), retenção urinária114 (1,01%), polaciúria (0,89%), hesitação urinária (0,89%), distúrbio da micção115 (0,48%).
Transtornos do sistema reprodutor e das mamas116: disfunção erétil (0,71%), disfunção sexual (0,24%).
Transtornos gerais e condições do local de aplicação: astenia117 (11,70%), edema188 (7,78%), pirexia189 (3,33%), dor (2,91%), desconforto torácico (2,73%), calafrios29 (1,48%), síndrome28 de abstinência (1,13%), mal-estar (0,77%), sensação anormal (0,48%), inquietude (0,42%), dificuldade para caminhar (0,24%), ressaca (0,12%), sentir-se bêbado (0,06%), sentir calor e frio (0,06%), hipotermia190 (0,06%).
Exames: redução do peso (1,48%) e diminuição da saturação de oxigênio (0,65%), potássio sanguíneo (0,36%), aumento das enzimas hepáticas120 (0,36%), aumento da amilase sanguínea (0,12%) e diminuição da testosterona sanguínea (0,06%).
Trauma, envenenamento e complicações de procedimento: queda (2,73%), contusão121 (1,72%), superdose (0,42%).
Atenção: esse é um medicamento novo e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis para comercialização, efeitos indesejáveis e não conhecidos podem ocorrer. Neste caso, informe seu médico.
Superdose
Sintomas26
A dose excessiva de opióide é caracterizada por depressão respiratória, sonolência que progride para estupor e coma67, flacidez musculoesquelética, pele107 fria, pupilas contraídas e, as vezes, taquicardia180 e hipotensão64. Em casos de superdose grave, apnéia191, colapso192 circulatório, parada cardíaca e óbito193 podem ocorrer.
Tratamento
No tratamento da dose excessiva, a atenção primária deve ser para o restabelecimento de troca respiratória adequada, mantendo as vias aéreas desobstruídas e instituindo ventilação122 assistida ou controlada. Se a ingestão oral foi recente, o conteúdo gástrico194 deve ser esvaziado através de lavagem gástrica123, como indicado.Medidas de suporte (incluindo oxigênio e vasoconstritores), devem ser usadas para controlar o choque124 e o edema pulmonar125 que potencialmente acompanham a dose excessiva. Parada cardíaca e arritmias126 podem exigir massagem cardíaca ou desfibrilação.
Em casos de superdose grave, antídotos específicos como naloxona e nalmefeno devem ser utilizados para controlar a depressão respiratória (ver a informação de prescrição para antagonistas opióides específicos para detalhes do uso apropriado). O efeito da naloxona é relativamente curto; portanto, o paciente deve ser monitorado com cuidado até a estabilização da respiração. Jurnista™ irá liberar a hidromorfona por aproximadamente 24 horas. Isso deve ser levado em conta ao determinar o tratamento. Os antagonistas opióides não devem ser administrados na ausência de depressão respiratória clinicamente significante ou depressão circulatória causada por opióides. Antagonistas opióides devem ser administrados com cautela em pacientes com suspeita de serem fisicamente dependentes da hidromorfona, uma vez que a reversão rápida de um opióide, incluindo a hidromorfona, pode precipitar os sintomas26 de abstinência.
Armazenagem
Jurnista™ deve ser armazenado em temperatura ambiente (entre 15°C e 30°C).
Jurnista TM - Laboratório
JANSSEN- CILAG FARMACÊUTICA LTDA.
Rod. Presidente Dutra, km 154
São José dos Campos/SP
Tel: 08007011851
Ver outros medicamentos do laboratório "JANSSEN- CILAG FARMACÊUTICA LTDA."