

LEVITRA
BAYER
LEVITRA
Forma Farmacêutica e Apresentações da Levitra
Levitra® é apresentado na forma de comprimidos revestidos, nas dosagens de 5 mg, 10 mg e 20 mg, em embalagens com 4 comprimidos. A dosagem de 10 mg é apresentada também em embalagens com 1 e 2 comprimidos e a de 20 mg em embalagens com 2 e 8 comprimidos.Composição da Levitra
Levitra® 5 mg: cada comprimido revestido contém 5 mg de vardenafila (5,926 mg de cloridrato de vardenafila triidratado).
Levitra® 10 mg: cada comprimido revestido contém 10 mg de vardenafila (11,852 mg de cloridrato de vardenafila triidratado).
Levitra® 20 mg: cada comprimido revestido contém 20 mg de vardenafila (23,705 mg de cloridrato de vardenafila triidratado).
Excipientes: crospovidona, estearato de magnésio, celulose microcristalina, dióxido de silício coloidal, macrogol 400, hipromelose, dióxido de titânio, óxido férrico e óxido de ferro amarelo.
Informações ao Paciente da Levitra
Ação esperada do medicamentoLevitra® é indicado para pacientes1 com disfunção erétil, isto é, incapacidade de alcançar ou manter suficiente ereção2 do pênis3 para obter uma relação sexual satisfatória. Levitra® deve ser ingerido no máximo uma vez por dia, cerca de 25 a 60 minutos antes da atividade sexual. O tempo para início do efeito varia ligeiramente de pessoa para pessoa, mas normalmente ocorre entre 10 e 60 minutos após sua administração. Nos estudos clínicos realizados, a vardenafila mostrou-se eficaz quando administrada até 4 a 5 horas antes da relação sexual. Todavia, para que a resposta ao tratamento seja obtida, é necessário que exista estímulo sexual.
Cuidados de armazenamento
Manter o medicamento em temperatura ambiente (entre 15°C e 30°C), na sua embalagem original.
Prazo de validade
O prazo de validade está indicado na embalagem do produto. Não utilize o medicamento se ele estiver com o prazo de validade vencido, pois isto pode ser prejudicial para a sua saúde4.
TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS.
Gravidez5 e lactação6
Levitra® não é indicado para uso em mulheres e crianças (abaixo de 16 anos).
Cuidados de administração
Não existem cuidados especiais de administração se o medicamento for utilizado conforme a prescrição médica.
Siga a orientação do seu médico, respeitando sempre os horários, as doses e a duração do tratamento.
Interrupção do tratamento
Não interromper o tratamento sem o conhecimento do seu médico.
Reações adversas
As reações adversas mais comuns são: dor de cabeça7, vermelhidão da face8, indisposição estomacal, náuseas9, tontura10 e congestão nasal. As reações adversas menos comuns são: sonolência, aumento de lacrimejamento e alterações visuais, pressão arterial11 alta, pressão arterial11 baixa e queda da pressão ao levantar repentinamente, falta de ar, sangramento nasal, testes de função hepática12 anormais, inchaço13 na face8, reação de fotossensibilidade, dores nas costas14, aumento da creatinina15 fosfoquinase no sangue16, dor muscular, hipersensibilidade, ansiedade, desmaio, convulsão17, perda da memória geral temporária, aumento da pressão intra-ocular, dor no peito18, infarto do miocárdio19, inchaço13 na garganta20, rigidez muscular, ereção2 aumentada e ereção2 involuntária21 dolorosa e persistente do pênis3.
Informe ao seu médico o aparecimento de reações desagradáveis.
Pós-comercialização
Há relatos de infarto do miocárdio19, raros casos de neuropatia22 óptica isquêmica anterior não arterítica (uma causa de diminuição da visão23 com possível perda permanente da visão23), raros relatos de distúrbios visuais com perda da visão23 (temporária ou permanente) e surdez repentina ou perda de audição em um pequeno número de casos. Não é possível determinar se esses eventos reportados estão diretamente relacionados ao uso de Levitra®, a fatores de risco subjacentes, associação destes fatores ou ainda a outros fatores.
Ingestão concomitante com outras substâncias
Informe seu médico sobre qualquer medicamento que esteja usando, antes do início ou durante o tratamento, pois o uso concomitante de Levitra® e alguns medicamentos pode causar interação entre si ou mesmo requerer cuidados especiais.
Levitra® pode ser tomado junto com a refeição ou fora dela.
Contra-indicações
O medicamento é contra-indicado a pessoas com hipersensibilidade conhecida a qualquer componente de Levitra®, a pacientes que estejam recebendo tratamento concomitante com medicamentos para angina24 do peito18 contendo nitratos ou substâncias doadoras de óxido nítrico, como propatilnitrato, nitroglicerina, isossorbida e a pacientes em tratamento para a AIDS com indinavir ou ritonavir e outros.
Precauções
Seu médico deverá avaliar sua condição cardiovascular, uma vez que existe certo risco cardíaco associado à atividade sexual.
Não é recomendado a pacientes com doenças graves do fígado25, dos rins26, do coração27 e da circulação28, pacientes com doença hereditária nos olhos29 denominada retinite pigmentosa, assim como a pacientes com pressão baixa (pressão arterial11 máxima abaixo de 90 mmHg), com problemas de coagulação30 do sangue16 ou que tiveram infarto31 ou derrame32 cerebral nos últimos 6 meses. Pacientes que também estejam sendo tratados com cetoconazol, itraconazol, eritromicina, claritromicina e alfa-bloqueadores não devem ultrapassar a dose máxima de 5 mg. O uso concomitante de inibidores potentes do citocromo P450 3A4 (CYP3A4), como cetoconazol, itraconazol, indinavir ou ritonavir pode produzir aumento considerável dos níveis plasmáticos da vardenafila. Levitra® não deve ser administrado a pacientes tomando doses maiores que 200 mg de cetoconazol ou de itraconazol. Pacientes com alterações do funcionamento do coração27 (prolongamento congênito33 do intervalo QT) e pacientes que estejam tomando medicamentos antiarrítmicos como quinidina, procainamida, amiodarona ou sotalol devem evitar tomar vardenafila. Levitra® não deve ser administrado a pacientes com alterações na coagulação30 sanguínea que provocam hemorragia34 ou com úlcera péptica35 ativa significativa, portanto, Levitra® somente deve ser administrado a tais pacientes após cuidadosa avaliação do risco/benefício. Informe ao seu médico sobre qualquer medicamento que esteja usando, antes de iniciar ou durante o tratamento.
Em geral, os agentes para o tratamento da disfunção erétil devem ser utilizados com cuidado em pacientes com deformações anatômicas do pênis3 ou em pacientes com condições que possam predispor à ereção2 involuntária21 dolorosa e persistente do pênis3.
A segurança e a eficácia da associação da vardenafila com outros tratamentos para a disfunção erétil não foram estudadas. Portanto, o uso destas associações não é recomendado.
Há relatos de perda temporária da visão23 e de casos de neuropatia22 óptica isquêmica não-arterítica associados à ingestão de Levitra® e de outros inibidores de PDE5. Em casos de perda súbita de visão23, você deve suspender a ingestão de Levitra® e consultar imediatamente um médico (vide “Reações Adversas”).
Não se sabe se o medicamento altera a capacidade de dirigir automóveis ou operar máquinas.
Portanto, o paciente deve ter cuidado ao executar estas atividades considerando os efeitos obtidos durante o tratamento.
NÃO TOME REMÉDIO SEM O CONHECIMENTO DO SEU MÉDICO. PODE SER PERIGOSO PARA A SAÚDE4.
Informações Técnicas da Levitra
Propriedades Farmacodinâmicas
A ereção2 do pênis3 é um processo hemodinâmico baseado no relaxamento do músculo liso36 do corpo cavernoso e das respectivas arteríolas37. Durante o estímulo sexual, as terminações nervosas do corpo cavernoso liberam óxido nítrico (NO), ativando a enzima38 guanilato-ciclase, o que resulta no aumento do nível de monofosfato cíclico de guanosina (GMPc) no corpo cavernoso. Isso, por sua vez, desencadeia o relaxamento do músculo liso36, permitindo o aumento do influxo de sangue16 no pênis3.
O nível efetivo de GMPc depende por um lado da taxa de síntese via guanilato-ciclase e, por outro, da taxa de degradação das fosfodiesterases (PDEs) hidrolisadoras de GMPc.
A PDE predominante no corpo cavernoso humano é a fosfodiesterase de tipo 5 (PDE5), específica para GMPc.
Ao inibir a PDE5, a enzima38 responsável pela degradação de GMPc no corpo cavernoso, a vardenafila potencialmente eleva o efeito do NO endógeno liberado localmente no corpo cavernoso em função da estimulação sexual. A inibição cloridrato de vardenafila de PDE5 pela vardenafila conduz à elevação dos níveis de GMPc no corpo cavernoso, resultando em relaxamento da musculatura lisa e influxo de sangue16 no corpo cavernoso.
Portanto, a vardenafila potencializa a resposta natural à estimulação sexual.
Estudos em preparados enzimáticos purificados mostraram que vardenafila é um inibidor altamente seletivo e muito potente da PDE5, com CI50 de 0,7 nM para PDE5 humana.
O efeito inibidor de vardenafila é mais potente sobre a PDE5 que sobre outras fosfodiesterases conhecidas (>15 vezes que sobre PDE6, >130 vezes que sobre PDE1, >300 vezes que sobre PDE11 e >1.000 vezes que sobre PDE2, 3, 4, 7, 8, 9 e 10). In vitro, vardenafila causa elevação de GMPc no corpo cavernoso humano isolado, resultando em relaxamento muscular.
Em coelhos conscientes, vardenafila causa ereção2 peniana dependente da síntese endógena de óxido nítrico, sendo potencializado por doadores de óxido nítrico.
Efeitos sobre a resposta erétil
Em um estudo de Rigiscan controlado por placebo39, 20 mg de vardenafila produziram em alguns homens ereções suficientes para a penetração (≥ 60% de rigidez por Rigiscan) já após 15 minutos. A resposta geral desses indivíduos a vardenafila tornou-se estatisticamente significativa em comparação com placebo39 aos 25 minutos após a administração.
Em um estudo multicêntrico, randomizado40, duplo-cego, controlado por placebo39 em homens com disfunção erétil, avaliou-se o menor tempo de ação de vardenafila, a partir de sua administração, para se obter ereção2 percebida como suficiente para penetração e relação sexual concluída com sucesso. A porcentagem de homens que concluíram a relação sexual com sucesso após receber doses de 10 ou 20 mg de vardenafila foi maior em comparação ao placebo39 (p<0,025), com início de ação ≥ 10 minutos e ≥ 11 minutos, respectivamente.
Propriedades Farmacocinéticas
Absorção
Após administração oral, vardenafila é absorvida rapidamente. A Cmax já pode ser atingida após 15 minutos; em 90% dos casos a Cmax é atingida em 30 a 120 minutos (média: 60 minutos) após administração oral em jejum.
Devido ao considerável efeito de primeira passagem, a biodisponibilidade oral absoluta média é de aproximadamente 15%.
Após administração oral de vardenafila, a AUC41 e a Cmax aumentam quase proporcionalmente à dose em toda a faixa de dosagem recomendada (5-20 mg).
Quando se ingere vardenafila com uma refeição altamente gordurosa (contendo 57% de gordura42) a taxa de absorção é reduzida, com um aumento de Tmáx de 60 minutos e uma redução média de 20% na Cmáx. A AUC41 de vardenafila não foi afetada. Após uma refeição normal (contendo 30% de gordura42), nenhum dos parâmetros farmacocinéticos de vardenafila (Cmáx, Tmáx e AUC41) foi afetado.
Tendo em vista estes resultados, vardenafila pode ser ingerida com ou sem alimentos.
Distribuição
O volume de distribuição médio no estado de equilíbrio (Vss) de vardenafila é de 208 l, indicando distribuição nos tecidos.
A vardenafila e seu principal metabólito43 circulante (M1) ligam-se em alto grau às proteínas44 plasmáticas (aproximadamente 95% da droga original ou de M1). Essa ligação protéica é reversível e independe das concentrações medicamentosas totais.
Constatou-se em medições de vardenafila no sêmen45 de indivíduos sadios 90 minutos após a administração que não mais de 0,00012% da dose administrada pode aparecer no sêmen45 dos pacientes.
Metabolismo46
A vardenafila é metabolizada predominantemente pelas enzimas hepáticas47 por meio do CYP3A4, com alguma contribuição das isoformas CYP3A5 e CYP2C9.
A meia-vida de eliminação média (t1/2) é de aproximadamente 4-5 horas.
Em humanos, o principal metabólito43 circulante (M1) resulta da desetilação da parte piperazínica de vardenafila e é susceptível de metabolismo46 subseqüente. A meia-vida de eliminação plasmática do metabólito43 M1 é de aproximadamente 4 horas, comparável à da droga original.
Partes do M1 aparecem na circulação28 sistêmica em forma de conjugado glicuronídeo (ácido glicurônico).
A concentração plasmática de M1 não-glicuronizado é de aproximadamente 26% da do composto original. O metabólito43 M1 apresenta um perfil de seletividade de fosfodiesterase similar à de vardenafila e uma potência inibidora de PDE5 in vitro de aproximadamente 28% em comparação com a vardenafila, resultando numa contribuição de aproximadamente 7% para a eficácia.
Excreção
A depuração corporal total de vardenafila é de 56 l/h, resultando numa meia-vida terminal de aproximadamente 4-5 horas.
Após administração oral, vardenafila é excretada em forma de metabólitos48 predominantemente nas fezes (aproximadamente 91-95% da dose administrada por via oral) e em menor extensão na urina49 (aproximadamente 2-6% da dose administrada por via oral).
Farmacocinética em populações especiais
Idosos (acima de 65 anos)
A depuração hepática12 de vardenafila em voluntários idosos saudáveis (65 anos ou mais) foi menor que a observada em voluntários mais jovens (45 anos ou menos). Na média, homens idosos apresentaram uma AUC41 52% maior que homens jovens, valor que se enquadra na variabilidade observada em estudos clínicos. Não se observaram diferenças totais de eficácia ou segurança entre indivíduos idosos e jovens nos estudos clínicos controlados por placebo39.
Insuficiência renal50
Em pacientes com insuficiência renal50 leve (CLcr > 50-80 ml/min) a moderada (CLcr > 30-50 ml/min), a farmacocinética de vardenafila foi similar à do grupo de controle com função renal51 normal. Em voluntários com insuficiência renal50 grave (CLcr < 30 ml/min), a AUC41 média aumentou em 21% e a Cmax média diminuiu em 23% em comparação com voluntários sem insuficiência renal50. Não se observou correlação estatisticamente significativa entre depuração de creatinina15 e exposição plasmática a vardenafila (AUC41 e Cmax).
Não se estudou a farmacocinética de vardenafila em pacientes com necessidade de diálise52.
Insuficiência hepática53
Em pacientes com insuficiência hepática53 leve a moderada (Child-Pugh A e B), a depuração de vardenafila foi reduzida na proporção do grau de insuficiência hepática53.
Em pacientes com insuficiência hepática53 leve (Child-Pugh A), a AUC41 e a Cmáx de vardenafila elevaram-se pelo fator 1,2 (a AUC41 em 17%, a Cmáx em 22%) em comparação com indivíduos de controle sadios.
Em pacientes com insuficiência hepática53 moderada (Child-Pugh B), a AUC41 de vardenafila elevou-se pelo fator 2,6 (160%) e a Cmáx pelo fator 2,3 (130%) em comparação com indivíduos de controle sadios.
Não se estudou a farmacocinética de vardenafila em pacientes com insuficiência hepática53 grave (Child-Pugh C).
Dados de segurança pré-clínicos
Os dados pré-clínicos baseados em estudos convencionais de farmacologia54 de segurança, toxicidade55 de doses repetidas, genotoxicidade, carcinogenicidade e toxicidade55 na reprodução56 não revelaram riscos especiais para humanos.
Indicações da Levitra
Tratamento da disfunção erétil (incapacidade de alcançar ou manter suficiente ereção2 do pênis3 para um desempenho sexual satisfatório).Contra-Indicações da Levitra
Hipersensibilidade a qualquer componente da fórmula (princípio ativo ou excipientes).
Os inibidores da PDE5 podem potencializar os efeitos hipotensivos dos nitratos, de acordo com os efeitos inibidores da PDE na via óxido nítrico/GMPc. Portanto, vardenafila é contra-indicada a pacientes em tratamento concomitante com nitratos ou doadores de óxido nítrico (vide “Interações Medicamentosas e Outras Formas de Interação”).
É contra-indicado o uso concomitante de vardenafila e inibidores de protease do HIV57, como indinavir ou ritonavir, uma vez que estes são potentes inibidores do citocromo CYP3A4.
Gravidez5 e Lactação6 da Levitra
Levitra® não é indicado para uso em mulheres e crianças.Advertências e Precauções da Levitra
Antes de iniciar qualquer tratamento para disfunção erétil, o médico deve avaliar a condição cardiovascular de seus pacientes, uma vez que existe um determinado risco cardíaco associado à atividade sexual. A vardenafila tem propriedades vasodilatadoras que podem causar reduções leves e transitórias da pressão arterial11. Pacientes com obstrução do fluxo ventricular esquerdo, como estenose58 aórtica e estenose58 subaórtica hipertrófica idiopática59 podem ser sensíveis à ação de vasodilatadores, inclusive os inibidores da fosfodiesterase do tipo 5.
Em geral, os agentes para o tratamento da disfunção erétil não devem ser utilizados em homens para os quais a atividade sexual não é recomendada por motivo da sua condição cardiovascular subjacente.
O efeito de Levitra® no intervalo QT foi estudado em 59 homens sadios. Doses terapêuticas (10 mg) e doses supraterapêuticas (80 mg) de Levitra® produziram aumentos no intervalo QTc (vide “Propriedades Farmacodinâmicas”). Um estudo pós-comercialização, para avaliar o efeito da combinação de vardenafila com outra substância de efeito comparável no intervalo QT, mostrou um efeito aditivo, quando comparado aos efeitos das substâncias isoladas (vide “Propriedades Farmacodinâmicas”). Estas observações devem ser consideradas na decisão clínica de prescrever Levitra® a pacientes com histórico de prolongamento QT ou aos que tomam medicamentos conhecidos por prolongarem o intervalo QT. Pacientes que tomam medicamentos antiarrítmicos Classe IA (por exemplo, quinidina e procainamida) ou Classe III (por exemplo, amiodarona e sotalol) ou aqueles com prolongamento congênito33 do intervalo QT devem evitar tomar Levitra®.
Em geral, os agentes para o tratamento da disfunção erétil devem ser utilizados com cuidado em pacientes com deformações anatômicas do pênis3 (como angulação, fibrose60 cavernosa ou doença de Peyronie) ou em pacientes com condições que possam predispor ao priapismo61 (como anemia falciforme62, mieloma63 múltiplo ou leucemia64).
A segurança e a eficácia da associação da vardenafila com outros tratamentos para a disfunção erétil não foram estudadas. Portanto, o uso destas associações não é recomendado.
A segurança da vardenafila não foi estudada nos seguintes subgrupos de pacientes, para os quais não se recomenda o seu uso até que informações adicionais estejam disponíveis: pacientes portadores de insuficiência hepática53 grave, doença renal51 terminal que requeira diálise52, hipotensão65 (pressão arterial sistólica66 em repouso < 90 mmHg), histórico recente (nos últimos 6 meses) de acidente vascular cerebral67 ou infarto do miocárdio19, angina24 do peito18 instável e doenças hereditárias degenerativas68 da retina69 conhecidas, como por exemplo, retinite pigmentosa.
Há relatos de perda temporária da visão23 e de casos de neuropatia22 óptica isquêmica não-arterítica associados à ingestão de Levitra® e de outros inibidores de PDE5. O paciente deve ser alertado para, em casos de perda súbita de visão23, suspender a ingestão de Levitra® e consultar imediatamente um médico (vide “Reações Adversas”).
O uso concomitante de vardenafila e alfa-bloqueadores pode causar hipotensão65 sintomática70 em alguns pacientes, o que é coerente com os efeitos vasodilatadores dos alfa-bloqueadores e da vardenafila (vide “Reações Adversas”). O uso associado só deverá ser iniciado se o paciente estiver estável na terapia com o alfa-bloqueador (vide “Interações medicamentosas e outras formas de interação”). Nestes pacientes estáveis sob terapia com alfa-bloqueadores, deve-se iniciar vardenafila na dose mais baixa recomendada, de 5 mg. Em conjunto com tansulosina, vardenafila pode ser administrada a qualquer momento. Quando vardenafila for prescrita concomitantemente com outros alfa-bloqueadores, deve-se considerar um intervalo de tempo entre as administrações (vide “Interações medicamentosas e outras formas de interação”). Nestes pacientes em tratamento com dose otimizada de vardenafila, a terapia com alfa-bloqueadores deverá ser iniciada com dose mínima. Em pacientes tratados com inibidor de PDE5, inclusive vardenafila, o aumento escalonado da dose de alfa-bloqueador poderá associar-se com redução adicional da pressão arterial11.
O uso concomitante de inibidores potentes do citocromo P450 3A4 (CYP3A4), como cetoconazol, itraconazol, indinavir ou ritonavir pode produzir aumento considerável dos níveis plasmáticos da vardenafifila. Em associação com eritromicina, claritromicina, cetoconazol ou itraconazol não se deve exceder uma dose máxima de 5 mg. A vardenafila não deve ser administrada com doses de cetoconazol e de itraconazol maiores que 200 mg (vide “Posologia e Modo de Administração”, “Interações Medicamentosas e Outras Formas de Interação”). É contra-indicado o uso concomitante com indinavir ou ritonavir, os quais são potentes inibidores do CYP3A4 (vide “Posologia e Modo de Administração”, “Contra-Indicações”, “Interações Medicamentosas e Outras Formas de Interação”).
Não se administrou vardenafila a pacientes com distúrbios hemorrágicos71 ou com úlcera péptica35 ativa significativa; portanto, somente se deve administrá-la a tais pacientes após cuidadosa avaliação do risco/benefício.
Estudos em seres humanos revelaram que a vardenafila não altera o tempo de sangramento quando administrada isoladamente ou em associação com o ácido acetilsalicílico.
Estudos in vitro com plaquetas72 humanas indicam que a vardenafila isolada não inibe a agregação plaquetária induzida por uma série de agonistas plaquetários. Observou-se um pequeno aumento (dependente da concentração) do efeito antiagregante do nitroprussiato de sódio, um doador de óxido nítrico, com concentrações supraterapêuticas de vardenafila.
A associação de heparina com vardenafila não afetou o tempo de sangramento em ratos, porém essa interação não foi estudada em seres humanos.
Habilidade para dirigir veículos ou operar máquinas
O paciente deve estar ciente de sua resposta ao Levitra® antes de dirigir ou operar máquinas.
Interações Medicamentosas e Outras Formas de Interação da Levitra
Inibidores do citocromo P450A vardenafila é metabolizada principalmente por meio das enzimas hepáticas47, pelo citocromo P450 (CYP) isoforma 3A4, com uma certa contribuição das isoformas CYP3A5 e CYP2C. Por isso, os inibidores dessas enzimas podem reduzir a depuração da vardenafila.
A cimetidina (400 mg, duas vezes por dia), um inibidor inespecífico do citocromo P450, não teve efeito sobre a biodisponibilidade (AUC41) nem sobre a concentração máxima (Cmax) da vardenafila, quando administrada concomitantemente com a vardenafila (20 mg) em voluntários sadios.
A eritromicina (500 mg, três vezes por dia), um inibidor do CYP3A4, provocou um aumento de 4 vezes (300%) na AUC41 e de 3 vezes (200%) na Cmax da vardenafila quando administrada simultaneamente com a vardenafila (5 mg) em voluntários sadios.
O cetoconazol (200 mg), um potente inibidor do CYP3A4, provocou um aumento de 10 vezes (900%) na AUC41 e de 4 vezes (300%) na Cmax da vardenafila quando administrado simultaneamente com a vardenafila (5 mg) em voluntários sadios.
A co-administração de vardenafila (10 mg) e de um inibidor da protease73 do HIV57, o indinavir (800 mg, três vezes por dia), resultou em aumento de 16 vezes (1.500%) no valor da AUC41 da vardenafila e de 7 vezes (600%) no valor da Cmax da vardenafila. Após 24 horas da co-administração, os níveis plasmáticos de vardenafila foram de aproximadamente 4% do nível plasmático máximo de vardenafila (Cmax).
O ritonavir (600 mg, duas vezes por dia) ocasionou aumento de 13 vezes na Cmáx e aumento de 49 vezes na AUC0-24 de vardenafila na administração concomitante com vardenafila 5 mg. A interação é conseqüência do bloqueio do metabolismo46 hepático de Levitra® pelo ritonavir, um inibidor altamente potente do CYP3A4, que inibe também o CYP2C9. O ritonavir prolongou significativamente a meia-vida de Levitra® para 25,7 horas.
O uso concomitante de inibidores potentes do citocromo P450 3A4 (CYP3A4), como cetoconazol, itraconazol, indinavir ou ritonavir, pode provocar um aumento considerável dos níveis plasmáticos de vardenafila. Não se deve exceder uma dose máxima de 5 mg quando usada em combinação com eritromicina ou claritromicina (vide “Advertências e Precauções”).
Não se deve ultrapassar uma dose máxima de 5 mg de vardenafila quando usada em associação com cetoconazol e itraconazol. A vardenafila não deve ser administrada com doses de cetoconazol e itraconazol maiores que 200 mg (vide “Advertências e Precauções”, “Posologia e Modo de Administração”). É contra-indicado o uso concomitante com indinavir ou ritonavir, inibidores muito potentes do CYP3A4 (vide “Posologia e Modo de Administração”, “Advertências e Precauções”, “Contra-Indicações”).
O nicorandil é um híbrido74 de abridor dos canais de cálcio e nitrato. Devido ao seu teor de nitrato, o produto tem potencial para interação séria com vardenafila.
Nitratos e doadores de óxido nítrico
Em um estudo com 18 homens sadios não se observou potencialização do efeito hipotensor da nitroglicerina sublingual (0,4 mg) quando se administrou vardenafila (10 mg) em intervalos de tempos variáveis (de 24 h até 1 h) antes da dose de nitroglicerina.
Em indivíduos sadios de meia-idade, o efeito hipotensor dos nitratos sublinguais (0,4 mg), administrados 1 e 4 horas após 20 mg de vardenafila, foi potencializado. Esses efeitos não foram observados com a ingestão de 20 mg de vardenafila 24 horas antes da nitroglicerina.
Entretanto, não há informações sobre os possíveis efeitos hipotensores da vardenafila quando administrada a pacientes em associação com nitratos. Logo, seu uso concomitante é contra-indicado (vide “Contra-Indicações”).
Outros
A administração concomitante de vardenafila (20 mg) e glibenclamida não afetou a biodisponibilidade relativa da glibenclamida (não houve efeito sobre a AUC41 e sobre a Cmáx da glibenclamida). Não houve evidência de alteração da farmacocinética de vardenafila pela co-administração da glibenclamida.
Não se observou nenhuma interação farmacocinética e farmacodinâmica (tempo de protrombina75 e fatores de coagulação30 II, VII e X) na co-administração de varfarina (25 mg) e vardenafifila (20 mg). A farmacocinética da vardenafila não foi afetada pela co-administração da varfarina.
Não se demonstrou nenhuma interação farmacocinética relevante na co-administração de vardenafila (20 mg) e nifedipino (30 ou 60 mg). O tratamento associado de vardenafila e nifedipino não causou interações farmacodinâmicas (em comparação com placebo39, a vardenafila induziu reduções adicionais médias na pressão arterial sistólica66 e diastólica supina de 5,9 mmHg e 5,2 mmHg, respectivamente).
Alfa-bloqueadores
Tendo em vista que a monoterapia com alfa-bloqueadores pode causar expressiva redução da pressão arterial11, especialmente hipotensão65 postural e síncope76, foram realizados estudos de interação com a vardenafila em pacientes com hiperplasia77 prostática benigna (HPB) sob terapia estável com tansulosina ou terazosina, assim como em voluntários normotensos após um curto período de uso de alfa-bloqueadores.
Em dois estudos de interação realizados em voluntários sadios normotensos após titulação forçada dos alfabloqueadores tansulosina ou terazosina até doses elevadas por 14 dias ou menos, constatou-se hipotensão65 (em alguns casos sintomática70) após co-administração de Levitra® em um número significativo de indivíduos.
Entre os indivíduos tratados com terazosina, observou-se a hipotensão65 (pressão arterial sistólica66 inferior a 85 mmHg em posição ereta) com maior freqüência quando se administravam Levitra® e terazosina de modo a atingir Cmax simultânea do que quando a administração era feita de modo a separar as Cmax por 6 horas.
Como esses estudos foram realizados em voluntários sadios após titulação forçada do alfa-bloqueador até doses elevadas (os indivíduos não estavam estáveis à terapia com alfa-bloqueadores), podem ter relevância clínica limitada.
Realizaram-se estudos de interação com Levitra® em pacientes com hiperplasia77 prostática benigna (HPB) sob terapia estável com tansulosina ou terazosina. Quando se administrou Levitra® em doses de 5, 10 ou 20 mg sobre uma base de terapia estável com tansulosina, não ocorreu redução adicional máxima média relevante de pressão arterial11. Quando se administrou Levitra® 5 mg simultaneamente com tansulosina 0,4 mg, 2 entre 21 pacientes apresentaram pressão arterial sistólica66 em posição ereta inferior a 85 mmHg. Quando se administraram Levitra® 5 mg e tansulosina com intervalo de 6 horas entre ambos, 2 entre 21 pacientes apresentaram pressão arterial sistólica66 em posição ereta inferior a 85 mmHg. Em um estudo subseqüente em pacientes com HPB, não ocorreram casos de pressão arterial sistólica66 inferior a 85 mmHg em posição ereta na administração de Levitra® 10 mg e 20 mg simultaneamente com tansulosina 0,4 ou 0,8 mg. Quando se administrou Levitra® 5 mg simultaneamente com terazosina 5 ou 10 mg, um dentre 21 pacientes apresentou hipotensão65 postural sintomática70. Não se observou hipotensão65 quando se administraram Levitra® 5 mg e terazosina com intervalo de 6 horas entre ambos. Isto deve ser levado em conta na decisão sobre o estabelecimento de um intervalo entre as administrações.
Um tratamento concomitante só deve ser iniciado se o paciente estiver estável em sua terapia com alfabloqueador. Nestes pacientes estáveis sob terapia de alfa-bloqueador, Levitra® deve ser iniciado com a mínima dose inicial recomendada, de 5 mg. Levitra® pode ser administrado com tansulosina a qualquer momento. Com outros alfa-bloqueadores deve-se considerar um intervalo de tempo em caso de prescrição concomitante de Levitra® (vide “Advertências e precauções”).
Quando se co-administrou digoxina (0,375 mg) no estado de equilíbrio com vardenafila (20 mg) durante 14 dias, em dias alternados, não se evidenciou nenhuma interação farmacocinética. Não houve evidência de que a farmacocinética da vardenafila seja alterada pela co-administração de digoxina.
Doses únicas de Maalox® (antiácido78, hidróxido de magnésio/hidróxido de alumínio) não tiveram influência sobre a biodisponibilidade (AUC41) ou a concentração máxima (Cmax) da vardenafila.
A biodisponibilidade da vardenafila (20 mg) não foi afetada pela co-administração dos antagonistas H2, ranitidina (150 mg, duas vezes por dia) e cimetidina (400 mg, duas vezes por dia).
A vardenafila (10 mg e 20 mg) não influenciou o tempo de sangramento quando administrada isoladamente ou em associação com doses baixas de ácido acetilsalicílico (81 mg, duas vezes por dia).
A vardenafila (20 mg) não potencializou o efeito hipotensor do álcool (0,5 g/kg de peso corporal). A farmacocinética da vardenafila não foi alterada.
Os dados de investigações farmacocinéticas populacionais de fase III não revelaram efeitos significativos de ácido acetilsalicílico, inibidores da enzima38 conversora da angiotensina (ECA), betabloqueadores, inibidores fracos do CYP3A4, diuréticos79 e medicamentos para o tratamento do diabetes80 (sulfoniluréias81 e metformina82) sobre a farmacocinética da vardenafila.
Gravidez5 e lactação6
Não aplicável
Reações Adversas da Levitra
A vardenafila foi administrada a mais de 9.500 pacientes nos estudos clínicos realizados em todo o mundo (Posição: Março 2004). Em geral, a vardenafila apresentou boa tolerabilidade. As reações adversas observadas foram geralmente transitórias e de intensidade leve a moderada.
Ensaios clínicos83 controlados com placebo39
Quando a vardenafila foi administrada conforme recomendado nos estudos clínicos controlados por placebo39, observaram-se as seguintes reações adversas (Posição: Março 2004):

Todos os ensaios clínicos83
A lista das reações adversas manifestadas durante o tratamento foi determinada de acordo com algoritmos pré-definidos. Nas categorias de freqüência, as reações adversas foram incluídas quando ocorreram no dia da última administração ou no dia seguinte de acordo com o critério abaixo:
• Raro: notas 1-2: graves de acordo com os termos críticos da OMS, e não usual na ausência de terapia com a droga.
• Pouco freqüente: notas ≥ 3-9: importante para orientação, monitoramento e decisão de tratamento; notas ≥ 10 todos.
• Freqüente e muito freqüente: todos.
As seguintes reações adversas foram relatadas em pacientes tratados com vardenafila em todos os estudos clínicos realizados (Posição: Março 2004):
A tabela a seguir contém todas as reações adversas relatadas em todos os estudos clínicos realizados mundialmente, que correspondem aos termos críticos da OMS (merecem atenção especial pela possibilidade de associação com doenças graves) ou que podem ter outro tipo de relevância clínica:
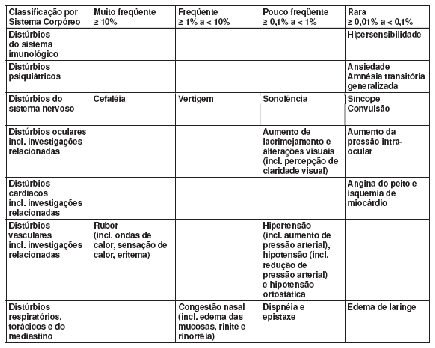
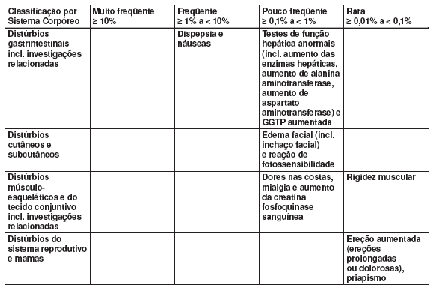
Pós-comercialização
Há relatos de infarto do miocárdio19 (IM) em associação temporal com o uso de vardenafila e a atividade sexual, mas não é possível determinar se o IM está diretamente relacionado à vardenafila, à atividade sexual, à doença cardiovascular subjacente do paciente ou à associação destes fatores.
Relataram-se raros casos pós-comercialização de neuropatia22 óptica isquêmica anterior não arterítica (NAION), uma causa de diminuição da visão23 com possível perda permanente da visão23, de relação temporal com o uso de inibidores da fosfodiesterase do tipo 5, inclusive de Levitra®. A maioria desses pacientes, mas não todos, apresentava fatores de risco subjacentes anatômicos ou vasculares84 para o desenvolvimento de NAION, incluindo baixa relação cup/disc (crowded disc), idade acima de 50 anos, diabetes80, hipertensão85, doença arterial coronariana, hiperlipidemia86 e tabagismo. Não é possível determinar se esses eventos estão diretamente relacionados ao uso de inibidores da PDE5, a pacientes com fatores de risco vasculares84 ou alterações anatômicas subjacentes ou a uma associação desses fatores, ou ainda a outros fatores.
Há raros relatos pós-comercialização de distúrbios visuais com perda da visão23 (temporária ou permanente) com relação temporal com o uso de inibidores da fosfodiesterase do tipo 5, inclusive de Levitra®. Não é possível determinar se esses eventos estão diretamente relacionados ao uso de inibidores da PDE5, a pacientes com fatores de risco vasculares84 subjacentes ou a outros fatores.
Surdez repentina ou perda de audição foram reportadas em um pequeno número de casos de estudos clínicos e de estudos de pós-comercialização com o uso de todos os inibidores de PDE5, inclusive Levitra®.
Não é possível determinar se esses eventos reportados estão diretamente relacionados ao uso de Levitra®, a fatores de risco subjacentes para perda da audição, a uma combinação destes fatores ou a outros fatores.
Posologia e Modo de Administração da Levitra
Dose habitual recomendadaA dose inicial recomendada é de 10 mg, administrada conforme necessário, cerca de 25 a 60 minutos antes da atividade sexual. Nos estudos clínicos, a vardenafila mostrou-se eficaz quando administrada até 4 a 5 horas antes da relação sexual. A freqüência máxima recomendada de administração é de uma vez por dia. A vardenafila pode ser ingerida junto com alimentos ou não (vide “Propriedades Farmacocinéticas”). O estímulo sexual é necessário para que se obtenha a resposta natural ao tratamento (vide “Propriedades Farmacodinâmicas”).
Faixa de doses
A dose pode ser aumentada para 20 mg ou diminuída para 5 mg, dependendo da eficácia e da tolerabilidade.
A dose máxima recomendada é de 20 mg, uma vez por dia.
Forma de administração
Para uso oral.
Ajuste posológico e controle especial
Não aplicável
Pacientes idosos (acima de 65 anos)
Não é necessário ajuste de dose em pacientes idosos.
Crianças (abaixo de 16 anos)
Levitra® não é indicado para uso em crianças.
Insuficiência hepática53 (vide “Propriedades Farmacocinéticas”)
Não é necessário ajustar a dose em pacientes com insuficiência hepática53 leve (Child-Pugh A).
A depuração da vardenafila apresenta-se reduzida em pacientes com insuficiência hepática53 moderada (Child-Pugh B); portanto, é recomendado utilizar a dose inicial de 5 mg, que pode ser aumentada posteriormente com base na eficácia e na tolerabilidade, até a dose máxima de 10 mg.
A farmacocinética da vardenafila não foi estudada em pacientes com insuficiência hepática53 grave (Child-Pugh C).
Insuficiência renal50 (vide “Propriedades Farmacocinéticas”)
Não é necessário ajustar a dose em pacientes com comprometimento renal51 leve (depuração de creatinina15 > 50 a 80 ml/min), moderado (depuração de creatinina15 > 30 a 50 ml/min) ou grave (depuração de creatinina15 < 30 ml/min).
A farmacocinética de vardenafila não foi estudada em pacientes sob diálise52.
Medicamentos concomitantes
Pelo efeito vasodilatador dos alfa-bloqueadores e da vardenafila, o uso concomitante de vardenafila e alfabloqueadores pode levar a hipotensão65 sintomática70 em alguns pacientes. O tratamento concomitante só deverá ser iniciado se o paciente estiver estável com o alfa-bloqueador (vide “Interações medicamentosas e outras formas de interação”). Nestes pacientes estáveis sob terapia com alfa-bloqueadores, deve-se iniciar vardenafila com a menor dose recomendada, de 5 mg. Em conjunto com tansulosina, vardenafila pode ser administrada a qualquer momento. Quando vardenafila for prescrita concomitantemente com outros alfa-bloqueadores, deve-se considerar um intervalo de tempo entre as administrações (vide “Interações medicamentosas e outras formas de interação”).
Em pacientes que já estejam em tratamento com dose otimizada de vardenafila, a terapia com alfa-bloqueadores deverá ser iniciada com dose mínima. Em pacientes tratados com inibidor de PDE5, inclusive vardenafila, o aumento escalonado da dose de alfa-bloqueador poderá associar-se com redução adicional da pressão arterial11.
A dose de Levitra® pode necessitar de ajuste em pacientes tratados com certos inibidores do CYP3A4 (por exemplo, cetoconazol, itraconazol, ritonavir, indinavir, eritromicina e claritromicina).
A dose máxima de 5 mg não deve ser ultrapassada quando usada em associação com eritromicina ou claritromicina, que são inibidores do citocromo P450 (CYP) 3A4.
A dose máxima de 5 mg não deve ser ultrapassada quando empregada em associação com cetoconazol e itraconazol, potentes inibidores do citocromo P450 (CYP) 3A4. A vardenafila não deve ser utilizada simultaneamente com doses de cetoconazol ou itraconazol maiores que 200 mg. É contra-indicado o uso concomitante com inibidores da protease87 do HIV57, tais como indinavir e ritonavir, inibidores muito potentes do CYP3A4 (vide “Contra-Indicações”, “Advertências e Precauções”, “Interações Medicamentosas e Outras Formas de Interação”).
Superdose da Levitra
A vardenafila foi avaliada em doses únicas de até 80 mg por dia, em estudos conduzidos em voluntários. Até a dose mais alta testada (80 mg por dia) foi bem tolerada, sem induzir reações adversas graves. Isso foi confirmado em um estudo com doses de 40 mg uma vez por dia administradas durante 4 semanas. Quando a dose de 40 mg foi administrada duas vezes por dia, ocorreram casos de lombalgia88 grave. Contudo, não se observou toxicidade55 muscular ou neurológica. Em casos de superdose, devem-se adotar medidas gerais de suporte conforme necessário. A diálise52 renal51 não deve acelerar a depuração da vardenafila, uma vez que esta se liga fortemente às proteínas44 plasmáticas, não sendo eliminada significativamente pela urina49.
Pacientes Idosos (Acima de 65 Anos da Levitra
Não é necessário ajuste de dose em pacientes idosos.
MS-1.7056.0034
Farm. Resp.: Dr. Braulio Lordêllo - CRF-SP n° 9496
Fabricado por:
Bayer HealthCare AG – Leverkusen – NRW – Alemanha U
Importado e distribuído por:
Bayer S.A
Rua Domingos Jorge, 1.100 - Socorro
04779-900 - São Paulo - SP
C.N.P.J. n° 18.459.628/0001-15
www.bayerscheringpharma.com.br
Atendimento ao consumidor
sac@bayerhealthcare.com
Venda sob prescrição médica
Lote, datas de fabricação e validade: vide cartucho
LEVITRA - Laboratório
BAYER
Rua Domingos Jorge, 1100
São Paulo/SP
- CEP: 04779-900
Tel: 08007231010
Fax: 55 (011)548-0485
Site: http://www.bayer.com.br/
Ver outros medicamentos do laboratório "BAYER"






