
INTERAÇÕES FARMACOCINÉTICAS REMINYL ER
Na eliminação da galantamina estão envolvidas várias vias metabólicas e a excreção renal1. Com base em estudos in vitro, CYP2D6 e CYP3A4 foram as principais enzimas envolvidas no metabolismo2 da galantamina. A inibição da secreção gástrica ácida não prejudica a absorção da galantamina.
Outros fármacos que afetam o metabolismo2 da galantamina
Fármacos que são inibidores potentes da CYP2D6 e CYP3A4 podem aumentar a AUC3 da galantamina. Estudos farmacocinéticos de dose múltipla demonstraram que a AUC3 da galantamina aumentou 30% e 40% respectivamente durante a administração concomitante de cetoconazol e paroxetina. Quando administrada com eritromicina, outro inibidor da CYP3A4, a AUC3 da galantamina aumentou apenas 10%. A análise farmacocinética na população com Doença de Alzheimer4 mostrou que a depuração da galantamina diminuiu cerca de 25-33% com a administração concomitante de amitriptilina, fluoxetina, fluvoxamina, paroxetina e quinidina, inibidores conhecidos da CYP2D6.
Portanto, no início do tratamento com inibidores potentes da CYP2D6 e da CYP3A4 os pacientes podem apresentar aumento da incidência5 de efeitos colaterais6 colinérgicos, principalmente náusea7 e vômito8. Nestas circunstâncias, uma redução da dose de manutenção da galantamina pode ser considerada, com base na tolerabilidade do paciente.
A memantina, um antagonista9 do receptor N-metil-D-aspartato (NMDA), na dose de 10 mg/dia por 2 dias seguidos de 10 mg duas vezes ao dia por 12 dias não apresenta efeito na farmacocinética da galantamina com 16 mg/dia no estado de equilíbrio.
Efeito da galantamina no metabolismo2 de outras drogas
Doses terapêuticas da galantamina (12 mg duas vezes por dia) não produzem efeitos sobre a cinética10 da digoxina e da varfarina. A galantamina não afeta o tempo aumentado da protrombina11 induzido pela varfarina.
Estudos in vitro indicaram que a inibição potencial da galantamina em relação às principais formas do citocromo P450 humano é muito baixa.
Reações Adversas a Medicamentos
Dados de estudos clínicos
Dados de estudos duplo-cegos- Reações adversas ao fármaco12 relatadas com freqüência ≥1%
A segurança de Reminy® foi avaliada em 4457 indivíduos com demência13 do tipo Alzheimer14 suave ou moderadamente severa que participaram em 7 estudos clínicos duplo-cegos placebo15 controlados. A informação apresentada nesta seção é derivada de dados destes estudos.
Reações adversas ao medicamento (RAMs) relatadas por ≥1% dos pacientes tratados com Reminy® nestes estudos clínicos estão na Tabela 1.
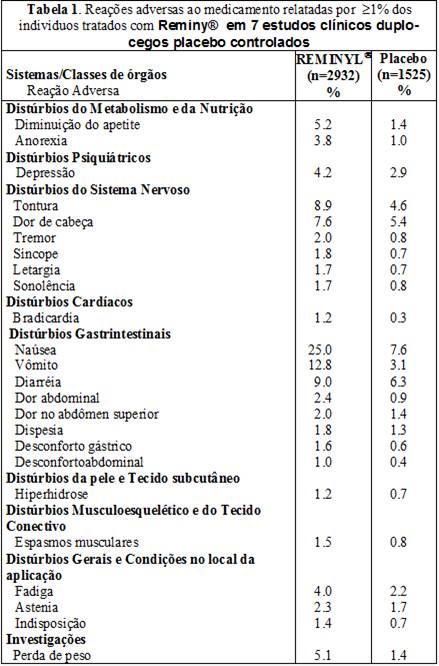
Em um estudo clínico randomizado16 duplo-cego e placebo15 controlado, o perfil de segurança do tratamento uma vez ao dia de Reminyl® ER, cápsulas de liberação prolongada, foi similar em freqüência e natureza do que os observados com os comprimidos simples.
Náusea7 e vômito8 foram os eventos adversos mais freqüentes e ocorreram principalmente durante o período de titulação da dose e permaneceram durante menos de uma semana na maioria dos casos e a maioria dos pacientes apresentaram apenas 1 episódio. A prescrição de anti-eméticos e ingestão adequada de fluídos pode ser útil para estes casos.
Dados de estudos abertos- Reações Adversas ao Medicamento relatadas com freqüência ≥1%.
A segurança de Reminyl® foi avaliada em 1454 indivíduos com demência13 do tipo Alzheimer14 leve ou moderadamente severa que participaram em 5 estudos clínicos abertos. A informação apresentada nesta seção é proveniente de dados destes estudos.
Reações Adversas ao Medicamento (RAMs) relatadas por ≥1% dosindividuos tratados com Reminyl® nestes estudos clínicos e não mencionadas na Tabela 1, incluído desmaios, que ocorreu com taxa de 6,5% nos estudos clínicos abertos.
Dados de estudos duplo-cegos e abertos- Reações Adversas ao Medicamentos relatadas com freqüência <1%.
RAMs adicionais que ocorreram em <1% dos indivíduos tratados com Reminyl® em estudos duplo-cegos e abertos estão listadas na Tabela 2.
| Tabela 2. Reações Adversas ao Medicamento relatadas por <1% dos indivíduos tratados com Reminyl® nos estudos clínicos duplo-cegos ou abertos |
| Distúrbios do Metabolismo2 e da Nutrição17 Desidratação18 |
| Distúrbios do Sistema Nervoso19 Disgeusia20, hipernosmia, parestesia21 |
| Distúrbios oftalmológicos Visão22 embaçada |
| Distúrbios Cardíacos Bloqueio átrio-ventricular de primeiro grau, palpitação23, bradicardia24 sinusal, extrassístoles, supraventriculares |
| Distúrbios Vasculares25 Rubor, hipotensão26 |
| Distúrbios gastrintestinais Ânsia de vômito8 |
| Distúrbios Musculoesqueléticos e do Tecido Conectivo27 Fraqueza muscular |
Na Tabela 3 as RAMS estão apresentadas por freqüência da categoria baseada na incidência5 em estudos clínicos.
| Tabela 3. Reações Adversas ao Medicamento identificadas durante o período de pós-comercialização de Reminyl® por freqüência da categoria estimada a partir de estudos clinicos |
| Distúrbios psiquiátricos Comum – alucinação28 Incomum – alucinação28 visual, alucinação28 auditiva |
| Distúrbios do ouvido e do Labirinto29 Incomum- tinido– Tinnitus30 |
| Distúrbios Vasculares25 Comum - hipertensão31 |
| Distúrbios hepatobiliares32 Raro - hepatite33 |
| Investigações Incomum – aumento das enzimas hepáticas34 |
Sintomas35: Os sinais36 e os sintomas35 esperados para a superdose significativa da galantamina são semelhantes aos sinais36 e sintomas35 da superdose de outros colinomiméticos. Estes efeitos geralmente envolvem o sistema nervoso central37, o sistema nervoso19 parassimpático e a junção neuromuscular38. Além da fraqueza muscular ou das fasciculações39 musculares, podem ocorrer alguns ou todos os sinais36 de crise colinérgica40: náusea7 grave, vômito8, cólicas41 gastrintestinais, salivação, lacrimejamento, incontinência urinária42 e fecal, sudorese43, bradicardia24, hipotensão26, colapso44 e convulsões. O aumento da fraqueza muscular junto com hipersecreções traqueais e broncoespasmo45 podem levar a um comprometimento vital das vias aéreas.
Durante o período de pós-comercialização foram relatados casos de “Torsade de Pointes” prolongamento do intervalo QT, bradicardia24, taquicardia46 ventricular e breve perda de consciência associada à ingestão acidental de galantamina. Em um dos casos foi relatada a ingestão de 8 comprimidos de 4 mg (total de 32 mg) em um único dia. Dois casos adicionais de ingestão acidental de 32 mg (náusea7, vômito8, boca47 seca; náusea7, vômito8 e dor torácica subesternal) e um de 40 mg (vômito8), resultaram em hospitalização breve para observação com recuperação completa. Um paciente, com história de alucinações48 nos dois anos anteriores, para o qual foi prescrita dose de 24 mg/dia, recebeu erroneamente 24 mg duas vezes ao dia por 34 dias e desenvolveu alucinações48 que exigiram hospitalização. Outro paciente, para o qual foram prescritos 16 mg/dia de solução oral, ingeriu inadvertidamente 160 mg (40 mL), apresentou sudorese43, bradicardia24 e quase síncope49 uma hora mais tarde e foi hospitalizado. Os sintomas35 desapareceram em 24 horas.
Tratamento: Como em qualquer caso de superdose, devem ser utilizadas medidas gerais de suporte. Nos casos graves, anticolinérgicos como a atropina podem ser utilizados como antídoto50 geral para os colinomiméticos. Recomenda-se uma dose inicial de 0,5 a 1,0 mg I.V., sendo as doses subseqüentes baseadas na resposta clínica.
Como estratégias para a conduta na superdose estão continuamente em desenvolvimento, é aconselhável contactar um centro de controle toxicológico para determinar as últimas recomendações para a conduta de uma superdose.
VENDA SOB PRESCRIÇÃO MÉDICA
SÓ PODE SER VENDIDO COM A RETENÇÃO DA RECEITA


