
COMPOSIÇÃO SPIRIVA
Cada cápsula para inalação contém 18 mcg de tiotrópio, correspondentes a 22,5
mcg de brometo de tiotrópio monoidratado e a 21,7 mcg de brometo de tiotrópio.
Excipiente: lactose1 monoidratada.
- INFORMAÇÕES AO PACIENTE
AÇÃO DO MEDICAMENTO ou COMO ESTE MEDICAMENTO FUNCIONA?
SPIRIVA é um medicamento que age na manutenção dos pacientes com DPOC
combatendo o estreitamento dos brônquios2 e a dificuldade para respirar (falta de
ar). O início da ação de SPIRIVA se dá dentro de 30 minutos após a primeira
dose e se mantém por 24 horas.
INDICAÇÕES DO MEDICAMENTO ou POR QUE ESTE MEDICAMENTO FOI
INDICADO?
SPIRIVA é indicado para o tratamento de manutenção de pacientes com
Doença Pulmonar Obstrutiva Crônica (DPOC - incluindo bronquite crônica3 e
enfisema4), associada à falta de ar, e para a prevenção dos episódios de piora da
doença (exacerbações).
RISCOS DO MEDICAMENTO ou QUANDO NÃO DEVO USAR ESTE
MEDICAMENTO?
Contra-indicações
SPIRIVA pó para inalação é contra-indicado para pacientes5 com história de
alergia6 à atropina ou a seus derivados, p.ex. ipratrópio ou oxitrópio, ou a
qualquer componente que faça parte da sua fórmula.
Este medicamento é contra-indicado em crianças, pois a segurança e
eficácia de SPIRIVA, pó para inalação, não foi estabelecida em pacientes
pediátricos.
Advertências
Informe ao médico ou cirurgião-dentista o aparecimento de reações
indesejáveis.
Não use medicamento sem o conhecimento do seu médico. Pode ser
perigoso para a sua saúde7.
Precauções
SPIRIVA é um broncodilatador8 para tratamento crônico9 de dose única diária e
não para os casos agudos de estreitamento dos brônquios2.
Após a administração de SPIRIVA em pó para inalação podem ocorrer reações
de alergia6 imediata.
Da mesma forma que com outros medicamentos semelhantes, SPIRIVA deve
ser utilizado com cuidado em pacientes com glaucoma10 de ângulo fechado,
hiperplasia11 da próstata12 ou obstrução do colo13 da bexiga14.
Medicamentos inalatórios podem provocar o aparecimento de estreitamento dos
brônquios2 induzido por inalação.
Assim como outros medicamentos excretados predominantemente por via renal15,
a administração de SPIRIVA deve ser acompanhada cuidadosamente em
pacientes com comprometimento moderado a grave da função renal15.
Deve-se evitar o contato do medicamento com os olhos16. Dor ou desconforto nos
olhos16, visão17 embaçada, visão17 de halos ou imagens coloridas em associação
com olhos16 avermelhados podem ser sinais18 de glaucoma10 de ângulo fechado.
Com o aparecimento de qualquer desses sintomas19, deve-se procurar um
especialista imediatamente.
Colírios para contrair a pupila não são considerados um tratamento eficaz.
SPIRIVA não deve ser utilizado mais do que uma vez ao dia.
As cápsulas de SPIRIVA devem ser usadas somente com o HANDIHALER que
acompanha o produto.
Este produto contém 5,5 mg de lactose1 monoidratada por cápsula.
Efeitos na habilidade de dirigir e operar máquinas
Não foram realizados estudos relativos a efeitos sobre a habilidade de dirigir e
operar máquinas. A ocorrência de tontura20 ou visão17 embaçada pode influenciar
na habilidade de dirigir e operar máquinas.
Gravidez21 e lactação22
Este medicamento não deve ser utilizado por mulheres grávidas sem
orientação médica ou do cirurgião-dentista.
SPIRIVA não deve ser utilizado por mulheres que estejam amamentando sem
orientação médica ou do cirurgião-dentista.
Interações Medicamentosas
Embora não se tenham realizado estudos para avaliar eventuais interações
medicamentosas, o brometo de tiotrópio tem sido utilizado concomitantemente
com outros medicamentos, comumente utilizados no tratamento de DPOC,
incluindo broncodilatadores23 simpaticomiméticos como salbutamol24, metilxantinas
como aminofilina e teofilina, esteróides orais como prednisona e inalatórios
como beclometasona, budesonida e fluticasona, sem evidência clínica de
interações medicamentosas.
A administração aguda de uma única dose de brometo de ipratrópio com
SPIRIVA administrado cronicamente em pacientes com DPOC e voluntários
sadios não foi associada a aumento dos eventos adversos, alterações nos sinais18
vitais ou achados eletrocardiográficos. Entretanto, a administração crônica de
outros fármacos anticolinérgicos com SPIRIVA não foi estudada e, portanto, não
é recomendada.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de
algum outro medicamento.
MODO DE USO ou COMO DEVO USAR ESTE MEDICAMENTO?
Aspecto físico
A cápsula de SPIRIVA é verde clara opaca e contém pó branco em seu interior.
As cápsulas de SPIRIVA contêm somente uma pequena quantidade de pó, e
desse modo, as cápsulas são apenas parcialmente preenchidas.
Características organolépticas
Não possui nenhum odor estranho.
Dosagem
A dosagem recomendada é a inalação do conteúdo de uma cápsula de SPIRIVA
uma vez ao dia, com o auxílio do HANDIHALER, sempre no mesmo horário.
As cápsulas de SPIRIVA não devem ser engolidas.
Pacientes idosos podem utilizar SPIRIVA nas doses recomendadas.
Pacientes com função renal15 comprometida podem utilizar SPIRIVA nas doses
recomendadas. Entretanto, assim como com outros medicamentos excretados
predominantemente por via renal15, o uso de SPIRIVA deve ser acompanhado
cuidadosamente em pacientes com comprometimento moderado a grave da
função renal15.
Pacientes com função hepática25 comprometida podem utilizar SPIRIVA nas
doses recomendadas.
A segurança e eficácia de tiotrópio, pó para inalação, não foi estabelecida em
pacientes pediátricos e, portanto, SPIRIVA não deve ser utilizado em crianças.
Como usar
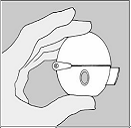
Lembre-se de seguir cuidadosamente as instruções de seu
médico.
O HANDIHALER possibilita a inalação do medicamento
contido na cápsula de SPIRIVA.
O HANDIHALER foi desenvolvido especialmente para
SPIRIVA, não devendo ser usado com nenhum outro
medicamento.
O HANDIHALER pode ser usado por até um ano para
administração de SPIRIVA.
As cápsulas de SPIRIVA devem ser usadas dentro de 9 dias
após a abertura do blíster (cartela das cápsulas).
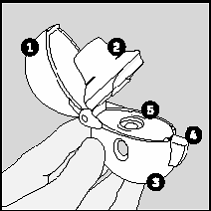
1. Para remover a tampa, pressione completamente o botão
(4) e solte.

2. Abra completamente a tampa puxando-a para cima. Em
seguida, abra o bocal puxando-o para cima.
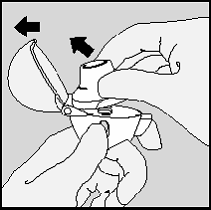
3. Remova uma cápsula de SPIRIVA do blíster
imediatamente antes do uso. Separe as tiras do blíster,
rasgando-o na parte picotada.

4. Levante e puxe a folha de alumínio do blíster até que uma
cápsula fique completamente visível.
Caso uma segunda cápsula seja exposta ao ar por acidente,
a mesma deverá ser descartada.
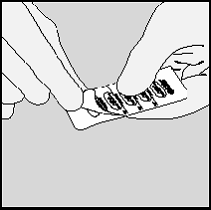
5. Remova a cápsula.
Observação: as cápsulas de SPIRIVA não devem ser
expostas (nem no blíster e nem no HANDIHALER) a
temperaturas superiores a 25°C, isto é, elas não devem ser
expostas à luz do sol e ao calor.
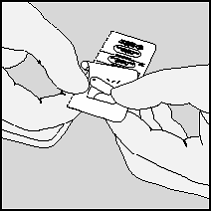
6. Coloque a cápsula no compartimento central (5) do
HANDIHALER. A posição da cápsula no compartimento não
tem importância.
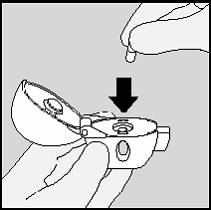
7. Feche firmemente o bocal até ouvir um “clic”. Mantenha a
tampa aberta.
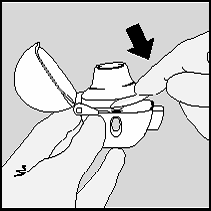
8. Segure o HANDIHALER com o bocal para cima. Pressione
completamente o botão (4), liberando-o em seguida. Este
perfura a cápsula efetuando pequenos orifícios na mesma os
quais permitem a passagem do medicamento no momento
da inspiração26.

9. Faça uma expiração27 completa.
Importante: Não expire dentro do bocal em nenhum
momento.
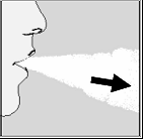
10. Leve o HANDIHALER até a boca28 e feche os lábios
firmemente ao redor do bocal. Mantenha a cabeça29 na
posição vertical e inspire lenta e profundamente, mas de
maneira que se possa ouvir a vibração da cápsula. Inspire
até encher os pulmões;30 prenda a respiração o quanto
possível, mas de forma confortável e ao mesmo tempo retire
o HANDIHALER da boca28. Reassuma a respiração normal.
Repita os itens 9 e 10, o que irá esvaziar a cápsula
completamente.
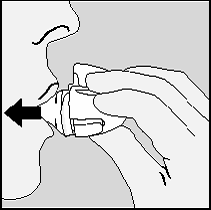
11. Abra o bocal novamente. Descarte a cápsula utilizada.
Feche o bocal e a tampa e guarde o HANDIHALER.
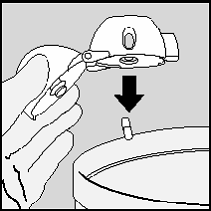
Limpeza do HANDIHALER
Limpe o HANDIHALER uma vez por mês.
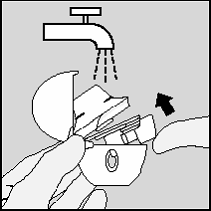
Abra a tampa e o bocal. Abra também a base levantando o
botão que perfura a cápsula (4). Enxágüe todo o inalador
com água morna para remover qualquer resíduo de pó.
Seque completamente o HANDIHALER, batendo-o de leve
em um papel toalha para remover o excesso de água e
depois deixe-o secar ao ar, deixando abertos a tampa, o
bocal e a base. O tempo para que o ar seque completamente
o HANDIHALER é de 24 horas, portanto, proceda à limpeza
imediatamente após o uso para que este esteja pronto na
administração da próxima dose.
Se necessário, pode-se efetuar a limpeza externa com um
pano úmido, evitando-se panos molhados.
Siga a orientação de seu médico, respeitando sempre os horários, as
doses e a duração do tratamento.
Não interrompa o tratamento sem o conhecimento do seu médico.
Não use o medicamento com o prazo de validade vencido. Antes de usar
observe o aspecto do medicamento.
REAÇÕES ADVERSAS ou QUAIS OS MALES QUE ESTE MEDICAMENTO
PODE CAUSAR?
Distúrbios do sistema nervoso31:
≥ 0,1% e < 1%: vertigem32.
Distúrbios oculares:
≥ 0,01% e < 0,1%: visão17 embaçada, pressão intraocular33 aumentada.
Freqüência desconhecida: glaucoma10.
Distúrbios cardíacos:
≥ 0,01% e < 0,1%: batimentos cardíacos acelerados, palpitações34
Freqüência desconhecida: taquicardia35 supraventricular, fibrilação atrial (arritmias36
cardíacas que, em geral, causam palpitações34 intensas).
Distúrbios respiratórios, torácicos e mediastinais:
≥ 0,1% e < 1%: alteração da voz, e assim como com outros tratamentos
inalatórios, estreitamento dos brônquios2, tosse, irritação da garganta37 e outras
irritações locais.
≥ 0,01% e < 0,1%: sangramento nasal.
Distúrbios gastrintestinais:
≥ 1% e < 10%: boca28 seca, em geral leve e freqüentemente resolvida com a
continuidade do tratamento.
≥ 0,1% e < 1%: candidíase38 oral (popularmente conhecida como “sapinho”)
≥ 0,01% e < 0,1%: prisão de ventre, doença de refluxo gastroesofágico39.
Freqüência desconhecida: obstrução intestinal, incluindo paralisia40 do intestino e
dificuldade para engolir.
Alterações do tecido subcutâneo41 e da pele42 e distúrbios do sistema imune43:
≥ 0,01% e < 0,1%: erupção44 da pele42, urticária45, coceira e outras alergias.
Freqüência desconhecida: inchaço46 da língua47, lábios e face48.
Distúrbios renais e urinários:
≥ 0,01% e < 0,1%: dificuldade de urinar e retenção urinária49 (normalmente em
homens com fatores de predisposição), infecção50 do trato urinário51.
Atenção: este é um medicamento novo e, embora as pesquisas tenham
indicado eficácia e segurança aceitáveis para comercialização, efeitos
indesejáveis e não conhecidos podem ocorrer. Neste caso, informe seu
médico.
CONDUTA EM CASO DE SUPERDOSE ou O QUE FAZER SE ALGUÉM
USAR UMA GRANDE QUANTIDADE DESTE MEDICAMENTO DE UMA SÓ
VEZ?
Altas doses de SPIRIVA podem levar a sinais18 e sintomas19 anticolinérgicos como
batimentos cardíacos acelerados, distúrbios da movimentação do estômago52 e
intestino e retenção da urina53.
Entretanto, não ocorreram reações adversas anticolinérgicas sistêmicas após
inalação de dose única de até 282 mcg de tiotrópio por voluntários sadios.
Observou-se conjuntivite54 bilateral em associação com boca28 seca, após repetidas
inalações de doses únicas diárias de 141 mcg de tiotrópio, em voluntários
sadios, que foram resolvidas durante o tratamento. A única reação adversa
atribuída ao tiotrópio, em estudos com múltiplas doses em pacientes com
DPOC, recebendo uma dose diária máxima de 36 mcg de tiotrópio durante
quatro semanas, foi boca28 seca.
A ocorrência de intoxicação aguda, devido à ingestão oral de cápsulas de
tiotrópio é improvável, pois o produto é pouco absorvido após administração
oral.
Na eventualidade da ingestão de doses muito acima das aconselhadas,
recomenda-se consultar o médico.
CUIDADOS DE CONSERVAÇÃO E USO ou ONDE E COMO DEVO
GUARDAR ESTE MEDICAMENTO?
Conserve o produto em temperatura inferior a 25°C, ao abrigo da luz do sol e da
umidade. Evite o congelamento.
As cápsulas devem ser usadas dentro de 9 dias após a abertura do blíster.
Todo medicamento deve ser mantido fora do alcance das crianças.
DIZERES LEGAIS
MS – 1.0367.0137
Farmacêutica Responsável: Laura M. S. Ramos – CRF/SP – 6870
N° do lote, data de fabricação e prazo de validade: vide cartucho.
Esta bula é atualizada continuamente. Por favor, proceda à sua leitura antes de
utilizar o medicamento.
Para sua segurança, mantenha esta embalagem até o uso total do
medicamento.
Fabricado e embalado por:
Boehringer Ingelheim Pharma GmbH & Co. KG
Ingelheim am Rhein – Alemanha
Importado por:
Boehringer Ingelheim do Brasil Química e Farmacêutica Ltda.
Rod. Regis Bittencourt (BR116), km 286
Itapecerica da Serra – SP
CNPJ/MF n° 60.831.658/0021-10
SAC 0800-7016633
Venda sob prescrição médica
BPI 0251-04 20060802
C08-01


