ENXAQUECA TOPAMAX
O tratamento deve ser iniciado com 25 mg à noite durante 1 semana. A dose deve então ser aumentada em 25 mg/dia, uma vez por semana. Se o paciente for incapaz de tolerar o esquema de gradação, intervalos maiores entre os ajustes de dose podem ser usados. A dose total diária de topiramato recomendada na profilaxia de enxaqueca1 é 100 mg/dia, divididos em duas tomadas. Alguns pacientes podem se beneficiar de uma dose diária total de 50 mg. Pacientes receberam dose diária total de até 200 mg/dia. A dose e a velocidade de gradação devem ser orientadas pelo resultado clínico.
Advertências
Atenção: este medicamento contém açúcar2, portanto, deve ser usado com cautela em portadores de diabetes3.
Nos pacientes com ou sem histórico de crises epilépticas ou epilepsia4, as drogas antiepilépticas incluindo o Topamax® devem ser gradativamente descontinuadas, para minimizar a possibilidade de crises epilépticas ou aumento da freqüência de crises epilépticas.
Em estudos clínicos, as doses diárias foram diminuídas de 50-100 mg nos adultos com epilepsia4 e 25-50 mg em adultos recebendo Topamax® em intervalos semanais a doses de até 100 mg/dia para a profilaxia da enxaqueca1. Em estudos clínicos em crianças, Topamax® foi retirado gradualmente por um período de 2-8 semanas. Nas situações onde a retirada rápida de Topamax® é de recomendação médica, é recomendada monitoração apropriada.
A principal via de eliminação do topiramato e seus metabólitos5 é através dos rins6. A eliminação pelos rins6 é dependente da função renal7 e independe da idade. Pacientes com insuficiência renal8 moderada ou grave podem levar de 10 a 15 dias para atingir as concentrações plasmáticas no estado de equilíbrio, em comparação com o período de 4 a 8 dias, observado em pacientes com função renal7 normal.
Em todos os pacientes, a titulação da dose deverá ser orientado pelo resultado clínico (isto é, controle das crises, evitando efeitos colaterais9), considerando-se que indivíduos sabidamente portadores de insuficiência renal8 poderão precisar de um tempo mais longo para alcançar o estado de equilíbrio, a cada dose.
Hidratação adequada durante o uso de topiramato é muito importante. Hidratação pode reduzir o risco de nefrolitíase. Hidratação apropriada antes e durante atividades como exercícios físicos ou exposição a temperaturas elevadas pode reduzir o risco de eventos adversos relacionados ao calor.
Transtornos do humor / Depressão
Um aumento na incidência10 de transtornos do humor e depressão tem sido observados durante o tratamento com topiramato.
Ideação suicida
Fármacos antiepilépticos, inclusive Topamax® , aumentam o risco de pensamentos ou comportamento suicidas em pacientes que utilizam estes fármacos para qualquer indicação. Uma meta-análise de estudo randomizado11 placebo12 controlado com medicamentos antiepilépticos mostrou um aumento do risco de ideação e comportamento suicida (0,43% em medicamentos antiepilépticos versus 0,24% com placebo12). O mecanismo de ação para este risco não é conhecido.
Em estudo clínico duplo-cego, eventos relacionados ao suicídio (ideação suicida, tentativa de suicídio) ocorreu com freqüência de 0,5% nos pacientes tratados com topiramato (46 dos 8652 pacientes tratados) comparado com 0,2% dos indivíduos tratados com placebo12. Um caso de suicídio foi relatado em paciente tratado com Topamax® para transtorno bipolar.
Pacientes devem ser monitorados para os sinais13 de ideação e comportamento suicida e tratamento apropriado deve ser considerado. Pacientes (e quando apropriado os cuidadores do paciente) devem ser avisados a procurar imediatamente cuidado médico quando aparecerem sintomas14 de ideação ou comportamento suicida.
Nefrolitíase
Alguns pacientes, especialmente aqueles com predisposição à nefrolitíase, podem ter risco aumentado de formação de cálculo15 renal7 e sinais13 e sintomas14 associados, tais como cólica renal7, dor renal7 e dor em flanco16.
Fatores de risco de nefrolitíase incluem antecedentes de cálculo15 renal7, histórico familiar de nefrolitíase e hipercalciúria17. Nenhum desses fatores de risco pode antecipar com certeza a formação de cálculo15 durante tratamento com topiramato. Além disso, pacientes utilizando outros medicamentos associados à possibilidade de ocorrência de nefrolitíase podem ter um risco aumentado.
Função hepática18 diminuída
Topamax® deve ser administrado com cuidado em pacientes com insuficiência hepática19, uma vez que o “clearance” do topiramato pode estar reduzido neste grupo de pacientes.
Miopia20 aguda e glaucoma21 agudo22 de ângulo fechado secundário
Uma síndrome23 consistindo de miopia20 aguda e glaucoma21 agudo22 de ângulo fechado secundário tem sido relatada em pacientes em uso de Topamax® . Os sintomas14 incluem início agudo22 de redução da acuidade visual24 e/ou dor ocular. Achados oftalmológicos podem incluir miopia20, redução da câmara anterior25, hiperemia26 ocular (vermelhidão) e aumento da pressão intraocular27. Midríase28 pode ou não estar presente. Esta síndrome23 pode estar associada com efusão29 supraciliar resultando no deslocamento do cristalino30 e da íris31, com glaucoma21 agudo22 de ângulo fechado secundário. Os sintomas14 ocorrem, caracteristicamente, no primeiro mês após do início do tratamento com Topamax® . Ao contrário do glaucoma21 de ângulo fechado primário, que é raro em pessoas com menos de 40 anos, o glaucoma21 agudo22 de ângulo fechado secundário associado com topiramato tem sido relatado tanto em pacientes pediátricos como adultos. O tratamento inclui a interrupção do Topamax® , o mais rápido possível de acordo com a avaliação do médico, e medidas apropriadas para reduzir a pressão intraocular27. Estas medidas geralmente resultam na redução da pressão intraocular27.
Elevada pressão intraocular27 de qualquer etiologia32, se não for tratada, pode acarretar em graves sequelas33, incluindo perda permanente da visão34
Acidose metabólica35
Hipercloremia, hiato não-aniônico, acidose metabólica35 (isto é, redução do bicarbonato sérico abaixo do intervalo de referência normal na ausência de alcalose36 respiratória) estão associadas ao tratamento com topiramato. Esta redução no bicarbonato sérico está relacionada ao efeito inibitório do topiramato na anidrase carbônica renal7. A redução no bicarbonato ocorre geralmente no início do tratamento, mas pode ocorrer ao longo da duração do tratamento. Estas reduções são usualmente leves a moderadas (redução média de 4 mmol/L37 em doses de 100 mg/dia ou acima em adultos e aproximadamente 6 mg/Kg/dia em pacientes pediátricos). Os pacientes raramente apresentaram redução a valores menores que 10 mmol/L37. As condições ou terapias que predispõe a acidose38 (como doença renal7, distúrbios respiratórios graves, “status epilepticus”, diarréia39, cirurgia, dieta cetogênica, ou alguns fármacos) podem ser aditivos aos efeitos do topiramato na redução do bicarbonato.
Acidose metabólica35 crônica em pacientes pediátricos pode reduzir as taxas de crescimento. O efeito do topiramato no crescimento e sequela40 relativa aos ossos não foi avaliado sistematicamente em pacientes pediátricos ou adultos.
Dependendo das condições de base, recomenda-se avaliação adequada, incluindo níveis de bicarbonato sérico, durante o tratamento com topiramato. Se a acidose metabólica35 ocorrer e persistir, deve-se considerar redução da dose ou interrupção do topiramato (usando redução gradual da dose).
Suplementação41 nutricional
A suplementação41 da dieta ou o aumento da ingestão de alimentos deve ser considerado se o paciente apresentar perda de peso durante o tratamento com topiramato.
Gravidez42 e Lactação43
Uso durante a gravidez42
Estudos em animais demonstraram toxicidade44 relacionada a reprodução45. Em ratos, o topiramato atravessou a barreira placentária.
Não foram realizados estudos adequados e bem controlados com Topamax® em gestantes.
Dados registrados sugerem que mal formações congênitas46 (como por exemplo defeitos craniofaciais, tais como lábio leporino47, hipospádia48 e anormalidades envolvendo vários sistemas corporais) podem estar associadas ao uso de Topamax® durante a gravidez42. Isto foi relatado em monoterapia com topiramato e em regimes politerápicos no qual topiramato fazia parte.
Topamax® deve ser usado durante a gravidez42 apenas se os benefícios potenciais justificarem os riscos potenciais para o feto49. No tratamento as mulheres devem ser advertidas sobre os potenciais riscos para a gravidez42, a prescrição médica deve pesar os benefícios da terapia contra os riscos potenciais. Se este medicamento está sendo usado durante a gravidez42 ou se a paciente ficar grávida durante o tratamento com este medicamento, a paciente deve ser advertida sobre os potenciais riscos para o feto49.
Uso durante a lactação43
O topiramato é eliminado no leite de ratas. A excreção do topiramato no leite humano não foi avaliada em estudos controlados. A observação em um número limitado de pacientes sugere uma excreção extensa do topiramato no leite. Uma vez que muitas drogas são excretadas no leite humano, deve-se decidir entre evitar a amamentação50 ou descontinuar o tratamento com a droga, levando-se em consideração a importância do medicamento para a mãe.
Durante a experiência pós-comercialização, casos de hipospadia48 foram relatados em bebês51 do sexo masculino expostos ao topiramato no útero52, com ou sem outros anticonvulsivantes; no entanto, uma relação causal com o topiramato não foi estabelecida.
Efeitos sobre a capacidade de dirigir veículos e operar máquinas
Topamax® age sobre o sistema nervoso central53, podendo produzir sonolência, tontura54 ou outros sintomas14 relacionados. Isto pode causar distúrbios visuais e/ou visão34 turva. Tais reações podem ser potencialmente perigosas para pacientes55 dirigindo veículos ou operando máquinas, particularmente até que se conheça a reação individual do paciente ao fármaco56.
Uso em idosos, crianças e outros grupos de pessoas
Não foram observadas diferenças farmacocinéticas relacionadas apenas à idade, embora a possibilidade de alterações da função renal7 associadas à idade deva ser considerada.
Interações Medicamentosas
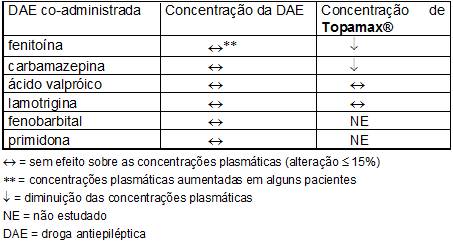
Para o proposto nesta seção, uma dose sem efeito é definida como uma alteração ≤ 15%.
- Efeitos do Topamax® sobre outras drogas antiepilépticas
A associação de Topamax® a outras drogas antiepilépticas (fenitoína, carbamazepina, ácido valpróico, fenobarbital, primidona) não afeta suas concentrações plasmáticas no estado de equilíbrio, exceto, ocasionalmente, em alguns pacientes, em que a adição de Topamax® à fenitoína poderá resultar em aumento das concentrações plasmáticas de fenitoína. Isto se deve possivelmente à inibição de uma isoforma específica de uma enzima57 polimórfica (CYP2C19). Consequentemente, deverá ser realizada dosagem do nível plasmático de fenitoína em qualquer paciente em tratamento com fenitoína que apresente sinais13 ou sintomas14 de toxicidade44.
Um estudo de interação farmacocinética em pacientes com epilepsia4 demonstrou que a associação do topiramato à lamotrigina não apresentou efeito na concentração plasmática de lamotrigina no estado estacionário com doses de topiramato de 100 a 400 mg/dia. Além disso, a concentração plasmática de topiramato no estado estacionário não sofreu alteração durante ou após a retirada do tratamento com lamotrigina (dose média de 327 mg/dia).
- Efeitos de outras drogas antiepilépticas sobre Topamax®
A fenitoína e a carbamazepina diminuem as concentrações plasmáticas do Topamax® . A adição ou descontinuação da fenitoína ou da carbamazepina ao tratamento com Topamax® poderá requerer um ajuste de dose deste último. A titulação da dose deverá ser realizada de acordo com o efeito clínico.
Tanto a adição quanto à retirada do ácido valpróico não produzem mudanças clinicamente significativas nas concentrações plasmáticas de Topamax® e, portanto, não exigem ajuste da dose do Topamax® . Os resultados destas interações estão resumidos na tabela a seguir.