
INFORMAÇÕES AO PACIENTE INVEGA SUSTENNA TM
PARA QUE ESTE MEDICAMENTO É INDICADO?
Invega® SustennaTM é indicado para o tratamento da esquizofrenia1 e para a prevenção da recorrência2 dos sintomas3 da esquizofrenia1.
COMO ESTE MEDICAMENTO FUNCIONA?
O palmitato de paliperidona é hidrolizado à paliperidona. A paliperidona é um antagonista4 dopaminérgico D2 de ação central com atividade antagonista4 5-HT2A serotoninérgica predominante. A paliperidona também é ativa como antagonista4 nos receptores alfa-1 e alfa-2-adrenérgicos5 e nos receptores histaminérgicos H1. A paliperidona não apresenta afinidade pelos receptores colinérgicos muscarínicos ou beta-1 e beta-2-adrenérgicos5. A atividade farmacológica dos enantiômeros (+) e (-) da paliperidona é quali e quantitativamente semelhante.
O mecanismo de ação da paliperidona, como ocorre com outros medicamentos eficazes contra a esquizofrenia1, é desconhecido. Entretanto, foi proposto que a atividade terapêutica6 do medicamento em esquizofrenia1 é mediada por uma combinação de antagonismo de receptor dopaminérgico do tipo 2 (D2) e serotoninérgico do tipo 2 (5HT2A). O antagonismo em receptores diferentes do D2 e do 5HT2A pode explicar parte dos outros efeitos da paliperidona.
Espera-se que a ação terapêutica6 do medicamento se inicie entre 8 e 22 dias após a injeção7.
QUANDO NÃO DEVO USAR ESTE MEDICAMENTO?
Contraindicações
Invega® SustennaTM é contraindicado em pacientes com hipersensibilidade conhecida à paliperidona ou a qualquer dos componentes da formulação. Como a paliperidona é um metabólito8 ativo da risperidona, Invega® SustennaTM é contraindicado em pacientes com hipersensibilidade conhecida à risperidona.
O QUE DEVO SABER ANTES DE USAR ESTE MEDICAMENTO?
Advertências
Síndrome9 Neuroléptica Maligna
A ocorrência da Síndrome9 Neuroléptica Maligna (SNM), caracterizada por hipertermia, rigidez muscular, instabilidade autonômica, alteração da consciência e níveis elevados de creatinofosfoquinase sérica, foi relatada com antipsicóticos, incluindo a paliperidona. Outros sinais10 clínicos podem incluir mioglobinúria (rabdomiólise11) e insuficiência renal12 aguda. Se um paciente desenvolve sinais10 ou sintomas3 indicativos de SNM, todos os antipsicóticos, inclusive o Invega® SustennaTM, devem ser descontinuados.
Discinesia tardia13
Os medicamentos com propriedades antagonistas do receptor dopaminérgico são associados à indução de discinesia tardia13 caracterizada por movimentos involuntários rítmicos, predominantemente da língua14 e/ou da face15. Se aparecerem sinais10 e sintomas3 de discinesia tardia13, a descontinuação de todos os medicamentos antipsicóticos, inclusive do Invega® SustennaTM, deve ser considerada.
Intervalo QT
Como ocorre com outros antipsicóticos, deve-se ter cautela ao prescrever Invega® SustennaTM a pacientes com história de arritmias16 cardíacas, pacientes com síndrome9 de QT longo congênita17 e com o uso concomitante de medicamentos conhecidos por prolongar o intervalo QT.
Hiperglicemia18 e diabetes mellitus19
Hiperglicemia18, diabetes mellitus19 e exacerbação da diabetes20 pré-existente foram relatadas durante o tratamento com Invega® SustennaTM. A avaliação da relação entre o uso de antipsicóticos atípicos e anormalidades da glicose21 é complicada pela possibilidade de um aumento do risco de diabetes mellitus19 em pacientes com esquizofrenia1 e a crescente incidência22 de diabetes mellitus19 na população geral. Não se entende completamente a relação entre o uso de antipsicóticos atípicos e eventos adversos relacionados à hiperglicemia18, dados os causadores dessa confusão. Qualquer paciente tratado com antipsicóticos atípicos, incluindo Invega® SustennaTM, deve ser monitorado para os sintomas3 de hiperglicemia18 e diabetes mellitus19.
Ganho de peso
Foi observado ganho de peso com o uso de antipsicóticos atípicos. Recomenda-se monitoramento do peso.
Hipotensão23 ortostática
A paliperidona pode induzir a hipotensão23 ortostática em alguns pacientes com base na sua atividade alfa-bloqueadora. Invega® SustennaTM deve ser usado com cautela em pacientes com doença cardiovascular conhecida (por exemplo, insuficiência cardíaca24, infarto25 ou isquemia26 do miocárdio27, anormalidades de condução), doença vascular28 cerebral ou condições que predispõem o paciente à hipotensão23 (por exemplo, desidratação29, hipovolemia30 e tratamento com medicamentos antihipertensivos).
Convulsões
Como ocorre com outros antipsicóticos, Invega® SustennaTM deve ser usado com cautela em pacientes com história de convulsões ou outras condições que potencialmente reduzem o limiar de convulsão31.
Pacientes idosos com demência32
Pacientes idosos com psicose33 decorrente de demência32 tratados com drogas anti psicóticas têm risco aumentado de morte. Invega® SustennaTM não está aprovado para uso em pacientes com psicose33 decorrente de demência32.
Mortalidade34 geral
Em uma metanálise de 17 estudos clínicos controlados, os pacientes idosos com demência32 tratados com outros antipsicóticos atípicos, incluindo a risperidona, o aripiprazol, a olanzapina e a quetiapina, apresentaram aumento do risco de mortalidade34 em comparação aos que receberam o placebo35. Entre os tratados com a risperidona, a mortalidade34 foi de 4% em comparação a 3,1% com o placebo35.
Eventos adversos vasculares36 cerebrais
Em estudos controlados por placebo35 em pacientes idosos com demência32 tratados com alguns antipsicóticos atípicos, incluindo a risperidona, o aripiprazol e a olanzapina, houve maior incidência22 de eventos adversos vasculares36 cerebrais (acidentes vasculares36 cerebrais e acidentes isquêmicos transitórios), inclusive com fatalidades, em comparação ao placebo35.
Leucopenia37, neutropenia38, e agranulocitose39
Eventos de leucopenia37, neutropenia38 e agranulocitose39 foram relatados com agentes antipsicóticos, incluindo Invega® SustennaTM. Agranulocitose39 foi relatada muito raramente ( < 1/10.000 pacientes) durante a vigilância pós-comercialização.
Pacientes com histórico de baixa contagem de células brancas do sangue40 (CBS) clinicamente significativa ou leucopenia37/neutropenia38 induzida por medicamento devem ser monitorados durante os primeiros meses de tratamento e deve-se considerar a descontinuação de Invega® SustennaTM ao primeiro sinal41 de queda clinicamente significativa nas CBS na ausência de outros fatores causadores.
Pacientes com neutropenia38 clinicamente significativa devem ser cuidadosamente monitorados para febre42 ou outros sintomas3 ou sinais10 de infecção43 e tratados imediatamente se tais sintomas3 ou sinais10 ocorrerem. Pacientes com neutropenia38 grave (contagem absoluta de neutrófilos44 < 1 X 109/L) devem descontinuar Invega® SustennaTM e ter suas contagens de células45 brancas (CBS) acompanhadas até sua recuperação.
Tromboembolismo46 venoso
Casos de tromboembolismo46 venoso (TEV) foram relatados com medicamentos antipsicóticos. Já que pacientes tratados com antipsicóticos frequentemente apresentam fatores de risco adquiridos para TEV, todos os possíveis fatores de risco para TEV devem ser identificados antes e durante o tratamento com Invega® SustennaTM e medidas preventivas devem ser tomadas.
Doença de Parkinson47 e Demência32 com Corpos de Lewy
Os médicos devem pesar os riscos em relação aos benefícios ao prescrever antipsicóticos, incluindo Invega® SustennaTM, a pacientes com Doença de Parkinson47 ou Demência32 com Corpos de Lewy (DCL48), uma vez que ambos os grupos podem correr maior risco de Síndrome9 Neurolóptica Maligna e por terem maior sensibilidade a antipsicóticos. A manifestação dessa sensibilidade aumentada pode incluir confusão, embotamento49, instabilidade postural com quedas frequentes, além de sintomas3 extrapiramidais.
Priapismo50
Foi relatado que medicamentos com efeitos bloqueadores alfa-adrenérgicos5 induzem o priapismo50 (ereção51 prolongada e dolorosa). Foi relatado priapismo50 com a paliperidona oral durante a vigilância pós-comercialização.
Regulação da temperatura corpórea
O comprometimento da capacidade de reduzir a temperatura corpórea central foi atribuído a agentes antipsicóticos. Recomenda-se cuidado adequado ao prescrever Invega® SustennaTM a pacientes que apresentarem condições que podem contribuir para a elevação da temperatura corpórea central, por exemplo, realização de exercícios extenuantes, exposição a calor intenso, uso de medicamento concomitante com atividade anticolinérgica ou estar sujeito à desidratação29.
Efeito antiemético52
Foi observado efeito antiemético52 nos estudos pré-clínicos com a paliperidona. Esse efeito, se ocorrer em humanos, pode mascarar os sinais10 e sintomas3 da superdosagem com certos medicamentos ou de condições como obstrução intestinal, síndrome9 de Reye e tumor53 cerebral.
Administração
Deve-se ter cuidado para evitar a injeção7 inadvertida de Invega® SustennaTM em um vaso sanguíneo.
Síndrome9 da Íris54 Flácida Intraoperatória
Durante uma operação nos olhos55 por turvação do cristalino56 (catarata57), a pupila (círculo preto no meio do olho58) pode não aumentar de tamanho conforme necessário. Além disso, durante a cirurgia, a íris54 (parte colorida do olho58) pode se tornar flácida, provocando danos nos olhos55. Informe seu médico que você está fazendo o uso deste medicamento, caso esteja planejando uma operação nos olhos55.
Pacientes com comprometimento renal59
Para pacientes60 com comprometimento renal59 leve, recomenda-se que a iniciação de Invega® SustennaTM seja com a dose de 100 mg no dia 1 do tratamento e 75 mg uma semana depois, ambas administradas no músculo deltoide61. Depois, serão administradas injeções mensais de 50 mg no músculo deltoide61 ou no músculo glúteo.
Não se recomenda o uso de Invega® SustennaTM em pacientes com comprometimento renal59 moderado ou grave.
Efeitos sobre a capacidade de dirigir veículos e utilizar máquinas
Invega® SustennaTM pode interferir com as atividades que requerem estado de alerta mental e pode ter efeitos visuais. Portanto, os pacientes devem ser aconselhados a não dirigir nem operar máquinas até a sua sensibilidade individual ser conhecida.
Durante o tratamento, o paciente não deve dirigir veículos ou operar máquinas, pois sua habilidade e atenção podem estar prejudicadas.
Gravidez62 e Amamentação63
Gravidez62
A segurança do palmitato de paliperidona administrado por via intramuscular ou da paliperidona por via oral para uso durante a gravidez62 humana ainda não foi estabelecida. Nenhum efeito teratogênico64 foi observado nos estudo em animais. Os animais de laboratório tratados com dose elevada da paliperidona oral demonstraram discreto aumento dos óbitos fetais. Os parâmetros da gravidez62 não foram afetados em ratos que receberam por via intramuscular o palmitato de paliperidona. As doses elevadas foram tóxicas às mães. Os filhotes não foram afetados nas exposições orais 20 a 22 vezes a exposição humana máxima ou nas exposições intramusculares 6 vezes a exposição humana máxima.
Recém-nascidos expostos a medicamentos antipsicóticos (incluindo paliperidona) durante o terceiro trimestre de gravidez62 correm o risco de apresentar sintomas3 extrapiramidais e/ou de retirada, que podem variar em gravidade após o parto. Estes sintomas3 em recém-nascidos podem incluir agitação, hipertonia65, hipotonia66, tremor, sonolência, dificuldade respiratória ou transtornos alimentares.
Invega® SustennaTM só deve ser usado durante a gravidez62 se os benefícios superarem os riscos. O efeito de Invega® SustennaTM sobre o trabalho de parto e o parto em humanos é desconhecido.
Amamentação63
Em estudos em animais com a paliperidona e em estudos em humanos com a risperidona, a paliperidona foi excretada no leite. Portanto, as mulheres que estão recebendo Invega® SustennaTM não devem amamentar.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Interações Medicamentosas
Deve-se ter cautela ao prescrever Invega® SustennaTM com medicamentos conhecidos por prolongar o intervalo QT.
Como o palmitato de paliperidona é hidrolizado à paliperidona, os resultados dos estudos com a paliperidona oral devem ser levados em consideração ao avaliar o potencial de interação medicamentosa.
Potencial de Invega® SustennaTM afetar outros medicamentos
Devido aos efeitos primários da paliperidona sobre o SNC67, Invega® SustennaTM deve ser usado com cautela em combinação a outros medicamentos de ação central e ao álcool. A paliperidona pode antagonizar o efeito da levodopa e de outros agonistas dopaminérgicos.
Devido ao seu potencial de indução da hipotensão23 ortostática, pode ser observado efeito aditivo ao administrar Invega® SustennaTM com outros agentes terapêuticos que apresentam esse potencial.
Potencial para outros medicamentos afetarem Invega® SustennaTM
A administração concomitante da paliperidona oral de liberação prolongada uma vez por dia com carbamazepina 200 mg duas vezes por dia provocou a redução de aproximadamente 37% da Cmáx e da AUC68 médias no estado de equilíbrio da paliperidona.
Com a iniciação da carbamazepina, a dose de Invega® SustennaTM deve ser reavaliada e aumentada, se necessário. Por outro lado, com a descontinuação da carbamazepina, a dose de Invega® SustennaTM deve ser reavaliada e diminuída, se necessário.
A administração concomitante 12 mg de paliperidona oral de liberação prolongada uma vez por dia e comprimidos de liberação prolongada de divalproato de sódio (dois comprimidos de 500 mg uma vez ao dia) provocou um aumento de aproximadamente 50% no Cmáx e AUC68 de paliperidona. Como não foi observado nenhum efeito significativo na eliminação, não é esperada uma interação clinicamente significativa entre comprimidos de liberação prolongada de divalproato de sódio e injeção intramuscular69 de Invega® SustennaTM. Esta interação não foi estudada com Invega® SustennaTM.
Uso concomitante de Invega® SustennaTM com a risperidona
O uso concomitante de Invega® SustennaTM com a risperidona ainda não foi estudado. Como a paliperidona é um metabólito8 ativo da risperidona, deve-se levar em consideração a exposição aditiva à paliperidona se a risperidona for administrada concomitantemente a Invega® SustennaTM.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde70.
ONDE, COMO E POR QUANTO TEMPO POSSO GUARDAR ESTE MEDICAMENTO?
Você deve conservar a embalagem de Invega® SustennaTM em temperatura ambiente (entre 15°C e 30°C).
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Aspecto Físico
Suspensão de liberação prolongada em seringas preenchidas. A suspensão é branca a quase branca.
Antes de usar, observe o aspecto do medicamento.
Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
COMO DEVO USAR ESTE MEDICAMENTO?
O Invega® SustennaTM não deve ser misturado a nenhum outro produto ou diluente e destina-se à administração intramuscular diretamente da seringa71 em que está embalado.
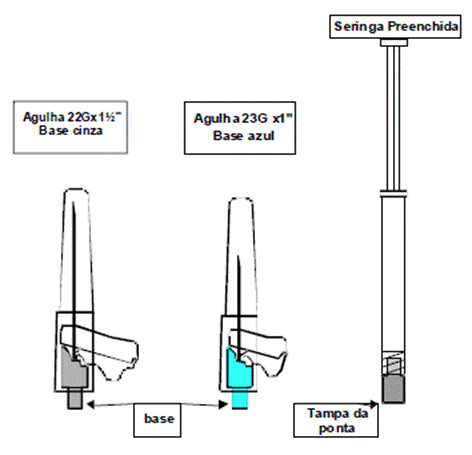
O kit contém uma seringa71 preenchida e 2 agulhas de segurança (uma agulha 22G de 1½ polegada e uma agulha 23G de 1 polegada) para administração intramuscular.
Invega® SustennaTM destina-se exclusivamente para uso único.
1. Agitar a seringa71 vigorosamente por, no mínimo, 10 segundos para obter uma suspensão homogênea.

2. Escolher a agulha adequada.
Para aplicação no DELTOIDE61, se o paciente pesa < 90 kg (< 200 lb), usar a agulha 23G de 1 polegada (agulha com base azul); se o paciente pesa 90 kg ( 200 lb), usar a agulha 22G de 1½ polegada (agulha com base cinza).
Para aplicação no GLÚTEO, usar a agulha 22G de 1½ polegada (agulha com base cinza).
3. Segurando a seringa71 voltada para cima, remover a tampa de ponta de borracha fazendo um movimento giratório simples no sentido horário.
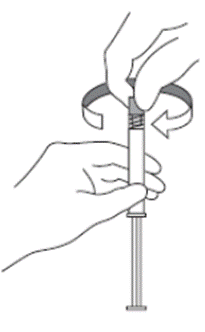
4. Abrir a embalagem da agulha de segurança até a metade. Segurar a tampa da agulha por cima da embalagem plástica. Acoplar a agulha de segurança à conexão luer da seringa71 com um movimento giratório simples no sentido horário.
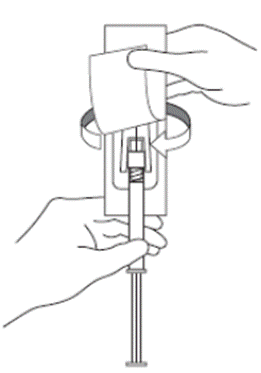
5. Retirar a tampa da agulha puxando-a no sentido vertical. Não girar a tampa pois a agulha pode se soltar da seringa71.
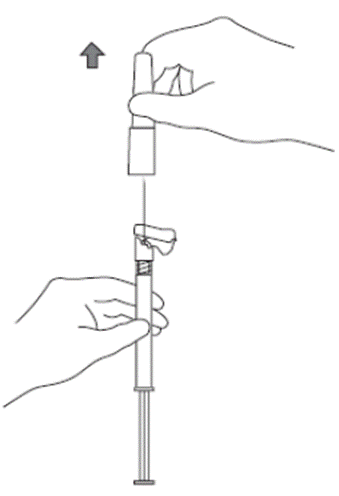
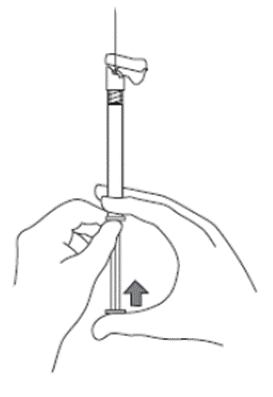
6. Colocar a seringa71 com a agulha acoplada na posição vertical para cima para retirar o ar. Retirar o ar da seringa71 empurrando cuidadosamente o êmbolo72 para cima.
7. Injetar todo o conteúdo por via intramuscular no músculo deltoide61 ou no músculo glúteo escolhido do paciente. Não administrar por via intravenosa ou subcutânea73.
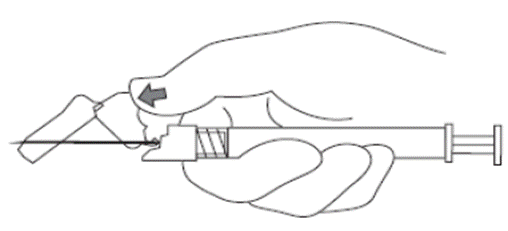
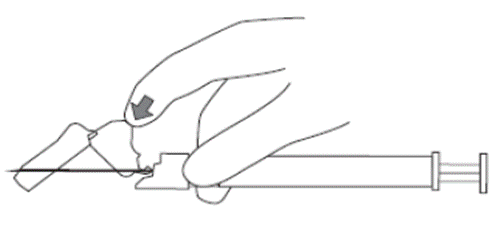
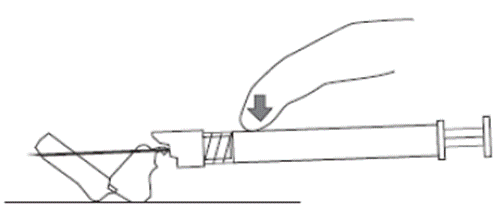
8. Após o término da injeção7, usar o polegar ou o indicador de uma das mãos74 (8a, 8b) ou uma superfície plana (8c) para ativar o sistema de proteção da agulha. O sistema de proteção da agulha é ativado por completo quando se ouve um ‘clique’. Descartar a seringa71 com a agulha adequadamente.
8a
8b
8c
Dosagem e Como Usar
Para os pacientes que nunca tomaram a paliperidona oral ou a risperidona oral ou injetável, recomenda-se estabelecer a tolerabilidade com a paliperidona oral ou a risperidona oral antes de iniciar o tratamento com Invega® SustennaTM.
A dose inicial recomendada é de 150 mg no dia 1 de tratamento e 100 mg uma semana depois, ambos administrados no músculo deltoide61. A dose mensal subsequente recomendada é de 75 mg; essa dose pode ser aumentada ou diminuída no intervalo de 25 a 150 mg com base na tolerabilidade e/ou na eficácia do paciente em particular. Após a segunda dose, as doses mensais podem ser administradas no músculo deltoide61 ou no músculo glúteo.
O ajuste da dose de manutenção pode ser feito mensalmente. Ao se fazer o ajuste da dose, as características de liberação prolongada do Invega® SustennaTM devem ser consideradas, uma vez que o efeito completo do ajuste da dose pode não ser evidente por vários meses.
Invega® SustennaTM é formulado como uma suspensão aquosa de ação prolongada para injeção intramuscular69 (equivalente a 100mg/mL) para liberar o palmitato de paliperidona de uma maneira controlada, iniciando no dia 1 e durando por pelo menos 4 meses. A partir da injeção7, inicialmente a taxa de absorção aumenta razoavelmente rápido, subsequentemente atingindo uma fase de influxo mais ou menos constante (até 1 a 2% da dose/dia) por aproximadamente 2 semanas, e declinando uniformemente depois disso.
Troca para outros agentes antipsicóticos
Não existem dados sistematicamente coletados que discutam especificamente a troca de antipsicóticos em pacientes esquizofrênicos para Invega® SustennaTM ou sobre a administração concomitante com outros antipsicóticos. Os antipsicóticos orais prévios podem ser descontinuados na ocasião da iniciação do tratamento com Invega® SustennaTM. Os pacientes que tomam antipsicóticos injetáveis de ação prolongada (exceto RISPERDAL® CONSTA®) podem ser iniciados com Invega® SustennaTM na próxima injeção7 programada de acordo com as recomendações posológicas acima.
Os pacientes atualmente sendo tratados com RISPERDAL® CONSTA® devem ser iniciados com Invega® SustennaTM um mês após a última injeção7 de RISPERDAL® CONSTA® de acordo com a tabela a seguir:

Doses acima ou abaixo da iniciação recomendada podem ser consideradas para pacientes60 com base em fatores individuais. Após o dia 8, as doses mensais subsequentes devem então prosseguir conforme descrito acima, ou seja, aumentada ou diminuída no intervalo de 25 mg a 150 mg com base na tolerabilidade e/ou na eficácia de cada paciente.
Se o Invega® SustennaTM for descontinuado, as suas características de liberação prolongada devem ser consideradas. Conforme recomendado com outros antipsicóticos, a necessidade do uso de medicação para o tratamento de sintomas3 extrapiramidais (SEP) deve ser periodicamente reavaliada.
Informações de administração
Invega® SustennaTM destina-se exclusivamente ao uso intramuscular. Deve ser injetado lenta e profundamente no músculo. Deve-se ter cuidado para evitar a administração inadvertida em um vaso sanguíneo. As injeções devem ser administradas por um profissional de saúde70. A administração deve ser feita em injeção7 única. Não administrar a dose em injeções divididas. Não administrar o medicamento por via intravascular75 ou subcutânea73.
O tamanho de agulha recomendado para a administração do Invega® SustennaTM no músculo deltoide61 é determinado pelo peso do paciente. Para pacientes60 90 kg ( 200 lb), recomenda-se a agulha 22G de 1½ polegada. Para pacientes60 < 90 kg (< 200 lb), recomenda-se a agulha 23G de 1 polegada. As administrações no músculo deltoide61 devem ser alternadas entre os dois músculos76 deltoides.
O tamanho de agulha recomendado para a administração do Invega® SustennaTM no músculo glúteo é de 22G de 1½ polegada. A administração deve ser feita no quadrante externo superior da região glútea77.
As injeções no músculo glúteo devem ser alternadas entre os dois músculos76 glúteos78.
O uso concomitante de Invega® SustennaTM com a paliperidona oral ou a risperidona oral ou injetável ainda não foi estudado. Como a paliperidona é o principal metabólito8 ativo da risperidona, deve-se considerar a exposição aditiva à paliperidona se qualquer desses medicamentos for administrado concomitantemente a Invega® SustennaTM.
Pacientes com comprometimento hepático
Invega® SustennaTM ainda não foi estudado em pacientes com comprometimento hepático. Com base em um estudo com a paliperidona oral, nenhum ajuste de dose é necessário em pacientes com comprometimento hepático leve ou moderado. A paliperidona ainda não foi estudada em pacientes com comprometimento hepático grave.
Pacientes com comprometimento renal59
Invega® SustennaTM ainda não foi sistematicamente estudado em pacientes com comprometimento renal59. Para pacientes60 com comprometimento renal59 leve (depuração de creatinina79 ≥ 50 a < 80 mL/min), recomenda-se que a iniciação de Invega® SustennaTM seja com a dose de 100 mg no dia 1 do tratamento e 75 mg uma semana depois, ambas administradas no músculo deltoide61. Depois, serão administradas injeções mensais de 50 mg no músculo deltoide61 ou no músculo glúteo.
Não se recomenda o uso de Invega® SustennaTM em pacientes com comprometimento renal59 moderado ou grave (depuração de creatinina79 < 50 mL/min).
Idosos
Em geral, a posologia recomendada do Invega® SustennaTM para pacientes60 idosos com função renal59 normal é a mesma utilizada para pacientes60 adultos mais jovens com função renal59 normal. Como os pacientes idosos podem apresentar função renal59 reduzida, veja acima “Pacientes com comprometimento renal” para recomendações posológicas em pacientes com comprometimento renal59).
Adolescentes e crianças
A segurança e a eficácia de Invega® SustennaTM em pacientes < 18 anos ainda não foram estudadas.
Outras populações especiais
Não se recomenda o ajuste da dose de Invega® SustennaTM com base em sexo, raça ou status de fumante.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento.
Não interrompa o tratamento sem o conhecimento do seu médico.
O QUE DEVO FAZER QUANDO EU ME ESQUECER DE USAR ESTE MEDICAMENTO?
Doses não administradas. Evitar falhas na continuidade da administração. Recomenda-se que a segunda dose de iniciação do tratamento com Invega® SustennaTM seja administrada uma semana após a primeira aplicação, com tolerância de até dois dias antes ou após o dia estabelecido. Da mesma forma, recomenda-se que a terceira e subsequentes aplicações após o início do tratamento sejam administradas mensalmente, com uma tolerância de sete dias antes ou após o dia previamente estabelecido para aplicação.
- Dose não administrada (1 mês a 6 semanas). Após a iniciação, o ciclo de administração recomendado para Invega® SustennaTM é mensal. Se menos de 6 semanas tiverem passado desde a última administração, a dose previamente estabilizada deve ser administrada assim que possível, seguida de administrações em intervalos mensais.
- Dose não administrada (> 6 semanas a 6 meses). Se mais de 6 semanas tiverem passado desde a última administração do Invega® SustennaTM, administrar a mesma dose que o paciente estava previamente estabilizado da seguinte maneira: 1) injeção7 no deltoide61 assim que possível, seguida de 2) outra injeção7 no deltoide61 (mesma dose) uma semana depois e 3) retomada da administração no músculo deltoide61 ou no glúteo em intervalos mensais.
- Dose não administrada (> 6 meses). Se mais de 6 meses tiverem passado desde a última administração do Invega® SustennaTM, iniciar a administração conforme descrito no item “COMO DEVO USAR ESTE MEDICAMENTO?”.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
QUAIS OS MALES QUE ESTE MEDICAMENTO PODE ME CAUSAR?
As reações adversas a medicamentos (RAMs) relatadas por 2% dos pacientes com esquizofrenia1 tratados com Invega® SustennaTM em estudos clínicos são: infecção43 do trato respiratório superior, agitação, insônia, ansiedade, parkinsonismo, pesadelo, inquietação, tontura80, sintomas3 extrapiramidais, dor de cabeça81, sonolência/sedação82, aumento da pressão sanguínea, desconforto abdominal, dor abdominal superior, prisão de ventre, diarreia83, boca84 seca, náusea85, dor de dentre, vômitos86, dor em extremidade, dor musculoesquelética, fraqueza muscular, fadiga87, dor no local da administração, prurido88, nódulo89 e endurecimento, aumento do peso.
As reações adversas a medicamentos (RAMs) relatadas por < 2% dos pacientes com esquizofrenia1 tratados com Invega® SustennaTM em estudos clínicos são: acarodermatite (erupção90 cutânea91 causada por ácaros), bronquite, celulite92 (erupção90 bacteriana no tecido subcutâneo93), infecção43 de ouvido, infecção43 no olho58, gripe94, onicomicose95 (infecção43 nas unhas96 causada por fungos) pneumonia97, infecção43 no trato respiratório, sinusite98, abscesso99 cutâneo100, tonsilite, infecção43 no trato urinário101, neutropenia38 (redução do número de neutrófilos44 circulantes), contagem reduzida de células brancas do sangue40, reação alérgica102, anorexia103, aumento do colesterol104 e triglicérides105 do sangue106, diminuição e aumento de apetite, hiperglicemia18, polidipsia107 (sede em demasia), diminuição do peso, depressão, transtorno do sono, transtorno do equilíbrio, acidente vascular cerebral108 (AVC), convulsão31, distúrbios de atenção, tontura80 postural, disartria109 (incapacidade de articular as palavras), discinesia (movimentos involuntários anormais), distonia110 (espasmos111 musculares involuntários), hipoestesia112, (diminuição da sensibilidade), parestesia113 (sensações cutâneas114 subjetivas), hiperatividade psicomotora115, síncope116, discinesia tardia13, tremor, olhos55 secos, crise oculógira, aumento do lacrimejamento, hiperemia117 ocular (aumento do sangue106 circulante nos olhos55), visão118 turva, dor de ouvido, vertigem119, bloqueio atrioventricular, bradicardia120, transtorno de condução, eletrocardiograma121 anormal, eletrocardiograma121 com QT prolongado, palpitações122, síndrome9 de taquicardia123 postural ortostática, arritmia124 sinual, taquicardia123, hipotensão23 ortostática, tosse, dispneia125 (falta de ar), epistaxe126 (hemorragia127 nasal), congestão nasal, dor na faringe128/laringe129, congestão pulmonar, congestão do trato respiratório, chiado, dispepsia130 (indigestão), disfagia131 (dificuldade de deglutição132), incontinência fecal133, flatulência, gastroenterite134, inchaço135 na língua14, aumento da gama-glutamiltransferase (enzima136 encontrada nas células45 do fígado137), aumento das enzimas do fígado137, aumento das transaminases, acne138, pele139 seca, eczema140 (infecção43 da pele139), eritema141 (vermelhidão), hiperqueratose142 (endurecimento da pele139 devido ao excesso de queratina), coceira, erupção90 cutânea91, urticária143, dor nas articulações144, dor nas costas145 e no pescoço146, rigidez das articulações144, espasmos111 musculares, dificuldade para urinar, aumento da frequência urinária, incontinência urinária147, ausência de menstruação148, transtorno da ejaculação149, disfunção erétil, galactorreia150 (produção de leite fora do período de amamentação63), ginecomastia151 (aumento das mamas152 nos homens), disfunção sexual, secreção vaginal, desconforto no peito153, calafrios154, edema155 de face15, marcha anormal, endurecimento, mal-estar, edema155, pirexia156 (elevação da temperatura do corpo), sede, queda.
As reações adversas a medicamentos (RAMs) relatadas com paliperidona e/ou risperidona em outros estudos clínicos mas não relatadas por pacientes tratados com Invega® SustennaTM são: cistite157, anemia158, contagem aumentada de eosinófilos159 (células45 de defesa do organismo), redução do hematócrito160 (porcentagem ocupada pelos glóbulos vermelhos no volume total de sangue106), reação anafilática161, glicose21 presente na urina162, hiperprolactinemia (excesso de produção de prolactina163), hiperinsulinemia164, anorgasmia165 (dificuldade de atingir o orgasmo), embotamento49 afetivo, estado confunsional, redução da libido166, transtorno vascular28 cerebral, coordenação anormal, nível reduzido de consciência, coma167 diabético, instabilidade da cabeça81, perda da consciência, síndorme neuroléptica maligna, ausência de resposta a estímulos, conjuntivite168, transtorno do movimento dos olhos55, glaucoma169, fotofobia170, zumbido, rubor, hipotensão23, isquemia26, dispneia125 (falta de ar), hiperventilação, pneumonia97 por aspiração, estertores, queilite (inflamação171 nos lábios), fecaloma (endurecimento das fezes), obstrução intestinal, erupção90 medicamentosa, dermatite seborreica172, descoloração da pele139, aumento da creatinafosfoquinase, fraqueza muscular, postura anormal, rabdomiólise11 (destruição muscular), secreção das mamas152, desconforto das mamas152, ingurgitamento das mamas152, aumento das mamas152, transtorno da menstruação148, atraso da menstruação148, diminuição e aumento da temperatura corpórea, síndrome9 de retirada do medicamento.
Dados de pós-comercialização
As primeiras reações adversas a medicamentos (RAMs) identificadas durante o período pós-comercialização com paliperidona e/ou risperidona estão classificados a seguir por categoria de frequência estimada a partir de taxas de relatos espontâneos:
Reação muito rara (ocorre em menos de 0,01% dos pacientes que utilizam este medicamento, incluindo relatos isolados): agranulocitose39 (ausência ou redução de granulócitos173), trombocitopenia174 (redução do número de plaquetas175), diabetes mellitus19, cetoacidose diabética176, hipoglicemia177, mania, disgeusia178 (alteração do paladar179), fibrilação atrial, trombose venosa profunda180, embolia181 pulmonar, síndrome9 da apneia182 do sono, pancreatite183, falta de movimentos da musculatura intestinal, ocasionando obstrução, alopécia184 (redução ou perda de pelos e cabelos), retenção urinária185, síndrome9 neonatal de retirada do medicamento, priapismo50 (ereção51 peniana prolongada e persistente), hipotermia186, abscesso99, celulite92 e hematoma187 no local da injeção7.
Mesmo em pacientes com tolerância prévia à risperidona oral ou paliperidona oral, muito raramente ocorreram reações alérgicas após administração de Invega® SustennaTM. Procure orientações médicas imediatamente caso apresente erupção90 cutânea91, inchaço135 na garganta188, coceira ou dificuldade em respirar, pois podem ser sintomas3 de reações alérgicas graves.
Reação rara (ocorre entre 0,01% e 0,1% dos pacientes que utilizam este medicamento):
Angioedema189.
Reação de frequência desconhecida: secreção inapropriada do hormônio190 antidiurético, intoxicação por água, icterícia191, cisto, necrose192 e úlcera193 no local de injeção7, Síndrome9 de Íris54 Flácida Intraoperatória (IFIS) (uma condição que pode ocorrer durante a cirurgia de catarata57 em pacientes que utilizaram Invega® SustennaTM nos últimos três meses).
Caso necessite passar por cirurgia de catarata57, informe seu oftalmologista194 caso tenha utilizado Invega® SustennaTM nos últimos três meses.
Informe ao seu médico, cirurgião-dentista ou farmacêutico o aparecimento de reações indesejáveis pelo uso do medicamento. Informe também à empresa através do seu serviço de atendimento.
Atenção: este produto é um medicamento novo e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos. Nesse caso, informe seu médico ou cirurgião-dentista.
O QUE FAZER SE ALGUÉM USAR UMA QUANTIDADE MAIOR DO QUE A INDICADA DESTE MEDICAMENTO?
Como o Invega® SustennaTM deve ser administrado por profissionais de saúde70, o potencial para superdosagem pelos pacientes é baixo.
Sintomas3
Em geral, os sinais10 e sintomas3 previstos são os resultantes da exacerbação dos efeitos farmacológicos conhecidos da paliperidona, ou seja, sonolência e sedação82, taquicardia123 e hipotensão23, prolongamento do QT e sintomas3 extrapiramidais. Foram relatados Torsade de Pointes e fibrilação ventricular em casos de superdose com paliperidona oral. No caso de superdosagem aguda, a possibilidade de envolvimento de múltiplos medicamentos deve ser considerada.
Tratamento
Deve-se considerar a natureza de liberação prolongada do Invega® SustennaTM e a meia-vida aparente longa da paliperidona quando se avalia as necessidades de tratamento e a recuperação. Não há antídoto195 específico para a paliperidona. Medidas de suporte geral devem ser utilizadas. Estabelecer e manter uma via aérea patente e garantir oxigenação e ventilação196 adequadas. Monitoração cardiovascular deve ser iniciada imediatamente e deve incluir a monitoração eletrocardiográfica contínua de possíveis arritmias16. Hipotensão23 e colapso197 circulatório devem ser tratados com condutas adequadas, como soluções intravenosas e/ou agentes simpatomiméticos. No caso de sintomas3 extrapiramidais graves, agentes anticolinérgicos devem ser administrados. Supervisão e monitoração rigorosa devem continuar até a recuperação do paciente.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível.
Ligue para 0800 722 6001, se você precisar de mais orientações.


