
INDICAÇÕES INFLUVAC
Esta vacina1 é destinada à prevenção da gripe2 (influenza3), especialmente para aqueles que têm risco aumentado de complicações pela gripe2.
A vacinação é particularmente recomendada para as seguintes categorias de pacientes, dependendo da política nacional de imunização4:
- Adultos com idade acima de 65 anos, independentemente do estado de saúde5;
- Adultos e crianças com doenças crônicas dos sistemas respiratório e/ou cardiovascular, incluindo asma6;
- Adultos e crianças com disfunção renal7 crônica;
- Adultos e crianças com doença metabólica crônica, como diabetes mellitus8;
- Adultos e crianças com imunodeficiências devido à doença ou em tratamento com medicamentos imunossupressores, como por exemplo: citostáticos9, corticosteroides ou radioterapia10;
- Crianças e adolescentes (6 meses – 18 anos) em tratamento com medicamentos que contenham ácido acetilsalicílico por período prolongado e, consequentemente, com risco aumentado de Síndrome11 de Reye após uma infecção12 por influenza3.
- RESULTADOS DE EFICÁCIA
A imunidade13 conferida pela vacina1 na temporada de 2015 desenvolveu-se após 21 dias da vacinação. Os títulos máximos de anticorpos14 diminuem gradativamente e, devido à característica mutante do vírus15 influenza3, recomenda-se que a vacinação seja anual e durante os meses de outono para que se possa obter máximo potencial imunogênico durante o inverno, quando a circulação16 do vírus15 influenza3 é maior.
Estudo clínico conduzido com as cepas17 presentes na vacina1 influenza3 A(H3N2), A(H1N1) e B, avaliou 120 pacientes adultos divididos em dois grupos, 60 pacientes entre ≥ 18 e ≤ 60 anos e 60 idosos com ≥ 61 anos de idade. Os resultados de eficácia analisados no 22º dia após a vacinação, demostraram as seguintes taxas de soroproteção por grupo de pacientes analisados:
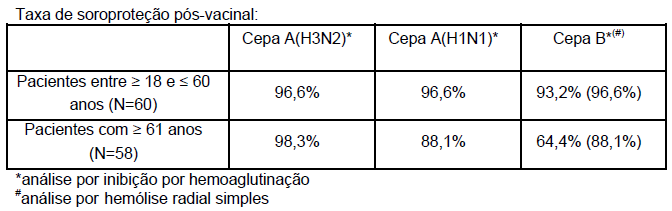
Os resultados deste estudo indicaram que a vacina1 influenza3 da temporada de 2015 induziu uma reposta de anticorpos14 adequada na população estudada, cumprindo com o requerimento do Comitê Europeu de Produtos Médicos para uso Humano (CHMP Committee for Medicinal Products for Human Use) para a imunogenicidade da vacina1 influenza3, para ambos os grupos de idade. A vacina1 influenza3 foi segura e bem tolerada neste estudo.
Com os resultados do estudo anual descrito acima1 e com resultados de estudos clínicos realizados durante 30 anos de comercialização da vacina2 é possível concluir que esta vacina1 encontra todos os critérios de imunogenicidade, estabelecidos pelo EU CHMP e a segurança desta vacina1 nesses estudos está de acordo com as informações descritas nesta bula.
Referências Bibliográficas
1. Dados não publicados: Investigador: Dr. M. Arya Immunogenicity, Reactogenicity and Safety of the Trivalent Influenza3 Subunit Vaccine Influvac for the Southern Hemisphere Season 2015. An Open-Label, Baseline-Controlled Study in Two Age Groups: Adult Subjects ≥ 18 and ≤ 60 Years and Elderly Subjects ≥ 61 Years of Age.
2. S.V. van de Witte, J. Nauta, K.M. Giezeman-Smits, J.M. de Voogd. Trivalent inactivated subunit influenza3 vaccine Influvac: 30-year experience of safety and immunogenicity. Trials in Vaccinology 1 (2012) 42- 48.
- CARACTERÍSTICAS FARMACOLÓGICAS
A vacina1 influenza3 (inativada, subunitária) é utilizada na prevenção da gripe2. A vacina1 influenza3 (inativada, subunitária) contém antígenos18 de superfície hemaglutinina e neuraminidase; 0,5 mL da vacina1 por injeção19 contêm 15 microgramas do antígeno20 hemaglutinina de cada cepa21 de vírus15 recomendada pela OMS para cada temporada. Os antígenos18 estimulam a produção dos anticorpos14 contra a cepa21 do vírus15 influenza3 especificada, prevenindo a gripe2 especialmente naqueles indivíduos que tenham risco aumentado de complicações associadas à gripe2. A imunidade13 é geralmente obtida em 2 a 3 semanas após a vacinação. A duração da imunidade13 pós-vacinação para a cepa21 homóloga ou cepas17 intimamente relacionadas às cepas17 da vacina1 varia, mas é usualmente de 6 a 12 meses.


