Feiba
SHIRE FARMACÊUTICA BRASIL LTDA.
IDENTIFICAÇÃO DO MEDICAMENTO
FEIBA®
complexo protrombínico parcialmente ativado
APRESENTAÇÕES
FEIBA
complexo protrombínico parcialmente ativado 500 U
- Frasco-ampola contendo 500 unidades de FEIBA, liofilizado1;
- Frasco-ampola contendo 10 mL de diluente (água para injetáveis).
- Conjunto de reconstituição e infusão.
FEIBA
complexo protrombínico parcialmente ativado 500 U
- Frasco-ampola contendo 500 unidades de FEIBA, liofilizado1;
- Frasco-ampola contendo 20 mL de diluente (água para injetáveis).
- Conjunto de reconstituição e infusão.
FEIBA
complexo protrombínico parcialmente ativado 1.000 U
- Frasco-ampola contendo 1.000 unidades de FEIBA, liofilizado1;
- Frasco-ampola contendo 20 mL de diluente (água para injetáveis).
- Conjunto de reconstituição e infusão.
FEIBA
complexo protrombínico parcialmente ativado 2.500 U
- Frasco-ampola contendo 2.500 unidades de FEIBA, liofilizado1;
- Frasco-ampola contendo 50 mL de diluente (água para injetáveis).
- Conjunto de reconstituição e infusão.
FEIBA
complexo protrombínico parcialmente ativado 500 U
- Frasco-ampola contendo 500 unidades de FEIBA, liofilizado1;
- Frasco-ampola contendo 10 mL de diluente (água para injetáveis).
- Dispositivo de reconstituição (Baxject II Hi-Flow) e conjunto de infusão.
FEIBA
complexo protrombínico parcialmente ativado 500 U
- Frasco-ampola contendo 500 unidades de FEIBA, liofilizado1;
- Frasco-ampola contendo 20 mL de diluente (água para injetáveis).
- Dispositivo de reconstituição (Baxject II Hi-Flow) e conjunto de infusão.
FEIBA
complexo protrombínico parcialmente ativado 1.000 U
- Frasco-ampola contendo 1.000 unidades de FEIBA, liofilizado1;
- Frasco-ampola contendo 20 mL de diluente (água para injetáveis).
- Dispositivo de reconstituição (Baxject II Hi-Flow) e conjunto de infusão.
FEIBA
complexo protrombínico parcialmente ativado 2.500 U
- Frasco-ampola contendo 2.500 unidades de FEIBA, liofilizado1;
- Frasco-ampola contendo 50 mL de diluente (água para injetáveis).
- Dispositivo de reconstituição (Baxject II Hi-Flow) e conjunto de infusão.
VIA INTRAVENOSA
USO ADULTO E PEDIÁTRICO
COMPOSIÇÃO
Cada frasco de FEIBA - complexo protrombínico parcialmente ativado, após conveniente reconstituição do pó liofilizado1, utilizando todo o volume do diluente contido nas respectivas embalagens contém na solução obtida, pronta para uso, a seguinte composição:
|
|
500 U* |
500 U* |
1000 U* |
2500 U* |
|
complexo protrombínico parcialmente ativado |
500 U |
500 U |
1000 U |
2500 U |
|
concentração do complexo protrombínico parcialmente ativado |
25 U/mL |
50 U/mL |
50 U/mL |
50 U/mL |
|
água para injetáveis |
20 mL |
10 mL |
20 mL |
50 mL |
Excipientes: citrato de sódio di-hidratado, cloreto de sódio e água para injetáveis.
* Uma solução contendo 1 unidade de FEIBA reduz o Tempo de Tromboplastina2 Parcial ativado (TTPa), de um Plasma3 com Inibidor de Fator VIII, a 50% do valor de referência (branco).
FEIBA contém os fatores II, IX e X principalmente na forma não ativada bem como o fator VII ativado; o antígeno4 coagulante do fator VIII (F VIIIC:Ag) também se encontra presente numa concentração de até 0,1 U/1 U de FEIBA. Os fatores do sistema calicreína-cinina se encontram presentes somente em pequenas quantidades, ou até mesmo ausentes.
INFORMAÇÕES AO PACIENTE
PARA QUE ESTE MEDICAMENTO É INDICADO?
FEIBA é indicado para o tratamento e profilaxia de hemorragias5 em pacientes portadores de hemofilia6 A ou B com inibidores.
Além disso, FEIBA pode ser usado para o tratamento e profilaxia de hemorragias5 em pacientes não hemofílicos que desenvolveram inibidores para fatores VIII, IX e XI.
Existem relatos isolados sobre o uso de FEIBA no tratamento de pacientes com inibidores adquiridos para os fatores X e XIII.
FEIBA é utilizado também em combinação com o concentrado de fator VIII para uma terapia contínua de longo prazo, objetivando conseguir uma completa e permanente eliminação do inibidor do fator VIII, com o propósito de permitir o tratamento regular com concentrado de fator VIII, como ocorre em pacientes sem inibidor (imunotolerância).
COMO ESTE MEDICAMENTO FUNCIONA?
FEIBA é uma preparação feita de plasma3 humano que promove a hemostase, mesmo quando os fatores de coagulação7 individuais estão reduzidos ou ausentes.
QUANDO NÃO DEVO USAR ESTE MEDICAMENTO?
Nas situações apresentadas a seguir, FEIBA somente deve ser usado se, por exemplo, devido à presença de altos títulos de inibidor, a ausência de resposta ao tratamento com o concentrado de fator de coagulação7 adequado pode ser esperada.
- Se o paciente é alérgico (hipersensível) a qualquer um dos componentes do FEIBA;
- Se existir coagulação7 intravascular8 disseminada (CID).
(CID = coagulopatia de consumo, com risco de vida, em que ocorre a coagulação7 excessiva do sangue9 com a formação pronunciada de coágulos de sangue9 nos vasos sanguíneos10. Isto leva a um consumo dos fatores de coagulação7 em todo o corpo). - Nos casos de infarto do miocárdio11, trombose12 aguda e/ou embolia13, FEIBA só deve ser usado nos episódios de sangramento em que há risco de vida.
O QUE DEVO SABER ANTES DE USAR ESTE MEDICAMENTO?
Informe seu médico se você possui alguma alergia14 conhecida. Informe seu médico se você está em uma dieta com restrição de sódio.
Converse com seu médico antes de usar FEIBA, porque podem ocorrer reações de hipersensibilidade (alergia14), como é o caso com todos os produtos plasmáticos administrados por via intravenosa. Para reconhecer uma reação alérgica15 o mais rápido possível, você deve estar ciente dos potenciais sinais16 e sintomas17 de uma reação de hipersensibilidade (alergia14) tais como: eritema18 (vermelhidão da pele19), erupção20 cutânea21 (rash22), ocorrência de urticária23 na pele19, coceira em todo o corpo, inchaço24 nos lábios e língua25, dispneia26 (dificuldade respiratória), aperto no peito27, mal-estar geral, tonturas28, queda da pressão arterial29.
Outros sintomas17 de reações de hipersensibilidade a produtos derivados do plasma3 incluem letargia30 (sonolência) e inquietação.
Se você perceber um ou mais destes sintomas17, interrompa imediatamente a infusão e contate o seu médico. Os sintomas17 mencionados acima podem ser os primeiros indícios de um choque anafilático31. Sintomas17 graves requerem tratamento de emergência32 imediatamente.
Seu médico poderá usar novamente FEIBA em pacientes com suspeita de hipersensibilidade ao produto ou qualquer um de seus componentes, após análise cuidadosa do benefício esperado e do risco de reexposição e/ou se não for esperada uma reação com outra terapia preventiva ou agentes terapêuticos alternativos:
- Se você apresentar grandes mudanças na pressão arterial29 ou pulsação, dificuldade de respiração, tosse ou dor no peito27, interrompa a infusão imediatamente e contate o seu médico. O seu médico realizará o diagnóstico33 apropriado e iniciará medidas terapêuticas.
- Pacientes hemofílicos com inibidores ou pacientes com inibidores adquiridos de fatores de coagulação7, em tratamento com FEIBA, podem ter uma maior tendência a hemorragias5 e um aumento do risco de trombose12 ao mesmo tempo.
Há relatos de eventos trombóticos34 ou tromboembólicos, incluindo coagulopatia intravascular8 disseminada (CID), trombose12 venosa, embolia13 pulmonar, infarto do miocárdio11 e derrame35 durante o tratamento com FEIBA. O uso concomitante com fator VIIa recombinante aumenta o risco de desenvolver um evento tromboembólico. Alguns eventos tromboembólicos ocorreram em tratamentos com doses elevadas de FEIBA.
Quando os medicamentos são produzidos a partir do sangue9 ou plasma3 humano, determinadas medidas são adotadas para evitar transmissão de infecções36 aos pacientes. Estas incluem a seleção de doadores de sangue9 e plasma3 para garantir que os portadores de infecções36 sejam excluídos, e os testes em cada doação e pool de plasma3 para sinais16 de vírus37/infecções36. Os fabricantes destes produtos também incluem etapas de processamento do sangue9 e plasma3 para inativar ou remover vírus37. Apesar destas medidas, quando medicamentos produzidos a partir de sangue9 ou plasma3 humano são administrados, a possibilidade de transmissão de infecções36 não pode ser totalmente excluída. Isto também se aplica a vírus37 desconhecidos ou emergentes ou outros tipos de infecções36.
As medidas adotadas são consideradas eficazes para vírus37 encapsulados tais como o vírus37 da imunodeficiência38 humana (HIV39), o vírus37 da hepatite40 B e vírus37 da hepatite40 C, e para os vírus37 não encapsulados da hepatite40 A. As medidas adotadas podem ter eficácia limitada contra vírus37 não encapsulados como o parvovírus B19. Infecção41 pelo parvovírus B19 pode ser grave em mulheres grávidas (infecção41 fetal) e em indivíduos com sistema imune42 deprimido ou que tenham algum tipo de anemia43 (por exemplo, doença falciforme ou anemia hemolítica44).
Seu médico pode recomendar a vacinação contra hepatite40 A e B se você receber regularmente ou repetidamente produtos derivados do plasma3 humano.
Após a administração de altas doses do FEIBA, o aumento transitório de anticorpos45 de superfície da hepatite40 B transferidos passivamente pode resultar em interpretação enganosa de resultados positivos nos testes sorológicos.
A transmissão passiva de anticorpos45 contra antígenos46 de glóbulos vermelhos pode interferir em alguns testes sorológicos para anticorpos45 de células47 vermelhas, como o teste antiglobulina.
Recomenda-se fortemente que cada vez que o paciente receber uma dose de FEIBA o nome e o número de lote do produto sejam registrados de forma a manter o registro dos lotes utilizados.
Gravidez48, lactação49 e fertilidade
Seu médico irá decidir se você deve utilizar FEIBA durante a gravidez48 ou lactação49. Devido ao aumento do risco de trombose12 durante a gravidez48, FEIBA deve ser administrado apenas sob o acompanhamento médico cuidadoso e somente se for absolutamente necessário.
Informações sobre infecção41 pelo parvovírus B19 são encontradas no item 4 - O que devo saber antes de usar este medicamento?
Categoria “C” de risco na gravidez48.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Condução de veículos e utilização de máquinas
Não há sinais16 de que FEIBA possa afetar a capacidade de conduzir ou utilizar máquinas.
Informações sobre alguns componentes de FEIBA
O FEIBA contém aproximadamente 4 mg de sódio (calculado) por mL; isto é aproximadamente 40 mg de sódio para a apresentação 500 U, aproximadamente 80 mg de sódio para a apresentação 1000 U e aproximadamente 200 mg de sódio para a apresentação 2500 U. Isto deve ser levado em consideração em pacientes com restrição de sódio na dieta.
Interações medicamentosas
Informe seu médico ou farmacêutico se você estiver usando ou usou recentemente algum outro medicamento, incluindo os medicamentos obtidos sem prescrição médica.
Não há estudos adequados e controlados do uso combinado ou sequencial de FEIBA e fator VIIa ou antifibrinolíticos50 sendo conduzidos. Deve ser considerada a possibilidade de eventos trombóticos34 quando antifibrinolíticos50 sistêmicos51, como por exemplo, os ácidos tranexâmico ou aminocapróicos, são usados durante o tratamento com FEIBA. Por isso, antifibrinolíticos50 não devem ser utilizados por aproximadamente 6 a 12 horas após a administração de FEIBA.
Em casos de uso de rFVIIa concomitante, uma potencial interação medicamentosa não pode ser excluída de acordo com dados e observações clínicas disponíveis. Assim, FEIBA não deve ser misturado com outros medicamentos antes da administração, uma vez que a eficácia e a tolerância do medicamento podem ser prejudicadas. É aconselhável lavar o acesso venoso comum com solução salina fisiológica52 antes da administração de FEIBA.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento. Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde53.
ONDE, COMO E POR QUANTO TEMPO POSSO GUARDAR ESTE MEDICAMENTO?
FEIBA na forma liofilizada54 deve ser conservado sob refrigeração entre 2° C e 8° C. Proteger da luz. Não congelar.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original. Após preparo, a solução deve ser usada imediatamente.
FEIBA apresenta-se sob a forma de pó branco ou quase branco a verde pálido. O valor do pH da solução reconstituída está entre 6,8 a 7,6. O pó liofilizado1 e o diluente são acondicionados em frascos de vidro e são fechados com tampa de borracha.
Os medicamentos não devem ser eliminados na água residual ou lixo doméstico. Perguntar ao farmacêutico como desprezar o medicamento que não será mais utilizado. Estas medidas ajudarão a proteger o ambiente.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
COMO DEVO USAR ESTE MEDICAMENTO?
Reconstituir o pó liofilizado1 do FEIBA com o diluente que o acompanha e aplicar a solução por via intravenosa.
Use o FEIBA exatamente como seu médico explicou. Você deve consultar o seu médico ou farmacêutico se você não tiver certeza.
O médico deve determinar individualmente a dose e intervalos de aplicação do medicamento, levando em consideração a gravidade do distúrbio hemostático, sua localização e extensão, além do estado geral do paciente e a resposta ao medicamento. Não altere a dosagem estabelecida pelo médico e não interrompa a administração do medicamento sem orientação.
Informe seu médico se tiver a impressão de que o efeito de FEIBA está muito forte ou muito fraco. Aquecer o produto a temperatura ambiente antes da administração se necessário.
FEIBA deve ser reconstituído imediatamente antes da administração. A solução deve ser usada imediatamente (uma vez que o medicamento não contém conservantes).
Agitar suavemente até que todo o material seja dissolvido. Certificar-se de que FEIBA esteja completamente dissolvido, caso contrário, menos unidades de FEIBA passarão através do filtro do dispositivo.
Se a solução estiver turva ou apresentar depósitos, descartar de forma adequada. Não reutilizar embalagens abertas.
Usar somente água para injetáveis e o conjunto dispositivo para reconstituição fornecidos.
Não usar o produto se a sua barreira estéril for violada, se a embalagem estiver danificada ou se mostrar algum sinal55 de deterioração.
Todo material não utilizado ou resíduo deve ser descartado de acordo com os requerimentos da legislação local.
Reconstituição do pó para preparação de uma solução para infusão com agulhas
Usar técnicas assépticas durante todo o procedimento.
- Aquecer o frasco fechado contendo o diluente (água para injetáveis) à temperatura ambiente ou no máximo 37° C se necessário.
- Remover as tampas plásticas protetoras dos frascos do concentrado e do diluente (fig. A) e fazer assepsia56 das tampas de borracha de ambos os frascos.
- Remover a tampa protetora de uma extremidade da agulha de transferência fechada exercendo um movimento de torcer e puxar, removê-la e inserir a agulha exposta através da tampa de borracha do frasco do diluente (fig. B e C).
- Remover a tampa protetora da outra extremidade da agulha de transferência, tendo o cuidado de não tocar na extremidade exposta.
- Inverter o frasco de diluente sobre o frasco do concentrado e inserir a extremidade livre da agulha de transferência para dentro do frasco do concentrado (fig. D). O diluente será aspirado para dentro do frasco de concentrado por vácuo.
- Quando o diluente for transferido completamente para o frasco contendo pó, desconectar os dois frascos removendo a agulha de transferência do frasco do concentrado (fig. E). Agitar suavemente o frasco do concentrado para acelerar a dissolução.
- Ao se completar a reconstituição do pó, inserir a agulha de aeração (fig. F), e qualquer espuma que tenha se formado desaparecerá. Remover a agulha de aeração.
Infusão:
Usar técnicas assépticas durante todo o procedimento:
- Abrir uma extremidade da tampa protetora da agulha com filtro por torção57 removê-la e inserir a agulha na seringa58 descartável estéril (Fig. G).
- Desconectar a agulha de filtro da seringa58 e administrar lentamente a solução via intravenosa com o conjunto de infusão fechado (ou agulha descartável).

Reconstituição do pó para preparação da solução para infusão com Baxject II Hi-Flow:
- Aquecer o frasco fechado de diluente (água para injetáveis) a temperatura ambiente ou no máximo a 37°C se necessário, por exemplo, usando banho de água por alguns minutos.
- Remover a tampa protetora do frasco contendo pó e do frasco de diluente e desinfetar a tampa de borracha de ambos os frascos. Colocar os frascos sobre uma superfície plana.
- Abrir a embalagem do Baxject II Hi-Flow retirando a tampa de proteção sem tocar no conteúdo da embalagem (Fig. a). Não remover o sistema de transferência da embalagem neste momento.
- Virar a embalagem e inserir a ponta de plástico transparente na tampa de borracha do frasco do diluente (Fig. b). Agora remover a embalagem do Baxject II Hi-Flow (Fig.c). Não remover a tampa protetora azul do Baxject II Hi-Flow neste momento.
- Agora girar o sistema, que consiste do Baxject II Hi-Flow e o frasco de diluente, de tal maneira que o frasco de diluente fique na parte de cima. Pressionar a ponta roxa do Baxject II Hi-Flow no frasco de FEIBA. O diluente é extraído do frasco de FEIBA por vácuo (Fig. d).
- Agitar todo o sistema suavemente até que o pó esteja dissolvido. Certificar-se de que de que o FEIBA esteja completamente dissolvido, senão o material ativo ficará retido no filtro do sistema.
Fig. a
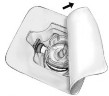
Fig. b

Fig. c

Fig. d

Infusão
Usar técnicas assépticas durante todo o procedimento.
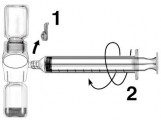
- Remover a tampa protetora azul do Baxject II Hi-Flow. Firmemente conectar a seringa58 no Baxject II Hi- Flow. NÃO RETIRAR O AR DE DENTRO DA SERINGA58 (Fig. e). A fim de garantir a conexão firme entre a seringa58 e Baxject II Hi-Flow, o uso de uma seringa58 luer lock é altamente recomendado (virar a seringa58 no sentido horário até a posição de parada durante a montagem).
- Inverter o sistema de modo que o produto dissolvido esteja na parte de cima. Passar o produto dissolvido dentro da seringa58 puxando lentamente o êmbolo59 para trás e garantir que a conexão firme entre Baxject II Hi-Flow e a seringa58 seja mantida durante todo o processo (Fig. f).
- Desconectar a seringa58.
- Se ocorrer a formação de espuma na seringa58, esperar até que a espuma desapareça. Administrar lentamente a solução por via intravenosa, com o conjunto de infusão fechado (ou agulha descartável).
Fig. e

Fig. f
Não exceder a velocidade de infusão de 2 unidades/FEIBA/kg de peso corpóreo por minuto.
Tratamento deve ser iniciado e monitorado por um médico com experiência no tratamento de distúrbios de coagulação7.
Posologia
A dosagem e a duração da terapia dependem da gravidade do distúrbio hemostático, da localização e extensão da hemorragia60 e da condição clínica do paciente.
A dose e frequência da administração devem ser sempre orientadas de maneira individualizada.
Como regra geral, recomenda-se uma dose de 50 a 100 U de FEIBA por kg de peso corpóreo, sem exceder a dose individual de 100 U/kg de peso corpóreo e a dose diária de 200 U/kg de peso corpóreo, a menos que a gravidade do sangramento justifique a utilização de doses maiores.
Devido aos fatores específicos do paciente, a resposta a um agente de bypass pode variar, e em uma determinada situação de sangramento, pacientes com resposta insuficiente a um agente podem responder a outro agente. Em caso de resposta insuficiente a um agente de bypass, deve ser considerado o uso de outro agente.
Pacientes pediátricos
A experiência em crianças menores de 6 anos de idade é limitada; o mesmo regime posológico dos adultos deve ser adaptado às condições clínicas da criança.
Hemorragias5 espontâneas
Hemorragia60 articular, muscular e de tecidos moles
Nos casos de hemorragias5 leves a moderadas, recomenda-se uma dose de 50 – 75 U/kg de peso corpóreo em intervalos de 12 horas. Deve-se dar continuidade ao tratamento até que haja sinais16 evidentes de melhoria clínica, tais como alívio da dor, redução da inflamação61 ou a melhora na mobilidade articular.
Nos casos de hemorragia60 muscular ou de tecido62 mole, de grande porte, tais como o sangramento retro peritoneal, recomendam-se doses de 100 U/kg de peso corpóreo em intervalos de 12 horas.
Hemorragia60 da membrana mucosa63
Recomenda-se uma dose de 50 U/kg de peso corpóreo administrada a cada 6 horas com monitoramento cuidadoso do paciente (controle visual da hemorragia60, medição repetida do hematócrito64). Se persistir a hemorragia60, a dose pode ser aumentada para 100 U/kg de peso corpóreo, tendo a cautela de não ultrapassar a dose máxima diária de 200 U/kg de peso corpóreo.
Outras hemorragias5 graves
Em hemorragias5 graves, tais como sangramentos de SNC65, recomenda-se uma dose de 100 U/kg de peso corpóreo em intervalos de 12 horas. Em casos individuais, pode-se administrar FEIBA em intervalos de 6 horas até que se alcance a melhora clínica evidente. (Não ultrapassar a dose máxima diária de 200 U/kg de peso corpóreo).
Cirurgia
Em intervenções cirúrgicas, pode ser administrada uma dose inicial de 100 U/kg de peso corpóreo no pré- operatório, e pode ser administrada dose adicional de 50 – 100 U/kg de peso corpóreo após 6 a 12 horas. Em manutenção de dose no pós-operatório, podem ser administrados 50 – 100 U/kg de peso corpóreo com 6 a 12 horas de intervalo; a dosagem, intervalo entre doses e duração da terapia no pré e pós-operatório são guiadas pela intervenção cirúrgica, condições gerais do paciente e eficácia clínica em cada caso individual. Não ultrapassar a dose máxima diária de 200 U/kg de peso corpóreo).
Profilaxia em pacientes com Hemofilia6 A com inibidores
Profilaxia de hemorragia60 em pacientes com inibidor de alto título e hemorragias5 frequentes após falha na indução de tolerância imunológica (ITI) ou quando uma ITI não é considerada: uma dose de 70-100U/kg de peso corpóreo a cada dois dias é recomendada. Se necessário, a dose deve ser aumentada para 100U/kg de peso corpóreo por dia ou pode ser diminuída gradualmente.
Profilaxia de hemorragias5 em pacientes com inibidor de alto título durante uma indução de imunotolerância (ITI): FEIBA deve ser administrado concomitantemente com a administração do fator VIII, em uma dosagem de 50 – 100U/kg de peso corpóreo, duas vezes por dia, até o título do inibidor do fator VIII diminuir para < 2 BU*
*1 unidade de Bethesda é definida como a quantidade de anticorpos45 que inibe 50% da atividade do fator VIII no plasma3 incubado (2h a 37°C).
Uso de FEIBA em grupos especiais de pacientes
Em combinação com concentrados de fator VIII, FEIBA também foi usado em terapia de longo prazo para alcançar a eliminação completa e permanente do inibidor de fator VIII.
QUAIS OS MALES QUE ESTE MEDICAMENTO PODE ME CAUSAR?
Como ocorre com todos os medicamentos, o uso de FEIBA pode causar eventos adversos, porém não são todos os pacientes que os apresentam.
Reações adversas comuns (pode afetar 1 em 10 indivíduos): hipersensibilidade, dor de cabeça66, tontura67, hipotensão68, rash22, anticorpos45 de superfície da Hepatite40 B positiva.
Reações adversas com frequência desconhecida (a frequência não pode ser estimada com os dados disponíveis)
Distúrbios do Sistema Sanguíneo e Linfático69: coagulopatia de consumo (CID), aumento dos níveis de inibidores.
Distúrbios do Sistema Imunológico70: reação de hipersensibilidade, reação anafilática71, rash22 no corpo inteiro (urticária23).
Distúrbios do Sistema Nervoso72: sensação de dormência73 nos membros (parestesia74), redução de sensibilidade normal (hipoestesia75), AVC (Acidente Vascular Cerebral76 trombótico77 ou embólico), sonolência, tonturas28, alteração do paladar78 (disgeusia79).
Distúrbios Cardíacos: ataque cardíaco (infarto do miocárdio11), palpitações80 (taquicardia81).
Distúrbios Vasculares82: formação de coágulo83 com inflamação61 nos vasos (eventos tromboembólicos, trombose12 venosa arterial), aumento na pressão arterial29 (hipertensão84), rubor (vermelhidão).
Distúrbios Respiratórios, torácicos e do mediastino85: obstrução da artéria pulmonar86 (embolia13 pulmonar), constrição87 da passagem de ar (broncoespasmo88), chiados (sibilos), tosse, dificuldade em respirar (dispneia26).
Distúrbios Gastrointestinais: vômitos89, diarreia90, desconforto abdominal, sensação de enjoo (náuseas91).
Distúrbios da pele e tecido subcutâneo92: sensação de dormência73 na face93, inchaço24 da face93, língua25 e lábios (angioedema94), rash22 no corpo inteiro (urticária23), coceira (prurido95).
Distúrbios Gerais e queixas no local da injeção96: dor no local da injeção96, sensação geral de mal-estar, calor, calafrios97, febre98, dor no peito27, desconforto no peito27.
Investigações: queda da pressão arterial29.
A infusão intravenosa rápida pode causar dor aguda e sensação de dormência73 na face93 e lábios, bem como queda da pressão arterial29.
Foi observado infarto do miocárdio11 após a administração de doses acima da dose máxima diária e/ou aplicação prolongada e/ou presença de fatores de risco de tromboembolismo99.
Informe ao seu médico, cirurgião-dentista ou farmacêutico o aparecimento de reações indesejáveis pelo uso do medicamento. Informe também à empresa através do seu serviço de atendimento.
O QUE FAZER SE ALGUÉM USAR UMA QUANTIDADE MAIOR DO QUE A INDICADA DESTE MEDICAMENTO?
Informe seu médico imediatamente. A superdose de FEIBA pode aumentar o risco de reações adversas, tais como tromboembolismo99 (formação de coágulo83 sanguíneo com inflamação61 dentro dos vasos sanguíneos10), coagulopatia de consumo (CID) e infarto do miocárdio11. Alguns dos eventos relatados ocorreram com doses acima de 200 U/kg ou em pacientes com outros fatores de risco para eventos tromboembólicos. Se forem observados sinais16 ou sintomas17 de eventos trombóticos34 ou tromboembólicos, a infusão deve ser interrompida imediatamente e devem-se iniciar medidas terapêuticas e de diagnóstico33.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
DIZERES LEGAIS:
Venda sob prescrição médica.
MS. 1.6979.0016
Farm. Resp.:
Jônia Gurgel Moraes
CRF/SP 10.616
Importado por:
Shire Farmacêutica Brasil Ltda.
Av. das Nações Unidas, 14.171 – 5º andar
São Paulo – SP – CEP 04794-000
CNPJ: 07.898.671/0001-60
Fabricado por:
Baxter AG, Viena, Áustria
SAC 0800 773 8880