Sprycel (Bula do profissional de saúde)
BRISTOL-MYERS SQUIBB FARMACÊUTICA LTDA
IDENTIFICAÇÃO DO MEDICAMENTO
Sprycel
dasatinibe
Comprimidos 20 mg e 100 mg
FORMA FARMACÊUTICA E APRESENTAÇÃO:
Comprimido revestido
Embalagens com 30 ou 60 comprimidos.
USO ORAL
USO ADULTO
COMPOSIÇÃO:
Cada comprimido de Sprycel 20 mg contém:
| dasatinibe | 20 mg |
| excipiente q.s.p. | 1 comprimido |
Excipientes: lactose1 monoidratada, celulose microcristalina, croscarmelose sódica, hiprolose e estearato de magnésio. O comprimido é revestido por hipromelose, dióxido de titânio e polietilenoglicol.
Cada comprimido de Sprycel 100 mg contém:
| dasatinibe | 100 mg |
| excipiente q.s.p. | 1 comprimido |
Excipientes: lactose1 monoidratada, celulose microcristalina, croscarmelose sódica, hiprolose e estearato de magnésio. O comprimido é revestido por hipromelose, dióxido de titânio e polietilenoglicol.
INFORMAÇÕES TÉCNICAS AOS PROFISSIONAIS DE SAÚDE2
INDICAÇÕES
Sprycel é indicado para o tratamento de adultos com leucemia3 mieloide crônica1 cromossomo4 Philadelphia- positivo (LMC Ph+) na fase crônica recém-diagnosticada.
Sprycel é indicado para o tratamento de adultos com leucemia3 mieloide crônica1 cromossomo4 Philadelphia- positivo (LMC Ph+) nas fases crônica, acelerada ou blástica mieloide /linfoide5 com resistência ou intolerância à terapia anterior incluindo imatinibe.
Sprycel também é indicado para o tratamento de adultos com leucemia3 linfoblástica aguda2 cromossomo4 Philadelphia-positivo (LLA Ph+) com resistência ou intolerância à terapia anterior.
- CID C92.1 – Leucemia3 mieloide crônica
- CID C91.0 – Leucemia3 linfoblástica aguda
RESULTADOS DE EFICÁCIA
A eficácia e a segurança do Sprycel foram investigadas em pacientes adultos com LMC Ph+ ou LLA Ph+, resistentes ou intolerantes ao imatinibe: 1158 pacientes tinham LMC Ph+ na fase crônica, 858 pacientes tinham LMC Ph+ na fase acelerada, fase mieloide blástica, ou fase linfoide5 blástica, e 130 pacientes tinham LLA Ph+. Em um estudo clínico de LMC Ph+ na fase crônica, a resistência ao imatinibe incluiu falha ao atingir a resposta hematológica completa (RHC; depois de 3 meses), resposta citogenética maior (RCM; depois de 6 meses), ou resposta citogenética completa (RCC; depois de 12 meses); ou perda de uma resposta molecular prévia (com aumento concomitante ≥ 10% em metáfases de Ph+), resposta citogenética, ou resposta hematológica. A intolerância ao imatinibe incluiu a incapacidade para tolerar 400 mg ou mais de imatinibe por dia ou a descontinuação do imatinibe devido à toxicidade6.
Os resultados descritos abaixo são baseados em um mínimo de 2 anos de acompanhamento após o início do tratamento com Sprycel em pacientes com uma média de tempo desde o início do diagnóstico7 de aproximadamente 5 anos. Em todos os estudos, 48% dos pacientes eram mulheres, 81% eram brancos, 15% negros ou asiáticos, 25% tinham 65 anos de idade ou mais, e 5% tinham 75 anos de idade ou mais. A maioria dos pacientes possuía um longo histórico da doença com tratamentos anteriores extensos, incluindo imatinibe, quimioterapia8 citotóxica, interferon, e transplante de medula óssea9. Em geral, 80% dos pacientes eram resistentes ao imatinibe e 20% eram intolerantes ao imatinibe. A dose máxima de imatinibe havia sido de 400- 600 mg/dia em aproximadamente 60% dos pacientes e > 600 mg/dia em 40% dos pacientes.
O objetivo principal de eficácia na fase crônica da LMC Ph+ foi a resposta citogenética maior (RCM), definida como eliminação (resposta citogenética completa, RCC) ou diminuição substancial (de pelo menos 65%, resposta citogenética parcial) das células10 hematopoiéticas Ph+. O objetivo principal de eficácia na fase acelerada, fase mieloide blástica, fase linfoide5 blástica da LMC Ph+, e na LLA Ph+ foi a resposta hematológica maior (RHM), definida como uma resposta hematológica completa (RHC), ou como nenhuma evidência de leucemia3 (NEL).
LMC Ph+ em fase crônica recém-diagnosticada
Um estudo Fase 3, aberto, multicêntrico, internacional, randomizado11 foi realizado em pacientes adultos com LMC Ph+ fase crônica recém-diagnosticada. Os pacientes foram randomizados para receber Sprycel 100 mg uma vez ao dia ou imatinibe 400 mg uma vez ao dia. O desfecho primário foi a taxa de resposta citogenética completa confirmada (RCCc) em 12 meses. Os desfechos secundários incluem o tempo em RCCc (medida da duração da resposta), tempo para RCCc, taxa de resposta molecular maior (RMM), tempo para RMM, sobrevida12 livre de progressão (SLP) e sobrevida12 global (SG). Outros resultados de eficácia relevantes incluem RCC e taxa de resposta molecular completa (RMC)
Um total de 519 pacientes foram randomizados em um grupo de tratamento: 259 para Sprycel e 260 para imatinibe. As características basais foram bem balanceadas entre os dois grupos de tratamento com respeito à idade (a mediana foi de 46 anos para o grupo de Sprycel e 49 anos para o grupo de imatinibe com 10% e 11% dos pacientes com 65 anos de idade ou mais, respectivamente), gênero (44% e 37% de mulheres, respectivamente) e raça (51% e 55% de caucasianos, 42% e 36% de asiáticos, respectivamente). O tempo mediano do diagnóstico7 inicial de LMC Ph+ até a randomização foi 1 mês (0,03 - 9,72) para dasatinibe e 1 mês (0,10 - 8,02) para imatinibe. Pacientes com história de doença cardíaca grave foram incluídos neste estudo, exceto aqueles que tiveram infarto do miocárdio13 nos últimos 6 meses, insuficiência cardíaca congestiva14 ou angina15 descontrolada nos últimos 3 meses, arritmias16 significantes ou prolongamento do intervalo QT. Na base, a distribuição dos escores de Hasford foi similar nos grupos de tratamento com Sprycel e imatinibe (baixo risco: 33% e 34%, risco intermediário: 48% e 47% e alto risco: 19% e 19%, respectivamente). O status de Performance (ECOG) foi também similar nos grupos de tratamento com Sprycel e imatinibe (ECOG 0 = 82% e 79%, ECOG 1 = 18% e 20% e ECOG 2 = 0 e 1%, respectivamente).
Com 12 meses de acompanhamento mínimo, 85% dos pacientes randomizados para o grupo de Sprycel e 81% dos pacientes randomizados no grupo do imatinibe ainda estavam recebendo tratamento em primeira linha. A descontinuação devido a progressão da doença ocorreu em 3% dos pacientes tratados com Sprycel e 5% dos pacientes tratados com imatinibe. Com acompanhamento mínimo de 60 meses, 61% dos pacientes randomizados para o tratamento com Sprycel e 63% dos pacientes randomizados para o tratamento com o imatinibe ainda estavam recebendo tratamento em primeira linha. A descontinuação devido a progressão da doença ocorreu em 7% dos pacientes tratados com Sprycel e 9% em pacientes tratados com imatinibe. Descontinuação devido à falha ao tratamento ocorreu em 4% dos pacientes tratados com Sprycel e 5% dos pacientes tratados com imatinibe. Descontinuação devido à intolerância ao tratamento ocorreu em 16% dos pacientes tratados com Sprycel e 7% dos pacientes tratados com imatinibe.
Os resultados de eficácia estão apresentados na Tabela 1. Uma proporção maior de paciente estatisticamente significativa no grupo de Sprycel alcançou a RCCc comparado com pacientes no grupo de imatinibe dentro dos primeiros 12 meses de tratamento. A eficácia de Sprycel foi consistentemente demonstrada entre os diferentes subgrupos, incluindo idade, gênero e escores basais de Hasford.
Tabela 1: Resultados de Eficácia em um Estudo Fase 3 de Pacientes com LMC Ph+ na Fase Crônica Recém-diagnosticados
|
Sprycel |
Imatinibe |
valor p |
|
|
Taxa de Resposta (95% IC) |
|||
|
Resposta Citogenética |
|||
|
em 12 meses |
|||
|
RCCc a |
76,8% (71,2–81,8) |
66,2% (60,1–71,9) |
p<0,007* |
|
RCC b |
85,3% (80.4–89,4) |
73,5% (67,7–78,7) |
— |
|
em 24 meses |
|||
|
RCCc a |
80,3% |
74,2% |
— |
|
RCC b |
87,3% |
82,3% |
— |
|
em 36 meses |
|||
|
RCCc a |
82,6% |
77,3% |
— |
|
RCC b |
88,0% |
83,5% |
— |
|
em 48 meses |
|||
|
RCCc a |
82,6% |
78,5% |
— |
|
RCC b |
87,6% |
83,8% |
— |
|
em 60 meses |
|||
|
RCCc a |
83,0% |
78,5% |
p = 0,1866 |
|
RCC b |
88,0% |
83,8% |
— |
|
Resposta Molecular Maiorc |
|
||
|
12 meses |
52,1% (45,9–58,3) 33,8% (28,1–39,9) |
p<0,00003* |
|
|
24 meses |
64,5% (58,3–70,3) 50% (43,8–56,2) | — | |
|
36 meses |
69,1% (63,1–74,7) 56,2% (49,9–62,3) | — | |
|
48 meses |
75,7% (70,0–80,8) 62,7% (56,5–68,6) |
— |
|
|
60 meses |
76,4% (70,8–81,5) 64,2% (58,1–70,1) |
p = 0,0021 |
|
|
PFS (60 months) |
88,9% 89,2% |
— |
|
|
OS (60 months) |
90,9% 89,6% |
— |
|
|
Razão de Risco
|
|||
|
em 12 meses (99,99% IC) |
|||
|
Tempo para RCCc |
1,55 (1,0–2,3) |
p<0,0001* |
|
|
Tempo para RMM |
2,01 (1,2–3,4) |
p<0,0001* |
|
|
Duração da RCCc |
0,7 (0,4–1,4) |
p<0,035 |
|
|
em 24 meses (95% IC) |
|||
|
Tempo para RCCc |
1,49 (1,22–1,82) |
— |
|
|
Tempo para RMM |
1,69 (1,34–2,12) |
— |
|
|
Duração da RCCc |
0,77 (0,55–1,10) |
— |
|
|
em 36 meses (95% IC) |
|||
|
Tempo para RCCc |
1,48 (1,22–1,80) |
— |
|
|
Tempo para RMM |
1,59 (1,28–1,99) |
— |
|
|
Duração da RCCc |
0,77 (0,53–1,11) |
— |
|
|
em 48 meses (95% IC) |
|||
|
Tempo para RCCc |
1,45 (1,20–1,77) |
— |
|
|
Tempo para RMM |
1,55 (1,26–1,91) |
— |
|
|
Duração da RCCc |
0,81 (0,56–1,17) |
— |
|
|
em 60 meses (95% IC) |
|||
|
Tempo para RCCc |
1,46 (1,20, 1,77) |
p = 0,0001 |
|
|
Tempo para RMM |
1,54 (1.25, 1,89) |
p < 0,0001 |
|
|
Duração da RCCc |
0,79 (0,55-1,13) |
p = 0,1983 |
|
|
a Resposta citogenética completa confirmada (RCCc) é definida como a resposta notada em duas ocasiões consecutivas (em no mínimo 28 dias de distância). |
|||
A progressão da doença foi definida como o aumento das células brancas do sangue19 apesar de manejo terapêutico apropriado, perda de RHC, perda de RCM, progressão para fase acelerada ou fase blástica, ou morte. Com um mínimo de 60 meses de acompanhamento, transformação para fase blástica ou acelerada ocorreu menos frequentemente com Sprycel (n=8, 3,1%) do que com imatinibe (n=15, 5,8%).
Após 60 meses de acompanhamento, o tempo médio para RCCc foi 3,1 meses em 214 respondentes ao Sprycel e 5,8 meses em 204 respondentes ao imatinibe. O tempo médio para RMM após 60 meses de acompanhamento foi 9,3 meses em 196 respondentes ao Sprycel e 15,0 meses em 163 respondentes ao imatinibe. O tempo para RMM foi consistentemente menor com pacientes tratados com Sprycel comparado com pacientes tratados com imatinibe. Com um acompanhamento mínimo de 60 meses, a taxa de RMC (isto é, ao menos uma redução de 4,5-log a partir do valor base padronizado de relação BCR-ABL ≤ 0.0032%) a qualquer momento foi 44% e 34% no grupo tratado com Sprycel e com imatinibe, respectivamente.
A taxa de RMM a qualquer momento, em cada grupo de risco20 determinado pelo escore de Hasford, foi maior no grupo de Sprycel comparada ao grupo de imatinibe (baixo risco: 90% e 69%; risco intermediário: 71% e 65%; alto risco: 67% e 54%, respectivamente).
A taxa de SLP foi consistentemente maior em pacientes tratados com Sprycel que atingiram o nível de BCR-ABL ≤ 10% em 3 meses dos que não atingiram.
A taxa de SG foi consistentemente maior em pacientes tratados com Sprycel que atingiram nível de BCR- ABL ≤ 10% do que aqueles que não atingiram.
Taxas de RMM foram consistentemente maiores nos pacientes tratados com Sprycel comparado com os pacientes tratados com imatinibe.
A taxa estimada de SLP de 60 meses foi de 88,9% (IC: 84,0%-92,4%) e 89,2% (IC: 84,3%-92,7%) para o grupo de tratamento com o dasatinibe e com o imatinibe, respectivamente. As taxas estimadas de sobrevida12 de 60 meses para os pacientes tratados com dasatinibe e imatinibe foram 90,9% (IC: 86,6%-93,8%) e 89,6% (IC: 85,2%-92,8%), respectivamente. No acompanhamento mínimo de 60 meses, não houve diferença entre Sprycel e imatinibe na SG (HR 1,01, 95% IC: 0,58-1,73, p=0,9800) ou SLP (HR 1,00, 95% IC 0,58-1,72, p=0,9998).
O número de pacientes no grupo dasatinibe e imatinibe que apresentaram progressão/falha ao tratamento foi 34 (13,1%) e 39 (15%) pacientes, respectivamente.
Após 5 anos de acompanhamento, menos pacientes tratados com dasatinibe transformaram para fase acelerada ou blástica comparado aos pacientes tratados com imatinibe. Após 12, 24, 36, 48 e 60 meses de tratamento, transformação foi reportada em um total de 5 (1,9%), 6 (2,3%), 8 (3,1%), 8 (3,1%) e 8 (3,1%) pacientes tratados com dasatinibe comparado com 9 (3,5%), 13 (5,0%), 13 (5,0%), 14(5,4%) e 15 (5,8%) pacientes tratados com imatinibe, respectivamente. Notavelmente, não houve transformação adicional após 36 meses no grupo com dasatinibe, 2 pacientes adicionais apresentaram transformação no grupo com imatinibe após 36 meses (ambos entre o Ano 4 e 5).
O Tempo até o Benefício Clínico Máximo (TBCM) avalia as razões cumulativas para a descontinuação do tratamento. No estudo CA180056, TBCM foi definido como o tempo desde a randomização até o último dia de medicação no estudo para os pacientes que descontinuaram devido à toxicidade6, ou a primeira data na qual o critério para falha ao tratamento foi atingido. Com um período de acompanhamento mínimo de 5 anos, um maior número de indivíduos foi descontinuado do estudo por causa de progressão, falha do tratamento ou intolerância no grupo de dasatinibe em comparação com o grupo de imatinibe (74 vs. 55, respectivamente). Tal diferença do tratamento não se manifestou até depois de 2 anos, momento no qual as curvas de Kaplan- Meier começaram a se separar resultando em um risco maior de eventos de progressão, falha do tratamento ou intolerância ao medicamento para o grupo dasatinibe em comparação ao grupo imatinibe [HR (IC de 95%): 1,35 (0,95-1,91)].
No estudo de Fase 3 de LMC Ph+ na fase crônica recém-diagnosticada, o sequenciamento de BCR-ABL foi realizado em amostras de sangue18 de pacientes que descontinuaram a terapia com dasatinibe e imatinibe. Entre os pacientes tratados com Sprycel, as mutações detectadas foram T315I (4%), F317I/L (2%) e V299L (3%).
Dasatinibe, imatinibe e nilotinibe não parecem ser ativos contra a mutação21 T315I, baseado em dados in vitro.
Adicionalmente, mais pacientes tratados com Sprycel (84%) atingiram a resposta molecular precoce (definida como níveis de BCR-ABL ≤ 10% em 3 meses) comparado com os sujeitos tratados com imatinibe (64%). Os pacientes que atingiram resposta molecular precoce em ambos os grupos tiveram menor risco de transformação, maior taxa de sobrevida12 livre de progressão (SLP) e maior taxa de sobrevida12 global (SG), como demonstrado nas Tabelas 2 e 3.
Tabela 2. Pacientes tratados com Sprycel com BCR-ABL ≤ 10% e >10% em 3 Meses
|
N = 235 |
Pacientes com BCR-ABL |
Pacientes com BRC-ABL |
|
Número de sujeitos (%) |
198 (84,3) |
37 (15,7) |
|
Taxa de transformação aos 60 Meses, n/N (%) |
6/198 (3,0) |
5/37 (13,5) |
|
Taxa de SLP em 60 Meses (95% IC) |
92.0% (89,6, 95,2) |
73,8% (52,0, 86,8) |
|
Taxa de SG em 60 Meses (95% IC) |
93.8% (89,3, 96,4) |
80,6% (63,5, 90,2) |
Tabela 3: Pacientes tratados com imatinibe com BCR-ABL ≤10% e >10% em 3 Meses
|
N = 235 |
Pacientes com BCR-ABL |
Pacientes com BRC-ABL |
|
Número de sujeitos (%) |
154 (64,4) |
85 (35,6) |
|
Taxa de transformação aos 60 Meses, n/N (%) |
5/154 (3,2) |
13/85 (15,3) |
|
Taxa de SLP em 60 Meses (95% IC) |
93,5% (87,8, 96,6) |
79,3% (67,3, 87,3) |
|
Taxa de SG em 60 Meses (95% CI) |
95,4% (90,5, 97,8) |
80,5% (70,1, 87,6) |
Outros estudos de longo prazo com pacientes com leucemia3 mieloide crônica recém diagnosticados estão em andamento.
LMC Ph+ fase crônica
Estudo de otimização da dose: Um estudo Fase 3 randomizado11, aberto, foi conduzido em pacientes com LMC Ph+ em fase crônica para avaliar a segurança e eficácia de Sprycel administrado uma vez ao dia comparado com Sprycel administrado duas vezes ao dia. Pacientes com doenças cardíacas significantes incluindo o infarto do miocárdio13 em 6 meses, insuficiência cardíaca congestiva14 em 3 meses, arritmias16 significantes ou prolongamento intervalo QTc foram excluídos do estudo. O objetivo principal de eficácia foi resposta citogenética maior (RCM) em pacientes com LMC Ph+ resistentes ao imatinibe. Um total de 670 pacientes, dos quais 497 eram resistentes ao imatinibe, foram randomizados nos seguintes grupos: 100 mg uma vez ao dia, 140 mg uma vez ao dia, 50 mg duas vezes ao dia ou 70 mg de Sprycel duas vezes ao dia. A média da duração do tratamento foi de 22 meses (faixa de <1 a 31 meses).
A eficácia foi atingida em todos os grupos tratados com Sprycel uma vez ao dia demonstrando eficácia comparável (não inferioridade) ao tratamento com Sprycel duas vezes ao dia para o objetivo principal de eficácia (diferença da RCM 1,9%; 95% de intervalo de confiança [- 6,8% a 10,6%].), entretanto, o regime de 100 mg uma vez ao dia demonstrou segurança e tolerabilidade melhorada.
Resultados de eficácia para pacientes22 com LMC Ph+ na fase crônica que receberam a dose inicial recomendada de 100 mg uma vez ao dia estão demonstrados na Tabela 4 e 5.
Tabela 4: Eficácia de Sprycel em Estudo Fase 3 de Optimização de Dose: LMC Ph+ na fase crônica Resistente ou Intolerante ao imatinibe (resultados de 2 anos)
|
Todos os pacientes |
100 mg uma vez ao diaa |
|
Pacientes resistentes ao imatinibe |
n=124 |
|
RHCb % (95% IC) |
92% (86-95) |
|
RCMc % (95% IC) |
63% (56-71) |
|
Pacientes resistentes ao imatinibe |
59% (50–68) |
|
RCC % (95% IC) |
50% (42-58) |
|
Pacientes resistentes ao imatinibe |
44% (35–53) |
|
Resposta Molecular Maior em Pacientes alcançando RCCd % (95% CI) |
69% (58-79) |
|
Pacientes resistentes ao imatinibe |
72% (58–83) |
|
a Resultados reportados em doses iniciais recomendadas de 100 mg uma vez ao dia. |
|
A eficácia foi avaliada também em pacientes que eram intolerantes ao imatinibe. Nesta população de paciente que recebeu 100 mg uma vez ao dia, RCM foi alcançada em 77% e RCC em 67% de pacientes com acompanhamento mínimo de 2 anos.
Tabela 5: Eficácia a Longo Prazo de Sprycel em Estudo Fase 3 de Optimização de Dose LMC Ph+ de Fase Crônica Resistente ou Intolerantea
|
|
Período de Acompanhamento Mínimo |
|||
|
1 ano |
2 anos |
5 anos |
7 anos |
|
|
Resposta Molecular Maior |
||||
|
Todos os pacientes |
NA |
37% (57/154) | 44% (71/160) | 46% (73/160) |
|
Pacientes resistentes ao imatinibe |
NA |
35% (41/117) |
42% (50/120) |
43% (51/120) |
|
Pacientes intolerantes ao imatinibe |
NA |
43% (16/37) |
53% (21/40) |
55% (22/40) |
|
Sobrevida12 Livre de Progressão (SLP)b |
||||
|
Todos os pacientes |
90% (86-95) |
80% (73, 87) |
51% (41, 60) |
42% (33, 51) |
|
Pacientes resistentes ao imatinibe |
88% (82, 94) |
77% (68, 85) |
49% (39, 59) |
39% (29, 49) |
|
Pacientes intolerantes ao imatinibe |
97% (92, 100) |
87% (76, 99) |
56% (37, 76) |
51% (32, 67) |
|
Sobrevida12 Global (SG) |
||||
|
Todos os pacientes |
96% (93, 99) |
91% (86, 96) |
78% (72, 85) |
65% (56, 72) |
|
Pacientes resistentes ao imatinibe |
94% (90, 98) |
89% (84, 95) |
77% (69, 85) |
63% (53, 71) |
|
Pacientes intolerantes ao imatinibe |
100% (100, 100) |
95% (88, 100) |
82% (70, 94) |
70% (52, 82) |
|
a Resultados reportados para dose recomendada de 100 mg uma vez ao dia. |
||||
Por sete anos, a transformação quer para a fase acelerada ou para fase blástica ocorreram em nove pacientes em tratamento.
LMC Ph+ fase avançada e LLA Ph+
- Estudo de otimização da dose: Um estudo Fase 3 randomizado11, aberto, foi conduzido em pacientes com LMC Ph+ em fase avançada (LMC Ph+ na fase acelerada, LMC Ph+ na fase mieloide blástica, ou LMC Ph+ na fase linfoide5 blástica) ou LLA Ph+ para avaliar a eficácia e segurança de Sprycel administrado uma vez ao dia comparado com Sprycel administrado duas vezes ao dia. O objetivo principal de eficácia foi resposta hematológica maior (RHM). Um total de 611 pacientes foram randomizados nos grupos de 140 mg de Sprycel uma vez ao dia ou de 70 mg de Sprycel duas vezes ao dia. A média da duração do tratamento foi de aproximadamente 6 meses para os dois grupos de tratamento (faixa de <1 a 31 meses). O grupo tratado com Sprycel uma vez ao dia demonstrou eficácia comparável (não inferioridade) ao tratamento com Sprycel duas vezes ao dia para o objetivo principal de eficácia, entretanto, o regime de 140 mg uma vez ao dia demonstrou segurança e tolerabilidade melhorada.
As taxas de resposta para pacientes22 no grupo de 140 mg uma vez ao dia estão apresentadas na Tabela 6.
Tabela 6: Eficácia de Sprycel em LMC Ph+ na fase avançada e em LLA Ph+ (Resultados de 2 Anos)
|
|
140 mg uma vez ao dia |
|||
|
Acelerada |
Mieloide Blástica |
Linfoide5 Blástica |
LLA Ph+ |
|
|
RHMa |
66% |
28% |
42% |
38% |
|
RHCa |
47% |
17% |
21% |
33% |
|
NELa |
19% |
11% |
21% |
5% |
|
RCMb |
39% |
28% |
52% |
70% |
|
RCC |
32% |
17% |
39% |
50% |
|
a critério para resposta hematológica (todas as respostas confirmadas após 4 semanas): |
||||
Em paciente com LMC Ph+ na fase acelerada tratados com o regime de 140 mg uma vez ao dia, a duração média da RHM e a sobrevida12 global (SG) média não foi atingida; a sobrevida12 livre de progressão (SLP) média foi de 25 meses. Em pacientes com LMC Ph+ na fase blástica mileóide tratados com o regime de 140 mg uma vez ao dia, a duração média da RHM foi 8 meses, a média da SLP foi 4 meses e a média de sobrevida12 global foi 8 meses. Em pacientes com LMC Ph+ na fase blástica linfóide, a duração média da RHM foi 5 meses, a média da SLP foi 5 meses e a sobrevida12 global média foi 11 meses. Em pacientes com LLA Ph+ tratados com o regime de 140 mg uma vez ao dia, a duração da RHM foi 5 meses, a média de SLP foi 4 meses e a média de sobrevida12 global foi 7 meses.
CARACTERÍSTICAS FARMACOLÓGICAS
Sprycel (dasatinibe) é inibidor de quinase. O nome químico do dasatinibe é N-(2-cloro-6-metilfenil)-2-[[6- [4-(2-hidroxietil)-1-piperazinil]-2-metil-4-pirimidinil]amino]-5-tiazolecarboxamida, monoidratado. A fórmula molecular é C22H26ClN7O2S • H2O, o que corresponde a um peso de 506,02 (monoidratado). A base anidra livre possui um peso molecular de 488,01. O dasatinibe possui a seguinte estrutura química:
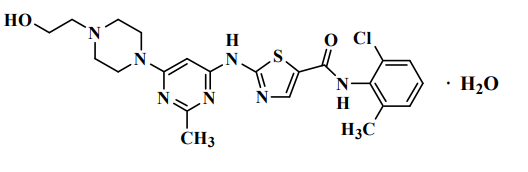
O dasatinibe é um pó branco a quase branco. O fármaco26 é insolúvel em água e levemente solúvel em etanol e metanol.
Mecanismo de Ação
O dasatinibe, em concentrações nanomolares, inibe as seguintes quinases: BCR-ABL, família SRC (SRC, LCK, YES, FYN), c-KIT, EPHA2, e PDGFRβ. Com base em estudos modelo, o dasatinibe previsivelmente liga-se a conformações múltiplas da quinase ABL.
In vitro, o dasatinibe é ativo em linhagens celulares leucêmicas representando variações da doença sensível e resistente ao mesilato de imatinibe. O dasatinibe inibiu o crescimento de linhagens celulares de Leucemia3 Mieloide Crônica (LMC) e Leucemia3 Linfoblástica Aguda Cromossomo4 Philadelphia-positivo (LLA Ph+) com superexpressão de BCR-ABL. Sob as condições dos ensaios, o dasatinibe foi capaz de superar a resistência ao imatinibe resultante das mutações no domínio da quinase do BCR-ABL, ativação das etapas de sinalização alternativas envolvendo as quinases da família SRC (LYN, HCK) e a superexpressão do gene de resistência a múltiplos medicamentos.
Farmacocinética
Absorção: As concentrações plasmáticas máximas (Cmax) de dasatinibe são observadas entre 0,5 e 6 horas (Tmax), após a administração oral. O dasatinibe exibe aumentos na AUC27 proporcionais à dose e características de eliminação lineares na faixa de dose de 15 mg a 240 mg/dia. A média da meia-vida terminal geral do dasatinibe é de 3 a 5 horas.
Dados de um estudo realizado com 54 indivíduos sadios que receberam uma dose única de 100 mg de dasatinibe 30 minutos após o consumo de uma refeição rica em gorduras indicaram um aumento de 14% na AUC27 média do dasatinibe. O consumo de uma refeição com baixo teor de gordura28 30 minutos antes do dasatinibe resultou num aumento de 21% na AUC27 média do dasatinibe. Os efeitos dos alimentos não foram clinicamente relevantes. A variabilidade da exposição ao dasatinibe é mais elevada em condições de jejum (47% CV) em comparação à refeição com baixo teor de gordura28 (39% CV) e à refeição rica em gorduras (32% CV).
Com base na análise farmacocinética da população de pacientes, estimou-se que a variabilidade da exposição ao dasatinibe se deve principalmente à variabilidade inter-ocasião da biodisponibilidade (44% CV) e, em menor medida, à variabilidade interindividual da biodisponibilidade e do clearance (32% e 30% CV, respectivamente). Não é esperado que a variabilidade aleatória inter-ocasião na exposição afete a exposição e a eficácia cumulativas.
Distribuição: Nos pacientes, o Sprycel apresenta um volume aparente de distribuição de 2505 L (CV% 93%), sugerindo que a droga é extensamente distribuída para o espaço extravascular29. A ligação do dasatinibe e o seu metabólito30 ativo às proteínas31 plasmáticas humanas in vitro foi aproximadamente 96% e 93%, respectivamente, sem dependência da concentração no intervalo de 100 – 500 ng/ mL.
Metabolismo32: O dasatinibe é extensamente metabolizado em humanos, principalmente pela enzima33 3A4 do citocromo P450. CYP3A4 é a principal enzima33 responsável pela formação do metabólito30 ativo. As enzimas mono-oxigenase 3 flavina (FMO-3) e a difosfato uridina glucuronosiltransferase (UGT) também estão envolvidas na formação dos metabólitos34 do dasatinibe.
A exposição do metabólito30 ativo, a qual é equipotente ao dasatinibe, representa aproximadamente 5% da AUC27 do dasatinibe. Isso indica que o metabólito30 ativo do dasatinibe dificilmente terá alguma função importante na farmacologia35 observada da droga. O dasatinibe apresenta diversos outros metabólitos34 oxidativos inativos.
O dasatinibe é um fraco inibidor da CYP3A4 dependente do tempo. Em concentrações clinicamente relevantes, dasatinibe não inibe CYP1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6, ou 2E1. O dasatinibe não é um indutor das enzimas CYP humanas.
Eliminação: A meia-vida terminal média de dasatinibe é de 3 a 5 horas. O clearance oral médio aparente é de 363,8 L/h (CV% 81,3%). A eliminação dá-se principalmente pelas fezes. Após uma dose oral única de dasatinibe marcado com [14C], aproximadamente 4% e 85% da radioatividade administrada foi recuperada na urina36 e nas fezes, respectivamente, dentro de 10 dias. O dasatinibe inalterado contabilizou 0,1% e 19% da dose administrada na urina36 e fezes, respectivamente, sendo que o restante da dose corresponde aos metabólitos34.
Populações especiais
Efeitos da idade e gênero: Análises farmacocinéticas dos dados demográficos indicam que não há efeitos clinicamente relevantes sobre a idade e sexo da farmacocinética do dasatinibe.
A farmacocinética do Sprycel não foi avaliada em pacientes pediátricos.
Insuficiência Hepática37: Doses de 50 mg e 20 mg de dasatinibe foram avaliadas em oito pacientes com insuficiência hepática37 moderada (Child-Pugh Classe B) e sete pacientes com insuficiência hepática37 grave (Child-Pugh Classe C), respectivamente. Controles combinados com função hepática38 normal (n=15) também foram avaliados e receberam uma dose de 70 mg de dasatinibe. Comparados a sujeitos com função hepática38 normal, pacientes com insuficiência hepática37 moderada tiveram decréscimos na Cmax de normalização da dose e AUC27 de 47% e 8%, respectivamente. Pacientes com insuficiência hepática37 grave tiveram um decréscimo de 43% na Cmax de normalização da dose e de 28% na AUC27 comparado aos controles normais.
Estas diferenças na Cmax e AUC27 não são clinicamente relevantes. O ajuste de dose não é necessário em pacientes com insuficiência hepática37.
Devido a limitações deste estudo clínico, deve-se ter cautela ao administrar dasatinibe a pacientes com insuficiência hepática37.
CONTRAINDICAÇÕES
Sprycel é contraindicado em pacientes com hipersensibilidade ao dasatinibe ou a qualquer outro componente da formulação.
ADVERTÊNCIAS E PRECAUÇÕES
GERAIS
Mielossupressão
O tratamento com Sprycel está associado com trombocitopenia39, neutropenia40 e anemia41 graves (graus 3 e 4), que ocorrem mais cedo e mais frequentemente em pacientes com LMC na fase avançada ou LLA Ph+ do que em pacientes com LMC na fase crônica.
Em pacientes adultos com LMC na fase avançada ou LLA Ph+ tratados com dasatinibe, hemogramas completos devem ser realizados semanalmente pelos 2 primeiros meses, e mensalmente depois disso ou conforme indicado clinicamente.
Em pacientes adultos com LMC na fase crônica, hemogramas completos devem ser realizados a cada 2 semanas por 12 semanas, e então a cada 3 meses depois disso ou conforme indicado clinicamente.
A mielossupressão é geralmente reversível e tratada suspendendo-se temporariamente o Sprycel ou reduzindo-se a dose (vide 8. POSOLOGIA E MODO DE USAR e 9. REAÇÕES ADVERSAS).
Eventos Relacionados com Sangramento
Em pacientes com LMC fase crônica, hemorragia42 severa ocorreu em 5 pacientes (1%) tomando Sprycel na dose recomendada (n=548).
Além de causar trombocitopenia39 em humanos, o dasatinibe causou disfunção plaquetária in vitro. Em todos os estudos clínicos de LMC ou LLA Ph+, hemorragias43 graves (graus 3 e 4) do SNC44 (sistema nervoso central45), incluindo casos fatais, ocorreram em 1% dos pacientes tomando Sprycel. Hemorragia42 gastrintestinal grave ocorreu em 6% dos pacientes e geralmente exigiu interrupções do tratamento e transfusões. Outros casos de hemorragia42 grave ocorreram em 2% dos pacientes. A maioria dos eventos relacionados com sangramento nos estudos clínicos foi tipicamente associada com trombocitopenia39 grave. Em pacientes com LMC em fase crônica recém-diagnosticados tratados com dasatinibe, dos 6 pacientes que apresentaram eventos de sangramento Grau 3 ou 4, 2 apresentaram evento de sangramento dentro de 3 dias do relato de trombocitopenia39 severa (Grau 3 ou 4). Estes eventos com contagem de plaquetas23 associada foram hemorragia42 GI baixa no dia antes a contagem de plaqueta46 Grau 4 e hemorragia42 GI no mesmo dia da contagem de plaqueta46 Grau 3.
Os pacientes tomando medicamentos que inibem a função plaquetária ou anticoagulantes47 foram excluídos da participação em estudos clínicos iniciais com Sprycel. Em estudos posteriores, o uso de anticoagulantes47, aspirina, e antiinflamatórios não esteroidais (AINEs) foi permitido concomitantemente com Sprycel se a contagem de plaquetas23 fosse > 50000-75000 mm3. Deve-se ter cautela se os pacientes necessitarem tomar medicamentos que inibem a função plaquetária ou anticoagulantes47.
Retenção de Líquidos
Sprycel está associado com a retenção de líquidos. Após 5 anos de acompanhamento do estudo Fase 3 de LMC em fase crônica recém-diagnosticada (n=258), retenção de líquidos grave foi relatada em 13 pacientes (5%) tomando Sprycel comparado com 2 pacientes (1%) tomando imatinibe (n=258). O evento adverso relacionado com retenção de líquidos mais comumente relatado foi derrame48 pleural (28,3%) no grupo com dasatinibe. O tempo mediano para a primeira ocorrência de derrame48 pleural Grau 1 ou 2 relacionado ao medicamento foi 114 semanas (faixa entre 4–299 semanas). Em pacientes com derrame48 pleural ≥ Grau 3 relacionado ao medicamento, o tempo até a primeira ocorrência foi 175 semanas (faixa entre 114 a 274 semanas). Pacientes com derrame48 pleural relacionados ao medicamento foram manejados com uma ou mais das opções seguintes: interrupção da dose (61,6%); redução da dose (41,1%); diuréticos49 (46,6%); corticosteroides (31,5%); combinação de diuréticos49 e corticosteroides (27,4%); e toracocentese50 terapêutica51 (12,3%).
Em todos os pacientes com LMC na fase crônica recém-diagnosticados ou resistentes ou intolerantes ao imatinibe (n=548), a retenção de líquidos grave ocorreu em 32 (6%) dos pacientes tratados com Sprycel na dose recomendada (n=548). Em pacientes com LMC ou LLA Ph+ tratados com Sprycel na dose recomendada (n=304), retenção de líquido grave foi relatada em 8% dos pacientes, incluindo derrame48 pleural e do pericárdio52 grave relatados em 7% e 1% dos pacientes, respectivamente. Eventos de edema pulmonar53 grave e hipertensão54 pulmonar grave foram relatados, cada um, em 1% dos pacientes.
Os pacientes que desenvolverem sintomas55 sugestivos de derrame48 pleural ou outra retenção de líquido, como dispneia56 nova ou piorada durante esforço ou em repouso, dor pleurítica ou tosse seca devem ser avaliados imediatamente por radiografia de tórax57 ou exame de imagem adicional conforme apropriado. Derrame48 pleural grave pode necessitar toracentese e terapia com oxigênio. Modificação da dose deve ser considerada. (vide 8.POSOLOGIA E MODO DE USAR). Eventos de retenção de líquidos foram tipicamente tratados com medidas de suporte, que pode incluir diuréticos49 ou administrações de esteróides por períodos curtos.
Prolongamento do intervalo QT
Dados in vitro sugerem que o dasatinibe tem potencial para prolongar a repolarização ventricular cardíaca (intervalo QT).
Após 5 anos de acompanhamento do estudo clínico Fase 3 de LMC em fase crônica recém-diagnosticada, 1 paciente (<1%) em cada grupo de tratamento com Sprycel (n=258) e com imatinibe (n=258) teve prolongamento do intervalo QTc reportado com reação adversa. As alterações médias no QTcF foram 3,0 mseg em pacientes tratados com Sprycel comparado com 8,2 mseg em pacientes tratados com imatinibe. Um paciente (<1%) em cada grupo apresentou um QTcF>500 mseg.
Em 865 pacientes com leucemia3 tratados com Sprycel em estudos de Fase II, as alterações médias em QTcF da linha de base, usando o método de Fridericia (QTcF) foram de 4–6 mseg, os intervalos de confiança (ICs) superiores a 95% para todas as alterações médias da linha de base foram <7 mseg. Dos 2182 pacientes com resistência ou intolerância a terapia prévia com imatinibe que tratados com Sprycel em estudos clínicos, 15 (1%) pacientes apresentaram prolongamento do intervalo QTc relatado como reação adversa. Vinte e um pacientes (1%) apresentaram um QTcF > 500 mseg.
Sprycel deve ser administrado com cuidado em pacientes que apresentam ou que podem apresentar prolongamento do intervalo QTc. Estes incluem pacientes com hipocalemia58 ou hipomagnesemia, pacientes com síndrome59 congênita60 de QT longo, pacientes tomando medicamentos antiarrítmicos ou outros medicamentos que possam levar ao prolongamento do intervalo QT e terapia cumulativa com altas doses de antraciclina. Hipocalemia58 ou hipomagnesemia devem ser corrigidas anteriormente à administração de Sprycel.
Reativação da hepatite61 B
TKIs BCR-ABL estão sendo associados com a reativação do vírus62 da hepatite61 B (HBV) incluindo casos individuais reportados para Sprycel. Em algumas instâncias, a reativação do HBV ocorrendo em conjunto com a terapia com outros TKIs BCR-ABL resultou em falência hepática38 aguda ou hepatite fulminante63 levando a transplante de fígado64 ou a um desfecho fatal.
A pesquisa para presença de HBV deve ser considerada de acordo com as diretrizes publicadas antes de iniciar a terapia com Sprycel. A consulta com um médico experiente no tratamento de hepatite61 B é recomendada para pacientes22 que tiveram sorologia positiva para HBV.
Pacientes que carregam o HBV e requerem tratamento com TKIs BCR-ABL devem ser cuidadosamente monitorados para sinais65 clínicos e laboratoriais de infecção66 ativa de HBV durante o tratamento e por vários meses após o término da terapia. Em pacientes que desenvolveram reativação do HBV enquanto estavam tomando Sprycel, recomenda-se uma consulta imediata com um médico experiente no tratamento de HBV.
Reações adversas cardíacas
Sprycel foi estudado em um estudo clínico randomizado11 de 519 pacientes com LCM na fase crônica recém- diagnosticados que incluíam pacientes com doença cardíaca prévia. As reações adversas cardíacas de falência cardíaca congestiva/ disfunção cardíaca, derrame48 do pericárdio52, arritmias16, palpitações67, prolongamento do intervalo QT e infarto do miocárdio13 (incluindo fatal) foram reportadas em pacientes tomando Sprycel. Eventos adversos cardíacos foram mais frequentes em pacientes com fatores de risco ou com histórica médica prévia de doença cardíaca. Pacientes com fatores de risco (como hipertensão54, hiperlipidemia68, ou diabetes69) ou história de doença cardíaca (como intervenção coronária percutânea prévia ou doença arterial coronariana) devem ser monitorados cuidadosamente para sinais65 e sintomas55 consistentes com disfunção cardíaca como dor no peito70, falta de ar e diaforese71. Se estes sinais65 e sintomas55 clínicos ocorrerem, aconselha-se a interrupção da administração de dasatinibe. Após a resolução, uma avaliação funcional deve ser realizada antes da retomada do tratamento com dasatinibe. O tratamento com dasatinibe pode ser retomado nas doses originais se os eventos forem leves ou moderados (≤ Grau 2) ou retomado com redução de dose se o evento for severo (≥ Grau 3). Pacientes com doença cardiovascular significante ou descontrolada não foram incluídos nos estudos clínicos.
Reações Dermatológicas Graves
Casos individuais de reações dermatológicas mucocutâneas graves, incluindo síndrome de Stevens-Johnson72 e eritema multiforme73, foram reportadas com o uso de Sprycel.
Sprycel deve ser descontinuado permanentemente em pacientes com experiência de reação mucocutânea grave durante o tratamento se nenhuma outra etiologia74 for identificada.
Hipertensão Arterial75 Pulmonar
Hipertensão arterial75 pulmonar (HAP), confirmada por cateterização cardíaca76 direita, foi relatada em associação ao tratamento com Sprycel. Nestes casos, a HAP foi relatada após o início da terapia de Sprycel, incluindo manifestações depois de mais de um ano de tratamento. Muitas vezes, os pacientes com HAP relatada durante o tratamento com Sprycel estavam tomando medicações concomitantes ou tinham comorbidades77 em complemento à malignidade subjacente.
Pacientes devem ser avaliados quanto à presença de sinais65 e sintomas55 de doença cardiopulmonar subjacente antes de iniciar a terapia com Sprycel. Pacientes que desenvolvem dispneia56 e fadiga78 após o início da terapia devem ser avaliados quanto às etiologias mais comuns, incluindo derrame48 pleural, edema pulmonar53, anemia41, ou infiltração no pulmão79. Durante esta avaliação, as diretrizes para o controle de reações adversas não- hematológicas devem ser seguidas (vide 8. POSOLOGIA E MODO DE USAR). Caso a reação adversa seja grave, o tratamento deverá ser suspenso até que o evento tenha evoluído para a resolução ou melhorado. Caso não seja encontrado diagnóstico7 alternativo, o diagnóstico7 de HAP deverá ser considerado. Caso a HAP seja confirmada, Sprycel deve ser permanentemente descontinuado. Acompanhamento deve ser realizado de acordo com as diretrizes de prática padrão. Melhoras nos parâmetros clínicos e hemodinâmicos foram observadas em pacientes tratados com Sprycel com HAP após a interrupção da terapia de Sprycel.
Informações importantes sobre um dos componentes do medicamento
O Sprycel contém 135 mg de LACTOSE1 monoidratada em uma dose de 100 mg ao dia e 189 mg de lactose1 monoidratada em uma dose de 140 mg ao dia.
Populações especiais
Uso Pediátrico: A segurança e eficácia do Sprycel em pacientes com menos de 18 anos de idade não foram estabelecidas.
Uso Geriátrico: Nenhuma diferença na RCC e RMM confirmadas foram observadas entre pacientes jovens e idosos. Dos 2712 pacientes nos estudos clínicos de Sprycel, 617 (23%) tinham 65 anos de idade ou mais e 123 (5%) tinham 75 anos ou mais. Enquanto o perfil de segurança de Sprycel na população geriátrica foi similar à população mais jovem, pacientes com 65 anos de idade ou mais foram mais propensos a apresentar as reações adversas mais comumente relatadas: fadiga78, derrame48 pleural, dispneia56, tosse, hemorragia42 gastrointestinal baixa, e distúrbio de apetite, e são mais prováveis de experienciar as reações adversas menos frequentemente reportadas: distensão abdominal, tontura80, efusão81 do pericárido, insuficiência cardíaca congestiva14 e perda de peso, e devem ser cuidadosamente monitorados.
Insuficiência hepática37: O efeito da insuficiência hepática37 na farmacocinética do dasatinibe foi avaliado em voluntários saudáveis com função normal do fígado64 e pacientes com moderada (Child-Pugh Classe B) e grave (Child-Pugh Classe C) insuficiência hepática37. Comparado aos voluntários saudáveis com função hepática38 normal, os parâmetros farmacocinéticos de normalização da dose foram diminuídos nos pacientes com insuficiência hepática37.
Nenhum ajuste de dose é necessário em pacientes com insuficiência hepática37 (vide 3. CARACTERÍSTICAS FARMACOLÓGICAS - Farmacocinética). Recomenda-se cuidado ao administrar Sprycel a pacientes com insuficiência hepática37.
Insuficiência Renal82: No momento não existem estudos clínicos com Sprycel em pacientes com insuficiência renal82. Menos de 4% do dasatinibe e seus metabólitos34 são excretados pelos rins83.
Carcinogênese, Mutagênese, Comprometimento da Fertilidade
Carcinogênese
Em um estudo de carcinogenicidade de 2 anos, foram administradas a ratos doses orais de dasatinibe de 0,3; 1 e 3 mg/kg/dia. A maior dose resultou em níveis de exposição plasmática da droga (AUC27) de aproximadamente 60% da exposição humana com 100 mg uma vez ao dia. Foi observado um aumento estatiscamente significativo na incidência84 combinada de carcinoma85 de células10 escamosas e papilomas no útero86 e colo87 de doses elevadas em fêmeas e de adenoma88 de próstata89 de baixas doses em machos. A relevância desses achados do estudo de carcinogenicidade em ratos para humanos não é conhecida.
Mutagênese
O dasatinibe foi clastogênico quando testado in vitro em células10 de ovário90 de hamster chinês, com ou sem ativação metabólica. O dasatinibe não foi mutagênico quando testado em um ensaio de células10 bacterianas in vitro (teste de Ames) e não foi genotóxico em um estudo em células10 de micronúcleo de ratos in vivo.
Comprometimento da Fertilidade
O dasatinibe não afetou a fertilidade masculina ou feminina em um estudo de fertilidade convencional e de desenvolvimento embrionário inicial em ratos, mas induziu a letalidade embrionária em exposição à droga plasmática (AUC27) similar às exposições em humanos na dose de 100 mg uma vez ao dia. Em estudos de desenvolvimento embriofetal, o dasatinibe também induziu a letalidade embrionária com diminuições associadas no tamanho das ninhadas em ratos, bem como alterações esqueléticas fetais em ratos e coelhos. Estes efeitos ocorreram em doses que não produziram toxicidade6 materna, indicando que o dasatinibe é uma substância tóxica seletiva para reprodução91 a partir da implantação até a conclusão da organogênese. Em um estudo exploratório de desenvolvimento pré e pós natal, a exposição indireta de filhotes de ratos ao dasatinibe (no útero86 ou durante o aleitamento) iniciando a partir do final da organogênese até o início da lactação92 era incompatível com a sobrevivência93 dos filhotes, mesmo com exposições maternas que são subterapêutica.
Os efeitos potenciais de Sprycel no esperma94 foram avaliados em um estudo oral de fertilidade e desenvolvimento embrionário inicial em ratos. O dasatinibe não é uma substancia tóxica para a reprodução91 em ratos machos em exposições clinicamente relevantes. No entanto, os dados da avaliação da toxicidade6 reprodutiva em pacientes do sexo masculino em tratamento com Sprycel são limitados.
Homens e mulheres com vida sexual ativa e em idade fértil devem usar meios de contracepção95 adequados durante a terapia com Sprycel.
Gravidez96 e Lactação92
O uso de Sprycel não é recomendado em mulheres grávidas ou que planejam engravidar. Se Sprycel for usado durante a gestação ou caso a paciente engravide durante a terapia com Sprycel, a paciente deve ser informada sobre o risco potencial ao feto97. Deve-se aconselhar as mulheres com potencial reprodutivo a evitar a gravidez96, o que pode incluir o uso de contracepção95, durante o tratamento com Sprycel.
O dasatinibe pode causar danos ao feto97 quando administrado a mulheres grávidas. Desfechos adversos fetais e infantis foram relatados em mulheres que tomaram Sprycel durante a gravidez96. Nos estudos de reprodução91 em animais, foram observadas toxicidades embrio-fetal, incluindo malformações98 ósseas, em ratos e coelhos em concentrações plasmáticas abaixo daquelas em humanos recebendo doses terapêuticas de dasatinibe. Houveram relatos pós-comercialização de aborto espontâneo e anomalias fetais e infantis de mulheres que utilizaram Sprycel durante a gravidez96.
Em estudos pré-clínicos, em concentrações plasmáticas abaixo daquelas observadas em humanos recebendo doses terapêuticas de dasatinibe, foi observada toxicidade6 fetal em ratos e coelhos. Morte dos fetos foi observada em ratos.
Categoria D – Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica. Informe imediatamente seu médico em caso de suspeita de gravidez96.
Não se sabe se Sprycel é excretado no leite humano. Dado que muitas drogas são excretadas no leite humano e dado o potencial de reações adversas sérias de Sprycel em lactentes99, deve-se decidir em descontinuar a amamentação100 ou descontinuar a droga, levando em consideração a importância da droga para a mãe. Mulheres que estão tomando Sprycel não devem amamentar.
Efeitos na habilidade de dirigir e operar máquinas
Nenhum estudo sobre o efeito na capacidade de dirigir e operar máquinas foi realizado. Pacientes devem ser advertidos sobre a possibilidade de apresentar eventos adversos com tontura80 ou visão101 borrada durante o tratamento com dasatinibe. Portanto, recomenda-se cautela na condução de veículos ou operação de máquinas.
INTERAÇÕES MEDICAMENTOSAS
Drogas que podem aumentar a concentração plasmática do dasatinibe
Inibidores da CYP3A4
O dasatinibe é um substrato da CYP3A4. Em um estudo com 18 pacientes com tumores sólidos, 20 mg de dasatinibe administrado uma vez ao dia, juntamente com 200 mg de cetoconazol duas vezes ao dia aumentaram a Cmax e AUC27 do dasatinibe em quatro e cinco vezes, respectivamente. O uso concomitante de Sprycel e drogas que inibem a CYP3A4 (exemplo: cetoconazol, itraconazol, eritromicina, claritromicina, ritonavir, atazanavir, indinavir, nelfinavir, nefazodona, saquinavir, telitromicina e voriconazol) podem aumentar a exposição ao dasatinibe e devem ser evitadas. A escolha de medicação concomitante alternativa com mínimo ou nenhum potencial para inibição de CYP3A4 é recomendada. Se a administração sistêmica de um potente inibidor de CYP3A4 não puder ser evitada, o paciente deve ser monitorado de perto para a toxicidade6 (vide 8. POSOLOGIA E MODO DE USAR - Modificação de Dose).
Drogas que podem diminuir a concentração plasmática do dasatinibe
Indutores da CYP3A4
Medicamentos que induzem a atividade da CYP3A4 podem reduzir a exposição ao dasatinibe. Quando uma dose matinal de Sprycel foi administrada após 8 dias de administração contínua pela noite de 600 mg de rifampicina, um potente indutor da CYP3A4, a Cmax média e AUC27 de dasatinibe diminuíram em 81% e 82%, respectivamente. Agentes alternativos com nenhum ou mínimo potencial de indução da enzima33 devem ser considerados. Se Sprycel deve ser administrado com um indutor de CYP3A4 (exemplo: dexametasona, fenitoína, carbamazepina, rifampina, rifabutina, fenobarbital), um aumento de dose de Sprycel deve ser considerado. (vide 8. POSOLOGIA E MODO DE USAR - Modificação de Dose). Não é recomendado o uso de potentes indutores da CYP3A4 concomitantemente com Sprycel.
Antiácidos102
Dados pré-clínicos demonstraram que a solubilidade do dasatinibe é dependente do pH. Em um estudo com 24 indivíduos saudáveis, a administração de 30 mL de hidróxido de alumínio/ hidróxido de magnésio 2 horas antes de uma dose única de 50 mg de Sprycel não foi associada com mudanças relevantes na AUC27 de dasatinibe; entretanto, a Cmax de dasatinibe aumentou 26%. Quando 30 mL de hidróxido de alumínio/ hidróxido de magnésio foi administrado aos mesmos indivíduos concomitantemente com uma dose de 50 mg de Sprycel, uma redução de 55% na AUC27 de dasatinibe e uma redução de 58% na Cmax foram observadas. Administração simultânea de Sprycel com antiácidos102 deve ser evitada. Se uma terapia antiácida for necessária, o antiácido103 deve ser administrado pelo menos 2 horas antes ou 2 horas depois da dose de Sprycel.
Antagonistas de H2/ inibidores da bomba de prótons
Supressão da secreção gástrica por antagonistas de H2 ou inibidores de bomba de prótons (exemplo: famotidina e omeprazol), por longos períodos, poderá reduzir a exposição do dasatinibe. Em um estudo com 24 indivíduos saudáveis, administração de uma dose única de 50 mg de Sprycel 10 horas após famotidina reduziu a AUC27 e a Cmax de dasatinibe em 61% e 63%, respectivamente. O uso concomitante de antagonistas de H2 ou inibidores da bomba de prótons com Sprycel não é recomendado. O uso de antiácidos102 deve ser considerado no lugar de antagonistas de H2 ou inibidores da bomba de prótons em pacientes recebendo Sprycel.
Drogas que podem ter suas concentrações plasmáticas alteradas pelo dasatinibe
Substratos da CYP3A4
Dados de um estudo de dose única realizado com 54 indivíduos sadios indicam que a Cmax média e AUC27 da sinvastatina, um substrato da CYP3A4, foram aumentadas em 37% e 20%, respectivamente, quando a sinvastatina foi administrada em combinação com uma dose única de 100 mg de Sprycel.O uso concomitante de dasatinibe com o substrato da CYP3A4 pode aumentar a exposição do substrato da CYP3A4. Desta maneira, substratos da CYP3A4 conhecidos por ter baixo índice terapêutico como, alfentanil, astemizil, terfenadina, cisaprida, ciclosporina, fentanil, pimozida, quinidina, sirolimus, tacrolimus e alcalóides de ergot (ergotamina, diidroergotamina) devem ser administrados com cautela em pacientes recebendo Sprycel.
Interações Medicamento-Alimento
Suco de toranja (grapefruit) pode aumentar a concentração plasmática de dasatinibe e deve ser evitado.
A Erva de São João pode diminuir as concentrações plasmáticas de dasatinibe de maneira imprevisível e deve ser evitada.
CUIDADOS DE ARMAZENAMENTO DO MEDICAMENTO
Cuidados de conservação
Conservar o produto em temperatura ambiente (entre 15°C e 30°C). Prazo de validade: 24 meses a partir da data de fabricação.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Características físicas e organolépticas do produto
- Comprimidos de 20 mg: comprimidos revestidos de coloração branca a quase branca, biconvexos, redondos com “BMS” impresso em um lado e “527” no outro lado.
- Comprimidos de 100 mg: comprimidos revestidos de coloração branca a quase branca, biconvexos, ovais com “BMS 100” impresso em um lado e “852” no outro lado.
Antes de usar, observe o aspecto do medicamento.
TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS.
POSOLOGIA E MODO DE USAR
A dose inicial recomendada de Sprycel para Leucemia3 Mieloide Crônica Cromossomo4 Philadelphia- positivo (LMC Ph+) na fase crônica é 100 mg administrada oralmente uma vez ao dia. A dose inicial recomendada de Sprycel para Leucemia3 Mieloide Crônica Cromossomo4 Philadelphia-positivo (LMC Ph+) na fase acelerada, blástica mieloide /linfoide5, ou para Leucemia3 Linfoblástica Aguda Cromossomo4 Philadelphia-positivo (LLA Ph+) é de 140 mg administrada oralmente uma vez ao dia.
Os comprimidos não devem ser esmagados, cortados ou mastigados. Eles devem ser ingeridos inteiros. Sprycel pode ser administrado junto ou não com a alimentação, pela manhã ou à noite.
Sprycel não deve ser tomado com toranja (grapefruit) ou suco de toranja (vide Drogas que podem aumentar a concentração plasmática do dasatinibe).
Em estudos clínicos, o tratamento com Sprycel em adultos com LMC na fase crônica; LMC nas fases acelerada, mieloide ou linfoblástica (fases avançadas); ou LLA Ph+ foi continuado até a progressão da doença ou até que o paciente não tolerasse mais o medicamento. O efeito da suspensão do tratamento na evolução da doença a longo prazo após atingir-se uma resposta citogenética (incluindo resposta citogenética completa [RCC]) ou resposta molecular maior (RMM) não foi investigado.
Modificação da dose
O aumento ou redução da dose é recomendado baseado na resposta e tolerabilidade individual do paciente.
Concomitantemente com fortes indutores da CYP3A4
O uso concomitante de um forte indutor da CYP3A4 pode diminuir as concentrações plasmáticas de dasatinibe e deve ser evitado (exemplo: dexametasona, fenitoína, carbamazepina, rifampina, rifabutina, fenobarbital). Erva de São João pode diminuir as concentrações plasmáticas de dasatinibe de maneira imprevisível e deve ser evitada. Se fortes indutores da CYP3A4 devem ser co-administrados aos pacientes, baseado nos estudos farmacocinéticos, um aumento na dose de Sprycel deve ser considerado. Se a dose de Sprycel for aumentada, o paciente deve ser cuidadosamente monitorado para a toxicidade6 (vide 6. INTERAÇÕES MEDICAMENTOSAS).
Concomitantemente com fortes inibidores da CYP3A4
Inibidores da CYP3A4 (exemplo: cetoconazol, itraconazol, claritromicina, atazanavir, indinavir, nefazodona, nelfinavir, ritonavir, saquinavir, telitromicina e voriconazol) podem aumentar a concentração plasmática de dasatinibe e devem ser evitados. Suco de toranja (grapefruit) também pode aumentar a concentração plasmática de dasatinibe e deve ser evitado.
A escolha de medicação concomitante alternativa com mínimo ou nenhum potencial para inibição enzimática, se possível, é recomendada. Se Sprycel precisar ser administrado com um inibidor potente da CYP3A4, um decréscimo da dose deve ser considerado:
- Para pacientes22 tomando 140 mg de Sprycel por dia, um decréscimo para 40 mg por dia.
- Para pacientes22 tomando 100 mg de Sprycel por dia, um decréscimo para 20 mg por dia.
- Para pacientes22 tomando 70 mg de Sprycel por dia, um decréscimo para 20 mg por dia.
Para pacientes22 tomando 60 mg ou 40 mg por dia de Sprycel, considerar a interrupção do tratamento com Sprycel até que o tratamento com o inibidor seja terminado. Quando o forte inibidor for descontinuado, um período de eliminação (washout) de aproximadamente uma semana deve ser considerado antes que seja reiniciado o tratamento com Sprycel.
Essas reduções na dose de Sprycel são previstas para ajustar a área sob a curva (AUC27) para a faixa observada sem inibidores de CYP3A4. No entanto, não existem dados clínicos com esses ajustes de dose em pacientes recebendo fortes inibidores de CYP3A4. Se Sprycel não é tolerado após a redução da dose, ou o forte inibidor de CYP3A4 deve ser descontinuado, ou o tratamento com Sprycel deve ser interrompido até que o tratamento com o inibidor seja terminado. Quando o forte inibidor é descontinuado, um período de eliminação (washout) de aproximadamente uma semana deve ser considerado antes que a dose de Sprycel seja aumentada (vide 6. INTERAÇÕES MEDICAMENTOSAS).
Escalonamento da dose
Em estudos clínicos realizados com pacientes adultos com LMC Ph+ e LLA Ph+, o escalonamento da dose para 140 mg uma vez ao dia (LMC Ph+ fase crônica) ou 180 mg uma vez ao dia (LMC Ph+ fase avançada e LLA Ph+) foi permitido para os pacientes que não atingiram uma resposta hematológica ou citogenética na dose inicial recomendada.
Ajuste da dose para reações adversas
Mielossupressão
Em estudos clínicos, a mielossupressão foi tratada com a interrupção da dose, redução da dose ou suspensão da terapia em estudo. O fator de crescimento hematopoiético tem sido utilizado em pacientes com mielossupressão resistente. Transfusão104 de plaquetas23 e transfusão104 de hemácias105 foram utilizadas conforme apropriado. As diretrizes para modificação de dose estão resumidas na Tabela 7.
Tabela 7. Ajustes da Dose para Neutropenia40 e Trombocitopenia39
|
LMC Ph+ Fase crônica (dose inicial 100 mg uma vez ao dia) |
CNA* < 0,5 × 109/L |
|
|
LMC Ph+ Fase Acelerada, LMC Ph+ Fase Blástica e LLA Ph+ (dose inicial 140 mg uma vez ao dia) |
CNA* < 0,5 × 109/L |
|
|
*CNA: Contagem de neutrófilos25 absolutos |
||
Reações adversas não-hematológicas
Caso ocorra uma reação adversa não-hematológica moderada (grau 2) com Sprycel, o tratamento deve ser interrompido até que a reação adversa tenha sido resolvida ou tenha sido retornada a condição inicial. A mesma dose deve ser restabelecida caso esta seja a primeira ocorrência e a dose deve ser reduzida se esta for uma reação adversa recorrente. Caso haja o desenvolvimento de reações adversas não-hematológicas graves (graus 3 ou 4) com o uso do Sprycel, o tratamento deve ser suspenso até a resolução ou melhora do evento. Então o tratamento pode ser reiniciado conforme adequado em uma dose reduzida dependendo da gravidade inicial e da recorrência106 do evento (vide 5. ADVERTÊNCIAS E PRECAUÇÕES).
Para pacientes22 com LMC na fase crônica que receberam 100 mg uma vez ao dia, é recomendada a redução da dose para 80 mg uma vez ao dia com uma redução maior, se necessário. Para pacientes22 com LMC em fase avançada ou LLA Ph+ que receberam 140 mg uma vez ao dia, é recomendada a redução de dose para 100 mg uma vez ao dia com uma redução maior, se necessário. (vide 5. ADVERTÊNCIAS E PRECAUÇÕES).
Derrame48 pleural: se um derrame48 pleural é diagnosticado, interromper dasatinibe até o paciente estar assintomático ou tiver retornado à linha basal. Se o episódio não melhorar dentro de aproximadamente uma semana, considerar o uso de diuréticos49 ou corticosteroides ou ambos concomitantemente. Depois da resolução do primeiro episódio, considerar a reintrodução do dasatinibe na mesma dose. Depois da resolução de um episódio recorrente, reintroduzir o dasatinibe em uma dose reduzida. Depois da resolução de um episódio severo (Grau 3 ou 4), o tratamento pode ser retomado com uma dose reduzida apropriada dependendo da severidade do evento.
Manuseio e Descarte
Procedimentos para o manuseio correto e descarte de medicamentos contra o câncer108 devem ser considerados. Foram publicadas diversas diretrizes sobre o assunto.
Sprycel (dasatinibe) comprimidos consiste de um comprimido central (contendo a substância ativa), revestido por uma camada de filme para impedir a exposição dos profissionais de saúde2 à substância ativa.
Os produtos não utilizados ou os resíduos devem ser eliminados de acordo com as exigências locais.
Mulheres grávidas devem evitar a exposição aos comprimidos amassados ou quebrados.
Risco de uso por via de administração não recomendada
Para segurança e eficácia desta apresentação, Sprycel não deve ser administrado por vias não recomendadas. A administração deve ser somente pela via oral.
Este medicamento não deve ser partido, aberto ou mastigado.
Sprycel deve ser engolido inteiro para manter a consistência da dose e minimizar o risco de exposição à pele109. Os comprimidos revestidos não devem ser dispersados uma vez que a exposição em pacientes recebendo um comprimido dispersado é menor do que em aqueles que ingerem um comprimido inteiro.
REAÇÕES ADVERSAS
As seguintes reações adversas estão discutidas com mais detalhes em outros itens da bula:
- Mielossupressão (vide 8. POSOLOGIA E MODO DE USAR - Ajuste da dose para reações adversas e PRECAUÇÕES - Gerais)
- Eventos relacionados a sangramentos (vide 5. ADVERTÊNCIAS E PRECAUÇÕES – Gerais)
- Retenção de líquidos (vide 5. ADVERTÊNCIAS E PRECAUÇÕES – Gerais)
- Prolongamento do intervalo QT (vide 5. ADVERTÊNCIAS E PRECAUÇÕES – Gerais)
- Reações adversas cardíacas (vide 5. ADVERTÊNCIAS E PRECAUÇÕES – Gerais)
- Reações Dermatológicas Graves (vide 5. ADVERTÊNCIAS E PRECAUÇÕES – Gerais)
- Hipertensão54 Pulmonar Arterial (vide 5. ADVERTÊNCIAS E PRECAUÇÕES – Gerais)
Pelo fato dos estudos clínicos serem conduzidos sob condições amplamente variadas, as taxas de reações adversas observadas nos estudos clínicos de uma droga não podem ser comparadas diretamente às taxas nos estudos clínicos de uma outra droga e podem não refletir as taxas observadas na prática.
Os dados descritos a seguir demonstram a exposição do Sprycel em todas as doses em 324 pacientes com LMC em fase crônica recém-diagnosticada e em 2388 pacientes com LMC ou LLA Ph+ em fase crônica ou avançada intolerantes ou resistentes ao imatinibe nos estudos clínicos, sendo que 1618 pacientes com um mínimo de 2 anos de acompanhamento e 662 pacientes com LMC em fase crônica com acompanhamento mínimo de 84 meses (dose inicial 100 mg uma vez ao dia, 140 mg uma vez ao dia, 50 mg duas vezes ao dia ou 70 mg duas vezes ao dia). A duração média do tratamento em 2712 pacientes tratados com Sprycel foi de 19,2 meses (variando entre 0-93,2 meses).
No estudo de Fase 3 de LMC fase crônica recém-diagnosticada, a duração média do tratamento foi de aproximadamente 60 meses tanto para Sprycel (variando entre 0,03-72,7 meses) quanto para imatinibe (variando entre 0,3-74,6 meses). A duração média do tratamento em 1618 pacientes com LMC fase crônica foi de 29 meses (variando entre 0-92,9 meses). Em 1094 pacientes com LCM em fase avançada ou LLA Ph+, a duração média do tratamento dos pacientes foi de 6,2 meses (variando entre 0-93,2 meses).
A maioria dos pacientes tratados com Sprycel apresentou algum tipo de reação adversa em algum momento. Na população total de 2712 pacientes tratados com Sprycel, 520 (19%) tiveram reações adversas que levaram à descontinuação do medicamento.
No estudo Fase 3 de LMC fase crônica recém-diagnosticada, o tratamento foi descontinuado por reações adversas em 14% dos pacientes recebendo Sprycel e 7% dos pacientes recebendo imatinibe com acompanhamento mínimo de 60 meses. Entre os 1618 pacientes com LMC fase crônica tratados com Sprycel, reações adversas que levaram a descontinuação foram reportadas em 329 (20,3%) dos pacientes, e entre os 1094 pacientes com a doença em fase avançada tratados com Sprycel, reações adversas que levaram a descontinuação foram reportadas em 191 (17,5%) pacientes.
Reações adversas reportadas em ≥ 10% dos pacientes, e outras reações de interesse, em um estudo Fase 3 de LMC fase crônica recém-diagnosticada com acompanhamento mínimo de 60 meses estão apresentados na Tabela 8. Neste estudo, derrame48 pleural foi reportado em 73 pacientes (28%) tratados com Sprycel. O tempo médio para início do derrame48 pleural Graus 1 e 2 foram 114 semanas (variando entre 4-299 semanas).
Menos de 3% dos eventos de derrame48 pleural foram Grau 3 ou 4. Com cuidado médico apropriado, 58 pacientes (80% daqueles com derrame48 pleural) puderam continuar com Sprycel (vide 5. ADVERTÊNCIAS E PRECAUÇÕES).
Leucemia3 Mieloide Crônica recém-diagnosticada
Tabela 8. Reações Adversas Reportadas em ≥ 10% dos Pacientes em estudo fase 3 (LMC em fase crônica recém-diagnosticada, mínimo de 60 meses de acompanhamento)
|
Termo Preferido |
Todos os Graus |
Graus 3/4 |
||
|
Sprycel n=258 |
Imatinibe n=258 |
Sprycel n=258 |
Imatinibe n=258 |
|
|
Porcentagem (%) dos Pacientes |
||||
|
Retenção de fluídos |
39 |
45 |
5 |
1 |
|
Derrame48 Pleural |
28 |
1 |
3 |
0 |
|
Edema110 superficial localizado |
14 |
38 |
0 |
<1 |
|
Hipertensão54 pulmonar |
5 |
1 |
<1 |
0 |
|
Edema110 generalizado |
4 |
7 |
0 |
0 |
|
Derrame48 do pericárdio52 |
4 |
1 |
1 |
0 |
|
Insuficiência cardíaca congestiva14/disfunção cardíacaa |
2 |
1 |
<1 |
<1 |
|
Edema pulmonar53 |
1 |
0 |
0 |
0 |
|
Diarreia111 |
22 |
23 |
1 |
1 |
|
Dor músculo-esquelética |
14 |
17 |
0 |
<1 |
|
Rash112b |
14 |
18 |
0 |
2 |
|
Dor de cabeça113 |
13 |
11 |
0 |
0 |
|
Dor abdominal |
11 |
8 |
0 |
<1 |
|
Cansaço |
11 |
12 |
<1 |
0 |
|
Náusea114 |
10 |
25 |
0 |
0 |
|
Mialgia115 |
7 |
12 |
0 |
0 |
|
Artralgia116 |
7 |
10 |
0 |
<1 |
|
Hemorragia42c |
7 |
7 |
1 |
1 |
|
Sangramento gastrointestinal |
2 |
1 |
1 |
0 |
|
Outro sangramentod |
6 |
6 |
0 |
1 |
|
Vômito117 |
5 |
12 |
0 |
0 |
|
Espasmo118 muscular |
5 |
21 |
0 |
<1 |
a Inclui insuficiência cardíaca119 aguda, insuficiência cardíaca congestiva14, cardiomiopatia, disfunção diastólica, decréscimo da fração de ejeção e disfunção ventricular esquerda.
b Inclui eritema120, eritema multiforme73, rash112, rash112 generalizado, rash112 macular, rash112 papular, esfoliação da pele109 e rash112 vesicular.
c Reação adversa de interesse especial com <10% de frequência.
d Inclui hemorragia42 conjuntival, hemorragia42 auricular, equimose121, epistaxe122, hemorragia42 ocular, sangramento gengival, hematoma123, hematúria124, hemoptise125, hematoma123 intra-abdominal, petéquia126, hemorragia42 escleral, hemorragia42 uterina e hemorragia vaginal127.
Leucemia3 Mieloide Crônica resistentes ou intolerantes ao imatinibe
Os eventos adversos graves foram relatados em 26,1% dos pacientes tratados na dose recomendada de 100 mg uma vez ao dia em um estudo clínico Fase 3 com pacientes com LMC na fase crônica resistentes ou intolerantes à terapia anterior com imatinibe. O único evento adverso grave reportado em ≥ 5% dos pacientes foi derrame48 pleural (10%).
No estudo clínico de Fase 3 de otimização da dose a duração média do tratamento para pacientes22 com LMC na fase crônica que receberem 100 mg uma vez ao dia foi de 37 meses (faixa de 1 - 91 meses). A duração média do tratamento para pacientes22 com LMC na fase avançada que receberam 140 mg uma vez ao dia foi de 14 meses (faixa de < 1 - 36 meses) para LMC na fase acelerada, 3 meses (faixa de < 1-32 meses) para LMC na fase mieloide blástica, e 4 meses (faixa de < 1 - 22 meses) para LMC na fase linfoide5 blástica.
As reações adversas (excluindo anormalidades laboratoriais) que foram reportadas em pelo menos 10% dos pacientes com LMC que receberam as doses iniciais recomendadas de Sprycel estão demonstradas por fase da doença na Tabela 10.
Tabela 10. Reações Adversas relatadas em ≥ 10% dos pacientes em Estudos Clínicos do Sprycel em LMC
|
Termo preferido |
100 mg uma vez ao dia |
140 mg uma vez ao dia |
||||||
|
Crônico128 |
Acelerada |
Mieloide Blástica |
Linfoide5 Blástica |
|||||
|
Todos Graus os Graus 3/4 |
Todos Graus os Graus 3/4 |
Todos Graus os Graus 3/4 |
Todos Graus os Graus 3/4 |
|||||
|
Porcentagem (%) dos pacientes |
||||||||
|
Retenção de Líquidos |
42 |
5 |
35 |
8 |
34 |
7 |
21 |
6 |
|
Edema110 Superficial localizado |
21 |
0 |
18 |
1 |
14 |
0 |
3 |
0 |
|
Derrame48 Pleural |
24 |
4 |
21 |
7 |
20 |
7 |
21 |
6 |
|
Edema110 generalizado |
4 |
0 |
1 |
0 |
3 |
0 |
0 |
0 |
|
Derrame48 do pericárdio52 |
2 |
1 |
3 |
1 |
0 |
0 |
0 |
0 |
|
Insuficiência cardíaca congestiva14/disfunção cardíacaa |
0 |
0 |
0 |
0 |
4 |
0 |
0 |
0 |
|
Edema pulmonar53 |
0 |
0 |
1 |
0 |
4 |
3 |
0 |
0 |
|
Cefaleia129 |
33 |
1 |
27 |
1 |
18 |
1 |
15 |
3 |
|
Diarreia111 |
28 |
2 |
31 |
3 |
20 |
5 |
18 |
0 |
|
Fadiga78 |
26 |
4 |
19 |
2 |
20 |
1 |
9 |
3 |
|
Dispneia56 |
24 |
2 |
20 |
3 |
15 |
3 |
3 |
3 |
|
Dor músculo-esquelética |
22 |
2 |
11 |
0 |
8 |
1 |
0 |
0 |
|
Náusea114 |
18 |
1 |
19 |
1 |
23 |
1 |
21 |
3 |
|
Erupção130 cutânea131b |
18 |
2 |
15 |
0 |
16 |
1 |
21 |
0 |
|
Mialgia115 |
13 |
0 |
NA |
NA |
NA |
NA |
NA |
NA |
|
Artralgia116 |
12 |
1 |
10 |
0 |
5 |
1 |
0 |
0 |
|
Infecção66 (incluindo bacteriana, viral, fúngica132 e não-especificada) |
13 |
1 |
10 |
6 |
14 |
7 |
9 |
0 |
|
Dor abdominal |
12 |
1 |
NA |
NA |
NA |
NA |
NA |
NA |
|
Hemorragia42 |
11 |
1 |
26 |
8 |
19 |
9 |
24 |
9 |
|
Sangramento gastrointestinal |
2 |
1 |
8 |
6 |
9 |
7 |
9 |
3 |
|
Sangramento no SNC44 |
0 |
0 |
1 |
1 |
0 |
0 |
3 |
3 |
|
Prurido133 |
10 |
1 |
NA |
NA |
NA |
NA |
NA |
NA |
|
Dor |
10 |
1 |
NA |
NA |
NA |
NA |
NA |
NA |
|
Vômito117 |
NA |
NA |
11 |
1 |
12 |
0 |
15 |
0 |
|
Pirexia134 |
NA |
NA |
11 |
2 |
18 |
3 |
6 |
0 |
|
Neutropenia40 febril |
NA |
NA |
4 |
4 |
12 |
12 |
12 |
12 |
a Inclui disfunção ventricular, insuficiência cardíaca congestiva14, cardiomiopatia, cardiomiopatia congestiva, disfunção diastólica, decréscimo da fração de ejeção e insuficiência135 ventricular.
b Inclui erupção130 da droga, eritema120, eritema multiforme73, eritrose, erupção130 cutânea131 exfoliativa, eritema120 generalizado, erupção130 cutânea131 genital, erupção130 cutânea131 de calor, milia, erupção130 cutânea131, erupção130 cutânea131 eritematosa136, erupção130 cutânea131 folicular, erupção130 cutânea131 generalizada, erupção130 cutânea131 macular, erupção130 maculopapular137, erupção130 cutânea131 papular, erupção130 pruriginosa, erupção130 cutânea131 pustular, esfoliação da pele109, irritação da pele109, urticária138 vesiculosa, e erupção130 cutânea131 vesicular.
As taxas cumulativas de reações adversas selecionadas que foram relatadas ao longo do tempo em pacientes tratados com a dose de início recomendada de 100 mg uma vez ao dia em um estudo clínico de Fase 3 com pacientes com LMC de fase crônica resistentes ou intolerantes ao imatinibe são apresentadas na Tabela 11.
Tabela 11: Reações adversas Selecionadas Reportadas em Estudo Clínico Fase 3 de Otimização de Dose (LMC em Fase Crônica Resistente ou Intolerante ao imatinibe)a
|
Termo Preferido |
Mínimo de 2 Anos de Acompanhamento |
Mínimo de 5 Anos de Acompanhamento |
Mínimo de 7 anos de Acompanhamento |
|||
|
Todos os Graus |
Grau 3/4 |
Todos os Graus |
Grau 3/4 |
Todos os Graus |
Grau 3/4 |
|
|
Porcentagem (%) dos pacientes |
||||||
|
Diarreia111 |
27 |
2 |
28 |
2 |
28 |
2 |
|
Retenção de Líquido |
34 |
4 |
42 |
6 |
48 |
7 |
|
Edema110 Superficial |
18 |
0 |
21 |
0 |
22 |
0 |
|
Derrame48 Pleural |
18 |
2 |
24 |
4 |
28 |
5 |
|
Edema110 generalizado |
3 |
0 |
4 |
0 |
4 |
0 |
|
Efusão81 do pericárdio52 |
2 |
1 |
2 |
1 |
3 |
1 |
|
Hipertensão54 pulmonar |
0 |
0 |
0 |
0 |
2 |
1 |
|
Hemorragia42 |
11 |
1 |
11 |
1 |
12 |
1 |
|
Sangramento gastrointestinal |
2 |
1 |
2 |
1 |
2 |
1 |
a Resultados do Estudo Clínico Fase 3 de otimização de dose relatados com a população de dose inicial recomendada de 100 mg uma vez ao dia.
Anormalidades Laboratoriais
A mielossupressão foi comumente relatada em todas as populações de pacientes. Na LMC fase crônica recém- diagnosticada, mielossupressão foi menos frequentemente reportada do que em pacientes com LMC fase crônica resistentes ou intolerantes à terapia prévia com imatinibe. A frequência de neutropenia40, trombocitopenia39 e anemia41 de Graus 3 ou 4 foi mais alta em pacientes com LMC na fase avançada ou LLA Ph+ do que em pacientes com LMC na fase crônica (Tabela 13). Mielossupressão foi relatada em pacientes com valores laboratoriais basais normais bem como em pacientes que já apresentavam anormalidades laboratoriais.
Em pacientes que apresentaram mielossupressão grave, a recuperação ocorreu geralmente após interrupção ou redução das doses, e a descontinuação permanente do tratamento ocorreu em 2% dos pacientes no estudo de Fase 3 com LMC fase crônica recém-diagnosticados e em 5% dos pacientes no estudo de Fase 3 resistentes ou intolerantes à terapia prévia com imatinibe (vide 5. ADVERTÊNCIAS E PRECAUÇÕES).
Elevações de Grau 3 ou 4 da transaminase ou bilirrubina139 e hipocalcemia140, hipocalemia58 e hipofosfatemia de graus 3 e 4 foram relatadas em pacientes em todas as fases de LMC, porém foram relatadas com uma frequência aumentada em pacientes com LMC nas fases mieloide ou linfoide5 blásticas. Elevações na transaminase ou bilirrubina139 foram geralmente tratadas com redução ou interrupção da dose. Pacientes desenvolvendo hipocalcemia140 graus 3 ou 4 durante o tratamento com Sprycel frequentemente recuperaram-se com suplementação141 oral de cálcio.
A Tabela 12 mostra os achados laboratoriais de um estudo clínico com pacientes com LMC fase crônica recém- diagnosticados. Não houve descontinuação de Sprycel devido a parâmetros bioquímicos laboratoriais.
Tabela 12. Anormalidades Laboratoriais CTC Grau 3/4 em um Estudo Fase 3 de Pacientes com LMC em Fase Crônica Recém-diagnosticados
|
Sprycel |
Imatinibe |
|
|
Porcentagem (%) dos Pacientes |
||
|
Parâmetros Hematológicos |
||
|
Neutropenia40 |
29 |
24 |
|
Trombocitopenia39 |
22 |
14 |
|
Anemia41 |
13 |
9 |
|
Parâmetros Bioquímicos |
||
|
Hipofosfatemia |
7 |
31 |
|
Hipocalemia58 |
0 |
3 |
|
Hipocalcemia140 |
4 |
3 |
|
TGP elevada (ALT) |
<1 |
2 |
|
TGO elevada (AST) |
<1 |
1 |
|
Bilirrubina139 elevada |
1 |
0 |
|
Creatinina142 elevada |
1 |
1 |
Graus CTC: neutropenia40 (Grau 3 ≥0.5–<1.0 × 109/L, Grau 4 <0.5 × 109/L); trombocitopenia39 (Grau 3 ≥25–<50 × 109/L, Grau 4 <25 × 109/L); anemia41 (hemoglobina143 Grau 3 ≥65–<80 g/L, Grau 4 <65 g/L); creatinina142 elevada (Grau 3 >3–6 × limite superior do intervalo normal (ULN), Grade 4 >6 × ULN); bilirrubina139 elevada (Grau 3 >3– 10 × ULN, Grau 4 >10 × ULN); elevadas TGO ou TGP (Grau 3 >5–20 × ULN, Grau 4 >20 × ULN); hipocalcemia140 (Grau 3 <7.0–6.0 mg/dL144, Grau 4 <6.0 mg/dL144); hipofosfatemia (Grau 3 <2.0–1.0 mg/dL144, Grau 4 <1.0 mg/dL144); hipocalemia58 (Grau 3 <3.0–2.5 mmol/L145, Grau 4 <2.5 mmol/L145).
Anormalidades laboratoriais relatadas em pacientes com LMC que receberam as doses iniciais recomendadas de Sprycel estão demonstradas, por fase da doença, na Tabela 13.
Tabela 13. Anormalidades Laboratoriais CTC Grau 3/4 em Estudos Clínicos em LMC
|
|
Fase crônica LMC |
LMC na fase avançada 140 mg uma vez ao dia |
||
|
Fase Acelerada |
Fase Mieloide Blástica |
Fase Linfoide5 Blástica |
||
|
Porcentagem (%) de pacientes |
||||
|
Parâmetros hematológicos* |
||||
|
Neutropenia40 |
35 |
58 |
77 |
79 |
|
Trombocitopenia39 |
24 |
63 |
78 |
85 |
|
Anemia41 |
13 |
47 |
74 |
52 |
|
Parâmetros bioquímicos |
||||
|
Hipofosfatemia |
10 |
13 |
12 |
18 |
|
Hipocalemia58 |
2 |
7 |
11 |
15 |
|
Hipocalcemia140 |
<1 |
4 |
9 |
12 |
|
TGP (ALT) Elevada |
0 |
2 |
5 |
3 |
|
TGO (AST) Elevada |
<1 |
0 |
4 |
3 |
|
Bilirrubina139 Elevada |
<1 |
1 |
3 |
6 |
|
Creatinina142 Elevada |
0 |
2 |
8 |
0 |
|
Graus de CTC: neutropenia40 (Grau 3 ≥0.5 - < 1.0 × 109/L, Grau 4 < 0,5 × 109/L), trombocitopenia39 (Grau 3 ≥ 25 - < 50 × 109/L, Grau 4 < 25 × 109/L), anemia41 (hemoglobina143 Grau 3 ≥ 65 - < 80 g/L, Grau 4 < 65 g/L), elevação de creatinina142 (Grau 3 > 3 - 6 × o limite superior do intervalo normal (ULN), Grau 4 > 6 × ULN); bilirrubina139 elevada (Grau 3 > 3 -10 × ULN, grau 4 > 10 x ULN); elevadas TGO ou TGP (Grau 3 > 5 -20 × ULN, grau 4> 20 x LSN), hipocalcemia140 (Grau 3 < 7,0 - 6,0 mg/dL144, Grau 4 < 6,0 mg/dL144); hipofosfatemia (Grau 3 < 2,0 -1,0 mg/dL144, Grau 4 < 1,0 mg/dL144), hipocalemia58 (Grau 3 < 3,0 – 2,5 mmol/L145, Grau 4 < 2,5 mmol/L145). |
||||
Entre os pacientes com LMC em fase crônica, a taxa cumulativa de citopenias grau 3 ou 4 foram semelhantes aos 2 e 5 anos, incluindo: neutropenia40 (36% vs 36%), trombocitopenia39 (23% vs 24%) e anemia41 (13% vs 13%).
Leucemia3 Linfoblástica Aguda Cromossomo4 Philadelphia-positivo (LLA Ph+)
Um total de 135 pacientes com LLA Ph+ foram tratados com Sprycel em estudos clínicos. A duração média do tratamento foi de 3 meses (faixa de < 1 - 29 meses). O perfil de segurança de pacientes com LLA Ph+ foi similar ao daqueles com LMC na fase blástica/linfoide5. As reações adversas mais frequentemente reportadas incluíram eventos de retenção de líquidos como derrame48 pleural (24%) e edema110 superficial (19%), e desordens gastrointestinais como diarreia111 (31%), náusea114 (24%), e vômito117 (16%). Hemorragia42 (19%), pirexia134 (17%), erupção130 cutânea131 (16%), e dispneia56 (16%) também foram frequentemente reportados. As reações adversas graves mais frequentemente reportadas incluíram derrame48 pleural (11%), sangramento gastrointestinal (7%), neutropenia40 febril (6%), infecção66 (5%), pirexia134 (4%), pneumonia146 (3%), diarreia111 (3%), náusea114 (2%), vômito117 (2%), e colite147 (2%).
Dados Adicionais de Estudos Clínicos
Os seguintes eventos adversos foram relatados em pacientes nos estudos clínicos de LMC e LLA Ph+ com Sprycel em uma frequência muito comum (≥ 10%), comum (1% - < 10%), incomum (0,1% - < 1%) ou raro (< 0,1%). Estes eventos são incluídos com base na relevância clínica.
Tabela 14. Resumo Tabulado das Reações Adversas
|
Distúrbios gastrointestinais |
|
|
Muito comum |
diarreia111, náusea114, vômito117, dor abdominal |
|
Comum |
sangramento gastrointestinal, inflamação148 das mucosas149 (incluindo mucosite150/estomatite151), dispepsia152, distenção abdominal, constipação153, gastrite154, colite147 (incluindo colite147 neutropênica), patologias dos tecidos moles da via oral |
|
Incomum |
ascite155, disfagia156, fissura157 anal, úlcera158 gastrointestinal superior, esofagite159, pancreatite160, doença do refluxo gastroesofágico161 |
|
Raro |
gastroenteropatia perdedora de proteínas31, íleo paralítico162, pancreatite160 aguda, fístula163 anal |
|
Distúrbios gerais e condições no local de administração |
|
|
Muito comum |
fadiga78, pirexia134, edema110 periféricoa, edema110 facialb |
|
Comum |
astenia164, dor, dor no peito70, edema110 generalizadoc, arrepios |
|
Incomum |
mal-estar, outro edema110 superficiald |
|
Raro |
alteração de marcha |
|
Distúrbios da pele109 e tecidos subcutâneos |
|
|
Muito comum |
rash112 cutâneo165e |
|
Comum |
prurido133, alopécia166, acne167, pele109 seca, hiper-hidrose, urticária138, dermatite168 (incluindo eczema169) |
|
Incomum |
distúrbio de pigmentação, úlcera158 da pele109, condições bolhosas, reação de fotossensibilidade, distúrbio nas unhas170, dermatose171 neutrofílica, paniculite, síndrome59 de eritrodisestesia palmo-plantar, alteração capilar172 |
|
Raro |
vasculite173 leucocitoclástica, fibrose174 cutânea131 |
|
Desconhecido |
síndrome59 de Stevens-Johnsonf |
|
Distúrbios respiratórios, torácicos e do mediastino175 |
|
|
Muito comum |
derrame48 pleural, dispneia56 |
|
Comum |
edema pulmonar53, infiltração pulmonar, pneumonite176, hipertensão54 pulmonar, tosse |
|
Incomum |
asma177, broncoespasmo178, disfonia179, hipertensão arterial75 pulmonar |
|
Raro |
síndrome59 da angústia respiratória aguda, embolismo180 pulmonar |
|
Desconhecido |
doença pulmonar intersticial181 |
|
Distúrbios do sistema nervoso182 |
|
|
Muito comum |
cefaleia129 |
|
Comum |
neuropatia183 (incluindo neuropatia periférica184), tontura80, disgeusia185, sonolência |
|
Incomum |
sangramento no sistema nervoso182 centralg, amnésia186, tremor, síncope187, distúrbio de equilíbrio |
|
Raro |
convulsões, acidente vascular cerebral188, ataque isquêmico189 transitório, neurite190 óptica, paralisia191 do 7º nervo, demência192, ataxia193 |
|
Distúrbios do sangue18 e sistema linfático194 |
|
|
Muito comum |
mielosupressão (incluindo anemia41, neutropenia40 e trombocitopenia39) |
|
Comum |
neutropenia40 febril |
|
Incomum |
linfoadenopatia195, linfopenia |
|
Raro |
aplasia pura de células10 vermelhas |
|
Distúrbios músculo esqueléticos e do tecido conjuntivo196 |
|
|
Muito comum |
dor músculo-esquelética |
|
Comum |
artralgia116, mialgia115, fraqueza muscular, rigidez muscular esquelética, espasmo118 muscular |
|
Incomum |
rabdomiólise197, tendinite198, inflamação148 muscular, osteonecrose, artrite199 |
|
Investigações |
|
|
Comum |
aumento do peso, diminuição do peso |
|
Incomum |
creatino-fosfoquinase sanguínea aumentada, aumento da gama-glutamiltransferase |
|
Infecções200 e infestações |
|
|
Muito comum |
infecção66 (incluindo bacteriana, viral,fúngica132 e não específica) |
|
Comum |
pneumonia146 (incluindo bacteriana, viral e fúngica132), infecções200/ inflamação148 do trato respiratório superior, infecção66 pelo vírus62 do herpes, infecção66 enterocolite; septicemia201 (incluindo relatos incomuns de resultados fatais) |
|
Desconhecido |
Reativação da hepatite61 B |
|
Distúrbios do metabolismo32 e nutrição202 |
|
|
Comum |
distúrbios do apetiteh, hiperuricemia |
|
Incomum |
hipoalbuminemia203, síndrome59 da lise204 tumoral, desidratação205, hipercolesterolemia206 |
|
Raro |
diabetes mellitus207 |
|
Distúrbios cardíacos |
|
|
Comum |
derrame48 pericárdico, insuficiência cardíaca congestiva14/ disfunção cardíacai, arritmias16 (incluindo taquicardia208), palpitações67 |
|
Incomum |
angina15 pectoris, cardiomegalia209, pericardite210, arritmia211 ventricular (incluindo taquicardia208 ventricular), infarto do miocárdio13 (incluindo resultados fatais), prolongamento do intervalo QT, eletrocardiograma212 da onda T anormal, aumento da troponina |
|
Raro |
cor pulmonale, miocardite213, síndrome59 coronariana aguda, parada cardíaca, prolongamento do intervalo PR do eletrocardiograma212, doença arterial coronariana, pleuropericardite |
|
Desconhecido |
fibrilação atrial / flutter atrialj |
|
Distúrbios oculares |
|
|
Comum |
distúrbio visual (incluindo perturbação visual, visão101 obscurecida, e acuidade visual214 reduzida), vista seca |
|
Incomum |
conjuntivite215, deficiência visual, fotofobia216, aumento do lacrimejamento |
|
Distúrbios vasculares217 |
|
|
Muito comum |
hemorragia42k |
|
Comum |
rubores, hipertensão54 |
|
Incomum |
hipotensão218, tromboflebite219, trombose220 |
|
Raro |
livedo reticulares221, trombose venosa profunda222, embolismo180 |
|
Desconhecido |
microangiopatia trombótica223 (MAT) |
|
Distúrbios psiquiátricos |
|
|
Comum |
insônia, depressão |
|
Incomum |
ansiedade, instabilidade emocional, confusão, redução da libido224 |
|
Gravidez96, Puerpério225 e Condições pré-natais |
|
|
Raro |
aborto |
|
Distúrbios do sistema reprodutivo e mamas226 |
|
|
incomum |
ginecomastia227, desordem menstrual |
|
Lesões228, intoxicações e complicações do procedimento |
|
|
Comum |
contusão229 |
|
Distúrbios do ouvido e labirinto230 |
|
|
Comum |
tinitus |
|
Incomum |
vertigem231, perda da audição |
|
Distúrbios hepatobiliares232 |
|
|
Incomum |
colestase233, colecistite234, hepatite61 |
|
Distúrbios renais e urinários |
|
|
Incomum |
frequência urinária, insuficiência renal82, proteinúria235 |
|
Raro |
falência renal236 |
|
Desconhecido |
síndrome nefrítica237 |
|
Distúrbios imunológicos |
|
|
Incomum |
hipersensibilidade (incluindo eritema nodoso238) |
|
Distúrbios endócrinos |
|
|
Incomum |
hipotireoidismo239 |
|
Raro |
hipertireoidismo240, tireoidite |
a Inclui edema110 gravitacional, edema110 localizado e edema110 periférico.
b Inclui edema110 conjuntival, edema110 ocular, inchaço241 ocular, edema110 palpebral, edema110 facial, edema110 labial, edema macular242, edema110 na boca243, edema110 orbital, edema110 periorbital e inchaço241 facial.
c Inclui sobrecarga hídrica, retenção de líquidos, edema110 gastrintestinal, edema110 generalizado, edema110, edema110 por doença cardíaca, derrame48 perinéfrico, edema110 pós-procedimento e edema110 visceral.
d Inclui inchaço241 genital, edema110 no local da incisão244, edema110 genital, edema110 peniano, inchaço241 peniano, edema110 escrotal, inchaço241 da pele109, inchaço241 testicular e inchaço241 vulvovaginal.
e Inclui erupção130 medicamentosa, eritema120, eritema multiforme73, eritrose, erupção130 cutânea131 exfoliativa, eritema120 generalizado, erupção130 cutânea131 genital, erupção130 cutânea131 ao calor, mília, miliária, psoríase245 pustulosa, erupção130 cutânea131, erupção130 cutânea131 eritematosa136, erupção130 cutânea131 folicular, erupção130 cutânea131 generalizada, erupção130 cutânea131 macular, erupção130 cutânea131 maculopapular137, erupção130 cutânea131 papular, erupção130 cutânea131 pruriginosa, erupção130 cutânea131 pustulosa, erupção130 cutânea131 vesicular, esfoliação da pele109, irritação da pele109, erupção130 cutânea131 tóxica, urticária138 vesiculosa e erupção130 vasculítica.
f Tipicamente reportado em pacientes idosos ou em pacientes com fatores de confusão, incluindo significantes distúrbios cardiovasculares ou cardíacos simultâneos ou subjacentes, ou outras comorbidades77 significantes (por exemplo.: infecção66 grave / sepse246, anormalidades eletrolíticas).
g Inclui hemorragia42 do sistema nervoso central45, hematoma123 cerebral, hemorragia42 cerebral, hematoma123 extradural, hemorragia42 intracraniana, acidente vascular cerebral188 hemorrágico247, hemorragia42 subaracnoideia, hematoma123 subdural e hemorragia42 subdural.
h Inclui diminuição do apetite, saciedade precoce, aumento do apetite.
i Inclui peptídeo natriurético cerebral aumentado, disfunção ventricular, disfunção ventricular esquerda, disfunção ventricular direita, insuficiência cardíaca119, insuficiência cardíaca119 aguda, insuficiência cardíaca119 crônica, insuficiência cardíaca congestiva14, cardiomiopatia, cardiomiopatia congestiva, disfunção diastólica, fração de ejeção diminuída, insuficiência135 ventricular, insuficiência135 ventricular esquerda, insuficiência135 ventricular direita e hipocinesia ventricular.
j No período pós-comercialização foram relatados casos individuais de síndrome de Stevens-Johnson72. Não foi possível determinar se estas reações mucocutâneas adversas estavam diretamente relacionadas a Sprycel ou a medicações concomitantes.
k Não inclui sangramento gastrointestinal e sangramento do sistema nervoso central45; estas reações adversas são reportadas como distúrbios gastrointestinais e distúrbios do sistema nervoso182, respectivamente.
Em casos de eventos adversos, notifique pelo Sistema VigiMed, disponível no Portal da Anvisa.
SUPERDOSE
Experiência de superdose com Sprycel nos estudos clínicos está limitada a casos isolados. A maior superdose de 280 mg por dia durante 1 semana foi relatada em dois pacientes e ambos desenvolveram significante diminuição na contagem de plaquetas23. Uma vez que Sprycel está associado com grave mielossupressão (vide 5. ADVERTÊNCIAS E PRECAUÇÕES e 9. REAÇÕES ADVERSAS), pacientes que tomarem mais do que a dose recomendada devem ser cuidadosamente monitorados para mielossupressão e tratamento de suporte adequado deve ser dado.
Superdose aguda em animais foi associada à cardiotoxicidade. Evidências de cardiotoxicidade incluíram necrose248 ventricular e hemorragia42 valvular/ ventricular/ atrial em doses únicas ≥ 100 mg/Kg (600 mg/m2) em roedores. Houve uma tendência para aumento da pressão arterial sistólica249 e diastólica em macacos em doses únicas ≥ 10 mg/Kg (120 mg/m2).
Em caso de intoxicação ligue para 0800 722 6001, se você precisar de mais orientações.
REFERÊNCIAS
- NIOSH Alert: Preventing occupational exposures to antineoplastic and other hazardous drugs in health care settings. 2004. U.S. Department of Health and Human Services, Public Health Service, Centers for Disease Control and Prevention, National Institute for Occupational Safety and Health, DHHS (NIOSH) Publication Nº. 2004–165.
- OSHA Technical Manual, TED 1-0.15A, Section VI: Chapter 2. Controlling Occupational Exposure to Hazardous Drugs. OSHA, 1999, http://www.osha.gov/dts/osta/otm/otm_vi/otm_vi_2.html.
- American Society of Health-System Pharmacists. ASHP guidelines on handling hazardous drugs. Am J Health-Syst Pharm. (2006) 63:1172–1193.
- Polovich M, White JM, Kelleher LO (eds). 2005. Chemotherapy and biotherapy guidelines and recommendations for practice (2nd ed). Pittsburgh, PA: Oncology Nursing Society.
- Shah NP, Guilhot F, Cortes JE et al. Long-term outcome with dasatinib after imatinib failure in chronic- phase chronic myeloid leukemia: follow-up of a phase 3 study. Blood. 2014 Apr 10;123(15):2317-24.
- Lilly MB, Ottmann OG, Shah NP et al. Dasatinib 140 mg once daily versus 70 mg twice daily in patients with Ph-positive acute lymphoblastic leukemia who failed imatinib: Results from a phase 3 study. Am J Hematol. 2010 Mar;85(3):164-70.
- Cortes J, Saglio G, Baccarani M et al. Final Study Results of the Phase 3 Dasatinib Versus Imatinib in Newly Diagnosed Chronic Myeloid Leukemia in Chronic Phase (CML-CP) Trial (DASISION, CA180-056). 56th ASH Annual Meeting and Exposition; 2014 Dec 6-9; San Francisco, United States.
DIZERES LEGAIS
VENDA SOB PRESCRIÇÃO MÉDICA
Reg. MS – 1.0180.0392
Responsável Técnico: Tais Helena Daronco Conti CRF-SP 35.315
Fabricado por:
AstraZeneca Pharmaceuticals LP
4601 Highway 62 East
Mount Vernon – Indiana – EUA
Ou
Patheon Inc. 2100 Syntex Court
Mississauga – Ontário – Canadá
Embalado por:
AndersonBrecon Inc. 4545 Assembly Drive Rockford, IL – EUA
Ou
AstraZeneca Pharmaceuticals LP
4601 Highway 62 East
Mount Vernon – Indiana – EUA
Importado por:
Bristol-Myers Squibb Farmacêutica LTDA.
Rua Verbo Divino, 1711 – Chácara Santo Antônio - São Paulo - SP
CNPJ 56.998.982/0001-07
SAC 0800 727 6160