Zaarpress (Bula do profissional de saúde)
EMS SIGMA PHARMA LTDA
IDENTIFICAÇÃO DO MEDICAMENTO
Zaarpress
losartana potássica
Comprimido 50 mg e 100 mg
FORMA FARMACÊUTICA E APRESENTAÇÃO:
Comprimido revestido
Embalagens com 7, 10, 14, 15, 20, 21, 28, 30 ou 60 comprimidos. Embalagem fracionada com 70 ou 90 comprimidos. Embalagem hospitalar com 500 comprimidos.
USO ORAL
USO ADULTO
COMPOSIÇÃO:
Cada comprimido de Zaarpress 50 mg contém:
| losartana potássica | 50 mg |
| excipientes q.s.p. | 1 comprimido |
Excipientes: lactose1 monoidratada, celulose microcristalina, amido pré-gelatinizado, croscarmelose sódica, dióxido de silício, estearato de magnésio, álcool polivinílico, dióxido de titânio, macrogol e talco.
Cada comprimido de Zaarpress 100 mg contém:
| losartana potássica | 100 mg |
| excipiente q.s.p. | 1 comprimido |
Excipientes: lactose1 monoidratada, celulose microcristalina, amido pré-gelatinizado, croscarmelose sódica, dióxido de silício, estearato de magnésio, álcool polivinílico, dióxido de titânio, macrogol e talco. Zaarpress 50 mg e 100mg contem potássio nas seguintes quantidades: 4,24 mg (0,108mEq) e 8,48 mg (0,216 mEq), respectivamente.
INFORMAÇÕES TÉCNICAS AOS PROFISSIONAIS DE SAÚDE2
INDICAÇÕES
Hipertensão3
Zaarpress é indicada para o tratamento da hipertensão3.
Zaarpress é também indicada para o tratamento da insuficiência cardíaca4, quando o tratamento com um inibidor da ECA não é mais considerado adequado. Não é recomendado trocar inibidores da ECA por Zaarpress no tratamento de pacientes com insuficiência cardíaca4 que estejam estabilizados com a terapia atual.
Redução do risco de morbidade5 e mortalidade6 cardiovasculares em pacientes hipertensos com hipertrofia7 ventricular esquerda
Zaarpress é indicada para reduzir o risco de morbidade5 e mortalidade6 cardiovasculares avaliado com base na incidência8 combinada de morte cardiovascular, acidente vascular cerebral9 e infarto do miocárdio10 em pacientes hipertensos com hipertrofia7 ventricular esquerda (veja o item 2. RESULTADOS DE EFICÁCIA – Raça).
Proteção renal11 em pacientes com diabetes tipo 212 e proteinúria13
Zaarpress é indicada para retardar a progressão da doença renal11, retardo avaliado com base na redução da incidência8 combinada de duplicação da creatinina14 sérica, insuficiência renal15 terminal (necessidade de diálise16 ou transplante renal11) ou morte, e para reduzir a proteinúria13.
RESULTADOS DE EFICÁCIA
Em estudos clínicos, a administração de losartana potássica em dose única diária a pacientes com hipertensão3 essencial leve à moderada propiciou reduções estatisticamente significativas das pressões arteriais sistólica e diastólica; nos estudos clínicos, o efeito anti-hipertensivo foi mantido por até um ano. A medida da pressão arterial17 no vale (24 horas após a dose) em relação à pressão no pico (5 a 6 horas após a dose) demonstrou redução da pressão arterial17 relativamente uniforme nas 24 horas. O efeito anti- hipertensivo acompanhou os ritmos diurnos naturais. A redução da pressão arterial17 no final do intervalo posológico foi de aproximadamente 70% a 80% do efeito observado 5 a 6 horas após a dose. A descontinuação da losartana em pacientes hipertensos não resultou em rebote abrupto da pressão arterial17. Apesar da diminuição significativa da pressão arterial17, a administração de losartana potássica não exerceu efeito clinicamente significativo na frequência cardíaca.
A administração de 50 mg a 100 mg de losartana potássica uma vez ao dia produz efeito anti-hipertensivo significativamente maior do que a administração de 50 mg a 100 mg de captopril uma vez ao dia. O efeito anti-hipertensivo de losartana potássica 50 mg é semelhante ao da administração única diária de enalapril 20 mg. O efeito anti-hipertensivo da administração única diária de 50 mg a 100 mg de losartana potássica é comparável ao da administração única diária de 50 mg a 100 mg de atenolol e equivalente ao da administração de 5 mg a 10 mg de felodipina de liberação prolongada em idosos hipertensos (≥ 65 anos) após 12 semanas de terapia.
losartana potássica é igualmente eficaz em pacientes hipertensos de ambos os sexos e em pacientes hipertensos mais jovens (< 65 anos) e mais velhos (? 65 anos). A exemplo do que ocorre com outros medicamentos que afetam o sistema renina-angiotensina, a resposta média à monoterapia com losartana é menor em pacientes da raça negra, embora o efeito anti-hipertensivo de losartana potássica se manifeste em todas as raças.
Os efeitos de losartana potássica administrado concomitantemente com diuréticos18 tiazídicos na redução da pressão arterial17 são aproximadamente aditivos.
Estudo LIFE (Losartan Intervention For Endpoint reduction in hypertension): foi um estudo de grande porte, multicêntrico, multinacional, randômico e triplo-cego, controlado com medicação ativa, que envolveu 9.193 pacientes hipertensos com idades entre 55 e 80 anos (média de 67 anos) e hipertrofia7 ventricular esquerda documentada por ECG. No período basal, 1.195 (13%) pacientes apresentavam diabetes19; 1.326 (14%), hipertensão3 sistólica isolada; 1.468 (17%), doença coronariana20 e 728 (8%), doença vascular21 cerebral. O objetivo do estudo foi demonstrar os efeitos protetores cardiovasculares de losartana potássica versus atenolol, além dos benefícios do controle da pressão arterial17 (medida no vale). Para atingir esse objetivo, a meta da pressão arterial17 foi a mesma para os dois grupos de tratamento. Os pacientes foram distribuídos de modo randômico para receber 50 mg de losartana
potássica ou 50 mg de atenolol uma vez ao dia. Quando a meta da pressão arterial17 (< 140/90 mmHg) não era atingida, adicionava-se, em primeiro lugar, a hidroclorotiazida (12,5 mg) e, se necessário, aumentava-se a dose de losartana potássica ou de atenolol para 100 mg uma vez ao dia. Se para atingir a meta ainda houvesse a necessidade de outras modificações do esquema terapêutico (por exemplo, aumento da dose de hidroclorotiazida para 25 mg ou adição de outro tratamento diurético22 ou de bloqueadores dos canais de cálcio, alfabloqueadores ou agentes de ação central), estas eram feitas. A adição de inibidores da ECA, antagonistas da angiotensina II ou betabloqueadores não foi permitida.
Nos dois grupos de tratamento, a pressão arterial17 foi significativamente reduzida para níveis semelhantes, e uma proporção semelhante de pacientes atingiu a meta da pressão arterial17. A duração média do período de acompanhamento foi de 4,8 anos.
O desfecho primário foi o composto de morbidade5 e mortalidade6 cardiovasculares, avaliado pela redução da incidência8 combinada de morte cardiovascular, acidente vascular cerebral9 e infarto do miocárdio10. Os resultados mostraram que o tratamento com losartana potássica, em comparação ao com atenolol, resultou em 13,0% de redução do risco (P = 0,021) para os pacientes que atingiram o desfecho primário composto (veja a Figura 1).
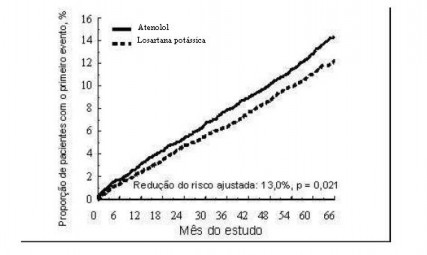
Figura 1. Estimativas de Kaplan-Meier do desfecho primário composto de morte cardiovascular, acidente vascular cerebral9 ou infarto do miocárdio10 nos grupos que receberam losartana potássica ou atenolol, ajustadas para o escore de risco de Framingham e o grau de hipertrofia7 ventricular esquerda (HVE) ao ECG no período basal.
O tratamento com losartana potássica, em comparação ao com atenolol, reduziu o risco de acidente vascular cerebral9 em 25% (P = 0,001). As taxas de morte cardiovascular e de infarto do miocárdio10 não foram significativamente diferentes entre os grupos de tratamento. O efeito de losartana potássica no desfecho primário composto aparentemente foi superior e além dos efeitos benéficos do controle da pressão arterial17 isoladamente (veja a tabela a seguir).
|
Resultado |
losartana potássica (N = 4.605) |
Taxa* |
Atenolol (N = 4.588) |
Taxa* |
Redução do risco** |
Valor de P |
|
n (%) |
|
|
n (%) |
|
|
|
|
Desfecho primário composto |
508 (11%) |
23,8 |
588 (13%) |
27,9 |
13% |
0,021 |
|
Componentes do desfecho primário composto |
||||||
|
Mortalidade6 cardiovascular |
204 (4%) |
9,2 |
234 (5%) |
10,6 |
11% |
0,206 |
|
Acidente vascular cerebral9 |
232 (5%) |
10,8 |
309 (7%) |
14,5 |
25% |
0,001 |
|
Infarto do miocárdio10 |
198 (4%) |
9,2 |
188 (4%) |
8,7 |
-7% |
0,491 |
*Por 1.000 pacientes-anos de acompanhamento.
**Ajustada para o escore de risco de Framingham e o grau de HVE ao ECG no período basal.
Os outros desfechos clínicos do estudo LIFE foram: mortalidade6 por todas as causas, hospitalização por insuficiência cardíaca4 ou angina23 pectoris, procedimentos de revascularização coronariana ou periférica e parada cardíaca com ressuscitação. Não ocorreram diferenças significativas entre os grupos de tratamento nas taxas desses desfechos. Os pacientes que receberam losartana potássica apresentaram redução significativamente maior dos índices de hipertrofia7 ventricular esquerda no ECG em comparação com os que receberam atenolol.
Os efeitos de losartana potássica versus atenolol na morbimortalidade cardiovascular foram examinados em subgrupos de pacientes com histórico de diabetes19 mellitus (n = 1.195) ou hipertensão3 sistólica isolada (HSI) (n = 1.326) no período basal. Em relação ao desfecho primário composto, os resultados observados nesses subgrupos foram compatíveis com o benefício do tratamento com losartana potássica observado na população global do estudo: observou-se redução de 24% do risco (P = 0,03) nos pacientes com diabetes19 e de 25% (P = 0,06) nos pacientes com hipertensão3 sistólica isolada. Compatível com os resultados observados na população global, a redução do risco de acidente vascular cerebral9 foi um importante fator contribuinte para o benefício observado nos pacientes com diabetes19 ou HSI.
Raça: com base no estudo LIFE, os benefícios da losartana potássica sobre a morbidade5 e a mortalidade6 cardiovasculares em comparação com os do atenolol não se aplicam a pacientes negros com hipertensão3 e hipertrofia7 ventricular esquerda, embora os dois esquemas de tratamento tenham reduzido de forma eficaz a pressão arterial17 nessa população de pacientes. No estudo LIFE, losartana potássica, em comparação ao atenolol, diminuiu o risco de morbidade5 e mortalidade6 cardiovasculares em pacientes hipertensos não negros com hipertrofia7 ventricular esquerda (n = 8.660), conforme medido pelo desfecho primário de incidência8 combinada de morte cardiovascular, acidente vascular cerebral9 e infarto do miocárdio10 (P = 0,003). Nesse estudo, entretanto, o risco de apresentar o desfecho primário composto foi menor em pacientes negros que receberam atenolol em comparação com os que receberam losartana potássica (P = 0,03). No subgrupo de pacientes negros (n = 533; 6% dos pacientes do estudo LIFE), ocorreram 29 desfechos primários entre os 263 pacientes do grupo do atenolol (11%, 25,9/1.000 pacientes-anos) e 46 entre os 270 pacientes (17%, 41,8/1.000 pacientes-anos) do grupo de losartana potássica.
Nesse estudo, losartana potássica em geral foi bem tolerado e seu perfil de tolerabilidade foi superior ao do atenolol, conforme evidenciado pela incidência8 significativamente mais baixa de descontinuações por efeitos adversos.
Estudo RENAAL (Reduction of Endpoints in NIDDM with the Angiotensin II Receptor Antagonist Losartana): foi um estudo mundial de grande porte, multicêntrico, com distribuição randômica, controlado com placebo24 e duplo-cego que envolveu 1.513 pacientes com diabetes tipo 212 e proteinúria13 (751 receberam losartana potássica), com ou sem hipertensão3. O objetivo do estudo foi demonstrar os efeitos protetores renais de losartana potássica além dos benefícios do controle da pressão arterial17 isoladamente. Para atingir esse objetivo, a meta da pressão arterial17 foi a mesma para os dois grupos de tratamento. Os pacientes com proteinúria13 e creatinina14 sérica entre 1,3 e 3,0 mg/dL25 foram distribuídos de modo randômico para receber 50 mg de losartana potássica uma vez ao dia, titulados de acordo com a resposta da pressão arterial17, ou placebo24 e tratamento anti-hipertensivo convencional, excluindo-se inibidores da ECA e antagonistas da angiotensina II. Os pesquisadores foram orientados a titular o medicamento do estudo para 100 mg uma vez ao dia, conforme apropriado; 72% dos pacientes tomaram a dose diária de 100 mg durante a maior parte do tempo em que receberam o medicamento de estudo. Em ambos os grupos, quando necessário, puderam ser adicionados outros agentes anti- hipertensivos (diuréticos18, bloqueadores dos canais de cálcio, alfa ou betabloqueadores e agentes de ação central). Os pacientes foram acompanhados por até 4,6 anos (média de 3,4 anos)
O desfecho primário do estudo foi o desfecho composto de duplicação da creatinina14 sérica, insuficiência renal15 terminal (necessidade de diálise16 ou transplante) ou morte. Os resultados mostraram que o tratamento com losartana potássica (327 eventos) em comparação com o placebo24 (359 eventos) resultou em redução do risco de 16,1% (P = 0,022) para os pacientes que atingiram o desfecho primário composto. Os resultados também demonstraram redução significativa do risco no grupo tratado com losartana potássica em relação aos seguintes componentes individuais e combinados do desfecho primário: 25,3% de redução do risco de duplicação da creatinina14 sérica (P = 0,006), 28,6% de redução do risco de insuficiência renal15 terminal (P = 0,002), 19,9% de redução do risco de insuficiência renal15 terminal ou morte (P = 0,009) e 21% de redução do risco de duplicação da creatinina14 sérica ou de insuficiência renal15 terminal (P = 0,010). A taxa de morte por todas as causas não foi significativamente diferente entre os dois grupos de tratamento.
Os desfechos secundários do estudo foram: alteração da proteinúria13, taxa de progressão da nefropatia26 e o composto de morbimortalidade de causas cardiovasculares (hospitalização por insuficiência cardíaca4, infarto do miocárdio10, revascularização, acidente vascular cerebral9, hospitalização por angina23 instável ou morte cardiovascular). Os resultados mostraram redução média de 34,3% do nível de proteinúria13 no grupo de losartana potássica (P < 0,001). O tratamento com losartana potássica reduziu a taxa de declínio da função renal11 durante a fase crônica do estudo em 13,9%, P = 0,003 (taxa média de declínio de 18,5%, P = 0,01), conforme medido pela recíproca da concentração sérica de creatinina14. Não houve diferença significativa entre o grupo que recebeu losartana potássica (247 eventos) e o grupo placebo24 (268 eventos) no desfecho composto de morbimortalidade cardiovascular, embora o estudo não tenha sido desenhado para detectar esse efeito.
Nesse estudo, losartana potássica em geral foi bem tolerado, conforme evidenciado pela incidência8 semelhante de descontinuações por efeitos adversos na comparação com o placebo24.
Estudos ELITE I e ELITE II: no estudo ELITE, de 48 semanas de duração, que envolveu 722 pacientes com insuficiência cardíaca4 (Classes II-IV da New York Heart Association [NYHA]), não foram observadas diferenças no desfecho primário de disfunção renal11 persistente entre os pacientes que receberam losartana potássica e os que receberam captopril. A observação não esperada do benefício superior de losartana potássica na redução do risco de morte em relação ao captopril no estudo ELITE não foi confirmada no estudo de sobrevida27 definitivo, o ELITE II, descrito a seguir.
No ELITE II, estudo que envolveu pacientes com insuficiência cardíaca4, desenhado para avaliar prospectivamente a mortalidade6, comparou-se um esquema de 50 mg de losartana potássica em dose única diária (dose inicial de 12,5 mg titulada para 25 mg e 50 mg 1x/dia) a um esquema de 50 mg de captopril 3x/dia (dose inicial de 12,5 mg titulada para 25 mg e 50 mg 3x/dia). Nesse estudo (n = 3.152), pacientes com insuficiência cardíaca4 (Classes II-IV da NYHA) foram acompanhados durante dois anos aproximadamente (mediana de acompanhamento de 1,5 ano) para que se avaliasse se losartana potássica era superior ao captopril na redução da mortalidade6 por todas as causas. O desfecho primário não mostrou diferença estatisticamente significativa entre losartana potássica e captopril na redução da mortalidade6 por todas as causas (17,7% para losartana potássica e 15,9% para o captopril, P = 0,16). O desfecho secundário não mostrou diferença estatisticamente significativa na redução de morte súbita de origem cardíaca e/ou parada cardíaca com ressuscitação (9,0% para losartana potássica e 7,3% para captopril, P = 0,08). O desfecho terciário de mortalidade6 por todas as causas e/ou hospitalizações por todas as causas não mostrou diferença estatisticamente significativa entre losartana potássica e captopril (47,7% para losartana potássica e 44,9% para captopril, P = 0,18). Em geral, os outros desfechos de morbidade5 e de mortalidade6, incluindo melhora da classe funcional de acordo com a classificação da NYHA, não foram diferentes entre os grupos de tratamento.
Nesses dois estudos clínicos controlados em pacientes com insuficiência cardíaca4, losartana potássica em geral foi bem tolerado e seu perfil de tolerabilidade foi superior ao do captopril, conforme avaliado pela incidência8 significativamente mais baixa de descontinuações por efeitos adversos e incidência8 significativamente mais baixa de tosse.
CARACTERÍSTICAS FARMACOLÓGICAS
Farmacologia28 clínica
Losartana potássica, o primeiro de uma nova classe de agentes para o tratamento da hipertensão3 e da insuficiência cardíaca4, é um antagonista29 do receptor (tipo AT1) da angiotensina II. Losartana potássica também reduz o risco combinado de morte cardiovascular, acidente vascular cerebral9 e infarto do miocárdio10 em pacientes hipertensos com hipertrofia7 ventricular esquerda e oferece proteção renal11 para pacientes30 com diabetes tipo 212 e proteinúria13.
Mecanismo de ação
A angiotensina II, um potente vasoconstritor, é o principal hormônio31 ativo do sistema renina-angiotensina e o maior determinante da fisiopatologia32 da hipertensão3. A angiotensina II liga-se ao receptor AT1 encontrado em muitos tecidos (por exemplo, músculo liso vascular33, glândulas34 adrenais, rins35 e coração36) e desencadeia várias ações biológicas importantes, incluindo vasoconstrição37 e liberação de aldosterona. A angiotensina II também estimula a proliferação de células musculares38 lisas. Foi identificado um segundo receptor da angiotensina II (subtipo AT2), mas sua função na homeostase cardiovascular é desconhecida.
A losartana é um composto sintético potente, ativo por via oral. De acordo com bioensaios de ligação e farmacologia28, a losartana liga-se seletivamente ao receptor AT1. In vitro e in vivo, tanto a losartana como o seu metabólito39 ácido carboxílico farmacologicamente ativo (E-3174) bloqueiam todas as ações fisiologicamente relevantes da angiotensina II, independentemente da fonte ou da via de síntese. Diferentemente de alguns antagonistas peptídicos da angiotensina II, a losartana não apresenta efeitos agonistas.
A losartana liga-se seletivamente ao receptor AT1 e não se liga ou bloqueia outros receptores de hormônios ou canais iônicos importantes na regulação cardiovascular. Além disso, a losartana não inibe a ECA (cininase II), a enzima40 que degrada a bradicinina41. Consequentemente, os efeitos não relacionados diretamente ao bloqueio do receptor AT1, como a potencialização dos efeitos mediados pela bradicinina41 ou o desenvolvimento de edema42 (losartana: 1,7%; placebo24: 1,9%), não estão associados à losartana.
Absorção: Após a administração oral, a losartana é bem absorvida e sofre metabolismo43 de primeira passagem, formando um metabólito39 ácido carboxílico ativo e outros metabólitos44 inativos. A biodisponibilidade sistêmica dos comprimidos de losartana é de aproximadamente 33%. As concentrações máximas médias de losartana e de seu metabólito39 ativo são atingidas em 1 hora e em 3 a 4 horas, respectivamente. Não houve efeito clinicamente significativo no perfil da concentração plasmática de losartana quando o fármaco45 foi administrado com uma refeição padrão.
Distribuição: Tanto a losartana como o seu metabólito39 ativo apresentam taxa de ligação a proteínas46 plasmáticas ? 99%, principalmente com a albumina47. O volume de distribuição da losartana é de 34 litros. Estudos em ratos indicam que a losartana praticamente não atravessa a barreira hematoencefálica.
Metabolismo43: Aproximadamente 14% da dose de losartana administrada por via intravenosa ou oral é convertida em seu metabólito39 ativo. Após a administração intravenosa ou oral de losartana potássica marcada com 14C, a radioatividade plasmática circulante principal é atribuída à losartana e ao seu metabólito39 ativo. Observou-se conversão mínima de losartana ao seu metabólito39 ativo em aproximadamente 1% dos indivíduos estudados.
Além do metabólito39 ativo, são formados metabólitos44 inativos, incluindo dois principais, formados por hidroxilação da cadeia lateral butílica, e um secundário, um glucuronídeo N-2 tetrazol.
Eliminação: A depuração plasmática da losartana e a de seu metabólito39 ativo são de aproximadamente 600 mL/min e 50 mL/min, respectivamente. A depuração renal11 da losartana e a de seu metabólito39 ativo são de aproximadamente 74 mL/min e 26 mL/min, respectivamente. Quando a losartana é administrada por via oral, aproximadamente 4% da dose é excretada inalterada na urina48 e 6%, na forma de metabólito39 ativo. As farmacocinéticas da losartana e de seu metabólito39 ativo são lineares com doses de losartana potássica de até 200 mg, administradas por via oral.
Após a administração oral, as concentrações plasmáticas da losartana e de seu metabólito39 ativo diminuem poliexponencialmente, com meia-vida final de aproximadamente 2 horas e de 6 a 9 horas, respectivamente. Durante a administração da dose única diária de 100 mg, a losartana e o seu metabólito39 ativo não se acumulam significativamente no plasma49.
Tanto a excreção biliar como a urinária contribuem para a eliminação de losartana e seus metabólitos44. Após uma dose oral de losartana potássica marcada com 14C em humanos, aproximadamente 35% da radioatividade é recuperada na urina48 e 58%, nas fezes. Após uma dose intravenosa de losartana potássica marcada com 14C em humanos, aproximadamente 43% da radioatividade é recuperada na urina48 e 50%, nas fezes.
Farmacodinâmica
A losartana inibe as respostas pressoras sistólica e diastólica a infusões de angiotensina II. No pico, 100 mg de losartana potássica inibem essas respostas em aproximadamente 85%; 24 horas após a administração de doses únicas e múltiplas, a inibição é de cerca de 26%-39%.
Durante a administração de losartana, a remoção do feedback negativo da angiotensina II sobre a secreção de renina aumenta a atividade da renina plasmática, o que resulta em aumento da angiotensina II no plasma49. Durante o tratamento crônico50 (6 semanas) de pacientes hipertensos com 100 mg/dia de losartana, foram observados aumentos nos níveis plasmáticos de angiotensina II de aproximadamente 2-3 vezes quando ocorreram concentrações plasmáticas máximas do fármaco45. Em alguns pacientes, foram observados aumentos maiores, particularmente durante o tratamento de curto prazo (2 semanas). No entanto, a atividade anti- hipertensiva e a supressão da concentração plasmática da aldosterona foram aparentes em 2 e 6 semanas, indicando bloqueio efetivo do receptor de angiotensina II. Após a descontinuação da losartana, os níveis de atividade da renina plasmática (ARP) e da angiotensina II declinaram aos níveis anteriores ao tratamento em 3 dias.
Uma vez que a losartana é um antagonista29 específico do receptor de angiotensina II tipo AT1, esse composto não inibe a ECA (cininase II), a enzima40 que degrada a bradicinina41. Em um estudo que comparou os efeitos de 20 mg e de 100 mg de losartana potássica e de um inibidor da ECA nas respostas à angiotensina I, à angiotensina II e à bradicinina41, a losartana demonstrou bloquear as respostas à angiotensina I e à angiotensina II sem afetar as respostas à bradicinina41. Esse achado é compatível com o mecanismo de ação específico da losartana. Em contrapartida, o inibidor da ECA demonstrou bloquear as respostas à angiotensina I e aumentar as respostas à bradicinina41 sem alterar a resposta à angiotensina II, proporcionando assim uma diferenciação farmacodinâmica entre a losartana e os inibidores da ECA.
As concentrações plasmáticas de losartana e seu metabólito39 ativo e o efeito anti-hipertensivo da losartana crescem com o aumento da dose. Como a losartana e seu metabólito39 ativo são ambos antagonistas do receptor de angiotensina II, eles contribuem para o efeito anti-hipertensivo.
Em um estudo de dose única que incluiu indivíduos do sexo masculino sadios, a administração de 100 mg de losartana potássica, sob condições nutricionais com altos e baixos teores de sal, não alterou a taxa de filtração glomerular, o fluxo plasmático renal11 efetivo ou a fração de filtração. A losartana apresentou efeito natriurético que foi mais acentuado com uma dieta pobre em sal e que pareceu não estar relacionado à inibição da reabsorção inicial proximal51 de sódio. A losartana também aumentou de modo transitório a excreção urinária de ácido úrico.
Em pacientes hipertensos sem diabetes19 com proteinúria13 (≥ 2 g/24 horas) tratados durante 8 semanas, a administração de 50 mg de losartana potássica titulada para 100 mg reduziu significativamente a proteinúria13 em 42%. A excreção fracionária de albumina47 e de IgG também foi significativamente reduzida. Nesses pacientes, a losartana manteve a taxa de filtração glomerular e reduziu a fração de filtração.
Em hipertensas pós-menopáusicas tratadas durante 4 semanas, a losartana potássica na dose de 50 mg não apresentou efeito sobre os níveis renais ou sistêmicos52 de prostaglandina53.
A losartana não teve efeito sobre os reflexos autonômicos e não teve efeitos sustentados sobre a norepinefrina plasmática.
A losartana potássica, administrada em doses únicas diárias de até 150 mg, não causou alterações clinicamente importantes nos níveis de triglicérides54, colesterol55 total ou colesterol55 HDL56 de pacientes hipertensos em jejum. As mesmas doses de losartana não apresentaram efeito sobre os níveis de glicemia de jejum57.
Em geral, a losartana reduziu os níveis séricos de ácido úrico (geralmente < 0,4 mg/dL25), efeito que persistiu com a terapia crônica. Nos estudos clínicos controlados em pacientes hipertensos, não houve descontinuação de nenhum paciente em razão de elevações dos níveis séricos de creatinina14 ou de potássio.
Em um estudo de 12 semanas, de desenho paralelo, que incluiu pacientes com insuficiência58 ventricular esquerda (Classes Funcionais II-IV da NYHA), cuja maioria estava recebendo diuréticos18 e/ou digitálicos, a losartana potássica administrada em doses únicas diárias de 2,5 mg, 10 mg, 25 mg e 50 mg foi comparada ao placebo24. As doses de 25 mg e 50 mg produziram efeitos hemodinâmicos e neuro-hormonais positivos, que foram mantidos durante todo o estudo. As respostas hemodinâmicas foram caracterizadas por aumento do índice cardíaco e reduções da pressão capilar59 pulmonar, resistência vascular21 sistêmica, pressão arterial17 sistêmica média e frequência cardíaca. A ocorrência de hipotensão60 nesses pacientes com insuficiência cardíaca4 foi relacionada à dose. Os resultados neuro-hormonais foram caracterizados por redução dos níveis circulantes de aldosterona e norepinefrina.
CONTRAINDICAÇÕES
Losartana potássica é contraindicado para pacientes30 com hipersensibilidade à substância ativa ou a qualquer um dos componentes do produto (veja os itens 5. ADVERTÊNCIAS E PRECAUÇÕES e COMPOSIÇÃO).
O uso concomitante de losartana potássica com produtos contendo alisquireno é contraindicado em pacientes com diabetes19 mellitus e insuficiência renal15 (TGF < 60 mL/min/1,73m2) (veja o item 6. INTERAÇÕES MEDICAMENTOSAS).
Losartana potássica não deve ser administrado durante o segundo ou o terceiro trimestre de gestação (veja o item 5. ADVERTÊNCIAS E PRECAUÇÕES – Uso na gravidez61 e amamentação62).
Losartana potássica é contraindicado para pacientes30 com insuficiência hepática63 grave (veja o item 5. ADVERTÊNCIAS E PRECAUÇÕES).
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica. Informe imediatamente seu médico em caso de suspeita de gravidez61.
ADVERTÊNCIAS E PRECAUÇÕES
Toxicidade64 fetal: o uso de fármacos que atuam no sistema renina-angiotensina, durante o segundo e o terceiro trimestre da gravidez61, diminui a função renal11 fetal e aumenta a morbidade5, e a morte fetal e a neonatal. O oligoidrâmnio resultante pode estar associado com hipoplasia65 pulmonar e deformações ósseas fetais. As potenciais reações adversas neonatais incluem deformação craniana, anúria66, hipotensão60, insuficiência renal15 e morte. Quando a gravidez61 for detectada, losartana potássica deverá ser descontinuado o mais rápido possível (veja Uso na gravidez61 e amamentação62).
Hipersensibilidade: angioedema67. Pacientes com histórico de angioedema67 (inchaço68 da face69, dos lábios, da garganta70 e/ou língua71) devem ser cuidadosamente monitorados (veja o item 9. REAÇÕES ADVERSAS).
Hipotensão60 e desequilíbrio hidroeletrolítico72: hipotensão60 sintomática73, especialmente após a primeira dose e após o aumento de dose, pode ocorrer em pacientes que apresentam depleção74 de volume e/ou depleção74 de sódio devido a terapia intensa com diuréticos18, dieta com restrição de sal, diarreia75 ou vômito76. Essas situações devem ser corrigidas antes da administração de losartana potássica ou deve-se utilizar dose inicial mais baixa (veja o item 8. POSOLOGIA E MODO DE USAR).
Desequilíbrio hidroeletrolítico72: desequilíbrios hidroeletrolíticos são comuns em pacientes com comprometimento renal11, com ou sem diabetes19, e devem ser corrigidos. Em um estudo clínico que envolveu pacientes com diabetes tipo 212 e com nefropatia26, a incidência8 de hipercalemia77 foi mais alta no grupo tratado com losartana potássica quando comparado ao grupo placebo24 (veja o item 9. REAÇÕES ADVERSAS). Por isso, as concentrações plasmáticas de potássio, assim como os valores da depuração plasmática da creatinina14, devem ser cuidadosamente monitoradas, especialmente em pacientes com insuficiência cardíaca4 e depuração plasmática da creatinina14 entre 30-50 mL/min.
O uso concomitante de losartana potássica e de agentes poupadores de potássio, suplementos de potássio e substitutos do sal que contenham potássio não é recomendado (veja o item 6. INTERAÇÕES MEDICAMENTOSAS).
Insuficiência hepática63: com base nos dados de farmacocinética que demonstraram aumentos significativos das concentrações plasmáticas de losartana em pacientes com cirrose78, deve-se considerar doses mais baixas para pacientes30 com histórico de insuficiência hepática63. Não há experiência terapêutica79 sobre a losartana em pacientes com insuficiência hepática63 grave. Portanto, não é recomendada a administração de losartana em pacientes com insuficiência hepática63 grave (veja os itens 3. CARACTERÍSTICAS FARMACOLÓGICAS - Farmacologia28 clínica, 4. CONTRAINDICAÇÕES e 8. POSOLOGIA E MODO DE USAR).
Insuficiência renal15: como consequência da inibição do sistema renina-angiotensina, foram relatadas alterações na função renal11 (particularmente em pacientes cuja função renal11 é dependente do sistema renina-angiotensina-aldosterona como os pacientes com insuficiência cardíaca4 grave ou disfunção renal11 preexistente). Assim como para outros fármacos que afetam o sistema renina- angiotensina-aldosterona, o aumento nas taxas de ureia80 sanguínea e de creatinina14 sérica também foi relatado em pacientes com estenose81 da artéria renal82 bilateral ou estenose81 da artéria83 de rim84 único. Essas alterações da função renal11 podem ser reversíveis com a descontinuação do tratamento. A losartana deve ser usada com cuidado em pacientes com estenose81 da artéria renal82 bilateral ou estenose81 da artéria83 de rim84 único.
O uso concomitante de losartana e inibidores da ECA demonstrou comprometer a função renal11. Portanto, não é recomendado o uso concomitante (veja o item 6. INTERAÇÕES MEDICAMENTOSAS).
Insuficiência cardíaca4: em pacientes com insuficiência cardíaca4, com ou sem insuficiência renal15, há – assim como com outros fármacos que atuam no sistema renina-angiotensina – um risco de hipotensão arterial85 grave e insuficiência renal15 (geralmente aguda). Não há experiência terapêutica79 suficiente sobre a losartana em pacientes com insuficiência cardíaca4 concomitante com insuficiência renal15 grave, em pacientes com insuficiência cardíaca4 grave (Classe IV da NYHA), assim como em pacientes com insuficiência cardíaca4 e arritmia86 cardíaca sintomática73 que ameaça a vida. Desta forma, a losartana deve ser utilizada com cautela nesses pacientes. A combinação de losartana com um betabloqueador deve ser utilizada com cautela (veja o item 3. CARACTERÍSTICAS FARMACOLÓGICAS – Farmacodinâmica).
Transplante renal11: não há dados sobre pacientes que tiveram um transplante de rim84 recente.
Hiperaldosteronismo primário: pacientes com hiperaldosteronismo primário geralmente não respondem a medicamentos anti- hipertensivos cuja ação se dá através da inibição do sistema renina-angiotensina. Assim sendo, o uso de losartana nesses pacientes não é recomendado.
Doença cardíaca coronariana e doença vascular21 cerebral: assim como com outros agentes anti-hipertensivos, a diminuição excessiva da pressão arterial17 em pacientes com isquemia87 cardiovascular ou doença vascular21 cerebral pode resultar em infarto do miocárdio10 ou derrame88.
Estenose81 de valva aórtica89 e mitral e cardiomiopatia hipertrófica obstrutiva: assim como com outros vasodilatadores, recomenda-se atenção especial em pacientes que sofrem de estenose81 aórtica ou mitral ou de cardiomiopatia hipertrófica obstrutiva. Bloqueio duplo do sistema renina-angiotensina-aldosterona: há evidências de que o uso concomitante de inibidor da ECA, antagonista29 de receptor da angiotensina II ou alisquireno aumenta o risco de hipotensão60, hipercalemia77 e diminui a função renal11 (incluindo insuficiência renal15 aguda). Portanto, o bloqueio duplo do sistema renina-angiotensina-aldosterona pelo uso combinado de inibidor da ECA, antagonista29 de receptor da angiotensina II ou alisquireno não é recomendado (veja o item 6. INTERAÇÕES MEDICAMENTOSAS).
Se a terapia utilizando o bloqueio duplo for considerada absolutamente necessária, esta deve ocorrer apenas com a supervisão de um especialista e com monitoramento constantemente da função renal11, dos eletrólitos90 e da pressão sanguínea. Inibidores da ECA e antagonistas de receptor da angiotensina II não devem ser utilizados concomitantemente em pacientes com nefropatia26 diabética.
Informações importantes sobre um dos componentes do medicamento
Excipientes: este medicamento contém lactose1. Pacientes com problemas hereditários raros de intolerância à galactose91, deficiência de lactose1 de Lapp ou má-absorção da glicose92-galactose91 não devem tomar este medicamento.
Gravidez61 e Lactação93
Uso na gravidez61 e amamentação62: categoria de risco na gravidez61: D. Os fármacos que atuam diretamente no sistema renina- angiotensina podem causar danos e morte ao feto94 em desenvolvimento. Quando houver confirmação de gravidez61, o tratamento com losartana potássica deverá ser descontinuado o mais rapidamente possível.
O uso da losartana não é recomendado durante o primeiro trimestre de gravidez61. O uso da losartana é contraindicado durante o segundo e terceiro trimestre de gestação (veja o item 4. CONTRAINDICAÇÕES).
A evidência epidemiológica relacionada ao risco de teratogenicidade após a exposição a inibidores da ECA durante o primeiro trimestre de gestação não foi conclusiva; entretanto, um leve aumento neste risco não pode ser descartado. Apesar de não haver dados epidemiológicos controlados sobre o risco com antagonistas de receptor da angiotensina II, riscos similares podem existir para esta classe de fármaco45.
A losartana não deve ser iniciada durante a gestação a não ser que a terapia com antagonistas de receptor da angiotensina II seja considerada essencial. Pacientes que planejam engravidar devem ter seu tratamento alterado para um tratamento anti-hipertensivo alternativo que possua perfil de segurança estabelecido para o uso durante a gestação. Quando a gravidez61 for identificada o tratamento com losartana deve ser interrompido imediatamente e, se apropriado, um tratamento alternativo deve ser iniciado.
Sabe-se que a exposição à terapia com antagonistas de receptor da angiotensina II durante o segundo e terceiro trimestre induz fetotoxicidade em humanos (diminuição da função renal11, oligoidrâmnio e retardo na ossificação do crânio95) e toxicidade64 neonatal (insuficiência renal15, hipotensão60 e hipercalemia77).
Se ocorrer exposição à losartana durante o segundo ou terceiro trimestre de gestação é recomendada a realização de ultrassonografia96 para avaliação da função renal11 e do crânio95.
Recém-nascidos cujas mães tomaram losartana devem ser observados cuidadosamente para hipotensão60 (veja o item 4. CONTRAINDICAÇÕES).
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica. Informe imediatamente seu médico em caso de suspeita de gravidez61.
Amamentação62: uma vez que não há informações referentes ao uso de losartana durante a amamentação62, seu uso não é recomendado neste período. Durante a amamentação62 recomenda-se utilizar um tratamento alternativo que possua perfil de segurança melhor estabelecido, especialmente se o lactente97 for recém-nascido ou prematuro.
Populações especiais
Uso pediátrico: recém-nascidos com histórico de exposição in utero98 a losartana potássica: caso ocorra oligúria99 ou hipotensão60, dar prioridade para a manutenção da pressão arterial17 e a perfusão renal11. Exsanguineotransfusões ou diálise16 podem ser necessárias como um meio de reverter a hipotensão60 e/ou substituir a função renal11 comprometida.
A segurança e a eficácia em crianças ainda não foram estabelecidas.
Uso em idosos: nos estudos clínicos, não houve diferença relacionada à idade nos perfis de eficácia e segurança da losartana. Outras advertências e precauções: assim como observado com os inibidores da enzima40 conversora da angiotensina, a losartana e outros antagonistas da angiotensina são aparentemente menos efetivos na redução da pressão sanguínea em pacientes negros, possivelmente devido a uma maior prevalência100 de baixo nível de renina nessa população.
Efeitos na habilidade de dirigir e operar máquinas
Não foram feitos estudos para avaliar os efeitos de losartana potássica na habilidade de dirigir e operar máquinas. Entretanto, deve-se considerar que tontura101 ou sonolência podem ocorrer ocasionalmente quando o paciente está recebendo terapia anti-hipertensiva, em particular quando está iniciando o tratamento ou quando tem a dose aumentada. Por isso, recomenda-se cautela ao dirigir veículos ou operar máquinas durante o uso de losartana potássica.
INTERAÇÕES MEDICAMENTOSAS
Nos estudos clínicos de farmacocinética realizados com hidroclorotiazida, digoxina, varfarina, cimetidina, fenobarbital, cetoconazol e eritromicina, não foram identificadas interações medicamentosas de importância clínica. Houve relatos de redução dos níveis do metabólito39 ativo pela rifampicina e pelo fluconazol. Não foram avaliadas as consequências clínicas dessas interações.
A exemplo do que ocorre com outros fármacos que bloqueiam a angiotensina II ou os seus efeitos, o uso concomitante de diuréticos18 poupadores de potássio (como espironolactona, triantereno e amilorida), suplementos de potássio ou substitutos do sal que contenham potássio pode resultar em aumento do potássio sérico.
A exemplo de outros fármacos que afetam a excreção de sódio, a excreção de lítio pode ser reduzida. Por isso, deve-se monitorar com cautela os níveis séricos do lítio, caso sais de lítio sejam administrados concomitantemente a antagonistas de receptores de angiotensina II.
Os fármacos anti-inflamatórios não esteroides (AINEs), incluindo os inibidores seletivos da cicloxigenase-2 (inibidores da COX-2), podem reduzir o efeito de diuréticos18 e outros medicamentos anti-hipertensivos. Por isso, o efeito anti-hipertensivo de antagonistas de receptores da angiotensina II ou inibidores da ECA pode ser atenuado pelos AINEs, incluindo os inibidores seletivos da COX-2. Para alguns pacientes com função renal11 comprometida (por exemplo, pacientes idosos ou hipovolêmicos, incluindo aqueles em terapia diurética) que estão em tratamento com fármacos anti-inflamatórios não esteroides, incluindo inibidores seletivos da COX-2, a administração concomitante de antagonistas de receptores da angiotensina II ou inibidores da ECA pode resultar em maior deterioração da função renal11, incluindo possível insuficiência renal15 aguda. Esses efeitos são usualmente reversíveis, portanto, a combinação deve ser administrada com cautela a pacientes com comprometimento da função renal11.
Dado do estudo clínico demonstrou que o bloqueio duplo do sistema renina-angiotensina-aldosterona através do uso combinado de inibidores da ECA, antagonistas de receptor da angiotensina II ou alisquireno está associado com uma frequência maior de reações adversas tais como hipotensão60, hipercalemia77 e diminuição da função renal11 (incluindo insuficiência renal15 aguda) comparado com o uso de apenas um agente que atua no sistema renina-angiotensina-aldosterona (veja os itens 4. CONTRAINDICAÇÕES e 5. ADVERTÊNCIAS E PRECAUÇÕES).
CUIDADOS DE ARMAZENAMENTO DO MEDICAMENTO
Cuidados de conservação
Conservar em temperatura ambiente (temperatura entre 15 e 30°C). Proteger da luz e umidade.
Prazo de validade: 24 meses (Zaarpress 50 mg) e 24 meses (Zaarpress 100 mg) após a data de fabricação impressa na embalagem.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Características físicas e organolépticas do produto
- Zaarpress 50 mg: comprimido revestido na cor branca, circular, biconvexo e monossectado.
- aarpress 100 mg: comprimido revestido na cor branca, circular e biconvexo.
O comprimido revestido de 50 mg após partido, deve ser mantido em temperatura ambiente (temperatura entre 15 e 30°C) e consumido dentro de 24 horas.
Antes de usar, observe o aspecto do medicamento.
TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS.
POSOLOGIA E MODO DE USAR
Zaarpress pode ser administrado com ou sem alimentos.
Zaarpress pode ser administrado com outros agentes anti-hipertensivos.
POSOLOGIA
Hipertensão3
Para a maioria dos pacientes, a dose usual inicial e de manutenção é de 50 mg uma vez ao dia. O efeito anti-hipertensivo máximo é alcançado 3 a 6 semanas após o início do tratamento. Alguns pacientes podem obter benefício adicional se a dose for aumentada para 100 mg uma vez ao dia.
Para pacientes30 com depleção74 de volume intravascular102 (por exemplo, pacientes tratados com altas doses de diuréticos18), deve ser considerada uma dose inicial de 25 mg uma vez ao dia (veja o item 5. ADVERTÊNCIAS E PRECAUÇÕES).
Não há necessidade de ajuste posológico inicial para pacientes30 idosos ou para pacientes30 com insuficiência renal15, inclusive para pacientes30 em diálise16.
Deve ser considerada a utilização de uma dose mais baixa para pacientes30 com histórico de insuficiência hepática63 (veja os itens 4. CONTRAINDICAÇÕES e 5. ADVERTÊNCIAS E PRECAUÇÕES).
Redução do risco de morbidade5 e mortalidade6 cardiovasculares em pacientes hipertensos com hipertrofia7 ventricular esquerda
A dose usual inicial de Zaarpress é de 50 mg uma vez ao dia. Uma dose baixa de hidroclorotiazida deve ser adicionada e/ou a dose de Zaarpress deve ser elevada para 100 mg uma vez ao dia com base na resposta da pressão arterial17.
Insuficiência cardíaca4
A dose inicial de Zaarpress para pacientes30 com insuficiência cardíaca4 é de 12,5 mg uma vez ao dia. Geralmente, a dose deve ser titulada a intervalos semanais (isto é, 12,5 mg/dia, 25 mg/dia, 50 mg/dia) até a dose usual de manutenção de 50 mg uma vez ao dia de acordo com a tolerabilidade do paciente.
Proteção renal11 em pacientes com diabetes tipo 212 e proteinúria13
A dose usual inicial é de 50 mg uma vez ao dia. Essa dose pode ser aumentada para 100 mg uma vez ao dia com base na resposta da pressão arterial17. Zaarpress pode ser administrado com outros agentes anti-hipertensivos (por exemplo, diuréticos18, bloqueadores dos canais de cálcio, alfa ou betabloqueadores e agentes de ação central) e também com insulina103 e outros agentes hipoglicemiantes104 comumente utilizados (como sulfonilureias105, glitazonas e inibidores da glucosidase).
REAÇÕES ADVERSAS
As frequências de eventos adversos são classificadas de acordo com as seguintes categorias: Muito comum (> 1/10), Comum (> 1/100, < 1/10), Incomum (> 1/1.000, < 1/100), Raro (> 1/10.000, < 1/1.000), Muito Raro (< 1/10.000) e Desconhecido (não puderam ser estimados a partir dos dados disponíveis).
Em estudos clínicos controlados sobre hipertensão3 essencial, a reação adversa mais comum em pacientes hipertensos com hipertrofia7 ventricular esquerda e com insuficiência cardíaca4 crônica, assim como em hipertensos com diabetes19 mellitus tipo 2 com doença renal11, foi tontura101.
Tabela 1. Frequência das reações adversas identificadas durante os estudos clínicos controlados com placebo24 e a experiência pós-comercialização
|
Reações adversas |
Frequência das reações adversas por indicação |
Outros |
|||
|
|
Hipertensão3 |
Hipertensão3 com hipertrofia7 ventricular esquerda |
Insuficiência cardíaca4 crônica |
Hipertensão3 e diabetes tipo 212 com doença renal11 |
Experiência pós- comercialização |
|
Alterações do sangue106 e sistema linfático107 |
|||||
|
Anemia108 |
|
|
Comum |
|
Desconhecido |
|
Trombocitopenia109 |
|
|
|
|
Desconhecido |
|
Alterações do sistema imune110 |
|||||
|
Reações de hipersensibilidade, reações anafiláticas111, angioedema671 e vasculite1122 |
|
|
|
|
Raro |
|
Alterações psiquiátricas |
|||||
|
Depressão |
|
|
|
|
Desconhecido |
|
Alterações do sistema nervoso113 |
|||||
|
Tontura101 |
Comum |
Comum |
Comum |
Comum |
|
|
Sonolência |
incomum |
|
|
|
|
|
Cefaleia114 |
Incomum |
|
Incomun |
|
|
|
Distúrbios do sono |
Incomum |
|
|
|
|
|
Parestesia115 |
|
|
Raro |
|
|
|
Enxaqueca116 |
|
|
|
|
Desconhecido |
|
Disgeusia117 |
|
|
|
|
Desconhecido |
|
Alterações do ouvido e labirinto118 |
|||||
|
Vertigem119 |
Comum |
Comum |
|
|
|
|
Zumbido |
|
|
|
|
Desconhecido |
|
Alterações cardíacas |
|||||
|
Palpitações120 |
Incomum |
|
|
|
|
|
Angina23 pectoris |
Incomum |
|
|
|
|
|
Síncope121 |
|
|
Raro |
|
|
|
Fibrilação atrial |
|
|
Raro |
|
|
|
Acidente vascular cerebral9 |
|
|
Raro |
|
|
|
Alterações vasculares122 |
|||||
|
Hipotensão60 (ortostática) (incluindo efeitos ortostáticos relacionados à dose)3 |
Incomum |
|
Comum |
Comum |
|
|
Alterações respiratórias, torácicas e mediastinais |
|||||
|
Dispneia123 |
|
|
Incomum |
|
|
|
Tosse |
|
|
Incomum |
|
Desconhecido |
|
Alterações gastrintestinais |
|||||
|
Dor abdominal |
Incomum |
|
|
|
|
|
Constipação124 |
Incomum |
|
|
|
|
|
Diarreia75 |
|
|
Incomum |
|
Desconhecido |
|
Náusea125 |
|
|
Incomum |
|
|
|
Vômito76 |
|
|
Incomum |
|
|
|
Alterações hepáticas126 |
|||||
|
Pancreatite127 |
|
|
|
|
Desconhecido |
|
Hepatite128 |
|
|
|
|
Raro |
|
Anormalidades no funcionamento do fígado129 |
|
|
|
|
Desconhecido |
|
Alterações de pele e tecido subcutâneo130 |
|||||
|
Urticária131 |
|
|
Incomum |
|
Desconhecido |
|
Prurido132 |
|
|
Incomum |
|
Desconhecido |
|
Erupção133 cutânea134 |
Incomum |
|
Incomum |
|
Desconhecido |
|
Fotossensibilidade |
|
|
|
|
Desconhecido |
|
Eritrodermia |
|
|
|
|
Desconhecido |
|
Urticária131 |
|
|
|
|
Desconhecido |
|
Alterações no musculoesquelético e nos tecidos conectivos |
|||||
|
Mialgia135 |
|
|
|
|
Desconhecido |
|
Artralgia136 |
|
|
|
|
Desconhecido |
|
Rabdomiólise137 |
|
|
|
|
Desconhecido |
|
Alterações renais e urinárias |
|||||
|
Insuficiência renal15 |
|
|
Comum |
|
|
|
Falência renal11 |
|
|
Comum |
|
|
|
Alterações do sistema reprodutivo e das mamas138 |
|||||
|
Disfunção erétil/impotência139 |
|
|
|
|
Desconhecido |
|
Perturbações gerais e alterações no local da administração |
|||||
|
Astenia140 |
Incomum |
Comum |
Incomum |
Comum |
|
|
Fadiga141 |
Incomum |
Comum |
Incomum |
Comum |
|
|
Edema42 |
Incomum |
|
|
|
|
|
Mal-estar |
|
|
|
|
Desconhecido |
|
Investigações |
|||||
|
Hipercalemia77 |
Comum |
|
Incomum4 |
Comum5 |
|
|
Aumento da alanina- aminotransferase (ALT)6 |
Raro |
|
|
|
|
|
Aumento da ureia80, da creatinina14 sérica e do potássio sérico no sangue106 |
|
|
Comum |
|
|
|
Hiponatremia142 |
|
|
|
|
Desconhecido |
|
Hipoglicemia143 |
|
|
|
Comum |
|
- Incluindo edema42 de laringe144 e glote145, face69, lábios, faringe146 e/ou língua71 (que causem obstrução de vias aéreas); alguns pacientes relataram histórico de angioedema67 com a administração de outros medicamentos, incluindo inibidores da ECA.
- Incluindo púrpura147 de Henoch-Schönlein.
- Especialmente em pacientes com depleção74 intravascular102 (por exemplo, pacientes com insuficiência cardíaca4 grave ou sob tratamento com altas doses de diuréticos18).
- Comum em pacientes que receberam 150 mg de losartana em vez de 50 mg.
- Em estudo clínico que incluiu pacientes com diabetes tipo 212 e nefropatia26, 9,9% dos pacientes tratados com losartana em comprimidos e 3,4% dos que receberam placebo24 desenvolveram hipercalemia77 > 5,5 mmol/L148.
- Geralmente resolvido com a descontinuação do tratamento.
As seguintes reações adversas adicionais ocorreram mais frequentemente em pacientes que receberam losartana do que em pacientes que receberam placebo24 (frequência desconhecida): dor nas costas149, infecção150 do trato urinário151 e sintomas152 parecidos com os da gripe153. Alterações renais e urinárias
Como consequência da inibição do sistema renina-angiotensina-aldosterona, mudanças no funcionamento dos rins35 (incluindo falência renal11) foram reportadas em pacientes em risco, essas alterações na função renal11 devem ser reversíveis com a descontinuação do tratamento (veja item 5. ADVERTÊNCIAS E PRECAUÇÕES).
Achados de exames laboratoriais
Em estudos clínicos controlados, alterações nos parâmetros laboratoriais de significância clínica com a administração de losartana potássica foram raramente reportadas.
Creatinina14 e nitrogênio ureico sanguíneo
Aumentos discretos no nitrogênio ureico sanguíneo (BUN) ou na creatinina14 sérica foram observados em menos de 0,1% dos pacientes com hipertensão3 essencial tratados apenas com losartana potássica (veja o item 5. ADVERTÊNCIAS E PRECAUÇÕES - Insuficiência renal15).
Hemoglobina154 e hematócrito155
Diminuições discretas na hemoglobina154 e do hematócrito155 (média de diminuição de aproximadamente 0,11 grama156 por cento e 0,09 por cento de volume, respectivamente) ocorreram com frequência em pacientes tratados apenas com losartana potássica, mas raramente tiveram importância clínica. Nenhum paciente abandonou o tratamento devido à anemia108.
Testes de função hepática157
Ocorreram elevações ocasionais das enzimas hepáticas158 e/ou da bilirrubina159 sérica. Dentre os pacientes com hipertensão3 essencial tratados apenas com losartana potássica, um paciente (< 0,1%) descontinuou o tratamento devido a essa reação adversa laboratorial.
Em casos de eventos adversos, notifique pelo Sistema VigiMed, disponível no Portal da Anvisa.
SUPERDOSE
Os dados disponíveis sobre superdose em humanos são limitados. As manifestações mais prováveis de superdose seriam hipotensão60 e taquicardia160; bradicardia161 poderia ocorrer por estimulação parassimpática (vagal). Se ocorrer hipotensão60 sintomática73, deve-se instituir tratamento de suporte.
Nem a losartana nem o seu metabólito39 ativo podem ser removidos da circulação162 por hemodiálise163.
Em caso de intoxicação ligue para 0800 722 6001, se você precisar de mais orientações.
DIZERES LEGAIS
VENDA SOB PRESCRIÇÃO MÉDICA
Registro MS – 1.3569.0686
Farm. Resp.: Dr. Adriano Pinheiro Coelho CRF-SP n° 22.883
Registrado por:
EMS SIGMA PHARMA LTDA
Rod. Jornalista F. A. Proença, km 08
Bairro Chácara Assay
CEP 13186-901 - Hortolândia/SP
CNPJ: 00.923.140/0001-31
Indústria Brasileira
Fabricado e Embalado por:
EMS S/A Hortolândia /SP
Ou
Registrado por:
EMS SIGMA PHARMA LTDA
Rod. Jornalista F. A. Proença, km 08
Bairro Chácara Assay
CEP 13186-901 - Hortolândia/SP
CNPJ: 00.923.140/0001-31
Indústria Brasileira
Fabricado por:
Novamed Fabricação de Produtos Farmacêuticos Ltda.
Manaus/AM
Embalado por:
EMS S/A
Hortolândia /SP
SAC 0800 191222