Miflonide (Bula do profissional de saúde)
NOVARTIS BIOCIENCIAS S.A
IDENTIFICAÇÃO DO MEDICAMENTO
Miflonide
budesonida
Cápsulas 200 mcg e 400 mcg
FORMA FARMACÊUTICA E APRESENTAÇÃO:
Cápsulas com pó para inalação
Embalagens com 60 cápsulas com inalador
VIA INALATÓRIA
USO ADULTO E PEDIÁTRICO ACIMA DE 6 ANOS
COMPOSIÇÃO:
Cada cápsula de Miflonide 200 mcg contém:
| budesonida | 200 mcg |
| excipiente q.s.p. | 1 cápsula |
Excipiente: lactose1 monoidratada.
Cada cápsula de Miflonide 400 mcg contém:
| budesonida | 400 mcg |
| excipiente q.s.p. | 1 cápsula |
Excipiente: lactose1 monoidratada.
INFORMAÇÕES TÉCNICAS AOS PROFISSIONAIS DE SAÚDE2
INDICAÇÕES
Asma3 brônquica
Quando inalada, a budesonida tem uma ação anti-inflamatória local nos pulmões4, com um efeito corticosteroide sistêmico5 mínimo.
DPOC (Doença Pulmonar Obstrutiva Crônica) de moderada a grave
Na bronquite obstrutiva crônica, na qual o tratamento adjuvante com corticosteroides é indicado. A budesonida em associação com o formoterol demonstrou maior eficácia no tratamento da DPOC de moderada a grave.
RESULTADOS DE EFICÁCIA
Quando utilizada como cápsulas para inalação por pacientes que se beneficiam da terapia com corticosteroide, pode ocasionar o controle da asma3 geralmente dentro de 10 dias após o início do tratamento. O uso regular da budesonida reduz a inflamação6 crônica dos pulmões4 asmáticos. Deste modo, budesonida melhora a função pulmonar e os sintomas7 da asma3, reduz a hiperreatividade brônquica e previne as exacerbações da asma3.
Referências Bibliográficas
- Jeffery PK, Godfrey RW, Adelroth E, Nelson F, Rogers A, Johansson SA. Effects of treatment on airway inflammation and thickening of basement membrane reticular8 collagen in asthma. A quantitative light and electron microscopic study. Am Rev Respir Dis 1992; 145(4 Pt 1):890-9.
- Juniper EF, Kline PA, Vanzieleghem MA, Ramsdale EH, O’Byrne PM, Hargreave FE. Effect of long-term treatment with an inhaled corticosteroid (budesonide) on airway hyper-responsiveness and clinical asthma in nonsteroid- dependent asthmatics. Am Rev Respir Dis 1990; 142(4):832-6.
- The Childhood Asthma Management Program Research Group. Long-term effects of budesonide or nedocromil in children with asthma. N Engl J Med 2000; 343(15):1054-63.
- Pauwels RA, Lofdahl CG, Postma DS, Tattersfield AE, O’Byrne P, Barnes PJ, et al. Effect of inhaled formoterol and budesonide on exacerbations of asthma. Formoterol and Corticosteroids Establishing Therapy (FACET) International Study Group. N Engl J Med 1997; 337(20):1405-11.
CARACTERÍSTICAS FARMACOLÓGICAS
Grupo farmacoterapêutico: outras drogas para doenças obstrutivas das vias aéreas, inalantes; glicocorticoides, código ATC R03B A02.
Mecanismo de ação e Farmacodinâmica
A budesonida é um corticosteroide com ação tópica acentuada, mas praticamente desprovida de ação sistêmica no ser humano. Como outros glicocorticoides inalatórios, a budesonida exerce seus efeitos farmacológicos através da interação com receptores intracelulares de glicocorticoides. A produção de muitas citocinas9, quimiocinas, enzimas e moléculas de adesão celular diferentes é inibida. Quando utilizada como cápsulas para inalação por pacientes que se beneficiam da terapia com corticosteroide, pode geralmente ocasionar o controle da asma3 dentro de 10 dias do início do tratamento. O uso regular da budesonida reduz a inflamação6 crônica nos pulmões4 asmáticos. Deste modo, budesonida melhora a função pulmonar e os sintomas7 da asma3, reduz a hiperreatividade brônquica e previne as exacerbações da asma3.
Farmacocinética
Absorção: A quantidade de budesonida depositada nos pulmões4 é rápida e completamente absorvida. O pico de concentração plasmática é atingido imediatamente após a administração. Após correção da dose depositada na orofaringe10, a biodisponibilidade absoluta é de 73%. Apenas 10 a 13% da fração ingerida de uma dose inalada é biodisponível devido ao metabolismo11 pré-sistêmico5 significante no fígado12.
A exposição sistêmica de budesonida no intervalo de dose recomendado de Miflonide® pode ser esperado como sendo proporcional à dose, tal como observado em outros inaladores de pó seco utilizando budesonida.
Distribuição: A ligação da budesonida à proteína plasmática é 85 a 90% sobre a taxa de concentração de 1 a 100 nmoL. A budesonida é amplamente distribuída nos tecidos, com um volume de distribuição de 183 a 301 L no estado de equilíbrio. A budesonina passa para o leite materno, em uma razão de concentração de leite para plasma13 de cerca de 0,46. A dose diária estimada para crianças é de 0,3% da dose diária materna, e a concentração plasmática média estimada em crianças é 1/600 do plasma13 materno, mesmo após assumir a biodisponibilidade oral infantil completa.
Em experimentos com animais foram observadas altas concentrações no baço14 e nas glândulas15 linfáticas, no timo16, no córtex da adrenal, nos órgãos reprodutivos e nos brônquios17. A budesonida atravessa a barreira placentária em camundongos.
Biotransformação/Metabolismo11: A budesonida não é metabolizada nos pulmões4. Após a absorção, é metabolizada no fígado12, originando vários metabólitos18 inativos, inclusive 6-beta-hidroxi-budesonida e 16-alfa-hidroxiprednisolona. A principal via de metabolização da budesonida é a via CYP3A4 e pode ser afetada por inibidores ou indutores conhecidos desta enzima19 (vide “Interações medicamentosas”).
Eliminação: Em voluntários humanos que inalaram budesonida marcada radioativamente (através de MDI), aproximadamente 32% da dose liberada foi recuperada na urina20 e 15% nas fezes. Após inalação, a 16-alfa-hidroxiprednisolona foi detectada na urina20, mas a budesonida não.
A budesonida apresenta uma depuração plasmática alta (84 L/h) após dose intravenosa. A meia-vida de eliminação é em torno de 2,8 a 5 h.
Populações especiais
Pacientes geriátricos (acima de 65 anos de idade): A farmacocinética da budesonida em pacientes geriátricos não foi estudada. No entanto, dados limitados em pacientes acima de 65 anos de idade, não sugerem diferença significante na farmacocinética quando comparados a adultos mais jovens após administração oral e intravenosa.
Pacientes pediátricos: A farmacocinética de budesonida não foi estudada na população pediátrica. No entanto, dados com outros produtos com budesonida inalatória sugerem que o clearance de peso corporal normalizado em crianças acima de 3 anos é cerca de 50% maior do que em adultos.
Pacientes com insuficiência hepática21: A farmacocinética de budesonida inalada não foi estudada em pacientes com insuficiência hepática21. No entanto, após a administração oral, existem relatos que a biodisponibilidade sistêmica de budesonida foi 2,5 vezes maior após a administração oral em pacientes com cirrose22 em comparação com pacientes-controle saudáveis. É relatado que a insuficiência hepática21 leve tem pouco efeito sobre a exposição sistêmica.
Pacientes com insuficiência renal23: A farmacocinética de budesonida não foi estudada em pacientes com insuficiência renal23, mas nenhum efeito adverso significativo é esperado. No entanto, como os metabólitos18 da budesonida são excretados na urina20, um aumento no risco de eventos adversos devido ao acúmulo de metabólitos18 não pode ser excluído na insuficiência renal23 grave.
Estudos clínicos
Miflonide® é um medicamento maduro. Nenhum estudo clínico recente foi conduzido com Miflonide®.
Dados de segurança pré-clínicos
Toxicidade24 de dose repetida: Dados de estudos pré-clínicos de toxicidade24 de dose repetida não revelaram risco específico para humanos na dose terapêutica25 pretendida.
Mutagenicidade e carcinogenicidade: A budesonida não demonstrou potencial mutagênico em uma bateria de testes de mutagenicidade in vitro e in vivo. Administrada oralmente, a budesonida demonstrou aumentar a incidência26 de tumores hepáticos em ratos machos a partir de doses de 25 microgramas/kg/dia. Estes efeitos também foram observados em um estudo de acompanhamento, incluindo outros esteroides (prednisolona e acetonido de triancinolona) e são considerados como efeitos de classe, da administração de corticosteroides.
Toxicidade24 reprodutiva: Vide “Advertências e Precauções – Gravidez27, lactação28, mulheres e homens com potencial reprodutivo”.
CONTRAINDICAÇÕES
- Hipersensibilidade conhecida à budesonida ou a qualquer outro componente da formulação (vide “Composição”);
- Tuberculose29 pulmonar ativa.
Miflonide® não deve ser utilizado por crianças com menos de 6 anos de idade.
ADVERTÊNCIAS E PRECAUÇÕES
Terapia de natureza profilática
Os pacientes devem ter conhecimento da natureza profilática do tratamento com budesonida inalatória e da necessidade de ser administrado regularmente, mesmo quando os pacientes não estiverem apresentando sintomas7. A budesonida inalada não produz alívio do broncoespasmo30 agudo31, nem é adequado para o tratamento primário do estado asmático ou de outros episódios agudos de asma3.
Condições concomitantes
São necessários cuidados especiais em pacientes com distúrbios concomitantes como tuberculose29 pulmonar latente ou infecções32 fúngicas33 e virais das vias aéreas.
Deve-se ter cautela quando tratar pacientes com distúrbios pulmonares concomitantes, como bronquiectasias e pneumoconiose34, devido à possibilidade de infecções32 fúngicas33.
Risco de pneumonia35 em pacientes com DPOC
Um aumento na incidência26 de pneumonia35, incluindo pneumonia35 com necessidade de hospitalização, tem sido observado em pacientes com DPOC recebendo corticosteroides inalatórios. Há alguma evidência de um risco aumentado de pneumonia35 com o aumento da dose de esteroides, porém isto não foi demonstrado conclusivamente em todos os estudos. A evidência clínica para as diferenças intraclasse na magnitude do risco de pneumonia35 entre os produtos corticosteroides inalatórios é inconclusiva.
Os médicos devem estar atentos para possível desenvolvimento de pneumonia35 em pacientes com DPOC já que as características clínicas de tais infecções32 podem coincidir com os sintomas7 de exacerbações da DPOC.
Fatores de risco para pneumonia35 em pacientes com DPOC incluem tabagismo, idade avançada, baixo IMC36 e condição grave de DPOC.
Exacerbações da asma3
Em casos de exacerbação aguda da asma3 pode ser necessário um aumento na dose de Miflonide® ou tratamento complementar com corticosteroides orais e/ou antibióticos, caso ocorra infecção37, por um curto período de tempo.
Os pacientes devem sempre ter um broncodilatador38 inalatório de curta duração disponível como medicação de resgate para o alívio dos sintomas7 agudos da asma3.
Os pacientes devem ser aconselhados a procurar seus médicos caso sua asma3 piore (frequência aumentada de tratamento com broncodilatador38 inalatório de curta duração ou sintomas7 respiratórios persistentes). O paciente deve ser reavaliado e na necessidade de terapia anti-inflamatória aumentada, um aumento na dose do corticosteroide inalatório ou oral deve ser considerado.
Broncoespamo paradoxal39
Em casos raros, a inalação de Miflonide® pode causar broncoespasmos40 após administração. Ocorrendo broncoespasmo30 paradoxal39, a inalação de Miflonide® deve ser interrompida imediatamente e, se necessário, ser substituída por outro tratamento. Broncoespasmo30 paradoxal39 responde a um broncodilatador38 inalatório de rápida ação.
Efeitos sistêmicos41
Efeitos sistêmicos41 de corticosteroides inalatórios podem ocorrer particularmente em altas doses prescritas por períodos prolongados. Esses efeitos são menos prováveis de ocorrer do que com corticosteroides orais. Possíveis efeitos sistêmicos41 incluem supressão adrenal, hiperadrenocorticismo/síndrome42 de Cushing, redução na velocidade de crescimento em crianças e adolescentes, diminuição na densidade mineral do osso, catarata43 e glaucoma44, reações de hipersensibilidade e mais raramente, uma gama de efeitos psicológicos ou comportamentais, incluindo hiperatividade psicomotora45, distúrbios do sono, ansiedade, depressão e agressividade (principalmente em crianças). Desta forma, é importante que a dose do corticosteroide inalatório seja ajustada para a menor dose efetiva na qual o controle da asma3 seja mantido (vide “Reações Adversas”).
Efeito no crescimento
É recomendado monitorar regularmente a altura da criança que recebe tratamento prolongado com corticosteroide inalatório. Se a redução na velocidade de crescimento for notada, a terapia deve ser revisada com o objetivo de diminuir a dose do corticosteroide inalatório, se possível, para a menor dose efetiva na qual os sintomas7 da asma3 sejam controlados. Adicionalmente, deve ser considerada a indicação do paciente para um especialista respiratório pediatra. Os efeitos em longo prazo dessa redução da velocidade de crescimento associada com corticosteroides inalatórios, incluindo o impacto na altura adulta final, são desconhecidos. O potencial para crescimento de recuperação ou “catch- up” após a descontinuação do tratamento com corticosteroides de inalação oral não foi adequadamente estudado.
Medicação concomitante
Deve-se ter cautela durante a coadministração de Miflonide® por um longo período de tempo com um potente inibidor da CYP3A4, por exemplo, itraconazol, atazanavir, cetoconazol, ritonavir, nelfinavir, amiodarona e claritromicina (vide “Interações Medicamentosas”).
Pacientes iniciando o tratamento com corticosteroides
Normalmente, obtém-se efeito terapêutico em 10 dias. Em pacientes com secreção brônquica excessiva, pode-se administrar inicialmente um esquema curto adicional com corticosteroide oral (cerca de 2 semanas).
Pacientes dependentes de corticosteroides
O paciente deve estar em uma fase relativamente estável ao alternar a terapia de esteroides orais para budesonida inalada. Uma dose alta de budesonida é dada em combinação com a dose de corticosteroide oral previamente utilizada pelo paciente por pelo menos 10 dias. A dose oral de corticosteroide deve então ser gradualmente reduzida (por exemplo, 2,5 mg de prednisolona ou equivalente a cada mês) até a maior redução possível. O tratamento complementar com corticosteroides sistêmicos41 ou com Miflonide® não deve ser suspenso abruptamente, mas gradualmente.
Uma precaução especial é requerida nos primeiros meses após o período de substituição do corticosteroide oral pela budesonida inalada, a fim de assegurar que a reserva adrenocortical destes pacientes seja capaz de contornar situações como trauma, cirurgias ou infecções32 graves, visto que estes pacientes podem desenvolver quadro agudo31 de insuficiência46 adrenal. A função do eixo hipotalâmico-hipofisário-adrenal deve ser monitorizada regularmente. Alguns pacientes necessitam de uma dose extra de corticosteroides nessas circunstâncias, estes devem ser aconselhados a portar um cartão descrevendo sua condição potencialmente séria. A substituição do corticosteroide oral sistêmico5 pela budesonida inalada pode revelar alergias previamente suprimidas pela terapia com corticosteroides sistêmicos41, como, por exemplo, rinite47 alérgica ou eczema48 e pacientes podem sofrer de letargia49, dores musculares ou articulares e, às vezes, náusea50 e vômito51. Estas alergias podem ser tratadas adequadamente utilizando-se anti-histamínicos ou corticosteroides de uso local.
Precauções adicionais
Para prevenir candidíase52 oral, o paciente deve ser aconselhado a enxaguar a boca53 com água após cada administração. Caso esta condição evolua, responderá a terapia antifúngica tópica na maioria dos casos, sem ter que descontinuar o tratamento com Miflonide® (vide “Posologia e modo de usar” e “Reações Adversas”).
Disfonia54 pode ocorrer, porém é prontamente reversível após a descontinuação doo tratamento, reduzindo a dose e/ou descansando a voz (vide “Reações Adversas”).
Informações importantes sobre um dos componentes do medicamento
As cápsulas contêm LACTOSE1. Este medicamento não é recomendado para pacientes55 com problemas hereditários raros de intolerância a galactose56, grave deficiência de lactase ou má-absorção de glicose57-galactose56.
Via de administração incorreta
Há relatos de pacientes que equivocadamente engoliram cápsulas de Miflonide® em vez de colocar as cápsulas no dispositivo de inalação Aerolizer®. A maioria destas ingestões não estava associada aos efeitos secundários. Os profissionais de saúde2 devem instruir o paciente sobre como utilizar corretamente o Miflonide® (vide “Posologia e Modo de Usar”). Se um paciente que está utilizando Miflonide® não sente a respiração melhorar, o médico deve perguntar como o paciente está utilizando Miflonide®.
Fertilidade, Gravidez27 e Lactação28
Não existem estudos adequados e bem controlados utilizando Miflonide® em mulheres grávidas. Os resultados de um grande estudo epidemiológico prospectivo58 indicaram que a budesonida inalada durante a gravidez27 não teve efeitos adversos sobre a saúde2 do feto59 ou do filho recém-nascido.
Em ratos administrados com 0,25 microgramas/kg de budesonida inalada não houve efeitos teratogênicos60. A budesonida administrada subcutaneamente demonstrou efeitos teratogênicos60 em maior ou igual a 100 ug/kg/dia em ratos e maior ou igual a 5 ug/kg/dia em coelhos, com as margens de exposição materna em cerca de 2,4 e 0,24 vezes a dose inalada humana máxima de 400 ug/dia, respectivamente, com base na área da superfície corporal. Em ratos administrados com budesonida por via subcutânea61 em um estudo de desenvolvimento pré e pós-natal, não houve efeitos sobre as ratas grávidas ou seus descendentes. Tal como acontece com outros glicocorticoides, a budesonida administrada por via subcutânea61 demonstrou ser teratogênica62 e fetotóxica (diminuição da viabilidade de filhotes) em ratos. Fetotoxicidade também foi observada em coelhos (redução na velocidade de crescimento e morte fetal observada em níveis de doses tóxicas maternas
A budesonida inalada é secretada no leite materno. As concentrações plasmáticas alcançadas em recém-nascidos seriam esperadas atingir cerca de 1/600 das concentrações no plasma13 (vide “Farmacocinética”). Embora essa pequena quantidade de budesonida sugira que Miflonide® possa ser usado durante a lactação28, o impacto clínico em lactentes63 durante o tratamento em longo prazo é desconhecido.
Não há nenhuma recomendação especial para mulheres em idade fértil.
Não há dados disponíveis sobre o uso de budesonida e seu efeito na fertilidade em humanos. Em ratos, a budesonida administrada por via subcutânea61 não teve um efeito adverso sobre a fertilidade.
Este medicamento pertence à categoria de risco na gravidez27 B, portanto, este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Categoria B – Não há estudos adequados em mulheres. Em experiência em animais não foram encontrados riscos, mas foram encontrados efeitos colaterais64 que não foram confirmados nas mulheres, especialmente durante o último trimestre de gravidez27.
Efeitos na habilidade de dirigir e operar máquinas
Não há dados sobre o efeito deste fármaco65 na habilidade de dirigir veículos e/ou operar máquinas, porém considera-se este efeito improvável de ocorrer.
INTERAÇÕES MEDICAMENTOSAS
A principal via metabólica da budesonida é via citocromo P450 (CYP) isoenzima 3A4 (CYP3A4). A coadministração de inibidores conhecidos da CYP3A4 (por exemplo, itraconazol, atazanavir, cetoconazol, ritonavir, nelfinavir, amiodarona, claritromicina), é conhecida por inibir o metabolismo11 da budesonida, e assim, aumentar a exposição sistêmica. Se estes produtos forem administrados concomitantemente, a função adrenocortical deve ser monitorada e a dose de budesonida ajustada de acordo com a resposta (vide “Advertências e Precauções” e “Características Farmacológicas”).
Agentes que resultam em indução de CYP3A4
A coadministração de potentes indutores da CYP3A4 (por exemplo, rifampicina) pode aumentar o metabolismo11 da budesonida, e assim, diminuem a exposição à budesonida (vide “Características Farmacológicas”).
CUIDADOS DE ARMAZENAMENTO DO MEDICAMENTO
Cuidados de conservação
Miflonide® deve ser conservado em temperatura ambiente (entre 15 e 30°C) e protegido da umidade.
O prazo de validade de Miflonide® 200 mg é de 18 meses a partir da data de fabricação. O prazo de validade de Miflonide® 400 mg é de 36 meses a partir da data de fabricação.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original. Para sua segurança, mantenha o medicamento na embalagem original.
Características físicas e organolépticas do produto
A cápsula de 200 microgramas tem a tampa rosa opaco e o corpo incolor transparente. A cápsula de 400 microgramas tem a tampa rosa opaco e o corpo incolor transparente. Antes de usar, observe o aspecto do medicamento.
TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS.
POSOLOGIA E MODO DE USAR
A dose deve ser ajustada individualmente à dose mais baixa necessária para a terapia de manutenção. Miflonide® deve ser administrado regularmente todos os dias. A dose deve ser reajustada individualmente na transferência de um paciente de um dispositivo de inalação para outro.
A menor dose em uma única cápsula é de 200 microgramas. Se uma dose única menor de 200 microgramas for requerida, este produto não pode ser utilizado.
População alvo geral
Pacientes adultos
O tratamento de adultos com asma3 leve pode ser iniciado com a dosagem mínima efetiva de 200 microgramas uma vez ao dia. A dosagem usual de manutenção é de 200 a 400 microgramas, duas vezes ao dia (equivalente a 400 a 800 microgramas diários).
A dosagem pode ser aumentada para 1.600 microgramas ao dia, em 2 a 4 administrações durante as crises de asma3, quando o paciente for alternar da terapia oral com corticosteroides para a terapia inalatória com budesonida ou quando a dose da corticoterapia for reduzida.
Dosagens especiais
Pacientes com insuficiência renal23: Não há estudos clínicos em pacientes com insuficiência renal23. Baseado nos dados de farmacocinética com budesonida oral, é improvável que a exposição sistêmica seja alterada para níveis clinicamente significantes nestes pacientes (vide “Características Farmacológicas”).
Pacientes com insuficiência hepática21: Não há estudos clínicos em pacientes com insuficiência hepática21. No entanto, como a budesonida é predominantemente eliminada pelo metabolismo11 hepático, deve-se ter cautela quando utilizar Miflonide® em paciente com insuficiência hepática21 grave. Com base nos dados farmacocinéticos da budesonida oral, pacientes com insuficiência hepática21 leve a moderada são improváveis de experimentar alterações clinicamente significantes na exposição à droga. (vide “Características Farmacológicas”).
Pacientes pediátricos (acima de 6 anos de idade): Devido à ausência de experiência clínica em crianças abaixo de 6 anos, Miflonide® não deve ser utilizado nesta faixa etária.
O tratamento de crianças acima de 6 anos de idade com asma3 leve pode ser iniciado com uma dose de 200 microgramas uma vez ao dia. A dosagem usual de manutenção é de 200 microgramas, duas vezes ao dia (equivalente a 400 microgramas diários). A dose total diária máxima é de 800 microgramas. Miflonide® deve ser utilizado sob a supervisão de adultos. Uso do inalador Aerolizer® deve depender da capacidade de utilização correta do inalador pela criança.
Pacientes geriátricos (acima de 65 anos de idade): Não há evidências que sugiram que pacientes acima de 65 anos necessitem de uma dose diferente da utilizada em pacientes adultos jovens.
Modo de usar
Miflonide® deve ser utilizado unicamente para inalação oral através do inalador Aerolizer®.
Para assegurar administração apropriada do medicamento, o médico ou outro profissional da saúde2 deve:
- Instruir o paciente sobre o uso correto do Aerolizer® de acordo com as instruções do usuário para garantir que a droga atinja as áreas-alvo nos pulmões4.
- Esclarecer ao paciente que as cápsulas são apenas para a utilização por inalação e não devem ser ingeridas (ver “Advertências e Precauções”).
Instruções detalhadas de manuseio estão incluídas na bula do paciente e na bula do profissional de saúde2. Os pacientes que não experimentarem melhora na respiração devem ser questionados se eles estão engolindo o medicamento ao invés de inalar.
A fim de reduzir os riscos de uma possível infecção37 por Candida, é recomendado enxaguar bem a boca53 com água, sem engolir, após cada administração (ver “Advertências e Precauções” e “Reações Adversas”). Enxaguar a boca53 também pode ajudar a prevenir irritação na garganta66 e possivelmente reduzir os riscos de efeitos sistêmicos41.
As cápsulas de Miflonide® devem ser utilizadas somente com o inalador fornecido na embalagem.
O inalador é composto pelas seguintes partes:

- uma capa para proteger o bocal;
- a base que permite uma liberação adequada do medicamento da cápsula;
A base consiste em: - o bocal;
- compartimento para a cápsula;
- botões com “asas” laterais projetadas e pinos em cada lado;
- um canal de passagem do ar.
Para usar o inalador, proceda do seguinte modo:
- Retire a tampa do inalador.
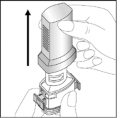
- Abra o compartimento da cápsula, segurando firmemente a base do inalador e girando o bocal na direção indicada pela seta.
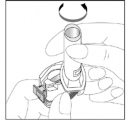
- Assegure-se que seus dedos estejam completamente secos. Retire uma cápsula do blíster e coloque-a horizontalmente no compartimento para a cápsula na base do inalador. É importante que a cápsula somente seja retirada do blíster imediatamente antes do uso.
Atenção: Não coloque a cápsula no bocal!

- Feche o compartimento da cápsula, voltando o bocal até que você escute um “click”.
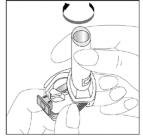
- Para liberar o pó da cápsula:
- Segure o inalador na posição vertical com o bocal para cima.
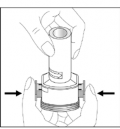
- Pressione firme e simultaneamente os botões, para romper a cápsula. Em seguida, solte os botões. Faça isso apenas uma vez.
Obs: Neste passo, a cápsula pode partir-se em pequenos fragmentos67 de gelatina que podem atingir sua boca53 ou a garganta66. No entanto, a gelatina é comestível e, portanto, não é prejudicial.
- Expire (solte todo o ar do seu pulmão68) o máximo possível.

- Para inalar seu medicamento profundamente para suas vias aéreas:
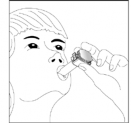
- Coloque o bocal do inalador na boca53 e incline levemente sua cabeça69 para trás.
- Feche firmemente os lábios ao redor dele.
- Inspire, pela boca53, de maneira rápida e o mais profundamente possível.
Obs.: Você deve ouvir um som de vibração, como se a cápsula girasse no espaço superior ao compartimento da cápsula. Se não ouvir esse ruído, abra o compartimento da cápsula, verifique se a cápsula está solta. Caso a cápsula esteja presa bata levemente no fundo do inalador e em seguida, repita o passo 7.
NÃO tente desprender a cápsula apertando repetidamente os botões.
- Após inspirar através do inalador, segure a respiração pelo maior tempo que você confortavelmente conseguir; enquanto isso retire o inalador da boca53. Em seguida, expire pelo nariz70. Abra o inalador e verifique se ainda há resíduo de pó na cápsula. Se ainda restar pó na cápsula, repita os passos de 6 a 8.
- Após o uso de todo o pó, abra o compartimento da cápsula (vide passo 2), remova a cápsula vazia e use um pano seco ou uma escova macia para remover o pó que porventura restou.
Obs.: NÃO UTILIZE ÁGUA para limpar o inalador.
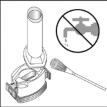
- Feche o bocal e recoloque a capa.
Este medicamento não deve ser partido, aberto ou mastigado
REAÇÕES ADVERSAS
As reações adversas a medicamento (Tabela 1) estão listadas de acordo com o sistema de classe de órgãos em MedDRA. Em cada classe de sistema de órgão, a reação adversa ao medicamento é classificada pela frequência, com as reações mais frequente primeiro. Em cada grupo de frequência, as reações adversas ao medicamento são apresentadas em ordem decrescente de gravidade. Além disso, a categoria de frequência, correspondente usando a seguinte convenção (CIOMS III) também é fornecida para cada reação adversa ao medicamento: muito comum (≥ 1/10), comum (≥ 1/100, < 1/10), incomum (≥ 1/1.000, < 1/100), rara (≥ 1/10.000, < 1/1.000), muito rara (< 1/10.000).
Tabela 1. Reações adversas ao medicamento
|
Distúrbios endócrinos |
|
|
Rara |
Supressão adrenal, síndrome42 de Cushing, hiperadrenocorticismo, redução na velocidade de crescimento em crianças e adolescentes |
|
Distúrbios oculares |
|
|
Rara |
Catarata43, glaucoma44 |
|
Distúrbios do sistema imune71 |
|
|
Rara |
Reações de hipersensibilidade, erupção72 cutânea73, urticária74, angioedema75, prurido76 |
|
Distúrbios musculoesqueléticos e do tecido conjuntivo77 |
|
|
Rara |
Diminuição da densidade mineral nos ossos |
|
Distúrbios respiratórios, torácicos e mediastinais |
|
|
Comum |
Tosse |
|
Rara |
Broncoespasmo30 paradoxal39, candidíase52 orofaríngea78, disfonia54, irritação da garganta66 |
Pós-comercialização
Reações adversas a medicamento de experiência pós-comercialização (frequência desconhecida)
As reações adversas a seguir foram derivadas de experiência pós-comercialização com Miflonide®. Devido a estas reações serem reportadas voluntariamente por uma população de tamanho incerto, não é possível estimar sua frequência com segurança, a qual é, portanto, categorizada como desconhecida.
Tabela 2. Reações adversas ao medicamento provenientes de relatos espontâneos e da literatura (frequência desconhecida)
|
Distúrbios do sistema imunológico79 |
|
Dermatite80 de contato (reação de hipersensibilidade do tipo IV – tardia) |
|
Distúrbios psiquiátricos |
|
Hiperatividade psicomotora45, distúrbios do sono, ansiedade, depressão, agressividade, alterações comportamentais (predominantemente em crianças) |
|
Distúrbios respiratórios, torácicos e mediastinal |
|
Pneumonia35* |
|
Distúrbios da pele81 e dos tecidos subcutâneos |
|
Hematomas82* |
*RAMs relatadas em literaturas publicadas de estudos clínicos de longa duração em pacientes com DPOC.
Em casos de eventos adversos, notifique pelo Sistema VigiMed, disponível no Portal da Anvisa.
SUPERDOSE
Overdose aguda
A toxicidade24 aguda da budesonida é baixa. A supressão da função do eixo hipotalâmico-hipofisário-adrenal (HHA) é o principal efeito nocivo resultando da inalação de grandes quantidades do fármaco65 durante um curto período de tempo. Nenhuma medida especial de emergência83 precisa ser tomada. O tratamento com Miflonide® deve ser continuado na dose recomendada para controlar a asma3 ou DPOC.
Overdose crônica
Corticosteroides inalatórios podem produzir efeitos sistêmicos41, particularmente em doses elevadas prescritas por períodos prolongados. Estes efeitos são menos prováveis de ocorrer quando comparados com corticosteroides orais. Alguns possíveis efeitos sistêmicos41 incluem supressão adrenal, hiperadrenocorticismo/síndrome42 de Cushing, redução na velocidade de crescimento em crianças e adolescentes, diminuição da densidade mineral óssea, catarata43 e glaucoma44, reações de hipersensibilidade e mais raramente, uma série de efeitos psicológicos ou comportamentais, incluindo hiperatividade psicomotora45, distúrbios do sono, ansiedade, depressão ou agressividade (principalmente em crianças).
Em caso de intoxicação ligue para 0800 722 6001, se você precisar de mais orientações.
DIZERES LEGAIS
VENDA SOB PRESCRIÇÃO MÉDICA
MS – 1.0068.0093
Farm. Resp.: Flavia Regina Pegorer – CRF-SP 18.150
Importado por:
Novartis Biociências S.A.
Av. Prof. Vicente Rao, 90
São Paulo – SP
CNPJ: 56.994.502/0001-30
Indústria Brasileira
Fabricado por:
Pharmachemie B.V., Haarlem, Holanda
SAC 0800 888 3003