

Ocrevus (Bula do profissional de saúde)
PRODUTOS ROCHE QUÍMICOS E FARMACÊUTICOS S.A.
IDENTIFICAÇÃO DO MEDICAMENTO
Ocrevus®
ocrelizumabe
Infusão 30 mg/mL
FORMA FARMACÊUTICA E APRESENTAÇÃO:
Solução para diluição para infusão
Caixa com 1 frasco-ampola de 10 mL
VIA INTRAVENOSA
USO ADULTO
COMPOSIÇÃO:
Cada frasco de Ocrevus® contém:
| ocrelizumabe | 300 mg |
| veículo q.s.p. | 10 mL |
Veículo: acetato de sódio trihidratado, ácido acético glacial, alfa-alfa trealose dihidratada, polissorbato 20 e água para injetáveis.
INFORMAÇÕES TÉCNICAS AOS PROFISSIONAIS DE SAÚDE1
INDICAÇÕES
Ocrevus® é indicado para o tratamento de pacientes com formas recorrentes de esclerose múltipla2 (EMR) e de pacientes com esclerose múltipla2 primária progressiva (EMPP).
RESULTADOS DE EFICÁCIA
Formas Recorrentes da Esclerose Múltipla2 (EMR)
A eficácia de Ocrevus® foi demonstrada em dois estudos clínicos randomizados, duplo-cegos, duplo-mascarados, controlados por comparador ativo de desenho idêntico, em pacientes com EMR tratados por 96 semanas (Estudo 1 e Estudo 2). A dose de Ocrevus® foi de 600 mg a cada 24 semanas (o tratamento inicial foi administrado com duas infusões intravenosas de 300 mg com um intervalo de 2 semanas, e as doses subsequentes foram administradas como uma infusão intravenosa única de 600 mg) e as injeções subcutâneas de placebo3 foram administradas 3 vezes por semana. A dose de REBIF, o comparador ativo, era de 44 mcg administrado como injeções subcutâneas 3 vezes por semana e as infusões intravenosas de placebo3 foram administradas a cada 24 semanas. Ambos os estudos incluíam pacientes que tinham apresentado pelo menos uma recidiva4 no ano anterior, ou duas recidivas5 em dois anos anteriores, e apresentavam uma pontuação na Escala Expandida do Estado de Incapacidade (Expanded Disability Status Scale - EDSS) de 0 a 5,5. Pacientes com formas primárias progressivas da esclerose múltipla2 (EM) foram excluídos. Avaliações neurológicas foram realizadas a cada 12 semanas e no momento de uma suspeita de recidiva4. RMNs (Ressonância Magnética6 Nuclear) do cérebro7 foram realizadas na linha de base e nas semanas 24, 48 e 96.
O resultado primário tanto do Estudo 1 quanto do Estudo 2 foi a taxa de recidiva4 anual (TRA). Medidas de resultados adicionais incluíam a proporção de pacientes com progressão de incapacidade confirmada, o número médio de lesões8 realçadas por gadolínio (Gd) em RMN T1 nas semanas 24, 48 e 96, e lesões8 hiperintensas novas ou em aumento em RMN T2. A progressão de incapacidade foi definida como um aumento de 1 ponto ou mais desde a pontuação de EDSS basal atribuível à EM quando a pontuação de EDSS basal era de 5,5 ou menos, ou 0,5 pontos ou mais quando a pontuação de EDSS basal estava acima de 5,5. A progressão de incapacidade foi considerada confirmada quando o aumento na EDSS foi confirmado em uma visita regularmente programada 12 semanas após a documentação inicial de piora neurológica. A população primária para análise de progressão de incapacidade confirmada foi a população agrupada dos Estudos 1 e 2.
No Estudo 1, 410 pacientes foram randomizados para Ocrevus® e 411 para REBIF. 11% dos pacientes tratados com Ocrevus® e 17% dos pacientes tratados com REBIF não concluíram o período de tratamento duplo-cego de 96 semanas. Os dados demográficos e características da doença na linha de base foram equilibrados entre os dois grupos de tratamento. Na linha de base, a idade média dos pacientes era de 37 anos; 66% eram mulheres. O tempo médio desde o diagnóstico9 da EM até a randomização foi de 3,8 anos, o número médio de recidivas5 no ano anterior foi de 1,3, e a pontuação média de EDSS foi de 2,8; 74% dos pacientes não tinham sido tratados com uma terapia não-esteroide para EM nos 2 anos anteriores ao estudo. Na visita basal, 40% dos pacientes apresentavam uma ou mais lesões8 realçadas por Gd em T1 (média 1,8).
No Estudo 2, 417 pacientes foram randomizados para Ocrevus® e 418 para REBIF; 14% dos pacientes tratados com Ocrevus® e 23% dos pacientes tratados com REBIF não concluíram o período de tratamento duplo-cego de 96 semanas. Os dados demográficos e as características da doença na visita basal foram equilibrados entre os dois grupos de tratamento. Na linha de base, a idade média dos pacientes era de 37 anos; 66% eram mulheres. O tempo médio desde o diagnóstico9 de EM até a randomização foi de 4,1 anos, o número médio de recidivas5 no ano anterior foi de 1,3, e a pontuação média na EDSS foi de 2,8; 74% dos pacientes não tinham sido tratados com uma terapia não-esteroide para EM nos 2 anos anteriores ao estudo. Na linha de base, 40% dos pacientes tratados com Ocrevus® apresentavam uma ou mais lesões8 realçadas por Gd em T1 (média 1,9).
No Estudo 1 e no Estudo 2, Ocrevus® reduziu significativamente a taxa de recidiva4 anual e a proporção de pacientes com progressão de incapacidade confirmada em 12 semanas após o início em comparação com REBIF. Os resultados do Estudo 1 e do Estudo 2 são apresentados na Tabela 1 e na Figura 1.
Tabela 1. Principais Desfechos Clínicos e de RMN em Pacientes com EMR do Estudo 1 e do Estudo 2 zzzz
|
Desfechos |
Estudo 1 |
Estudo 2 |
||
|
Ocrevus® 600 mg a cada 24 semanas N=410 |
REBIF 44 mcg três vezes por semana |
Ocrevus® 600 mg a cada 24 semanas |
REBIF 44 mcg três vezes por semana |
|
|
Desfechos Clínicos |
||||
|
Taxa de Recidiva4 Anual (Desfecho Primário) |
0,156 |
0,292 |
0,155 |
0,290 |
|
Redução Relativa |
46% (p<0,0001) |
47% (p<0,0001) |
||
|
Proporção livre de Recidiva4 |
83% |
71% |
82% |
72% |
|
Proporção de Pacientes com Progressão de Incapacidade Confirmada em 12 Semanas1 |
9,8% Ocrevus® vs 15,2% REBIF |
|||
|
Redução do Risco (Análise Agrupada2) |
40%; p=0,0006 |
|||
|
Desfechos de RMN |
||||
|
Número médio de lesões8 realçadas por Gd em T1 por RMN |
0,016 |
0,286 |
0,021 |
0,416 |
|
Redução Relativa |
94% (p<0,0001) |
95% (p<0,0001) |
||
|
Número médio de lesões8 hiperintensas novas e/ou em aumento em T2 por RMN |
0,323 |
1,413 |
0,325 |
1,904 |
|
Redução Relativa |
77% (p<0,0001) |
83% (p<0,0001) |
||
1 Definida como um aumento de 1,0 ponto ou mais da pontuação basal da Escala Expandida do Estado de Incapacidade (Expanded Disability Status Scale - EDSS) para pacientes10 com pontuação basal de 5,5 ou menos, ou 0,5 ou mais quando a pontuação basal é maior que 5,5, Estimativas de Kaplan-Meier na Semana 96.
2 Dados agrupados prospectivamente a partir do Estudo 1 e do Estudo 2.
Figura 1. Gráfico de Kaplan-Meier* do Tempo até o Início da Progressão de Incapacidade Confirmada Mantida por pelo menos 12 Semanas com o Evento Inicial de Agravamento Neurológico tendo ocorrido durante o Período de Tratamento Duplo-cego nos Estudos Agrupados 1 e 2 em Pacientes com EMR (População ITT Agrupada)
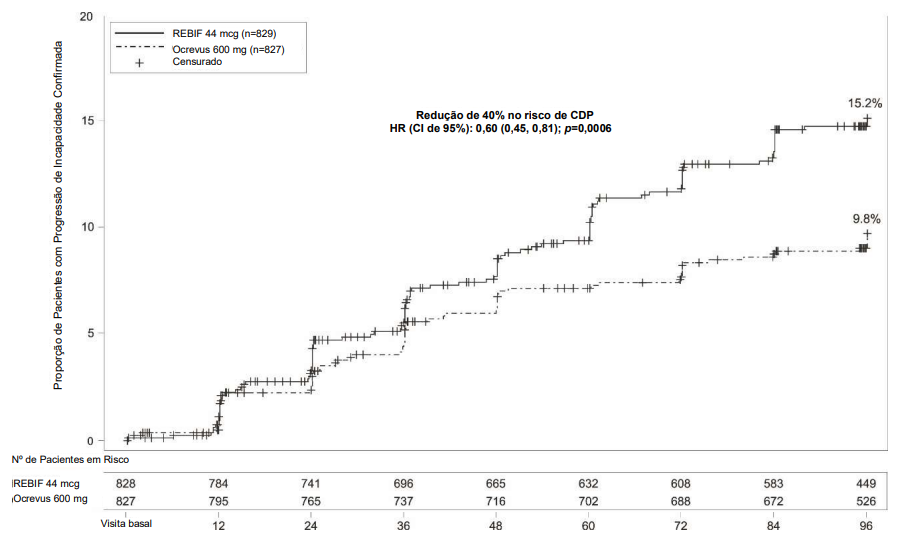 |
Em análises do subgrupo exploratório do Estudo 1 e do Estudo 2, o efeito de Ocrevus® na taxa de recidiva4 anual e na progressão de incapacidade foi semelhante em pacientes homens e mulheres.
Esclerose Múltipla2 Primária Progressiva (EMPP)
O Estudo 3 foi um estudo clínico randomizado11, duplo-cego, controlado por placebo3 em pacientes com EMPP. Os pacientes foram randomizados a 2:1 para receber Ocrevus® 600 mg ou placebo3 como duas infusões intravenosas de 300 mg com um intervalo de 2 semanas a cada 24 semanas por pelo menos 120 semanas. Os critérios de seleção exigiam uma EDSS basal de 3 a 6,5 e uma pontuação de 2 ou mais para o sistema funcional piramidal12 da EDSS em razão de achados na extremidade inferior. Avaliações neurológicas foram conduzidas a cada 12 semanas. Uma RMN foi realizada na visita basal e nas Semanas 24, 48 e 120.
No Estudo 3, o resultado primário foi o tempo até o início da progressão de incapacidade atribuível à EM confirmada como presente na próxima avaliação neurológica pelo menos 12 semanas depois. A progressão de incapacidade ocorria quando a pontuação da EDSS aumentava 1 ponto ou mais a partir da EDSS basal se a EDSS basal fosse de 5,5 pontos ou menos, ou por 0,5 pontos ou mais se a EDSS basal fosse maior que 5,5 pontos. No Estudo 3, também foi considerado que a progressão de incapacidade confirmada tinha ocorrido se os pacientes que apresentassem progressão de incapacidade descontinuassem a participação no estudo antes da próxima avaliação. Medidas de resultado adicionais incluíam caminhada cronometrada por uma distância de 25 pés, e alteração percentual no volume da lesão13 hiperintensa em T2.
O Estudo 3 randomizou 488 pacientes para Ocrevus® e 244 para placebo3; 21% dos pacientes tratados com Ocrevus® e 34% dos pacientes tratados com placebo3 não concluíram o estudo. Os dados demográficos e as características da doença na linha de base foram equilibrados entre os dois grupos de tratamento. Na linha de base, a idade média dos pacientes era de 45; 49% eram mulheres. O tempo médio desde o aparecimento do sintoma14 foi de 6,7 anos, a pontuação média na EDSS foi de 4,7, e 26% apresentaram uma ou mais lesões8 realçadas por Gd em T1 na visita basal; 88% dos pacientes não tinham sido tratados anteriormente com um tratamento não-esteroide para EM. O tempo até o início da progressão de incapacidade confirmada em 12 semanas após o início foi significativamente mais longo para pacientes10 tratados com Ocrevus® do que para pacientes10 tratados com placebo3 (vide Figura 2). Os resultados do Estudo 3 são apresentados na Tabela 2 e na Figura 2.
Tabela 2. Principais Desfechos Clínicos e de RMN em pacientes com EMPP no Estudo 3 zzzz
|
Desfechos |
Estudo 3 |
|
|
Ocrevus® 600 mg (duas infusões de 300 mg com um intervalo de duas semanas a cada 24 semanas) |
Placebo3 |
|
|
Resultados Clínicos |
||
|
Proporção de Pacientes com Progressão de Incapacidade Confirmada em 12 Semanas1 |
32,9% |
39,3% |
|
24%; p=0,0321 |
||
|
Desfechos de RMN |
||
|
Alteração média no volume das lesões8 T2, desde a visita basal até a Semana 120 (cm3) |
-0,39 |
0,79 |
|
p<0,0001 |
||
1 Definida como um aumento de 1,0 ponto ou mais a partir da pontuação de EDSS basal para pacientes10 com pontuação basal de 5,5 ou menos, ou um aumento de 0,5 ou mais quando a pontuação basal é maior que 5,5.
Figura 2. Gráfico de Kaplan-Meier do tempo até o início da progressão de incapacidade confirmada mantida por pelo menos 12 semanas com o evento inicial de agravamento neurológico tendo ocorrido durante o período de tratamento duplo-cego no Estudo 3*
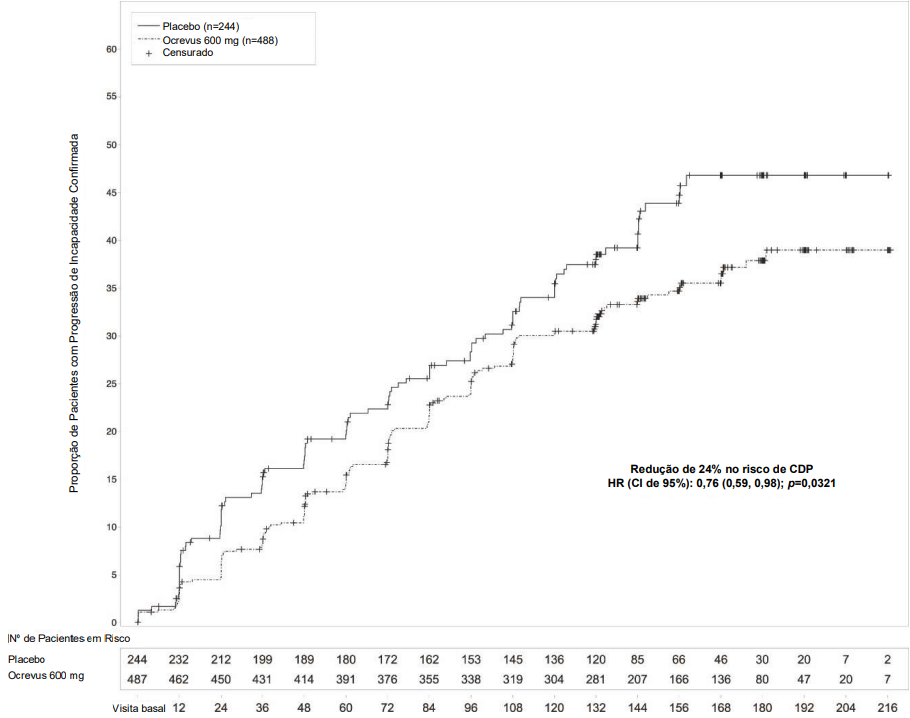 |
*Todos os pacientes nesta análise tinham no mínimo 120 semanas de acompanhamento. A análise primária baseia-se em todos os eventos de progressão de incapacidade acumulados, incluindo 21 sem EDSS confirmatória em 12 semanas.
Na população geral do Estudo 3, a proporção de pacientes com agravamento de 20 por cento na caminhada cronometrada de 25 pés confirmada em 12 semanas foi de 49% nos pacientes tratados com Ocrevus® em comparação com 59% nos pacientes tratados com placebo3 (redução de risco de 25%).
Nas análises do subgrupo exploratório do Estudo 3, a proporção de pacientes do sexo feminino com progressão de incapacidade confirmada em 12 semanas após o início foi semelhante nos pacientes tratados com Ocrevus® e nos pacientes tratados com placebo3 (aproximadamente 36% em cada grupo). Em pacientes do sexo masculino, a proporção de pacientes com progressão de incapacidade confirmada em 12 semanas após o início foi de aproximadamente 30% nos pacientes tratados com Ocrevus® e 43% nos pacientes tratados com placebo3. Os desfechos clínicos e de RMN que geralmente favoreciam Ocrevus® numericamente na população geral, e que mostravam tendências semelhantes tanto em pacientes do sexo masculino quanto feminino, incluíam taxa de recidiva4 anual, alteração no volume da lesão13 em T2, e número de lesões8 novas ou em aumento em T2.
Redução do tempo de infusão (2 horas) das doses subsequentes:
A segurança de uma infusão mais curta (2 horas) de Ocrevus® foi avaliada no estudo 4, um subestudo prospectivo15, multicêntrico, randomizado11, duplo-cego, controlado, de braços paralelos em pacientes com esclerose múltipla2 remitente- recorrente que não haviam recebido tratamentos modificadores da doença anteriores. A primeira dose de Ocrevus® foi administrada com duas infusões de 300 mg (total de 600 mg) separadas por 14 dias. Os pacientes foram randomizados a partir da sua segunda dose em diante (Dose 2 a Dose 6) em uma proporção 1: 1 dentre o grupo de infusão convencional com Ocrevus® infundido por aproximadamente 3,5 horas a cada 24 semanas, e no grupo de infusão mais curta, no qual Ocrevus® é infundido por aproximadamente 2 horas a cada 24 semanas. A randomização foi estratificada pela região e dose nas quais os pacientes foram randomizados pela primeira vez.
O desfecho primário foi a proporção de pacientes com reações relacionadas à infusão que ocorreram durante ou dentro de 24 horas após a primeira infusão randomizada de Ocrevus®. A análise primária foi realizada quando 580 pacientes foram randomizados. A proporção de pacientes com reações relacionadas à infusão que ocorreram durante ou dentro de 24 horas após a primeira infusão randomizada foi de 24,6% no grupo que recebeu uma infusão mais curta, em comparação com 23,1% no grupo que recebeu uma infusão convencional. A diferença no grupo estratificado foi semelhante. No geral, em todas as doses randomizadas, a maioria das reações relacionadas à infusão foram leves ou moderadas e apenas duas reações relacionadas à infusão foram graves quanto à intensidade, com uma reação grave relacionada à infusão em cada grupo. Não houve reações com risco de morte, fatais ou graves.
Referências bibliográficas
- Estudos 1 e 2: (WA21092 e WA21093): Hauser S.L., et al. Ocrelizumab versus Interferon Beta-1a in Relapsing Multiple Sclerosis. N Engl J Med 2017; 376:221-234.
- Estudo 3: (WA21093): Montalban X. et al. Ocrelizumab versus Placebo3 in Primary Progressive Multiple Sclerosis. N Engl J Med 2017; 376:209-220.
- Estudo 4 (MA30143): H-P Hartung, et al. Shorter infusion time of ocrelizumab: Results from the randomized, double- blind ENSEMBLE PLUS substudy in patients with relapsing-remitting multiple sclerosis. J MSRD 2020 Nov;46:102492. doi: 10.1016/j.msard.2020.102492. Epub 2020 Sep 24.
- Estudo 5: Update Clinical Study Report – WA25056. A Phase III, multicenter, randomized, parallel-group, double blinded, placebo3 controlled study to evaluate the efficacy and safety of ocrelizumab in adults with primary progressive multiple sclerosis. Research Report Number. 1103369 – November 2020. (CDS v9.0)
CARACTERÍSTICAS FARMACOLÓGICAS
Propriedades Farmacodinâmicas
Mecanismos de ação: O mecanismo preciso pelo qual ocrelizumabe exerce seus efeitos terapêuticos na esclerose múltipla2 é desconhecido, mas supõe-se que envolva a ligação ao CD20, um antígeno16 da superfície celular presente em linfócitos pré-B e linfócitos B maduros. Após a ligação da superfície celular aos linfócitos B, ocrelizumabe causa citólise celular dependente de anticorpo17 e lise18 mediada por complemento.
Para contagens de células19 B, são usados ensaios de células19 B CD19+ pois a presença de Ocrevus® interfere no ensaio de CD20. O tratamento com Ocrevus® reduz as contagens de células19 B CD19+ no sangue20 14 dias após a infusão. Em estudos clínicos, as contagens de células19 B aumentaram acima do limite inferior do normal (LIN) ou acima das contagens basais entre as infusões de Ocrevus® pelo menos uma vez em 0,3% a 4,1% dos pacientes. Em um estudo clínico de 51 pacientes, o tempo mediano para as contagens de células19 B voltarem ao valor basal ou LIN foi de 72 semanas (intervalo de 27-175 semanas) após a última infusão de Ocrevus®. Em 2,5 anos após a última infusão, as contagens de células19 B aumentaram até o valor basal ou LIN em 90% dos pacientes.
Propriedades farmacocinéticas
A farmacocinética (PK) de Ocrevus® em estudos clínicos de EM se enquadra em um modelo bicompartimental com a depuração dependente do tempo. A exposição geral no estado de equilíbrio (AUC21 durante os intervalos de dosagem de 24 semanas) de Ocrevus® foi de 3.510 mcg/mL por dia. Em estudos clínicos com pacientes com EM, as doses de manutenção de ocrelizumabe foram de 600 mg a cada 6 meses (pacientes com EMR) ou duas infusões de 300 mg separadas por um intervalo de 14 dias a cada 6 meses (pacientes com EMPP). A concentração máxima média foi de 212 mcg/mL para pacientes10 com EMR (infusão de 600 mg) e 141 mcg/mL para pacientes10 com EMPP (duas infusões de 300 mg administradas em duas semanas). A farmacocinética de ocrelizumabe foi essencialmente linear e proporcional à dose entre 400 mg e 2000 mg.
Absorção: Ocrevus® é administrado em infusão endovenosa. Não foram realizados estudos com outras formas de administração.
Distribuição: A estimativa de PK da população do volume de distribuição central foi de 2,78 L. O volume periférico e a depuração intercompartimental foram estimados em 2,68 L e 0,29 L/dia, respectivamente.
Metabolismo22: O metabolismo22 de Ocrevus® não foi estudado diretamente, pois a depuração de anticorpos23 ocorre principalmente por catabolismo24.
Eliminação: A depuração constante foi estimada em 0,17 L/dia, e a depuração inicial dependente do tempo em 0,05 L/dia, que diminuiu com uma meia-vida de 33 semanas. A meia-vida de eliminação terminal foi de 26 dias.
Farmacocinética em populações especiais
Pediatria: Não foram conduzidos estudos para investigar a farmacocinética de Ocrevus® em crianças e adolescentes (menos de 18 anos de idade).
Idosos: Não foram conduzidos estudos para investigar a farmacocinética de Ocrevus® em pacientes com 65 anos ou mais.
Insuficiência renal25: Pacientes com comprometimento renal26 leve foram incluídos nos estudos clínicos. Nenhuma alteração significativa na farmacocinética de Ocrevus® foi observada nesses pacientes.
Insuficiência hepática27: Pacientes com comprometimento hepático leve foram incluídos em estudos clínicos. Nenhuma alteração significativa na farmacocinética de Ocrevus® foi observada nesses pacientes.
Segurança pré-clínica
Carcinogênese, Mutagênese, Comprometimento da Fertilidade: Nenhum estudo de carcinogenicidade foi realizado para avaliar o potencial carcinogênico de Ocrevus®.
Nenhum estudo foi realizado para avaliar o potencial mutagênico de Ocrevus®. Como um anticorpo17, não se espera que Ocrevus® interaja diretamente com o DNA.
Não foi observado nenhum efeito nos órgãos reprodutores em macacos machos que receberam ocrelizumabe por injeção28 intravenosa (três doses iniciais de 15 ou 75 mg/kg, seguidas por doses semanais de 20 ou 100 mg/kg) durante 8 semanas. Também não foi observado efeito no ciclo estral em macacas que receberam ocrelizumabe durante três ciclos menstruais usando o mesmo regime de dosagem. As doses testadas em macacos são 2 e 10 vezes a dose humana recomendada de 600 mg, baseado em mg/kg.
Teratogenicidade: Após a administração intravenosa de Ocrevus® a macacas durante a organogênese (doses iniciais de 15 ou 75 mg/kg nos dias de gestação 20, 21 e 22, seguidas por doses semanais de 20 ou 100 mg/kg), observou-se depleção29 de linfócitos B no tecido linfoide30 (baço31 e linfonodos32) nos fetos em ambas as doses.
A administração intravenosa de Ocrevus® (três doses iniciais diárias de 15 ou 75 mg/kg, seguidas por doses semanais de 20 ou 100 mg/kg) a macacas prenhas durante todo o período de organogênese e continuando até o período neonatal resultou em mortes perinatais (algumas associadas a infecções33 bacterianas), toxicidade34 renal26 (glomerulopatia e inflamação35), formação de folículo36 linfoide37 na medula óssea38, e diminuições severas nos linfócitos B circulantes em recém- nascidos. A causa das mortes neonatais é incerta, porém, constatou-se que ambos os neonatos39 afetados apresentavam infecções33 bacterianas. Peso testicular reduzido foi observado nos recém-nascidos sob a dosagem alta.
Não foi identificada dose sem efeito quanto a efeitos adversos no desenvolvimento, as doses testadas em macacos são 2 e 10 vezes a dose recomendada em humanos de 600 mg, baseado em mg/kg.
CONTRAINDICAÇÕES
Ocrevus® é contraindicado para pacientes10 com:
- Infecção40 por HBV ativa (vide “Posologia e Modo de Usar” e “Advertências e Precauções”).
- Histórico de reação à infusão de risco à vida ao Ocrevus® (vide “Advertências e Precauções”).
- Hipersensibilidade conhecida ao ocrelizumabe ou qualquer de seus excipientes.
ADVERTÊNCIAS E PRECAUÇÕES
Reações à Infusão
Ocrevus® pode causar reações à infusão, que podem incluir prurido41, erupção42 cutânea43, urticária44, eritema45, broncoespasmo46, irritação na garganta47, dor orofaríngea48, dispneia49, edema50 na faringe51 ou laringe52, rubor, hipotensão53, pirexia54, fadiga55, cefaleia56, tontura57, náusea58, taquicardia59 e anafilaxia60. Em estudos clínicos da esclerose múltipla2 (EM), a incidência61 de reações à infusão em pacientes tratados com Ocrevus®, que receberam metilprednisolona (ou um esteroide equivalente) e possivelmente outra pré-medicação para reduzir o risco de reações à infusão antes de cada infusão, foi de 34 a 40%, sendo a incidência61 mais alta com a primeira infusão. Não houve nenhuma reação à infusão fatal, mas 0,3% dos pacientes com EM tratados com Ocrevus® apresentaram reações à infusão que foram sérias, algumas com necessidade de hospitalização.
Observar os pacientes tratados com Ocrevus® quanto à presença de reações à infusão durante a infusão e por pelo menos uma hora após o término da infusão. Informar os pacientes que reações à infusão podem ocorrer até 24 horas após a infusão.
Reduzindo o risco de reações à infusão e tratando as reações à infusão
Administrar a pré-medicação (ex. metilprednisolona ou um corticosteroide equivalente, e um anti-histamínico) para reduzir a frequência e a gravidade de reações à infusão. A adição de um antipirético62 (ex. acetaminofeno) também pode ser considerada (vide “Posologia e Modo de Usar”).
As recomendações de tratamento das reações à infusão dependem do tipo e da gravidade da reação (vide “Posologia e Modo de Usar”). Para reações à infusão de risco à vida, interromper imediata e permanentemente o uso de Ocrevus® e administrar o tratamento de suporte apropriado. Para reações à infusão menos severas, o tratamento pode envolver a interrupção temporária da infusão, redução da velocidade de infusão e/ou administração de tratamento sintomático63.
Infecções33
Uma proporção maior de pacientes tratados com Ocrevus® apresentou infecções33 em comparação com pacientes que usaram REBIF ou placebo3. Nos estudos de EMR, 58% dos pacientes tratados com Ocrevus® apresentaram uma ou mais infecções33 em comparação com 52% dos pacientes tratados com REBIF. No estudo de EMPP, 70% dos pacientes tratados com Ocrevus® apresentaram uma ou mais infecções33 em comparação com 68% dos pacientes com placebo3. Ocrevus® aumentou o risco de infecções33 do trato respiratório superior, infecções33 do trato respiratório inferior, infecções33 cutâneas64 e infecções33 relacionadas a herpes (vide “Reações Adversas”). Ocrevus® não esteve associado a um aumento no risco de infecções33 sérias em pacientes com EM. Postergar a administração de Ocrevus® em pacientes com uma infecção40 ativa até que a infecção40 seja resolvida.
Infecções33 do trato respiratório
Uma proporção maior de pacientes tratados com Ocrevus® apresentou infecções33 do trato respiratório em comparação com pacientes que usaram REBIF ou placebo3. Nos estudos de EMR, 40% dos pacientes tratados com Ocrevus® apresentaram infecções33 do trato respiratório superior em comparação com 33% dos pacientes tratados com REBIF, e 8% dos pacientes tratados com Ocrevus® apresentaram infecções33 do trato respiratório inferior em comparação com 5% dos pacientes tratados com REBIF. No estudo de EMPP, 49% dos pacientes tratados com Ocrevus® apresentaram infecções33
do trato respiratório superior em comparação com 43% dos pacientes com placebo3 e 10% dos pacientes tratados com Ocrevus® apresentaram infecções33 do trato respiratório inferior em comparação com 9% dos pacientes com placebo3. As infecções33 foram predominantemente leves a moderadas e consistiam, sobretudo em infecções33 do trato respiratório superior e bronquite.
Herpes
Em estudos clínicos controlados por medicamento ativo (EMR), infecções33 por herpes foram relatadas de forma mais frequente em pacientes tratados com Ocrevus® do que em pacientes tratados com REBIF, incluindo herpes zoster65 (2,1% vs. 1,0%), herpes simples (0,7% vs. 0,1%), herpes oral (3,0% vs. 2,2%), herpes genital (0,1% vs. 0%), e infecção40 pelo vírus66 do herpes (0,1% vs. 0%). As infecções33 foram de gravidade predominantemente leve a moderada.
No estudo clínico controlado por placebo3 (EMPP), herpes oral foi relatada com maior frequência nos pacientes tratados com Ocrevus® do que nos pacientes com placebo3 (2,7% vs 0,8%).
Casos graves de infecções33 causadas pelo vírus66 do herpes simples e varicela67-zoster65, incluindo infecções33 do sistema nervoso central68 (encefalite69 e meningite70), infecções33 intraoculares e infecções33 disseminadas na pele71 e tecidos moles, foram reportados no período pós-comercialização em pacientes com esclerose múltipla2 tratados com Ocrevus®.
Infecções33 sérias causadas pelo vírus66 do herpes podem ocorrer a qualquer momento durante o tratamento com Ocrevus®. Alguns casos reportados apresentaram risco de morte.
Caso ocorra infecção40 grave causada pelo vírus66 do herpes, Ocrevus® deve ser descontinuado ou interrompido até que a infecção40 esteja resolvida, e tratamento adequado deve ser administrado.
Alerte os pacientes que ocorreram infecções33 causadas pelo vírus66 do herpes, incluindo infecções33 graves que afetam o sistema nervoso central68, pele71 e olhos72 durante o tratamento com Ocrevus®. Oriente os pacientes a contatar um profissional de saúde1 caso tenham qualquer sinal73 ou sintoma14 de infecções33 causadas pelo vírus66 do herpes, incluindo sintomas74 orais ou genitais, febre75, rash76 cutâneo77, dor, coceira, redução da acuidade visual78, vermelhidão nos olhos72, dor nos olhos72, dor de cabeça79, rigidez no pescoço80 ou alteração no estado mental.
Leucoencefalopatia Multifocal Progressiva (LMP)
A LMP é uma infecção40 oportunista do cérebro7 causada pelo vírus66 John Cunningham (JC) que normalmente ocorre somente em pacientes imunocomprometidos, e que geralmente leva à morte ou incapacidade severa. Embora nenhum caso de LMP tenha sido identificado nos estudos clínicos de Ocrevus®, a infecção40 pelo vírus66 JC que resulta em LMP foi observada em pacientes tratados com outros anticorpos23 anti-CD20 e outras terapias para EM e estava associada a alguns fatores de risco (ex. pacientes imunocomprometidos, politerapia com imunossupressores). No primeiro sinal73 ou sintoma14 sugestivo de LMP, suspender Ocrevus® e realizar uma avaliação diagnóstica apropriada. Achados de RMN podem ser aparentes antes dos sinais81 ou sintomas74 clínicos. Os sintomas74 típicos associados à LMP são diversos, evoluem durante dias a semanas, e incluem fraqueza progressiva de um lado do corpo ou membros desajeitados, distúrbio visual, e alterações no raciocínio, memória e orientação, levando à confusão e a alterações na personalidade.
Reativação do Vírus66 da Hepatite82 B (HBV)
A reativação do vírus66 da hepatite82 B foi relatada em pacientes com esclerose múltipla2 tratados com Ocrevus® no período pós-comercialização. Hepatite fulminante83, insuficiência hepática27 e morte causadas pela reativação do HBV ocorreram em pacientes tratados com anticorpos23 anti-CD20. Realizar o teste de HBV em todos os pacientes antes do início do tratamento com Ocrevus®. Não administrar Ocrevus® a pacientes com HBV ativo confirmado por resultados positivos nos testes de HBsAg e anti-HB. Para pacientes10 negativos para o antígeno16 de superfície [HBsAg] e positivos para o anticorpo17 antinuclear de HB [HBcAb+] ou que são portadores de HBV [HBsAg+], consultar um especialista em doença hepática84 antes de iniciar e durante o tratamento.
Possível risco aumentado de efeitos imunossupressores com outros imunossupressores
Ao iniciar Ocrevus® após uma terapia imunossupressora ou ao iniciar uma terapia imunossupressora após Ocrevus®, considerar o potencial de efeitos imunossupressores aumentados (vide “Interações medicamentosas” e “Características Farmacológicas”). Ocrevus® não foi estudado em combinação com outras terapias para EM.
Vacinações
Administrar todas as imunizações de acordo com as diretrizes de imunização85 pelo menos 4 semanas antes do início de Ocrevus® para vacinas vivas ou vivas atenuadas e, sempre que possível, pelo menos 2 semanas antes do início do tratamento com Ocrevus® para vacinas inativas.
Ocrevus® pode interferir na eficácia de vacinas inativas (vide “Interações medicamentosas”).
A segurança de imunização85 com vacinas vivas ou vivas-atenuadas após a terapia com Ocrevus® não foi estudada, e a vacinação com vacinas vivas-atenuadas ou vivas não é recomendada durante o tratamento e até a repleção das células19 B (vide “Características Farmacológicas”).
Não há nenhum dado disponível sobre os efeitos de vacina86 viva ou inativa em pacientes que receberam Ocrevus®.
Vacinação de crianças nascidas de mães tratadas com Ocrevus® durante a gravidez87
Não devem ser administradas vacinas vivas ou vivas atenuadas a bebês88 de mães expostas a Ocrevus® durante a gravidez87 antes de se confirmar a recuperação das contagens de células19 B, conforme medido pelo nível de células19 B, CD19 +. A depleção29 de células19 B nestas crianças pode aumentar os riscos relacionados às vacinas vivas ou vivas atenuadas.
Vacinas inativas podem ser administradas antes da recuperação da depleção29 de células19 B, conforme indicado, mas deve- se considerar a avaliação das respostas imunológicas da vacina86, por meio de consulta com um especialista qualificado, para avaliar se uma resposta imune protetora foi desenvolvida (vide “Uso em populações especiais”).
Redução de imunoglobulinas89
Conforme esperado com qualquer terapia de depleção29 de células19 B, uma redução dos níveis de imunoglobulina90 é observada no tratamento com Ocrevus®. Os dados agrupados de estudos clínicos de Ocrevus® (EMR e EMPP) e de sua fase aberta open-label (até aproximadamente 7 anos de exposição ao Ocrevus®) demostraram uma associação entre níveis reduzidos de imunoglobulina90 G (IgG <LIN) e aumento de taxas de infecções33 sérias. Monitorar os níveis de imunoglobulinas89 séricas quantitativas durante o tratamento com Ocrevus® e após a descontinuação do tratamento, até a repleção de células19 B e, especialmente, no contexto de infecções33 graves recorrentes. Considere descontinuar a terapia com Ocrevus® em pacientes com infecções33 oportunistas sérias ou recorrentes, e se a hipogamaglobulinemia prolongada exigir tratamento com imunoglobulinas89 intravenosas (vide item “Reações Adversas”).
Malignidades
Pode existir um risco maior de malignidade com Ocrevus®. Em estudos controlados, malignidades, incluindo câncer91 de mama92, ocorreram de forma mais frequente em pacientes tratados com Ocrevus®. Câncer91 de mama92 ocorreu em 6 de 781 mulheres tratadas com Ocrevus® e nenhuma das 668 mulheres tratadas com REBIF ou placebo3. As pacientes devem seguir as diretrizes padrão de triagem de câncer91 de mama92.
Gravidez87 e Lactação93
Ocrevus® é um anticorpo17 monoclonal humanizado de uma imunoglobulina90 do subtipo G1. As imunoglobulinas89 são conhecidas por atravessarem a barreira placentária. Não há dados adequados sobre o risco no desenvolvimento associado ao uso de Ocrevus® por mulheres grávidas. No entanto, depleção29 transitória de células19 B periféricas e linfocitopenia foram relatadas em bebês88 nascidos de mães expostas a outros anticorpos23 anti-CD20 durante a gravidez87. Os níveis de células19 B em bebês88 após a exposição materna ao Ocrevus® não foram estudados em ensaios clínicos94. A duração potencial da depleção29 de células19 B em tais bebês88 e o impacto da depleção29 de células19 B na segurança e eficácia são desconhecidos (vide “Advertências e Precauções”).
Após a administração de ocrelizumabe a macacas prenhas em doses semelhantes a ou maiores do que as doses usadas clinicamente, observou-se aumento da mortalidade95 perinatal, depleção29 de populações de células19 B, toxicidade34 renal26, da medula óssea38 e testicular nos filhotes, na ausência de toxicidade34 materna (vide “Características Farmacológicas” - Teratogenicidade).
Na população geral dos EUA, o risco inicial estimado de defeitos congênitos96 significativos e aborto em gestações clinicamente reconhecidas é de 2% a 4% e 15% a 20%, respectivamente. O risco inicial de defeitos congênitos96 significativos e aborto para a população indicada é desconhecido.
Categoria de risco na gravidez87: C. Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Não há dados sobre a presença de ocrelizumabe no leite humano, os efeitos no lactente97, ou os efeitos do medicamento na produção de leite. Ocrelizumabe foi excretado no leite de macacas tratadas com ocrelizumabe. IgG humano é excretado no leite humano, e o potencial de absorção de ocrelizumabe para causar depleção29 de células19 B no bebê é desconhecido. Os benefícios da amamentação98 no desenvolvimento e na saúde1 devem ser considerados juntamente com a necessidade clínica de Ocrevus® da mãe e com qualquer possível efeito adverso no lactente97 decorrente de Ocrevus® ou da condição subjacente materna.
Contracepção99: Mulheres com potencial para engravidar devem usar um contraceptivo efetivo enquanto estiverem recebendo Ocrevus® e por 6 meses após a última infusão de Ocrevus® (vide “Características Farmacológicas”).
Populações especiais
Uso pediátrico: A segurança e eficácia de Ocrevus® em pacientes pediátricos não foi estabelecida.
Uso geriátrico: Estudos clínicos de Ocrevus® não incluíram quantidades suficientes de indivíduos com idade de 65 ou mais para determinar se eles respondem de forma diferente de indivíduos mais jovens.
Insuficiência renal25: Pacientes com comprometimento renal26 leve foram incluídos nos estudos clínicos. Nenhuma alteração significativa na farmacocinética de Ocrevus® foi observada nesses pacientes.
Insuficiência hepática27: Pacientes com comprometimento hepático leve foram incluídos em estudos clínicos. Nenhuma alteração significativa na farmacocinética de Ocrevus® foi observada nesses pacientes.
Efeitos na habilidade de dirigir e operar máquinas
Ocrevus® não possui nenhuma influência, ou possui influência insignificante, na habilidade de dirigir veículos ou operar máquinas.
Até o momento, não há informações de que ocrelizumabe possa causar doping.
INTERAÇÕES MEDICAMENTOSAS
Terapias imunossupressoras ou imunomoduladoras
Presume-se que o uso concomitante de Ocrevus® e outras terapias imunomoduladoras ou imunossupressoras, incluindo doses imunossupressoras de corticosteroides, aumente o risco de imunossupressão100. Considerar o risco de efeitos cumulativos no sistema imunológico101 ao administrar concomitantemente terapias imunossupressoras com Ocrevus®. Ao trocar de medicamentos com efeitos imunológicos prolongados, como daclizumabe, fingolimode, natalizumabe, teriflunomida ou mitoxantrona, considerar a duração e o modo de ação desses medicamentos por causa dos efeitos imunossupressores cumulativos ao iniciar Ocrevus® (vide “Advertências e Precauções”).
Vacinações
Um estudo aberto, randomizado11 de Fase 3b, avaliou o uso concomitante de Ocrevus® e várias vacinas inativadas, em adultos entre 18 e 55 anos de idade com formas recorrentes de esclerose múltipla2 (68 indivíduos em tratamento com Ocrevus® no momento da vacinação e 34 indivíduos não submetidos a tratamento com Ocrevus® no momento da vacinação). A exposição concomitante a Ocrevus® atenuou as respostas de anticorpos23 contra a vacina86 contendo toxóide tetânico, polissacarídeo pneumocócico, vacinas conjugadas pneumocócicas e vacinas contra influenza102 sazonais inativadas. O impacto da atenuação observada na eficácia da vacina86 nesta população de pacientes é desconhecido. A segurança e a eficácia das vacinas vivas ou atenuadas administradas concomitantemente com Ocrevus® não foram avaliadas (vide “Advertências e Precauções”).
CUIDADOS DE ARMAZENAMENTO DO MEDICAMENTO
Cuidados de conservação
Ocrevus® deve ser conservado sob refrigeração (entre 2–8°C). Manter o frasco-ampola dentro do cartucho para proteger da luz. Não congelar. Não agitar.
Ocrevus® é uma solução sem conservantes, estéril, clara ou ligeiramente opalescente, e incolor a marrom pálida fornecida em uma caixa contendo uma ampola de dose única de 300 mg/10 mL (30 mg/mL). Antes do início da infusão intravenosa, o conteúdo da bolsa de infusão deve estar em temperatura ambiente.
Utilizar a solução de infusão preparada imediatamente. Se não for usada imediatamente, armazenar até 24 horas no refrigerador entre 2–8°C e 8 horas em temperatura ambiente até 25°C, incluindo o tempo de infusão.
Caso a infusão intravenosa não possa ser concluída no mesmo dia, descartar a solução restante.
Este medicamento possui prazo de validade 18 meses a partir da data de fabricação.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Características físicas e organolépticas do produto
Ocrevus® é uma solução para infusão intravenosa sem conservantes, estéril, clara ou ligeiramente opalescente, e incolor a marrom pálido.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS.
POSOLOGIA E MODO DE USAR
Ocrevus® deve ser preparado por profissional de saúde1 usando técnica asséptica. Utilize agulha e seringa103 estéreis para a preparação da solução diluída para infusão. Não é recomendável o uso de dispositivos de transferência de sistema fechado (Closed System Transfer Devices - CSTD) para a preparação de Ocrevus®, uma vez que não há evidências sobre a compatibilidade desses dispositivos com o produto.
O produto não contém conservantes e se destina a uso único.
Inspecionar visualmente quanto à presença de material particulado e descoloração antes da administração. Não usar a solução se houver descoloração ou se a solução contiver discreta quantidade de material particulado estranho. Não agitar.
Retirar a dose pretendida e diluir em uma bolsa de infusão contendo Injeção28 de Cloreto de Sódio 0,9%, até uma concentração final do medicamento de aproximadamente 1,2 mg/mL.
- Retirar 10 mL (300 mg) de Ocrevus® e injetar em 250 mL
- Retirar 20 mL (600 mg) de Ocrevus® e injetar em 500 mL
Não usar outros diluentes para diluir Ocrevus® uma vez que seu uso não foi testado. O produto não contém conservantes e destina-se somente a uso único.
A solução para infusão diluída precisa ser administrada usando um equipo de infusão com filtro de linha de 0,2 ou 0,22 mícron.
Antes de iniciar a infusão IV, o conteúdo da bolsa de infusão precisar estar em temperatura ambiente para evitar uma reação de infusão decorrente de aplicação de solução com temperatura baixa.
Avaliações antes da Primeira Dose de Ocrevus®
Teste do Vírus66 da Hepatite82 B: Antes de iniciar Ocrevus®, realizar o teste do vírus66 da Hepatite82 B (HBV). Ocrevus® é contraindicado para pacientes10 com HBV ativo confirmado por resultados positivos para os testes de HBsAg e anti-HBV. Para pacientes10 negativos para o antígeno16 de superfície (HBsAg) e positivos para o anticorpo17 antinuclear do HB (HBcAb+) ou que sejam portadores de HBV (HBsAg+), consultar especialistas em doença hepática84 antes de iniciar e durante o tratamento (vide “Advertências e Precauções”).
Antes de iniciar Ocrevus®, realizar dosagem quantitativa sérica de imunoglobulinas89 (vide Advertências e Precauções). Para pacientes10 com imunoglobulina90 sérica baixa, consulte um especialista em imunologia antes de iniciar o tratamento com Ocrevus®.
Vacinações: Como a vacinação com vacinas vivas-atenuadas ou vivas não é recomendada durante o tratamento e após a descontinuação até a repleção das células19 B, administrar todas as imunizações necessárias de acordo com as diretrizes de imunização85 pelo menos 4 semanas antes do início de Ocrevus® para vacinas vivas ou vivas atenuadas e, sempre que possível, pelo menos 2 semanas antes do início do Ocrevus® para vacinas inativadas (vide “Advertências e Precauções” e “Características Farmacológicas”).
Preparo antes de cada Infusão
Avaliação de infecção40: Antes de cada infusão de Ocrevus®, determinar se há uma infecção40 ativa. Em caso de infecção40 ativa, postergar a infusão de Ocrevus® até que a infecção40 seja resolvida (vide “Advertências e Precauções”).
Pré-medicação recomendada
Pré-medicar com 100 mg de metilprednisolona (ou um corticosteroide equivalente) administrado por via intravenosa aproximadamente 30 minutos antes de cada infusão de Ocrevus® para reduzir a frequência e a gravidade de reações à infusão (vide “Advertências e Precauções”). Pré-medicar com um anti-histamínico (ex.: difenidramina) aproximadamente 30-60 minutos antes de cada infusão de Ocrevus® para reduzir a frequência e a gravidade de reações à infusão.
A adição de um antipirético62 (ex. acetaminofeno) também pode ser considerada.
Dosagem recomendada e administração da dose
- Administrar Ocrevus® sob rigorosa supervisão de um profissional de saúde1 experiente com acesso a suporte médico apropriado para controlar reações severas como reações sérias à infusão.
- Dose inicial: infusão intravenosa de 300 mg, seguida, duas semanas depois, por uma segunda infusão intravenosa de 300 mg.
- Doses subsequentes: infusão intravenosa única de 600 mg a cada 6 meses.
- Observar o paciente por pelo menos uma hora após o término da infusão (vide “Advertências e Precauções”).
Se os pacientes não apresentaram uma reação relacionada à infusão séria com qualquer infusão anterior de Ocrevus®, uma infusão mais curta (2 horas) pode ser administrada para as doses subsequentes (vide tabela 3, opção 2) [vide itens “Reações Adversas” e “Resultados de Eficácia”].
Tabela 3. Dose Recomendada, Velocidade da Infusão e Duração da Infusão para EMR e EMPP zzzz
|
|
Quantidade e Volume1 |
Velocidade e Duração da Infusão3 |
|
|
Dose Inicial |
Infusão 1 |
300mg |
• Iniciar a 30 mL por hora • Aumentar 30 mL por hora a cada 30 • Máximo: 180 mL por hora • Duração: 2,5 horas ou mais |
|
Infusão 2 |
300mg |
||
|
Doses Subsequentes |
Opção 01 |
600 mg |
• Iniciar a 40 mL por hora • Aumentar 40 mL por hora a cada 30 • Máximo: 200 mL por hora • Duração: 3,5 horas ou mais |
|
OU |
|||
|
Opção 02 |
600 mg |
• Iniciar a 100 mL por hora pelos primeiros • Aumentar para 200 mL por hora pelos • Aumentar para 250 mL por hora pelos • Aumentar para 300 mL por hora pelos 60 • Duração: 2 horas ou mais |
|
1 As soluções de Ocrevus® para infusão intravenosa são preparadas por diluição do medicamento em uma bolsa de infusão contendo Injeção28 de Cloreto de Sódio 0,9%, até uma concentração final do medicamento de aproximadamente 1,2 mg/mL.
2 Administrar a primeira Dose Subsequente 6 meses após a Infusão 1 da Dose Inicial.
3 O tempo de infusão pode ser mais longo se a infusão for interrompida ou retardada (vide “Posologia e Modo de Usar”).
Doses postergadas ou omitidas
Se uma infusão planejada de Ocrevus® for omitida, administrar Ocrevus® assim que possível; não aguardar até a próxima dose programada. Redefinir o cronograma de dosagem para administrar a próxima dose sequencial 6 meses depois que a dose omitida for administrada. As doses de Ocrevus® devem ter um intervalo de pelo menos 5 meses (vide “Posologia e Modo de Usar”).
Modificações da dose por causa de reações à infusão
As modificações da dose em resposta a reações à infusão dependem da gravidade.
Reações à infusão de risco à vida
Interromper imediatamente e descontinuar permanentemente Ocrevus® se houver sinais81 de uma reação à infusão de risco à vida ou incapacitante (vide “Advertências e Precauções”). Fornecer tratamento de suporte apropriado.
Reações à infusão severas
Interromper imediatamente a infusão e administrar tratamento de suporte apropriado, conforme necessário (vide “Advertências e Precauções”). Reiniciar a infusão somente depois que todos os sintomas74 tiverem sido resolvidos. Ao reiniciar, começar na metade da velocidade de infusão da ocasião do início da reação à infusão (vide “Posologia e Modo de Usar”). Se esta velocidade for tolerada, aumentar a velocidade conforme descrito na Tabela 3. Essa alteração na velocidade aumentará a duração total da infusão, mas não a dose total.
Reações à infusão leves a moderadas
Reduzir a velocidade de infusão para metade da velocidade do início da reação à infusão e manter a velocidade reduzida por pelo menos 30 minutos (vide “Advertências e Precauções”). Se esta velocidade for tolerada, aumentar a velocidade conforme descrito na Tabela 3. Esta alteração na velocidade aumentará a duração total da infusão, mas não a dose total.
Incompatibilidades
Não foram observadas incompatibilidades entre Ocrevus® e bolsas de policloreto de vinila (PVC) ou poliolefina (PO) e conjuntos de administração intravenosa (IV).
Não use outros diluentes para diluição de Ocrevus® porque seu uso não foi testado.
Instruções especiais para administração
Crianças e adolescentes: A segurança e a eficácia de Ocrevus® em crianças e adolescentes (< 18 anos) não foram estudadas.
Pacientes idosos: Estudos clínicos de Ocrevus® não incluíram quantidades suficientes de indivíduos com idade de 65 ou mais para determinar se eles respondem de forma diferente de indivíduos mais jovens.
Insuficiência renal25: Pacientes com comprometimento renal26 leve foram incluídos nos estudos clínicos. Nenhuma alteração significativa na farmacocinética de Ocrevus® foi observada nesses pacientes.
Insuficiência hepática27: Pacientes com comprometimento hepático leve foram incluídos em estudos clínicos. Nenhuma alteração significativa na farmacocinética de Ocrevus® foi observada nesses pacientes.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento. Não interrompa o tratamento sem o conhecimento do seu médico.
REAÇÕES ADVERSAS
A segurança do Ocrevus® foi avaliada em 1.311 pacientes em estudos clínicos de EM, o que inclui 825 pacientes em estudos clínicos com controle ativo (EMR) e 486 pacientes em estudo controlado com placebo3 (EMPP).
Formas recorrentes de EM
Em estudos clínicos controlados por medicamento ativo (Estudo 1 e Estudo 2), 825 pacientes com EMR receberam Ocrevus® 600 mg por via intravenosa a cada 24 semanas (o tratamento inicial foi administrado como duas infusões separadas de 300 mg nas Semanas 0 e 2) (vide “Resultados de Eficácia”). A exposição geral nos períodos de tratamento controlado de 96 semanas foi de 1448 pacientes-anos.
As reações adversas mais comuns nos estudos de EMR (incidência61 ≥ 10%) foram infecções33 do trato respiratório superior e reações à infusão. A Tabela 4 resume as reações adversas que ocorreram nos estudos de EMR (Estudo 1 e Estudo 2).
Tabela 4. Reações Adversas em Pacientes Adultos com EMR com uma Incidência61 de pelo menos 5% para Ocrevus® e Maior do que REBIF
|
Reações Adversas |
Estudos 1 e 2 |
|
|
Ocrevus® |
REBIF |
|
|
Infecções33 do trato respiratório superior |
40 |
33 |
|
Reações à infusão |
34 |
10 |
|
Depressão |
8 |
7 |
|
Infecções33 do trato respiratório inferior |
8 |
5 |
|
Dor nas costas104 |
6 |
5 |
|
Infecções33 associadas ao vírus66 da herpes |
6 |
4 |
|
Dor nas extremidades |
5 |
4 |
1 A primeira dose foi administrada como duas infusões separadas de 300 mg nas Semanas 0 e 2.
Reações adversas em pacientes que receberam uma infusão de 2 horas
No estudo clínico 04, designado para caracterizar o perfil de segurança de uma infusão mais curta (2 horas) de Ocrevus® em pacientes com esclerose múltipla2 remitente-recorrente, a incidência61, intensidade e tipos de sintomas74 de reações relacionadas à infusão foram consistentes com aqueles observados quando a infusão foi administrada por 3,5 horas.
No estudo clínico 04 desenhado para caracterizar o perfil de segurança de infusões mais curtas de Ocrevus® (2 horas) em pacientes com esclerose múltipla2 remitente-recorrente, a incidência61, intensidade e tipo de sintomas74 de reações relacionadas à infusão foram consistentes com àqueles observados quando a infusão foi administrada por 3,5 horas. O número global de intervenções necessárias foi baixo em ambos os grupos de infusão, no entanto, foram necessárias mais intervenções para gerir reações relacionadas à infusão (diminuição da velocidade ou interrupções temporárias) no grupo de infusão mais curta (2 horas), em comparação com o grupo de infusão de 3,5 horas (8,7 % vs 4,8%, respetivamente).
EM primária progressiva
Em um estudo clínico controlado por placebo3 (Estudo 3), 486 pacientes com EMPP, no total, receberam um ciclo de Ocrevus® (600 mg de Ocrevus® administrado como duas infusões separadas de 300 mg com um intervalo de duas semanas) administrado por via intravenosa a cada 24 semanas e 239 pacientes receberam placebo3 por via intravenosa (vide “Resultados de Eficácia”). A exposição total no período de tratamento controlado foi de 1416 pacientes-anos, com uma duração mediana de tratamento de 3 anos.
As reações adversas mais comuns no estudo de EMPP (incidência61 ≥ 10%) foram infecções33 do trato respiratório superior, reações à infusão, infecções33 cutâneas64, e infecções33 do trato respiratório inferior. A Tabela 5 resume as reações adversas que ocorreram no estudo de EMPP (Estudo 3).
Tabela 5. Reações Adversas em Pacientes Adultos com EMPP com uma Incidência61 de pelo menos 5% para Ocrevus® e Maior do que Placebo3
|
Reações Adversas |
Estudo 3 |
|
|
Ocrevus® 600 mg IV |
Placebo3 |
|
|
Reações à infusão |
40 |
26 |
|
Infecções33 cutâneas64 |
14 |
11 |
|
Infecções33 do trato respiratório inferior |
10 |
9 |
|
Tosse |
7 |
3 |
|
Diarreia105 |
6 |
5 |
|
Edema50 periférico |
6 |
5 |
|
Infecções33 associadas ao vírus66 do herpes |
5 |
4 |
1 Uma dose de Ocrevus® (600 mg administrada como duas infusões separadas de 300 mg com um intervalo de duas semanas).
Anormalidades Laboratoriais
Redução das imunoglobulinas89
Ocrevus® diminuiu o total de imunoglobulinas89, com o maior declínio observado nos níveis de IgM. Entretanto, a redução dos níveis de IgG foi associada a um aumento na taxa de infecções33 sérias.
Nos estudos controlados por medicamento ativo (EMR) (Estudo 1 e Estudo 2), a proporção de pacientes na visita basal que relataram IgG, IgA e IgM abaixo do limite inferior do normal (LIN) em pacientes tratados com Ocrevus® foi de 0,5%, 1,5% e 0,1%, respectivamente. Após o tratamento, a proporção de pacientes tratados com Ocrevus® que relataram IgG, IgA e IgM abaixo do LIN em 96 semanas foi de 1,5%, 2,4% e 16,5%, respectivamente.
No estudo controlado por placebo3 (EMPP) (Estudo 3), a proporção de pacientes na visita basal que relataram IgG, IgA e IgM abaixo do LIN em pacientes tratados com Ocrevus® foi de 0,0%, 0,2% e 0,2%, respectivamente. Após o tratamento, a proporção de pacientes tratados com Ocrevus® que relataram IgG, IgA e IgM abaixo do LIN em 120 semanas foi de 1,1%, 0,5% e 15,5%, respectivamente.
Os dados agrupados de estudos clínicos de Ocrevus® (EMR e EMPP) e sua fase aberta open-label (até aproximadamente 7 anos de exposição ao Ocrevus®) demostraram uma associação entre níveis reduzidos de IgG e taxas aumentadas de infecções33 sérias. O tipo, gravidade, latência106, duração e desfecho das infecções33 sérias (ISs) observadas durante episódios de imunoglobulinas89 abaixo do LIN foram consistentes com as infecções33 sérias gerais observadas em pacientes tratados com Ocrevus®.
Redução dos níveis de neutrófilos107
No estudo clínico de EMPP (Estudo 3), ocorreu redução nas contagens de neutrófilos107 em 13% dos pacientes tratados com Ocrevus® em comparação com 10% nos pacientes com placebo3. A maioria das contagens de neutrófilos107 reduzidas foi observada somente uma vez para um determinado paciente tratado com Ocrevus® e estavam entre LIN – 1,5 x 109/L e 1,0 x 109/L. De modo geral, 1% dos pacientes no grupo com Ocrevus® apresentou contagens de neutrófilos107 inferiores a 1,0 x 109/L e estas não estavam associadas a uma infecção40.
Imunogenicidade
Assim como todas as proteínas108 terapêuticas, existe um potencial de imunogenicidade. Os dados de imunogenicidade são altamente dependentes da sensibilidade e da especificidade dos métodos de teste usados. Além disso, a incidência61 observada de um resultado positivo em um método de teste pode ser influenciada por vários fatores, incluindo manuseio da amostra, momento da coleta da amostra, interferência medicamentosa, medicação concomitante e doença subjacente. Portanto, a comparação da incidência61 de anticorpos23 ao Ocrevus® com a incidência61 de anticorpos23 a outros produtos pode ser enganosa.
Os pacientes nos estudos de EM (Estudo 1, Estudo 2 e Estudo 3) foram testados em diversos momentos (na visita basal e a cada 6 meses após o tratamento, pela duração o estudo) para anticorpos23 anti-medicamento (ADAs). Dos 1311 pacientes tratados com Ocrevus®, 12 (~1%) foram positivos para ADAs, dos quais 2 pacientes foram positivos para anticorpos23 neutralizantes. Esses dados não são adequados para avaliar o impacto de ADAs na segurança e eficácia de Ocrevus®.
Experiência pós-comercialização
As reações adversas descritas abaixo foram identificadas durante o período pós-comercialização de Ocrevus®. Como se
tratam de reações reportadas voluntariamente por uma população de tamanho incerto, nem sempre é possível estimar de forma confiável a frequência ou estabelecer uma relação causal com a exposição ao medicamento.
Infecções33 graves causadas pelo vírus66 do herpes foram identificadas durante o período pós-comercialização de Ocrevus®. As seguintes reações adversas sérias são discutidas mais detalhadamente em outras seções da bula:
- Reações à Infusão (vide “Advertências e Precauções”);
- Infecções33 (vide “Advertências e Precauções”);
- Malignidades (vide Advertências e Precauções”).
Atenção: este produto é um medicamento novo e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos imprevisíveis ou desconhecidos. Nesse caso, notifique os eventos adversos pelo Sistema VigiMed, disponível no Portal da Anvisa.
SUPERDOSE
A experiência em estudos clínicos é limitada com doses mais altas do que a dose intravenosa aprovada de Ocrevus®. A maior dose testada até hoje em pacientes com EM é de 2000 mg, administrada na forma de duas infusões IV de 1000 mg separadas por 2 semanas (estudo Fase II de pesquisa de dose em EMRR). As reações adversas à droga foram compatíveis com o perfil de segurança para Ocrevus® nos estudos clínicos de referência.
Não existe nenhum antídoto109 específico para o caso de superdose; interrompa imediatamente a infusão e observe o paciente verificando se há o aparecimento de reações relacionadas à infusão (vide item “Advertências e Precauções -Reações à Infusão”).
Em caso de intoxicação ligue para 0800 722 6001, se você precisar de mais orientações.
DIZERES LEGAIS
USO RESTRITO A HOSPITAIS
VENDA SOB PRESCRIÇÃO MÉDICA
MS – 1.0100.0666
Farm. Resp.: Tatiana Tsiomis Díaz - CRF-RJ nº 6942
Fabricado por Roche Diagnostics GmbH, Mannheim, Alemanha
Embalado por F. Hoffmann-La Roche Ltd., Kaiseraugst, Suíça
Importado por: Produtos Roche Químicos e Farmacêuticos S.A.
Est. dos Bandeirantes, 2.020 CEP 22775-109 – Rio de Janeiro – RJ
CNPJ: 33.009.945/0023-39
SAC 0800 7720 289







